Resumos
Este trabalho foi realizado com o objetivo de otimizar o protocolo para enraizamento in vitro de Anemopaegma arvense, planta medicinal do Cerrado em risco de extinção e conhecida popularmente como catuaba, a qual é amplamente utilizada na medicina popular. Brotações cultivadas in vitro foram inoculadas em meio de cultura MS/2 liquido e MS sólido suplementado com diferentes concentrações de auxinas, poliaminas ou dithiothreitol (DTT). As avaliações foram realizadas quanto à porcentagem de enraizamento, número e comprimento das raízes. A presença de NAA (Ácido naftaleno acético) no meio de cultura foi essencial para promover a indução de raízes adventícias nas brotações. A maior porcentagem de enraizamento, 50%, foi obtida no tratamento 2 mg L-1 de NAA com tempo de permanência de 15 dias nesta auxina. No experimento com poliaminas o melhor tratamento foi MS/2 + 5 mg L-1 de putrescina, com 27% de brotações enraizadas. Na presença de DTT (Dithiothreitol), 23% das brotações enraizaram em 0,10 mg L-1 de DTT. A presença da auxina NAA e a alternância no tempo de permanência foi a melhor condição para promover o enraizamento in vitro da de A. arvense.
auxinas; poliaminas; compostos fenólicos
This work was carried out in order to optimize an efficient protocol for the in vitro rooting of Anemopaegma arvense, a medicinal plant of the Brazilian Cerrado in danger of extinction, popularly known as Catuaba in Portuguese and widely used in folk medicine. Shoots cultivated in vitro were inoculated in liquid MS/2 and solid MS culture medium supplemented with different concentrations of auxins, polyamines or dithiothreitol (DTT). Evaluations were performed for the rooting percentage and for the number and length of roots. The presence of NAA (naphthaleneacetic acid) in the culture medium was essential to promote the induction of adventitious roots. Higher rooting percentage (50%) was obtained in the treatment with 2 mg L-1 NAA and duration of stay of 15 days in this auxin. In the experiment with polyamines, the best treatment was MS/2 + 5 mg L-1 putrescine with 27% of shoots rooted. In the presence of DTT (dithiothreitol), 23% of shoots rooted at 0.10 mg L-1 DTT. The presence of the auxin NAA and the alternation in length of stay was the best condition to promote in vitro rooting of A. arvense.
auxins; polyamines; phenolic compounds
INTRODUÇÃO
Anemopaegma arvense (Vell.) Stell. ex de Souza (Bignoniaceae), conhecida popularmente como catuaba, é uma planta medicinal endêmica do Cerrado, potencialmente útil para a indústria farmacêutica. Os metabólitos secundários de interesse desta espécie estão localizados em suas raízes, cuja ação é estimulante e tonificante do sistema nervoso central em humanos (Hoehne, 1978HOEHNE, M.V. Plantas e substâncias vegetais tóxicas e medicinais. São Paulo, p. 269-271, 1978.).
Atualmente a A. arvense encontra-se na lista de flora ameaçada de
extinção do Brasil, na categoria vulnerável (BDT,
2002BDT: Base de Dados Tropical. Disponível em:
http://www.bdt.fat.org.b/iScan?278+edora+1+0+Anemopaegma bAND barvense. Acesso em
20/05/2004.
http://www.bdt.fat.org.b/iScan?278+edora...
), porque toda a coleta das plantas no hábitat natural é
realizada de maneira extrativista predatória não só pela população, mas também por
laboratórios farmacêuticos, sem preocupação quanto à conservação. Não existem até o
momento programas voltados à produção de mudas em escala comercial para esta espécie, o
que poderá amenizar o risco de erosão genética, bem como servir de subsídio para o
fornecimento de matéria prima para a produção de medicamentos. Pesquisas que viabilizem
a produção de plantas medicinais em larga escala são certamente os principais recursos
que poderão reduzir o impacto da devastação da flora do Cerrado.
Embora as sementes da espécie apresente tolerância a determinados tipos de estresse abiótico (Pereira et al., 2007PEREIRA, A.M.S.; SALOMÃO, A.N.; JANUÁRIO, A.H.; BERTONI, B.W.; AMUI, S.F.; FRANÇA, S.C. CERDEIRA, A.L.; MORAES, R.M. Seed germination and triterpenoid contente of Anemopaegma arvense (Vell.) Stellfeld varieties. Genetic Resourse and Crop Evolution, v.54, p.849-854, 2007.)o que facilita a propagação por via sexuada, somente a técnica da cultura de tecidos é capaz de viabilizar a produção de milhares de mudas, em curto período e espaço físico reduzido, capaz de suprir a demanda de indústrias farmacêuticas. Além disso, o desenvolvimento de metodologia de produção in vitro de A. Arvense, com ênfase na obtenção de raízes adventícias em brotações desta espécie é fundamental para se determinar protocolo para produção de raízes in vitro, visando obtenção de metabolitos secundários. De acordo com Pereira et al 2007PEREIRA, A.M.S.; SALOMÃO, A.N.; JANUÁRIO, A.H.; BERTONI, B.W.; AMUI, S.F.; FRANÇA, S.C. CERDEIRA, A.L.; MORAES, R.M. Seed germination and triterpenoid contente of Anemopaegma arvense (Vell.) Stellfeld varieties. Genetic Resourse and Crop Evolution, v.54, p.849-854, 2007. a produtividade de raízes desta espécie cultivadas em condição ex vitro é muito baixa.
O protocolo para a propagação in vitro da catuaba, foi estabelecido por Pereira et al. (2003)PEREIRA, A.M.S.; AMUI, S.F.; BERTONI, B.W. MORAES, R.M.; FRANÇA, S.C. Micropropagation of Anemopaegma arvense: Conservation of an Endangered Medicinal Plant. In: Planta Medica - Natural Products and Medicinal Plant Research. v.69, p.571-573, 2003.. Contudo, a metodologia empregada foi ineficiente quanto ao enraizamento. Considerando a necessidade da realização de ajustes neste já estabelecido a fim de viabilizar a produção de mudas de catuaba em escala comercial, objetivou-se com este trabalho otimizar o protocolo mais eficiente para o enraizamento in vitro de A. arvense.
MATERIAL E MÉTODO
Os experimentos foram conduzidos no Laboratório de Biotecnologia e Plantas Medicinais da Universidade de Ribeirão Preto (UNAERP). Como fonte de explantes, foram utilizadas brotações com 3-4 cm, multiplicadas in vitro segundo protocolo estabelecido por Pereira et al. (2003)PEREIRA, A.M.S.; AMUI, S.F.; BERTONI, B.W. MORAES, R.M.; FRANÇA, S.C. Micropropagation of Anemopaegma arvense: Conservation of an Endangered Medicinal Plant. In: Planta Medica - Natural Products and Medicinal Plant Research. v.69, p.571-573, 2003.. Uma exsicata está depositada no Herbário de Plantas Medicinais da Universidade de Ribeirão Preto (voucher HPMU-791, coletada no município de Altinópolis SP em 04/11/2003).
Para a instalação dos experimentos, foram utilizadas cubetas de vidro (25x85mm) contendo os meios de cultura MS sólido + 30 g L-1 de sacarose (Murashige e Skoog, 1962MURASHIGE, T.; SKOOG, F. A revised medium for rapid growth and bioassays with tobaco tissue cultures. Physiologia Plantarum,Copenhagen, v.1, p.437-496, 1962.) ou MS líquido com metade da concentração para macro e micronutrientes suplementada com 15 g L-1 de sacarose. As brotações foram colocadas nas cubetas, que foram tampadas com tampa plástica e vedadas com parafilme e mantidas em sala de crescimento sob condições controladas de temperatura 26±1ºC, fotoperíodo de 16 horas e intensidade luminosa de 25 μmol m-2 s-1, fornecida por lâmpadas do tipo fluorescente branca, até o momento da avaliação. O pH dos meios foi ajustado para 5,7±0,1 antes da autoclavagem e, para os tratamentos em meio líquido, foram utilizados papéis de filtro como suporte sólido.
Todos os experimentos foram instalados em delineamento experimental inteiramente casualizado (DIC) e todos os tratamentos constituíram-se de seis repetições e cinco cubetas/parcela. As avaliações foram realizadas aos 30 dias (experimento 1) e 60 dias (experimento 2 e 3), quanto à porcentagem de enraizamento, número e comprimento de raiz. Para a análise estatística dos resultados utilizou-se o software SISVAR(r) (Ferreira 2011FERREIRA, D.F. Sisvar: a computer statistical analysis system. Ciência e Agrotecnologia, v.35, p.1039-1042, 2011.) e os dados de todos os experimentos foram transformados pela equação .
Efeito do tempo de permanência dos explantes em presença de NAA e IBA
Foram instalados dois experimentos diferentes utilizando o NAA e o IBA. As brotações foram inoculadas em meio de cultura MS/2 líquido, suplementado com ácido naftaleno acético (NAA) ou ácido indol butírico (IBA), em diferentes concentrações, onde permaneceram por períodos de 10, 15 e 30 dias. Posteriormente, as brotações foram transferidas para o mesmo meio (MS/2 liquido), porém sem a adição do regulador. Os explantes que foram cultivados em meio de cultura MS/2 líquido sem auxina não foram transferidos e este tratamento sem regulador vegetal foi considerado o controle.
Os tratamentos foram: 1) MS/2 - controle; 2) MS/2 + 1 mg L-1 de NAA ou IBA, tempo de permanência 10 dias; 2) MS/2 + 1 mg L-1 de NAA ou IBA, tempo de permanência 15 dias; 4) MS/2 + 1 mg L-1 de NAA ou IBA, tempo de permanência 30 dias; 5) MS/2 + 2 mg L-1 de NAA ou IBA, tempo de permanência 10 dias; 6) MS/2 + 2 mg L-1 de NAA ou IBA, tempo de permanência 15 dias; 7) MS/2 + 2 mg L-1 de NAA ou IBA, tempo de permanência 30 dias; 8) MS/2 + 4 mg L-1 de NAA ou IBA, tempo de permanência 10 dias; 9) MS/2 + 2 mg L-1 de NAA ou IBA, tempo de permanência 15 dias; 10) MS/2 + 4 mg L-1 de NAA ou IBA, tempo de permanência 30 dias.
Efeito de diferentes concentrações e tipos de poliaminas
As brotações foram inoculadas em meio MS/2 líquido, suplementado diferentes concentrações de poliaminas e o tratamento sem adição do regulador vegetal, foi considerado o controle.
Os tratamentos foram: 1) controle - MS/2; 2) 1 mg L-1 de espermina; 3) 5 mg L-1 de espermina; 4) 10 mg L-1 de espermina; 5) 1 mg L-1 de espermidina; 6) 5 mg L-1 de espermidina; 7) 10 mg L-1 de espermidina; 8) 1 mg L-1 de putrescina; 9) 5 mg L-1 de putrescina; 10) 10 mg L-1 de putrescina; 11) 1 mg L-1 de 1,3-diaminopropano; 12) 5 mg L-1 de 1,3-diaminopropano; 13) 10 mg L-1 de 1,3-diaminopropano.
Efeito do Dithiothreitol (DTT)
A base das brotações selecionadas para este experimento foram mantidas durante 1 hora em solução de 8 mg L-1 de ágar + 0,20 mg L-1 de NAA e, posteriormente, transferidas para o meio MS + 2 g L-1 de Fitagel(r), suplementado com 0; 0,10 e 0,25 mg L-1 de dithiothreitol (DTT). O tratamento sem adição do regulador vegetal foi considerado o controle.
Os tratamentos foram: 1) controle - MS; 2) 0,10 mg L-1 de DTT; 3) 0,25 mg L-1 de DTT.
RESULTADO E DISCUSSÃO
Efeito do tempo de permanência das brotações em presença de NAA e IBA
A presença de NAA foi essencial para promover a indução de raízes adventícias nas brotações de catuaba in vitro. Nenhuma brotação enraizou no tratamento controle e a alternância da concentração da auxina e tempo de permanência, aumentou consideravelmente a porcentagem de enraizamento, o número e o comprimento das raízes. A suplementação do meio com 2 mg L-1 de NAA e o tempo de permanência de 15 dias, foi a melhor condição em que obteve-se 48,33% de enraizamento. Quando as brotações permaneceram durante 30 dias em 1 mg L-1 de NAA, 23,3% apresentaram raiz. Nos demais tratamentos, a porcentagem de enraizamento foi menor que 20% (Figura 1).
Para as brotações cultivadas na presença de IBA, os resultados foram diferentes e observou-se que esta auxina foi menos efetiva e menos tóxica em relação ao NAA. Maior porcentagem de enraizamento (27%) foi obtida quando as brotações permaneceram durante todo o tempo na presença da maior concentração testada, ou seja, 30 dias em 4 mg L-1 de IBA. Nos outros tratamentos, a porcentagem de enraizamento foi menor que 25% (Figura 1).
Porcentagem de enraizamento de plântulas de Anemopaegma arvense em função de diferentes concentrações de NAA (A) e IBA (B) em diferentes tempos de permanência, aos 30 dias.
A necessidade de suplementação do meio de cultura com auxinas durante a etapa de enraizamento in vitro, tem sido relatada por vários autores, principalmente para plantas lenhosas. Os resultados obtidos neste experimento corroboram com a literatura e com as respostas obtidas para várias espécies (Bosa et al., 2003BOSA, N.; CAVETE, E.O.; SUZIN, M.; BORDIGNON, L. Avaliação do crescimento de Gypsophila paniculata durante o enraizamento in vitro. Horticultura Brasileira, v. 21, p. 510-513, 2003.; Nodoye et al., 2003NODOYE, M.; DIALLO, I.; GASSAMA, Y.K. In vitro multiplication of the semi-arid forest tree, Balanites aegyptiaca (L.) Del. Africam Jounal of Biotechnology vol. 2, p. 421-424, 2003.; Souza et al., 2004SOUZA, A.V.; PINTO, J.E.B.P., BERTOLLUCCI, S.;TEIXEIRA, R.N. Enraizamento in vitro de plântulas de arnica (Lychnophora pinaster Mart.), uma planta medicinal. Revista Brasileira de plantas Medicinais, v.7, n.1, p.86-91, 2004.; Sharma et al., 2005SHARMA, A.R.; TRIGIANO, R.N.; WITTE, W.T.; SCHWARZ, O.J. In vitro adventitious rooting of Cornus florida microshoots. Short communication., Scientia Horticulturae v.103, p. 381-385, 2005.; Naija et al., 2008NAIJA, S.; ELLOUMI, N.; JBIR N.; AMMAR, S.; KEVERS, C. Anatomical and biochemical changes during adventitious rooting of apple rootstocks MM 106 cultured in vitro. Biologies, v.331, p.518-525, 2008.; Ramanayake et al., 2008RAMANAYAKE, S.M.S.D.; MADDEGODA, K.M.M.N.; VITHARANA, M.C.; et al. Root induction in three species of bamboo with different rooting abilities. Scientia Horticulturaev.118, p.270-273, 2008.; Phelan et al., 2009PHELAN, S.; HUNTER, A.; DOUGLAS, G. C. Effect of explants source on shoot proliferation and adventitious regeneration in 10 Buddleia cultivars. Scientia Horticulturae, v.120, p. 518-524, 2009.; Soares et al., 2011SOARES, F.P.; et al. Taxa de multiplicação e efeito residual de diferentes fontes de citocinina no cultivo in vitro de Hancornia speciosa gomes. Revista Ciência e Agrotecnologia, v. 35, p. 152-157, 2011.; Junior & Scherwinski-Pereira, 2012JUNIOR, P.C.P.F.; SCHERWINSKI-PEREIRA, J.E. Germinação e propagação in vitro de cerejeira (Amburana acreana (DUCKE) A.C. SMITH - Fabaceae). Ciência Florestal, v. 22, p.1-9, 2012.; Kataria et al., 2013KATARIA, N.; YADAV, K.; KUMARI, S.; SINGH, N. Micropropagation: An Important Tool for Conserving Forest Trees. Tropical Agricultural Science, v.36, p.1-26, 2013.).
Contudo, o efeito da auxina é significativamente variável entre as espécies, haja vista os inúmeros fatores que estão envolvidos no processo de enraizamento, especialmente o genótipo (Davis et al., 1988DAVIS, T.; HAISSIG, B.E.; SANKHLA, N. Adventitious root formation in cuttings. Portland - Oregon, 1988, v.2, 315p.; Assis & Teixeira, 1998ASSIS, T.F.; TEIXEIRA, S.L. Enraizamento de plantas lenhosas. In: TORRES, A. C.; CALDAS, L.S.; BUSO, J.A. Cultura de tecidos e transformação genética de plantas. Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 261-296.; Souza & Pereira, 2007SOUZA, A.V.; PINTO, J.E.B.P.; BERTOLLUCCI, S., CORREA, R. M. In vitro propagation of Lychnophora pinaster (Asteraceae): A Threatened Endemic Medicinal Plant. Hortscience, v.42, p.1665-1669, 2007.). Algumas auxinas como o NAA, podem, realmente, apresentar um efeito tóxico mais significativo quando comparado ao IBA (Grattapaglia & Machado, 1998GRATTAPAGLIA, D.; MACHADO, M. A. Micropropagação. In:TORRES, A. C. CALDAS, L. S.; BUSO, J. A.. Cultura de tecidos e transformação genética de plantas Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 43-76.; Souza et al., 2004SOUZA, A.V.; PINTO, J.E.B.P., BERTOLLUCCI, S.;TEIXEIRA, R.N. Enraizamento in vitro de plântulas de arnica (Lychnophora pinaster Mart.), uma planta medicinal. Revista Brasileira de plantas Medicinais, v.7, n.1, p.86-91, 2004.). Nesse caso, é recomendável que as brotações destinadas ao enraizamento in vitro, permaneçam apenas por alguns dias em meio contendo esta auxina.
Naija et al. (2008)NAIJA, S.; ELLOUMI, N.; JBIR N.; AMMAR, S.; KEVERS, C. Anatomical and biochemical changes during adventitious rooting of apple rootstocks MM 106 cultured in vitro. Biologies, v.331, p.518-525, 2008., obtiveram 97% de brotos enraizados de maçã quando estes permaneceram somente cinco dias na presença de 1 mg L-1 de IBA, o que também pode indicar um efeito tóxico desta auxina para esta espécie. Estes autores observaram em seus estudos anatômicos, que a divisão celular na zona cambial ocorreu em três dias na presença de auxina exógena e a individualização dos meristemóides radiculares em cinco dias.
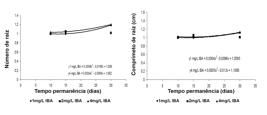
O número e o comprimento das raízes para as brotações cultivadas na presença de NAA seguiram o mesmo comportamento da variável porcentagem de enraizamento. Quando estes explantes permaneceram em 2 mg L-1 de NAA durante 20 dias, obteve-se o maior número de raízes (1,3 raízes) com o maior comprimento (1,3 cm) (Figura 2).
Número e comprimento de raiz de plântulas de Anemopaegma arvense em função do tempo de permanência (dias) em diferentes concentrações de NAA (mg L-1), aos 30 dias.
Os resultados obtidos estão de acordo com a literatura sobre o tempo de permanência de 2, 3 ou 4 semanas na presença de auxina exógena, como as condições mais adequadas para induzir o enraizamento in vitro em brotações (Grattapaglia e Machado, 1998GRATTAPAGLIA, D.; MACHADO, M. A. Micropropagação. In:TORRES, A. C. CALDAS, L. S.; BUSO, J. A.. Cultura de tecidos e transformação genética de plantas Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 43-76.; Souza e Pereira, 2007SOUZA, A.V.; PINTO, J.E.B.P.; BERTOLLUCCI, S., CORREA, R. M. In vitro propagation of Lychnophora pinaster (Asteraceae): A Threatened Endemic Medicinal Plant. Hortscience, v.42, p.1665-1669, 2007.).
As brotações cultivadas na presença de IBA emitiram o maior número de raiz no tratamento 4 mg L-1 e tempo de permanência de 30 dias (1,21 raízes). Nos tratamentos 1 ou 4 mg L-1 de IBA e 10 dias de permanência e 1 mg L-1 de IBA e 15 dias de permanência, as brotações apresentaram 1,02 raízes. Quando permaneceram durante 15 dias em 4 mg L-1 de IBA e 30 dias em 1 mg L-1 de IBA, o resultado foi de 1,08 raízes (Figura 3).
Número e comprimento de raiz de plântulas de Anemopaegma arvense em função do tempo de permanência (dias) em diferentes concentrações de IBA (mg L-1), aos 30 dias.
Para a característica comprimento de raiz, os resultados foram semelhantes e maior comprimento (1,21cm), foi obtido quando as brotações permaneceram durante 30 dias na presença de 4 mg L-1 de IBA, seguido de 1,15 cm, quando cultivadas nas mesmas condições na presença de 1 mg L-1 de IBA. As raízes apresentaram 1,0 cm quando permaneceram durante 10 ou 15 dias na presença de 1 ou 4 mg L-1 de IBA (Figura 3).
Estes resultados obtidos com a catuaba são interessantes, porque para esta espécie, a presença constante de uma fonte externa de auxina, não afetou o crescimento das raízes. A baixa porcentagem de enraizamento não foi devido à permanência constante na presença de IBA, mas sim ao efeito menos efetivo desta auxina para esta espécie.
As respostas obtidas para a catuaba, corroboram com os resultados reportados por Souza et al., (2004)SOUZA, A.V.; PINTO, J.E.B.P., BERTOLLUCCI, S.;TEIXEIRA, R.N. Enraizamento in vitro de plântulas de arnica (Lychnophora pinaster Mart.), uma planta medicinal. Revista Brasileira de plantas Medicinais, v.7, n.1, p.86-91, 2004.. Os autores obtiveram melhores respostas para a espécie medicinal do Cerrado, Lychnophora pinaster Mart. (Asteraceae), quando as brotações foram cultivadas por um período de duas semanas na presença de NAA e concluíram que esta auxina pode ser utilizada em protocolos de micropropagação para plantas medicinais lenhosas (Souza et al., 2007SOUZA, A.V.; PINTO, J.E.B.P.; BERTOLLUCCI, S., CORREA, R. M. In vitro propagation of Lychnophora pinaster (Asteraceae): A Threatened Endemic Medicinal Plant. Hortscience, v.42, p.1665-1669, 2007.).
Não foi observada a formação de calos na base nas brotações de A. arvense, para nenhum dos tratamentos.
Efeito de diferentes concentrações e tipos de poliaminas
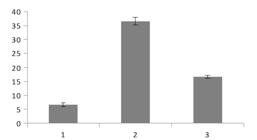
O efeito das poliaminas no enraizamento in vitro da catuaba foi consideravelmente diferente quando comparado às auxinas, pois as brotações enraizaram em todos os tratamentos. Contudo, a maior porcentagem de enraizamento obtida foi menor que 50%. O meio MS/2 + 5 mg L-1 de putrescina foi o melhor tratamento com 27% de enraizamento. Nos outros tratamentos, a porcentagem de enraizamento foi menor que 20% (Figura 4). Para o número e comprimento de raiz, não houve diferença estatística significativa entre tipos e concentrações das poliaminas testadas, assim como na interação poliaminas x concentração (Tabela 1).
Porcentagem de enraizamento de brotações de Anemopaegma arvense em função de diferentes concentrações e tipos de poliaminas em meio MS/2, aos 60 dias.
Vários autores sugerem que há uma correlação entre o conteúdo endógeno de poliaminas e o desenvolvimento de raízes. Além da associação com atividades meristemáticas, a ação das poliaminas também pode estar relacionada à interação com fito-hormônios e interações bioquímicas inespecíficas em níveis moleculares com outras substâncias envolvidas no processo de indução de raízes (Sankhla e Upadhyaya, 1988SANKHLA, A.; UPADHYAYA, A. Polyamines and adventitious root formation. In: DAVIS, T.D.; HAISSIG, B.E.; SANKHLA, N. Adventitious root formation in cuttings. Portland - Oregon, 1988, v.2, p. 289-302.; Couée et al., 2004COUÉE, I.; HUMMEL, I.; SULMON, C.; GOUESBET, G.; EL AMRANI, A. Involvement of polyamines in root development. Plant Cell, Tissue and Organ Culture, v.76, p. 1-10, 2004.). Estudos realizados por esses mesmos autores mostram que existe uma relação entre crescimento de raízes e conteúdo endógeno de espermina, espermidina, putrescina e 1,3 diaminopropano.
Estudos realizados com Berberis buxifolia Lam (Berberidaceae) envolvendo a atividade da peroxidase e variações nos níveis endógenos das poliaminas putrescina, espermidina e espermina, mostraram mudanças significativas deste compostos no período de enraizamento, constatando que houve baixa concentração de poliaminas e alta atividade de peroxidade, durante os primeiros quatro dias do processo de indução de raízes (Arena et al., 2003ARENA, M.E.; MARTÍNEZ, G.; GUSTAVO, V. In vitro propagation of Berberis buxifolia Lam. Biocell, v.24, p.73-80, 2003.).
Outro fator relevante no enraizamento é que o balanço total de diferentes poliaminas pode ser mais importante do que o uso isolado de cada poliamina (Couée et al., 2004COUÉE, I.; HUMMEL, I.; SULMON, C.; GOUESBET, G.; EL AMRANI, A. Involvement of polyamines in root development. Plant Cell, Tissue and Organ Culture, v.76, p. 1-10, 2004.; Tang et al., 2004TANG, W.; NEWTON, R. J. Increase of polyfhenol oxidase and decrease of polyamines correlate with tissue browning in Virginia pine (Pinus virginiana Mill.). Plant Science, v. 167, p.621-628, 2004.).
Neste experimento com A. arvense, embora tenha sido utilizado vários tipos de poliaminas estas foram adicionadas ao meio de cultura isoladamente e em concentrações relativamente altas, o que pode ter influenciado negativamente na indução de raízes, tendo em vista que embora o enraizamento tenha ocorrido este foi consideravelmente baixo.
A importância das poliaminas nos diferentes aspectos do desenvolvimento de raiz, incluindo o crescimento de raízes primárias, laterais e adventícias já esta bem consolidada. Entretanto a concentração ideal para indução de raízes é discrepante entre espécies variando de 0,5 mg L-1 a 50 mg L-1 (Lee 1997LEE, T.M. ; Polyamine regulation of growth and chilling toler- ance of rice (Oryza sativa L.) roots cultured in vitro. Plant Sci. 122: 111-117, 1997.; Hummel et al., 2002HUMMEL, I.; COUÉE, I.; EL AMRANI, A.; MARTIN-TANGUY, J.; HENNION, F. Involvement of polyamines in root development at low temperature in the subantarctic cruciferous species Pringlea antiscorbutica. J. Exp. Bot. v. 53, p. 1463-1473, 2002.; Couée et al., 2004COUÉE, I.; HUMMEL, I.; SULMON, C.; GOUESBET, G.; EL AMRANI, A. Involvement of polyamines in root development. Plant Cell, Tissue and Organ Culture, v.76, p. 1-10, 2004.; Yang et al., 2010YANG, Y.K.; LEE, S.Y.; PARK, W.T.; PARK, N.; PARK, S.U. Exogenous auxins and polyamines enhance growth and rosmarinic acid production in hairy root cultures of Nepeta cataria L. Plant Omics Journal POJ, v.3, p. 190-193, 2010.). Isto representa um desafio para o estabelecimento de dosagens adequadas para o enraizamento in vitro. Outro fator importante a ser considerado além da concentração, é que para espécies recalcitrantes a associação de poliaminas e auxinas pode ser necessário (Tonon et al , 2001TONON, G.; KEVERS, C.; GASPAR, T. Changes in polyamines, auxins and peroxidase activity during in vitro rooting of Fraxinus angustifolia shoots: an auxin-independent rooting model. Tree Physiol. v. 21, p. 655-663, 2001.).
Efeito do Efeito do Dithiothreitol (DTT)
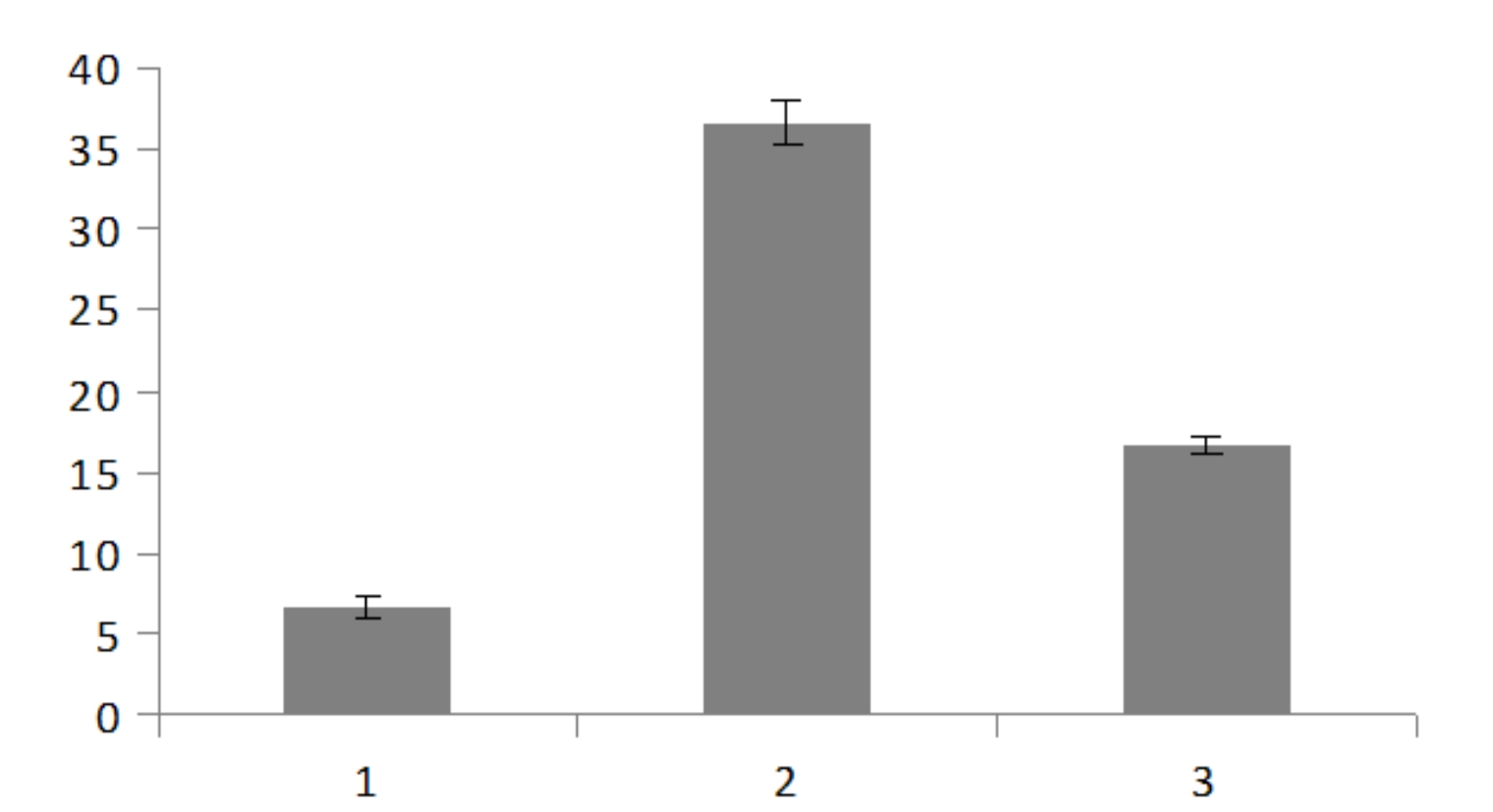
Assim como as outras substâncias, o DTT promoveu o enraizamento in vitro da catuaba. Aos 60 dias, a maior porcentagem de enraizamento (37%) foi obtida em 0,10 mg L-1 de DTT. Na concentração de 0,25 mg L-1, o valor foi 17% e no tratamento controle, 6,7% (Figura 5). Mas também não houve diferença estatística entre as concentrações de DTT testadas para o número e o comprimento de raiz de A. arvense e o valor médio foi uma raiz com 1,0 cm, aproximadamente.
Porcentagem de enraizamento de plântulas de Anemopaegma arvense em função de diferentes concentrações de dithiothreitol (DTT) aos 60 dias.
A ação dos compostos fenólicos na indução de raízes adventícias está relacionada a sua ação como co-fatores de enraizamento. Esses co-fatores agem como indutor das auxinas estimulando sua síntese e aumentando sua liberação, mas podem atuar também, como protetores de auxinas endógenas, servindo de substrato alternativo para a IAA-oxidase (Aloufa, 2003ALOUFA, M.A.I. Enraizamento in vitro de plantas lenhosas: Dificuldades e soluções. In: XIV Congresso Brasileiro de Floricultura e Plantas ornamentais e I Congresso Brasileiro de Cultura de Tecidos de Plantas. Universidade Federal de Lavras, Lavras - MG.; Grattapaglia & Machado, 1998GRATTAPAGLIA, D.; MACHADO, M. A. Micropropagação. In:TORRES, A. C. CALDAS, L. S.; BUSO, J. A.. Cultura de tecidos e transformação genética de plantas Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 43-76.; Assis & Teixeira, 1998ASSIS, T.F.; TEIXEIRA, S.L. Enraizamento de plantas lenhosas. In: TORRES, A. C.; CALDAS, L.S.; BUSO, J.A. Cultura de tecidos e transformação genética de plantas. Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 261-296., McCown, 1988MCCOWN, B.H. Adventitious Rooting of Tissue Cultured Plants. In: DAVIS, T.D.; HAISSIG, B. E.; SANKHLA, N.. Adventitious root formation in cuttings Portland - Oregon, 1988, v.2, p. 289-302.). Quando agem como protetores de auxinas, os polímeros de ortho-dihydroxyphenois, específicos (co-fatores de enraizamento), são produzidos nas folhas e brotos e translocados à região de enraizamento, onde, junto com auxinas e polifenoloxidases, dão origem a um complexo estimulador de enraizamento que conduz à iniciação e crescimento do primórdio radicial (Aloufa, 2003ALOUFA, M.A.I. Enraizamento in vitro de plantas lenhosas: Dificuldades e soluções. In: XIV Congresso Brasileiro de Floricultura e Plantas ornamentais e I Congresso Brasileiro de Cultura de Tecidos de Plantas. Universidade Federal de Lavras, Lavras - MG.).
O composto dithiothreitol (DTT) tem se mostrado efetivo para algumas espécies que apresentam dificuldade de enraizamento (Auderset et al., 1997AUDERSERT, G.; MONCOUSIN, C.; O'ROURKE, J.; JAMES MORRE, D. Stimulation of root formation in difficult-to-toot woody cuttings by dithiothreitol. International Journal of Plant Sciences, v.158, p.132-135, 1997.; Vasar & Svensson, 2005VASAR, V.; SVENSSON, M. Effects antioxidants on root formation and morphology of micropropagated Prunus avium. New Phytologist, 2005, p. 773-781.; Biondo et al., 2004BIONDO, R.; SOARES, A.M.; BERTONI, B.W.; FRANÇA, S.C.; PEREIRA, A.M.S. Direct organogenesis of Mandevilla illustris (Vell) Woodson and efects of its aqueous extract on the enzymatic and toxic activities of Crotalus durissus terrificus snake venom. Plant Cell Report. , v.22, p.549-552, 2004.). Essas substâncias geralmente são empregadas quando o interesse é a eliminação de espécies reativas de oxigênio e a neutralização de oxidantes extracelulares (Murina et al., 2005MURINA, M. A. et al. Chemiluminescence in a stimulated polymorphonuclear leukocytes - Luminol system: suppression by thiols. Biofizika, v. 50, p. 1100-1104, 2005.). Quando Vasar e Svensson (2005)VASAR, V.; SVENSSON, M. Effects antioxidants on root formation and morphology of micropropagated Prunus avium. New Phytologist, 2005, p. 773-781., testaram o efeito de DTT juntamente com outros antioxidantes na formação de raiz e morfologia de plantas micropropagadas de Prunus avium L. (Rosaceae), cultivar Stella e Va, observaram o DTT e os outros antioxidantes, mostraram influência positiva na morfologia das raízes somente para a cultivar Stella. Contudo, quando Biondo et al., (2004)BIONDO, R.; SOARES, A.M.; BERTONI, B.W.; FRANÇA, S.C.; PEREIRA, A.M.S. Direct organogenesis of Mandevilla illustris (Vell) Woodson and efects of its aqueous extract on the enzymatic and toxic activities of Crotalus durissus terrificus snake venom. Plant Cell Report. , v.22, p.549-552, 2004., estudaram o efeito do DTT no enraizamento in vitro de Mandevilla illustris (Vell.) Woodson (Apocynaceae), observaram que diferentemente dos resultados obtidos neste estudo com a catuaba, o DTT, não foi eficiente para promover o enraizamento.
De acordo com os resultados obtidos neste trabalho, pode-se concluir que a espécie A. arvense comporta-se de maneira diferente quanto à indução de raízes adventícias in vitro, quando submetidas à ação de substâncias empregadas para tal finalidade em estudos de cultura de tecidos.
Nos experimentos em que se utilizou poliaminas, pode ser que a alta taxa da peroxidase tenha afetado os níveis endógenos nas brotações e, a suplementação com poliaminas exógenas não tenha sido suficiente para induzir o enraizamento, uma vez que estas foram testadas separadamente. Contudo, para que se obtenha o maior número de brotações enraizadas, maior número e comprimento de raiz, as brotações de A. arvense, devem permanecer durante 20 dias, na concentração de 2 mg L-1 de NAA.
As plantas produzidas in vitro foram aclimatizadas com taxa de sobrevivência aproximada de 60%.
- ALOUFA, M.A.I. Enraizamento in vitro de plantas lenhosas: Dificuldades e soluções. In: XIV Congresso Brasileiro de Floricultura e Plantas ornamentais e I Congresso Brasileiro de Cultura de Tecidos de Plantas. Universidade Federal de Lavras, Lavras - MG.
- ARENA, M.E.; MARTÍNEZ, G.; GUSTAVO, V. In vitro propagation of Berberis buxifolia Lam. Biocell, v.24, p.73-80, 2003.
- ASSIS, T.F.; TEIXEIRA, S.L. Enraizamento de plantas lenhosas. In: TORRES, A. C.; CALDAS, L.S.; BUSO, J.A. Cultura de tecidos e transformação genética de plantas. Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 261-296.
- AUDERSERT, G.; MONCOUSIN, C.; O'ROURKE, J.; JAMES MORRE, D. Stimulation of root formation in difficult-to-toot woody cuttings by dithiothreitol. International Journal of Plant Sciences, v.158, p.132-135, 1997.
- BDT: Base de Dados Tropical. Disponível em: http://www.bdt.fat.org.b/iScan?278+edora+1+0+Anemopaegma bAND barvense. Acesso em 20/05/2004.
» http://www.bdt.fat.org.b/iScan?278+edora+1+0+Anemopaegma bAND barvense - BIONDO, R.; SOARES, A.M.; BERTONI, B.W.; FRANÇA, S.C.; PEREIRA, A.M.S. Direct organogenesis of Mandevilla illustris (Vell) Woodson and efects of its aqueous extract on the enzymatic and toxic activities of Crotalus durissus terrificus snake venom. Plant Cell Report. , v.22, p.549-552, 2004.
- BOSA, N.; CAVETE, E.O.; SUZIN, M.; BORDIGNON, L. Avaliação do crescimento de Gypsophila paniculata durante o enraizamento in vitro. Horticultura Brasileira, v. 21, p. 510-513, 2003.
- COUÉE, I.; HUMMEL, I.; SULMON, C.; GOUESBET, G.; EL AMRANI, A. Involvement of polyamines in root development. Plant Cell, Tissue and Organ Culture, v.76, p. 1-10, 2004.
- DAVIS, T.; HAISSIG, B.E.; SANKHLA, N. Adventitious root formation in cuttings. Portland - Oregon, 1988, v.2, 315p.
- FERREIRA, D.F. Sisvar: a computer statistical analysis system. Ciência e Agrotecnologia, v.35, p.1039-1042, 2011.
- GRATTAPAGLIA, D.; MACHADO, M. A. Micropropagação. In:TORRES, A. C. CALDAS, L. S.; BUSO, J. A.. Cultura de tecidos e transformação genética de plantas Brasília: Embrapa-SPI / Embrapa-CNPH, 1998, v.1, p. 43-76.
- HOEHNE, M.V. Plantas e substâncias vegetais tóxicas e medicinais. São Paulo, p. 269-271, 1978.
- HUMMEL, I.; COUÉE, I.; EL AMRANI, A.; MARTIN-TANGUY, J.; HENNION, F. Involvement of polyamines in root development at low temperature in the subantarctic cruciferous species Pringlea antiscorbutica. J. Exp. Bot. v. 53, p. 1463-1473, 2002.
- JUNIOR, P.C.P.F.; SCHERWINSKI-PEREIRA, J.E. Germinação e propagação in vitro de cerejeira (Amburana acreana (DUCKE) A.C. SMITH - Fabaceae). Ciência Florestal, v. 22, p.1-9, 2012.
- KATARIA, N.; YADAV, K.; KUMARI, S.; SINGH, N. Micropropagation: An Important Tool for Conserving Forest Trees. Tropical Agricultural Science, v.36, p.1-26, 2013.
- MCCOWN, B.H. Adventitious Rooting of Tissue Cultured Plants. In: DAVIS, T.D.; HAISSIG, B. E.; SANKHLA, N.. Adventitious root formation in cuttings Portland - Oregon, 1988, v.2, p. 289-302.
- LEE, T.M. ; Polyamine regulation of growth and chilling toler- ance of rice (Oryza sativa L.) roots cultured in vitro. Plant Sci. 122: 111-117, 1997.
- MURASHIGE, T.; SKOOG, F. A revised medium for rapid growth and bioassays with tobaco tissue cultures. Physiologia Plantarum,Copenhagen, v.1, p.437-496, 1962.
- MURINA, M. A. et al. Chemiluminescence in a stimulated polymorphonuclear leukocytes - Luminol system: suppression by thiols. Biofizika, v. 50, p. 1100-1104, 2005.
- NAIJA, S.; ELLOUMI, N.; JBIR N.; AMMAR, S.; KEVERS, C. Anatomical and biochemical changes during adventitious rooting of apple rootstocks MM 106 cultured in vitro. Biologies, v.331, p.518-525, 2008.
- NODOYE, M.; DIALLO, I.; GASSAMA, Y.K. In vitro multiplication of the semi-arid forest tree, Balanites aegyptiaca (L.) Del. Africam Jounal of Biotechnology vol. 2, p. 421-424, 2003.
- PASTUR, G.M.; ARENA, M.E.;BANAVIDES, M.P. et al. Role of polyamines during in vitro rhizogenesis of Nothofagus nervosa using successive culture media. New Forests, v.34, p.83-93, 2005.
- PEREIRA, A.M.S.; AMUI, S.F.; BERTONI, B.W. MORAES, R.M.; FRANÇA, S.C. Micropropagation of Anemopaegma arvense: Conservation of an Endangered Medicinal Plant. In: Planta Medica - Natural Products and Medicinal Plant Research. v.69, p.571-573, 2003.
- PEREIRA, A.M.S.; SALOMÃO, A.N.; JANUÁRIO, A.H.; BERTONI, B.W.; AMUI, S.F.; FRANÇA, S.C. CERDEIRA, A.L.; MORAES, R.M. Seed germination and triterpenoid contente of Anemopaegma arvense (Vell.) Stellfeld varieties. Genetic Resourse and Crop Evolution, v.54, p.849-854, 2007.
- PHELAN, S.; HUNTER, A.; DOUGLAS, G. C. Effect of explants source on shoot proliferation and adventitious regeneration in 10 Buddleia cultivars. Scientia Horticulturae, v.120, p. 518-524, 2009.
- RAMANAYAKE, S.M.S.D.; MADDEGODA, K.M.M.N.; VITHARANA, M.C.; et al. Root induction in three species of bamboo with different rooting abilities. Scientia Horticulturaev.118, p.270-273, 2008.
- SHARMA, A.R.; TRIGIANO, R.N.; WITTE, W.T.; SCHWARZ, O.J. In vitro adventitious rooting of Cornus florida microshoots. Short communication., Scientia Horticulturae v.103, p. 381-385, 2005.
- SANKHLA, A.; UPADHYAYA, A. Polyamines and adventitious root formation. In: DAVIS, T.D.; HAISSIG, B.E.; SANKHLA, N. Adventitious root formation in cuttings. Portland - Oregon, 1988, v.2, p. 289-302.
- SOARES, F.P.; et al. Taxa de multiplicação e efeito residual de diferentes fontes de citocinina no cultivo in vitro de Hancornia speciosa gomes. Revista Ciência e Agrotecnologia, v. 35, p. 152-157, 2011.
- SOUZA, A.V.; PINTO, J.E.B.P.; BERTOLLUCCI, S., CORREA, R. M. In vitro propagation of Lychnophora pinaster (Asteraceae): A Threatened Endemic Medicinal Plant. Hortscience, v.42, p.1665-1669, 2007.
- SOUZA, A.V.; PINTO, J.E.B.P., BERTOLLUCCI, S.;TEIXEIRA, R.N. Enraizamento in vitro de plântulas de arnica (Lychnophora pinaster Mart.), uma planta medicinal. Revista Brasileira de plantas Medicinais, v.7, n.1, p.86-91, 2004.
- SOUZA, A.V.; PEREIRA, A.M.S. Enraizamento de plantas cultivadas in vitro. Revista Brasileira de Plantas Medicinais. v.9, p.103-117, 2007.
- TANG, W.; NEWTON, R. J. Increase of polyfhenol oxidase and decrease of polyamines correlate with tissue browning in Virginia pine (Pinus virginiana Mill.). Plant Science, v. 167, p.621-628, 2004.
- TONON, G.; KEVERS, C.; GASPAR, T. Changes in polyamines, auxins and peroxidase activity during in vitro rooting of Fraxinus angustifolia shoots: an auxin-independent rooting model. Tree Physiol. v. 21, p. 655-663, 2001.
- URIBE, M.E.; MATER, M.E.; CAAL, M.J.; et al. Specific polyamine ratios as indicators of Pinus caribaea microshoot rooting phases. Plant Biosystem, v. 142, p.446-453, 2008.
- VASAR, V.; SVENSSON, M. Effects antioxidants on root formation and morphology of micropropagated Prunus avium. New Phytologist, 2005, p. 773-781.
- YANG, Y.K.; LEE, S.Y.; PARK, W.T.; PARK, N.; PARK, S.U. Exogenous auxins and polyamines enhance growth and rosmarinic acid production in hairy root cultures of Nepeta cataria L. Plant Omics Journal POJ, v.3, p. 190-193, 2010.
Disponibilidade de dados
Citações de dados
BDT: Base de Dados Tropical. Disponível em: http://www.bdt.fat.org.b/iScan?278+edora+1+0+Anemopaegma bAND barvense. Acesso em 20/05/2004.
Datas de Publicação
-
Publicação nesta coleção
Jan-Mar 2015
Histórico
-
Recebido
22 Abr 2012 -
Aceito
28 Maio 2014