Resumos
Objetivou-se avaliar os efeitos de óleo de soja (500 mL/animal/dia), Rumensin® (3 g/animal/dia) e níveis de concentrado (0, 25, 50, 75%) na dieta de bovinos, e cana-de-açúcar como volumoso, sobre alguns parâmetros ruminais e consumo de matéria seca. Foram utilizados quatro bovinos 7/8 holandês-zebu fistulados no rúmen, com peso vivo médio de 400 kg. O experimento consistiu de quatro períodos de 15 dias, sendo 12 dias para adaptação à dieta e três dias para coletas de amostras. Utilizou-se um nível de concentrado em cada período e o óleo e rumensin foram distribuídos em quadrado latino, em um fatorial 2x2. As análises de amônia, pH e AGV do líquido ruminal foram feitas em amostras coletadas através da fístula às 0, 3 e 6 horas após a alimentação. A leitura do pH foi feita com potenciômetro, as análises de amônia por colorimetria e as de ácidos graxos voláteis por cromatografia gasosa. O acetato, a relação acetato:propionato e o pH decresceram, e os teores de isobutirato, isovalerato e amônia ruminal aumentaram com a elevação do nível de concentrado. O propionato aumentou e a relação acetato:propionato diminuiu com a presença de Rumensin. O butirato aumentou com o óleo quando a dieta continha somente volumoso e diminuiu com o aumento de concentrado. O pH e a amônia ruminais diminuíram com o tempo de coleta. A atividade in vitro de desaminação pela população microbiana decresceu com o aumento do nível de concentrado e aumentou na presença de óleo. O consumo de matéria seca aumentou com a elevação do nível de concentrado e diminuiu na presença de Rumensin e óleo. Todos os outros efeitos principais e interações não foram significativos.
bovinos; concentrado; fermentação; ionóforos; lipídios; rúmen
The objective of this research was to evaluate the effects of soybean oil (500 mL/animal/day), Rumensin® (3g/animal/day) and levels of concentrate (0, 25, 50 and 75%) in the diet of bovines, and sugarcane as a forage source, in some ruminal parameters and dry matter intake. There were used four rumen fistulated 7/8 holstein-zebu steers, at 400 kg of live weight. The experiment consisted of four periods of 15 days, in which 12 were for adaptation to the diets and three for sampling. It was used one level of concentrate in each period and oil and Rumensin were distributed in a latin square, as 2x2 factorial design. Ammonia, pH and VFA analysis in the rumen fluid were measured in samples collected at 0, 3 and 6 hours after feeding. The pH was immediately measured by glass electrode, ammonia was analysed by colorimetry and VFA by gas chromatography. Acetate, acetate to propionate ratio and pH were decreased, but isobutyrate, isovalerate, and ruminal ammonia were increased in high concentrate levels. Propionate was increased and acetate to propionate ratio was decreased with Rumensin. Butyrate was increased with oil in the forage diet, but decreased with increasing concentrate. Ruminal ammonia and pH were decreased during sampling time. In vitro deamination activity by the mixed ruminal bacteria decreased by increasing concentrate and increased by adding oil. Dry matter intake increased by increasing concentrate level and decreased with Rumensin and oil. All other main effects and interactions were not significant.
bovine; concentrate; fermentation; ionophore; lipids; rumen
Influência de Rumensin®, Óleo de Soja e Níveis de Concentrado sobre o Consumo e os Parâmetros Fermentativos Ruminais em Bovinos1 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG.
Luiz Henrique Vargas2 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , Rogério de Paula Lana3 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , Antônio Bento Mâncio3 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , José Maurício de Souza Campos3 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , Gulab Newamdram Jham4 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , Acyr Wanderley de Paula Freitas2 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG. , Marcus Vinicius Morais de Oliveira2 1 Parte da tese de Mestrado do primeiro autor apresentada à Universidade Federal de Viçosa - Viçosa-MG.
RESUMO - Objetivou-se avaliar os efeitos de óleo de soja (500 mL/animal/dia), Rumensin® (3 g/animal/dia) e níveis de concentrado (0, 25, 50, 75%) na dieta de bovinos, e cana-de-açúcar como volumoso, sobre alguns parâmetros ruminais e consumo de matéria seca. Foram utilizados quatro bovinos 7/8 holandês-zebu fistulados no rúmen, com peso vivo médio de 400 kg. O experimento consistiu de quatro períodos de 15 dias, sendo 12 dias para adaptação à dieta e três dias para coletas de amostras. Utilizou-se um nível de concentrado em cada período e o óleo e rumensin foram distribuídos em quadrado latino, em um fatorial 2x2. As análises de amônia, pH e AGV do líquido ruminal foram feitas em amostras coletadas através da fístula às 0, 3 e 6 horas após a alimentação. A leitura do pH foi feita com potenciômetro, as análises de amônia por colorimetria e as de ácidos graxos voláteis por cromatografia gasosa. O acetato, a relação acetato:propionato e o pH decresceram, e os teores de isobutirato, isovalerato e amônia ruminal aumentaram com a elevação do nível de concentrado. O propionato aumentou e a relação acetato:propionato diminuiu com a presença de Rumensin. O butirato aumentou com o óleo quando a dieta continha somente volumoso e diminuiu com o aumento de concentrado. O pH e a amônia ruminais diminuíram com o tempo de coleta. A atividade in vitro de desaminação pela população microbiana decresceu com o aumento do nível de concentrado e aumentou na presença de óleo. O consumo de matéria seca aumentou com a elevação do nível de concentrado e diminuiu na presença de Rumensin e óleo. Todos os outros efeitos principais e interações não foram significativos.
Palavras-chave: bovinos, concentrado, fermentação, ionóforos, lipídios, rúmen
Effect of Rumensin
®, Soybean Oil and Concentrate Levels on Ruminal Parameters and Dry Matter Intake in Bovines
ABSTRACT - The objective of this research was to evaluate the effects of soybean oil (500 mL/animal/day), Rumensin® (3g/animal/day) and levels of concentrate (0, 25, 50 and 75%) in the diet of bovines, and sugarcane as a forage source, in some ruminal parameters and dry matter intake. There were used four rumen fistulated 7/8 holstein-zebu steers, at 400 kg of live weight. The experiment consisted of four periods of 15 days, in which 12 were for adaptation to the diets and three for sampling. It was used one level of concentrate in each period and oil and Rumensin were distributed in a latin square, as 2x2 factorial design. Ammonia, pH and VFA analysis in the rumen fluid were measured in samples collected at 0, 3 and 6 hours after feeding. The pH was immediately measured by glass electrode, ammonia was analysed by colorimetry and VFA by gas chromatography. Acetate, acetate to propionate ratio and pH were decreased, but isobutyrate, isovalerate, and ruminal ammonia were increased in high concentrate levels. Propionate was increased and acetate to propionate ratio was decreased with Rumensin. Butyrate was increased with oil in the forage diet, but decreased with increasing concentrate. Ruminal ammonia and pH were decreased during sampling time. In vitro deamination activity by the mixed ruminal bacteria decreased by increasing concentrate and increased by adding oil. Dry matter intake increased by increasing concentrate level and decreased with Rumensin and oil. All other main effects and interactions were not significant.
Key Words: bovine, concentrate, fermentation, ionophore, lipids, rumen
Introdução
Os ionóforos são produtos da fermentação de vários actinomicetos, sendo a monensina um composto ionóforo produzido por linhagens de Streptomices cinnamonensis, originalmente utilizada como agente coccidiostático em dietas de aves (RICHARDSON et al., 1976). A partir de 1967, com a observação de que possuía atividade moderada contra microrganismos gram-positivos (HANEY e HOEHN, 1967), a monensina passou a ser testada sobre microrganismos do rúmen. Existem mais de 70 tipos diferentes de ionóforos, porém apenas a monensina e a lasalocida, comercializadas como Rumensin® e Bovitec®, respectivamente, foram aprovadas para serem utilizadas na alimentação de bovinos, tendo como principal objetivo aumentar a eficiência alimentar (LANA, 1998).
O aumento no desempenho dos animais é atribuído principalmente à melhora da eficiência energética, devido ao aumento da produção do ácido propiônico, redução da relação acetato/propionato e diminuição da produção de metano, além da diminuição da produção de ácido lático e redução nas perdas de aminoácidos que seriam potencialmente fermentados no rúmen (RUSSELL e STROBEL, 1989).
Os ionóforos modificam o movimento dos íons através das membranas celulares, afetando assim o desenvolvimento dos microrganismos. Quando fornecidos aos ruminantes, vão atuar sobre bactérias do rúmen e intestino grosso. Os ionóforos favorecem o desenvolvimento de certas bactérias em relação a outras, e o metabolismo da bactéria beneficiada pode afetar o desempenho do animal hospedeiro, proporcionando vantagens metabólicas ou nutricionais em relação ao animal não suplementado (McGuffey, 1995, citado por BAGG, 1997).
Mesmo com mais de 20 anos de utilização de ionóforos para bovinos, seu mecanismo de atuação ruminal não está completamente elucidado. O mecanismo de ação e os efeitos dos ionóforos sobre a população microbiana, têm sido normalmente baseados em experimentos com culturas puras, extrapolando-se estes dados para as condições in vivo. Deste modo, a ação dos ionóforos sobre o desempenho animal ainda permanece discutível (LANA, 1997).
Uma nova técnica para avaliação in vivo de ionóforos, desenvolvida por LANA e RUSSELL (1996), é baseada na determinação da capacidade das bactérias ruminais em resistir à perda de potássio intracelular quando submetidas a níveis crescentes do ionóforo. Através desta técnica será possível a avaliação de novos ionóforos, assim como da população microbiana efetiva do rúmen.
A aplicação da técnica citada acima permitiu obter alguns dados interessantes. LANA e RUSSELL (1996) observaram que a adição de óleo de milho à ração aumentou a resistência das bactérias ruminais à perda do potássio intracelular, quando foram submetidas a níveis crescentes de monensina e lasalocida no laboratório. Este resultado, junto com a redução na relação acetato:propionato pelo óleo de milho (modo de ação semelhante aos ionóforos), podem explicar a falta de efeito da monensina + tilosina no desempenho alimentar quando a dieta continha gordura, conforme observado por CLARY et al. (1993).
Os ácidos graxos insaturados de cadeia longa reduzem a digestibilidade e a relação acetato:propionato, inibem a produção de metano e alteram a resistência das bactérias ruminais aos ionóforos, como comentado anteriormente. Experimentos in vitro demonstraram aumento na eficiência de síntese microbiana e redução na concentração de amônia ruminal, em animais recebendo óleo na dieta (VAN NEVEL e DEMEYER, 1988).
ANDRADE et al. (1996) utilizaram monensina na terminação de novilhos mestiços, em três tratamentos: T1 - controle, T2 - 300 mg de monensina/cabeça/dia adicionada ao suplemento mineral e T3 - idem ao T2 mais 300 mg de levedura de cana de açúcar. Não houve diferença nos ganhos de peso entre os animais que recebiam o T1 e o T2, contrariando BOLING et al. (1977) e PARROT et al. (1990) que observaram a elevação do ganho de peso com a adição de monensina na dieta de animais alimentados com altas proporções de volumosos. O fato da monensina funcionar como inibidor de apetite, em função do seu gosto amargo, sugere que houve inibição do consumo. Ao se adicionar levedura de cana como palatabilizante à dieta, houve aumento no ganho de peso em relação aos demais grupos, sugerindo um aumento de consumo com conseqüente aproveitamento da proteína do suplemento, o que está de acordo com GOODRICH et al. (1984) e MULLER et al. (1986).
Existem várias interações entre a monensina, e possivelmente outros ionóforos, com a alimentação, e algumas ainda são desconhecidas pelos nutricionistas. GOODRICH et al. (1984) verificaram em um trabalho de revisão de literatura, que a monensina teve melhor efeito sobre a conversão alimentar de bovinos em pastagens, do que em confinamento à base de concentrados (13% vs 7,5%). LANA et al. (1997) observaram em dietas ricas em concentrado, que a monensina melhorou a conversão alimentar em 6% quando a ração era suplementada com proteína verdadeira (farelo de soja), mas não houve efeito quando utilizou-se nitrogênio não protéico (uréia). CLARY et al. (1993) verificaram que monensina mais tilosina ou 4% de gordura animal aumentaram a eficiência alimentar em 8%, mas não houve nenhum efeito adicional dos ionóforos quando a gordura já estava presente na ração.
Este trabalho foi conduzido a fim de se avaliar os efeitos de óleo de soja, Rumensin® e níveis crescentes de concentrado sobre o consumo e a fermentação ruminal de bovinos. Os parâmetros de fermentação ruminal analisados foram os ácidos graxos voláteis (AGV), pH e amônia (NH3). Determinou-se, ainda, a atividade específica de produção de amônia (AEPA) ou capacidade de desaminação pela população microbiana ruminal.
Material e Métodos
O experimento foi realizado no setor de bovinos do Departamento de Zootecnia (DZO) e as análises laboratoriais foram realizadas nos laboratórios de Nutrição Animal do DZO, Microbiologia de Anaeróbios do Departamento de Microbiologia, e Pesquisas em Produtos Naturais do Departamento de Química, todos da Universidade Federal de Viçosa, em Viçosa, MG.
Foram utilizados quatro bovinos 7/8 holandês-zebu, com peso vivo médio de 400 kg, fistulados no rúmen, segundo as técnicas descritas por LEÃO e SILVA (1980). Os animais foram mantidos confinados em baias individuais cobertas, com piso de concreto, e providas de comedouros e bebedouros. A higienização das baias, comedouros e bebedouros foi feita diariamente. Os animais foram alimentados nos horários das 7:00 e 15:00 horas, recebendo o concentrado juntamente com o volumoso em dieta completa, além de suplemento mineral e água à vontade.
O experimento constou de um fatorial 2x2 (0 e 500 mL de óleo de soja/animal/dia; 0 e 3 g Rumensin®/animal/dia), distribuído em quadrado latino, e níveis crescentes de concentrado (0, 25, 50, 75%) ao longo de quatro períodos experimentais (Tabela 1). Encontra-se na Tabela 2 a composição das dietas experimentais, formuladas utilizando-se cana-de-açúcar como volumoso e concentrado à base de milho e farelo de soja. Os tratamentos com 25 e 50% de concentrado continham energia e proteína suficiente para ganhos de peso de 0,9 a 1,2 kg/animal/dia, enquanto aqueles com 0 e 75% de concentrado estavam desbalanceados por deficiência ou excesso de proteína.
Os períodos experimentais tiveram duração de 15 dias, sendo 12 dias de adaptação à dieta e três dias de coletas de amostras. Diariamente, foram feitas pesagens e amostragens do volumoso, do concentrado oferecido e das sobras. Após a amostragem, o material foi colocado em sacos plásticos, devidamente identificados e congelados a -15oC, e ao final de cada fase, foram descongelados e homogeneizados para se retirar uma amostra composta por animal/período, para posterior análise de matéria seca, segundo SILVA (1990).
Para a determinação da concentração de amônia, pH e AGV do líquido ruminal, as amostras foram coletadas manualmente, através da fístula ruminal e filtradas em gaze. Os tempos de coleta foram 0, 3 e 6 horas após a alimentação da manhã. Foi feita leitura imediata do pH do líquido ruminal, utilizando-se um potenciômetro. As amostras do líquido ruminal foram colocadas em dois tubos eppendorfs de 1,5 mL, centrifugadas a 5200xg por 10 minutos, retirando-se os sobrenadantes com uma seringa até completar um terceiro tubo eppendorf para posterior congelamento. Foi feita análise de amônia pelo método colorimétrico de CHANEY e MARBACH (1962) e análise de AGV, por intermédio da modificação do método descrito por ERWIN et al. (1961).
Foram colocados 500 mL de amostra do líquido ruminal e 500 mL de ácido fosfórico (25%) em tubos eppendorf de 1,5 mL, homogeneizados e, após 20 minutos, centrifugados a 13000 xg por 20 minutos. As análises dos líquidos sobrenadantes foram realizadas em um cromatógrafo a gás, modelo Shimadzu GC17 A com autoinjetor Shimadzu AOC17 e, através de um módulo de comunicação Shimadzu CBM-101, acoplado a um micro computador Pentium 100 com o software Class - GC10 versão 1.61. Os AGV foram separados em uma coluna NukolTM capilar de sílica fundida (30 m x 0,25 mm x 0,25 mm Film Thickness, Supelco, Inc., Bellefonte, PA).
As condições utilizadas para a separação cromatográfica foram: temperatura da coluna = 100oC por 5 minutos, 185oC por 0 minuto; temperatura do injetor = 220oC; temperatura do detector = 250oC; tempo total = 13,5 minutos; modo de controle = split; pressão na coluna (Kpa) = 150; fluxo na coluna (mL/min) = 1,90647; velocidade linear (cm/s) = 43,228; fluxo total = 113; taxa de split = 1:40. Os padrões de AGV foram do kit de ácidos orgânicos Supelco.
Para a análise da atividade específica de produção de amônia por bactérias ruminais, amostras separadas de líquido ruminal foram coletadas do rúmen como descrito anteriormente. Estas amostras foram transportadas para o laboratório a 39°C e centrifugadas anaerobiamente a 500 x g (5 min, 5°C), para eliminar as partículas alimentares e protozoários. A concentração de proteína bacteriana foi determinada centrifugando-se 1,5 mL do líquido sobrenadante a 13000 x g, por 5 minutos, seguido de sucessivas ressuspensões e centrifugações do pellet bacteriano em solução de NaCl a 0,9% (p/v). Em seguida, foi feito o reestabelecimento do volume com água e armazenamento em tubos eppendorf a -15°C, para posterior análise de proteína pelo método colorimétrico descrito por LOWRY et al. (1951).
Do sobrenadante da centrifugação a 500 x g, 9 mL do líquido foram transferidos em triplicata para tubos Vacumtainerâ. Os tubos foram preenchidos com CO2 e vedados com rolha de borracha e selados com capas de alumínio. No tempo zero, 1 mL de uma solução anaeróbica de Trypticaseâ(BBL Microbiology Systems, Cockeysville, MD) foi adicionada aos tubos (15 g/L de concentração final). Os tubos foram incubados a 39°C por 4 horas. Antes e após a incubação, 1,5 mL do meio foi centrifugado (13000 x g, 5 minutos) para remoção das bactérias. O líquido sobrenadante foi armazenado separadamente a -15°C para mensuração de amônia pelo método colorimétrico de CHANEY e MARBACH (1962).
A atividade específica de produção de amônia (AEPA) foi determinada, conforme fórmula abaixo (LANA e RUSSELL, 1997):
AEPA = (NH3 x 1.000.000)/(proteína microbiana * tempo de incubação)
em que: AEPA = nmol NH3/mg proteína microbiana/minuto; NH3 = concentração final (4 horas) - inicial de amônia (0 horas), em mM; proteína microbiana = concentração inicial, em mg/L; tempo de incubação = em minutos.
Cada animal em cada período correspondeu a uma unidade experimental. Nas análises que incluíram efeito de tempo, cada tempo de coleta de cada animal em cada período correspondeu a uma unidade experimental. O modelo estatístico incluiu efeitos de nível de concentrado, Rumensin®, óleo de soja, tempo de coleta (quando pertinente, em parcela subdividida) e todas as interações possíveis. As análises estatísticas foram feitas usando o método de regressão do Minitab (RYAN e JOINER, 1994). Os efeitos foram considerados significativos a 5% e tendência estatística a 10% de probabilidade.
Resultados e Discussão
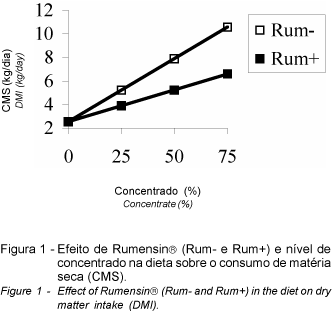
Houve aumento linear no consumo de matéria seca com a elevação do nível de concentrado. Houve interação entre rumensin e nível de concentrado, onde rumensin foi mais eficiente em reduzir o consumo com o aumento do nível de concentrado (P<0,01; Figura 1). Também o óleo reduziu o consumo em 26% (de 6,39 para 4,72 kg/animal/dia), independentemente do nível de concentrado (P<0,05). O reduzido consumo de matéria seca observado em baixos níveis de concentrado deve estar relacionado ao insignificante nível de amônia ruminal. Devido à fibra proveniente da cana ser de baixa qualidade e conter elevado nível de lignina, associado com a deficiência de nitrogênio ruminal, o qual não estimula a fermentação da fibra, é provável que tenha ocorrido redução da taxa de passagem da cana pelo sistema digestivo e conseqüente redução no consumo, conforme verificado por PEREIRA (1999).
O maior efeito depressivo de rumensin sobre o consumo de matéria seca em alto nível de concentrado concorda com GOODRICH et al. (1984), que observaram decréscimo de 6,4% no consumo de dietas contendo concentrado, sem afetar o consumo de pastagem. Isto ocorre devido ao efeito físico de enchimento do rúmen estar limitando o consumo de animais em dietas de volumoso. No caso de animais em confinamento, em que o nível de energia (efeito fisiológico) regula o consumo, o aumento da eficiência energética, pelo decréscimo das perdas de metano, favorece a redução do consumo de alimentos para satisfazer as necessidades nutricionais.
O efeito negativo do óleo sobre o consumo foi também verificado por JENKINS e PALMQUIST (1984). Isto ocorre devido ao óleo, assim como à monensina, serem tóxicos às bactérias gram-positivas (RUSSELL e WALLACE, 1997) e devido ao efeito de barreira física da película formada pelo mesmo sobre a fibra do alimento (TEIXEIRA, 1992). Com isto, há impedimento da adesão e multiplicação da população de bactérias celulolíticas, responsáveis pela fermentação da fibra, reduzindo a passagem do alimento pelo sistema digestivo e, conseqüentemente, o consumo.
BROOKS et al. (1954) demonstraram reduções em 40% da digestibilidade da celulose, quando de 10 a 170 mg de óleo de milho foram adicionados a 1 g de matéria seca contendo 50% de celulose, em experimentos in vitro. Portanto, segundo MACZULAK et al. (1981), esta redução no consumo é comumente atribuída a uma combinação do decréscimo da atividade celulolítica, da barreira física da fibra e da taxa de passagem dos alimentos no rúmen.
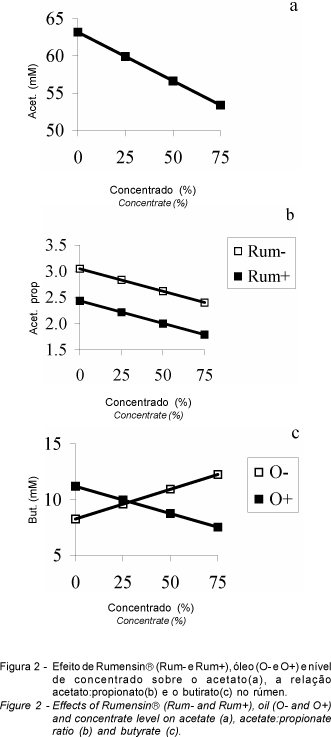
O teor de acetato no AGV total decresceu linearmente com aumento do nível de concentrado (P<0,01; Figura 2a). O propionato aumentou (de 22,7 para 27,5%) e a relação acetato:propionato diminuiu na presença de Rumensin (P<0,05). A relação acetato:propionato tendeu, ainda, a diminuir linearmente em função do nível de concentrado (P<0,10; Figura 2b).
O decréscimo de acetato e da relação acetato:propionato pelo nível de concentrado tem sido explicado pela tendência de bactérias fibrolíticas em produzir acetato e amilolíticas em produzir propionato (BLAXTER, 1962). O efeito inibidor da monensina sobre a produção de acetato e estímulo à produção de propionato foi explicado por BERGEN e BATES (1984), como sendo devido à resistência à monensina proporcionada pela enzima fumarato redutase, comum nas bactérias ruminais produtoras de propionato. Entretanto, RUSSELL e STROBEL (1988) verificaram que a resistência à monensina estava mais relacionada com a presença da membrana externa presente nas bactérias gram-negativas, que agem como barreira protetora ao acesso dos ionóforos e outras macromoléculas à membrana celular.
Houve tendência de interação entre o nível de concentrado e óleo sobre o teor de butirato no AGV total, onde o óleo aumentou o butirato quando a dieta continha somente volumoso e diminuiu em 75% de concentrado (P<0,10; Figura 2c). CLARY et al. (1993), utilizando sebo (0 e 4%), monensina e lasalocida, não encontraram efeito da suplementação de lipídios e ionóforos sobre a proporção molar de butirato. Geralmente a proporção de butirato pode ou não ser diminuída por ionóforos (FULLER e JOHNSON, 1981; RICKE et al., 1984).
O isobutirato e o isovalerato aumentaram com o nível de concentrado (P<0,05; Figuras 3a e 3b). A amônia aumentou com o nível de concentrado e decresceu em função do tempo de coleta do líquido de rúmen (P<0,05; Figuras 4a e 4b). O efeito do nível de concentrado sobre o aumento do isobutirato, isovalerato e amônia foi provavelmente devido ao aumento de consumo de PB, uma vez que o concentrado apresentou alto nível de PB em relação à cana-de-açúcar.
No caso de dietas isoprotéicas, era de se esperar o contrário, pois com o aumento do concentrado, haveria decréscimo no pH ruminal, que inibiria a fermentação de aminoácidos no rúmen (LANA et al., 1998) e consequente produção de amônia (CAMERON et al., 1991; GRIGSBY et al., 1993; LANA et al., 1998) e ácidos graxos voláteis de cadeia ramificada. O efeito de redução na concentração de amônia ruminal com o aumento do nível do concentrado tem sido também justificado pelo aumento na disponibilidade de energia ruminal que possibilita maior utilização da amônia para o crescimento microbiano (ANNISON, 1956). Entretanto, estudos in vitro indicam que a eficiência de síntese de proteína microbiana pode diminuir significativamente, quando o pH é menor que 6 (STROBEL e RUSSELL, 1986).
Também, era de se esperar redução de isobutirato, isovalerato e amônia na presença de rumensin, que contém o antibiótico monensina, responsável pela inibição da população bacteriana fermentadora de aminoácidos (RAUN et al., 1976; RICHARDSON et al., 1976; RICKE et al., 1984; RUSSELL e MARTIN, 1984). CLARY et al. (1993), utilizando sebo (0 e 4%), monensina e lasalocida, não encontraram efeito da suplementação de lipídios e ionóforos sobre a proporção molar de isobutirato e valerato, mas houve redução de isovalerato com a adição de ionóforos nas dietas sem lipídios.
Os tratamentos contendo 50 e 75% de concentrado apresentaram níveis de amônia superior a 5 mg/100 mL de líquido de rúmen, nível mínimo necessário para estimular a fermentação da fibra (SLYTER, 1976). Entretanto, a dieta contendo exclusivamente cana-de-açúcar praticamente não proporcionou a produção de amônia no rúmen, devido provavelmente ao baixo nível de PB em sua constituição.
O pH ruminal diminuiu linearmente em função do tempo de coleta do líquido de rúmen (P<0,05), sem contudo ocorrer interação do tempo com tratamentos (Figura 5a). Normalmente, o pH atinge valores mínimos 0,5 a 4 horas após a alimentação, sendo o mesmo o reflexo do balanço entre as taxas de produção e absorção de ácidos graxos voláteis, a presença de tampões no conteúdo ruminal oriundos da saliva e a presença ou liberação de tampões ou bases do alimento (OWENS e GOETSCH, 1988).
ØRSKOV (1986), por sua vez, relata que o abaixamento do pH ruminal ocorre, principalmente, após a ingestão rápida de alimento, por causa de uma rápida taxa de fermentação de açúcares e ácidos orgânicos. Relata, ainda, que a alimentação com grãos de cereais moídos resulta em alguns problemas, dentre os quais, encontram-se a inadequada secreção de saliva para manter o pH entre 6 e 7 e a inadequada estrutura física para estimular a mobilidade ruminal em dietas com elevadas quantidades de grãos. O consumo de alimento é deprimido quando o pH do líquido ruminal cai abaixo de 5,5 (FULTON et al., 1979).
OWENS e GOETSCH (1988) reportam que o pH do fluido ruminal varia entre 5,5 e 6,5 para dietas concentradas, e de 6,2 a 7,0 para dietas constituídas exclusivamente de volumosos. Entretanto, neste experimento, os valores de pH geralmente mantiveram-se em valores acima de 6,2, mesmo em níveis elevados de concentrado, nível este mínimo necessário para manutenção da atividade fermentativa das bactérias celulolíticas ruminais (GRANT e WEIDNER, 1992).
Houve interação entre óleo e nível de concentrado sobre o pH médio ruminal, onde o óleo diminuiu o pH em dieta contendo somente cana-de-açúcar e aumentou em dieta contendo altos níveis de concentrado (P<0,05; Figura 5b). Não houve efeito de rumensin sobre o pH ruminal (P>0,10), semelhante ao resultado de COE et al. (1996). Alguns autores afirmam que a monensina causa um ligeiro aumento na concentração de lactato (BEEDE e FARLIN, 1977; BARTLEY et al., 1979), sem causar mudança no pH do líquido ruminal quando bovinos são alimentados com baixas taxas de carboidratos (DINIUS et al., 1976). Entretanto, com altas taxas de carboidratos em estudos in vitro com líquido de rúmen, a monensina produziu significante aumento no pH e redução na concentração de lactato (DENNIS et al., 1980).
A atividade específica de produção de amônia pela população microbiana mista ruminal decresceu linearmente com o aumento do nível de concentrado na dieta e aumentou na presença de óleo (P<0,05; Figura 6). Apesar de não ter sido verificada redução do nível de amônia in vitro, com o aumento do nível de concentrado, devido ao incremento no consumo de proteína, conforme verificado anteriormente, verifica-se claramente que o pH é um importante fator inibidor da atividade desaminadora, conforme observado anteriormente por LANA et al. (1998). Esperava-se efeito inibidor de rumensin sobre a capacidade microbiana ruminal em desaminar aminoácidos, segundo SCHELLING (1984). Corroborando o resultado observado, também não foi verificado efeito de rumensina sobre o teor de ácidos graxos voláteis de cadeia ramificada no AGV total.
Conclusões
O nível de concentrado afetou mais o consumo de matéria seca e os parâmetros ruminais que Rumensin® e o óleo de soja.
Rumensin® reduziu o consumo de matéria seca, à medida que aumentou o nível de concentrado e reduziu a relação acetato:propionato, independentemente do nível de concentrado.
O óleo somente aumentou o pH em altos níveis de concentrado e aumentou a atividade de produção de amônia pela população microbiana ruminal, independentemente do nível de concentrado.
Referências Bibliográficas
Recebido em: 17/08/00
Aceito em: 11/05/01
2 Estudantes de Pós-graduação pela Universidade Federal de Viçosa, CEP 36571-000, Viçosa-MG.
3 Professor do Departamento de Zootecnia da Universidade Federal de Viçosa, CEP 36571-000, Viçosa-MG; Bolsista do CNPq. E.mail do 2o autor: rlana@mail.ufv.br
4 Professor do Departamento de Química da Universidade Federal de Viçosa, CEP 36571-000, Viçosa-MG. E.mail: gulab@mail.ufv.br
- ANNISON, E.F. 1956. Nitrogen metabolism in the sheep. Biochem. J, 64:705-714.
- ANDRADE, V.J., CORDEIRO, J.S., FERREIRA, M.B.D. et al. Monensina na terminação de novilhos mestiços zebu x angus, a pasto. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 33, 1996, Fortaleza. Anais ... Fortaleza, 1996. v.3, p.23-25.
- BAGG, R. Mode of action of ionophores in lactating dairy cattle. In: USEFULNESS OF IONOPHORES IN LACTATING DAIRY CATTLE, 1997, Ontario. Proceedings ... Ontario, Canada: Ontario veterinary College, 1997. p.13-21.
- BARTLEY, E.E., HEROD, E.L., BECHTLE, R.M. et al. 1979. Effect of monensin, lasalocid, or a new polyether antibiotic with and without niacin or amicloral on rumen fermentation in vitro and in vivo on heifer growth and feed efficiency. J. Anim. Sci, 49:1066.
- BEEDE, D.K., FARLIN, S.D. 1977. Effects of antibiotics on apparent studies. J. Anim. Sci., 45:385.
- BERGEN, W.G., BATES, D.B. 1984. Ionophores: their effect on production efficiency and mode of action. J. Anim. Sci, 58:1465-83.
- BLAXTER, K.L. 1962. The energy metabolism of ruminants. Springfield, IL: Charles C. Thomas.
- BOLING, J.A., BRADLEY, N.M., CAMBELL, L.D. 1977. Monensin levels for growing and finishing steers. J. Anim. Sci., 68(5):867-71.
- BROOKS, C.C., GARNER, G.B., GEHRKE, C.W. 1954. The effect of added fat on the digestion of cellulose and protein by ovine rumen microorganisms. J. Anim. Sci., 13:758-764.
- CAMERON, M.R., KLUSMEYER, T.H., LYNCH, G.L. 1991. Effect of urea and starch on rumen fermentation, nutrient passage to the duodenum, and performance of cows. J. Dairy Sci., 74:1321-1336.
- CLARY, E.M., BRANDT JR., R.T., HARMON, D.L. et al. 1993. Suplemental fat and ionophores in finishing diets: feedlot performance and ruminal digesta kinetics in steers. J. Anim. Sci, 71:3115-3131.
- CHANEY, A.L., MARBACH, E.P. 1962. Modified reagents for determination of urea and ammonia. Clin. Chem., 8:130-132.
- COE, M.L., SUN, Y., NAGARAJA, T.G. et al. 1996. Virginiamycin and ruminal fermentation in cattle. J. Anim. Sci., 74 (Suppl 1):272.
- DENNIS, S.M., NAGARAJA, T.G., BARTLEY, E.E. 1980. Effect of lasalocid or monensin on lactic acid production by rumen bacteria. J. Anim. Sci, 51 (Suppl. 1):96.
- ERWIN, E.S., MARCO, G.J., EMERY, E.M. 1961. Volatile fatty acid analyses of blood and rumen fluid by gas chromatography. J. Dairy Sci., 44:1768-1771.
- FULLER, J.R., JOHNSON, D.E. 1981. Monensin and lasalocid effects on fermentation in vitro. J. Anim. Sci., 53(6):1574-1580.
- GOODRICH, R.D., GARRETT, J.E., GAST, D.R. et al. 1984. Influence of monensin on the performance of cattle. J. Anim. Sci., 58(6):1484-1498.
- GRANT,R.J., WEIDNER, S.J. 1992. Digestion kinetics of fiber: influence of in vitro buffer pH varied within observed physiological range. J. Dairy Sci., 75(4):1060-1068.
- GRIGSBY, K.N., KERLEY, M.S., PATERSON, J.A. 1993. Combinations of starch and digestible fiber in supplements for steers consuming a low-quality Bromegrass hay diet. J. Anim. Sci., 71(4):1057-1064.
- HANEY JUNIOR, M.E., HOEHN, M.M. 1967. Monensin, a new biologically active compound. I. Discovery and isolation. Antimicrob. Agents Chemother. 349p.
- JENKINS, T.C., PALMQUIST, D.L. 1984. Effect of fatty acids or calcium soaps on rumen and total nutrient digestibility of dairy rations. J. Dairy Sci, 67:978-986.
- LANA, R.P. Microbiologia aplicada à nutrição de ruminantes. In: CONGRESSO NACIONAL DE ESTUDANTES DE ZOOTECNIA, 1998, Viçosa. Anais ... Viçosa, MG: UFV, 1998. p.125-138.
- LANA, R.P. Effects of monensin on ruminal bacteria, ruminal fermentation and feedlot performance. Ithaca, NY: Cornell University, 1997. 87p. Thesis (Doctor of Philosophy) - Cornell University, 1997.
- LANA, R.P., RUSSELL, J.B. 1996. Use of potassium depletion to asses adaptation of ruminal bacteria of ionophores. Appl. Environ. Microbiol., 62(12):4499-4503.
- LANA, R.P., RUSSELL, J.B. 1997. Effect of forage quality and monensin on the ruminal fermentation of fistulated cows fed continuously at a constant intake. J. Anim. Sci., 75:224-229.
- LANA, R.P., RUSSELL, J.B., VAN AMBURGH, M.E. 1998. The role of pH in regulating ruminal methane e ammonia production. J. Anim. Sci., 76:2190-2196.
- LEÃO, M.I., SILVA, J.F.C. Técnica de fistulação de abomaso em bezerros. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 1980, Fortaleza. Anais... Fortaleza: SBZ, 1980. p.3.
- LOWRY, O.H., ROSEBROUGH, N.J., FARR, A.L. et al. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem, 193:265-275.
- MACZULAK, A.E., DEHORITY, B.A., PALMQUIST, D.L. 1981. Effects of long-chain fatty acids on growth of rumen bacteria. Appl. Environ. Microbiol., 42:856-862.
- MULLER, R.D.E., POTTER, M.I., WRAY, L.R. et al. 1986. Administration of monensin in self fed (sal limiting), dry supplements or on an alternate day feeding schedule. J. Anim. Sci., 62(3):593-600.
- ØRSKOV, E.R. 1986. Starch digestion and utilization in ruminants. J. Anim. Sci., 63(5):1624-1633.
- OWENS, F.N., GOESTSCH, A.L. 1988. Ruminal fermentation. In: Church, D.C. The ruminant animal digestive physiology and nutrition. Englewood cliffs: O & Books Inc. p.146-171.
- PARROT, C.J., CONRAD, M.J., BASSON, P.R. 1990. The effect of a monensin ruminal delivery device on performance of cattle grazing pasture. J. Anim. Sci., 68(7):2614-2621.
- PEREIRA, E.S. Dinâmica ruminal e pós-ruminal da proteína e de carboidratos: aplicação de um modelo matemático para avaliação de dietas à base de cana-de-açúcar. Viçosa, MG: UFV, 1999. 95p. Tese (Doutorado em Zootecnia) - Universidade Federal de Viçosa, 1999.
- RAUN, A.P., COOLEY, C.O., POTTER, E.L. et al. 1976. Effect of monensin on feed efficiency of feedlot cattle. J. Anim. Sci., 43:660-667.
- RICKE, S.C., BERGER, L.L., VAN DER AAR, P.J. et al. 1984. Effects of lasalocid and monensin on nutrient digestion, metabolism and rumen characteristics of sheep. J. Anim. Sci, 58(1):194-202.
- RICHARDSON, L.F., RAUN, A.P., POTTER, E.L. et al. 1976. Effect of monensin on ruminal fermentation in vitro and in vivo J. Anim. Sci, 43:657-664.
- RUSSELL, J.B., MARTIN, S.A. 1984. Effects of various methane inhibitors on the fermentation of amino acids by mixed rumen microorganisms in vitro J. Anim. Sci, 59:1329-1338.
- RUSSELL, J.B., STROBEL, H.J. 1989. Minireview. Effect of ionophore on ruminal fermentation. Appl. Environ. Microbiol., 55:1-6.
- RUSSELL, J.B., STROBEL, H.J. 1988. Effects of additives on in vitro ruminal fermentation: a comparison of monensin and bacitracin, another gram-positive antibiotic. J. Anim. Sci, 66:552-558.
- RUSSELL, J.B., WALLACE, R.J. 1997. Energy-yielding and energy-consuming reactions. In: Hobson, P.N. (Ed). The ruminal microbial ecosystem. Essex, England: Elsevier Science, 2.ed. p.267-268.
- RYAN, B.F., JOINER, B.L. 1994. Minitab handbook. 3.ed. Belmont, CA: Duxbury Press. 448p.
- SCHELLING, G.T. 1984. Monensin mode of action in the rumen. J. Anim. Sci, 58: 1518-1527.
- SILVA, D.J. 1990. Análise de alimentos (métodos químicos e biológicos). Viçosa, MG: UFV. 165p.
- SLYTER, L.L. 1976. Influence of acidosis on rumen function. J. Anim. Sci., 43:910-929.
- STEEL, R.G.D., TORRIE, J.H. 1980. Principles and procedures of statistics: a biometrical approach 2.ed. New York: McGraw - Hill Publishing Co.
- STROBEL, H.J., RUSSELL, J.B. 1986. Effect of pH and energy spilling on bacterial protein synthesis by carbohydrate limited cultures of mixed rumen bacteria. J. Dairy Sci, 69(11):2941-2947.
- TEIXEIRA, J.C. 1992. Nutrição de ruminantes. Lavras, MG: ESAL/FAEPE. 239p.
- VAN NEVEL, C.J., DEMEYER, D.I. 1988. Manipulation of ruminal fermentation. In: Hobson, P.N. (Ed). The ruminal microbial ecosystem. Essex, England: Elsevier Science. p.87-443.
Datas de Publicação
-
Publicação nesta coleção
20 Fev 2002 -
Data do Fascículo
Out 2001
Histórico
-
Aceito
11 Maio 2001 -
Recebido
17 Ago 2000