Resumos
O declínio da capacidade cognitiva (DCC) decorre dos processos fisiológicos do envelhecimento normal ou de um estágio de transição para as demências. Estudos epidemiológicos mostram que idosos com declínio da capacidade cognitiva apresentam maior risco de desenvolver Doença de Alzheimer (DA), em particular aqueles com déficit de memória episódica. A presente atualização mostra os principais critérios diagnósticos, achados neuropatológicos e neuropsicológicos do declínio da capacidade cognitiva durante o envelhecimento.
Doença de Alzheimer; Envelhecimento; Demência; Transtornos cognitivos; Cognição; Neuropsicologia
Decline of cognitive capacity (DCC) is due to normal physiological aging processes or to pre-dementia stage. Epidemiological studies show that elderly with decline of cognitive capacity have higher risk to develop Alzheimer's disease (AD), especially those with episodic memory deficits. This review presents the most important diagnosis criteria, neuropathological and neuropsychological findings of decline of cognitive capacity during aging.
Alzheimer disease; Aging; Dementia; Cognitive disorders; Cognition; Neuropsychology
ATUALIZAÇÃO
Declínio da capacidade cognitiva durante o envelhecimento
Decline of cognitive capacity during aging
Helenice Charchat-FichmanI, II; Paulo CaramelliI; Koichi SameshimaI; Ricardo NitriniI
IGrupo de Neurologia Cognitiva e do Comportamento, Departamento de Neurologia, Faculdade de Medicina da Universidade de São Paulo, SP
IILaboratório de Neuropsicologia, Curso de Psicologia, Universidade Estácio de Sá, RJ
Endereço para correspondência Endereço para correspondência Helenice Charchat Fichman Rua Conrado Niemeyer, 14 /302, Copacabana 22021-050 Rio de Janeiro, Brasil Tel: (21) 3473-1288 / (21) 2249-2710 E-mail: hcharchat@uol.com.br
RESUMO
O declínio da capacidade cognitiva (DCC) decorre dos processos fisiológicos do envelhecimento normal ou de um estágio de transição para as demências. Estudos epidemiológicos mostram que idosos com declínio da capacidade cognitiva apresentam maior risco de desenvolver Doença de Alzheimer (DA), em particular aqueles com déficit de memória episódica. A presente atualização mostra os principais critérios diagnósticos, achados neuropatológicos e neuropsicológicos do declínio da capacidade cognitiva durante o envelhecimento.
Descritores: Doença de Alzheimer; Envelhecimento; Demência; Transtornos cognitivos; Cognição; Neuropsicologia
ABSTRACT
Decline of cognitive capacity (DCC) is due to normal physiological aging processes or to pre-dementia stage. Epidemiological studies show that elderly with decline of cognitive capacity have higher risk to develop Alzheimer's disease (AD), especially those with episodic memory deficits. This review presents the most important diagnosis criteria, neuropathological and neuropsychological findings of decline of cognitive capacity during aging.
Keywords: Alzheimer disease; Aging; Dementia; Cognitive disorders; Cognition; Neuropsychology
Introdução
O envelhecimento da população é um fenômeno mundial que tem conseqüências diretas nos sistemas de saúde pública. Uma das principais conseqüências do crescimento desta parcela da população é o aumento da prevalência das demências, especialmente da doença de Alzheimer (DA).1-2 Assim, a identificação de indivíduos com potencial risco de desenvolver demência torna-se fundamental. Apesar de ainda gerar controvérsias, o diagnóstico precoce das demências possibilita intervenção terapêutica, diminui os níveis de estresse para os familiares, reduz riscos de acidentes, prolonga autonomia e talvez, em alguns casos, evite ou retarde o início do processo demencial.3
Este artigo tem como finalidade apresentar uma atualização sobre declínio da capacidade cognitiva (DCC) no envelhecimento. Foram selecionados artigos clássicos que introduziram as principais categorias diagnósticas de DCC, artigos de revisão baseados em evidências e estudos longitudinais/transversais relevantes publicados nos últimos cinco anos em revistas internacionais de impacto. A atualização objetiva caracterizar clinicamente a fração da população idosa que apresenta declínio da capacidade cognitiva em decorrência dos processos fisiológicos do envelhecimento normal ou que representam uma transição para as síndromes demenciais e apresentar os principais critérios diagnósticos, achados neuropsicológicos e neuropatológicos.
Aspectos conceituais
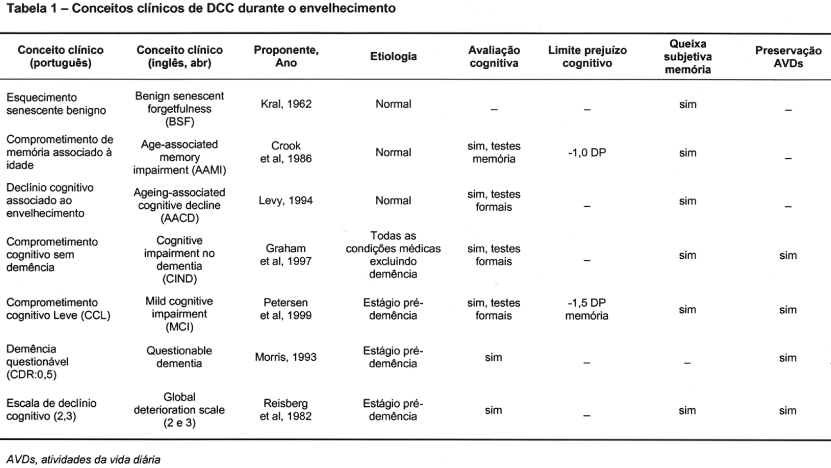
Ao longo das últimas décadas, têm sido formuladas diferentes definições para caracterizar o DCC durante o envelhecimento. As primeiras definições propostas objetivavam caracterizar o DCC dentro dos limites do processo fisiológico do envelhecimento normal.4-6 Posteriormente, surgiram outros sistemas de classificação diagnóstica para identificar indivíduos com maior risco de desenvolver formas específicas de demência.3,7-9 A diversidade de definições que se deve, em grande parte, à falta de uniformidade conceitual resultou na ausência de consenso dos algoritmos diagnósticos, acarretando importantes limitações metodológicas para estudos de caso-controle e populacionais.3,10 A Tabela 1 compara estes conceitos clínicos de DCC durante o envelhecimento.
Dentre estes conceitos clínicos, o de Comprometimento Cognitivo Leve (CCL) (Mild Cognitive Impairment) tem sido o mais amplamente estudado na literatura internacional.3,11-12 As características clínicas, critérios diagnósticos e trajetória evolutiva do CCL foram temas de amplas revisões baseadas em evidências publicadas nos últimos três anos.3,11-12 A Academia Americana de Neurologia recomendou o diagnóstico de CCL para a detecção precoce de demência.3 O CCL do tipo amnésico refere-se à zona de transição entre o envelhecimento normal e os estágios muito iniciais da DA. A taxa de conversão para DA foi de, aproximadamente, 10 a 15% ao ano, representando um subgrupo com risco elevado de desenvolver esta síndrome demencial.3,11
Um grupo de pesquisadores se reuniu em Chicago, em junho de 1999, e outro em Stocolmo, em setembro de 2003, para revisar a literatura mundial sobre os conceitos atuais em CCL. Os principais critérios diagnósticos sugeridos foram: 1) o indivíduo não seria normal nem demente; 2) evidência de declínio cognitivo mensurado objetivamente ou baseado em percepção subjetiva combinada a comprometimento cognitivo objetivo; 3) preservação das atividades da vida diária, atividades instrumentais complexas intactas ou minimamente comprometidas.12 Os estudos mostraram que CCL seria uma entidade heterogênea quanto à sua trajetória clínica, dividindo-se em três categorias diagnósticas: 1) CCL amnésico com maior risco de desenvolver DA; 2) CCL com comprometimento leve de múltiplos domínios cognitivos com maior risco de desenvolver outras síndromes demenciais, sendo DA uma trajetória possível; 3) CCL com comprometimento de uma única função cognitiva diferente de memória com maior risco de desenvolver demência fronto-temporal e/ou afasia progressiva primária. Todos os grupos poderiam permanecer estáveis e não evoluir para síndrome demencial.11-12
Os principais critérios diagnósticos para CCL amnésico são: 1) comprometimento subjetivo de memória, preferencialmente confirmado por um informante; 2) comprometimento objetivo de memória comparado com grupo emparelhado por idade e escolaridade (tem sido usualmente recomendado que o desempenho situe-se abaixo de 1,5 desvio padrão da média); 3) funcionamento cognitivo global normal; 4) independência quanto às atividades da vida diária; 5) ausência de demência. As demais funções cognitivas não estão necessariamente preservadas, contudo o grau de comprometimento não é suficiente para o indivíduo ser diagnosticado como demente.3,11
Controvérsias e críticas sobre a aplicação destes critérios à população idosa não pertencente às clínicas especializadas para a qual esta entidade diagnóstica foi proposta foram evidenciadas na literatura internacional.10,13 As principais limitações foram instabilidade diagnóstica ao longo do tempo, indefinição de testes neuropsicológicos para avaliar funções cognitivas e atividades da vida diária, e ênfase no comprometimento baseado em um grupo controle emparelhado por idade e escolaridade e não em declínio cognitivo.10,13
Outra forma de caracterizar o DCC durante o envelhecimento é a escala de estadiamento das demências Clinical Dementia Rating (CDR).7 Os indivíduos classificados como CDR: 0,5 apresentam demência questionável. Neste estágio, os idosos mostram esquecimento leve e constante com recuperação parcial de eventos, orientação temporal e espacial, ausência ou dificuldade leve nas atividades da vida diária, preservação dos cuidados de higiene pessoal. Nesta categoria são incluídos idosos com CCL ou com demência incipiente.9
Aspectos epidemiológicos
Apesar da diversidade metodológica e a utilização de diferentes sistemas de classificação diagnóstica, estudos epidemiológicos corroboram que idosos com DCC apresentam maior risco de desenvolver demência.3,10,14-15 Os conceitos clínicos que mostram maior taxa de conversão para DA são aqueles com critérios mais restritivos, que incluem idosos com déficit de memória episódica.10,14,16 As Tabelas 2 e 3 apresentam, respectivamente, a prevalência e a taxa de conversão anual para DA dos conceitos clínicos de DCC. No Brasil, comprometimento cognitivo associado à dependência nas atividades da vida diária estão fortemente relacionados com mortalidade em idosos residentes em centros urbanos.17
Achados neuropatológicos
Estudos neuropatológicos mostram que idosos com CCL, especialmente na forma amnésica, apresentam placas senis no neocórtex e emaranhados neurofibrilares nas regiões dos lobos temporais mediais. A maioria dos estudos neuropatológicos de pacientes com CCL (amnésico) verificou a presença de padrão neuropatológico semelhante ao observado na DA, mas em grau insuficiente para este diagnóstico, sendo considerada, por alguns autores, uma forma incipiente ou um estágio pré-demencial da doença.18 Os resultados de estudos de neuroimagem estrutural e funcional estão em concordância com os achados neuropatológicos, ao mostrar alterações no lobo temporal medial (redução dos volumes hipocampais e do córtex entorrinal).19-21 Essas alterações, evidenciadas pelos métodos de neuroimagem, são importantes marcadores diagnósticos de CCL amnésico e fator de risco para o desenvolvimento de DA.18,21
Achados neuropsicológicos
Estudos longitudinais sustentam que a maior parte da população idosa não apresenta declínio cognitivo, ou seja, apresenta trajetória evolutiva estável e benigna.15 No entanto, declínio cognitivo é observado nos indivíduos que apresentam diagnóstico de DA e naqueles que evoluirão para a doença no seguimento.15-16
Apesar da maioria dos sistemas de classificação diagnóstica de declínio da capacidade cognitiva no envelhecimento sugerir queixa subjetiva de déficit de memória como critério de inclusão,3-6,8-9 as evidências da literatura mostram que a percepção subjetiva não corresponde necessariamente ao comprometimento objetivo da função e isoladamente não consegue predizer o desenvolvimento de demência.22-23 Os estudos que sustentam esta posição mostram que a queixa subjetiva reflete o estado afetivo dos indivíduos e não necessariamente declínio cognitivo.22-23 Contudo, em estudos populacionais, no qual o uso de testes psicométricos é limitado, a investigação da queixa subjetiva torna-se fundamental.24
Alguns estudos clínicos evidenciam longos períodos pré-demenciais.16 O declínio da memória episódica anterógrada, especialmente nas tarefas de aprendizagem associativa e evocação livre após intervalo, tem sido descrito como um importante fator preditivo para DA.15-16,25-27 O declínio no desempenho nestas tarefas cognitivas é acentuado pela disfunção no centro executivo da memória operacional que prejudica o desenvolvimento de estratégias de codificação de material novo e busca de informações previamente armazenadas.15-16,25-26
Além da existência de subgrupos que representam os estágios pré-demenciais, variáveis demográficas, clínicas, ambientais e genéticas influenciam o desempenho em testes neuropsicológicos e contribuem para a heterogeneidade cognitiva do processo de envelhecimento.11,16,24,27
Conclusão
Os idosos com DCC dividem-se em dois grupos. Um com trajetória cognitiva estável e benigna e outro com declínio da memória episódica anterógrada associado à disfunção do lobo temporal medial, decorrente de um estágio incipiente ou de transição para DA. A caracterização clínica destes grupos é fundamental para prática clínica e pesquisa. Assim, o aperfeiçoamento dos critérios diagnósticos existentes e a investigação de novos marcadores clínicos devem ser temas para estudos futuros.
Referências
1. Prince M, Acosta D, Chiu H, Scazufca M, Varghese M. Dementia diagnosis in developing countries: a cross-cultural validation study. Lancet. 2003;361(9361):909-17. Comment in: Lancet. 2003;361(9361):888-9.
2. Herrera E , Caramelli P, Silveira AS, Nitrini R. Epidemiologic survey of dementia in a community-dwelling Brazilian population. Alzheimer Dis Assoc Disord. 2002;16(2):103-8.
3. Petersen RC, Stevens JC, Ganguli M, Tangalos EG, Cummings JL, Dekosky ST. Practice parameter: early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56(9):1133-42. Comment in: Neurology. 2001;56(9):1131-2.
4. Kral VA. Senescent forgetfulness: benign and malignant. Can Med Assoc J. 1962;86:257-60.
5. Crook T, Bartus RT, Ferris SH, Whitehouse P, Cohen GD, Gershon S. Age Associated Memory Impairment: proposed diagnostic criteria and measures of clinical change: report of a National Institute of Mental Health Work Group. Dev Neuropsychol. 1986;2:261-76.
6. Levy R.. Aging-associated cognitive decline. Working Party of the International Psychogeriatric Association in collaboration with the World Health Organization. Int Psychogeriatr. 1994;6:63-8. Erratum in: Int Psychogeriatr 1994;6(2):133.
7. Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology. 1993;43(11):2412-4.
8. Graham JE, Rockwood K, Beattie BL, Eastwood R, Gauthier S, Tuokko H, et al. Prevalence and severity of cognitive impairment with and without dementia in an elderly population. Lancet. 1997;349(9068):1793-6.
9. Reisberg B, Ferris SH, De Leon MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry. 1982;139(9):1136-9.
10. Ritchie K, Artero S, Touchon J. Classification criteria for mild cognitive impairment: a population- based validation study. Neurology. 2001;56(1):37-42.
11. Petersen RC, Doody R, Kurz A, Mohs RC, Morris JC, Rabins PV, et al. Current concepts in mild cognitive impairment. Arch Neurol. 2001;58(12):1985-92.
12. Winblad B, Palmer K, Kivipelto M, Jelic V, Fratiglioni I, Wahlund LO, et al. Mild cognitive impairment-beyond controversies, towards a consensus: report of International Working Group on Mild Cognitive Impairment. J Intern Med. 2004;256(3):240-6.
13. Hänninen T, Hallikainen M, Tuomainen S, Vanhanen M, Soininen H. Prevalence of mild cognitive impairment: a population-based study in elderly subjects. Acta Neurol Scand. 2002;106(3):148-54.
14. Larrieu S, Letenneur L, Orgogozo JM, Fabrigoule C, Amieva H, Le Carret N, et al. Incidence and outcome of mild cognitive impairment in a population-based prospective cohort. Neurology. 2002;59(10):1594-9.
15. Bennett DA, Wilson RS, Schneider JA, Evans DA, Beckett LA, Aggarwal NT, et al. Natural history of mild cognitive impairment in older persons. Neurology. 2002;59(2):198-205.
16. Elias MF, Beiser A, Wolf PA, Au R, White RF, D'Agostino RB. The preclinical phase of alzheimer disease: A 22-year prospective study of the Framingham Cohort. Arch Neurol. 2000;57(6):808-13.
17. Ramos LR, Simoes EJ, Albert MS. Dependence in activities of daily living and cognitive impairment strongly predicted mortality in older urban residents in Brazil: a 2-year follow-up. J Am Geriatr Soc. 2001;49(9):1168-75.
18. Morris JC, Storandt M, Miller JP, Mckeel DW, Price JL, Rubin EH, et. Mild cognitive impairment represents early-stage Alzheimer disease. Arch Neurol. 2001;58(3):397-405.
19. Killiany RJ, Gomez-Isla T, Moss M, Kikinis R, Sandor T, Jolesz F, et al. Use of structural magnetic resonance imaging to predict who will get Alzheimer's disease. Ann Neurol. 2000;47(4):430-9.
20. de Leon MJ, Convit A, Wolf OT, Tarshish CY, DeSanti S, Rusinek H, et al. Prediction of cognitive decline in normal elderly subjects with 2-[(18)fluoro-2-deoxi-D-glucose/positron-emission tomography (FDG/PET). Proc Natl Acad Sci USA. 2001;98(19):10966-71.
21. Bottino CM, Castro CC, Gomes RL, Buchpiguel CA, Marchetti RL, Netto RM. Volumetric MRI measurements can differentiate Alzheimer's Disease, mild cognitive impairment, and normal aging. Int Psychogeriatr. 2002;14(1):59-72.
22. Schmand B, Jonker C, Hooijer C, Lindeboom J. Subjective memory complaints may announce dementia. Neurology. 1996;46(1):121-5.
23. Jorm AF, Christensen H, Korten AE, Henderson AS, Jacomb PA, Mackinnon A. Do cognitive complaints either predict future cognitive decline or reflect past cognitive decline? A longitudinal study of an elderly community sample. Psychol Med. 1997;27(1):91-8.
24. Jonker C, Geerlings MI, Schmand B. Are memory complaints predictive for dementia? A review of clinical and population-based studies. Int J Geriatric Psychiatry. 2000;15(11):938-91.
25. Fichman-Charchat H. Heterogeneidade neuropsicológica no processo de envelhecimento: transição do normal aos estágios iniciais da Doença de Alzheimer [tese]. São Paulo: Instituto de Psicologia, Universidade de São Paulo; 2003.
26. Daly E, Zaitchik D, Copeland M, Schmahmann J, Gunther J, Albert M. Predicting conversion to Alzheimer disease using standardized clinical information. Arch Neurol. 2000;57(5):675-80. Comment in: Arch Neurol. 2000;57(5):643-4.
27. Nitrini R, Caramelli P, Herrera Junior E, Porto CS, Charchat-Fichman H, Carthery M T, et al. Performance of illiterate and literate nondemented elderly subjects in two tests of long-term memory. J Int Neuropsychol Soc. 2004;10(4):634-8.
Recebido: 14 Abril 2004
Aceito: 02 Novembro 2004
Financiamento e conflito de interesses: inexistente
Este artigo de atualização baseou-se na seguinte tese de doutorado: Charchat-Fichman, H. Heterogeneidade neuropsicológica no processo de envelhecimento: transição do normal aos estágios iniciais da Doença de Alzheimer [tese]. São Paulo: Instituto de Psicologia, Universidade de São Paulo; 2003.
- 1 Prince M, Acosta D, Chiu H, Scazufca M, Varghese M. Dementia diagnosis in developing countries: a cross-cultural validation study. Lancet. 2003;361(9361):909-17.
- Comment in: Lancet. 2003;361(9361):888-9.
- 2 Herrera E , Caramelli P, Silveira AS, Nitrini R. Epidemiologic survey of dementia in a community-dwelling Brazilian population. Alzheimer Dis Assoc Disord. 2002;16(2):103-8.
- 3 Petersen RC, Stevens JC, Ganguli M, Tangalos EG, Cummings JL, Dekosky ST. Practice parameter: early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56(9):1133-42.
- Comment in: Neurology. 2001;56(9):1131-2.
- 4 Kral VA. Senescent forgetfulness: benign and malignant. Can Med Assoc J. 1962;86:257-60.
- 5 Crook T, Bartus RT, Ferris SH, Whitehouse P, Cohen GD, Gershon S. Age Associated Memory Impairment: proposed diagnostic criteria and measures of clinical change: report of a National Institute of Mental Health Work Group. Dev Neuropsychol. 1986;2:261-76.
- 6 Levy R.. Aging-associated cognitive decline. Working Party of the International Psychogeriatric Association in collaboration with the World Health Organization. Int Psychogeriatr. 1994;6:63-8. Erratum in: Int Psychogeriatr 1994;6(2):133.
- 7 Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology. 1993;43(11):2412-4.
- 8 Graham JE, Rockwood K, Beattie BL, Eastwood R, Gauthier S, Tuokko H, et al. Prevalence and severity of cognitive impairment with and without dementia in an elderly population. Lancet. 1997;349(9068):1793-6.
- 9 Reisberg B, Ferris SH, De Leon MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry. 1982;139(9):1136-9.
- 10 Ritchie K, Artero S, Touchon J. Classification criteria for mild cognitive impairment: a population- based validation study. Neurology. 2001;56(1):37-42.
- 11 Petersen RC, Doody R, Kurz A, Mohs RC, Morris JC, Rabins PV, et al. Current concepts in mild cognitive impairment. Arch Neurol. 2001;58(12):1985-92.
- 12 Winblad B, Palmer K, Kivipelto M, Jelic V, Fratiglioni I, Wahlund LO, et al. Mild cognitive impairment-beyond controversies, towards a consensus: report of International Working Group on Mild Cognitive Impairment. J Intern Med. 2004;256(3):240-6.
- 13 Hänninen T, Hallikainen M, Tuomainen S, Vanhanen M, Soininen H. Prevalence of mild cognitive impairment: a population-based study in elderly subjects. Acta Neurol Scand. 2002;106(3):148-54.
- 14 Larrieu S, Letenneur L, Orgogozo JM, Fabrigoule C, Amieva H, Le Carret N, et al. Incidence and outcome of mild cognitive impairment in a population-based prospective cohort. Neurology. 2002;59(10):1594-9.
- 15 Bennett DA, Wilson RS, Schneider JA, Evans DA, Beckett LA, Aggarwal NT, et al. Natural history of mild cognitive impairment in older persons. Neurology. 2002;59(2):198-205.
- 16 Elias MF, Beiser A, Wolf PA, Au R, White RF, D'Agostino RB. The preclinical phase of alzheimer disease: A 22-year prospective study of the Framingham Cohort. Arch Neurol. 2000;57(6):808-13.
- 17 Ramos LR, Simoes EJ, Albert MS. Dependence in activities of daily living and cognitive impairment strongly predicted mortality in older urban residents in Brazil: a 2-year follow-up. J Am Geriatr Soc. 2001;49(9):1168-75.
- 18 Morris JC, Storandt M, Miller JP, Mckeel DW, Price JL, Rubin EH, et. Mild cognitive impairment represents early-stage Alzheimer disease. Arch Neurol. 2001;58(3):397-405.
- 19 Killiany RJ, Gomez-Isla T, Moss M, Kikinis R, Sandor T, Jolesz F, et al. Use of structural magnetic resonance imaging to predict who will get Alzheimer's disease. Ann Neurol. 2000;47(4):430-9.
- 20 de Leon MJ, Convit A, Wolf OT, Tarshish CY, DeSanti S, Rusinek H, et al. Prediction of cognitive decline in normal elderly subjects with 2-[(18)fluoro-2-deoxi-D-glucose/positron-emission tomography (FDG/PET). Proc Natl Acad Sci USA. 2001;98(19):10966-71.
- 21 Bottino CM, Castro CC, Gomes RL, Buchpiguel CA, Marchetti RL, Netto RM. Volumetric MRI measurements can differentiate Alzheimer's Disease, mild cognitive impairment, and normal aging. Int Psychogeriatr. 2002;14(1):59-72.
- 22 Schmand B, Jonker C, Hooijer C, Lindeboom J. Subjective memory complaints may announce dementia. Neurology. 1996;46(1):121-5.
- 23 Jorm AF, Christensen H, Korten AE, Henderson AS, Jacomb PA, Mackinnon A. Do cognitive complaints either predict future cognitive decline or reflect past cognitive decline? A longitudinal study of an elderly community sample. Psychol Med. 1997;27(1):91-8.
- 24 Jonker C, Geerlings MI, Schmand B. Are memory complaints predictive for dementia? A review of clinical and population-based studies. Int J Geriatric Psychiatry. 2000;15(11):938-91.
- 25 Fichman-Charchat H. Heterogeneidade neuropsicológica no processo de envelhecimento: transição do normal aos estágios iniciais da Doença de Alzheimer [tese]. São Paulo: Instituto de Psicologia, Universidade de São Paulo; 2003.
- 26 Daly E, Zaitchik D, Copeland M, Schmahmann J, Gunther J, Albert M. Predicting conversion to Alzheimer disease using standardized clinical information. Arch Neurol. 2000;57(5):675-80.
- Comment in: Arch Neurol. 2000;57(5):643-4.
- 27 Nitrini R, Caramelli P, Herrera Junior E, Porto CS, Charchat-Fichman H, Carthery M T, et al. Performance of illiterate and literate nondemented elderly subjects in two tests of long-term memory. J Int Neuropsychol Soc. 2004;10(4):634-8.
Datas de Publicação
-
Publicação nesta coleção
14 Abr 2005 -
Data do Fascículo
Mar 2005
Histórico
-
Aceito
02 Nov 2004 -
Recebido
14 Abr 2004