Resumos
A influenza aviária é doença exótica no Brasil. O sistema de vigilância implementado pelo Programa Nacional de Sanidade Avícola (PNSA) mantém monitoração permanente das aves das principais espécies domésticas, tanto do material genético importado para a indústria avícola, por exemplo, da espécie das galinhas (Gallus gallus formadomestica), perus (Meleagris gallopavo formadomestica), codornas (Coturnix coturnix japonica), patos (Anas), primários (elite), bisavós e avós para postura ou corte, como aves de espécies de exploração mais recente, exóticas, por exemplo avestruzes (Struthio camelus) ou nativas, por exemplo emas (Rhea americana). Os plantéis de reprodutores em produção são também acompanhados por amostragens periódicas, conforme previsto no PNSA, além da monitoração das respostas aos programas de vacinação, por exemplo, contra bronquite infecciosa e doença infecciosa bursal. O PNSA estabelece as normas de atuação para o controle e erradicação da doença de Newcastle (ND) e Influenza Aviária (AI) (Projeto de Vigilância, 2001), a saber: I - Notificação de focos da doença (e confirmação laboratorial no LARA-Campinas); II - Assistência a focos; III - Medidas de desinfecção; IV - Sacrifício sanitário; V - Vazio sanitário; VI - Vacinação dos plantéis ou esquemas emergenciais; VII - Controle e fiscalização dos animais susceptíveis; VIII - Outras medidas sanitárias; A vigilância e atenção ao foco exige o diagnóstico laboratorial e diferencial de AI e ND, que segue as normas do PNSA, conforme o sumário abaixo: 1- Interdição e coleta de materiais para exame laboratorial oficial; 2- Registro das aves: espécie(s), categoria(s), número(s), manutenção de aves; utensílios e produtos no local; proibição de trânsito de e para a(s) propriedade(s) em um raio de 10 km; controle de todos os animais e materiais possíveis fontes de propagação; desinfecção de vias de entradas e saídas à(s) propriedade(s); inquérito epidemiológico. 3- Confirmação laboratorial: isolamento de agente letal hemaglutinante em ovos embrionados de galinhas SPF, não inibido (inibição da hemaglutinação) ou não neutralizado (soroneutralização) por soro específico para o vírus da doença de Newcastle; caracterização do agente como vírus da influenza aviária (AIV) por detecção de antígenos da nucleoproteína e/ou matriciais de AIV e de seu subtipo por ensaios específicos para a caracterização da hemaglutinina e neuraminidase (imunodifusão, imunoenzimáticos ou moleculares). 4- Abate e destruição imediata (cremação) de todas as aves, resíduos, carnes e ovos da(s) propriedade(s) atingida(s) e vizinhas (raio de 3 km); limpeza e desinfecção das instalações; vazio sanitário (mínimo 21 dias); 5- Permitir o transporte para o abate ou incubação dentro da zona de vigilância (raio de 10 km). 6- Proibir feiras, exposições, mercados na zona de vigilância (10 km). 7- Aplicar estas medidas por mínimo de 21 dias após a destruição das fontes de propagação e desinfecção das instalações, proibir a retirada de aves e produtos na zona de proteção (3 km) por 21 dias e 15 dias na zona de vigilância (10 km). A certificação de área livre segue as normas da OIE e PNSA, considerando AI exótica no Brasil (país livre), e exige: 1- AI de alta patogenicidade não diagnosticada pelo sistema de vigilância pelos últimos 3 anos; 2- Um período de 6 meses após o abate, destruição das aves e resíduos e desinfecção após surto; O sistema de criação da avicultura predominante no Brasil (galinhas e perus) emprega a mais atual tecnologia e conhecimento científico na produção, no qual os plantéis são gerenciados com biossegurança, avaliação permanente dos pontos críticos, sistema de qualidade total e programas de vacinações que garantem a prevenção de inúmeros problemas sanitários. A prevenção de influenza aviária é especialmente favorecida por essas características. O sistema e tipo de construção (galpões) para o alojamento dos plantéis dessas espécies dificultam também o desafio eventualmente imposto pelas aves de vida livre. A localização geográfica da avicultura nacional, localizada fora das rotas migratórias das aves-reservatório, pode também exercer papel importante na ausência de focos de influenza no Brasil. Além disso, o baixo índice de replicação dos AIV nas aves migratórias durante a estada na região subtropical também influi para a menor ocorrência. As espécies de aves domésticas de importância comercial mais sensíveis à infecção e potencialmente envolvidas no papel de fonte de infecção, conforme citadas na literatura internacional, perus e patos, são mantidas em galpões industriais com sistema de biossegurança e de distribuição geográfica bastante restrita, em contraste com as criações dos países com relatos permanentes de surtos, em que se associam as condições de desafio naturais geográficas ditadas pelas rotas migratórias, mais alta replicação na ave na estação (países temperados) e a criação em campo aberto.
Influenza aviária; vírus; aves (Aves); frangos de corte; vacina
Avian influenza is an exotic disease in the Brazilian poultry. The National Avian Health Surveillance Program (PNSA) maintains permanent monitoring of AVES of all domestic species, including imported genetic material for the poultry industry, for example chickens (Gallus gallus formadomestica), turkeys (Meleagris gallopavo formadomestica), quail (Coturnix coturnix japonica), ducks (Anas), elite, grand grandparent and grandparent stocks for layers and broilers, as well as species more recently exploited for production, for example, the exotic ostriches (Struthio camelus) or native rheas (Rhea americana). The breeding stocks are monitored by regular sampling for serology, virology and bacteriology, principally looking for Newcastle disease, influenza, salmonellas and mycoplasmas, as established by the PNSA, in addition to monitoring vaccination responses to, for example, infectious bursal disease and infectious bronchitis. The PNSA establishes the rules for the control and eradication of Newcastle disease and avian influenza (Projeto de Vigilância..., 2001), including the need for differential diagnosis, according to the following major actions: I. Notification of outbreaks (and laboratory confirmation at the LARA-Campinas); II. Sanitary assistance to the outbreaks; III. Disinfection and sanitation measures; IV. Sanitary slaughter; V. Sanitary depopulation; VI. Vaccination of flocks and emergency strategies; VII. Control and monitoring of susceptible flocks; VIII. Other sanitary measures; The active surveillance and outbreak attention policies require the diagnosis and differential diagnosis of ND and AI, following the code described by OIE and the PNSA, as follows: 1- Zoning, interdiction and sampling for laboratory confirmation; 2- Registry of AVES, including species, category and numbers; applicable to a 10 km radius: restriction to transportation of animals and materials possible source of infection and propagation; disinfection of sites of entry and exit to affected properties; epidemiological surveillance; 3- Laboratory confirmation by isolating and characterizing AIV: hemagglutinating agent isolated in SPF eggs not inhibited by NDV specific serum, characterized as AIV by detecting antigens of the nucleoprotein and/or matrix and subtyped by assaying for hemagglutinin and neuraminidase subtypes (immunodiffusion, enzyme immunoassays or molecular methodology); 4- Slaughter and cremation of all avian individuals, residues, meats and eggs of all affected and neighboring properties (3 km radius), cleaning and disinfection of premises; sanitary depopulation for 21 days (minimum). 5- Allow transportation for slaughter or incubation within the vigilance area (10 km radius). 6- Prohibit fairs, markets, expositions etc., within the vigilance area (10 km radius). 7- Apply these measures for a minimum of 21 days after disinfection (which follows slaughter, cremation and cleaning) and prohibit transportation of animals and residues/products of properties within the protection area (3 km radius) and for 15 days within the vigilance area (10 km radius). The certification of HPAIV area is according to OIE and PNSA regulations and considers Brazil as a free country, applicable as follows: 1- HPAIV is not diagnosed by the active surveillance for the last 3 years; 2- 6 months after an outbreak of HPAIV is diagnosed, birds and residues/products are destroyed. The major species (chickens and turkeys) maintained in the Brazilian poultry industry employ the state-of-the-art production technology. Flocks are managed with the forefront knowledge in biosecurity, housing, permanent evaluation of critical points and quality and vaccination programs, which guarantee the prevention of most health problems. The geographic localization of the Brazilian poultry industry may also play a role in the absence of influenza outbreaks, in addition to the lower rate of replication of AIV in migratory birds during their subtropical season. Migratory routes may also concentrate in areas not occupied by poultry industry. Added to that, the biosecurity/housing and quality system of the industry may represent the step further to prevent health problems caused by transmissible infectious diseases such as influenza, considering that, for instance, all chicken and turkey industrial flocks are kept in houses, in contrast to open field farming, especially for ducks, geese and turkeys, kept on migratory routes of countries facing influenza problems.
Avian influenza; virus; avian (Aves); broilers; vaccine
Influenza Aviária: Uma Revisão dos Últimos Dez Anos
Avian Influenza: A Review of the Last Ten Years
Martins NRS1
1-Medico Veterinário, MSc e PhD em Microbiologia Veterinária (1987 e 1990, University of Surrey, UK), Prof. Adjunto do Departamento de Medicina Veterinária Preventiva (Doenças das Aves), Escola de Veterinária da UFMG.
Correspondência / Mail Address
Nelson Rodrigo da Silva Martins
Escola de veterinária - UFMG
Av. Antônio Carlos 6627 - Caixa Postal 567
Belo Horizonte - MG - Brasil
E-mail: rodrigo@vet.ufmg.br
Unitermos / Keywords
Influenza aviária, vírus, aves (Aves), frangos de corte, vacina
Avian influenza, virus, avian (Aves), broilers, vaccine
A influenza aviária é doença exótica no Brasil. O sistema de vigilância implementado pelo Programa Nacional de Sanidade Avícola (PNSA) mantém monitoração permanente das aves das principais espécies domésticas, tanto do material genético importado para a indústria avícola, por exemplo, da espécie das galinhas (Gallus gallus formadomestica), perus (Meleagris gallopavo formadomestica), codornas (Coturnix coturnix japonica), patos (Anas), primários (elite), bisavós e avós para postura ou corte, como aves de espécies de exploração mais recente, exóticas, por exemplo avestruzes (Struthio camelus) ou nativas, por exemplo emas (Rhea americana). Os plantéis de reprodutores em produção são também acompanhados por amostragens periódicas, conforme previsto no PNSA, além da monitoração das respostas aos programas de vacinação, por exemplo, contra bronquite infecciosa e doença infecciosa bursal.
O PNSA estabelece as normas de atuação para o controle e erradicação da doença de Newcastle (ND) e Influenza Aviária (AI) (Projeto de Vigilância, 2001), a saber:
I - Notificação de focos da doença (e confirmação laboratorial no LARA-Campinas);
II - Assistência a focos;
III - Medidas de desinfecção;
IV - Sacrifício sanitário;
V - Vazio sanitário;
VI - Vacinação dos plantéis ou esquemas emergenciais;
VII - Controle e fiscalização dos animais susceptíveis;
VIII - Outras medidas sanitárias;
A vigilância e atenção ao foco exige o diagnóstico laboratorial e diferencial de AI e ND, que segue as normas do PNSA, conforme o sumário abaixo:
1- Interdição e coleta de materiais para exame laboratorial oficial;
2- Registro das aves: espécie(s), categoria(s), número(s), manutenção de aves; utensílios e produtos no local; proibição de trânsito de e para a(s) propriedade(s) em um raio de 10 km; controle de todos os animais e materiais possíveis fontes de propagação; desinfecção de vias de entradas e saídas à(s) propriedade(s); inquérito epidemiológico.
3- Confirmação laboratorial: isolamento de agente letal hemaglutinante em ovos embrionados de galinhas SPF, não inibido (inibição da hemaglutinação) ou não neutralizado (soroneutralização) por soro específico para o vírus da doença de Newcastle; caracterização do agente como vírus da influenza aviária (AIV) por detecção de antígenos da nucleoproteína e/ou matriciais de AIV e de seu subtipo por ensaios específicos para a caracterização da hemaglutinina e neuraminidase (imunodifusão, imunoenzimáticos ou moleculares).
4- Abate e destruição imediata (cremação) de todas as aves, resíduos, carnes e ovos da(s) propriedade(s) atingida(s) e vizinhas (raio de 3 km); limpeza e desinfecção das instalações; vazio sanitário (mínimo 21 dias);
5- Permitir o transporte para o abate ou incubação dentro da zona de vigilância (raio de 10 km).
6- Proibir feiras, exposições, mercados na zona de vigilância (10 km).
7- Aplicar estas medidas por mínimo de 21 dias após a destruição das fontes de propagação e desinfecção das instalações, proibir a retirada de aves e produtos na zona de proteção (3 km) por 21 dias e 15 dias na zona de vigilância (10 km).
A certificação de área livre segue as normas da OIE e PNSA, considerando AI exótica no Brasil (país livre), e exige:
1- AI de alta patogenicidade não diagnosticada pelo sistema de vigilância pelos últimos 3 anos;
2- Um período de 6 meses após o abate, destruição das aves e resíduos e desinfecção após surto;
O sistema de criação da avicultura predominante no Brasil (galinhas e perus) emprega a mais atual tecnologia e conhecimento científico na produção, no qual os plantéis são gerenciados com biossegurança, avaliação permanente dos pontos críticos, sistema de qualidade total e programas de vacinações que garantem a prevenção de inúmeros problemas sanitários. A prevenção de influenza aviária é especialmente favorecida por essas características. O sistema e tipo de construção (galpões) para o alojamento dos plantéis dessas espécies dificultam também o desafio eventualmente imposto pelas aves de vida livre. A localização geográfica da avicultura nacional, localizada fora das rotas migratórias das aves-reservatório, pode também exercer papel importante na ausência de focos de influenza no Brasil. Além disso, o baixo índice de replicação dos AIV nas aves migratórias durante a estada na região subtropical também influi para a menor ocorrência. As espécies de aves domésticas de importância comercial mais sensíveis à infecção e potencialmente envolvidas no papel de fonte de infecção, conforme citadas na literatura internacional, perus e patos, são mantidas em galpões industriais com sistema de biossegurança e de distribuição geográfica bastante restrita, em contraste com as criações dos países com relatos permanentes de surtos, em que se associam as condições de desafio naturais geográficas ditadas pelas rotas migratórias, mais alta replicação na ave na estação (países temperados) e a criação em campo aberto.
ABSTRACT
Avian influenza is an exotic disease in the Brazilian poultry. The National Avian Health Surveillance Program (PNSA) maintains permanent monitoring of AVES of all domestic species, including imported genetic material for the poultry industry, for example chickens (Gallus gallus formadomestica), turkeys (Meleagris gallopavo formadomestica), quail (Coturnix coturnix japonica), ducks (Anas), elite, grand grandparent and grandparent stocks for layers and broilers, as well as species more recently exploited for production, for example, the exotic ostriches (Struthio camelus) or native rheas (Rhea americana). The breeding stocks are monitored by regular sampling for serology, virology and bacteriology, principally looking for Newcastle disease, influenza, salmonellas and mycoplasmas, as established by the PNSA, in addition to monitoring vaccination responses to, for example, infectious bursal disease and infectious bronchitis.
The PNSA establishes the rules for the control and eradication of Newcastle disease and avian influenza (Projeto de Vigilância..., 2001), including the need for differential diagnosis, according to the following major actions:
I. Notification of outbreaks (and laboratory confirmation at the LARA-Campinas);
II. Sanitary assistance to the outbreaks;
III. Disinfection and sanitation measures;
IV. Sanitary slaughter;
V. Sanitary depopulation;
VI. Vaccination of flocks and emergency strategies;
VII. Control and monitoring of susceptible flocks;
VIII. Other sanitary measures;
The active surveillance and outbreak attention policies require the diagnosis and differential diagnosis of ND and AI, following the code described by OIE and the PNSA, as follows:
1- Zoning, interdiction and sampling for laboratory confirmation;
2- Registry of AVES, including species, category and numbers; applicable to a 10 km radius: restriction to transportation of animals and materials possible source of infection and propagation; disinfection of sites of entry and exit to affected properties; epidemiological surveillance;
3- Laboratory confirmation by isolating and characterizing AIV: hemagglutinating agent isolated in SPF eggs not inhibited by NDV specific serum, characterized as AIV by detecting antigens of the nucleoprotein and/or matrix and subtyped by assaying for hemagglutinin and neuraminidase subtypes (immunodiffusion, enzyme immunoassays or molecular methodology);
4- Slaughter and cremation of all avian individuals, residues, meats and eggs of all affected and neighboring properties (3 km radius), cleaning and disinfection of premises; sanitary depopulation for 21 days (minimum).
5- Allow transportation for slaughter or incubation within the vigilance area (10 km radius).
6- Prohibit fairs, markets, expositions etc., within the vigilance area (10 km radius).
7- Apply these measures for a minimum of 21 days after disinfection (which follows slaughter, cremation and cleaning) and prohibit transportation of animals and residues/products of properties within the protection area (3 km radius) and for 15 days within the vigilance area (10 km radius).
The certification of HPAIV area is according to OIE and PNSA regulations and considers Brazil as a free country, applicable as follows:
1- HPAIV is not diagnosed by the active surveillance for the last 3 years;
2- 6 months after an outbreak of HPAIV is diagnosed, birds and residues/products are destroyed.
The major species (chickens and turkeys) maintained in the Brazilian poultry industry employ the state-of-the-art production technology. Flocks are managed with the forefront knowledge in biosecurity, housing, permanent evaluation of critical points and quality and vaccination programs, which guarantee the prevention of most health problems. The geographic localization of the Brazilian poultry industry may also play a role in the absence of influenza outbreaks, in addition to the lower rate of replication of AIV in migratory birds during their subtropical season. Migratory routes may also concentrate in areas not occupied by poultry industry. Added to that, the biosecurity/housing and quality system of the industry may represent the step further to prevent health problems caused by transmissible infectious diseases such as influenza, considering that, for instance, all chicken and turkey industrial flocks are kept in houses, in contrast to open field farming, especially for ducks, geese and turkeys, kept on migratory routes of countries facing influenza problems.
INTRODUÇÃO
A influenza aviária (AI) inclui amplitude de síndromes que se manifestam desde infecção subclínica, doença suave respiratória das vias superiores ou doença fatal generalizada em aves domésticas. Inúmeros diferentes isolados do vírus da influenza aviária (AIV) circulam entre diversas espécies animais ao redor do mundo. Embora AIV possa infectar enorme diversidade de espécies das classes de aves e mamíferos, são tidas como reservatórios naturais as aves aquáticas, aves habitantes das praias e gaivotas, sendo consideradas aberrantes as infecções em galinhas, perus, suínos, eqüinos e humanos (Suarez, 2000). O alto nível de recombinação genética, observado especialmente entre integrantes dos AIV do tipo A, é conseqüência do genoma segmentado, que permite permutações de genes, em contraste com integrantes de Paramyxoviridae, por exemplo o vírus da doença de Newcastle, que não apresentam recombinação detectável por apresentar genoma não segmentado (Kingsbury, 1990.) A baixa incidência dos AIV nos períodos migratórios sub-tropicais das aves aquáticas (Murphy & Webster, 1996) pode explicar a baixa ou rara ocorrência no Brasil.
As conceituações e procedimentos do Programa Nacional de Sanidade Avícola (PNSA) descrevem a AI como doença causada por Orthomyxoviridae Influenza A, com patogenicidade intravenosa em aves de 6 semanas de idade maior que 1,2, ou infecções com AIV dos subtipos H5 ou H7 ou AIV cujas seqüências do sítio de clivagem da hemaglutinina contém múltiplos aminoácidos básicos, de acordo com o manual da O.I.E. ((Projeto de Vigilância, 2001).
Influenza como zoonose
A influenza em humanos parece ocorrer desde os primórdios da humanidade, segundo a literatura antiga, que data, por exemplo 2000 a.C., com o registro de doença respiratória aguda com duração de poucos dias ou semanas (Toniolo Neto, 2001). A evolução de variantes de AIV capazes de apresentar caráter zoonótico é constante e tem sido demonstrada experimentalmente. As etiologias pelo menos das últimas duas pandemias (1918-1919 e 1968) foram caracterizadas como estirpes híbridas que continham genoma recombinante de AIV de aves e humanos. A ameaça de pandemia por AIV em humanos é preocupação permanente dos agentes de saúde pública, uma vez que há evidências dos vírus H5N1 e H9N2 terem sido transmitidos de aves para humanos nos mercados de aves de Hong Kong (Horimoto & Kawaoka, 2001). Alguns subtipos de AIV têm importância direta em saúde humana. O AIV H5N1, que ocasionou o óbito de 6 pessoas em Hong Kong em 1997, foi transmitido diretamente de galinhas para humanos. A adaptação a novo hospedeiro significa principalmente alteração rápida das glicoproteínas da superfície, especialmente da hemaglutinina (HA), embora o H5N1 tenha apresentado mudanças de aminoácidos em outras proteínas e não em HA, indicando que sua HA está altamente adaptada às aves, não necessitando mudar e que os outros genes podem advir de outras origens por recombinação genética, inclusive com seqüências internas de consenso previamente encontradas em humanos, a exemplo de H5N1. As seqüências de aminoácidos de origem humana obtidas por recombinação podem ter importância como determinantes do aspecto zoonótico (Zhou et al., 1999b). A recombinação genética entre influenza de aves, suínos e humanos foi demonstrada, após episódios de doença respiratória em plantéis de suínos na Carolina do Norte (NC), Texas (TX), Minnesota (MN) e Iowa (IO) em 1998. O isolado da NC resultou de recombinação entre H3N2 de humanos com o clássico H1N1 de suínos e os demais de H3N2 humano, H1N1 clássico suíno e genes de vírus de aves (AIV). A hemaglutinina dos quatro isolados obtidos derivou-se de H3N2 humano em circulação em 1995 (Zhou et al., 1999a).
Uma estirpe de AIV classificada como A/Hong Kong/156/97 (H5N1) de alta patogenicidade foi descrita em episódio fatal de influenza em criança com faringite, tosse seca e febre, estirpe que apresentava múltiplos aminoácidos básicos no sítio de clivagem da HA, caráter associado à alta patogenicidade para galinhas, nas quais resultou na mortalidade de 15/16 aves inoculadas. Em mais 12 casos humanos com estirpes de AIV semelhantes essas foram isoladas, 3 obtidas de casos fatais (Subbarao et al., 1997).
Na China, o surgimento de AIV H1N1 em suínos alertou para o papel da espécie como intermediária de todos os oito genes de origem primariamente aviária, funcionando ainda como fonte de genes para a recombinação genética de subtipos de AIV. Os suínos podem assim representar uma importante espécie na transmissão para humanos na China. (Guan et al., 1996.). Novas estirpes de influenza vírus estão constantemente emergindo na população humana. Três pandemias em humanos (1918-19 H1N1 - Espanhola, 1957 H2N2 Asiática e 1968 H3N2 Hong Kong) estão descritas na literatura, nas quais os subtipos cruzaram as barreiras de espécie hospedeira. Da mesma forma, o surto em Hong Kong em 1997 com H5N1 indica para o risco futuro de pandemia, contra a qual não haveria tempo suficiente para estabelecimento de proteção vacinal às populações humanas. Estirpes de AIV em períodos interpandêmicos podem apresentar variação antigênica leve (antigenic drift) e podem evoluir para variação antigênica forte (antigenic shift) e originar surto de doença. A vigilância epidemiológica é base para a determinação de atualizações vacinais e os agentes antivirais anti-neuraminidase devem ser considerados como adjuvantes para vacinas (De Jong et al., 2000).
A alta homologia entre os genes internos dos isolados H6N1 indica que esses subtipos são capazes de intercambiar seus genes e são, portanto, fonte potencial de isolados patogênicos para humanos, sendo sugerida a vigilância epidemiológica para aves aquáticas e domésticas, suínos e humanos (Hoffmann et al., 2000). As seqüências dos genes de 18 estirpes de AIV de humanos, que resultaram em óbito de seis pacientes, no surto de Hong Kong, em 1997, evidenciaram que as estirpes desse surto derivaram de influenza vírus de aves e não de humanos (Subbarao & Shaw, 2000). Um estudo dos fatores de risco para AIV em 15 pacientes humanos hospitalizados, relacionado ao isolado H5N1 (Hong Kong), foi conduzido após a morte de uma criança em Hong Kong, em 1997. Fatores como idade, sexo e vizinhança foram considerados. A exposição às galinhas vivas do mercado de aves de Hong Kong foi considerada significativa, enquanto o consumo ou preparação de produtos, bem como a exposição a humanos com doença respiratória, inclusive influenza, não foi associada à doença (Mounts et al., 1999).
Impacto econômico
O impacto econômico nas espécies domésticas destinadas à produção é enorme em muitos países, sem contar o envolvimento das espécies de vida selvagem e preservação, valor individual de estimação e ainda os investimentos em saúde humana. Surtos de AI causados pela amostra de baixa patogenicidade H7N2 em poedeiras, frangas em recria (Gallus gallus formadomestica) e perus (Meleagris gallopavo formadomestica), na Pennsylvania (EUA), durante 1997 e 1998, foram analisados economicamente (depopulação e lucros cessantes) e extrapolados para a população avícola total deste estado, indicando um custo total de US$ 3,5 milhões (Davison et al., 1999). Os episódios em Minnesota nos EUA, entre 1979 e 1981, foram monitorados economicamente e indicaram despesas anuais em torno de 1 milhão de dólares (Poss et al., 1982), relacionadas com perdas de produtividade em ganho de peso e produção de ovos. Os custos relacionados às indenizações, diagnóstico, suporte técnico e comando tático (Pennsylvania - sacrifício de mais de 11,2 milhões de aves mais de 7,2 milhões de poedeiras e 3,6 milhões de frangos de corte em 278 propriedades) no programa de erradicação da AI, estabelecido a partir de novembro de 1983 na Pennsylvania e Virginia, foram US $ 30.140.574,00 e 2.328.317, respectivamente (Avian Influenza Task Force, 1984), incluindo isolamento de vírus de aves de vida livre da região de quarentena (patos preto-Anas anas e Mallard-Anas platyrhynchos, gansos canadenses-Branta canadensis, faisões de pescoço anelado-Phasianus, gaivota de bico anelado-Larus) e sorologia (inibição da hemaglutinação e inibição da neuraminidase) em aves e mamíferos (patos-Anas e gansos domésticos-Branta e selvagens, gaivotas marinhas-Larus, corvos-Corvus, estorninhos-Sturnus, pássaros pretos de asa vermelha-Agelaius phoeniceus, pardais-Passer, pombos-Columba, faisões-Phasianus, camundongos-Mus e ratos-Rattus) (Avian Influenza Task Force, 1984.), totalizando ao final US $ 60 milhões ao governo e 15 milhões aos proprietários, que poderiam chegar a US $ 1,5 bilhões aos avicultores e 5 bilhões aos consumidores, caso não houvesse a decisão de erradicação. Os consumidores dispenderam mais de US $ 300 milhões em custos aumentados dos produtos (Lasley, 1987). Os efeitos negativos dos surtos de AIV de alta patogenicidade (HPAIV) na província de Guangdong (China) foram sentidos nos mercados de produtos e aves, repercutindo nos estabelecimentos rurais. Um sistema de informação entre instituições de pesquisa, ensino e indústria de processamento com o manejo animal e mercado foi recomendado para minimizar os prejuízos (Wei-Hua, 1998).
ETIOLOGIA
A influenza aviária é causada por vírus da família Orthomyxoviridae. As propriedades físicas, químicas e biológicas dos vírus da influenza aviária (AIV) serão descritas a seguir.
Os vírions dos AIV são aproximadamente esféricos de até 200nm de diâmetro ou pleomórficos, quando observados os replicados pelos hospedeiros naturais. Estirpes propagadas em ovos têm morfologia mais regular (circular) e em média entre 80 e 120nm de diâmetro. O envelope contém projeções rígidas (spikes) de hemaglutinina e neuraminidase, que formam um halo característico ao redor das partículas em coloração negativa e observadas por microscopia eletrônica (Fig. 1 e 2; ©Copyright Linda M Stannard, 1995 e Fig. 3 e 4, ISTOÉ 1561/01/09/1999). O genoma viral é composto de oito segmentos de RNA de fita simples. A estrutura de RNA-proteína (nucleoproteína NP) do cerne não é comumente observável, apenas poucas partículas íntegras evidenciam o conteúdo helicoidal interno. Entretanto, partículas rompidas liberam o conteúdo de NP, que é longa e apresenta um aspecto de zíper ou espinha de peixe (estrutura helicoidal). Maiores detalhes da estrutura, composição e biologia dos influenza vírus em geral são encontrados nos capítulos Orthomyxoviruses (Murphy & Webster, 1996) e Orthomyxoviridae: The Viruses and Their Replication (Lamb & Krug, 1996)
Dados da estrutura e composição dos AIV podem ser conferidos na Tabela 1. O cerne dos AIV contém o material genético formado por RNA dividido em 8 segmentos de fita simples enrolados em si próprios e revestidos por unidades da proteína do capsídeo, a nucleoproteína (NP), formando uma hélice. A NP, embora exerça o revestimento do RNA, permite espaço entre essas unidades estruturais e o RNA, com exposição das ligações fosfo-diester do RNA, rapidamente acessíveis à digestão por ribonucleases (Kingsbury, 1990.). Dez genes estão localizados nos 8 segmentos do RNA. As proteínas estruturais compreendem, de acordo com os genes codificadores, como produto do gene 4, a hemaglutinina (HA) e do gene 6 a neuraminidase (NA). Ambas são glicoproteínas que formam as grandes projeções superficiais do envelope. O gene 7 codifica a glicoproteína da membrana (M1) ou matriz, a proteína menor da membrana (M2) e o polipeptídeo M3, todos estes 3 componentes inseridos na dupla camada lipídica do envelope. O gene 5 codifica a nucleoproteína (NP), as unidades que revestem o RNA, formando o nucleocapsídeo. As 3 enzimas polimerases virais, PA codificada pelo gene 3, PB1 codificada pelo gene 2 e PB2 codificada pelo gene 1 estão todas localizadas na extremidade de cada unidade do nucleocapsídeo. O gene 8 codifica as proteínas não estruturais NS1 e NS2, de função desconhecida.
A HA é responsável pela adsorção ao receptor celular. Este receptor é composto de glicoproteína siálica, contendo o ácido N-acetil neuramínico terminal (COOH-C=O-CH2-CH-OH-CH-NH-C=O-CH3-CH-OH-CH-OH-CH2-OH), proteína que necessita maturação pós tradução para poder intermediar a fusão com a membrana da célula sendo infectada (Kingsbury, 1990.). A HA reconhece receptores com cadeias de açúcares da série lacto-sialil tipos I e II (ácido siálico) nas células, determinando a amplitude de hospedeiros (Suzuki, 2000). O sítio de conexão da HA ao receptor celular forma uma cavidade em cada uma das três subunidades do trímero de HA, cujos resíduos de aminoácidos tirosina 98, triptofânio 153, histidina 183, ác. glutâmico 190 e leucina 194, inacessíveis aos anticorpos, são muito conservados entre os subtipos (Lamb & Krug, 1996). A HA confere também capacidade de aglutinação ao muco do sistema respiratório.
Classificação
A classificação dos integrantes da família Orthomyxoviridae é muito precisa. O nome do vírus compõe-se de informações separadas por barras verticais, que incluem o tipo (A, B ou C)/ espécie animal/ localização geográfica/ número de referência do laboratório/ ano de isolamento/ subtipo de HA/ subtipo de NA. Entretanto, as informações sobre virulência não estão incluídas na nomenclatura.
Geral
A família Orthomyxoviridae contém três tipos antigênicos ou gêneros A, B e C de vírus influenza, distingüíveis pela composição da unidade estrutural protéica do nucleocapsídeo (NP) e da proteína não glicosilada do envelope (M1). Desses, B e C são principalmente patógenos humanos e A são isolados de muitas espécies animais, incluindo humanos. As glicoproteínas da superfície das estirpes integrantes do tipo A apresentam muito maior variabilidade antigênica se comparadas àquelas de integrantes de B e C. Os tipos A e B apresentam maior semelhança morfológica entre si e são diferentes de representantes do tipo C, que contém as glicoproteínas do envelope dispostas em disposição hexagonal (Kingsbury, 1990.). Todos os AIV de aves são integrantes do tipo A e são divididos em subtipos pela análise da hemaglutinina (HA) e neuraminidase (NA) (Easterday et al., 1997). Atualmente, 15 HA e 9 NA antigenicamente distintas são conhecidas.
Subtipos de influenza A aviários
As hemaglutininas H1 a H15 e neuraminidases N1 a N9 são reconhecidas (Easterday et al., 1997). Quaisquer combinações entre HA e NA são possíveis na natureza. Alguns exemplos de estirpes de aves classificadas incluem: H5N2 (Pennsylvania e Virginia, EUA, Nov 1983-Jan 1984 alta patogenicidade; H5N1 (Hong Kong, China, A/Environment/Hong Kong/437/99, 1997 alta patogenicidade); H5N1 (Inglaterra, A/turkey/England/91 alta patogenicidade); H7N2 (Pennsylvania, EUA, Jan 1997 Mar 1998 média patogenicidade); H8N4 (Wisconsin, EUA, 1968, A/turkey/Wisconsin/1/68 média patogenicidade); H5N3 (Hokkaido, Japão A/duck/Hokkaido/4/96 não patogênico).
A doença causada por AIV nas espécies de aves pode variar grandemente com a estirpe de vírus e a espécie hospedeira. A infecção produzida pela maioria das estirpes é subclínica, embora algumas resultem em doença que envolve o sistema nervoso central com mortalidade alta em uma semana de curso clínico. Essas estirpes estão classificadas principalmente nos subtipos de hemaglutinina H5 e H7, como por exemplo A/fowlplaguevirus/dutch/27 (H7N7-galinha) e A/Tern/SouthAfrica/1/61 (H5N3-Chlidonias). Em perus, as infecções resultam em problemas muito importantes (de H1 a H15), pois é uma espécie em que as infecções respiratórias crônicas causam sérios problemas econômicos. As infecções em perus parecem estar associadas periodicamente pela transmissão de aves migratórias. Doença por AIV ocorre com menos freqüência em Gallus gallus formadomestica (galinha industrial), especialmente pelas características de manejo, que aplica noções de biossegurança, com afastamento de aves domésticas e selvagens, especialmente Anatidae. Entretanto, episódios importantes em galinhas estão relacionados na literatura. Um exemplo é H5N2 na Pennsylvania, Estados Unidos, em 1983, que tornou-se virulento e custou US$ 60 milhões para a erradicação. A infecção em patos (Anatidae), geralmente subclínica, inclui a replicação pulmonar e intestinal. Os AIV mais importantes que ocorrem em humanos (H1N1, H2N2 e H3N2) ocorrem também em patos, nos quais produzem infecção respiratória superior e não intestinal (Murphy & Webster, 1996).
Os subtipos H5 e H7 comumente estão associados a estirpes de alta patogenicidade para certas aves selvagens e domésticas. A HA dessas estirpes é clivada (haste da HA2-glicoproteína da fusão) e infecta diretamente os cultivos em monocamada, não requerendo tratamento enzimático com proteases exógenas (tripsinas). Essas estirpes contêm múltiplos aminoácidos básicos na região carboxi-terminal de HA1, o que possivelmente está relacionado ao reconhecimento pelas proteases endógenas celulares, permitindo clivagem imediata pós-tradução e infecciosidade in vitro e in vivo, com caráter transmissível (Tabela 2). O seqüenciamento dos oito segmentos do genoma de uma estirpe do subtipo H5N1 de humanos, considerado como original de aves e comparado com uma estirpe de galinhas de alta patogenicidade (H5N1, A/Environment/Hong Kong/437/99 - Hong Kong, China, 1997), revelou 99% de identidade das seqüências, mas ambos não foram relacionados a nenhuma informação genética de influenza acessível no GenBank, com quatro clusters relacionados com isolados da Eurásia. A análise filogenética da HA revelou múltiplos aminoácidos básicos no sítio de clivagem da HA (Tabela 2), fenótipo presente em isolados de alta patogenicidade para galinhas (Suarez et al., 1998). A heterogeneidade no gene da hemaglutinina e a emergência de fenótipo de alta virulência entre estirpes do subgrupo H5N2 foram descritas no México. Estirpes obtidas no surto de AIV no México Central foram comparadas no gene codificador e sítios de clivagem da HA, estudo que demonstrou que nenhuma das 18 estirpes apresentou seqüências de aminoácidos previstas (predicted) idênticas em HA1, com mudanças não restritas a uma região. Duas linhagens filogenéticas foram estabelecidas com variações de 10,5% para a seqüência de aminoácidos e 6,2% para os nucleotídeos. As estirpes patogênicas (HPAIV) que causaram alta mortalidade em galinhas apresentaram a substituição do ácido glutâmico por lisina na posição 324 da HA e inserção de arginina e lisina nas posições 325 e 326, sendo que essa inserção pareceu ser uma duplicação da seqüência AAAGAA da posição 965-970 dos nucleotídeos de HA1, possivelmente duplicada pela polimerase (Garcia et al., 1996).
Estrutura e Composição Química
Os vírions completos dos integrantes de Orthomyxoviridae são compostos de 0,8 a 1% de RNA, 70% de proteína, 20% de lipídio e 5 a 8% de carboidratos. O envelope é derivado da membrana plasmática da célula hospedeira replicadora. Partículas virais replicadas em hospedeiros naturais humanos ou animais são pleomórficas (morfologia heterogênea), principalmente arredondadas, de até 200nm de diâmetro, mas incluindo também formas longas em bastão, enquanto que partículas propagadas em ovos ou cultivos de células têm morfologia mais regular (80-120nm). O caráter para maior uniformidade morfológica é determinado geneticamente e associado principalmente ao gene de M1 e menos associado aos genes das principais projeções superficiais hemaglutinina e neuraminidase (Lamb & Krug, 1996; Murphy & Webster, 1996). Os vírions de todas as estirpes de AIV não são morfologicamente distingüíveis de outros vírus influenza dos tipos A e B. As projeções do envelope conferem aspecto característico aos vírions dos tipos A e B e distingüíveis de C (neste dispostas em arranjo hexagonal) (Kingsbury, 1990.)
A hemaglutinina (HA), juntamente com a neuraminidase (NA), determina o impressionante aspecto do envelope viral (Figura 1, 2, 3 e 4), caracterizado por aproximadamente 500 projeções radiais de HA que se projetam para fora. A proporção HA:NA é de 4 a 5 HA para cada NA.
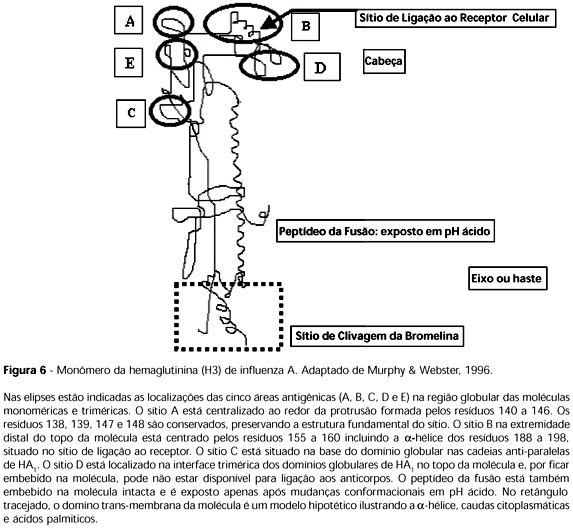
A HA é codificada pelo segmento 4 do RNA genômico, sendo sintetizada no retículo endoplasmático rugoso (RER) como um polipeptídeo único HAo (peso molecular 76.000). O segmento 4 do RNA constitui-se de 1742 a 1778 nucleotídeos e codifica um polipeptídeo de 562 a 566 resíduos de aminoácidos, sendo a cadeia HA1 de 319 a 326 e HA2 de 221 a 222 resíduos de aminoácidos. Um peptídeo de sinalização direciona a cadeia nascente para a membrana do RER, onde é clivada por peptidase de sinal que a transforma em proteína protótipo tipo 1 HA, integrante da membrana viral (Figura 6). A clivagem pode resultar em perda de um a seis resíduos. A HA é pós-maturada pela adição de sete cadeias de oligossacarídeos, adicionados à cadeia principal e três resíduos de palmitato adicionados por ligação tio-éter aos três carbonos terminais das cisteinas proximais. A anexação de cinco cadeias de carboidratos na estrutura lateral da HA1 e uma na cadeia lateral de HA2 resulta aparentemente na conformação tridimensional adequada da HA. Apenas uma cadeia de açúcar é anexada à região globular de HA1, para estabilização das associações dos oligômeros entre as unidades globulares do topo da estrutura. A estrutura ancorada no envelope viral é um trímero homogêneo de monômeros não ligados covalentemente entre si. A clivagem da HA em duas cadeias ligadas por pontes dissulfídricas, HA1 (~47.000) e HA2 (~29.000), depende da estirpe viral, tipo de célula hospedeira e condições de replicação, necessária para a infecciosidade, é determinante da patogenicidade e disseminação da infecção. A HA estende-se por 135 Å para fora do envelope. Três moléculas de HA2 formam um trímero espiralizado que está ancorado e se projeta do envelope (76 Å), na extremidade distal do qual conecta-se a HA1, a subunidade globular mais externa. Uma região hidrofóbica de HA2, que é embebida na haste da HA e torna-se exposta em pH ácido, forma o peptídeo da fusão (Lamb & Krug, 1996; Wiley & Skehel, 1990). A homologia dos aminoácidos da HA entre duas estirpes uma do grupo A e outra do grupo B foi de 24% em HA1 e 39% em HA2, sugerindo relacionamento evolutivo entre os grupos A e B do vírus influenza (Lamb & Krug, 1996).
As três principais funções ou propriedades da HA são:
-
Ligar-se ao receptor contendo ácido siálico na superfície da célula hospedeira, proporcionando a adsorção da partícula viral à célula;
-
Responsável pela penetração do vírus através da membrana citoplasmática, intermediando a fusão do envelope da partícula endocitada com a membrana endosomal, resultando na liberação dos nucleocapsídeos no citoplasma;
-
É o principal antígeno do vírus contra o qual o hospedeiro desenvolve anticorpos neutralizantes e pandemias de influenza estão associadas a mudanças em sua estrutura antigênica.
Todos os tipos de hemaglutininas (H1 a H15) reconhecem cadeias de açúcares da série sialil-lactose tipo I e II (ácido siálico alfa 2-3 (6)Gal beta 1-3 (4) GlcNAc beta 1-) em glicoproteínas e glicolipídeos nas células alvo como moléculas receptoras. Diferentes ácidos siálicos nas membranas das células resultam em diferentes permissividades à replicação de AIV. As estirpes de aves e eqüinos ligam preferencialmente ao receptor 2-3Gal (SA2-3Gal) do ácido siálico terminal, enquanto as estirpes humanas ligam-se ao receptor SA2-6Gal. A distribuição do ácido siálico nas membranas celulares das espécies animais influencia o espectro de hospedeiros. As traquéias de suinos têm ambos receptores para vírus de aves (SA2-3Gal) e de humanos (SA2-6Gal). HA que reconhecem Neu5Gc2-3Gal, abundantes nas células epiteliais da traquéia de eqüinos, são capazes de infectar eqüinos, enquanto um AIV com HA que reconhece Neu5Ac2-6Gal mas não Neu5Ac2-3Gal é incapaz de infectar eqüinos. AIV que reconhece Neu5Ac2-3Gal é replicado nos intestinos de patos, principalmente nas células epiteliais das criptas. Os suínos podem representar, por essa permissividade, hospedeiros para a recombinação de estirpes de aves e humanos (Suzuki, 2000). Uma estirpe humana de AIV do subtipo H3, apesar de origem aviária, não é replicada no intestino de patos, para a qual o reconhecimento do glicoconjugado que possui ácido N-gliconeuramínico ligado à galactose por ligação a2,3 é relacionado com a habilidade de replicação no epitélio do colon de patos e o reconhecimento de NeuGcalfa2,3-Gal determina o enterotropismo (Suzuki et al., 2000).
Determinantes antigênicos comuns podem ser encontrados nas HA de diferentes subtipos. Um estudo com anticorpos monoclonais detectou duas regiões conservadas conformacionais na haste da HA, uma em HA1 e outra em HA2, dos subtipos H1, H2, H5 e H6 (Smirnov et al., 1999).
Cinco sítios antigênicos (A, B, C, D e E) estão localizados na região globular mais externa (HA1) de cada monômero (Figura 5). O sítio de ligação ao receptor celular (ácido siálico) corresponde à localização B e forma uma bolsa em cada subunidade de HA1. As bolsas são inacessíveis aos anticorpos e os aminoácidos (tirosina 98, triptofânio 153, histidina 183, ácido glutâmico 190 e leucina 194) componentes são muito conservados entre as estirpes. As especificidades entre os sítios de ligação e os receptores celulares diferem de acordo com os hospedeiros. Por exemplo, humanos, aves e cavalos podem apresentar restrições às infecções inter-específicas (Lamb & Krug, 1996).
Glicoproteína da fusão: Ativação por da HA e relação com patogenicidade
As estratégias para a fusão das duplas camadas lipídicas do envelope viral e célula hospedeira incluem:
-
A mudança conformacional da HA deve ocorrer no momento e local certo para evitar que o peptídeo de fusão da HA produza auto-aglutinação dos monômeros;
-
O peptídeo de fusão pode intercalar dentro das duas camadas lipídicas;
-
Vários trímeros de HA devem adsorver para assegurar a formação do poro de fusão competente;
-
A HA requer o sítio trans-membrana para a completa fusão. HA de engenharia genética ancora às membranas, com âncora de fosfatidilinositol glicosil, e promove fusão apenas parcial (hemifusão);
Uma região hidrofóbica de HA2 torna-se exposta em pH ácido e forma a glicoproteína da fusão. As mudanças conformacionais na HA em pH baixo resultam na exposição de alguns sítios e no seqüestramento de outros. Por exemplo, os sítios de clivagem por tripsina do peptídeo da fusão exposto tornam-se sensíveis à digestão pela termolisina e a ponte dissulfídrica única que liga HA1 e HA2 torna-se exposta. Apesar das modificações, a molécula mantém a estrutura trimérica e os sítios de combinação com o receptor mantêm os resíduos de ligação ao ácido siálico. As pontes dissulfídricas entre as subunidades HA1 e HA2 protegem a cabeça globular da HA de mudança conformacional em pH ácido, que impediria a associação ao receptor celular (Lamb & Krug, 1996).
A clivagem da molécula HAΟ em HA1 e HA2 é um pré-requisito para a mudança conformacional, que ocorre em pH ácido e, portanto, uma condição para infecciosidade (Figura 6). As HA que possuem resíduo único do aminoácido básico arginina no peptídeo de conexão entre HA1 e HA2 não são clivadas in vitro, ou seja, não são clivadas por maturação no complexo de Golgi, mas podem ser clivadas pela adição de tripsina exógena (Klenk et al., 1975), enquanto HA com múltiplos resíduos de aminoácidos básicos no mesmo peptídeo de conexão são clivadas pela furina, uma protease residente na rede trans-Golgi (Tabela 2). A existência de motivos reconhecidos e clivados pela furina tem sido relacionada à virulência, aspecto especialmente caracterizado para os influenza de aves (Klenk et al., 1994). A patogenicidade dos AIV está relacionada à ativação dos novos vírions pela furina. O sítio de clivagem está localizado em seqüência de múltiplos aminoácidos básicos e a clivabilidade máxima foi observada com pelo menos 5 resíduos básicos no sítio que contenha carboidratos associados. A substituição da arginina carboxi-terminal por lisina em HA1 inibe a clivagem (Walker & Kawaoka, 1993). As proteases de diversas células em cultivo in vitro foram comparadas com a furina purificada, confirmando o papel da furina como ativadora da HA para fusão (Walker et al., 1994).
Além da ativação da HA pela furina (endoprotease relacionada a subtilisina; do complexo trans-Golgi) há outras enzimas descritas com papel maturador da HA. A protease PC6, também relacionada a subtilisina e muito disseminada, pode também ativar AIV virulentos in vitro, indicando que outras enzimas de clivagem da HA podem estar presentes nos animais (Horimoto et al., 1994).
Neuraminidase
A neuraminidase (NA) é uma das glicoproteínas do envelope que qualifica, juntamente com a HA, o subtipo das estirpes dos vírus influenza. A estrutura física da NA é de uma haste com uma porção globular (cabeça) na extremidade, tomando a forma de um cogumelo. A NA é um tetrâmero homogêneo de peso molecular aproximado de 220.000 (proteína integrante da membrana da classe II) e pode ser removida do envelope viral com protease, condição em que aglutinam formando rosetas entre a haste e a cabeça. A NA removida enzimaticamente do vírion retém a atividade enzimática e as propriedades antigênicas. É um tetrâmero em forma de cubo, cada monômero composto de 6 folhas b antiparalelas de 4 fitas cada (Bossart-Whitaker et al., 1993). A NA é produto do gene 6 do RNA e, para o subtipo A/PR/8/34, por exemplo, o segmento 6 do RNA tem 1413 nucleotídeos e codifica um polipeptídeo de 453 aminoácidos. A atividade biológica da NA está envolvida com a catálise de remoção dos açúcares de ácido siálico da HA. A NA (acetil neuramil hidrolase) está, também como a HA, sujeita à variação antigênica e atua na hidrólise da ligação a-cetosídica entre o ácido siálico terminal e uma D-galactose ou D-galactosamina adjacente. Anticorpos específicos contra a NA não são neutralizantes, embora reduzam o tamanho das placas de efeito citopático (Lamb & Krug, 1996).
A atividade enzimática da NA sobre os sítios de ácido siálico dos receptores celulares é mediada por dois sítios na superfície superior (distal) e outro na superfície inferior (proximal) da cabeça globular. Na extremidade globular, 11 sítios conservados apresentam ligação ao ácido siálico. Embora as atividades biológicas e enzimáticas estejam confinadas à cabeça, mesmo quando removida do vírion, o papel da NA no ciclo biológico de influenza vírus está ainda obscuro. A remoção do ácido siálico da HA, NA e superfície celular permite o transporte do vírus pela camada de mucina, o que permite ao vírus encontrar o seu receptor na membrana celular das células da mucosa. Algumas NA (N1 e N9) têm atividade hemaglutinante além de enzimática, um receptor que não se conhece o papel (Lamb & Krug, 1996). Todos os subtipos de NA de origem aviária exibem atividade de hemadsorção, embora a ausência dessa não impeça a replicação desses em hospedeiros aviários (patos de Pequim) (Kobasa et al., 1997). Conforme descrito para os subtipos N1 e N9, a região hidrofóbica da NA (resíduos 7 a 35 N-terminais) na base da haste tem o papel de direcionar a molécula para a membrana do RER e sua ancoragem estável no envelope e, tem sua seqüência embebida na membrana citoplasmática (cauda trans-membrana) e conservada (N-Met-Asn-Pro-Asn-Gli-Lis). A haste tem grandes variações em seqüência e número de aminoácidos (62 a 82), enquanto a cabeça pode apresentar homologia entre 42 e 57% entre subtipos de influenza A, com os resíduos de cisteína conservados e conformação tridimensional semelhante. O sítio de combinação com o substrato forma uma grande bolsa em cada um dos quatro monômeros, cada um com a configuração de hélice de avião determinada por seis dobras de quatro fitas protéicas cada. Mutações dos resíduos conservados da região podem resultar em perda da atividade enzimática. Há cinco sítios potenciais para incorporação de carboidratos por ligações nitrogenadas (Lamb & Krug, 1996; Bossart-Whitaker et al., 1993).
Mutação antigênica em HA e NA: Drift e shift antigênico
A mutação antigênica dos AIV está caracterizada por alterações leves ou sutis (drift) ou grandes alterações (shift) na seqüência de aminoácidos da HA e NA. A acumulação de mutações de ponto na HA ou NA resulta em alterações detectáveis como antigenic drift (mudança leve), cuja taxa de acumulação varia com a taxa evolutiva dos AIV, sendo menor entre os AIV que os demais influenza A vírus. As taxas de mutação mais altas são encontradas entre os influenza A humanos, enquanto influenza A de eqüinos e suínos são intermediários. Substituições de aminoácidos não foram detectadas em um período de 50 anos entre alguns AIV. Os AIV representam, assim, influenza vírus conservados antigenicamente, com acumulações de mutações ao acaso, indicando a não participação da seleção imune nas mudanças antigênicas leves, em contraste com o que ocorre em humanos. Antigenic drift foi detectado em influenza vírus de eqüínos e suínos, mas os resultados podem confundir comparações com diferentes linhagens filogenéticas (Murphy & Webster, 1996). Os caminhos da evolução de estirpes de H1N1 humanos entre 1997 e 1986 foram determinados pelo mapeamento de oligonucleotídeos e estudos de seqüenciamento, que evidenciaram que os influenza A podem evoluir por dois ou mais caminhos evolutivos simultaneamente nos casos estudados, confirmando a mutação média de 4 a 6 oligonucleotídeos por ano (Cox et al., 1989). As mutações que resultam em mudanças na especificidade do sítio da HA de ligação ao receptor celular ocorrem logo após a transmissão de AIV de aves para suínos ou humanos, sendo altamente associadas à capacidade do novo vírus em desencadear epidemias. Os vírus de aves e focas ligaram-se de forma fraca ao polímero sintético sialilglicopolímero (6'SLN-PAA), uma indicação de pouca afinidade ao receptor celular, enquanto as primeiras estirpes humanas e de suínos detectadas pós-transmissão ligaram-se ao 6'SLN-PAA com grande afinidade (Matrosovich et al., 2000).
Nucleoproteina
A nucleoproteína (NP) é o principal componente estrutural em contato direto com o RNA (Figura 5), revestindo e dando forma à estrutura da ribonucleoproteina (RNP). As diferenças na composição antigênica da NP permitem a classificação em influenza vírus tipos A, B e C. Todos os AIV estão classificados no tipo A. O segmento 5 de 1565 nucleotídeos do RNA codifica a síntese de um polipeptídeo de 498 aminoácidos rico em resíduos de arginina. Embora reaja com o fosfato (ácido) do RNA, nenhuma seqüência básica foi reconhecida para a interação, o que sugere múltiplos sítios de interação RNA-NP. As NP recém-sintetizadas no citoplasma são transportadas ao núcleo por informações dos resíduos de aminoácidos 327 a 345. O RNA do vírion (fita negativa) e o molde (fita positiva) mantém associações com a NP, enquanto os RNAm não (Lamb & Krug, 1996). A fosforilação da NP ocorre, mas não está claro o seu papel ou função. Uma proporção das NP recém- sintetizadas é fosforilada imediatamente após a tradução, estando a fosfolização associada à migração ao núcleo e a quinase envolvida na fosforilação parece ser influenciada pela temperatura de incubação (in vitro) das células infectadas (Almond & Felsenreich, 1982).
Proteínas da Membrana M1 e M2
A proteína matriz do envelope viral M1 (Figura 5) é o mais abundante polipeptídeo da partícula de AIV, com 3.000 unidades por vírion, localiza-se na face interna da dupla camada lipídica e representa um antígeno tipo ou gênero-específico (influenza vírus A, B ou C) altamente conservado dentro de cada tipo. Ao revestir a face interna do envelope, confere a esse rigidez e interage com as caudas citoplasmáticas de HA, NA, M2 do envelope e no cerne com a RNP, todas essas interações, entretanto, sem confirmação experimental. Ao interagir com a RNP, M1 inibe a transcrição e direcionamento ao núcleo celular, enquanto após sua síntese é enviada ao núcleo para permitir a saída da RNP do núcleo (Lamb & Krug, 1996). A M1 contém um motivo (motif) de zinco que promove interação proteína-proteína (Elster et al., 1994). Purificações da RNP contêm M1, demonstrável com anticorpos monoclonais anti-M1. A interação entre M1 e a proteína não estrutural NS2 foi demonstrada em vírions purificados (Yasuda et al., 1993.). Ambas proteínas M1 e M2 são produto da tradução do segmento 7 do RNA, que contém 1027 nucleotídeos os quais codificam para M1 um polipeptídeo de 252 aminoácidos (PM 27.801) e, para M2, 97 aminoácidos (PM 11.010) (Lamb & Krug, 1996).
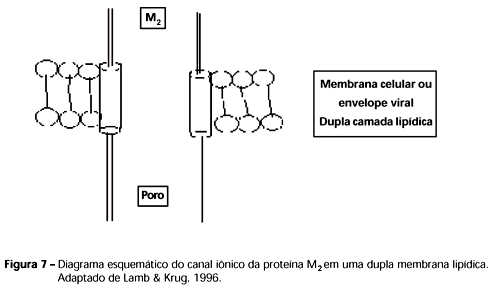
A proteína M2 (Figura 7) está presente em pequeno número no vírion (20 a 60 unidades), embora seja muito expressada na membrana plasmática da célula infectada. Localiza-se atravessando a dupla camada lipídica, formando o canal iônico do vírion. (Lamb & Krug, 1996). A proteína M2 é um tetrâmero homogêneo que consiste de um par de dímeros ou tetrâmeros ligados por pontes dissulfídricas. Um anticorpo monoclonal (14C2) anti-M2 restringe o tamanho das placas de efeito citopático por interferir nas interações entre M1 e M2 durante montagem e brotamento. A partir dos estudos do efeito de amantidina, utilizada na profilaxia e tratamento de infecções por influenza A, propôs-se a função da proteína M2 como canal iônico que permite íons Na+ e principalmente H+ entrarem no vírion durante a desnudação e modulação do pH de compartimentos intracelulares, uma vez que está expressa de forma abundante na membrana celular.
Produto do gene PB2
Um AIV recombinante com o gene PB2 derivado do AIV A/Mallard/NY/78 e os demais derivados do influenza humano A/Los Angeles/2/87 apresenta expressão do fenótipo de restrição na amplitude hospedeira, que resulta em eficiente replicação em tecidos de aves, mas incapacidade para produzir placas em monocamadas de células de mamíferos (MDCK), fenótipo que está associado à capacidade de replicação no trato respiratório de humanos e esquilos. Entretanto, a substituição de apenas um aminoácido na posição 627 do produto do gene PB2 (de Glu para Lis) resulta em restauração da infecciosidade aos hospedeiros mamíferos (Subbarao et al., 1993).
A proteína é um tetrâmero homogêneo, em que cada cadeia tem 97 aminoácidos, com 24 resíduos expostos para fora da célula, 19 resíduos na região trans-membrana (poro propriamente dito) e 54 resíduos como caudas intracitoplasmáticas. A função do canal é ativada por pH baixo e bloqueada por amantadina, uma droga antiviral. A atividade do canal iônico é essencial para o desnudamento dos influenza vírus nos compartimentos endossomais da célula infectada (Lamb et al., 1985 apud Lamb & Krug, 1996).
Replicação
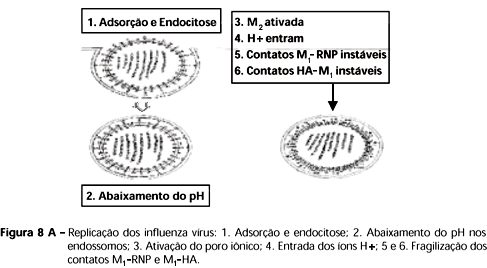
Ilustrações sobre a replicação podem ser observadas nas figuras 8 a e b .
Adsorção, Fusão e Desnudamento
A adsorção, fusão e desnudamento podem ser observadas na Figura 8. Os vírions dos influenza vírus têm afinidade química e colam aos receptores celulares que contêm ácido siálico, atividade mediada no vírion pela extremidade mais externa da HA. O sítio de combinação entre a HA e o receptor celular é uma estrutura tridimensional em forma de bolsa, com diferenças de especificidade variável com a seqüência de aminoácidos do segmento protéico, cuja interação com o ácido siálico é mediada pela galactose a2,6 em humanos ou a2,3 em aves (Lamb & Krug, 1996). As glicoproteΝnas e glicolipídios dos receptores celulares reconhecidos pela HA de todos os subtipos de AIV contêm cadeias de açúcares (ácido siálico- a2-3(6)Gal b1-3 Glc NAc b 1-) (Suzuki, 2000). Embora a interação química seja fraca e de baixa avidez individualmente, uma alta avidez total é obtida por múltiplas interações de baixa afinidade (Lamb & Krug, 1996). A endocitose mediada pelo receptor é a denominação atual para penetração na célula por englobamento (viropexis). A alta capacidade de internalização é mediada por vesículas recobertas por clatrina, a principal proteína das vesículas recobertas e mediadora de endocitose, associadas à membrana celular. A endocitose envolve receptores de manose, os quais são considerados os principais receptores de endocitose para os influenza vírus, para a internalização em macrófagos de camundongos (Reading et al., 2000). Uma invaginação forma-se em sítios tipo bolsa, recobertos pela clatrina na membrana. Após a internalização, o revestimento de catrina é removido e a vesícula funde com endossomos que formam a série de organelas celulares de pH ácido crescente, cujo ambiente gerado por H+-ATPases, promove o desnudamento das partículas virais. Compostos que alcalinizam o pH dos endossomos (cloreto de amônia; cloroquina) impedem o desnudamento viral dos influenza vírus e outros vírus que utilizam a rota de endocitose, embora não tenham atividade antiviral. O papel da proteína M2 como canal iônico é essencial para o desnudamento dos influenza vírus. A droga amantadina tem atividade antiviral nesse processo inicial da infecção, impedindo a liberação da ribonucleoproteína RNP presa à proteína M1 e caudas citoplasmáticas da HA, a RNP não é assim transportada ao núcleo e bloqueia-se a replicação viral. O pH baixo do endossomo ativa o canal iônico de M2 e o fluxo de íons para o interior do vírion rompe as interações proteína-proteína entre RNP e M1. O pH neutro da membrana celular permite, ao contrário, a associação RNP-M1 e montagem do vírion na saída da célula. O canal iônico mediado pela proteína M2 permite o pH ácido correto no interior da partícula viral para permitir a fusão do envelope do vírion com a membrana da célula (Murphy & Webster, 1996; Lamb & Krug, 1996).
Transcrição e Replicação do RNA
A introdução do RNA no núcleo celular dá-se através dos poros da membrana nuclear ainda como complexo RNP. O RNA (13.588 nucleotídeos para a estirpe A/PR/8/34) liberado para o núcleo celular é composto de 8 segmentos lineares e de fita simples e contém 10 genes. Cada segmento contém uma seqüência conservada de 12 ou 13 nucleotídeos nas extremidades 3' e 5', respectivamente. O RNA viral (RNAv) é transcrito em RNA mensageiro (RNAm) por estimulação pelo dinucleotídeo ApG, que é complementar à extremidade 3' de cada segmento de RNAv (3'-UpCpG-..........5') e é incorporado ao novo RNA transcrito na extremidade 5'. A iniciação da síntese do RNAm ocorre por fragmentos 5' capeados derivados de recém-formadas transcrições de RNA polimerase II da célula. A cópia é efetuada até que resíduos de uridina são encontrados, 15-20 bases antes da extremidade 5' do RNAv, quando se encerra a transcrição e é adicionada a terminação poli-A (poliadenilada) ao RNAm. A replicação do RNAv ocorre primeiramente com a síntese dos RNA moldes (cópias de tamanho total do RNAv) e cópia desse molde para RNAv. Para ocorrer a replicação, são necessárias cópias de extensão completa do RNAv. Os RNA transcritos ou moldes são copiados sem iniciadores e não são terminados em poli-A durante a síntese do RNAm. A replicação ou cópias a partir desse molde, sem iniciadores, dá origem a RNAv, que contém terminações 5' trifosforiladas. Os três tipos de RNA que existem durante a replicação (RNAv, RNAmolde e RNAm) são todos sintetizados no núcleo da célula. O processamento celular do RNAm viral utiliza os mesmos mecanismos dos precursores celulares, permitindo a metilação do RNAm em resíduos de adenosina e dois segmentos de RNAm atuarem como precursores, que são processados resultando em fragmentos de RNAm menores. Iniciadores da célula, fragmentos de RNA derivados de transcrições de RNA polimerase II especificamente capeadas iniciam a síntese de RNAm no núcleo. Esse mecanismo exige o suprimento continuado de RNA polimerase II celular plenamente funcional e justifica a inibição da síntese de RNAm por actinomicina D e Α-amantadina. A transcrição do RNAm é comandada pelo penúltimo resíduo de citosina do RNAv e é alongada até atingir os 5 a 7 resíduos de uridina 15-22 nucleotídeos do final 5' do RNAv, quando a cauda poli-A é adicionada à extremidade 3' do RNAm. Wsta cauda é relacionada com a "alça-de-panela" que determinaria o encerramento da transcrição. Esse encerramento também poderia ser causado pela própria RNA polimerase atuando como barreira física (Lamb & Krug, 1996). Replicases (complexo enzimático) podem ser catalizadoras diferentes das transcriptases, envolvidas nas cópias de RNAv e síntese dos moldes. As transcriptases estariam envolvidas na síntese de RNAm.
Papel da Proteína Não Estrutural NS1
A NS1 está envolvida na regulação da exportação de RNAm (viral) clivado do núcleo (e RNAm celulares), inibindo essa exportação e também a clivagem do pre-RNAm.
Tradução
Durante a infecção pelos influenza vírus ocorre uma dramática mudança de síntese protéica, de proteínas celulares para proteínas virais, comandada por processos nucleares e citoplasmáticos. Embora haja no núcleo a degradação das transcrições de RNAm celular, esse mecanismo não explica suficientemente a interrupção da tradução de RNAm celular, pois há muitos RNAm celulares funcionais no citoplasma. A interrupção da tradução dos RNAm celulares ocorre em 3 horas após a infecção de diversos tipos celulares. Não ocorre por degradação ou modificação do RNAm celular, mas se deve à interrupção da iniciação e alongamento das traduções. A iniciação da tradução é seletiva e privilegia RNAm viral por serem muito eficientes os iniciadores desses (Lamb & Krug, 1996).
Brotamento
Observações de células infectadas ao microscópio eletrônico permitem a visualização dos influenza vírus na membrana plasmática, as quais evidenciam proteínas estruturais presentes na membrana celular, independentemente de outros componentes estruturais, estrutura híbrida de membrana celular e proteína viral precursora do envelope viral e relacionada ao brotamento dos novos vírions para fora da célula. As proteínas da célula hospedeira não são incluídas na estrutura do envelope viral e, a exemplo de algumas proteínas virais não transportadas para a membrana, parecem ser excluídas ou seletivamente impedidas (por exemplo, a proteína viral M2 está expressa na membrana celular em concentração 4 vezes menor que a HA). As associações protéicas envolvidas no brotamento viral (Figura 8) incluem contatos entre M1, ligada à dupla camada lipídica e a nucleoproteína (NP). É atraente a noção de que as caudas citoplasmáticas das HA teriam o papel de permitir essas interações entre o envelope viral e seus componentes internos, embora tenha sido demonstrado que vírions sem as caudas citoplasmáticas executam brotamento normal. Os sítios citoplasmáticos da HA (caudas citoplasmáticas), pelo menos em parte, pareceram necessários para o processo de seleção das proteínas a serem montadas no vírion (Naim & Roth, 1993). A liberação dos vírions após o envelopamento pelas associações de NP-M1 parece necessitar da ação da neuraminidase (NA), uma vez que vírions com NA defectiva formam agregados e se reduz a liberação (e título) desses em cultura (Lamb & Krug, 1996).
Classificação de Isolados
Os líquidos alantóides (LA) de ovos SPF inoculados com material suspeito via cavidade alantóidea aos 10-11 dias de embriogênese são testados para atividade hemaglutinante (HA) frente a hemácias de galinhas SPF. LA reagentes para HA devem ser titulados (microteste em diluição dupla seriada), padronizados para 4 e 8 unidades hemaglutinantes e avaliados em provas de inibição da hemaglutinação (HI) com soro monovalente contra o vírus da doença de Newcastle (NDV). LA com HA não neutralizada no HI para NDV deve ser testado para a presença de antígenos da nucleoproteína (NP) ou proteína da matriz do tipo A, para confirmação de AIV. Os testes mais comuns para identificação da NP ou proteína da matriz de AIV são imunodifusão dupla ou teste de hemólise simples radial em gel, na qual reagem o AIV sendo identificado e um soro monoespecífico contra AIV. ELISA foram desenvolvidos empregando anticorpo monoclonal específico para a NP ou proteína da matriz e representam ensaios rápidos, sensíveis e específicos (Walls et al., 1986.). A subtipificação da HA e NA é a seguir obtida em testes com um painel de 15 soros contra as 15 HA e 9 NA diferentes, não podendo haver reação cruzada entre elas, sendo fundamental a identificação prévia do AIV pela detecção de NP ou proteína da matriz, por haver possibilidade de reação negativa por surgimento de nova HA. Testes de inibição da neuraminidase, especialmente os microtestes, detectam subtipos de NA, com soros específicos contra cada uma das nove neuraminidases (Easterday et al., 1997).
Aves domésticas comercializadas nos mercados de aves vivas em Hong Kong foram monitoradas desde 1997, após o surto de HPAIV H5N1 em humanos, sendo que foram detectados gansos sorologicamente reagentes ao AIV H5N1 em 1999 e os vírus isolados, denominados coletivamente A/Environment/Hong Kong/437/99, por swabbing das gaiolas. A/Env/HK/437/99 foram caracterizados como uma mistura de quatro isolados, muito relacionados aos isolados A/Goose/Guangdong/1/96 (Cauthern et al., 2000). As seqüências de estirpes de AIV do surto de Hong Kong em 1997 foram examinadas evidenciando que derivaram de influenza vírus de aves e não de humanos (Subbarao & Shaw, 2000). Estudos filogenéticos de isolados de AIV contendo H7, obtidos de aves dos mercados de aves vivas do nordeste dos EUA indicaram para múltiplas recombinações de genes, em que o gene da HA pareceu ter sido o único gene novo introduzido (Suarez et al., 1999.). As hemaglutininas de isolados de oito surtos de AIV H5N2 de alta patogenicidade no norte da Itália foram estudadas, sendo os isolados considerados semelhantes ao A/HK/156/97 (H5N1 de Hong Kong - 1997), agrupando filogeneticamente com esse, mas distingüíveis deste. A HA de uma amostra não patogênica H5N9 isolada durante o período dos surtos foi considerada semelhante à amostra altamente patogênica A/turkey/England/91 (H5N1) (Donatelli et al., 2001).
EPIDEMIOLOGIA
Ocorrência
Somente o tipo A de AIV causa infecção natural em aves, embora todos os 15 subtipos de HA e nove de NA tenham sido isolados de aves, nas quais dois grupos distintos podem ser divididos, considerando a virulência. Os isolados muito virulentos causam a influenza de alta patogenicidade (HPAIV), com mortalidade que atinge 100% das aves. Os HPAIV apresentam geralmente HA dos subtipos H5 e H7, embora nem todos isolados desses subtipos sejam de alta patogenicidade. Todos os outros subtipos são menos patogênicos para aves, resultando em doença respiratória leve, embora possa ser agravada por infecções concomitantes, imunodepressão e/ou condições de ambiência desfavoráveis às aves. Surtos primários de HPAIV têm sido descritos desde 1959, cinco em perus e 12 em galinhas. Subtipos causadores de HPAIV são raramente isolados de aves silvestres. Por exemplo, HPAIV representam 15% dos isolados de patos e gansos e 2% de outras espécies. Em silvestres, entretanto, é mais comum o isolamento de amostras de baixa virulência para aves domésticas. O contato das aves domésticas com aves silvestres é determinante para a ocorrência de surtos nas primeiras. O papel da transmissão mecânica é também importante, principalmente por trabalhadores e técnicos ao transferir fezes infectadas para lotes susceptíveis (Alexander, 2000).
As informações sanitárias do Office International des Epizooties (http://www.oie.int/esp/info/hebdo/EIS_01.HTM) registram os focos de influenza aviária por HPAIV em janeiro e fevereiro de 2000 na Itália, em galinhas, perus, codornas e galinhas da Angola e várias outras espécies nas regiões de Fruili, Venezia, Giulia, Lombardia, Sicilia, Trento, Veneto e Piemonte, com maior número de focos na província de Brescia (65 em janeiro e 33 em fevereiro) e Mantova (28 em janeiro e 3 em fevereiro) na região da Lombardia, Verona (65 em janeiro e 21 em fevereiro) e Vicenza (19 em janeiro e 1 em fevereiro) em Veneto, envolvendo um total de 5.932.622 aves em janeiro e 1.777.777 em fevereiro. Na Itália, HPAIV parecem ser enzoóticos desde o século 19 e relatos de isolamentos de AIV de baixa patogenicidade de vários subtipos têm sido publicados (Franciosi et al., 1981; Petek, 1982; Papparella et al., 1994; 1995), isolados de aves domésticas, especialemente perus e aves aquáticas selvagens (Capua & Marangon, 2000). De acordo com o relatório da O.I.E. de 1997 (O.I.E. Bulletin, 1997), formas de alta patogenicidade de AIV ocorreram em Hong Kong (um em abril e dois em maio), na Itália (3 surtos em novembro e 4 em dezembro) e Austrália (um surto).
AIV foram isolados da água (onde podem ser preservados durante o congelamento de inverno, aguardando o retorno das aves) e de fezes da margem de lagos que abrigam comunidades de patos selvagens migratórios no Canadá. O estudo canadense concluiu que 20% dos patos selvagens jovens estão infectados com muitos subtipos (enzoóticos) quando se agrupam para a migração, embora não apresentando sinais clínicos. Os patos podem excretar AIV por 30 dias, mas infecção persistente não foi demonstrada. A contínua circulação dos AIV nas populações de aves aquáticas migratórias ocorre, entretanto em baixa incidência nos períodos migratórios subtropicais (Murphy & Webster, 1996), possivelmente explicando a baixa ou não ocorrência no Brasil. A baixa virulência dos AIV em patos garante a preservação do vírus na natureza, por adaptação da infecção durante muitos séculos, perpetuando os AIV nesses reservatórios naturais, dos quais disseminam-se mutantes e/ou recombinantes capazes de infectar as diversas espécies animais, incluindo focas, baleias, suínos, cavalos e aves domésticas, especialmente perus (Murphy & Webster, 1996), além de humanos (Figura 9).
A hipótese atual considera as aves aquáticas, especialmente da ordem Anseriformes, incluindo patos, marrecos e gansos como reservatórios principais de influenza A na natureza. Dessas espécies haveria a transmissão para todas as demais espécies de aves, por exemplo aquáticas da ordem das procelárias (Procellariidae, Puffinus sp.; Diomedeidae; Hydrobatidae; Pelecanoididae) e gaivotas (Laridae, Larus sp.), passeriformes e mamíferos. A transmissão de AIV foi demonstrada entre suínos e humanos (linhas sólidas). Há inúmeras evidências da transmissão entre patos e outras espécies com base nas informações de análises filogenéticas do gene da nucleoproteína de grande número de estirpes de influenza vírus dos cinco diferentes grupos de hospedeiros. O intercâmbio de AIV entre suínos e humanos tem sido demonstrado (seta em negrito).
Alta homologia entre os genes internos foi detectada nos isolados H9N1, H6N1 e H5N1 indicando que esses subtipos são capazes de fazer intercâmbio de genes e, portanto, figurar como fonte potencial de isolados patogênicos para humanos, sendo necessária a vigilância epidemiológica para esses em aves aquáticas e domésticas, suínos e humanos (Hoffmann et al., 2000).
As etiologias das pandemias humanas de 1957 e 1968 foram caracterizadas como estirpes híbridas que continham genoma recombinante de AIV de aves e humanos (Horimoto & Kawaoka, 2001). O pool genético de AIV em aves aquáticas migratórias e de praia sugere que uma transmissão de baixo nível ocorre entre essas aves por todo o ano, caracterizando dois grupos reservatórios com intersecção geográfica em todo o globo. Todos os subtipos de HA e NA ocorrem nessas aves. Embora tenham sido detectadas evidentes tendências dos isolados serem geograficamente restritos e hospedeiros específicos, caracterizados pela proteína NP, por exemplo de eqüinos, suínos, gaivotas e outras espécies de aves e isolados de humanos, outros genes apresentam extensiva tendência à recombinação genética. Todas as linhagens de AIV de mamíferos foram originadas do pool genético das aves (possível inclusive para influenza B). As análises dos segmentos do RNA que codificam as proteínas das espículas (HA, NA e M2) e proteínas internas (RNA transcriptases A, B1 e B2; NP, M e S) de uma grande variedade de hospedeiros e de regiões geográficas distintas permitiram essas conclusões. O compartilhamento genético de AIV entre essas espécies ocasiona surtos e pandemia, indicando a possibilidade de suínos servir como hospedeiros intermediários para intercâmbio genético entre AIV de aves reservatório e humanos (Webster et al., 1992).
O último surto de AIV de alta patogenicidade (HPAIV) em galinhas nos Estados Unidos foi causado por representantes do subtipo H5N2 na Pennsylvania e New Jersey, em 1983-1984, que foi controlado pelo esforço federal de erradicação (Avian Influenza Task Force, 1984.). Entretanto, vários AIV H5N2 foram isolados entre 1986 e 1989 em aves de mercados de aves vivas nos Estados Unidos. Para avaliar as relações epidemiológicas entre as estirpes, as seqüências dos genes que codificam a subunidade HA1 da HA e do gene que codifica a proteína não estrutural (NS) foram determinadas para 11 estirpes e comparadas com as seqüências de estirpes conhecidas. As estirpes de 1986-1989 foram todas relacionadas às estirpes de 1983-1984 da Pennsylvania, pela seqüência de bases e de aminoácidos de ambos os genes e proteínas, provando que a linhagem Pennsylvania/83 (Penn/83) não foi completamente erradicada. Outra informação interessante sobre a linhagem Penn/83 é que ela apresentou substituições de aminoácidos exclusivas, não detectadas em outras linhagens de AIV, indicando que Penn/83 pode estar circulando de forma inaparente nas aves antes dos surtos clínicos, representando outro exemplo de manutenção e evolução de longo termo de AIV (Suarez & Senne, 2000).
Oito surtos de influenza aviária subtipo H5N2 de alta patogenicidade, com índices de patogenicidade de 2,98 a 3,00, caracterizados por inoculação intravenosa em galinhas de 6 semanas de idade, foram diagnosticados nas regiões de Veneto e Fruili-Venezia Giulia, no nordeste da Itália, entre outubro de 1997 e janeiro de 1998. Em todos os surtos, os riscos caracterizados incluíram movimentação de aves, criações de múltiplas espécies e contato com aves aquáticas migratórias. As medidas de controle previstas pela Comunidade Européia, na lei 92/40/EEC, foram aplicadas e impediram a disseminação para a avicultura industrial (Capua et al., 1999).
Surtos de AIV foram diagnosticados em galinhas poedeiras, frangos e reprodutoras da região metropolitana de Islamabad, Murree e Abbatt Abad (Paquistão), entre 1994 e 1995, resultando em mortalidade de mais de 85% das aves. Vírus hemaglutinante de eritrócitos (galinha, ovelha, coelho, cobaio, bovino, papagaio, pombo, codorna e pardal) foi isolado em embriões SPF, ocasionando a morte embrionária 36 horas p.i., não sendo inibido por anticorpos contra o vírus da doença de Newcastle ou bronquite infecciosa. A estirpe foi caracterizada como integrante do subtipo H7 de AIV (Muhammad et al., 1997). Um surto de doença caracterizada por queda súbita na produção de ovos, de 70% para 5%, edema das faces, fraqueza e morte de 2 a 3% ao dia, ocorrido em 1998, também no Paquistão, foi descrito em reprodutores de diferentes idades, principalmente em lotes de 45 semanas, do qual se isolou A/chicken/Pakistan/3/99 (H9N2) (Naeem et al., 1999).
Em humanos, há evidências sorológicas que houve pandemias em 1889-1890 causadas por vírus semelhante ao subtipo "asiático" (H2N2), em 1900 (H3N8), 1918 (H1N1 - Espanhola), 1957 (H2N2 Asiática), 1968 (H3N2 Hong Kong), 1977 (H1N1 Russa). A pandemia de 1918 matou entre 20-40 milhões de pessoas e mudou o curso da história, por debilitação do exército alemão. A mortalidade por influenza entre as tropas dos EUA atingiu 80% do efetivo na 1ª Guerra Mundial (Murphy & Webster, 1996). Crianças humanas são a principal fonte de transmissão de vírus influenza A na comunidade, visto que as escolas e salas de aulas fornecem as condições de proximidade e aglomeração que favorecem a disseminação, especialmente por aerossol. Os influenza A resistem nos aerossóis por um inverno inteiro no ambiente de baixa umidade dentro de casa nos climas temperados (dezembro-janeiro a abril-maio nos EUA), contribuindo para a ocorrência estacional de influenza no inverno. A detecção de mutantes de hemaglutinina ao final da primavera tem sido considerada indicação de risco de surto para o próximo inverno (Moriuchi et al., 1991 citados por Murphy & Webster, 1996). Em humanos, embora a morbidade mais alta esteja em pessoas com 20 anos ou menos, a taxa de mortalidade mais alta ocorre entre pessoas com 65 anos ou mais. A mortalidade média de humanos por influenza em adultos de 65 anos de idade ou mais velhos a cada ano é de 1:2200. A pandemia de 1918 ocasionou alta mortalidade em jovens adultos e naqueles acima de 65 anos, característica que não se repetiu em pandemias subseqüêntes. Nos anos de epidemia de 1957 e 1958, 70.000 pessoas morreram e 1 em cada 300 adultos com 65 anos de idade ou mais morreu. Embora a mortalidade humana seja mais alta no primeiro ano de surto com novo subtipo, a mortalidade acumulada nos anos seguintes interpandemia é significativamente mais alta que a do primeiro ano (Murphy & Webster, 1996).
Nenhum título de anticorpos circulantes específicos contra AIV foi detectado em 100 pombos (Columba livia) urbanos da cidade de Santiago do Chile avaliados durante 12 meses (março 1996-março 1997). Títulos muito baixos (1 a 3 log2) para PMV-1 (doença de Newcastle) e nenhum título para PMV-7 foram detectados (Toro et al., 1999).
Na China, vinte espécies (não citadas) de aves raras em 4 fazendas foram avaliadas sorologicamente para diversos agentes de doença para as aves industriais. Anticorpos para Mycoplasma gallisepticum (Mg), Salmonella pullorum (SP), clamidiose aviária (CA), doença de Newcastle (ND), laringotraqueite infecciosa (LI), doença de Marek (DM), bronquite infecciosa (BI), síndrome da queda da postura (EDS), bouba aviária (FP), leucose aviária, artrite viral e cólera aviária foram detectados em 13 espécies, com Mg ocorrendo como o mais alto índice (25%), seguido de SP (21.5%), CA (16.67%) e ND (15.31%). Anticorpos para doença infecciosa bursal (Gumboro), coriza infecciosa, adenovírus aviários do grupo I e influenza aviária não foram encontrados e testes intradérmicos de tuberculina foram negativos (Zhang et al., 1996). Outro estudo foi desenvolvido em outras 13 granjas de aves industriais e um de aves exóticas, nas quais todas as aves industriais foram negativas para AIV, e 39/50 das amostras de soros das aves exóticas foram positivas para AIV pelo teste de AGP. As aves exóticas tinham histórico de doença clinicamente semelhante à cólera aviária, não resolvida com vacinação contra a cólera aviária e doença de Newcastle ou soroterapia contra a doença infecciosa bursal. A doença causou a mortalidade de 10.000 faisões e o controle de novos episódios foi obtido com a destruição dos faisões sobreviventes e de outras espécies de aves, além da aplicação de limpeza e desinfecção rigorosas (Zhu et al., 1996).
Um estudo epidemiológico desenvolvido na Itália investigou a presença de AIV em faisões criados para esporte em fazendas de caça. As amostras de swab cloacal de 200 indivíduos não resultaram em isolamento de agente hemaglutinante (Piccirillo et al., 1999). Outro estudo italiano caracterizou estirpes de alta patogenicidade de AIV (HPAIV) do subtipo H5N2 isolados da avicultura do norte da Itália. As estirpes italianas, embora distingüíveis de A/Hong Kong/156/97 (H5N1), foram consideradas antigenicamente semelhantes. A análise filogenética da HA das estirpes italianas agrupou essas com as estirpes de Hong Kong, embora as análises de HA, NS e NP das estirpes de H5N1 em circulação em Hong Kong e H5 italianas indicarem origens de ancestrais diversos. Na Itália, nenhuma evidência de transmissão de aves para humanos foi detectada para H5N2 (Donatelli et al., 2001), em contraste com as estirpes H5N1 de Hong Kong. Entretanto, estudos anteriores de composição e seqüenciamento da HA de A/duck/Ukraine/1/63 (H7) indicaram que as HA1 e HA2 dessa estirpe estão intimamente relacionadas com o subtipo H3 de Hong Kong (Ward et al., 1981).
Influenza aviária no Brasil
Há ainda pouquíssimos estudos na literatura científica nacional e internacional sobre a ocorrência de AIV nas aves selvagens e ornamentais da fauna brasileira. Os trabalhos descrevem avaliações de fauna local, com amostragem de algumas espécies. Um estudo da fauna de aves do Rio de Janeiro descreveu a ocorrência e caracterizou estirpes de AIV natural em espécies ornamentais nesse estado (Couceiro et al., 1982). Um estudo sorológico em espécies de aves silvestres foi desenvolvido no Estado de São Paulo por Anraku et al. (1971), estudando anticorpos por gel precipitação.
Em avaliações sorológicas de plantéis industriais conduzidas em Minas Gerais, em frangos de corte (Resende et al., 1990), não foram detectados anticorpos para AIV. Após os surtos de 1983-1984 nos EUA, os pesquisadores investigaram anticorpos para AIV H5N2 em frangos de corte, com vistas a determinar o status sanitário específico desses. Para os ensaios laboratoriais, foi utilizada a gel precipitação em ágar, não sendo detectadas quaisquer reações específicas para AIV. Soros de 2000 frangos, entre 49 e 60 dias de idade, de 175 lotes em 96 granjas comerciais das regiões do Alto São Francisco e Metalúrgica de Minas Gerais, colhidos entre 1985 e 1986, foram avaliados. Os resultados indicaram que as estratégias de biossegurança implementadas pelo Ministério da Agricultura, proibindo a importação de aves e ovos férteis dos EUA no período crítico, foram eficientes.
Atualmente, o Ministério da Agricultura mantém monitoração permanente das aves importadas nas portas de entrada do país. O Projeto de Vigilância Ativa (Projeto de Vigilância, 2001) do PNSA, coordenado pelo Ministério da Agricultura, em colaboração com instituições públicas (universidades, Secretarias da Agricultura, institutos de pesquisa etc) e privadas (indústria, laboratórios de produção de vacinas e diagnóstico etc) prevê também a amostragem para a avaliação permanente dos plantéis comerciais nacionais, que inclui a simultânea avaliação para vírus, assim como anticorpos, para a doença de Newcastle e influenza aviária.
Em humanos, a ocorrência de influenza tem sido regularmente acompanhada. Um estudo de 12 meses após a implementação do programa de vacinação voluntária indicou que a vacinação não foi suficiente para a redução dos episódios clínicos e faltas ao trabalho em relação aos indivíduos não vacinados (Ramadan et al., 2001). Estudos sobre a ocorrência de esquizofrenia em humanos adultos no Brasil e sua relação com a estação de chuvas indicaram a infeccção por influenza vírus durante a gestação como base para esta relação (Messias et al., 2001). Em outro estudo, soros de humanos foram avaliados em Belém do Pará para anticorpos contra influenza A e B, nos anos de 1992 e 1993, por inibição da hemaglutinação para anticorpos contra A/Taiwan/1/86 (H1N1), A/Beijing/353/89 (H3N2) e B/Yamagata/16/88. Anticorpos para ambas estirpes de influenza A foram detectados em 84% (H3N2) e 56% (H1N1) dos soros e níveis mais baixos para o tipo B. Um aumento na incidência de títulos para H3N2 e tipo B foi detectado em 1993. (Santos et al., 1997). Anticorpos para H3N2 A/Hong Kong/1/68 e A/Bangkok/1/79 e A/Brazil/11/78 (H1N1) foram também investigados em nativos americanos da tribo Kren-Akorore (Parque Indígena do Xingu), tribo contactada pela primeira vez apenas em 1973, para os quais nenhum título de anticorpos foi detectado, indicando a ausência de transmissão por contato prévio e o isolamento dessa população (Nascimento et al., 1985).
Evolução dos AIV
Os estudos da ecologia dos influenza vírus têm confirmado a hipótese que as estirpes de mamíferos evoluem de estirpes de aves. Cinco linhagens filogenéticas foram estabelecidas com base nos estudos da NP: uma eqüina antiga (não detectada há 15 anos), uma linhagem eqüina recente, uma linhagem de gaivotas, uma de suínos e outra de humanos formam os ramos principais de evolução. Os grupos de suínos e humanos são relacionados, ambos possivelmente originários de influenza A aviário (AIV) comum. Linhagens separadas de AIV, baseadas em estudos da NP e outros genes, foram determinadas para estirpes das Américas e Europa/Asia (Webster et al., 1992), distinção que estaria associada à migração de aves aquáticas, principalmente no sentido norte-sul (latitude) nesses continentes, e não leste-oeste (longitude). Aves que migram no sentido da longitude teriam importante papel na continuidade da evolução de influenza. Os modelos atuais de evolução para os vírus influenza A são baseados em estudos de estirpes humanas, nas quais a taxa de evolução é muito alta em HA, em contraste com as proteínas internas (RNA transcriptases A, B1 e B2; NP, M1 e NS). As velocidades de evolução de M1 e M2 têm índices diferentes e estão adequadas ao critério proteína externa e proteína interna, a M2 localizada externamente com taxa muito mais alta que M1 interna e uma grande proporção das mutações no gene de M2 não são silenciosas, enquanto que as mudanças em M1 não afetaram a codificação em um período de 55 anos (Ito et al., 1991). Em contraste aos influenza A de humanos, os AIV de aves aquáticas têm índices de evolução baixos, com indicações de que não há evolução líquida nos últimos 60 anos. As mudanças de nucleotídeos nos AIV são silenciosas e não representam trocas de aminoácidos, significando que os AIV das aves aquáticas funcionam como reservatório natural de genes sem ou com poucas mudanças (Murphy & Webster, 1996), entre eles os vírus que forneceram os segmentos genéticos envolvidos nas pandemias de 1918 (gripe Espanhola), 1957 e 1968 (Ásia). A evolução molecular dos influenza A nas populações de aves e humanas apresenta diferentes padrões. Em aves co-circulam um grande número de segmentos genômicos de hemaglutininas diferentes. A modificação simultânea da HA e NA foi sugerida como necessária para a adaptação de influenza A de aves aquáticas selvagens para galinhas domésticas, embora a modificação da HA para Sia2-3Gal pareça não restringir a transmissão inicial de aves para humanos. Os AIV H5N1 de aves apresentam deleção de 19 aminoácidos na haste da NA e um carboidrato na cabeça globular da HA. A deleção reduz a liberação do AIV das células e a presença do carboidrato reduz a afinidade viral para os receptores celulares. A NA encurtada e HA adicionalmente glicosilada são características dos subtipos H5 e H7 de galinhas (Matrosovich et al, 1999).
A taxa de evolução dos AIV nas espécies hospedeiras naturais (aves aquáticas, aves de praia e gaivotas) é considerada baixa, enquanto que em mamíferos é alta. Outras espécies como galinhas, perus, suínos, eqüinos e humanos são consideradas como hospedeiros aberrantes. A distinção entre espécies hospedeiras normais e aberrantes é importante, pois permite a verificação de taxas de mutação diferenciadas nesses dois grupos. A pressão seletiva para adaptação nas espécies aberrantes, por exemplo espécies da classe dos mamíferos, determina alta mutabilidade de AIV presentes nesses. As seqüências de nucleotídeos dos genes precursores da hemaglutinina (HA) e componentes não estruturais (NS) foram comparadas entre seqüências de consenso e seqüências genéticas de AIV de surtos em galinhas e perus, indicando que as taxas de evolução foram semelhantes àquelas de mamíferos, evidenciando a adaptação de AIV nessas espécies de aves (Suarez, 2000). Informações genéticas entre AIV de humanos, suínos e aves foram demonstradas na HA do subtipo H1, após a detecção de semelhanças empregando anticorpos monoclonais contra A/duck/Alberta/35/76 (Austin & Webster, 1986).
Analisando a evolução molecular dos vírus influenza, Marakova et al. (1998) produziram um dendograma com dois grupos distintos, no primeiro com relação linear entre o ano do isolamento e a distância evolucionária, incluindo os vírus humanos, mas não linear no segundo grupo, composto predominantemente por AIV (de aves), concluindo que a recombinação genética não atuou de forma considerável neste processo, os subtipos modernos de HA possivelmente formados antes da introdução de AIV na espécie humana. As relações filogenéticas entre amostras de AIV do subtipo H5 isoladas na América do Norte foram avaliadas por análise dos genes da HA e NS, indicando a manutenção de múltiplas divisões e sublinhagens em aves aquáticas migratórias, sendo que, das quatro seqüências de HA1 conhecidas, três estão presentes em aves aquáticas migratórias. A análise filogenética do gene NS em populações de patos evidenciou a existência de sublinhagens múltiplas e re-arranjo deste gene em dois alelos. Das sublinhagens, as mais instáveis geneticamente foram aquelas isoladas dos surtos recentes no México central (Garcia et al., 1997), presentes em plantéis de galinhas durante 16 meses. As seqüências de aminoácidos deduzidas de HA na região associada com a adsorção ao receptor celular revelaram que isolados de aves aquáticas, galinhas vivas de mercado popular e perus não possuíam glicosilação no aminoácido 236, embora essa ocorra em isolados de galinhas industriais (Garcia et al., 1997).
O papel dos suínos como fonte de vírus para humanos e aves e vice-versa (Figura 9) tem sido relatado. O isolamento de AIV do subgrupo H4N6 de suínos com pneumonia de uma fazenda comercial, descrito no Canadá, permitiu a demonstração da infecção natural inter-espécie de aves para suínos. A análise filogenética dos 8 segmentos do RNA demonstrou ser essa estirpe representante da linhagem norte americana de AIV (Karasin et al., 2000). Um isolado de AIV H1N1 em suínos foi descrito como capaz de cruzar a barreira específica entre aves e suínos, indicando evolução e mutação independentes do isolado após a transmissão para suínos (Stech et al., 1999). Os genes da hemaglutinina de quatro isolados de AIV de suínos da Carolina do Norte, Texas, Minnesota e Iowa foram todos derivados do isolado humano H3N2 que circulou em 1995 (Zhou et al., 1999). A seqüência de nucleotídeos do gene da HA1 da estirpe A/turkey/Germany/2482/90, isolada de aves mantidas em fazenda de suínos, foi comparada com o gene da HA1 de estirpes isoladas dos surtos recentes de influenza em aves e suínos. As seqüências do gene da HA de uma estirpe H1 de perus proporcionaram evidências adicionais de transmissão originária de suínos (Wood et al., 1997). A co-infecção de suínos com influenza vírus suíno e aviário defectivo gerou recombinantes que apresentavam HA de origem aviária e que puderam ser replicados em suínos. Essas evidências indicam que infecções múltiplas de influenza vírus contribuem para a geração de variantes por recombinação (Kida et al., 1994). De fato, recombinações genéticas múltiplas foram demonstradas entre AIV e influenza humanos em co-infecções em suínos, gerando novo genótipo de H1N2, a partir de co-infecção de H1N1 tipo humano e H3N2 tipo suíno seguido de infecção por H1N1 tipo aviário (Brown et al., 1998). Os seqüenciamentos parciais dos genes codificadores da neuraminidade e de componentes estruturais internos de AIV foram obtidos de um isolado 268/96 de um humano (mulher) com conjuntivite, apresentando homologia de 98,2% à estirpe AIV H7N7 de perus isolada na Irlanda do Norte, em 1995. O relato descreve e caracteriza pela primeira vez a infecção de humanos por AIV diretamente de aves (Banks et al., 1998).
TRANSMISSÃO
A transmissão de AIV da ave infectada para a ave susceptível ocorre principalmente a partir de secreções respiratórias e digestórias, direta ou indiretamente, essa última especialmente por equipamentos contaminados com fezes (insetos, veículos de transporte, bebedouros, água, comedouros, ração, gaiolas, pessoal por roupas, calçados e botas etc). As aves de vida livre podem transmitir diretamente a infecção ao inadvertidamente compartilharem o ambiente de criação.
Quatro categorias de fontes de transmissão para a avicultura industrial foram hierarquizadas (Alexander, 1982), em ordem de importância, sendo: a 1ª outras espécies de aves domésticas (por exemplo, patos para galinhas), a 2ª aves de companhia exóticas (não ainda descrito na literatura apesar do potencial teórico), a 3ª aves selvagens (fonte comum de transmissão para a avicultura industrial, por exemplo a partir de aves aquáticas migratórias) e a 4ª outras espécies animais (por exemplo, de suínos para perus).
A transmissão de AIV H2 da Eurásia para aves de praia da América do Norte foi determinada. A HA da linhagem Eurásica foi detectada em isolados americanos que, considerando a importância da pandemia de 1957 pelo subtipo H2, reforça a necessidade de vigilância epidemiológica continuada (Marakova et al., 1999).
A importância da via fecal-oral de transmissão de aves migratórias para outras espécies foi demonstrada em estudo em que isolados de AIV, assim como do vírus da doença de Newcastle, foram obtidos de patos migratórios abatidos em Mississipi (EUA), sendo a neuraminidase (NA) de um AIV não reconhecida por nenhum dos soros de referência, embora relacionada com a NA de A/duck/GDR/72 (patos - Alemanha), A/turkey/Ontario/7732/66 (perus - Canada), A/duck/Ukraine/1/60 (patos Ucrânia) e A/turkey/Wisconsin/68 (perus EUA). Um dos isolados A/duck/Memphis/546/74 produziu conjuntivite e descarga ocular em 1/5 dos patos inoculados experimentalmente e eliminação nas fezes por 10 dias (Webster et al., 1976). Aves aquáticas, consideradas reservatórios de AIV e vírus da doença de Newcastle (NDV), têm sido amostradas para virologia. Aves aquáticas selvagens de 14 espécies da África do Sul (262 aves) que habitavam as proximidades de criatório intensivo de avestruzes (Struthio camelus), onde ocorreram casos de influenza, foram avaliadas, sendo que oito continham a estirpe H10N9. Todas as estirpes foram apatogênicas para galinhas com índice de patogenicidade intravenoso 0,00 (Pfitzer et al., 2000).
A circulação continuada de vírus de alta virulência entre aves domésticas e humanos foi detectada em Hong Kong, relacionada com os isolados H5N1 de 1997 (A/HK/156//97), compartilhando H5 com idênticos sítios de clivagem, indicando que pelo menos um dos genes das estirpes H5N1 de Hong Kong de 1997 continua a circular pela China continental (Cauthen et al., 2000). Entretanto, a transmissão de AIV de galinhas para uma criança parece ter ocorrido em um episódio sem o papel de espécie intermediária (por exemplo, suínos) como "recipiente de mistura" para recombinação (Claas et al., 1998). Ao contrário, em estudos para a caracterização de isolados de H5N2 da avicultura italiana, não foram encontradas evidências de transmissão de ave para humanos (Donatelli et al., 2001).
A transmissão inter-espécies de AIV, tendo em vista os surtos de H5N1 em Hong Kong, foi abortada parcialmente, impedindo pandemia. A estratégia foi de erradicação por sacrifício de aves nos mercados de aves vivas e outras aves na região dos surtos, e chamou a atenção para aves como fonte de vírus para humanos (Shordridge et al., 2000).
Portadores e Reservatórios Naturais
A co-infecção de AIV de diferentes subgrupos em espécies de aves é considerada importante estratégia de geração de diversidade entre os genótipos de AIV. Surtos em perus têm sido descritos nos EUA, nos estados produtores de perus, mantidos em rotas de migração de aves aquáticas migratórias, especialmente da ordem Anseriformes. Os perus têm sido desafiados nas estações de migração por estirpes patogênicas (Alexander, 2000).
O papel dos patos na introdução de AIV com hemaglutinina (HA) H3 para suínos no sul da China foi considerado no surgimento da estirpe A/Hong Kong/68 (H3N2), em que a HA entre vírus isolado de pato doméstico apresentou semelhança de 98,7 e 99,5%, respectivamente, para HA de suíno e pato selvagem (Yasuda et al., 1991).
A transmissão de HPAIV AIV (H7) de propriedades vizinhas com galinhas e patos para uma granja de matrizes de frangos de corte de 24 semanas de idade foi registrada na Austrália. Aves acometidas no surto apresentaram edema subcutâneo, congestão da cabeça e palidez do músculo do peito. AIV foi detectado nas aves industriais em impressões pancreáticas coradas por imunofluorescência e as aves das propriedades vizinhas apresentaram títulos de anticorpos para H7 (Selleck et al., 1997).
Embora algumas espécies exóticas possam representar risco de transmissão de doenças para a avicultura industrial, uma estirpe de AIV H10N7 isolada de emu (Dromaius novaehollandiae) que apresentava sinais clínicos respiratórios e conjuntivite, foi caracterizada como não patogênica para galinhas (Woolcock et al., 2000).
Diferenças de adaptação de diferentes AIV para diferentes espécies de aves foi descrita. Sharp et al. (1997) propõem que os subtipos de AIV são diferentemente adaptados aos hospedeiros, nos quais a infecção natural não ocorre ao acaso. Os subtipos de AIV mais raros às aves poderiam ser adaptados por co-infecção com AIV mais comuns. De acordo com esses autores, os subgrupos de AIV predominantes nas espécies são relativamente espécie-específicos, enquanto os AIV de outros subgrupos presentes em eventos de co-infecção não o são (Sharp et al., 1997).
Soros de falcões das pradarias (Falco mexicanus) foram negativos para anticorpos contra AIV, assim como negativos para o vírus da doença de Newcastle (Morishita et al., 1998). Aves aquáticas selvagens foram consideradas reservatórios de AIV e vírus da doença de Newcastle (NDV). Amostras para virologia de 14 espécies aquáticas selvagens da África do Sul, que habitavam as proximidades de criatório intensivo de avestruzes (Struthio camelus) onde ocorreram casos de influenza, foram examinadas para AIV. Das 262 aves avaliadas, oito amostras continham a estirpe H10N9 e todas as estirpes foram apatogênicas para galinhas (índice de patogenicidade intravenoso 0,00). Em contraste, os soros de 33 aves continham anticorpos contra AIV H10 e apenas uma ave com anticorpos para H6, esse último sendo isolado de avestruzes durante um surto de influenza na área. As aves aquáticas foram também avaliadas para o NDV, não sendo nenhuma estirpe isolada, embora anticorpos tenham sido detectados em 34 de 46 soros examinados (Pfitzer et al., 2000).
PERÍODO DE INCUBAÇÃO
O período de incubação de AIV para o aparecimento dos sinais clínicos em aves é variável com a espécie de ave, estirpe de vírus, dose de desafio e via de aplicação ou exposição, variando entre poucas horas e 3 dias (Easterday et al., 1997).
SINAIS CLÍNICOS
A infecção por AIV em aves resulta em quadro clínico muito variável, dependendo da espécie, idade e sexo da ave, estirpe e dose de vírus e infecções oportunistas ou concomitantes. Os sinais clínicos são conseqüências de alterações geralmente dos sistemas respiratório, digestório, nervoso e reprodutivo, com decréscimo do consumo de alimento e produtividade (ganho de peso e produção de ovos), emagrecimento, quadro respiratório de leve a grave, com lacrimejamento, edema da face e cabeça, cianose, alterações nervosas e diarréia (Easterday & Hinshaw, 1991; Easterday et al., 1997). A doença pode ser superaguda e resultar em mortes fulminantes sem quadro clínico prévio. As diferenças de susceptibilidade entre as espécies de aves ocasionam ampla variação nas conseqüências clínicas da infecção, em que uma estirpe é patogênica para uma espécie e não para outra. Os perus parecem ser muito sensíveis a estirpes que ocorrem de forma assintomática em patos (Murphy, 1987).
LESÕES
A caracterização da patogenicidade dos AIV foi por algum tempo relacionada com a presença de HA do subtipo H7 e não permitia a elucidação dos episódios de doença em que estirpes não virulentas do mesmo subtipo eram isoladas de aves normais. A terminologia de peste aviária (fowl plague), associada a H7, foi sendo abandonada e em substituição adotaram-se critérios de classificação dos AIV de alta virulência (HPAIV), conforme as seguintes recomendações:
1 - Qualquer vírus de influenza letal a 6, 7 ou 8 de 8 galinhas com 4-6 semanas de idade em um período 10 dias, inoculadas via intravenosa com 0,2 ml de líquido alantóide a 1:10 sem bactérias;
2 - Qualquer vírus da influenza dos subtipos H5 e H7 que não atinja o critério acima, mas apresente seqüência de aminoácidos no sítio de clivagem da HA compatível com as estirpes de alta virulência (múltiplos aminoácidos básicos);
3 - Qualquer vírus da influenza não integrante dos subtipos H5 e H7, que cause a morte de 1 a 5 das galinhas de 4 a 6 semanas de idade via intravenosa (item 1), em 10 dias e seja replicado em monocamadas celulares na ausência de tripsina (Proceedings, 1994).
As lesões resultantes de infecção por AIV (Easterday et al., 1997; Easterday & Hinshaw, 1991) são amplamente variáveis, dependendo da estirpe de AIV, quanto à patogenicidade, à espécie de ave, dose de infecção, status imune do hospedeiro e infecção(ões) concomitante(s). Em infecções por HPAIV, a morte pode ocorrer antes que lesões proeminentes sejam observáveis. Em termos gerais nenhuma lesão é considerada característica de influenza. As lesões do sistema respiratório, por exemplo, nos seios paranasais (secreção fibrinosa, mucopurulenta ou catarral), traquéia (edema e secreção de intensidade variável na mucosa), sacos aéreos espessados e com exsudato seroso, fibrinoso ou fibrinopurulento. Peritonite por ovo ectópico e por contigüidade dos sacos aéreos pode ser observada. Poedeiras podem também sofrer salpingite com acumulação de exsudatos no oviduto. Enterite hemorrágica, fibrinosa (graves) ou catarral (leve) pode ser observada e é mais comum em perus (intestino delgado e cecos).
Estirpes de subtipos de AIV que causam doença sistêmica apresentam HA clivada (ativação que permite a penetração na célula) por todas as proteases presentes em quaisquer células do hospedeiro sensível, enquanto AIV não patogênicos ou de baixa patogenicidade têm clivagem, e ativação da HA, somente nos intestinos das aves. Os mamíferos podem ativar a HA com enzimas principalmente do sistema respiratório, onde causam maior patogenia, embora as complicações sistêmicas possam envolver produtos de outros genes, como NA (Zambon, 1999). A presença de múltiplos aminoácidos básicos no sítio de clivagem da HA (Tabela 2) é considerada fenótipo característico de estirpes de alta patogenicidade para galinhas (Suarez et al., 1998).
Uma estipe de AIV A/mandarin duck/Singapore/805/F-72/7/93 (H10) de alta patogenicidade (HPAIV) para galinhas e isolado de patos, embora de subtipo não comumente associado às estirpes de HPAIV (H5 e H7), não apresentou seqüência de múltiplos aminoácidos básicos no sítio de clivagem da HA e não foi replicado no encéfalo de galinhas inoculadas via intravenosa. Os autores concluíram que a patogenicidade estaria associada à replicação renal (Wood et al., 1996).
As estirpes de HPAIV estão relacionadas na lista A de doenças do Office International des Epizooties (OIE), são altamente contagiosas e produzem doença em múltiplos sistemas das aves, levando à alta mortalidade algumas estirpes integrantes dos subtipos H5 e H7. A maior parte dos AIV isolados são, entretanto, de baixa patogenicidade e resultam em infecção subclínica ou respiratória e/ou reprodutiva em grande variedade de espécies de aves domésticas e selvagens e não constam da lista da OIE. Desde 1955, 18 surtos foram documentados de HPAIV. Não são consideradas as aves aquáticas selvagens como reservatório de HPAIV, embora sejam portadoras de AIV de baixa patogenicidade, que periodicamente cruzam as barreiras específicas de hospedeiros, ocasionando doença leve em aves domésticas. AIV suaves podem evoluir para HPAIV por mutações ou recombinação da HA. As estirpes de HPAIV de surtos em aves domésticas são comumente isoladas de aves selvagens durante o surto. Métodos de controle que contam com a ocorrência de infecção baixa nos plantéis não são, por isto, aceitáveis por geração de oportunidade de mutação e recombinação (Swayne & Suarez, 2000).
AIV de baixa patogenicidade A/emu/TX/39924/93 (H5N2) isolado de ratitas foi submetido a cultivos que selecionaram mutante de HPAIV. O mutante apresentou alterações na HA com a adição de 6 nucleotídeos na posição 970-975 codificadora da HA1, resultando na inserção de arginina e lisina próxima do sítio de clivagem (glicoproteína da fusão). O restante da seqüência da HA diferiu apenas em 7 aminoácidos e o sítio de clivagem foi imediatamente clivado durante a replicação. A estirpe causou lesões compatíveis com estirpes de HPAIV em galinhas. Uma PCR dirigida para a detecção do sítio de mutação (6 nucleotídeos) detectou apenas a estirpe mutante e não a original, podendo significar que a mutação foi rápida ou não detectada no vírus precursor (Perdue et al., 1996). A virulência dos AIV foi associada à duplicação da seqüência de clivagem da HA. Estirpes de AIV de alta patogenicidade (HPAIV) isoladas dos surtos de 1994-1995 no México tinham a inserção de dois aminoácidos básicos (arginina e lisina) no sítio de clivagem da HÁ. Uma das estirpes (A/Ck/Queretaro/7653-20/95) tinha informação genética adicional para quatro aminoácidos (arg-lys-arg-lys) no mesmo sítio e a análise da seqüência do gene de HA sugere que ela derivou de estirpe não patogênica isolada um mês antes. A inserção dos quatro aminoácidos é produto da duplicação direta de parte da região rica em purina que precede o códon da arginina no gene do sítio de clivagem (Perdue et al., 1997).
Uma estirpe de H5N2 altamente disseminada no México e associada apenas a quadros clínicos e lesões leves foi associada à evolução de estirpe de HPAIV para a avicultura industrial dos Estados Unidos. O seqüenciamento do segmento do gene codificador da região de clivagem da HA das estirpes detectou apenas seqüências características de estirpes não patogênicas na estirpe original e seqüências de estirpes de alta virulência na estirpe variante, a estirpe HPAIV com clivabilidade em cultivos de fibroblastos sem tripsina (Horimoto et al., 1995).
Os linfócitos foram caracterizados como a principal célula alvo em perus para uma estirpe de HPAIV. Grandes diferenças na capacidade de infectar a traquéia de perus foram observadas, entretanto, entre duas estirpes de AIV virulenta e não virulenta, após a exposição intratraqueal de doses pequenas de AIV. A estirpe não patogênica turkey/Wisconsin/68 exigiu doses muito mais altas de desafio e provocou infecção do epitélio traqueal, espalhando para a serosa peritoneal, enquanto a estirpe patogênica turkey/Ontario/7732/66 apresentou intenso pantropismo, atingindo primeiramente células mononucleares (macrófagos e linfócitos), excretada em 24 horas pela traquéia e em 32 horas pela cloaca, presente em 24 horas nos sítios linforeticulares do timo, baço e tonsilas cecais e replicação secundária detectada no baço, timo, tonsilas cecais, bolsa cloacal, glândula de Harder, áreas linforeticulares dos intestinos, medula óssea e no pâncreas. Nos intestinos, não houve detecção de infecção epitelial por turkey/Ontario/7732/66, nos quais foram observados pontos brancos de necrose através da serosa. Os picos de replicação de turkey/Ontario/7732/66 na bolsa cloacal e glândula de Harder ocorreram mais tardiamente. Infecção tardia (após 104 horas de infecção) por turkey/Ontario/7732/66 foi detectada no cérebro, com lesões em pequenos focos de encefalomalácia, e coração, com pericárdio descorado, atrofia da gordura cardíaca e múltiplos focos de necrose do miocárdio (Resende, 1980).
A patobiologia de A/chicken/Hong Kong/220/97 (H5N1) para 7 espécies de aves galináceas, incluindo galinhas, perus, codornas de penacho branco e japonesa, galinha da Angola, faisões e perdiz foi estudada, nas quais resultou em mortalidade entre 75 e 100% em 10 dias. Clinicamente, as aves apresentaram depressão, diarréia mucóide e disfunção neurológica. As lesões mais proeminentes foram esplenomegalia, edema e congestão pulmonar, hemorragias em regiões linfóides do intestino, nas superfícies serosas e musculatura esquelética. A mortalidade precoce em 24 horas após a inoculação foi relacionada ao edema e congestão pulmonar e localização do vírus no endotélio vascular, enquanto a mortalidade após 48 horas foi relacionada ao desequilíbrio bioquímico sistêmico, falha múltipla de órgãos ou combinação de ambas (Perkins & Swayne, 2001).
Uma patologia semelhante à síndrome do nanismo infeccioso (má absorção) foi descrita em pintinhos de 32 dias inoculados via saco aéreo (108,1 DIE50/ml) com A/whistling swan/Shimane/499/83 (H5N3), cujos sinais clínicos iniciaram dia 3 p.i., caracterizados por diarréia de suave a severa e espirros. Diferenças significativas foram detectadas entre os pesos corporais dos sobreviventes e controles, com lesões no pâncreas, timo e bolsa cloacal. Antígenos do vírus foram detectados no pâncreas, fígado, rins, pulmões, sacos aéreos e mucosa do cecum. Os autores sugeriram a possibilidade do AIV atuar como agente de nanismo infeccioso em pintinhos (Silvano et al., 1997).
A susceptibilidade dos pombos foi avaliada após a inoculação via oculo-nasal ou intravenosa com estirpes dos subtipos de AIV alta patogenicidade (HPAIV; HP CK/PA H5N2 e HP CK/Australia H7N7) ou AIV não patogênica (NPAIV; NP CK/PA H5N2 e NP emu/TX H7N1) na dose de 105 DIE50/dose de ave. Galinhas foram usadas como aves controles sensíveis. Os pombos inoculados com HP CK/PA H5N2 ou HP CK/Australia H7N7 permaneceram saudáveis por todos os 21 dias do experimento, não excretaram vírus nos dias 3, 7, 14 e 21 p.i. nem converteram títulos de anticorpos séricos até o 21º dia p.i., enquanto 9/12 das galinhas morreram de influenza, tinham vírus nos tecidos respiratório e digestório e todas sobreviventes expressaram conversão sorológica, para ambas vias de inoculação. Os pombos inoculados com NP CK/PA H5N2 ou NP emu/TX H7N1 permaneceram saudáveis durante todos os 21 dias de observação e nenhum título de anticorpos foi detectado ao 21º dia p.i., com a detecção de NP emu/TX H7N1 no 3º dia p.i. de apenas um indivíduo, possivelmente vírus do inoculo residual obtido com o swab traqueal. Os autores concluíram que os pombos são resistentes e permitem apenas fraca replicação de AIV de alta ou baixa patogenicidade (Panigrahy et al., 1996).
Um estudo das relações entre a mudança estrutural no gene codificador da HA e na patogenicidade de uma estirpe de AIV H5N2 foi desenvolvido, analisando AIV de diversos níveis de virulência isolados no México. A patogênese e mortalidade, causada por falha de múltiplos órgãos, especialmente renal e/ou respiratória, pode ser associada à presença de dois aminoácidos básicos e uma substituição no peptídeo de conexão da HA, sendo os HPAIV pantrópicos quanto aos sítios de replicação e produção de lesões, com as lesões mais graves localizadas no cérebro coração, glândulas adrenais e pâncreas. A seqüência de aminoácidos comuns no peptídeo de conexão da HA de isolados de baixa patogenicidade foi Prolina-Glutamina-Arginina-Ácido Glutâmico-Treonina-Arginina (nenhum aminoácido básico) e entre os isolados de alta patogenicidade Prolina-Glutamina-Arginina-Lisina-Arginina-Lisina-Treonina-Arginina (dois resíduos do aminoácido básico Lisina). Entretanto, nenhuma razão molecular foi encontrada para explicar as variações de tropismo, lesões e mortalidade entre os AIV de alta virulência (Swayne, 1997). Múltiplos aminoácidos básicos próximos ao sítio de clivagem, característica de influenza vírus de alta virulência, foram também encontrados na composição da HA de isolado de AIV que causou doença fatal em criança, sendo todos os oito segmentos do genoma caracterizados com de origem aviária, isolado, que em galinhas produziu mortalidade de 87,5-100 %. (Subbarao et al., 1998).
As atividades da protease responsável pela clivagem ativadora da HA de AIV foram avaliadas em AIV replicado em líquido alantóide (LA) de embriões com 10 ou 14 dias de incubação. A protease foi mais ativa em cultivos de AIV de LA de embriões de 14 dias que 10 dias, degradando a HA. Os resultados indicaram que as atividades de proteases fortes encontradas em embriões mais velhos prejudicam a replicação de AIV não patogênico mas não prejudicam os títulos de AIV patogênico, que são ativados por proteases intracelulares, o mecanismo que indica haver a seleção de AIV mutantes patogênicos por adaptação em ovos mais velhos (Horimoto & Kawaoka, 1998).
Uma estirpe de AIV H10N7, isolada de emu (Dromaius novaehollandiae), com sinais clínicos respiratórios e conjuntivite, caracterizada como não patogênica para galinhas, resultando em traqueíte, dispnéia e sinais leves respiratórios, foi investigada, sendo a nucleoproteína (NP) do AIV detectada por imunohistoquímica em células epiteliais dos brônquios, parênquima pulmonar e mucosa traqueal e células inflamatórias mononucleares do exsudato do lúmen bronquial. A NP não foi detectada na conjuntiva, sacos aéreos, rins, intestinos e fígado (Woolcock et al., 2000).
Os efeitos da infecção com a estirpe A/chicken/Hong Kong/220/97 (H5N1) foram avaliados em 7 espécies de aves galináceas, incluindo galinhas, perus, codornas de penacho branco e japonesa, galinha da Angola, faisão e perdiz, nas quais resultou em mortalidade entre 75 e 100% em 10 dias. O quadro clínico incluiu depressão, diarréia mucóide e disfunção neurológica e as lesões mais proeminentes foram esplenomegalia, edema e congestão pulmonar, hemorragias em regiões linfóides do intestino, nas superfícies serosas e musculatura esquelética. Lesões microscópicas foram observadas em múltiplos órgãos, incluindo pulmões, coração, cérebro, baço e adrenais, com exsudação, necrose hemorrágica e inflamação. A mortalidade antes de 48 horas foi relacionada com insuficiência respiratória aguda (edema e congestão pulmonar) e lesões do endotélio vascular. A mortalidade após 48 horas resultou do desequilíbrio bioquímico e falha múltipla dos órgãos, separadamente ou juntas. A transmissão direta de infecção e doença de aves para humanos foi descrita pela primeira vez para o vírus de alta virulência A/chicken/Hong Kong/220/97 (Perkins & Swayne, 2001).
A patologia comparada de estirpes de AIV de baixa e alta patogenicidade foi avaliada em galinhas SPF de 4 semanas de vida. As estirpes de baixa patogenicidade (LPAIV) A/chicken/Pennsylvania/21525/83 (H5N2) (LPAIV-Penn) e A/chicken/Alabama/7395/75 (H4N8) (MP-Alab) e de alta patogenicidade (HPAIV) A/chicken/Pennsylvania/1370/83 (H5N2), A/chicken/Victoria/A185/85 (H7N7) e A/turkey/Ontario/7732/66 (H5N9) foram avaliadas. As estirpes de HPAIV ocasionaram necrose e inflamação na bolsa cloacal, timo, baço, coração, pâncreas, rins, cérebro, pulmões e músculos esqueléticos, enquanto que as estirpes de LPAIV resultaram em lesões restritas aos pulmões e traquéia ou nenhuma lesão aparente. A coloração específica de proteínas de AIV por imunohistoquímica foi mais comumente verificada no coração, pulmão, rins, cérebro e pâncreas para HPAIV e mais raramente na traquéia e pulmão das aves inoculadas com LPAIV-Penn. A estirpe LPAIV-Ala não ocasionou lesões e não foram detectados antígenos de AIV nos tecidos, apenas conversão sorológica nas aves. As estirpes de HPAIV demonstraram capacidade de disseminação para além do trato respiratório, confirmando o caráter pantrópico dessas, embora existam diferenças de severidade e distribuição das lesões causadas por HPAIV. As estirpes de LPAI, ao apresentarem tropismo restrito, ocasionaram lesões e mortalidade apenas esporádica (Mo et al., 1997).
A patogenicidade de duas estirpes de eqüinos foi avaliada em galinhas. As estirpes A/equi 1 (H7N7) e A/equi 2 (H3N8) foram inoculadas em pintinhos entre 4 e 18 dias de idade e amostras cloacais colhidas entre 1 e 15 dias p.i. e inoculadas em embriões de galinhas com 11 dias de incubação. Os vírus reisolados foram identificados por IH utilizando anticorpos específicos contra cada estirpe, totalizando 12/633 (0,001%) reisolamentos, apenas para A/equi 2 e não para A/equi 1. Os soros dos pintinhos foram avaliados por IH entre 18 e 21 dias p.i. e evidenciaram resposta em 79,8% das aves. Nenhum sinal clínico foi detectado nas aves (Cunha et al., 1993).
DIAGNÓSTICO
A influenza aviária é doença enquadrada no grupo A de epizootias da O.I.E. de notificação obrigatória no Brasil. O diagnóstico de influenza aviária depende do isolamento e identificação do vírus, uma vez que os sinais clínicos e lesões são muito variáveis entre os episódios e estão dependentes da estirpe de AIV, espécie de ave, status imune específico e não específico, estado nutricional, doenças concomitantes etc. O isolamento e identificação viral segue normas oficiais previstas pelos centros internacionais de referência para influenza (por exemplo, Central Veterinary Laboratory, no Reino Unido) e pelo Programa Nacional de Sanidade Avícola (PNSA) no Brasil. Os laboratórios de diagnóstico devem ser credenciados pelo Ministério da Agricultura e atender rígidas normas de biossegurança e qualidade. O laboratório de referência para a identificação de AIV no Brasil é o LARA (Laboratório de Referência Animal) em Campinas, São Paulo.
O diagnóstico diferencial para a distinção de AI de outras enfermidades de quadro clínico e patológico semelhante é necessário, especialmente para doença de Newcastle, cólera aviária, micoplasmose e clamidiose.
Isolamento de identificação do vírus
A amostragem oficial para o diagnóstico de AIV em plantéis comerciais pode apenas ser efetuada por fiscais do Ministério da Agricultura ou médicos veterinários autorizados. As amostras independentemente colhidas e isoladas devem ser caracterizadas no Laboratório de Referência Animal (LARA, Campinas) e, se necessário, nova amostragem oficial agendada. O PNSA está implantando o projeto de vigilância ativa da doença de Newcastle e influenza aviária, para o qual os abatedouros receberão materiais (kit) para a colheita de amostras, incluindo frascos, etiquetas, canetas, sacos plásticos, seringas, swabs, fitas colantes, gelo reciclável e caixa isotérmica de transporte (Projeto de Vigilância, 2001).
Há vários manuais de prática laboratorial (por exemplo, Isolation and Identification of Avian Pathogens da American Association of Avian Pathologists), nos quais os detalhes para o diagnóstico de AI podem ser encontrados. Os tecidos e secreções das aves infectadas ou doentes são fonte de vírus para replicação e isolamento em laboratório. Os tecidos recomendados para amostragem refletem o quadro clínico ou sistemas mais comumente atingidos pela infecção, principalmente sistema respiratório e digestivo. As estirpes de HPAIV têm grande pantropismo infeccioso, atingem virtulamente todos os tecidos e de quaisquer tecidos podem ser isoladas. Altos títulos de excreção fecal, que garantem alta transmissibilidade de aves reservatório (Anseriformes, Procellariformes e Laridae) para domésticas, permitem o isolamento dos AIV das fezes ou por amostragem cloacal (swabbing). A infecção respiratória, por sua constância, garante o sucesso de isolamento nasofaríngeo (por exemplo, fenda palatina) e da traquéia, mesmo na ausência de sinais clínicos (Easterday et al., 1997).
Diversos substratos celulares e animais de laboratório podem ser utilizados. Todos, entretanto, devem ser livres de patógenos e anticorpos específicos, entre estes ovos embrionados, pintinhos e frangas/frangos e galinhas (Gallus gallus formadomestica), perus Meleagris gallopavo formadomestica) e patos (Anas). AIV também são replicados em mamíferos como marta (ferret) e vison (mink) (mustelídeos, marta Mustela putorius e vison Mustela vison), camundongos, hamsters, gatos e suínos. Embriões de galinhas SPF (specific pathogen free) podem ser inoculados entre 9 e 11 dias de incubação via cavidade alantóide com material de macerado de tecidos ou excreções, tratados com antibióticos e antimicótico são inoculados via cavidade alantóidea (CA). Os líquidos alantóide (LA) dos embriões vivos, mortos ou com alterações de desenvolvimento em até sete dias após a inoculação são examinados para atividade hemaglutinante misturando-se LA e hemácias de galinhas SPF a 5% (50 Μl de cada) em lâmina ou placa de vidro. A hemaglutinação é visível pela formação de grumos que separam as hemácias da fase aquosa. Os LA com atividade hemaglutinante são examinados para a caracterização do agente em testes para a identificação de influenza A em reação contra anticorpos específicos para a NP (imunodifusão em gel de ágar AGP), de inibição da hemaglutinação com anticorpos policlonais ou monoclonais específicos contra cada subtipo de AIV e para diferencial do vírus da doença de Newcastle (VDN).
Cultivos primários de fibroblastos, rins e fígado de embriões SPF são também substratos para o cultivo de AIV. Estirpes patogênicas de AIV podem infectar esses cultivos sem tratamento enzimático prévio, enquanto estirpes não patogênicas necessitam tratamento prévio com tripsina em pH ácido, para a ativação da glicoproteína da fusão (porção da HA2). Cultivos de órgãos, como anéis de traquéias, são também excelentes substratos por permitirem o isolamento e o desenvolvimento de ensaios de caracterização específica do subtipo (neutralização da HA ou NA). Uma estirpe de HPAIV que atinge o sistema linfo-reticular pode ser isolada de diversos substratos celulares, por esses sistemas integrarem também estas células (Resende, 1980). Um eventual agente com atividade hemaglutinante de eritrócitos de galinhas isolado em embriões deve ser caracterizado, primeiramente diferenciando de outros agentes com esta propriedade, em testes de inibição específica da HA (inibição da hemaglutinação) e testes de identificação do tipo de vírus influenza (Projeto de Vigilância, 2001) com anticorpos específicos, monoclonais ou policlonais, contra a nucleoproteína do tipo A, o único que ocorre em aves.
Um método de separação para a proteína da matriz de influenza A para imunoensaios foi descrito utilizando eletroeluição após eletroforese de vírus lisado, podendo ser os antígenos eluídos de influenza A (não de B) utilizados em ELISA e immunoblotting de lavados nasais de humanos (Donofrio et al., 1986) para antígeno ou anticorpo anti-A. Em outro ensaio descrito para proteínas internas, Coonrad et al. (1988) descreveram um ELISA para antígenos do cerne de influenza A, utilizando anticorpos monoclonais específicos, com alta sensibilidade para a matriz (1 ng) ou nucleoproteína (0,05 ng), em lavados nasais de humanos (Coonrad et al., 1988). A diferenciação de variantes de escape de influenza A, por detecção de determinantes antigênicos da HA de influenza A (A/Brazil/11/78, H1N10), foram determinados por cultivo de vírus na presença de anticorpos monoclonais específicos para quatro determinantes da HA (Sa, Sb, Ca e Cb), todas as 400 projeções de HA possuindo cada um dos determinantes (Drescher & Verhagen, 1993).
Recomendações do Programa Nacional de Sanidade Avícola
A vigilância ativa, com o objetivo de reduzir o risco da introdução de influenza nos lotes comerciais em território nacional, prevê amostragens e quarentena de quaisquer aves entrando em território nacional, em aeroportos, portos ou fronteiras terrestres. A admissão de aves em território nacional está subordinada à solicitação específica para este fim junto à Secretaria de Defesa Agropecuária do Ministério da Agricultura (SDA/MA). A indústria avícola nacional mantém importação regular devidamente regulamentada e monitorada pelo SDA/MA. Aves capturadas por entrada clandestina não são admitidas e o proprietário deve providenciar seu retorno ao país de origem. Aves clandestinas capturadas sem dono são confiscadas e enviadas para quarentena oficial.
O lote suspeito de infecção por AIV deve ser amostrado colhendo-se de 10 aves, 10 swabs de traquéia e 10 swabs de cloaca. O meio de transporte das amostras deve conter, para traquéia, 2000 U.I. de penicilina, 2 mg de estreptomicina, 50 mg de gentamicina e 1000 U.I. de anfotericina B e para cloaca, 10000 U.I. de penicilina, 10 mg de estreptomicina, 250 mg de gentamicina e 5000 U.I de anfotericina B, para 100 ml de PBS (soluΗão salina tamponada por fosfato, pH 7,2). Os swabs são acondicionados em tubos plásticos, com tampa de rosca e meio de transporte, identificados individualmente com etiquetas padronizadas e conservados entre 2 e 8°C durante o transporte. Colheitas oficiais são apenas executadas pelo fiscal agropecuário ou médico veterinário autorizado pelo PNSA.
Sorologia
Estudos sorológicos de AIV podem ser implementados para a detecção de anticorpos específicos para a nucleoproteína (NP) de AIV, garantindo a detecção ampla de resposta contra o grupo A e baixos índices de falsos negativos, sem, entretanto, poder identificar o(s) subtipo(s) prevalentes. Em contraste, estudos empregando ensaios para a detecção de anticorpos para as glicoproteínas da superfície (HA e NA) permitem a demonstração de anticorpos subtipo-específicos, com altos índices de falsos negativos se entre os antígenos não forem incluídos todos os subtipos prevalentes.
O PNSA no projeto de vigilância ativa da doença de Newcastle e influenza aviária (Projeto de Vigilância, 2001) prevê a amostragem, na linha de abate, de 24 aves por lote para a sorologia, colhendo-se 2 a 3 mL de sangue por ave individualmente em tubos de plástico estéreis com tampa de rosca, identificados por indivíduo e colocados em repouso, idealmente nas condições de temperatura adequadas para a coagulação (37ºC/2 horas) e a seguir para contração do coágulo e separação do soro (4ºC/2 horas). Os tubos devem a seguir soros ser centrifugados (aproximadamente 2000xg/10 min) e os soros sobrenadantes transferidos individualmente para frascos de conservação com rotulação e tampa (-20ºC). Os soros das 20 amostras com melhor separação e pureza são selecionados para o envio ao laboratório e congelados.
A monitoração sorológica para AI pode empregar o teste de inibição da hemaglutinação, inibição da neuraminidase ou ensaios imunoenzimáticos (ELISA). ELISA comerciais estão disponíveis para a detecção de anticorpos contra a nucleoproteína (NP) de AIV do tipo A e outros para a caracterização do subtipo de AIV quanto à hemaglutinina (HA) durante a identificação de estirpes. Esses testes estão descritos em detalhe nos manuais dos fabricantes (ELISA) ou nos manuais de diagnóstico de doenças aviárias. A detecção de anticorpos contra a NP permite a demonstração de contato prévio com AIV do tipo A, grupo em que estão todos os AIV. A caracterização da resposta quanto à especificidade dos anticorpos para as diversas HA existentes (subtipos) é mais complexa e pode requerer um ensaio de captura de glicoproteína de cada subtipo (H1 a H15) e/ou anticorpos monoclonais. Há variações na intensidade da resposta imune natural para a NP conforme a espécie de ave, sendo os títulos em patos muito baixos ou não detectáveis em comparação com altos títulos em perus e faisões (Easterday et al., 1997).
Para a diferenciação de estirpes sendo isoladas, a sorologia com o emprego de anticorpos específicos contra a NP ou HA é empregada. A descrição oficial da técnica de inibição da hemaglutinação para a diferenciação entre AIV e vírus da doença de Newcastle em material de diagnóstico virológico está publicada na Portaria da Secretaria de Defesa Agropecuária nº 182 de 8/11/94 (Portaria, 1984).
Métodos sorológicos de diagnóstico foram avaliados na China, em cujos estudos foi observado que a resposta imune mediada por anticorpos específicos para AIV pode apresentar variação individual. Frangas SPF desafiadas com uma estirpe de patos expressaram níveis de anticorpos detectáveis entre 7 e 79 dias p.i. por ELISA, este sendo o mais sensível teste, ou IH (inibição da hemaglutinação) e entre 13 e 79 dias por imunodifusão em gel de agar (Lin et al., 1998).
ELISAs competitivos foram desenvolvidos para a detecção de antígenos e anticorpos específicos para AIV. Um ELISA de competição baseado na utilização de antígeno de nucleoproteína expresso em baculovírus e em anticorpos monoclonais foi desenvolvido para a detecção de anticorpos específicos para a nucleoproteína de AIV. O teste foi avaliado com soros de galinhas (756), perus (1123), emus [(Dromaius novaehollandiae) 707] e avestruzes [(Struthio camelus) 1261]. A sensibilidade relativa ao teste de imunodifusão (AGP) foi de 100% para todas a 4 espécies e em relação ao IH foi de 100% para galinhas, perus e emu e de 96,2 para avestruzes. Mais de 90% das amostras de soros negativos ao AGP e positivas ao ELISA foram positivas ao IH para pelo menos um subtipo de AIV. A especificidade do ELISA relativamente ao AGP foi de 85,5 a 99,8%. O ELISA de competição foi considerado mais sensível e específico que o AGP e com a mesma sensibilidade e especificidade que o IH, sendo recomendado para a avaliação dos soros destas espécies de aves (Zhou et al., 1998). Um ensaio imunoenzimático de captura de antígeno, desenvolvido para a detecção de influenza A em humanos, foi avaliado para a detecção de AIV em aves industriais. A sensibilidade e especificidade foram avaliadas para a detecção de H7N2 não patogênico de ocorrência natural em galinhas industriais e para permitir a adoção de estratégias em plantéis durante a quarentena. A especificidade relativa foi de 100% e a sensibilidade de 79%, sendo considerado útil para diagnóstico de rotina (Davison et al., 1998). Outro ELISA competitivo foi descrito para a detecção de anticorpos específicos para AIV em soros de aves utilizando antígeno da nucleoproteína de A/Ann Arbor/6/60 expresso em baculovírus (poliedrose) de Autographa californica. Anticorpos monoclonais (AcM) específicos para a nucleoproteína de AIV foram utilizados para a captura do antígeno. O ELISA foi comparado com AGP na avaliação 1651 soros de referência e experimentais. As amostras de soros com resultados diferentes no ELISA e AGP foram também testadas em imunofluorescência (IF), IH e NI (inibição da neuraminidase). Um alto grau de correlação foi detectado entre o ELISA e AGP, com os resultados em especificidade validados por IF, IH e NI, permitindo a recomendação desse para a monitoração de grandes números de amostras de soros (Shafer et al., 1998).
AIV H10N7 de emu (Dromaius novaehollandiae), embora resultando em traqueíte, dispnéia e sinais leves respiratórios em emús, foi caracterizado como não patogênico para galinhas. A nucleoproteína (NP) do AIV foi detectada por imunohistoquímica em células epiteliais dos brônquios, parênquima pulmonar e mucosa traqueal e células inflamatórias mononucleares do exsudato do lúmen bronquial e não detectada na conjuntiva, sacos aéreos, rins, intestinos e fígado (Woolcock et al., 2000).
O isolamento viral e testes sorológicos do diagnóstico de rotina de AIV foram avaliados em aves infectadas experimentalmente com H5/94, M5/94 ou J12/94 (todas resultando em doença esporádica e mortalidade, classificadas como medianamente patogênicas), Q1/95 (doença e morte em todas as aves infectadas altamente patogênica) ou P11/94B (doença sem mortalidade). Swabs da orofaringe foram superiores para o isolamento durante o quadro clínico e swabs cloacais superiores após o fim da doença clínica. Para a sorologia, a precipitação em gel de agar (AGP) foi superior durante a fase clínica e equivalente ao IH depois da recuperação. A passagem da estirpe de baixa patogenicidade P11/94B em embriões de galinhas SPF de 14 dias de incubação ou diretamente em galinhas adultas resultou na emergência de mutantes de alta patogenicidade para galinhas adultas. Os sítios de clivagem das hemaglutininas de Q1/95 e P11/94B apresentaram-se idênticos e consistentes com estirpes de alta patogenicidade, discrepantes com as diferenças em patogenicidade, o que sugere que outros genes além da HA podem estar associados com a alta letalidade das estirpes Mexicanas (Swayne et al., 1997).
AIV A/Chicken/Puebla/1485-622/94 (H5N2) replicado na membrana cório-alantóide de embriões de galinha foi utilizado para comparações entre os ensaios de imunodifusão (ID), microimunodifusão (MID) e inibição da hemaglutinação (IH) para anticorpos contra AIV. A sensibilidade do MID e ID, comparados entre si, foi de 98% e de ambos foi de 43%, comparados ao IH, detectando soros com títulos de 320 ou mais altos (Loza et al., 1997).
A imunidade cruzada celular entre isolados pode mudar o prognóstico da doença em aves e pode resultar em perpetuação de infecção não letal. As galinhas do mercado de aves vivas em Hong Kong eram portadoras de H5N1 e não apresentaram sinais clínicos, embora a amostra fosse letal para aves e humanos. A imunidade celular derivada da infecção com H9N2, que co-infectava os plantéis de galinhas, e foi transmitido também para humanos, pode ter protegido as populações de aves contra os efeitos da infecção com a amostra letal H5N1. (Seo & Webster, 2001).
Soros de emus (Dromaius novaehollandiae) experimentalmente infectados com AIV foram reagentes em ensaios para a detecção de anticorpos em ELISA de competição (C-ELISA), imunodifusão e inibição da hemaglutinação, sendo o C-ELISA proposto para substituição da imunodifusão, em testes de varredura para detecção de anticorpos contra a nucleoproteína (Zhou et al., 1998).
Em humanos, anticorpos das classes IgA, IgG e IgM foram detectados por imunofluorescência utilizando eritrócitos formolinados adsorvidos com influenza A (A/Philippines/2/82, A/Brazi/11/78) ou B/Singapore, em teste complementar à fixação de complemento (Doller et al., 1985). Os testes de inibição da hemaglutinação (HI) e hemólise simples radial (HSR) foram comparados para detecção de anticorpos séricos para influenza também em humanos (Mancini et al., 1983), cujos resultados pareceram indicar maior sensibilidade para a HSR.
Diagnóstico e Identificação por Genética Molecular
Ensaios para a detecção do genoma de AIV têm sido descritos na literatura. A detecção de região conservada do gene da nucleoproteína (N) e/ou matriz (M1 e/ou M2) garante o diagnóstico amplo de quaisquer estipes de quaisquer subtipos do tipo A. Ensaios de genética molecular para a detecção de seqüências genômicas que codificam as glicoproteínas do envelope têm a vantagem de permitir a classificação da estirpe quanto ao subtipo (HA e NA) e a desvantagem de resultados falso-negativos, contornáveis em parte pela utilização de iniciadores para os principais subtipos prevalentes.
A aplicação de uma PCR fluorogênica para a tipificação e subtipificação de vírus influenza de amostras respiratórias foi descrita. A PCR emprega a tecnologia de sonda que explora a atividade de nuclease endógena 5'-3' da Taq DNA polimerase, permitindo a detecção do amplicon pela liberação de um reagente fluorescente durante a PCR. O método mostrou-se mais sensível que isolamento e de excelente correlação para tipificação e subtipificação, sendo utilizado na Alemanha para estudos de vigilância em humanos (Schweiger et al., 2000)
Um ensaio PCR-imunoenzimático foi desenvolvido para a identificação do RNA matricial do influenza A em amostras clínicas negativas para vírus cultivável. O ensaio imunoenzimático associado a PCR (PCR-EIE) foi empregado para a detecção de RNA viral do vírus da influenza A em secreções respiratórias. A PCR com transcrição reversa foi desenvolvida com oligonucleotídeos para uma região altamente conservada de influenza A. O DNA complementar foi detectado por hibridização com uma sonda aninhada (nested) biotinilada e quantificada por EIE. O PCR-EIE detectou três subtipos de influenza A (Cherian et al., 1994).
A detecção de influenza A de diferentes espécies foi obtida por amplificação com PCR de seqüências conservadas do gene matricial. Um painel de iniciadores, baseado em regiões altamente conservadas do RNA, foi desenhado para RT-PCR (PCR após transcrição reversa) em tubo único, para detecção de influenza A de espécies múltiplas. Uma coleção de 25 isolados de aves, humanos, suínos, eqüinos e focas, incluindo todos os subtipos conhecidos, foi utilizado. Onze vírus RNA heterólogos foram incluídos como controle. Os swabs fecais e de cloaca de aves confirmaram ser a PCR mais rápida e 100 vezes mais sensível que os procedimentos clássicos de isolamento (Fouchier et al., 2000).
MEDIDAS DE CONTROLE E PREVENÇÃO
Vacinas
Nos Estados Unidos, o controle das formas de alta patogenicidade de AIV tem sido atingido com programas de erradicação, assim como contra as formas velogênicas da doença de Newcastle (Villegas, 1998)
Entretanto, novas estirpes de influenza vírus estão constantemente emergindo na população humana e animal. Três pandemias em humanos estão descritas na literatura, nas quais os subtipos cruzaram as barreiras de espécie hospedeira. Da mesma forma, o surto em Hong Kong em 1997 com H5N1 indica para o risco futuro de pandemia, contra a qual não haveria tempo suficiente para estabelecimento de proteção vacinal às populações humanas. Estirpes de AIV em períodos interpandêmicos podem apresentar variação antigênica leve (antigenic drift) que podem evoluir para variação antigênica forte (antigenic shift) e originar surto de doença. A vigilância epidemiológica é base para a determinação de atualizações vacinais e os agentes antivirais anti-neuraminidase devem ser considerados como adjuvantes para vacinas (De Jong et al., 2000).
Métodos de controle que contam com a ocorrência de infecção baixa nos plantéis não são aceitáveis por geração de oportunidade de mutação e recombinação. O controle ideal deve incluir prevenção da exposição, biossegurança, vigilância epidemiológica e diagnóstico, educação, quarentena e depopulação. Algumas tentativas de vacinação foram integradas a programas de controle e erradicação de AIV. HPAIV, embora, não estejam permanentemente infectando aves aquáticas selvagens, elas são portadoras de AIV de baixa patogenicidade, que cruzam as barreiras específicas de hospedeiros, ocasionando doença leve em aves domésticas e podem evoluir para HPAIV por mutações ou recombinação da HA. As estirpes de HPAIV de surtos em aves domésticas são comumente isoladas de aves selvagens durante o surto (Swayne & Suarez, 2000).
Vacinas têm protegido contra HPAIV do subtipo H5 apesar das mudanças genéticas dos AIV de campo durante alguns anos. Vacinas inativadas contendo vírus íntegro, hemaglutinina expressa em baculovírus ou recombinante de pox galinha expressando hemaglutinina foram eficientes em induzir proteção ao desafio com múltiplas estirpes de HPAIV do subtipo H5 de quatro continentes, de seis espécies hospedeiras diferentes e obtidas em um período de 38 anos. A proteção foi eficaz para sinais clínicos e mortalidade e reduziu o número de aves e o título da excreção viral. A mudança genética suave (drift) não interferiu na proteção geral, embora tenha sido descrita para vírus humanos (Swayne et al., 2000b).
Grupos de galinhas de 4 semanas de idade foram vacinados com HA de uma estirpe do subtipo H5, uma heteróloga H7 ou líquido alantóide (controle) e desafiados com uma estirpe de HPAIV H5. Todas dez HA avaliadas resultaram em proteção contra doença e mortalidade, com anticorpos detectados por IH e imunodifusão em ágar (Swayne et al., 1999). Em contraste, falhas de uma vacina recombinante de pox galinha expressando a hemaglutinina de HPAIV do subtipo H5 foram descritas quando a vacina recombinante foi aplicada após uma vacina de bouba, podendo limitar sua eficiência em aves previamente imunizadas contra a bouba aviária (Swayne et al., 2000a).
A vacinação de galinhas com DNA plasmideal nu foi avaliada usando cinco promotores: dois de citomegalovírus (CMV), um de sarcoma de Rous, actina de galinha ou vírus símio SV40] e 5 plasmídeos diferentes, para a expressão da HA de uma estirpe do subtipo H5, sendo que todos expressaram HA detectável em cultivo celular. O promotor pCI-neo de CMV proporcionou a melhor resposta em pintinhos vacinados no 1º dia de vida via intramuscular, considerando a proteção ao desafio com HPAIV às 6 semanas após a vacinação e os títulos de anticorpos. Melhores respostas foram obtidas com revacinação às três semanas, sítios múltiplos de inoculação e uso de lipossomos catiônicos como adjuvante (Suarez & Schultz-Cherry, 2000). Uma vacina de DNA expressando a HA de H5 não protegeu camundongos contra infecção por H5N1 heterólogo, com diferença de 12% na HA1, embora tenha protegido contra a mortalidade (Kodihalli et al., 1999).
Um adjuvante para a administração de vacina de influenza vírus empregando Bifidobacterium breve estirpe YIT4064 foi avaliado em camundongos e os resultados, que apontaram para um aumento da resposta imune local anti-influenza, mediada por imunoglobulina A nas placas de Peyer, indicam para uma melhor distribuição de anticorpos de mucosa e de proteção às portas de entrada (Yasui et al., 1994).
Uma vacina recombinante de pox aviário (vírus da bouba das galinhas) expressando o gene da HA de estirpe mexicana do subtipo H5 foi aplicada em pintinhos de 1 dia. Nenhum pintinho apresentou conversão sorológica, não interferindo com o programa de monitorização sorológica por imunodifusão em agar de rotina para AIV dos EUA mas com 8% de positividade de baixos títulos em IH. A proteção contra a doença clínica e mortalidade, após desafio com HPAIV H5N2 isolada de galinhas no México, foi de 90-100% entre 3 e 20 semanas pós vacinação, com redução (50-75%) da excreção intestinal e respiratória do AIV de desafio nos vacinados, assim como redução da transmissão por contato (Swayne et al., 1997). A inoculação direta (grupo 1-100mg antígeno AIV/ave; grupo 2-10mg e grupo 3-1 mg; grupo 4-placebo) do plasmΝdeo psVH7 expressando a HA de uma estirpe do subtipo H7 em pintinhos de 3 semanas de idade via intramuscular resultou em proteção contra o desafio com a estipe HPAIV A/Afri. Star/Eng-Q/983/79 (H7N1), conversão de títulos sorológicos, de 64 na primeira e 512-1024 na segunda semana pós desafio (grupos 1, 2 e 3) e redução da excreção viral, mas apenas 16 e 128 para o grupo 4, nas 1ª e 2ª semanas pós desafio, respectivamente (Chen et al., 1998). Outra vacina recombinante empregando pox aviário (galinha) com a expressão da hemaglutinina H7 resultou em proteção contra o desafio homólogo (Boyle et al., 2000).
Baculovirus foram utilizados para a expressão da hemaglutinina (HA) de isolados dos subtipos H5 e H7 de AIV. As proteínas expressas no sistema baculovírus mantiveram atividade hemaglutinante e formaram rosetas em solução, tanto quando expressas inteiras como quando expressas em partes, indicando que a conformação tridimensional foi obtida. As HA foram imunogênicas per se, mas a melhor resposta foi obtida com preparações oleosas (água em óleo), com títulos de anticorpos inibidores da hemaglutinação comparáveis àqueles derivados de inoculação com vírus completo, mais altos e uniformes em aves de 3 semanas (GMT 121 para H5 e 293 para H7), que em aves de um ou dois dias de idade. A proteção foi total ao desafio com estirpe de alta virulência do subtipo homólogo, com nenhuma ou reduzida excreção de vírus já em 3 dias após o desafio. A ausência de resposta imune aos demais componentes estruturais dos AIV permite a diferenciação das respostas imunes derivadas da vacina recombinante e infecções naturais por AIV (Crawford et al., 1999). Uma preparação de vacina recombinante expressando uma inserção de H5 em vírus da bouba aviária protegeu galinhas contra sinais clínicos, mortalidade e excreção de vírus após o desafio com HPAIV. A estirpe de desafio continha 87,3 a 100% de semelhança na seqüência de aminoácidos deduzida para a HA, oriunda de região geográfica diferente. As seqüências da HA de vírus isolado da orofaringe após o desafio foram semelhantes às seqüências do vírus de desafio. Entretanto, vírus isolado da cloaca não foi semelhante ao original de desafio (Swayne et al., 2000a), indicando drift antigênico.
Uma vacina não adjuvantada clássica preparada com subunidades de AIV e uma vacina baseada em complexos imunoestimulantes (ISCOM) preparada com glicoproteínas da membrana de AIV A/Hong Kong/156/97 (H5N1) foram comparadas na proteção de galinhas contra o desafio com este mesmo HPAIV. A vacina de ISCOM induziu imunidade protetora, enquanto a preparação de subunidades não adjuvantada não (Rimmelzwaan et al., 1999).
A produção de vacinas para as estirpes de AIV de alta patogenicidade (HPAIV) esbarra na virulência dessas para o embrião, resultando em mortalidade muito precoce e baixos títulos, assim como na necessidade de rigorosa biossegurança laboratorial. Vacinas inativadas por formol, preparadas com uma estirpe não patogênica de H5N4 como doador genético, uma estirpe de H5N1 como recombinante com uma H3N1 aviária ou uma não patogênica de H5N1 gerada por reversão genética foram inoculadas via intraperitoneal em camundongos, resultando em anticorpos de mucosa e sistêmicos inibidores da hemaglutinação e protetores contra o desafio com H5N1 letal (Takada et al., 1999).
Preparações vacinais de AIV H5N9 A/mallard/Ohio/556/1987 (MOh87) viva ou inativada foram avaliadas em galinhas SPF administradas via oral. Anticorpos circulantes foram detectados após a aplicação de quaisquer das preparações. As aves resistiram ao desafio com H5 letal, inclusive com a interrupção da excreção viral pela cloaca (Crawford et al., 1998).
Embriões (White Leghorn-WL ou White Rock-WR) de 18 dias de embriogênese foram vacinados com vacina oleosa contra AIV in ovo em vários volumes e concentrações de antígeno. Anticorpos séricos IH foram detectados a partir de duas semanas pós-eclosão entre 85 e 100% dos pintinhos e houve proteção contra desafio com AIV de alta patogenicidade aos 34 dias de idade. A eclodibilidade dos embriões inoculados com 100 ml de vacina não foi diferente dos embriões controles (Stone et al., 1997).
Um estudo foi desenvolvido para avaliar a concentração de hemaglutinina necessária para induzir proteção contra sinais de doença e a quantidade de antígeno necessário para reduzir a excreção de vírus. Seis preparações comerciais de vacinas inativadas e em emulsão oleosa H5N2 foram comparadas na proteção contra desafio com a estirpe A/chicken/Queretaro/19/95. A concentração de HA de 0,4 micrograma por dose preveniu o aparecimento de sinais. Todas as preparações comerciais impediram o quadro clínico e reduziram a excreção viral (Garcia et al., 1998).
Biossegurança
O controle de AIV em regiões de avicultura densamente povoadas é difícil, especialmente onde já existe estirpe de HPAIV circulando e disseminada. Idealmente, a avicultura deveria ser planejada para impedir a concentração de granjas em área geográfica com proximidade e multiplicidade de idades e tipos de aves. A implementação de estratégias de biossegurança nessas regiões é essencial para a redução da disseminação de doenças infecto-contagiosas, entre estas influenza, reduzindo as despesas com medicação e melhorando a qualidade dos produtos. A implementação dessas estratégias, além da atenção aos focos, conforme recomendado pelo Office International des Epizooties para a erradicação das doenças da lista A, nos episódios ocorridos na avicultura industrial americana (Davison et al., 1999; Avian Influenza Task Force, 1984; Lasley, 1987), européia (Capua & Marangon, 2000) e asiática (Wei-Hua, 1998) impediu que os prejuízos econômicos ficassem fora do controle.
Desinfetantes
Produtos anticongelantes de água (etileno glicol e propileno glicol) ou líquido de lavagem de pára-brisa (automobilísticos) foram adicionados na preparação de diluições de uso dos desinfetantes para o tratamento ambiental nos surtos de AIV na Pennsylvania para reduzir o risco de congelamento e manutenção da atividade virucida contra o AIV. Para avaliar os efeitos dessas combinações, foram testados dois compostos fenólicos, um quaternário de amônia e uma combinação de quaternário de amônia-formaldeído (AF) e um hipoclorito de sódio. Os produtos fenólicos e quaternário de amônia puro foram eficientes, enquanto a combinação AF e o hipoclorito de sódio tiveram sua eficiência reduzida pela adição do etileno glicol, sendo apenas afetada a eficácia do hipoclorito pela adição de propileno glicol. O líquido de parabrisas manteve a eficácia de todos os desinfetantes exceto a combinação AF (Davison et al., 1999).
Peróxido de hidrogênio em vapor foi avaliado na desinfecção de vírus exóticos, em cabine de descontaminação em unidades de isolamento. Representantes de Orthomyxoviridae, Reoviridae, Flaviviridae, Paramyxoviridae, Herpesviridae, Picornaviridae, Caliciviridae e Rhabdoviridae de aves e mamíferos foram avaliados, especialmente estirpes exóticas no Canadá. As suspensões virais em meio de cultivo celular, líquidos de ovos ou sangue secas em superfície de vidro e aço inoxidável foram expostas durante 30 minutos ao vapor de próxido de hidrogênio, reduzindo a zero a contaminação para os vírus de aves (influenza e Newcastle) ou menos de 10 doses infecciosas de cultivos de células para os vírus de mamíferos (peste suína, peste suína africana, língua azul, pseudo-raiva, doença vesicular dos suínos, exantema vesicular e estomatite vesicular), sem efeitos adversos sobre os equipamentos (Heckert et al., 1997).
TRATAMENTO
Resistência temporária foi detectada em AIV ao interferon (IFN) alfa quando cultivado em células de galinha (Gallus) ou codornas (Coturnix), enquanto o restante (60-40%) da partida viral foi sensível. Partidas de vírus contendo resistência produziram populações sensíveis e resistentes. A inativação da quinase protéica dependente do dsRNA e seu ativador dsRNA pela NS1 aumentaram a sobrevivência de AIV em células infectadas por AIV e tratadas por IFN e 2-aminopurina (Sekellick et al., 2000).
O ácido 4-guanidino-2-4-dideoxy-2,3-didehydro-N-acetilneuramínico (4-guanino-Neu5Ac-2en), Zanamavir, GG167, um inibidor específico da neuraminidase dos vírus influenza, foi avaliado na profilaxia de influenza. A sensitividade do AIV ao produto depende do ensaio in vitro empregado para avaliação (inibição da formação, redução do tamanho e alteração da morfologia das placas ou redução da produção de vírus). Avaliações in vivo demonstraram que o produto não apresentou efeito profilático, embora tenha retardado o surgimento de febre e mortalidade em apenas uma estirpe e não em duas outras de AIV. Como experimentos-controle, foi utilizada a droga amantidina, bem estabelecida como antiviral para influenza, cujos resultados foram inibição da febre e mortalidade em aves desafiadas via intratraqueal. A aplicação e ação local de drogas antivirais não impede a disseminação do vírus para sítios não atingidos pela droga (McCauley et al., 1994; Thomas et al., 1994).
Estão atualmente autorizados nos EUA para uso na profilaxia e terapêutica de influenza A o hidrocloreto de amantadina e a rimantadina. A concentração que exerce inibição de formação de placas varia entre 0,2 e 0,4 mg/ml. Ambas drogas agem apΣs a adsorsão viral e antes da replicação primária, e progênie virais resistentes podem ser isoladas in vivo e in vitro. Estipes de alta patogenicidade resistentes à amantidina são transmitidas para hospedeiros sensíveis sem redução da virulência. O mecanismo primário de ação de amantidina e rimantadina é baseado na interrupção do fluxo de íons H dos endossomas acidificados para dentro do vírion, um processo necessário para a liberação do complexo de nucleoproteína e ácido nucléico, que é transportado ao núcleo para transcrição (Murphy & Webster, 1996).
Compostos desenhados podem ter importância no tratamento de influenza. Oligopeptídeos com seqüências de aminoácidos semelhantes ao N-terminal do polipeptídeo HA2 têm atividade antiviral in vitro. Outra estratégia emprega análogos do ácido siálico, os quais diminuem a taxa de replicação dos influenza vírus por impedirem a remoção do ácido neuramínico dos receptores da superfície da célula e do envelope do vírus. O sítio de reação do ácido siálico na NA tem a conformação de uma bolsa para cada uma das quatro subunidades, nas quais os aminoácidos são conservados para todos os influenza vírus (A e B). Dois compostos (4-amino ou 4 guanidino ácido 2-deoxy-2,3 didehidro-D-N-acetilneuraminico e 4-amino ou guanidino-Neu 5Ac2en) são altamente eficientes inibidores da NA de influenza vírus. A e B. Entretanto, a geração de resistência tem sido preocupante, uma vez que a bolsa da NA não parece ser essencial para o substrato natural (ácido siálico) e vírions mutantes sem a cavidade podem eliminar a ação de bloqueio sobre a NA (Lamb & Krug, 1996).
Vírus produzido em células cultivadas na presença de inibidores da neuraminidase não tem a remoção do ácido siálico aderido à HA, NA e receptores da superfície da célula, inibindo a atividade de adsorção do HA do vírus e receptor celular. Algumas drogas são desenhadas com o auxílio de computação gráfica para definir precisamente, por exemplo, os sítios relevantes na associação neuraminidase-ácido siálico (Lamb & Krug, 1996).
- Alexander DJ. Avian Influenza: recent developments. Veterinary Bulletin 1982; 52: 341-359.
- Alexander DJ. A review of avian influenza in different bird species. Veterinary Microbiology 2000; 74(1-2): 3-13.
- Almond JW, Felsenreich V. Phosphorilation of the nucleoprotein of an avian influenza virus. Journal of General Virology 1982; 60: 295-305.
- Avian Influenza Task Force, United States Department of Agriculture, January 16, 1984.
- Anraku MMC, de Fario WC, Takeyama DC. Influenza aviária em aves silvestres brasileiras. I. Inquérito sorológico através da imunodifusão. Revista do Instituto de Medicina Tropical 1971; 13: 292-296.
- Austin FJ, Webster RG. Antigenic mapping of an avian H1 influenza virus haemagglutinin and interrelationships of H1 viruses from humans, pigs and birds. Journal of General Virology 1986; 67: 983-992.
- Banks J, Speidel E, Alexander DJ. Characterisation of an avian influenza A virus isolated from a human - is an intermediate host necessary for the emergence of pandemic influenza viruses? Archives of Virology 1998; 143(4): 781-787.
- Bossart Whitaker P, Carson M, Babu YS, Smith CD, Laver WG, Air GM. Three-dimensional structure of influenza A N9 neuraminidase and its complex with the inhibitory 2-deoxy 2,3-dehydro-N-acetyl neuraminic acid. Journal of Molecular Biology 1993; 232: 1069-1083.
- Boyle DB, Selleck P, Heine HG. Vaccinating chickens against avian influenza with fowlpox recombinants expressing the H7 hemagglutinin. Australian Veterinary Journal 2000: 78: 44-48.
- Brown HH, Harris PA, McCauley JW, Alexander DJ. Multiple genetic reassortment of avian and human influenza A viruses in European pigs, resulting in the emergenceof na H1N2 virus of novel serotype. Journal of General Virology 1998; 79: 2947-2955.
- Capua I, Marangon S. The avian influenza epidemic in Italy, 1999-2000: a review. Avian Pathology 2000; 29: 289-294.
- Capua I, Marangon S, Selli L, Alexander DJ, Swayne DE, Pozza MD, Parenti E, Cancellotti FM. Outbreaks of highly pathogenic avian influenza (H5N2) in Italy during October 1997 to January 1998. Avian Pathology 1999; 28(5): 455-460.
- Cauthern AN, Swayne DE, Schultz-Cherry S, Perdue ML, Suarez DL. Continued circulation in China of highly pathogenic avian influenza viruses encoding the hemagglutinin gene associated with the 1997 H5N1 outbreak in poultry and humans. Journal of Virology 2000; 74(14): 6592-6599.
- Chaves JRS. Ocorrência de influenza em aves selvagens e pássaros ornamentais no Rio de Janeiro. Tese, Fundação Oswaldo Cruz, 1980.
- Chen H, Yu K, Tian G, Tang X, Lu J, Chen HL, Yu KZ, Tian GB, Tang XY, Lu JL.. Protective immune response against avian influenza virus in chicken induced by DNA inoculation. Scientia Agricultura Sinica 1998; 31(5): 63-68.
- Cherian T, Bobo L, Steinhoff MC, Karron RA, Yolken RH. Use of PCR-enzyme immunoassay for identification of influenza A virus matrix RNA in clinical samples negative for cultivable virus. Journal of Clinical Microbiology 1994; 32(3): 623-628.
- Claas EC, Osterhaus AD, van Beek R, De Jong JC, Rimmelzwaan GF, Senne DA., Shortridge KF, Webster RG. Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. Lancet 1998; 351: 472-477.
- Coonrad JD, Karathanasis P, Betts RF, Donofrio JC. Enzyme-linked immunosorbent assay of core antigens for clinical diagnosis of influenza. Journal of Medical Virology 1988; 25: 399-409.
- Couceiro JNSS, Machado RD. Artigo de revisão: Influenza Aviária. Arquivo Fluminense de Medicina Veterinária 1988; 3: 45-52.
- Couceiro JN, Chaves JR., Brandão CT, Machado RD. Isolation and characterization of influenza virus type A in ornamental birds in Rio de Janeiro. Anais de Microbiologia 1982; 27: 159-167
- Cox NJ, Black RA, Kendal AP. Pathways of evolution of influenza A (H1N1) viruses from 1977 to 1986 as determined by oligonucleotide mapping and sequencing studies. Journal of General Virology 1989; 70: 299-313.
- Crawford JM, Garcia M, Stone H, Swayne D, Slemons R, Perdue ML. Molecular characterization of the hemagglutinin gene and oral immunization with a waterfowl-origin avian influenza virus. Avian Diseases 1998; 42: 486-496.
- Crawford J, Wilkinson B, Vosnesensky A, Smith G, Garcia M, Stone H, Perdue ML. Baculovirus-derived hemagglutinin vaccines protect against lethal influenza infections by avian H5 and H7 subtypes. Vaccine 1999; 17(18): 2265-2274.
- Cunha RG, Passos WS, Souza MC. Pathogenicity of equine influenza viruses in chickens. Revista Brasileira de Biologia 1993; 53: 29-36.
- Davison S, Benson CE, Ziegler AF, Eckroade RJ. Evaluation of disinfectants with the addition of antifreezing compounds against nonpathogenic H7N2 avian influenza virus. Avian Diseases 1999; 43: 533-537.
- Davison S, Galligan D, Eckert TE, Ziegler AF, Eckroade RJ. Economic analysis of an outbreak of avian influenza, 1997-1998. Journal of American Veterinary Medicine Association 1999; 214(8): 1164-1167.
- Davison S, Ziegler AF, Eckroade RJ. Comparison of an antigen-capture enzyme immunoassay with virus isolation for avian influenza from field samples. Avian Diseases 1998; 42(4): 791-795.
- De Jong JC, Rimmelzwaan GF, Fouchier RA, Osterhaus AD. Influenza virus: a master of metamorphosis. Journal of Infection 2000; 40: 218-228.
- Doller PC, Doller G, Gerth HJ. Immunofluorescence test with antigen-loaded erythrocytes: detection of influenza virus specific IgG, IgA and IgM antibodies. Medical Microbiology and Immunology (Berlim) 1985; 173: 291-302.
- Donatelli I, Campitelli L, Di Trani L, Puzelli S, Selli L, Fioretti A, Alexander DJ, Tollis M, Krauss S, Webster RG. Characterization of H5N2 influenza viruses from Italian poultry. Journal of General Virology 2001; 82: 623-630.
- Donofrio JC, Coonrad JD, Karathanasis V, Coelingh KV. Electroelution for purification of influenza A matrix protein for use in immunoassay. Journal of Virological Methods 1986; 13: 107-120.
- Drescher J, Verhagen W. Comparative investigation of the hemagglutinin epitopes of influenza virus A/Brazil/11/78 (H1N1) and its escape mutants. Journal of Virological Methods 1993; 42: 75-78.
- Easterday BC, Hinshaw VS. Influenza. In: Diseases of Poultry, 9Ş ed. Editores BW. Calnek HJ Barnes, CW Beard LR. McDougald YM. Saif, Iowa State University Press, Ames, Iowa, EUA, 1991. p. 533-551.
- Easterday BC, Hinshaw Virginia S, Halvorson DA. Influenza. In: Diseases of Poultry, 10Ş ed. Editores B.W. Calnek HJ Barnes, CW Beard LR. McDougald YM. Iowa State University Press, Ames, Iowa, EUA, 1997. p. 583-605.
- Elster C, Fourest E, Baudin F, Larsen K, Cusack S, Ruigrok RWH. A small percentage of influenza virus M1 protein contains zinc but zinc does not influence in vitro M1-RNA interaction. Journal of General Virology 1994; 75: 37-42.
- Fouchier RAM, Bestebroer TM, Herfst S, van der Kemp L, Rimmelzwaan GF, Osterhaus ADME. Detection of Influenza A viruses from different species by PCR amplification of conserved sequences in the matrix gene. Journal of Clinical Microbiology 2000; 38(11): 4096-4101.
- Franciosi C, D'Aprile PN, Alexander DJ, Petek M. Influenza virus infections in commercial turkeys in North East Italy. Avian Pathology 1981; 10: 303-311.
- Garcia M, Crawford JM, Latimer JW, Rivera Cruz E, Perdue ML. Heterogeneity in the haemagglutinin gene and emergence of the highly pathogenic phenotype among recent H5N2 avian influenza viruses from Mexico. Journal of General Virology 1996; 77: 1493-1504.
- Garcia M, Johnson H, Srivastava DK, Jayawardene DA, Wehr DR, Webster RG. Efficacy of inactivated H5N2 influenza vaccines against lethal A/chicken/Queretaro/19/95 infection. Avian Diseases 1998; 42: 248-256.
- Garcia M, Suarez DL, Crawford JM, Latimer JW, Slemons RD, Swayne DE, Perdue ML. Evolution of H5 subtype avian influenza A viruses in North America. Virus Research 1997; 51(2): 115-124.
- Guan Y, Shortridge KF, Krauss S, Li PH, Kawaoka Y, Webster RG. Journal of Virology 1996; 70(11): 8042-8046.
- Heckert RA, Best M, Jordan LT, Dulac GC, Eddington DL, Steritt WG. Efficacy of vaporized hydrogen peroxide against exotic animal viruses. Applied Environmental Microbiology 1997; 63: 3916-3918.
- Hoffmann E, Stech J, Levena Irina, Krauss S, Scholtissek C, San Chin P, Peiris M, Shortridge KF, Webster RG. Characterization of the influenza A virus gene pool in avian species in southern China: was H6N1 a derivative or precursor of H5N1? Journal of Virology 2000; 74(14): 6309-6315.
- Horimoto T, Kawaoka Y. A possible mechanism for selection of virulent avian influenza A viruses in 14-day-old embryonated eggs. Journal of Veterinary Medical Science 1998; 60: 273-275.
- Horimoto T, Kawaoka Y. Pandemic threat posed by avian influenza A viruses. Clinical Microbiology Review 2001; 14: 129-149.
- Horimoto T, Nakayama K, Smeekens SP, Kawaoka Y. Proprotein-processing endoprotein PC6 and furin both activate hemagglutinin of virulent avian influenza viruses. Journal of Virology 1994; 68: 6074-6078.
- Horimoto T, Rivera E, Pearson J, Senne D, Krauss S, Kawaoka Y, Webster RG. Origin and molecular changes associated with emergence of a highly pathogenic H5N2 influenza virus in Mexico. Virology New York, 1995; 213: 223-230.
- Ito T, Gorman OT, Kawaoka Y, Bean WJ, Webster RG. Evolutionary analysis of the influenza A virus M gene with comparison of the M1 and M2 proteins. Journal of Virology 1991; 65: 5491-5498.
- Karasin AI, Brown IH, Carman Suzanne, Olsen CW. Isolation and characterization of H4N6 Avian Influenza viruses from pigs with pneumonia in Canada. Journal of Virology 2000; 74(19): 9322-9327.
- Kida H, Ito T, Shimizu Y, Itakura C, Shortridge KF, Kawaoka Y, Webster RG. Potential for transmission of avian influenza viruses to pigs. Journal of General Virology 1994; 75: 2183-2188.
- Kingsbury DW. Orthomyxoviridae and their replication. In: Virology, Second Edition, Edited by Fields BN, Knipe DM, Raven Press, New York, 1990.
- Klenk HD, Garten W. Host cell proteases controlling virus pathogenicity. Trends in Microbiology 1994; 2: 39-43.
- Klenk HD, Rott R, Orlich M, Blodorn J. Activation of influenza A viruses by trypsin treatment. Virology 1975; 68: 426-439.
- Kobasa D, Rodgers ME, Wells K, Kawaoka Y. Neuraminidase hemadsorption activity, conserved in avian influenza A viruses, does not influence viral replication in ducks. Journal of Virology 1997; 71: 6706-6713.
- Kodihalli S, Goto H, Kobasa DL, Krauss S, Kawaoka Y, Webster RG. DNA Vaccine Encoding Hemagglutinin Provides Protective Immunity against H5N1 Influenza Virus Infection in Mice. Journal of Virology 1999; 73: 2094-2098.
- Lamb RA & Krug RM. Orthomyxoviridae: The Viruses and Their Replication. In: Fields Virology, Ed. BN, Fields DM, Knipe PM. Howley, 3Ş ed., Lippincott Raven Publishers, Philadelphia, 1996. p. 1353-1395.
- Lamb RA, Zebedee SL, Richardson CD. Influenza virus M2 protein is an integral membrane protein expressed on the infected-cell surface. Cell 1985; 40: 627-633.
- Lasley FA. Economics of avian influenza: Control vs noncontrol. Proc 2nd International Symposium Avian Influenza 1986, University of Wisconsin, Madison, 1987. p. 390-399.
- Lin X, Zhao Z, Tian G, Chen W, Chen P, Yu K, Lin XM, Zhao ZL, Tian GB, Chen WF, Chen PY, Yu KZ. Comparison of sensitivity among indirect ELISA, haemagglutinin inhibition (HI) and AGP tests for detecting antibodies against avian influenza A virus in chickens. Chinese Journal of Veterinary Science 1998; 18(5): 454-456.
- Loza RE, Diosdado VF, Hernandez MA, Banda RVM, Morilla GA, Garcia GJ. Serological diagnosis of avian influenza using a microimmunodiffusion in agar technique. Tecnica Pecuaria en Mexico 1997; 35(3): 165-169.
- Mancini G, Donatelli I, Arangio Ruiz G, Rozera C, Macchia T. Comparison of haemagglutination-inhibition and single radial haemolysis techniques for detecting antibodies to influenza A and B viruses. Journal of Hygiene (London) 1983; 91: 157-162.
- Marakova KS, Wulf Yul, Tereza EP, Ratner VA. Different patterns of molecular evolution of influenza A viruses in avian and human populations. Genetika 1998; 34(7): 890-896.
- Marakova NV, Kaverin NV, Krauss S, Senne D, Webster RG. Transmission of Eurasian avian H2 influenza virus to shore birds in North America. Journal of General Virology 1999; 80: 3167-3171.
- Matrosovich M, Zhou N, Yoshihiro K, Webster R. The surface glycoproteins of H5 influenza viruses isolated from humans, chickens, and wild aquatic birds have distinguishable properties. Journal of Virology 1999; 73: 1146-1155.
- Matrosovich M, Tuzikov A, Bovin N, Gambaryan Alexandra, Klimov A, Castrucci Maria R, Donatelli Isabella, Kawaoka Y. Early alterations of the receptor-binding properties of H1, H2 and H3 avian influenza virus hemaglutinins after their introduction into mammals. Journal of Virology 2000; 74: 8502-8512.
- McCauley JW, Pullen LA, Penn CR, Forsyth M, Thomas GP. The effect of 4-guanidino-neu5Ac2en on the replication of avian influenza viruses in vitro and its effects in vivo on infection of chickens with highly pathogenic avian influenza virus. Abstracts, 9th International Conference on Negative Strand Viruses, Estoril, 1994. p. 170, 259.
- Messias EL, Cordeiro NF, Sampaio JJ, Bartko JJ, Kirkpatrick B. Schizophrenia and season of birth in a tropical region: relation to rainfall. Schizophrenia Research 2001; 48: 227-234.
- Mo IP, Brugh M, Fletcher OJ, Rowland GN, Swayne DE. Comparative pathology of chickens experimentally inoculated with avian influenza viruses of low and high pathogenicity. Avian Diseases 1997; 41: 125-136.
- Morishita TY, McFadzen ME, Mohan R, Aye PP, Brooks DL. Serologic survey of free-living nestling prairie falcons (Falco mexicanus) for selected pathogens. Journal of Zoological and Wildlife Medicine 1998; 29: 18-20.
- Moriuchi H, Oshima T, Komatsu S, Katsushima N, Kitame F, Nakamura K, Numazaki Y. The herald waves of influenza virus infections detected in Sendai and Yamagata cities in 1985-1990. Microbiology and Immunology 1991; 35: 375-388.
- Mounts AW, Kwong H, Izureta HS, Ho Y, Au T. Lee M, Buxton BC, Williams SW, Mak KH, Thompson WW, Cox NJ, Fukuda K. Case-control study of risk factors for avian influenza A (H5N1) disease, Hong Kong, 1997. Journal of Infectious Diseases 1999; 180: 505: 508.
- Muhammad K, Muneer MA, Yaqub T. Isolation and characterization of avian influenza virus from an outbreak in commercial poultry in Pakistan. Pakistan Veterinary Journal 1997; 17(1): 6-8.
- Murphy TM. The control of avian influenza in Ireland. Proc. 2nd Int Symp Avian Influenza, Athens, Georgia, EUA, 1987. p. 39-50.
- Murphy BR, Webster RG. Orthomyxoviruses. In: Fields Virology, Editores B.N. Fields, DM Knipe, PM Howley, Lippincott Raven Publishers, Philadelphia, 1996. p. 1397-1445.
- Naeem K, Ullah A, Manvell RJ, Alexander DJ. Avian influenza A subtype H9N2 in poultry in Pakistan. Veterinary Record 1999; 145(19): 560.
- Naim HY, Roth MG. Basis for selective incorporation of glycoproteins into the influenza virus envelope. Journal of Virology 1993; 67: 4831-4841.
- Nascimento JP, Krawczuk MM, Marcopito LF, Baruzzi RG. Prevalence of antibody against influenza A viruses in the Kren-Akorore, an Indian tribe of Central Brazil, first contacted in 1973. Journal of Hygiene (London) 1985; 95: 159-164.
- OIE Bulletin - November-December 1997. [International disease statistics]. Office International des Epizooties. Bulletin Office International des Epizooties 1997; 109(6): 551-576.
- Panigrahy B, Senne DA, Pedersen JC, Shafer AL, Pearson JE. Susceptibility of pigeons to avian influenza. Avian Diseases 1996; 40: 600-604.
- Papparella V, Fioretti A, Menna LF. The epidemiological situation of avian influenza in Italy from 1990 to 1993 in feral bird populations and in birds in quarantine. In Proceedings of the Joint First Annual Meetings of the National Newcastle Disease and Avian Influenza Laboratories of Countries of the European Communities, 5-6 October 1993, p. 19-21. Brussels, Belgium, 1994.
- Papparella V, Fioretti A, Menna LF. The epidemiological situation of avian influenza in Italy from 1990 to 1993 in feral bird populations and in birds in quarantine. In Proceedings of the Joint First Annual Meetings of the National Newcastle Disease and Avian Influenza Laboratories of Countries of the European Communities, 18-19 October 1994, p. 14-15. Brussels, Belgium, 1995.
- Perdue ML, Garcia M, Beck J, Brugh M, Swayne DE. An arg-lys insertion at the hemagglutinin cleavage site of an H5N2 avian influenza isolate. Virus Genes 1996; 12(1): 77-84.
- Perdue ML, Garcia M, Senne D, Fraire M. Virulence-associated sequence duplication at the hemagglutinin cleavage site of avian influenza viruses. Virus Research 1997; 49: 173-186.
- Perkins LE, Swayne DE. Pathobiology of A/chicken/Hong Kong/220/97 avian influenza virus in seven gallinaceous species. Veterinary Pathology 2001; 38: 149-164.
- Pfitzer S, Verwoerd DJ, Gerdes GH, Labuschagne AE, Erasmus A, Manvell RJ, Grund C. Newcastle disease and avian influenza A virus in wild waterfowl in South Africa. Avian Diseases 2000; 44: 655-660.
- Piccirillo A, Calabria M, Baiano A, Marotta G, Fioretti A. Indagine sulla presenza di virus influenzali aviari in fagiani allevati intensivamente. (Avian influenza viruses in pheasants reared under intensive condition. A virological investigation.). XXXVII Convegno della Societa Italiana di Patologia Aviare, Flori, Italy, 1-2 October 1998. Selezione Veterinaria 1999; (8-9): 663-668.
- Projeto de Vigilância Ativa da Doença de Newcastle e da Influenza Aviária, Manual de Procedimentos Operacionais, Versão Preliminar, Programa Nacional de Sanidade Avícola, Coordenação de Vigilância e Programas Sanitários, Departamento de Defesa Animal, Secretaria de Defesa Agropecuária, Ministério da Agricultura e Abastecimento, Brasília, 2001.
- Portaria nş 182 de 08/11/1984, da Secretaria de Defesa Agropecuária do Ministério da Agricultura, Diário Oficial da União, Brasília, 1994.
- Poss PE, Halvorson DA, Karunakaran D. Economic impact of avian influenza in domestic fowl in the United States. Proc 1st International Symposium Avian Influenza 1981, Carter Comp. Corp., Richmond, USA, 1982. p. 100-111.
- Proceedings 98th Annual Meeting of the US Animal Health Association 1994. Report of the Committee on Transmissible Diseases of Poultry and Other Avian Species Spectrum Press, Richmond, VA, 1994. p. 522.
- Ramadan PA, Araujo FB, Ferreira M. A 12-month follow-up of an influenza vaccination campaign based on voluntary adherence: report on upper-respiratory symptoms among volunteers and non-volunteers. São Paulo Medical Journal 2001; 119: 142-145.
- Reading PC, Miller Joanna L, Anders Margot. Involvement of the Mannose Receptor in Infection of Macrophages by Influenza Virus. Journal of Virology 2000; 74: 5190-5197.
- Resende M. Comparative Pathogenesis of Virulent and Avirulent Avian Influenza Viruses in Turkeys. PhD Thesis, University of Wisconsin Madison, WI, 1980. 131p.
- Resende JS, Oliveira RL, Jorge MA, Resende M. Influenza A Antibodies in Broilers in Brazil after American Outbreaks of 1983-1984. Arquivo Brasileiro de Medicina Veterinária e Zootecnia 1990; 42: 453-454.
- Rimmelzwaan GF, Claas EC, van Amerongen G, de Jong JC, Osterhaus AD. ISCOM vaccine induced protection against a lethal challenge with a human H5N1 influenza virus. Vaccine 1999; 17: 1355-1358.
- Santos DE, Cardias CA, Mello WA. Seroepidemiological survey for influenza virus in Belém, Pará, Brazil, 1992-1993. Cadernos de Saúde Pública 1997; 13: 119-125.
- Schweiger B, Zadow I, Hecker R, Timm H, Pauli G. Application of a fluorogenic PCR assay for typing and subtyping of influenza viruses in respiratory samples. Journal of Clinical Microbiology 2000; 8(4): 1552-1558.
- Selleck PW, Gleeson LJ, Hooper PT, Westbury HA, Hansson E. Identification and characterisation of an H7N3 influenza A virus from an outbreak of virulent avian influenza in Victoria. Australian Veterinary Journal 1997; 75(4): 289-292.
- Sekellick MJ, Carra SA, Bowman A, Hopkins DA, Marcus PI. Transient resistance of influenza virus to interferon action attributed to random multiple packaging and activity of NS genes. Journal of Interferon and Cytokine 2000; 20: 963-970.
- Seo SH, Webster R. Cross-reactive, cell-mediated immunity and protection of chickens from lethal H5N1 influenza virus infection in Hong Kong poultry markets. Journal of Virology 2001; 75(6): 2516-2525.
- Shafer AL, Katz JB, Eernisse KA. Development and validation of a competitive enzyme-linked immunosorbent assay for detection of type A influenza antibodies in avian sera. Avian Diseases 1998; 42: 28-34.
- Sharp GB, Kawaoka Y, Jones DJ, Bean WJ, Prior SP, Hinshaw V, Webster RG. Coinfection of wild ducks by influenza A viruses: distribution patterns and biological significance. Journal of Virology 1997; 71(8): 6128-6135.
- Shordridge KF, Gao P, Guan Y, Ito T, Kawaoka Y, Markwell D, Takada A, Webster RG. Interspecies transmission of influenza viruses: H5N1 virus and a Hong Kong SAR perspective. Veterinary Microbiology 2000; 74: 141-147.
- Silvano FD, Kanata Y, Takeuchi M, Shimada A, Otsuki K, Umemura T. Avian influenza A virus induced stunting syndrome-like disease in chicks. Journal of Veterinary Medical Science 1997; 59: 205-207.
- Smirnov IA, Lipatov AS, Okuno I, Gitel'man AK. A common antigenic epitope in influenza A virus (H1, H2, H5, H6) hemaglutinin. Voprosy Virusologü 1999; 44: 111-115.
- Stech J, Xiong X, Scholtissek C, Webster RG. Independence of evolutionary and mutational rates after transmission of avian influenza viruses to swine. Journal of Virology 1999; 73(3): 1878-1884.
- Stone H, Mitchell B, Brugh M. In ovo vaccination of chicken embryos with experimental Newcastle disease and avian influenza oil-emulsion vaccines. Avian Diseases 1997; 41: 856-863.
- Suarez DL. Evolution of avian influenza viruses. Veterinary Microbiology, 2000; 74(1-2): 15-27.
- Suarez DL, Garcia Maricarmen Latimer J, Senne D, Perdue M. Phylogenetic analysis of H7 avian influenza viruses isolated from the live bird markets of the northeast United States. Journal of Virology 1999; 73: 3567-3573.
- Suarez DL, Perdue ML, Cox Nancy Rowe T, Bender Catherine Huang J, Swayne DE. Comparisons of highly virulent H5N1 influenza A viruses isolated from humans and chickens from Hong Kong. Journal of Virology 1998; 72(8): 6678-6688.
- Suarez DL, Senne DA. Sequence analysis of related low-pathogenic and highly pathogenic H5N2 avian influenza isolates from United States live bird markets and poultry farms from 1983 to 1989. Avian Diseases 2000; 44: 356-364.
- Suarez DL, Schultz-Cherry S. The effect of eukaryotic expression vectors and adjuvants on DNA vaccines in chickens using an avian influenza model. Avian Diseases 2000; 44: 861-868.
- Subbarao K, Shaw MW. Molecular aspects of avian influenza (H5N1) viruses isolated from humans. Reviews in Medical Virology 2000; 10: 337-348.
- Subbarao K, Klimov A, Katz J, Regnery H, Lim W, Hall H, Perdue M, Swayne D, Bender C, Huang J, Hemphill M, Rowe T, Shaw M, Xu X, Fukuda K, Cox N. Characterization of an avian influenza A (H5N1) virus isolated from a child with a fatal respiratory illness. Science 1997; 279: 324.
- Subbarao EK, London W, Murphy BR. A single aminoacid in the PB2 gene of influenza A virus is determinant of host range. Journal of Virology 1993; 67: 1761-1764.
- Suzuki IT, Suzuki T, Takada A, Horimoto T, Wells K, Kida H, Otsuki K, Kiso M, Ishida H, Kawaoka Y. Recognition of N-glyconeuraminic acid linked to galactose by the alpha2,3 linkage is associated with intestina replication of influenza A virus in ducks. Journal of Virology 2000; 74: 9300-9305.
- Suzuki Y. Receptor sialylsugar chains as determinants of host range of influenza viruses. Nippon Rinsho 2000; 58: 2206-2210.
- Swayne DE. Pathobiology of H5N2 Mexican avian influenza virus infections of chickens. Veterinary Pathology 1997; 34: 557-567.
- Swayne DE, Beck JR, Garcia M, Stone HD. Influence of virus strain and antigen mass on efficacy of H5 avian influenza inactivated vaccines. Avian Pathology 1999; 28: 245-255.
- Swayne DE, Beck JR, Kinney N. Failure of a recombinant fowlpox vaccine containing an avian influenza hemagglutinin gene to provide consistent protection against influenza in chickens preimmunized with a fowl pox vaccine. Avian Diseases 2000a; 44: 132-137.
- Swayne DE, Beck JR, Mickle TR. Efficacy of recombinant fowl poxvirus vaccine in protecting chickens against a highly pathogenic Mexican-origin H5N2 avian influenza virus. Avian Diseases 1997; 41: 910-922.
- Swayne DE, Garcia M, Beck JR, Kinney N, Suarez DL. Protection against diverse highly pathogenic H5 avian influenza viruses in chickens immunized with a recombinant fowlpox vaccine containing an H5 avian influenza hemagglutinin gene insert. Vaccine 2000b; 18: 1088-1095.
- Swayne DE, Perdue ML, Beck JR., Garcia M, Suarez DL. Vaccines protect chickens against H5 highly pathogenic avian influenza in the face of genetic changes in field viruses over multiple years. Veterinary Microbiology 2000c; 74: 165-172.
- Swayne DE, Perdue ML, Garcia M, Rivera Cruz E, Brugh M. Pathogenicity and diagnosis of H5N2 Mexican avian influenza viruses in chickens. Avian Diseases 1997; 41(2): 335-346.
- Swayne DE, Suarez DL. Highly pathogenic avian influenza. Reviews in Science and Technology 2000; 19: 463-482.
- Takada A, Kubori N, Okasaki K, Mimomiya A, Tanaka H, Ozaki H, Itamura S, Nishimura H, Enami M, Tashiro M, Shortridge K, Kida H. Avirulent Avian Influenza Virus as a Vaccine Strain against a Potential Human Epidemic. Journal of Virology 1999; 73: 8303-8307.
- Thomas GP, Forsyth M, Penn CR, McCauley JW. Inhibition of the growth of influenza virus in vitro by 4-guanidino-2,4-dideoxy-N-acetylneuraminic acid. Antiviral Research 1994; 24: 351-356.
- Toniolo Neto J. A história da gripe. ed. Dezembro Editorial, São Paulo, 2001.
- Toro H, Saucedo C, Borie C, Gough RE, Alcaino H. Health status of free-living pigeons in the city of Santiago. Avian Pathology 1999; 28(6): 619-623.
- Villegas P. Viral diseases of the respiratory system. Poultry Science 1998; 77: 1143-1145.
- Walker JA, Kawaoka Y. Importance of conserved aminoacids at the cleavage site of the haemagglutinin of a virulent avian influenza A virus. Journal of General Virology 1993; 74: 311-314.
- Walker JA, Molloy SS, Thomas G, Sakagushi T, Yoshida T, Chambers TM, Kawaoka Y. Sequence specificity of furin, a proprotein-processing endoprotease, for the hemagglutinin of a virulent avian influenza virus. Journal of Virology 1994; 67: 1213-1218.
- Walls HH, Harmon MW, Slagle JJ, Stocksdale C, Kendal AP. Characterization and evaluation of monoclonal antibodies developed for typing influenza A and B viruses. Journal of Clinical Microbiology 1986; 23: 240-245.
- Ward CW, Webster RG, Inglis AS, Dopheide TA. Composition and sequence studies show that A/duck/Ukraine/1/63 haemagglutinin (Hav7) belongs to the Hong Kong (H3) subtype. Journal of General Virology 1981; 53: 163-168.
- Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y. Evolution and ecology of influenza A viruses Microbiology Reviews 1992; 56(1): 152-179.
- Webster RG, Morita M, Pridgen C, Tumova B. Ortho and paramyxoviruses from migrating feral ducks: characterization of a new group of influenza viruses. Journal of General Virology 1976; 32: 217-225.
- Wei Hua, Wei H. The present status of the poultry industry in Guangdong Province. Poultry Husbandry and Disease Control 1998; 10: 8.
- Whiteman CE, Bickford AA. Avian Diseasesease Manual, American Association of Avian Pathologists, Texas, EUA, 1979.
- Wiley DC, Skehel JJ. Viral Membranes. In: Virology, Ed. B.N. Fields, D.M. Knipe, P.M. Howley, 2Ş ed., Raven Press, New York, 1990. p. 63-85.
- Woolcock PR, Shivaprasad HL, De Rosa M. Isolation of avian influenza virus (H10N7) from an emu (Dromaius novaehollandiae) with conjunctivitis and respiratory disease. Avian Diseases 2000; 44: 737-744.
- Wood GW, Banks J, Brown IH, Strong I, Alexander DJ. The nucleotide sequence of the HA1 of the haemagglutinin of an H1 avian influenza virus isolate from turkeys in Germany provides additional evidence suggesting recent transmission from pigs. Avian Pathology 1997; 26: 347-355.
- Wood GW, Banks J, Strong I, Parsons G, Alexander DJ. An avian influenza virus of H10 subtype that is highly pathogenic for chickens, but lacks multiple basic amino acids at the haemagglutinin cleavage site. Avian Pathology 1996; 25(4): 799-806.
- Yasuda J, Nakada S, Kato A, Toyoda T, Ishihama A. Molecular assembly of influenza virus: association of the NS2 protein with virion matrix. Virology 1993; 196: 249-255.
- Yasui H, Nagaoka N, Hayakawa K. Augmentation of anti-influenza virus hemaglutinin antibody production by Peyer's patch cells with Bifidobacterium breve YIT4064. Clinical Diagnostic Laboratory Immunology 1994; 1: 244-246.
- Yasuda J, Shortridge KF, Shimizu Y, Kida H. Molecular evidence for a role of domestic ducks in the introduction of avian H3 influenza viruses to pigs in southern China, where the A/Hong Kong/68 (H3N2) strain emerged. Journal of General Virology 1991; 72: 2007-2010.
- Zambon MC. Epidemiology and pathogenesis of influenza. Journal of Antimicrobial Chemotherapy 1999; 44(supl. B): 3-9.
- Zhang DeLing, Jia JunYuan, Chen FuWang, Wei WanRen, Zhang ChengHu, Wu LianHua, Zhang DL, Jia JY, Chen FW, Wei WR, Zhang CH, Wu LH. Serological investigation of 16 infectious diseases in rare birds in the Lanzhou area. Chinese Journal of Veterinary Medicine 1996; 22(6): 22.
- Zhou EM, Chan M, Heckert RA, Riva J, Cantin MF. Evaluation of a competitive ELISA for detection of antibodies against avian influenza virus nucleoprotein. Avian Diseases 1998; 42: 517-522.
- Zhou EM, Chan M, McIsaac M, Heckert. Evaluation of antibody responses of emus (Droamius novaehollandiae) to avian infectious influenza virus infection. Avian Diseases 1998; 42: 757-761.
- Zhou NN, Senne DA, Landgraf JS, Swenson SL, Erickson G, Rossow K, Liu L, Yoon K, Krauss S, Webster RG. Genetic reassortment of avian, swine and human influenza A viruses in american pigs. Journal of Virology 1999a; 73(10): 8851-8856.
- Zhou NN, Shortridge KF, Claas ECJ, Krauss SL, Webster RG. Rapid evolution of H5N1 influenza viruses in chickens in Hong Kong. Journal of Virology 1999b; 73(4): 3366-3374.
- Zhu CG, Li YM, Zhu CG, Li YM. Diagnosis and management of an outbreak of avian influenza in exotic birds. Chinese Journal of Veterinary Medicine 1996; 22(1): 20.
Datas de Publicação
-
Publicação nesta coleção
16 Ago 2002 -
Data do Fascículo
Maio 2001