Resumos
Apesar da introdução da quelação parenteral de ferro com desferoxamina há mais de trinta anos, 50% dos pacientes com talassemia major morrem antes dos 35 anos de idade, predominantemente por insuficiência cardíaca secundária a sobrecarga de ferro. Embora a desferrioxamina, possa reduzir ou estabilizar o acúmulo de ferro no corpo, um grande número de pacientes não recebe terapia adequada com este quelante devido principalmente à intolerância a um regime que requer administração parenteral prolongada, cinco a sete dias por semana. Para esses pacientes, a deferiprona, um quelante oralmente ativo, surge com uma alternativa de tratamento para o controle da sobrecarga de ferro. Um grande número de estudos clínicos demonstraram a segurança e eficácia da deferiprona. Estima-se que mais de 6 mil pacientes com sobrecarga de ferro já tenham sido tratados com este quelante, com alguns pacientes tomando a droga por mais de dez anos. A quantidade de ferro excretada induzida pela deferiprona é diretamente influenciada pela dose da droga e pelo grau de sobrecarga de ferro do paciente. Recentemente, demonstrou-se que desferrioxamina e deferiprona exibem capacidades quelantes diversas e que, usados simultaneamente ou numa terapia sequencial, promovem uma excreção de ferro adicional ou sinérgica com rápida redução na carga de ferro do corpo. Pela primeira vez é possível considerar esquemas de quelação individualizados baseados nas necessidades individuais de cada paciente.
Deferiprona; desferrioxamina; talassemia; quelação
Despite the introduction of the parenteral iron chelator desferrioxamine more than 30 years ago, 50% of patients with thalassemia major die before the age of 35 years, predominantly due to iron-induced heart failure. Although desferrioxamine can reduce or stabilize the iron load, many patients still do not receive adequate chelation mainly due to its cumbersome mode of administration which impairs the compliance with the regime of repeatedly subcutaneous infusions. For these patients, the orally active iron chelator deferiprone is an attractive alternative to control the overloaded iron. It has been estimated that more than six thousands patients have already been treated with deferiprone, with some of them taking the chelator for 10 years or more. The deferiprone-induced iron excretion is directly related to the dose of deferiprone and the patient's iron load. In most of transfusion-dependent patients, a dose of 75 mg/kg/day is sufficient to offset the transfusional iron-load. Recently, it has been demonstrated that desferrioxamine and deferiprone exhibit different chelating capabilities for the removal of iron from the various body iron pools and that the use of both chelators promote an additive or synergistic iron excretion with rapid reduction in the body iron load. It now is possible to consider tailor-made chelation regimens based on individual patient needs.
Deferiprone; desferrioxamine; thalassemia; iron chelation
REVISÃO
Terapia quelante oral com deferiprona em pacientes com sobrecarga de ferro
Oral iron chelator therapy with deferiprone in patients with overloaded iron
Antonio Fabron JrI; Fernando TrictaII
IMédico Doutor da Disciplina de Hematologia e Hemoterapia da Faculdade de Medicina de Marília-SP Brasil
IIDiretor Médico, Apotex Research Inc. Toronto Canadá
Endereço para correspondência Endereço para correspondência Fernando Tricta Apotex Research Inc. 150 Signet Drive Weston, ON Canada M9L 1T9 Fone/FAX: (416) 407-0332 - E-mail: ftricta@apotex.com
RESUMO
Apesar da introdução da quelação parenteral de ferro com desferoxamina há mais de trinta anos, 50% dos pacientes com talassemia major morrem antes dos 35 anos de idade, predominantemente por insuficiência cardíaca secundária a sobrecarga de ferro. Embora a desferrioxamina, possa reduzir ou estabilizar o acúmulo de ferro no corpo, um grande número de pacientes não recebe terapia adequada com este quelante devido principalmente à intolerância a um regime que requer administração parenteral prolongada, cinco a sete dias por semana. Para esses pacientes, a deferiprona, um quelante oralmente ativo, surge com uma alternativa de tratamento para o controle da sobrecarga de ferro. Um grande número de estudos clínicos demonstraram a segurança e eficácia da deferiprona. Estima-se que mais de 6 mil pacientes com sobrecarga de ferro já tenham sido tratados com este quelante, com alguns pacientes tomando a droga por mais de dez anos. A quantidade de ferro excretada induzida pela deferiprona é diretamente influenciada pela dose da droga e pelo grau de sobrecarga de ferro do paciente. Recentemente, demonstrou-se que desferrioxamina e deferiprona exibem capacidades quelantes diversas e que, usados simultaneamente ou numa terapia sequencial, promovem uma excreção de ferro adicional ou sinérgica com rápida redução na carga de ferro do corpo. Pela primeira vez é possível considerar esquemas de quelação individualizados baseados nas necessidades individuais de cada paciente.
Palavras-chave: Deferiprona; desferrioxamina; talassemia; quelação.
ABSTRACT
Despite the introduction of the parenteral iron chelator desferrioxamine more than 30 years ago, 50% of patients with thalassemia major die before the age of 35 years, predominantly due to iron-induced heart failure. Although desferrioxamine can reduce or stabilize the iron load, many patients still do not receive adequate chelation mainly due to its cumbersome mode of administration which impairs the compliance with the regime of repeatedly subcutaneous infusions. For these patients, the orally active iron chelator deferiprone is an attractive alternative to control the overloaded iron. It has been estimated that more than six thousands patients have already been treated with deferiprone, with some of them taking the chelator for 10 years or more. The deferiprone-induced iron excretion is directly related to the dose of deferiprone and the patient's iron load. In most of transfusion-dependent patients, a dose of 75 mg/kg/day is sufficient to offset the transfusional iron-load. Recently, it has been demonstrated that desferrioxamine and deferiprone exhibit different chelating capabilities for the removal of iron from the various body iron pools and that the use of both chelators promote an additive or synergistic iron excretion with rapid reduction in the body iron load. It now is possible to consider tailor-made chelation regimens based on individual patient needs.
Key words: Deferiprone; desferrioxamine; thalassemia; iron chelation.
Introdução
A terapia quelante de ferro é indispensável para a sobrevida de pacientes com hemosiderose secundária a transfusões de hemácias.1-3 Até recentemente, somente um quelante de ferro, a desferrioxamina (DFO), estava disponível para o tratamento clínico destes pacientes. A eficácia e segurança do uso da DFO, bem como sua eficácia em aumentar a sobrevida em pacientes com acúmulo de ferro, tem sido bem documentada durante as últimas duas décadas.4-6 Entretanto, muitos pacientes não toleram as infusões por via subcutânea ou endovenosa de DFO, por 8 a 12 horas, pelo menos cinco dias por semana.7-9 Além disso, em muitos pacientes, a DFO provoca irritação no local das infusões, causa anormalidades ósseas e retardo no crescimento, além de efeitos neurotóxicos visuais e auditivos.7-9 A intolerância à terapia quelante é considerada a principal causa de morte em pacientes com acúmulo de ferro, particularmente em pacientes com talassemia maior.1,6,7,10 Uma intensa procura por regimes quelantes menos agressivos11-13 e por quelantes orais vem sendo desenvolvida nas últimas décadas.14 Centenas de quelantes foram desenvolvidos, mas somente a deferiprona demonstrou resultados aceitáveis para seu uso na prática clínica.
A deferiprona (1,2 dimethyl-3-hydroxypyrid-4-one, L1) é um quelante sintético, desenvolvido no King's College de Londres em 1984. Estima-se que mais de 6 mil pacientes com sobrecarga de ferro, a maioria deles com talassemia, já tenham recebido tratamento com deferiprona, com alguns pacientes tomando a droga por dez anos ou mais.10,15-25 Este artigo oferece uma revisão dos recentes estudos clínicos conduzidos com a deferiprona e as novas perspectivas de seu uso na prática clínica.
Farmacocinética
A deferiprona é um agente quelante do ferro ativo oralmente, que quela preferencialmente o cation ferro trivalente (Fe3+), formando um complexo deferiprona/ferro numa proporcão molar de 3:1 (3 deferiprona: 1 ferro), o qual é excretado junto com a droga livre. Estudos em animais mostraram que 92% a 99% da dose de deferiprona administrada por via oral é rapidamente absorvida pelo trato gastrointestinal.26 Esses achados foram confirmados em pacientes com talassemia major onde o pico plasmático da droga foi alcançado entre 45 e 60 minutos após a ingestão e que mais de 90% da dose é eliminada como droga livre em cinco a seis horas após a sua administração.27-29 A ingestão concomitante de alimentos reduz a velocidade de absorção mas não a quantidade de droga absorvida.30,31 Em pacientes com sobrecarga de ferro, aproximadamente 85% da dose de deferiprona ingerida é metabolizada em um conjugado glucoronídeo inativo, que é excretado na urina juntamente com os complexos deferiprona:ferro.28,29 Estudos clínicos mostram que a excreção fecal de ferro corresponde em média a 20% do total eliminado, variando de zero a 60% em alguns pacientes.32-34
Eficácia
A eficácia da deferiprona tem sido avaliada em pacientes com hemosiderose secundária, principalmente naqueles com talassemia major, pela sua capacidade em promover a excreção de ferro, pelo seu efeito nos níveis de ferritina sérica, e no acúmulo de ferro no fígado e no coração.
Excreção de ferro
Estudos clínicos demonstraram a eficácia da deferiprona em induzir a excreção de ferro em pacientes com hemosiderose.15-17,35-37 A quantidade de ferro eliminada é em geral diretamente influenciada pela dose de deferiprona e pelo grau de acúmulo de ferro do paciente.15, 36-39 Estudos metabólicos do balanço de ferro mostraram que 25 mg de deferiprona, três vezes ao dia, promovem excreção de ferro semelhante à excreção promovida por 40 mg de desferrioxamina.22,37,41,43-45 Esta dose promove uma excreção de ferro que neutraliza o ferro introduzido pelas transfusões na maioria dos pacientes em regime transfusional crônico. A excreção urinária de ferro em resposta ao uso de deferiprona não é influenciada pela administração concomitante de vitamina C ou de alimentos.15,27
Ferritina sérica
Novos procedimentos como a ressonância (MRI) e a susceptometria (SQUID) magnética vêm sendo desenvolvidos para a avaliação da concentração do ferro nos diversos órgãos. No entanto, a dosagem da ferritina sérica continua a ser o método diagnóstico mais usado na prática clínica para avaliação do acúmulo de ferro. Devido à variabilidade de seus resultados, uma dosagem única da ferritina sérica tem um valor diagnóstico limitado na avaliação da eficácia de uma terapia quelante.46 Entretanto, dosagens seriadas da ferritina geralmente refletem as alterações da concentração de ferro no fígado e fornecem uma indicação relativamente precisa da eficácia da terapia quelante, indicando se o acúmulo de ferro está estático, aumentando ou diminuindo.40-42 Em adição, o nível da ferritina sérica continua a ser considerado o fator prognóstico mais importante em pacientes com acúmulo de ferro.43,44
Os estudos clínicos com deferiprona demonstram que o seu uso diminui ou estabiliza os níveis de ferritina sérica em pacientes em regime transfusional crônico (Figura 1).42,45-47 Estudos comparativos mostram que a deferiprona tem eficácia semelhante à da DFO.42,48 Similarmente ao que se observa com DFO,49 a intensidade da resposta à deferiprona é diretamente proporcional à dose utilizada e à sobrecarga de ferro ao início do tratamento. Pacientes com carga inicial de ferro mais altas têm os maiores declínios durante o tratamento com deferiprona, enquanto pacientes com sobrecarga menor apresentam uma estabilização ou discreto aumento nos níveis de ferritina sérica.16,45-47 Ceci e colaboradores, estudando 532 pacientes em uso de deferiprona, observaram que pacientes que iniciaram tratamento com níveis de ferritina sérica >4.000mg/l mostraram uma significante e persistente queda na ferritina sérica, ao passo que pacientes que iniciaram tratamento com níveis de ferritina <2.000mg/l não mostraram significantes alterações.47 Em adição, Wonke e colaboradores, mostraram em nove pacientes considerados inadequadamente quelados na dose de 75mg/kg/dia de deferiprona, que um pequeno aumento da dose para 83100 mg/kg/dia ou sua combinação com DFO produziu uma queda significante no nível de ferritina e na concentração hepática de ferro em poucos meses de tratamento e sem novos efeitos colaterais.50
Concentração de ferro hepático
A determinação da concentração de ferro hepático (CFH) tem a vantagem de medir a quantidade de ferro no órgão que apresenta a maior sobrecarga deste mineral, e a sua concentração proporciona uma estimativa relativamente precisa do ferro corpóreo total.51 A CFH pode ser determinada pela dosagem bioquímica de fragmentos hepáticos obtidos por biópsias ou por biosusceptometria magnética (SQUID). Entretanto, devido à inconveniência de biópsias hepáticas repetidas e à reduzida disponibididade do SQUID (só quatro aparelhos, dois nos EUA e dois na Europa estão atualmente ativos para uso clínico), poucos estudos utilizaram determinações seqüenciais da CFH para avaliar o efeito da terapia quelante com desferrioxamina ou com deferiprona. Em adição, a CFH avaliada em fragmentos de biópsia pode apresentar grande variabilidade, que pode dificultar a interpretação do efeito quelante em alguns pacientes. Essa variabilidade pode ser explicada por fatores tais como o tamanho inadequado das amostras obtidas pelas biópsias e pela distribuição heterogênea do ferro no parênquima hepático, particularmente na presença de severa fibrose ou cirrose.52-55 Mais recentemente, vem se tentando avaliar a CFH com o uso de ressonância magnética (MRI).
Os estudos que avaliaram a CFH durante tratamento com a deferiprona mostram resultados semelhantes aos da ferritina sérica, com sua diminuição ou estabilização apesar do contínuo acúmulo do ferro transfusional (Tabela 1).24,41,42,56,57 Em um dos estudos, os autores compararam a eficácia da deferiprona e da DFO na mudança da CFH, avaliada através de biópsias hepáticas, em pacientes com talassemia major.42 Os autores mostraram que a deferiprona e a DFO foram igualmente eficazes na diminuição dos níveis de ferro hepático.
Ferro cardíaco
Uma vez que a doença cardíaca é responsável pela maioria das mortes de pacientes com talassemia major (78%), a redução da carga de ferro no coração é o componente mais essencial da terapia quelante.58
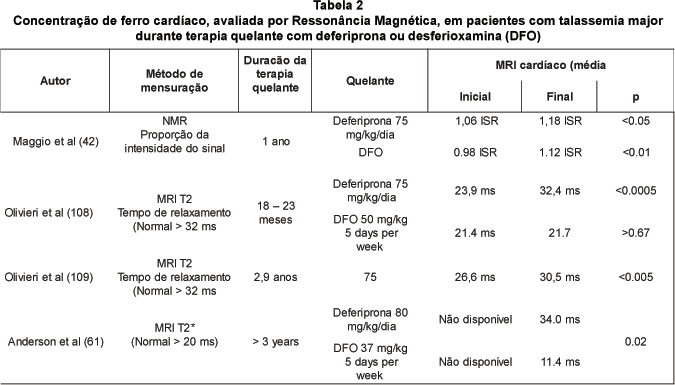
Métodos variados da ressonância magnética têm sido usados para avaliar a carga de ferro no coração. Estes estudos demonstram que a deferiprona é tão eficaz ou superior à DFO na remoção de ferro cardíaco, como mostram os estudos na tabela 2. Maggio e colaboradores compararam a concentração cardíaca de ferro utilizando MRI em 145 pacientes tratados com deferiprona ou DFO.42 Após um ano de estudo, o uso de ambos os quelantes promoveu um aumento semelhante na intensidade do sinal da ressonância magnética, compatível com uma diminuição do ferro cardíaco. Estudos mais longos e com técnicas consideradas mais precisas da ressonância magnética mostram uma maior eficácia da deferiprona na remoção de ferro cardíaco do que o uso da DFO por via subcutânea. Um outro estudo randomizado, que avaliou pacientes tratados com deferiprona ou desferrioxamina por um período médio de 22 meses, mostrou uma melhora significativa no tempo de relaxamento T2, compatível com a redução no ferro cardíaco, em pacientes tratados com deferiprona (T2 inicial = 23,9±6,4 ms; final = 32,4± 9,3 ms; p < 0.0005), mas inalterado nos pacientes tratados com DFO (inicial = 21,4±7,9; final = 21,7 ± 6,9 ms; p > 0.67).59 Numa avaliação de um outro grupo de pacientes recebendo deferiprona por um período mais longo (2,9±1,3 anos), os mesmos autores também observaram uma significativa melhora no tempo de relaxamento T2 no coração (T2 inicial = 26,6±8,4 ms; final = 30,5±6,7 ms; p < 0.005).60
Mais recentemente, um estudo demonstrou que a avaliação de T2* (T2 estrela) é um método promissor para o diagnóstico precoce de sobrecarga de ferro no miocárdio. Os autores avaliaram a concentração de ferro do coração e a função cardíaca em pacientes tratados por pelo menos três anos com a deferiprona ou DFO. A deferiprona foi não somente mais eficaz que a DFO na remoção de ferro do coração como também na melhora da função cardíaca.61 Pennel & Bland demonstraram que o T2* tem melhor efeito preditivo da disfunção ventricular que a ferritina sérica ou a concentração hepática de ferro.62
Outra indicação da maior eficácia da deferiprona em relação à DFO na redução do ferro cardíaco foi demonstrada num estudo retrospectivo que comparou a ocorrência de cardiopatias e a sobrevida em pacientes com talassemia major tratados com deferiprona ou DFO, por um período mínimo de quatro anos em um único centro de tratamento. Ao final do período de estudo, a incidência de cardiopatias nos pacientes tratados com deferiprona foi quatro vezes menos freqüente que nos pacientes tratados com DFO (p = 0.007). Os três pacientes que morreram devido a insuficiência cardíaca durante o período de estudo haviam sido tratados somente com DFO.63
O mecanismo do aparente melhor efeito cardioprotetor da deferiprona pode ser devido à sua maior lipofilicidade e menor peso molecular que a DFO, o que facilita sua passagem através da membrana celular e uma quelação mais eficaz do ferro intracelular.64
Apesar dos dados globais disponíveis demonstrarem que a eficácia da deferiprona é comparável, se não superior, àquela da DFO na remoção do ferro cardíaco, não se conhece ainda a eficácia da deferiprona em pacientes com falência cardíaca secundária a sobrecarga de ferro. Para estes pacientes, o tratamento recomendado continua a ser a infusão endovenosa contínua com DFO. No entanto, como a infusao endovenosa contínua de DFO não é eficaz em todos os pacientes,65,66 estudos prospectivos são necessários para avaliar se a deferiprona sozinha ou em combinação com a DFO pode aumentar a recuperação de pacientes com falência cardíaca.
Qualidade de vida
Em termos de qualidade de vida, o uso do deferiprona tem sido associado com uma significante melhora na qualidade de vida dos pacientes com talassemia. A troca de infusões subcutâneas diárias de DFO pela deferiprona oral foi associada com uma diminuição no Perfil de Impacto da Doença, de 5,2±7,0 para 2,2±2,3 (p<0.05), consistente com uma melhora na qualidade de vida.67 A melhora na qualidade de vida com a mudança da terapia quelante parenteral para oral foi também demonstrada por Zahed e colaboradores.68
Segurança clínica
A segurança clínica no uso da deferiprona foi avaliada em aproximadamente mil pacientes, alguns deles tratados com este quelante por mais de dez anos.16,20,21,24,42,57,69 Os estudos clínicos identificaram agranulocitose, artralgia, sintomas gastrointestinais e flutuações no nível sérico das enzimas hepáticas como os principais efeitos colaterais da terapia com deferiprona.
Agranulocitose e neutropenia
Agranulocitose transitória (neutrófilos de 0 a 0,5 x 109/l) é a reação adversa mais grave associada com o uso da deferiprona, sendo observada em aproximadamente 1% dos pacientes.20,21,42 A causa de agranulocitose durante o tratamento com deferiprona é incerta.70 Estudos em animais sem sobrecarga de ferro mostraram que a deferiprona tem um efeito dose-dependente na produção medular,71 mas, em humanos, a agranulocitose parece ter uma ocorrência idiossincrática.72,73 Num estudo clínico desenvolvido especificamente para estabelecer a freqüência da agranulocitose, exames de sangue eram realizados semanalmente e, se uma contagem absoluta de neutrófilos abaixo de 1,5 x 109/l era confirmada, a droga era descontinuada. Nesse estudo, a agranulocitose foi diagnosticada em um (0,5%) de 187 pacientes estudados, correspondente a uma incidência de 0,6 por 100 pacientes/anos de terapia.21 Outros estudos confirmaram a baixa freqüência da agranulocitose e a sua resolução após a suspensão da deferiprona ou com o uso de fator de crescimento de granulócitos (G-CSF) em alguns pacientes.20,42,74 Contudo, dois relatos fatais de agranulocitose durante tratamento com deferiprona são descritos na literatura,75,76 enfatizando a necessidade do controle semanal da contagem de neutrófilos em todos os pacientes tratados com a deferiprona até que os fatores de risco para agranulocitose sejam identificados.
Cohen e colaboradores relataram que formas mais leves de neutropenia, transitórias durante o uso da deferiprona, parecem estar mais relacionadas ao hiperesplenismo e a infecções intercorrentes que ao uso do quelante.21 Resultados semelhantes foram descritos por Ceci e colaboradores.20
Embora o número de casos de agranulocitose e neutropenia seja pequeno, a análise desses episódios indica que o baço, em condições de hiperesplenismo, desenvolve um papel importante em determinar a probabilidade de neutropenia em pacientes. Durante quatro anos de avaliação, agranulocitose ou neutropenia leve foi detectada em dois (2,7%) de 74 pacientes esplenectomizados e em 15 (13,3%) de 113 pacientes não esplenectomizados (p = 0.014).77 Neutropenia também tem sido observada em pacientes tratados com DFO.78 Num estudo randomizado com a DFO, 20% dos 36 pacientes tratados com DFO apresentaram contagem de neutrófilos inferior a 1,5 x 109/l.79 Num outro estudo que comparou o uso da DFO com o uso alternado da deferiprona e DFO, episódios de neutropenia foram observados somente em pacientes tratados só com a DFO.80
Apesar da possibilidade de que alguns fatores possam interferir no desenvolvimento de uma baixa contagem de neutrófilos em pacientes com talassemia, a reintrodução da deferiprona em pacientes que desenvolveram agranulocitose não é recomendada. A reintrodução da deferiprona em pacientes com neutropenia leve deve ser considerada com cautela.
Hepatotoxicidade
Alguns pacientes apresentam flutuações nos níveis das transaminases hepáticas, particularmente nos primeiros meses de tratamento com a deferiprona. Num estudo cooperativo internacional, 50 de 84 (59,5%) pacientes apresentaram pelo menos um valor da ALT sérica duas vezes maior que o limite superior do normal, durante os primeiros seis meses de tratamento.16 As alterações nas enzimas hepáticas, em geral, foram leves e transitórias, com elevação persistente em apenas um paciente, o qual voltou a apresentar níveis pré-tratamento após a suspensão da deferiprona. Outros estudos não observaram alteração significativa nos níveis das enzimas hepáticas durante até três anos de terapia com deferiprona.17,20
Um estudo considerou que a deferiprona pudesse estar associada com progressão de fibrose hepática.45 Utilizando biópsias hepáticas seriadas, cinco de 14 pacientes recebendo deferiprona foram considerados ter progressão da fibrose quando comparados a nenhum de um grupo de 12 pacientes tratados com DFO. No entanto, um editorial que acompanhou essa publicação questionou as conclusões, citando algumas diferenças entre os pacientes recebendo os dois quelantes, tais como maiores CFH e média de idade no grupo com deferiprona, tamanhos diferentes das biópsias coletadas e presença de hepatite C em 4/5 pacientes em uso de deferiprona e com progressão da fibrose.81 Progressão de fibrose hepática é um achado freqüente em pacientes com alta CFH, principalmente se coexistir com hepatite C, e já havia sido observada em 25%-35% dos pacientes com talassemia tratados com DFO.82,83 Recentemente, um estudo realizado por Wanless e colaboradores, utilizando biópsias hepáticas seriadas em 58 pacientes com talassemia major, após uma média de 3,1 anos de tratamento com deferiprona, não demonstrou evidência da progressão de fibrose hepática induzida pelo quelante, nem mesmo em pacientes soropositivos para hepatite C,84 confirmando outros estudos menores que também avaliaram a histologia hepática em pacientes tratados com deferiprona.18,85-89
Outros efeitos adversos
Num dos maiores estudos multicêntricos, desenhados para avaliar o perfil de segurança da deferiprona, Cohen e colaboradores avaliaram semanalmente, por até quatro anos, 187 pacientes com talassemia major e verificaram que os efeitos colaterais mais freqüentemente associados com o seu uso são sintomas gastrointestinais, como náusea, vomito e dor abdominal.21,90 Estes sintomas, relatados em 24% dos pacientes, ocorreram mais freqüentemente nas primeiras semanas de terapia, eram de intensidade leve/moderada, e, na maioria dos casos, desaparecem em poucos dias sem necessidade de descontinuação da deferiprona ou redução da sua dose. Sintomas articulares, principalmente artralgia nas grandes articulações, foram observados em 13% dos pacientes, uma freqüência semelhante à relatada com o uso da DFO.91 A artralgia geralmente desaparece após temporária descontinuação da droga ou redução da dose, com uma duração média de 12 dias.20 A causa das manifestações articulares durante a terapia com deferiprona permanece obscura, não tendo sido encontrada alteração laboratorial indicativa de etiologia auto-imune ou relativa à gravidade do acúmulo de ferro.21,74
Poucos estudos avaliaram se a deferiprona provoca perda auditiva em pacientes com auscuta normal. Uma progressão da capacidade auditiva foi observada durante terapia com deferiprona em cinco de nove pacientes que haviam iniciado este quelante devido a perda auditiva anteriormente provocada pela DFO.92
Em contraste com a DFO, que é um sideróforo microbiano e que pode ser usada pela Y. entrocolitica para a aquisição de ferro para sua multiplicação, a deferiprona é um quelante de ferro sintético que não favorece septicemia por Y. entrocolitica.93 A aumentada incidência de infecção por Y. entrocolitica em pacientes com sobrecarga de ferro é bem reconhecida, particularmente em pacientes recebendo DFO como terapia quelante.94,95 Ao contrário da DFO, quelantes sintéticos como a deferiprona podem inibir o crescimento bacteriano pela remoção do ferro dos siderófilos, ou por bloquear a captação do ferro mediada pelo sideróforo.96 Consistente com os estudos in vitro e em animais, raros episódios de infecção por Y. entrocolitica têm sido relatados nos últimos nove anos de uso clínico da deferiprona em mais de 6 mil pacientes, a despeito da aumentada predisposição destes pacientes para infecção devido à sobrecarga de ferro.
Terapias alternativas
O reconhecimento que a deferiprona e a DFO têm características diferentes para a quelação do ferro de diversos órgãos do corpo proporciona, pela primeira vez, a possibilidade de se utilizarem regimes quelantes com o uso concomitante ou seqüencial de ambos os medicamentos. Os dados disponíveis indicam que, em doses convencionais, a deferiprona tem acesso preferencial ao ferro cardíaco, e a DFO tem acesso preferencial ao ferro hepático.61 Estudos metabólicos com o uso de ambos os quelantes demonstram que o uso combinado proporciona um efeito aditivo e possivelmente sinérgico na excreção de ferro.34,97 Baseado no exposto acima, regimes combinados de tratamento com DFO e deferiprona estão atualmente sob investigação para otimizar a terapia quelante em pacientes com sobrecarga de ferro.34,50,97-100
A terapia quelante combinada tem sido investigada como uma opção atrativa para aqueles pacientes com intenso acúmulo de ferro ou para aqueles que não atingem uma redução adequada do acúmulo de ferro com o uso isolado da deferiprona ou DFO. Vários estudos têm demonstrado que a terapia combinada está associada com uma redução significativa nos níveis de ferro corporal, sem aparente aumento da freqüência ou intensidade das manifestações colaterais de ambos os quelantes.50,99-103
O uso alternado de ambos os quelantes foi publicado inicialmente por Aydinok e colaboradores, que utilizaram um regime semanal de deferiprona oral, 75 mg/kg por quatro dias, seguido por DFO 40-50 mg/kg subcutânea por dois dias, no tratamento de sete crianças com talassemia major.104 DFO intravenosa, 40-50 mg/kg, era adicionada a cada 3-4 semanas no momento das transfusões. A aceitação desta terapia foi excelente e em seis meses promoveu a redução dos níveis de ferritina sérica de 5.536 mg/l para 3.778mg/l, e do ferro hepático de 26,5 mg/g para 21,1mg/g. Um outro estudo clínico comparou a eficácia e a segurança do uso alternado da deferiprona, 75mg/kg por cinco dias, seguido por dois dias de DFO 33 ± 6 mg/kg em trinta pacientes, com o uso de DFO 38 ± 9 mg/kg, 5-7 dias por semana em outros trinta pacientes durante um ano.80 Ambos os regimes foram igualmente eficazes, e o uso alternado dos quelantes não foi associado a um aumento na incidência de efeitos colaterais.
Discussão
Um grande número de estudos clínicos foi conduzido nos últimos anos para avaliar a segurança e a eficácia da deferiprona como agente quelante do ferro. O grande número de pacientes e o longo período de intenso monitoramento desses pacientes fornece um perfil detalhado e bem documentado da segurança e eficácia do uso prolongado da deferiprona.
Na dose de 75mg/kg/dia, a deferiprona mostrou ser eficaz em estabilizar ou reduzir o acúmulo de ferro nos pacientes submetidos a regime crônico de transfusões. Doses maiores, de até 100 mg/kg por dia de deferiprona promovem uma maior eliminação de ferro e devem ser consideradas para aqueles pacientes com regime transfusional mais intenso ou que não responderam adequadamente à dose de 75 mg/kg/dia. Recentemente, foi demonstrado que a DFO e a deferiprona exibem capacidades diferentes para a quelação e eliminação do ferro de diferentes órgãos do corpo,106,107 e que quando administradas simultaneamente, o efeito na excreção de ferro é aditiva ou mesmo sinérgica em alguns pacientes, com rápida redução na carga de ferro corporal.34,50,97,99,100,102 Estes esquemas podem incluir o uso simultâneo de ambos os quelantes para promover um rápido decréscimo da carga de ferro do corpo, particularmente em pacientes severamente carregados de ferro, ou alternar o uso dos quelantes, aumentando ou diminuindo a freqüência e a dose de cada quelante de acordo com o órgão alvo para a redução do acúmulo de ferro.
Conclusões
Pacientes com acúmulo de ferro secundário a transfusões e que responderam adequadamente ao tratamento com DFO devem ser encorajados a continuar com esse esquema de tratamento. Contudo, a dificuldade em manter a terapia quelante com DFO é amplamente reconhecida.
A deferiprona mostrou ser uma droga que apresenta eficácia comparável, se não superior, àquela das infusões subcutâneas de DFO, principalmente na redução do acúmulo de ferro cardíaco; que seu uso tem sido associado com uma melhora na qualidade de vida dos pacientes e que seus efeitos colaterais são conhecidos, predizíveis, reversíveis e controláveis. Agora é possível considerar esquemas de quelação personalizados, baseado nas necessidades individuais dos pacientes.
79. Tricta F. Randomized trial of deferiprone and deferoxamine in thalassemia major. Manuscrito em preparação.
80. Galanello R, Kattamis C, Piga A, Tricta F. Safety and efficacy of sequential deferiprone and desferrioxamine compared to desferrioxamine alone in the treatment of iron overload in thalassemia major patients. Manuscrito em preparação.
Recebido: 07/05/2003
Aceito após modificações: 20/06/2003
Avaliação: Participou como editor associado Prof. Dr. Reinaldo Azoubel e mais dois revisores externos.
Conflito de interesse: O autor Fernando Tricta é diretor médico da companhia Apotex Research Inc., Toronto, Canada, responsável pelo desenvolvimento do produto farmacêutico e declarou que o autor Antonio Fabron Jr. não é funcionário da empresa farmacêutica nem recebeu auxílio ou proventos de qualquer espécie para a elaboração deste manuscrito.
- 1. Modell B. Thalassemia and Desferal. In: Gross K, Aumiller J, Gelzer J, editors. Desferrioxamine History, Clinical Value, Perspectives. 1992. 37-44.
- 2. Zurlo MG, De Stefano P, Borgna-Pignatti C, Di Palma A, Piga A, Melevendi C et al. Survival and causes of death in thalassaemia major. Lancet 1989;2(8653): 27-30.
- 3. Borgna-Pignatti C, Rugologgo S, De Stefano P, Piga A, et al. Survival and disease complications in thalassemia major. Ann N Y Acad Sci 1998;850:227-31.
- 4. Borgna-Pignatti C, Zurlo MG, De Stefano P, Di Gregorio F, Di Palma A, Piga A et al. Survival in thalassemia with conventional treatment. Prog Clin Biol Res 1989; 309: 27-33.
- 5. Olivieri NF, Brittenham GM. Iron-chelating therapy and the treatment of thalassemia. Blood 1997;89(3):739-61.
- 6. Gabutti V, Piga A. Results of long-term iron-chelating therapy. Acta Haematol 1996;95:26-36.
- 7. Olivieri NF. Long-term therapy with deferiprone. Acta Haematol 1996;95:37-48.
- 8. Porter JB, Huehns ER. The toxic effects of desferrioxamine. Baillière's Clin Haematol 1989;2(2): 459-74.
- 9. Porter JB. Reasons for the outcome of the desferal questionnaire. TIF News 1996; 17:12.
- 10. Al-Refaie FN, Hoffbrand AV. Oral iron-chelating therapy: The L1 experience. Baillière's Clin Haematol 1994; 7(4):941-63.
- 11. Borgna-Pignatti C, Cohen A. Evaluation of a new method of administration of the iron chelating agent desferrioxamine. J Pediatr 1997;130:86-8.
- 12. Dragsten PR, Hallaway PE, Hanson GJ, Kling PJ, Berger AE, Hedlund BE. First use of a novel high molecular weight iron chelator in humans. Blood 1994;84[No. 10 Suppl. 1], 259a.
- 13. Boturao-Neto E, Marcopito LF, Zago MA. Urinary iron excretion induced by intravenous infusion of deferoxamine in beta-thalassemia homozygous patients. Braz J Med Biol Res 2002;35(11):1.319-28.
- 14. Hoffbrand AV, Wonke B. Iron chelation therapy. J Intern Med 1997;242:37-41.
- 15. Al-Refaie FN, Wonke B, Hoffbrand AV, Wickens DG, Nortey P, Kontoghiorghes GJ. Efficacy and possible adverse effects of the oral iron chelator 1,2-Dimethyl-3-Hydroxypyrid-4-One (L1) in thalassemia major. Blood 1992;80(3):593-99.
- 16. Al-Refaie FN, Hershko C, Hoffbrand AV, Kosaryan M, Olivieri NF, Töndury P et al. Results of long-term deferiprone (L1) therapy: A report by the International Study Group on Oral Iron Chelators. Br J Haematol 1995;91:224-29.
- 17. Olivieri NF, Brittenham GM, Matsui D, Berkovitch M, Blendis LM, Cameron R et al. Iron-chelation therapy with oral deferiprone in patients with thalassemia major. N Engl J Med 1995;332(14):918-22.
- 18. Hoffbrand AV, Al-Refaie FN, Davis B, Siritanakatkul N, Jackson BFA, Cochrane J et al. Long-term trial of deferiprone in 51 transfusion-dependent iron overloaded patients. Blood 1998;91(1):295-300.
- 19. Kersten MJ, Lange R, Smeets MEP, Vreugdenhil G, Roozendaal KJ, Lameijer W et al. Long-term treatment of transfusional iron overload with the oral iron chelator deferiprone (L1): A dutch multicenter trial. Ann Hematol 1996;73(5):247-52.
- 20. Ceci A, Balardi P, Felisi M, Cappellini MD, Carnelli V, De Sanctis V et al. The safety and effectiveness of deferiprone in a large-scale, 3-year study in Italian patients. Br J Haematol 2002;118(1):330-36.
- 21. Cohen AR, Galanello R, Piga A, DiPalma A, Vullo C, Tricta F. Safety profile of the oral iron chelator deferiprone: A multicentre study. Br J Haematol. 2000. 108:305-12.
- 22. Mazza P, Amurri B, Lazzari G, Masi C, Palazzo G, Spartera MA et al. Oral iron chelating therapy. A single center interim report on deferiprone (L1) in thalassemia. Haematologica 1998;83(6):496-501.
- 23. Kontoghiorghes GJ, Agarwal MB, Grady RW, Kolnagou A, Marx JJ. Deferiprone for thalassaemia. Lancet 2000; 356:1.444-45.
- 24. Töndury P, Zimmermann A, Nielsen P, Hirt A. Liver iron and fibrosis during long-term treatment with deferiprone in Swiss thalassaemic patients. Br J Haematol 1998;101(3):413-15.
- 25. Maggio A, D'Amico G, Morabito A, Capra M, Ciaccio C, Cianciulli P et al. Deferiprone versus desferrioxamine in patients with thalassemia major: A randomized clinical trial. Blood Cells, Molecules, and Disease 2002; 28(2):196-208.
- 26. Schnebli HP. Final Report: Preclinical Evaluation of CGP 37 391 (L1). Schnebli HP, editor. ERS 62/93, 2-30. 1993. Ciba Geigy. 1993.
- 27. Matsui D, Klein J, Hermann C, Grunau V, McClelland R, Chung D et al. Relationship between the pharmacokinetics and iron excretion pharmacodynamics of the new oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-one in patients with thalassemia. Clin Pharmacol Ther 1991;50(3):294-98.
- 28. Kontoghiorghes GJ, Goddard JG, Bartlett AN, Sheppard L. Pharmacokinetic studies in humans with the oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-one. Clin Pharmacol Ther 1990;48(3):255-61.
- 29. Al-Refaie FN, Sheppard L, Nortey P, Wonke B, Hoffbrand AV. Pharmacokinetics of the oral iron chelator deferiprone (L1) in patients with iron overload. Br J Haematol 1995;89:403-08.
- 30. Hoffbrand AV. Oral iron chelation. Semin Hematol 1996; 33(1):1-8.
- 31. Al-Refaie FN, Hoffbrand AV. Oral iron chelation therapy. In: Brenner MK, Hoffbrand AV, editors. Recent Advances in Haematology. Edinburgh: Churchill Livingstone. 1993. 185-216.
- 32. Collins AF, Fassos FF, Stobie S, Lewis N, Shaw D, Fry M et al. Iron-balance and dose-response studies of the oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-one (L1) in iron-loaded patients with sickle cell disease. Blood 1994;83(8):2.329-33.
- 33. Kontoghiorghes GJ, Bartlett AN, Hoffbrand AV, Goddard JG, Sheppard L, Barr J et al. Long-term trial with the oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-one (L1). I. Iron chelation and metabolic studies. Br J Haematol 1990;76:295-300.
- 34. Grady RW, Berdoukas VA, Rachmilewitz A, Galanello R, Borgna-Pignatti C, Ladis V et al. Combination of desferrioxamine and deferiprone markedly enhance iron excretion. Blood 2002;100[11] 241a.
- 35. Grady RW, Hilgartner MW, Giardina PJV. Deferiprone: its effectiveness relative to that of desferrioxamine. 6th International Conference on Thalassaemia and the Haemoglobinopathies. Malta 1997:2.
- 36. Agarwal MB, Gupte SS, Viswanathan C, Vasandani D, Ramanathan J, Desai N et al. Long-term assessment of efficacy and safety of l1, an oral iron chelator, in transfusion dependent thalassaemia: Indian trial. Br J Haematol 1992;82:460-66.
- 37. Addis A, Loebstein R, Koren G, Einarson TR. Meta-analytic review of the clinical effectiveness of oral deferiprone (L1). Eur J Clin Pharmacol 1999;55:1-6.
- 38. Kontoghiorghes GJ, Aldouri MA, Sheppard L, Hoffbrand AV. 1,2-dimethyl-3-hydroxypyrid-4-one, an orally active chelator for treatment of iron overload. Lancet 1987; 1(8.545):1.294-95.
- 39. Jaeger M, Aul C, Sohngen D, Germing U, Schneider W. iron overload in polytransfused patients with mds: use of l1 for oral iron chelation. Drugs of Today 1992; 28(Suppl. A):143-47.
- 40. Olivieri NF, Brittenham GM, Matsui D, Berkovitch M, Blendis LM, Cameron R et al. Iron-chelation therapy with oral deferiprone in patients with thalassemia major. N Engl J Med 1995; 332(14):918-22.
- 41. Olivieri NF, Brittenham GM, McLaren CE, Templeton DM, Cameron RG, McClelland RA et al. Long-term safety and effectiveness of iron-chelation therapy with deferiprone for thalassemia major. N Engl J Med 1998; 339(7):417-23.
- 42. Maggio A, D'Amico G, Morabito A, Capra M, Ciaccio C, Cianciulli P et al. Deferiprone versus desferrioxamine in patients with thalassemia major: a randomized clinical trial. Blood Cells, Molecules, and Disease. 2002; 28 (2): 196-208.
- 43. Telfer PT, Prestcott E, Holden S, Walker M, Hoffbrand AV, Wonke B. Hepatic iron concentration combined with long-term monitoring of serum ferritin to predict complications of iron overload in thalassaemia major. Br J Haematol 2000;110(4):971-77.
- 44. Olivieri NF, Nathan DG, MacMillan JH, Wayne AS, Liu P, McGee A et al. Survival in medically treated patients with homozygous beta-thalassemia. N Engl J Med 1994; 331(9):574-78.
- 45. Olivieri NF, Brittenham GM, McLaren CE, Templeton DM, Cameron RG, McClelland RA et al. Long-term safety and effectiveness of iron-chelation therapy with deferiprone for thalassemia major. N Engl J Med 1998; 339(7):417-23.
- 46. Cohen AR, Galanello R, Piga A, DiPalma A, Vullo C, Tricta F. Safety profile of the oral iron chelator deferiprone: A multicentre study. Br J Haematol 2000; 108:305-12.
- 47. Ceci A, Balardi P, Felisi M, Cappellini MD, Carnelli V, De Sanctis V et al. The safety and effectiveness of deferiprone in a large-scale, 3-year study in Italian patients. Br J Haematol 2002. 118(1):330-36.
- 48. Taher A, Sheikh-Taha M, Koussa S, Inati A, Neeman R, Mourad F. Comparison between desferrioxamine and deferiprone (L1) in iron-loaded thalassemia patients. European Journal of Haematology. 2001. 67(1):30-4.
- 49. Gabutti V, Piga A, Luzzatto L, Davico S, Sandri A, Vota MG et al. evaluation of the standard iron chelating treatment. In: Sirchia G, Zanella A, editors. Thalassemia Today - The Mediterranean Experience. Milano: Centro Transfusionale Ospedale Maggiore Policlinico di Milano Editore, 1987. 125-33.
- 50. Wonke B, Wright C, Hoffbrand AV. Combined therapy with deferiprone and desferrioxamine. Br J Haematol 1998;103(2):361-64.
- 51. Angelucci E, Brittenham GM, McLaren CE, Ripalti M, Baronciani D, Giardini C et al. Hepatic iron concentration and total body iron stores in thalassemia major. N Engl J Med 2000;343(5):327-31.
- 52. Ambu R, Crisponi G, Sciot R, Van Eyken P, Parodo G, Iannelli S et al. Uneven hepatic iron and phosphorus distribution in beta-thalassemia. J Hepatol 1995;23: 544-49.
- 53. Overmoyer BA, McLaren CE, Brittenham GM. Uniformity of liver density and nonheme (storage) iron distribution. Arch Pathol Lab Med 1987;111:549-54.
- 54. Villeneuve JP, Bilodeau M, Lepage R, Cote J, Lefebvre M. Variability in hepatic iron concentration measurement from needle-biopsy specimens. J Hepatol 1996;25:172-77.
- 55. Deugnier Y, Turlin B, le Quilleuc D, Moirand R, Loreal O, Messner M et al. A reappraisal of hepatic siderosis in patients with end-stage cirrhosis: practical implications for the diagnosis of hemochromatosis. Am J Surg Pathol 1997;21(6):669-75.
- 56. Taher A, Sheikh-Taha M, Koussa S, Inati A, Neeman R, Mourad F. Comparison between desferrioxamine and deferiprone (L1) in iron-loaded thalassemia patients. Europian Journal of Haematology 2001;67(1):30-34.
- 57. Mazza P, Amurri B, Lazzari G, Masi C, Palazzo G, Spartera MA et al. Oral iron chelating therapy. A single center interim report on deferiprone (L1) in thalassemia. Haematologica 1998;83(6):496-501.
- 58. Borgna-Pignatti C, Rugologgo S, DeStefano P, Piga A, et al. Survival and disease complications in thalassemia major. Ann N Y Acad Sci 1998;850:227-31.
- 59. Olivieri NF, Brittenham GM, Armstrong SAM, Basran RK, Daneman R, Daneman N et al. First prospective randomized trial of the iron chelators deferiprone (L1) and desferrioxamine. Blood 1995;86[10 Suppl. 1], 249a.
- 60. Olivieri NF, Belluzzo N, Muraca M, MacKenzie CC, Milone S, Polsinelli K et al. Evidence of reduction in hepatic, cardiac and pituitary iron stores in patients with thalassemia major during long-term therapy with the orally active iron chelating agent L1. Blood 1994; 84[10 Suppl. 1], 109a.
- 61. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron concentrations and ventricular function in beta-thalassic. Lancet. 2002. 360: 516-20.
- 62. St Pierre TG. Deferiprone versus desferrioxamine in thalassemia, and T2* validation and utility. Lancet 2003; 361:182.
- 63. Piga A, Gaglioti C, Fogliaco E, Tricta F. Comparative effects of deferiprone and desferrioxamine on survival and cardiac disease in patients with thalassemia major: a retrospective analysis. Haematologica 2003;88.
- 64. De Franceschi L, Shalev O, Piga A, Collell M, Olivieri O, Corrocher R et al. Deferiprone therapy in homozygous human beta-thalassemia removes erythrocyte membrane free iron and reduces KCl cotransport activity. J Lab Clin Med 1999;133:64-9.
- 65. Davis BA, Porter JB. Long-term outcome of continuous 24-hour deferoxamine infusion via indwelling intravenous catheters in high-risk beta-thalassemia. Blood 2000;95(4):1.229-36.
- 66. Porter JB. Practical management of iron overload. Br J Haematol 2001;115(2):239-52.
- 67. Basran RK, Fassos FF, Shaw D, Olivieri NF. Assessment of the relative quality of life in patients receiving subcutaneous desferrioxamine and the orally active iron chelating agent L1. Blood 1994;84[No. 10 Suppl. 1], 261a.
- 68. Zahed L, Mourad FH, Alameddine R, Aoun S, Koussa S, Taher A. Effect of oral iron chelation therapy with deferiprone (L1) on the psychosocial status of thalassaemia patients. Haematologia (Budap) 2002; 31(4):333-39.
- 69. Kersten MJ, Lange R, Smeets MEP, Vreugdenhil G, Roozendaal KJ, Lameijer W et al. Long-term treatment of transfusional iron overload with the oral iron chelator deferiprone (L1): A dutch multicenter trial. Ann Hematol 1996;73(5):247-52.
- 70. Cunningham JM, Al-Refaie FN, Hunter AE, Sheppard L, Hoffbrand AV. Differential toxicity of ?-keto hydroxypyridine iron chelators and desferrioxamine to human haemopoietic precursors in vitro. Eur J Haematol 1994; 52:176-79.
- 71. Hoyes KP, Jones HM, Abeysinghe RD, Hider RC, Porter JB. In vivo and in vitro effects of 3-hydroxypyridin-4-one chelators on murine hemopoiesis. Exp Hematol 1993;21(1):86-92.
- 72. Al-Refaie FN, Hoffbrand AV, Nortey P, Wonke B, Wickens DG. Oral iron chelator L1 and autoimmunity. Lancet 1993;81:1.971-72.
- 73. Al-Refaie FN, Wonke B, Hoffbrand AV. Deferiprone-associated myelotoxicity. Eur J Haematol 1994;53:298-301.
- 74. Hoffbrand AV, Cohen A, Hershko C. Role of deferiprone in chelation therapy for transfusional iron overload. Blood 2003. Blood First Edition Paper prepublished online March 13, 2003.
- 75. Choudhury VP, Pati HP. Deferiprone (L1) associated neutropenia in beta thalassemia major - An Indian experience. 6th International Conference on Thalassaemia and the Haemoglobinopathies. Malta 1997. 141.
- 76. Müller A, Soyano A, Soyano-Müller A, Torres MA, Lanes R, Ponte B et al. Irreversible aplastic anemia after treatment with deferiprone in a patient with Blackfan Diamond anemia and hemochromatosis. Blood 2000; 96[11]:13b.
- 77. Cohen AR, Galanello R, Piga A, Gamberini R, De Sanctis V, Tricta F. Long-term safety and efficacy of the oral iron chelator deferiprone. Blood 2000;96[11]:434a.
- 78. Bertola U, Collell M, Piga A, Visconti RM, Cohen A. Neutropenia in homozygous ?-Thalassemic patients on desferrioxamine (DFO) treatment. 8th Int'l Conference - Corfu, 1997. 90.
- 81. Kowdley KV, Kaplan MM. Iron-chelation therapy with oral deferiprone toxicity or lack of efficacy? N Engl J Med 1998;339(7):468-69.
- 82. Maurer HS, Lloyd-Still JD, Ingrisano C, Gonzalez-Crussi F, Honig GR. A prospective evaluation of iron chelation therapy in children with severe ?-Thalassemia. A six-year study. Am J Dis Child 1988;142(March):287-92.
- 83. Aldouri MA, Wonke B, Hoffbrand AV, Flynn DM, Laulicht M, Fenton LA et al. Iron state and hepatic disease in patients with thalassaemia major, treated with long term subcutaneous desferrioxamine. J Clin Pathol 1987; 40:1.353-59.
- 84. Wanless I, Sweeney G, Dhillon AP, Guido M, Piga A, Galanello R et al. Lack of progressive hepatic fibrosis during long term therapy with deferiprone in subjects with transfusion-dependent beta-thalassemia. Blood 2002;100:1.566-69.
- 85. Töndury P, Zimmermann A, Nielsen P, Hirt A. Liver iron and fibrosis during long-term treatment with deferiprone in Swiss thalassaemic patients. Br J Haematol 1998;101(3):413-15.
- 86. Stella M, Pinzello G, Maggio A. Iron chelation therapy with oral deferiprone in patients with thalassemia. Letter to the Editor. N Engl J Med 1998;339:1.710-14.
- 87. Berdoukas V, Lindeman R, Eagle C, Bohane T, Tobias V, DeSilve K et al. The Sydney Children's Hospital Experience with the oral iron chelator - Deferiprone. Transfusion Science 2000.
- 88. Piga A, Facello S, Gaglioti C, Pucci A, Pietribiasi F, Zimmermann A. No progression of liver fibrosis in thalassemia major during deferiprone or desferrioxomine iron chelation. Blood 1998;92[10 (Suppl 1)].
- 89. Galanello R, De Virgiliis S, Agus A, Carta E, Cao A, Mancosu MG et al. Sequential liver firbrosis grading during deferiprone treatment in patients with thalassemia major. 9th International Conference on Oral Chelation in the treatment of thalassaemia and other diseases. 1999;50:3-25-.
- 90. Del Vecchio GC, Crollo E, Schettini F, Schettini F, Fischer R, De Mattia D. Factors influencing effectiveness of deferiprone in a thalassaemia major clinical setting. Acta Haematol 2000;104:99-102
- 91. Novartis Brochure on Desferal (Deferrioxamine): Basic Prescribing Information. Switzerland, Novartis Pharma AG. 1998.
- 92. Chiodo AA, Alberti PW, Sher GD, Francombe WH, Tyler B. Desferrioxamine ototoxicity in an adult transfusion-dependent population. Journal of Otolaryngology 1997; 26(2):116-22.
- 93. Lesic B, Foulon J, Carniel E. Comparison of the effects of deferiprone versus desferrioxamine on growth and virulence of yersinia ectercolitica. Antimicrob Agents Chemother 2002;46(6):1.741-45.
- 94. Cherchi GB, Cossellu S, Pacifico L, et al. Incidence and outcome of Yersinia enterocolitica infection in thalassemic patients. Contrib Microbiol Immunol 1995; 13:16-18.
- 95. Cherchi GB, Pacifico L, Cossellu S, Gallisai D et al. Prospective study of Yersinia enterocolitica infection in thalassemic patients. Pediatr Infect Dis J 1995;14: 579-84.
- 96. Brock JH, Liceaga J, Kontoghiorghes GJ. The effect of synthetic iron chelators on bacterial growth in human serum. FEMS Microbiology Immunology 1998;47:55-60.
- 97. Grady RW, Hilgartner MW, Giardina PJV. Deferiprone (DFP) and Desferal (DFO): complementary chelators? Seventh Cooley's Anemia Symposium. New York 1997. 37.
- 98. Aydinok Y, Nisli G, Kavakli K, Coker C, Kantar M, Cetingül N. Sequential use of deferiprone and desferrioxamine in primary school children with thalassaemia major in Turkey. Acta Haematol 1999;102:17-21.
- 99. Kattamis A, Kassou C, Ladis V, Berdussi H, Papasotiriou I, Kattamis C. Safety and efficacy of combining deferiprone and desferroxamine in iron chelation therapy in patients with thalassemia. Blood 2002; 100 [11]:120a.
- 100. Galanello R, Doneddu I, Origa R, Dess C, Defraia E, Crobu G et al. Combination therapy with desferrioxamine and deferiprone. 12th International Conference on Oral Chelation in the Treatment of Thalassemia & Other Diseases (ICOC), Santorini 2002. 105.
- 101. Balveer K, Pyar K, Wonke B. Combined oral and parenteral iron chelation in beta thalassaemia major. Med J Malaysia 2000;55(4):493-497.
- 102. Farmaki K, Anagnostopoulos G, Platis O, Gotsis E, Toulas P. Combined chelation therapy in patients with thalassaemia major: A fast and effective method of reducing ferritin & cardiological complications. European Haematology Conference. Florence 2002.
- 103. Alymara V, Bourantas DK, Chaidos A, Hatzimichael EC, Vergos A, Dimos GA et al. Combined iron chelation therapy with desferrioxamine and deferiprone in ?-thalassemic patients. European Haematology Conference. Florence 2002.
- 104. Aydinok Y, Nisli G, Kavakli K, Coker C, Kantar M, Çetingül N. Sequential use of deferiprone and desferrioxamine in primary school children with thalassaemia major in Turkey. Acta Haematol 1999; 102: 17-21.
- 105. Galanello R. Oral Iron Chelation with Deferiprone. 7th Conference of the International Association for the Study of Disorders of Iron Metabolism (Bioiron), Sorrento 1999. 24.
- 106. Link G, Konijn AM, Breuer W, Cabantchik ZI, Hershko C. Exploring the "iron shuttle" hypothesis in chelation therapy: effects of combined desferrioxamine and deferiprone treatment in hypertransfused rats with labeled iron stores and in iron-loaded rat heart cells in culture. J Lab Clin Med 2001;138(2):130-38.
- 107. Hershko C, Abrahamov A, Konjin AM, Breuer W, Cabantchik IZ, Pootrakul P et al. Combined DFO and L1 in chelation therapy: the iron shuttle phenomenon. European Haematology Conference, Florence. 2002.
- 108. Olivieri NF, Brittenham GM, Armstrong SAM, Basran RK, Daneman R, Daneman N et al. first prospective randomized trial of the iron chelators deferiprone (L1) and desferrioxamine. Blood 1995;86[10 Suppl. 1]:249a.
- 109. Olivieri NF, Belluzzo N, Muraca M, MacKenzie CC, Milone S, Polsinelli K et al. Evidence of reduction in hepatic, cardiac and pituitary iron stores in patients with thalassemia major during long-term therapy with the orally active iron chelating agent L1. Blood 1994; 84[10 Suppl. 1]: 109a.
Datas de Publicação
-
Publicação nesta coleção
18 Fev 2004 -
Data do Fascículo
2003
Histórico
-
Aceito
20 Jun 2003 -
Recebido
07 Maio 2003