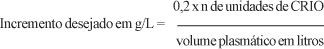Resumos
A prática da transfusão de sangue é uma ciência que cresce rapidamente, modifica-se continuamente e que apresenta uma grande perspectiva de desenvolvimento futuro. A rotina habitual dos serviços de hemoterapia requer o aperfeiçoamento de técnicas, pois o fracionamento do sangue coletado se faz necessário, uma vez que cada unidade doada pode beneficiar diversos pacientes e permitir que sejam transfundidas grandes quantidades de um determinado componente que o paciente necessite. O objetivo do presente trabalho foi revisar os procedimentos de coleta, produção, armazenamento e a indicação clínica dos principais hemocomponentes, como concentrado de hemácias, concentrado de hemácias lavadas, eritrócitos pobres em leucócitos, concentrado de plaquetas, concentrado de plaquetas por aférese, concentrado de granulócitos, plasma fresco congelado, plasma normal ou comum e crioprecipitado. Perspectivas futuras apontam para mudanças na terapia transfusional, e o maior foco será no aperfeiçoamento da segurança, havendo aumento de produtos manufaturados, desenvolvimento de produtos acelulares, tecnologias em aféreses, atenuação microbiana e proteínas recombinantes do plasma, que poderão substituir produtos derivados plasmáticos dentro de poucas décadas.
Hemocomponentes; hemoterapia; transfusão de sangue
The practice of blood transfusion is a science which has been showing fast growth, continuous changes and a great perspective of future development. The day-to-day routines of hemotherapy services require the improvement of techniques, as the fractionation of collected blood is necessary and each donated unit may benefit several patients and allow large amounts of a certain component to be transfused. The purpose of the present work is to revise the collection, production and storage procedures and the clinical indication of the main blood components such as concentrated red blood cells, concentrated washed red blood cells, erythrocytes with low numbers of leucocytes, concentrated platelets, apheresis concentrated platelets, concentrated granulocytes, frozen fresh plasma and regular plasma and cryoprecipited. Future perspectives suggest there will be changes in transfusion therapy with its main purpose stressing an improvement of security, with an increase of manufactured products, development of non-cellular products, apheresis technology, microbial attenuation and plasma recombining proteins, which may replace plasma products within a few decades.
Blood components; hemotherapy; blood transfusion
REVISÃO REVIEW
Caracterização, produção e indicação clínica dos principais hemocomponentes
Characterization, production and indication of the principal blood components
Fernanda H. RazoukI; Edna M. V. ReicheII
IFarmacêutica Bioquímica, Laboratório Oscar Pereira, Ponta Grossa, PR
IIProfessor Adjunto de Imunologia Clínica, Departamento de Patologia, Análises Clínicas e Toxicológicas, Universidade Estadual de Londrina
Endereço para correspondência Endereço para correspondência Fernanda Horn Razouk Rua Prudente de Morais, 200/42, Vila Estrela 84040-150 Ponta Grossa-PR. E-mail: ferazouk21@hotmail.com
RESUMO
A prática da transfusão de sangue é uma ciência que cresce rapidamente, modifica-se continuamente e que apresenta uma grande perspectiva de desenvolvimento futuro. A rotina habitual dos serviços de hemoterapia requer o aperfeiçoamento de técnicas, pois o fracionamento do sangue coletado se faz necessário, uma vez que cada unidade doada pode beneficiar diversos pacientes e permitir que sejam transfundidas grandes quantidades de um determinado componente que o paciente necessite. O objetivo do presente trabalho foi revisar os procedimentos de coleta, produção, armazenamento e a indicação clínica dos principais hemocomponentes, como concentrado de hemácias, concentrado de hemácias lavadas, eritrócitos pobres em leucócitos, concentrado de plaquetas, concentrado de plaquetas por aférese, concentrado de granulócitos, plasma fresco congelado, plasma normal ou comum e crioprecipitado. Perspectivas futuras apontam para mudanças na terapia transfusional, e o maior foco será no aperfeiçoamento da segurança, havendo aumento de produtos manufaturados, desenvolvimento de produtos acelulares, tecnologias em aféreses, atenuação microbiana e proteínas recombinantes do plasma, que poderão substituir produtos derivados plasmáticos dentro de poucas décadas. Rev. bras. hematol. hemoter. 2004;26(2):126-134.
Palavras-chaves: Hemocomponentes, hemoterapia, transfusão de sangue.
ABSTRACT
The practice of blood transfusion is a science which has been showing fast growth, continuous changes and a great perspective of future development. The day-to-day routines of hemotherapy services require the improvement of techniques, as the fractionation of collected blood is necessary and each donated unit may benefit several patients and allow large amounts of a certain component to be transfused. The purpose of the present work is to revise the collection, production and storage procedures and the clinical indication of the main blood components such as concentrated red blood cells, concentrated washed red blood cells, erythrocytes with low numbers of leucocytes, concentrated platelets, apheresis concentrated platelets, concentrated granulocytes, frozen fresh plasma and regular plasma and cryoprecipited. Future perspectives suggest there will be changes in transfusion therapy with its main purpose stressing an improvement of security, with an increase of manufactured products, development of non-cellular products, apheresis technology, microbial attenuation and plasma recombining proteins, which may replace plasma products within a few decades. Rev. bras. hematol. hemoter. 2004;26(2):126-134.
Key words: Blood components, hemotherapy, blood transfusion.
Introdução
Transfusão de sangue, técnicas e estratégias que evitam a necessidade de sangue são atividades complementares que constituem a área clínica da Medicina Transfusional. Recentes avanços na segurança e qualidade do sangue e o aumento dos custos associados com a terapia transfusional têm levado a uma reavaliação da prática desta área da medicina.
O fracionamento do sangue total traz como vantagens o uso otimizado em relação ao aproveitamento e eficácia, aumento do tempo de validade de todos os componentes sangüíneos, além de diminuir, consideravelmente, o risco de reação transfusional. Contudo, essas vantagens somente são obtidas quando há a real necessidade da transfusão e prescrição adequada com a indicação clínica.
A realização desse procedimento de forma não criteriosa expõe o receptor a sérias complicações como a aquisição de doenças transmissíveis, reações transfusionais (hemolíticas ou não) que podem ser graves, sensibilização imunológica, falha terapêutica, aumento no custo do tratamento e ansiedade gerada no paciente e nos familiares envolvidos. Acrescenta-se, ainda, o desperdício de um material nobre, devido ao generoso ato da doação e ao elevado custo na adequação do mesmo para fins terapêuticos.
De acordo com a Resolução da Diretoria Colegiada RDC n 343, de 13 de dezembro de 2002, Anexo 1- Regulamento Técnico dos Serviços de Hemoterapia,1 os componentes sangüíneos são preparações obtidas pelo processamento, após centrifugação das bolsas de sangue total. Podem ser obtidos, também, mediante aféreses. A esterilidade dos componentes deverá ser mantida durante o processamento empregando-se métodos assépticos, equipamentos e soluções estéreis e livres de pirogênicos. A transferência de componente de uma bolsa-satélite para outra deverá realizar-se em circuito fechado. Se durante o processamento o circuito for aberto, os componentes devem ser descartados. Posteriores manipulações dos hemocomponentes que exijam a abertura do circuito deverão ser feitas sob câmara de fluxo laminar. Se os componentes vão ser criopreservados, deverão ser depositados no congelador até no máximo quatro horas depois da abertura do circuito.
O objetivo deste artigo foi revisar os principais hemocomponentes quanto à sua caracterização, produção, armazenamento, indicação clínica e reações adversas.
Sangue total (ST)
O ST se caracteriza como o sangue coletado de um doador misturado com a solução preservativa e anticoagulante, na proporção de aproximadamente 450 mL de sangue para 63 mL de solução preservativa. O hematócrito dessa unidade varia de 36% a 44%. Deve ser estocado em refrigerador monitorizado entre 1º e 6º C. Seu prazo de validade depende do anticoagulante utilizado na bolsa de coleta: Citrato-Fosfato-Dextrose (CPD) é de 21 dias e Citrato - Fosfato-Dextrose- Adenina (CPDA - 1) é de 35 dias.2
A indicação primária para a transfusão de sangue total é para pacientes com sangramento ativo que tenham perdido mais que 25% de seu volume sangüíneo total e que possam desenvolver choque hemorrágico. O sangue total restaura a capacidade de transporte do oxigênio e também promove expansão de volume.3 Uma contra-indicação definitiva para o emprego do sangue total é a anemia crônica severa.2
O ST estocado por mais de 24 horas contém poucas plaquetas e leucócitos viáveis. Também os níveis de Fator V e Fator VIII decrescem durante a estocagem, mantendo-se na unidade de sangue total apenas os fatores estáveis da coagulação.3
Em um indivíduo adulto, uma unidade de sangue total aumenta a hemoglobina em aproximadamente 1g/dL ou o hematócrito em 3%-4%. Para se obter este resultado em pacientes pediátricos, recomenda-se a transfusão de 8 mL/kg de sangue total. Deve ser administrado através de filtro de transfusão no período de quatro horas. Não há indicações precisas para a transfusão de sangue total fresco. Nos casos de exosangüíneo transfusão, a prática tem sido a reconstituição do volume a ser trocado com concentrado de hemácias e plasma fresco congelado em proporções adequadas ao hematócrito desejado.
O desenvolvimento de hemocomponentes tem limitado o uso de sangue total a poucas condições clínicas. O uso de ST fresco não é mais aceito na hemoterapia atual e traduz apenas a falta de disponibilidade de produtos mais adequados. Portanto, seu uso deverá ser apenas como matéria-prima para o preparo de hemocomponentes. O ST estocado deverá ser usado nos casos em que tenha ocorrido uma perda superior a 30% da volemia. Todavia, essas hemorragias também poderão ser manuseadas com concentrado de glóbulos vermelhos e soluções eletrolíticas e/ou coloidais.5
Concentrado de hemácias (CH)
O CH é constituído por eritrócitos que permanecem na bolsa depois que esta é centrifugada, e o plasma extraído para uma bolsa-satélite. Este procedimento pode ser realizado em qualquer momento antes da data de expiração do sangue coletado. O hematócrito do CH deve estar entre 65% a 75%, nas bolsas cuja solução preservativa seja CPDA-1, e permanecer armazenados à temperatura de 4º-2º C, por 35 dias.1 CH estocados em soluções aditivas têm hematócritos entre 52%-60% e validade de 42 dias. A estocagem de hemácias em CPD resulta em hematócritos similares aos obtidos com CPDA-1, mas o prazo de validade é de 21 dias. CH estocado não contém plaquetas ou granulócitos funcionais.3 Como vantagens do emprego de eritrócitos sobre o sangue total tem-se a obtenção da mesma capacidade de oxigênio com a metade do volume; redução no nível de isoaglutininas naturais (anti-A e anti-B) e redução significativa nos níveis de citrato e potássio, principalmente para doentes cardíacos, renais e/ou hepáticos.6
CH é indicado para aumentar a massa eritrocitária em pacientes que necessitem aumentar sua capacidade de transporte de oxigênio.2 Uma unidade de eritrócitos aumenta a hemoglobina do adulto de 1 g/dL, e, o hematócrito, de 3%.7 Alguns princípios devem ser levados em conta para a prática da transfusão de células vermelhas em adultos, entre eles: o prescritor clínico da transfusão de eritrócitos deve estar ciente da indicação apropriada e dos riscos e benefícios dessa transfusão; os pacientes devem receber informações sobre os riscos e benefícios da transfusão de células vermelhas, incluindo a possibilidade de transfusão autóloga; a causa da anemia deve ser estabelecida e o tratamento com transfusão de hemácias não deve ser alternativo para o tratamento de deficiências de ferro, anemia megaloblástica e anemia hemolítica auto-imune, a menos que esta anemia ameace a vida do paciente; não existe um consenso mundial da concentração de hemoglobina para a transfusão de concentrado de hemácias. Os critérios clínicos têm um papel vital na decisão da transfusão ou não; na perda aguda de sangue, cristalóides e colóides sintéticos podem ser usados para restabelecer rapidamente o volume inicial. Os efeitos da anemia precisam ser considerados separadamente dos efeitos da hipovolemia. É aceitável que, em pacientes com perda aguda de massa sangüínea maior que 50% do volume de sangue circulante, a decisão empírica da imediata transfusão de células vermelhas tenha de ser tomada. Entretanto, é importante definir os pacientes que precisam restabelecer componentes sangüíneos e fluidos o mais especificadamente possível, para garantir que o uso de hemocomponentes seja feito de forma racional; deve haver um local apropriado para providenciar a transfusão urgente para pacientes com hemorragia importante, incluindo o uso emergencial de sangue O Rh negativo; a razão da administração de células vermelhas deve ser documentada no prontuário do paciente.8
As principais situações descritas na literatura em que a transfusão de CH não se encontra justificada são: hematócrito superior a 30%, exceto nos casos com queda superior a 6% em 24 horas ou superior a 12% em 48 horas; hematócrito entre 24% a 30% desde que não ocorram as seguintes alterações: queda do hematócrito superior a 6% nas últimas 24 horas; angina e dor torácica nas 24 horas que antecedem o ato transfusional; infarto agudo do miocárdio (IAM) até seis semanas antes da transfusão; perda de sangue superior a 1.000 mL antes da transfusão; eletrocardiograma indicando isquemia coronariana ou IAM.5
Há considerável controvérsia sobre o nível de hemoglobina no qual a transfusão de CH pode ser apropriada, mas, em geral, pacientes com hemoglobina menor que 7 g/dL, particularmente pessoas idosas, podem apresentar sintomas clínicos consistentes com transporte insuficiente de oxigênio.9 A controvérsia existe em relação à transfusão de CH a pacientes com anemia normovolêmica e hemoglobina entre 7 e 10 g/dL e a prática transfusional varia entre médicos, mesmo dentro da mesma instituição.
Em um estudo multiinstitucional realizado no Canadá, 418 pacientes criticamente doentes com normovolemia receberam transfusão de CH quando o valor de hemoglobina estava abaixo de 7 g/dL, com o objetivo de mantê-lo em uma escala de 7 a 9 g/dL, e 420 pacientes receberam transfusão de CH quando o valor de hemoglobina estava abaixo de 10 g/dL, para mantê-lo em uma escala de 10 a 12 g/dL. O índice de mortalidade no 30º dia foi similar em ambos os grupos (18,7% versus 23,3%, p= 0,11), indicando que a transfusão em um limiar abaixo de 7 g/dL de hemoglobina é tão segura quanto a transfusão em um limite superior (10 g/dL), em pacientes criticamente doentes. No entanto, os autores concluem que mais informações são necessárias para determinar quando a transfusão em unidades de terapia intensiva é benéfica.10 Outros estudos encontraram substancial variabilidade no uso de transfusão de CH em pacientes submetidos a cirurgias de quadril e joelho e esta variabilidade foi atribuída à falta de critérios claramente definidos para a transfusão de CH e de diferenças na disponibilidade de transfusão autóloga entre os hospitais.11,12,13
O CH deve ser administrado através de filtro de transfusão com velocidade de infusão no máximo em quatro horas. Nenhuma medicação ou solução (exceto salina isotônica) deve ser adicionada à bolsa de sangue.3
Concentrado de hemácias pobre em leucócitos
A doação de 450 mL de sangue contém cerca de 3,0x109 leucócitos. Em pacientes politransfundidos, pode-se observar a presença de anticorpos antileucocitários, que produzem reações febris não hemolíticas (RFNH) em transfusões que contenham essas células.5
Concentrado de hemácias pobre em leucócitos são hemácias preparadas por um método que assegure a remoção de, pelo menos, 85% dos leucócitos originalmente presentes na bolsa de sangue coletado. Os métodos de remoção podem ser a lavagem, a centrifugação invertida com retirada da camada leucoplaquetária do buffy-coat ou a extração automática do buffy-coat durante a preparação e uso de filtro leucodepletores. O número de leucócitos no componente final deverá ser menos de 5x106 células. Sua validade é de 24 horas quando preparado em sistema aberto e mantém a validade original se for em sistema fechado.1
A maioria das reações transfusionais febris ocorre devido à presença de leucócitos na bolsa de sangue a ser transfundida. Atualmente, o método mais eficiente que remove aproximadamente 99% dos leucócitos é o uso de filtros leucodepletores. Pacientes que tiveram reações febris repetidas (duas ou mais) são candidatos ao uso de hemácias pobres em leucócitos.2
O uso do filtro de leucodepleção está indicado para os pacientes cronicamente dependentes de transfusões, particularmente os talassêmicos. Embora questionável, esse produto tem sido utilizado para prevenção da transmissão de infecção pelo Citomegalovírus (CMV) e infeção pelo Vírus Linfotrópico de Células T Humanas tipo I (HTLV-I). Um nível de leucócitos menor que 5x108 células poderá prevenir RFNH. Muitos filtros sangüíneos garantem níveis menores que 1x106 células ou até 1x104 células. Baixos níveis de leucócitos podem prevenir ou retardar a sensibilização com antígenos leucocitários humanos (HLA) ou possivelmente prevenir a transmissão da infecção pelo CMV, uma vez que o CMV é transportado nas formas latentes ou infecção ativa pelos leucócitos polimorfonucleares e monócitos.2
O efeito da leucorredução na transmissão de outros vírus, como o Vírus da Imunodeficiência Humana tipo 1 (HIV-1), ainda vem sendo investigado. Estudos preliminares têm sugerido que a redução leucocitária pode também diminuir a incidência de crescimento bacteriano, principalmente Yersinia enterocolítica ou outras bactérias durante o estoque refrigerado de glóbulos vermelhos.4
Concentrado de hemácias lavadas
Pacientes que tiveram reações transfusionais alérgicas com CH normal poderão ser beneficiados com o uso de hemácias lavadas. Hemácias lavadas são usadas para pacientes com deficiência de IgA e anticorpos anti-IgA. A resposta esperada com relação ao hematócrito é a mesma que com a transfusão de CH não lavados.2 Entretanto, há relatos contraditórios afirmando que pacientes que são cronicamente transfundidos com hemácias lavadas podem necessitar de um maior número de unidades para atingir o hematócrito apropriado, devido à perda de glóbulos vermelhos durante a lavagem.3 O procedimento de lavagem deverá ser realizado com solução isotônica de cloreto de sódio.1 Para esse processo ser efetivo, deve compreender pelo menos três ciclos de lavagem.14 Este procedimento pode ser realizado a qualquer momento dentro do prazo de validade do componente, mas uma vez que a lavagem é realizada em sistema aberto, o CH resultante pode ser estocado por apenas 24 horas, entre 1º e 6ºC, devido ao risco de contaminação bacteriana. CH lavadas devem ser administrados através de filtros de transfusão em até quatro horas.3
Concentrado de hemácias congeladas
Concentrado de hemácias congeladas é constituído por hemácias conservadas em temperaturas iguais ou inferiores a -65ºC na presença de um agente crioprotetor como o glicerol ou amido hidroxilado. Na utilização de glicerol, este deve ser removido por meio de lavagem, depois que as hemácias forem descongeladas. Os concentrados de hemácias poderão ser congelados em até 15 dias, embora se recomendam seis dias, e sua validade é de dez anos, a contar da data da doação do sangue.1 A unidade de CH descongelada é reconstituída com salina estéril, usualmente com hematócritos entre 70%-80% e pode ser estocada entre 1º e 6ºC por até 24 horas, uma vez que a lavagem é realizada em sistema aberto. Normalmente não é necessário o uso de hemácias deglicerolizadas para a prevenção de reações transfusionais febris, pois estes produtos são de baixo estoque devido ao custo e tempo necessário para sua estocagem. Podem ser utilizados como alternativa de conservação e disponibilidade de bolsas coletadas de doadores CMV negativos, com a intenção de diminuir a incidência de soroconversão para CMV em paciente suscetíveis.3
Células vermelhas congeladas permitem o estoque por um longo tempo de unidades de sangue raro, bolsas autólogas e unidades para situações especiais, como a transfusão intra-uterina. Através do processo de deglicerolização com a remoção de, aproximadamente, todos os leucócitos e plasma, as células vermelhas congeladas podem ser usadas alternativamente com hemácias lavadas, diminuindo o custo do tratamento. O aumento do hematócrito no paciente é o mesmo de quando se utiliza concentrado de hemácias normal.2
Todas as unidades de hemácias congeladas devem ser transfundidas através de filtros de transfusão.3
Hemácias rejuvenescidas
São hemácias tratadas por um método que restabelece os níveis normais de 2,3 Difosfato glicerol (2,3-DPG) e Adenina Trifosfato (ATP). As hemácias podem ser rejuvenescidas até três dias após seu vencimento, desde que tenham sido mantidas a 4º - 2ºC. Depois desse procedimento, os glóbulos vermelhos podem ser lavados e transfundidos dentro de 24 horas. Os rótulos dessas unidades devem indicar o uso de soluções de rejuvenescimento.1
Concentrado de plaquetas (CP)
O CP consiste de uma suspensão de plaquetas em plasma, preparado mediante dupla centrifugação de uma unidade de sangue total. É importante que este sangue total não seja colhido em tempo maior que 15 minutos. O CP deve conter, pelo menos, 5,5x1010 plaquetas e deverão ser armazenados à temperatura de 20º a 24ºC, sob agitação constante, pelo prazo máximo de cinco dias.1
Vários autores citam a preocupação especial com a contaminação bacteriana do CP devido à sua estocagem à temperatura ambiente, devendo-se respeitar seu prazo de validade.3,5,15 O risco de sepsis relacionado à plaqueta é estimado ser de 1:12.000, mas é maior quando a transfusão de CP é obtida de múltiplos doadores do que a transfusão de uma unidade de plaqueta obtida por aférese de um único doador. O aumento do risco de crescimento bacteriano com o tempo justifica a vida média das plaquetas estocadas a 20º-24ºC ser de cinco dias. Em ordem decrescente, os microrganismos mais comumente envolvidos em mortes são Staphylococcus aureus, Klebsiella pneumoniae, Serratia marcescens e Staphylococcus epidermidis.16
Após a monitorização de alguns parâmetros visando atingir a qualidade de produtos plaquetários, como a calibração dos equipamentos, determinação do tempo ideal de coleta do sangue e escolha do melhor método de definição do pH, constatou-se que algumas centrífugas não atingem a velocidade exigida pela técnica de calibração, não sendo, portanto, indicada para este fim. Relatou ainda que os CP produzidos a partir de ST, colhidos em intervalo de tempo inferior a oito minutos, apresentaram os melhores resultados, e a determinação do pH pelo método da fita, que é simples, rápido e de baixo custo, também apresentou os melhores resultados, sendo indicado seu uso antes da liberação imediata do hemocomponente.17
A efetividade de uma transfusão de plaquetas é determinada pelo cálculo do Incremento Plaquetário Corrigido (ICP), que consiste de:
onde, o Incremento Plaquetário (IP) é a contagem de plaquetas após a transfusão subtraída da contagem pré-transfusional. Este procedimento será considerado efetivo quando o IPC for maior que 7.500 em uma hora ou maior que 4.500 após vinte horas da transfusão.15
As plaquetas possuem a função de controlar o sangramento ao atuar como tampão hemostático no endotélio vascular.7 A utilização de plaquetas ABO compatíveis com o receptor é aconselhável, porém não é obrigatória, não sendo necessária a realização dos testes de compatibilidade pré-transfusionais.5
As indicações clínicas para transfusão de plaquetas são para prevenir ou controlar a hemorragia em pacientes com baixas contagens de plaquetas (trombocitopenia), ou, menos freqüentemente, em pacientes com disfunção plaquetária (trombocitopatias). Em pacientes com trombocitopenia, o CP está indicado para prevenir hemorragia espontânea, particularmente intracraniana, condição que pode ocorrer em pacientes que apresentam contagens de plaquetas abaixo de 10.000/mm3. Pacientes que apresentam valores inferiores a 5.000/mm3 apresentam alto risco para hemorragias espontâneas. Outra indicação clínica seria em pacientes trombocitopênicos (<50.000/mm3) submetidos a procedimentos invasivos de diagnóstico como biópsia hepática, colonoscopia com biópsia, broncoscopia com bióspia, entre outros. Uma terceira situação clínica é a presença de trombocitopenia em pacientes que serão submetidos a procedimentos cirúrgicos. Uma quarta situação é uma trombocitopenia (<100.000/mm3) em pacientes com hemorragia ativa como a hemorragia aguda gastrointestinal. Uma quinta situação seria quando o número de plaquetas é normal, mas são consideradas disfuncionais. Verifica-se o desenvolvimento de uma anormalidade plaquetária funcional proporcional à extensão da derivação cardiopulmonar durante a cirurgia cardíaca e em pacientes que estão em uso de aspirina ou drogas com efeitos farmacológicos similares. Nestes casos, há indicação de CP quando procedimentos cirúrgicos ou procedimentos invasivos de diagnóstico de urgência são necessários.9
Transfusão de plaquetas profiláticas e terapêuticas vem sendo cada vez mais usada para pacientes com condições associadas a trombocitopenia, com o objetivo de prevenir o desenvolvimento de um provável sangramento que possa ameaçar a vida do paciente.18
A dose usual para pacientes adultos e pediátricos varia muito segundo a literatura. Para um paciente adulto trombocitopênico, 6 - 10 unidades de CP, e para pacientes pediátricos, 1 unidade para cada 10 kg de peso.3 Outros estudos recomendam o uso de 5 - 8 unidades de CP ou 1 unidade de plaquetas por aférese para um adulto e 10 mL de CP por quilo de peso para crianças.15 O principal uso da transfusão profilática de plaquetas é na prevenção de sangramento em pacientes com doenças hematológicas, especialmente as leucemias, que apresentam insuficiência medular causada pela doença ou seu tratamento. Nestes pacientes, usualmente transfundem-se plaquetas quando os níveis estão em torno de 10.000/mm3. Se o paciente apresenta algum outro fator de risco (sepsis, uso de antibióticos), adota-se um limiar transfusional em torno de 30.000/mm3.15
Em cirurgias cardíacas, o número mínimo aceitável de plaquetas com CEC não está bem estabelecido. Este valor pode variar entre os diferentes serviços, diferentes pacientes e diferenças de função plaquetária. Neste caso, a transfusão profilática pré-cirúrgica de plaquetas é indicada em pacientes com contagem inferior a 100.000/mm3.15 Outros autores defendem que uma contagem plaquetária superior a 60.000/mm3, na vigência de função plaquetária normal, poderá ser suficiente para uma hemostasia adequada em um procedimento cirúrgico de grande porte.19
Esplenomegalia, púrpura trombocitopênica imune e coagulação intravascular disseminada (CIVD) são condições onde é desnecessária a transfusão de concentrados plaquetários. Transfusões repetidas podem levar a aloimunização a antígenos do sistema HLA, resultando em um estado refratário que se manifesta pela ausência de resposta às transfusões de plaquetas. Tais pacientes, usualmente, necessitam plaquetas HLA compatíveis. A irradiação de plaquetas está indicada para prevenção da doença do enxerto versus hospedeiro (DEVH) em pacientes imunodeprimidos.3
Plasma fresco congelado (PFC)
O plasma é composto primariamente de água, com aproximadamente 7% de proteínas e 2% de carboidratos e lipídeos. É preparado a partir do ST, após centrifugação e congelamento do plasma dentro de seis horas após a coleta.3 O PFC pode ser totalmente congelado em até oito horas após a coleta. Deve ficar armazenado a uma temperatura de, no mínimo, - 20º C, tendo a validade de 12 meses. Porém, a temperatura mais recomendada é a de -30º C e, assim, a validade do PFC passa a ser de 24 meses.1
O volume de uma unidade de plasma fresco deve ficar em torno de 200 a 250 mL. Sob as condições de temperaturas citadas, é mínima a perda dos fatores V e VIII, os fatores lábeis da coagulação. Um mL de PFC contém, aproximadamente, uma unidade de atividade de fator de coagulação.3 De acordo com o Colégio Americano de Patologistas, o uso do PFC deve ser considerado nas seguintes situações: coagulopatia congênita ou adquirida, com sangramento ativo e previamente a procedimentos invasivos; transfusão maciça de hemácias associada à deficiência da coagulação; reversão rápida da anticoagulação pela warfarina; deficiência congênita de fator II, V, VII, X, XI ou XIII, com sangramento anormal; púrpura trombocitopênica trombótica (PTT); deficiência da antitrombina III, co-fator II de heparina, proteína C ou proteína S.15
A compatibilidade ABO deve ser respeitada na administração de plasma fresco, com o objetivo de evitar hemólise no receptor, embora não sejam necessários testes de compatibilidade.5
O PFC não deve ser utilizado para expansão de volume ou reposição protéica, visto que produtos mais seguros, que não oferecem risco de transmissão de doenças ou reações alérgicas aos receptores, estão disponíveis com este fim, como a albumina sérica, soluções colóides sintéticas e soluções balanceadas de salina.2,7 De acordo com um estudo experimental realizado com recém-nascidos com poliglobulia, não se observaram diferenças estatisticamente significativas nos valores plasmáticos de sódio, cloro e bicarbonato, ao se administrarem plasma e solução salina. Concluiu-se que o uso de solução salina é tão eficaz quanto o plasma para diminuir significativamente o valor do hematócrito nos pacientes com a referida patologia. Prefere-se a administração de solução salina, pois não oferece os riscos imunológicos nem infecciosos do plasma, sendo também um produto mais acessível e com menor custo.20
Em cirurgias cardíacas, há indicação da transfusão de PFC na fase pré-cirúrgica nos casos de insuficiência hepática com alteração dos fatores de coagulação, na indisponibilidade de concentrados específicos de um fator em pacientes portadores de deficiência congênita ou adquirida e nas cirurgias de emergência em indivíduos que recebem terapia de anticoagulação oral. Na fase pós-operatória, recomenda-se a transfusão de plasma fresco em pacientes que apresentam sangramento aumentado por drenos torácicos, na presença de exames laboratoriais sugerindo coagulopatia de causa não plaquetária. O PFC deve ser administrado na dose de 10 a 20 mL/kg de peso na criança e de uma a duas bolsas no adulto, podendo variar em função da indicação.19
Plasma comum (PC)
Pode ser chamado também de plasma normal, plasma simples ou plasma de banco, diferencia-se do PFC, pois seu congelamento se dá mais de oito horas depois da coleta do ST que lhe deu origem. Pode resultar também da transformação de um PFC cujo período de validade expirou. Deve ser armazenado em temperatura igual ou inferior a -20º C e tem a validade de cinco anos. O PC não pode ser utilizado para transfusão.1
Existem controvérsias com relação ao uso de plasma com remoção de crioprecipitado para o tratamento da PTT. Algumas indicações do PC são absolutamente injustificadas, como expansão de volume plasmático, complementação nutricional, uso profilático em cirurgias cardiopulmonares com CEC e transfusão maciça, melhora da cicatrização de ferimentos e fonte de imunoglobulinas para pacientes com hipogamaglobulinemia severa.15
Crioprecipitado (CRIO)
Constitui-se da fração de plasma insolúvel ao frio, obtida a partir do PFC. Para sua produção, o PFC deverá ser descongelado a 4 ± 2º C. Após completado o descongelamento, este plasma deverá ser centrifugado à temperatura de 4 ± 2º C e separado do material insolúvel ao frio em circuito fechado. O CRIO resultante deverá ser recongelado em até uma hora após sua obtenção a -20º C e sua validade é de um ano a partir da data de doação. Se permanecer conservado à temperatura de -30º C sua validade passa a ser de dois anos. O produto final deverá conter 80 unidades internacionais de Fator VIII e 150 mg/dL de fibrinogênio em todas as unidades analisadas.1
O número de unidades de CRIO necessárias para corrigir o déficit de fibrinogênio pode ser calculado pela seguinte fórmula:15
Recomenda-se administrar 1 unidade de CRIO para cada 5 kg de peso do paciente. O fibrinogênio possui meia-vida entre quatro e seis dias e a recuperação transfusional é de 50%.
Atualmente, a principal fonte de fibrinogênio concentrado é o CRIO.3 A infusão de CRIO pode ser realizada a partir de bolsas individuais ou reunidas em pool, devido ao seu pequeno volume. O produto deve ser aplicado logo após o descongelamento, pois se observa uma rápida perda de atividade do Fator VIII em altas temperaturas. Se o título de isoaglutininas for superior a 1:32, deve-se respeitar a compatibilidade ABO, especialmente em crianças, pois pode-se observar um teste de Coombs direto positivo no receptor que receba unidades ABO incompatíveis.5
As principais indicações da transfusão de CRIO são no tratamento da hemofilia A, doença de von Willebrand, deficiência de fibrinogênio congênita ou adquirida, deficiência de Fator XIII e complicações obstétricas ou outras situações associadas com o consumo de fibrinogênio, como CIVD. Seu uso também é benéfico no tratamento da tendência hemorrágica associada à uremia. No caso da hemofilia A, no Brasil existe uma normatização do Ministério da Saúde, onde os hemofílicos deveriam ser tratados apenas com Fator VIII industrializado. Quantidades pequenas de CRIO são utilizadas no preparo de "cola de fibrina" para o auxílio de hemostasia cirúrgica ou para remoção de cálculos renais.3
Em cirurgias cardíacas, portadores de disfunção plaquetária decorrente de insuficiência renal poderão se beneficiar com a transfusão pré-cirúrgica de CRIO, devido ao aumento do fator de von Willebrand. No período pós-operatório, a infusão de CRIO está indicada no sangramento devido a hipofibrinogenemia. Deve ser administrado na dose de uma bolsa/10 kg de peso do paciente.19
O CRIO não deve ser utilizado no tratamento de pacientes com deficiências de outros fatores que não os já citados. O risco de transmissão de doenças infecciosas, para cada unidade de CRIO, é o mesmo do PFC. Quando altas quantidades de CRIO são transfundidas, o nível de fibrinogênio do indivíduo deve ser monitorizado, pois este pode atingir níveis bastante elevados (hiperfibrinogenemia), levando a um risco aumentado de tromboembolismo.3
Concentrado de granulócitos
Concentrado de granulócitos se caracteriza por uma suspensão de granulócitos em plasma obtida por aférese. Este componente deverá conter, no mínimo, 1010 granulócitos em, pelo menos, 90% das unidades avaliadas. Possui validade de apenas 24 horas e deve ser conservado a temperatura de 22 ± 2º C.1
Os concentrados de granulócitos possuem uma aplicação muito limitada. Pacientes com neutropenia severa (menos que 500 leucócitos/mL), febre que não responde a terapia antibiótica, hipoplasia mielóide da medula óssea e que apresentam uma possibilidade razoável de sobrevivência são candidatos à transfusão de granulócitos.6
A administração de granulócitos deverá ser realizada através de filtros normais, não se usando filtros de microagregados. São necessárias as provas de compatibilidade devido ao número elevado de hemácias presentes neste produto. Não devem se utilizar doadores familiares em candidatos a transplante de medula óssea sob o risco de aloimunização.5
A utilização de concentrado de granulócitos está em declínio nos Estados Unidos, uma vez que a antibioticoterapia apropriada pode ser mais eficaz que transfusões de granulócitos em pacientes neutropênicos infectados. Não há consenso sobre a dose e duração desta terapêutica, entretanto existem relatos sobre pacientes que indicam ser necessário um mínimo de quatro dias de terapia para demonstrar algum efeito benéfico.3
As reações pulmonares severas ocorrem em pacientes que recebem transfusão de granulócitos, especialmente os pacientes com infecção pulmonar ou aloimunização a antígenos HLA presentes nas células do doador. Quando esta reação é muito grave, a infusão do concentrado de granulócitos deve ser interrompida e deve haver uma suplementação com oxigênio. Também podem ocorrer reações febris que podem ser tratadas com antipiréticos e com uma transfusão mais lenta. O risco de transmissão de doenças como o CMV e a DEVH está presente na terapia com granulócitos.4
Albumina humana
A albumina humana constitui-se de uma proteína altamente solúvel, simétrica, heterogênea, com peso de aproximadamente 67.000 daltons (D). Carrega uma alta carga negativa que possibilita a ligação desta a uma grande quantidade de componentes, incluindo drogas. É produzida no fígado, sendo que o organismo de um indivíduo adulto de aproximadamente 70 kg armazena cerca de 300g de albumina, das quais 60% a 65% extravascular em pele, músculos e intestinos.15
A solução de albumina é derivada do plasma de doadores, obtido a partir de ST ou de plasmaférese. É preparada através do processo de fracionamento por álcool a frio e subseqüente aquecimento a 60ºC por dez horas. Estes produtos não oferecem riscos de transmissão de doenças virais devido ao período de aquecimento a que são submetidos.3 Este produto encontra-se disponível em soluções a 25% e 5%, armazenadas à temperatura de 1º a 6º C, e possui uma vida de armazenamento de cinco anos.6
A albumina humana pode ser usada para o tratamento de pacientes que requerem expansão de volume. Surgem controvérsias quanto ao uso deste produto ou de cristalóides (salina ou soluções eletrolíticas) como melhor opção para o tratamento de hipovolemia. É usada rotineiramente como fluido de reposição em muitos procedimentos de plasmaféreses. Também pode ser utilizada, assim como a fração protéica plasmática, juntamente com diuréticos, para induzir a diurese em pacientes com baixa dosagem de proteína total ou perda protéica. Pacientes que recebem 25% de albumina precisam adequar a água extravascular e compensar o mecanismo para tratar a expansão do volume sangüíneo.2
O uso de albumina está contra-indicado como suporte nutricional, pois o mesmo apresenta resultado mais efetivo se ocorrer por nutrição parenteral, para melhoria de cicatrização no período pós-operatório ou para correção de hipoproteinemias associadas a hepatopatias ou enteropatia com perda protéica. Outra contra-indicação do uso de albumina humana seria nos casos de mobilização de ascite e terapêutica única para desidratados.19
Perspectivas futuras
A prática da transfusão sangüínea sofrerá mudanças brevemente, no século 21. O maior foco será no aperfeiçoamento da segurança, havendo aumento de produtos manufaturados. A leucorredução universal de todos os produtos celulares sangüíneos (exceto granulares) e, talvez, produtos acelulares, é um acontecimento que provavelmente ocorra dentro dos primeiros anos. Diversos países da Europa e Canadá têm no momento utilizado leucorredução universal. Isto ocorre para evitar os efeitos adversos conhecidos associados com leucócitos alogênicos, a difícil associação da administração de duas invenções de produtos sangüíneos (leucorreduzidos e não-leucorreduzidos) e o risco teórico de uma nova variante da transmissão da doença de Creutzfeldt-Jakob pela transfusão de sangue. Também ocorrerão benefícios como a redução da reação transfusional não-hemolítica, a eliminação da transmissão de vírus presentes em leucócitos como os da família Herpesvirus (Citomegalovírus, Epstein Barr Vírus, Herpes Vírus tipo 6 e Herpes Vírus tipo 8), a redução da transmissão de vírus que estão presentes tanto em leucócitos como na forma de virions livres no plasma (Vírus Linfotrópico de Células T Humanas Tipos I e II e o Vírus da imunodeficiência Humana tipos 1 e 2) e uma provável redução nas reações alérgicas. O efeito na redução da morbidez pós-operatória em pacientes cirúrgicos será antecipado sendo também importante vantagem.9
Tecnologias em aféreses serão mais amplamente utilizadas para coleta de doadores sangüíneos e poderão substituir o padrão mundial da coleta de sangue dentro das duas primeiras décadas nos países economicamente desenvolvidos. Isto porque, devido à idade populacional, poucos doadores são vantajosos e pessoas idosas são os maiores consumidores de produtos sangüíneos. Maximizar a coleta desses doadores será de suprema importância. Quando isso ocorrer, "unidades" de sangue não estarão em apropriados pedidos, como a coleta de células vermelhas irá conter 380 - 400 mL de células vermelhas e todas as plaquetas serão derivadas de aféreses (doador único); plasma será a "unidade" de 500 - 600 mL, enfatizando a necessidade da prescrição em mL/kg. A atenuação microbiana de produtos acelulares, com a destruição de vírus e bactérias, está avançando desde 1999 e será, provavelmente, suplementada em 2010. Isto geralmente ocorre pela adição de azul de metileno nas unidades únicas com subseqüente exposição à luz fluorescente, a quarentena das unidades únicas, pasteurização ou tratamento dos pools de plasma com detergente solvente. Já a atenuação microbiana de produtos sangüíneos celulares está mais desafiadora. Para células vermelhas, fitalociaminas (quando expostas à luz vermelha) e psoralen derivados inativam bactérias e vírus. Entretanto, ocorre algum dano para a membrana das células vermelhas. Para plaquetas, derivados psoralen mostram-se extremamente promissores. Produtos celulares inativados utilizando estes processos (ou outros) irão continuar em experiências clínicas próximo a primeira década. Proteínas recombinantes do plasma vêm sendo eficazes para fator VIII e fator IX. Albumina recombinante e outras proteínas poderão substituir produtos derivados plasmáticos dentro de poucas décadas.9
Recebido: 12/04/2004
Aceito após modificações: 05/06/2004
Avaliação: Editor e dois revisores externos.
Conflito de interesse: não declarado
-
1Ministério da Saúde (Brasil). Resolução da Diretoria Colegiada -RDC no. 343, de 13 de dezembro de 2002. Anexo 1- Regulamento Técnico dos Serviços de Hemoterapia,. Brasília, Distrito Federal: Ministério da Saúde, 2002.
- 2. Kennedy MS, Julius C. Transfusion therapy. In: Harmening, D. Modern Blood Banking and Transfusion Practices. 3th. ed. Philadelphia: FA Davis Company, p. 316-333, 1994.
- 3. Associação Americana de Bancos de Sangue (AABB). Terapêutica Transfusional: Manual para Médicos. 3 ed. Bethesda, 1986, 104p.
- 4. Walker RH. Technical Manual. 11th ed. Bethesda: American Association of Blood Banks, p:389-434, 1993.
- 5. Wendel Neto S. Hemoterapia. In: Verrastro T, Lorenzi TF, Wendel Neto S. Hematologia e Hemoterapia: Fundamentos de Morfologia, Fisiologia, Patologia e Clínica. São Paulo: Ed. Atheneu, p. 237-293, 1996.
- 6. Wright PA. Seleção do doador e preparação do componente. In: Harmening DM, Calhoun L e Polesky HF. Técnicas Modernas em Bancos de Sangue e Transfusão. 2Ş ed. Rio de Janeiro: Revinter, p.198-208, 1992.
- 7. Viele M, Donegan E, Bossom EL. Banco de sangue e imuno-hematologia. In: Stites DP, Terr AI, Parslow TG. Imunologia Médica. 9Ş ed. Rio de Janeiro: Guanabara Koogan, p:215-222, 2000.
- 8. Murphy MF, Wallington TB, Kelsey P, et al. Guidelines for the clinical use of red cell transfusions. British Journal of Haematology 2001; 113:24-31.
- 9. Sweeney JD, Rizk Y. Clinical Transfusion Medicine. Austin, USA: Landes Bioscience 1999, 170p.
- 10. Hébert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. New England Journal of Medicine 1999; 340: 409-17.
- 11. Surgenor DM, Wallace EL, Churchhill H, et al. Red cell transfusions in total knee and total hip replacement surgery. Transfusion 1991; 31:531-7,
- 12. Audet AM, Andrzejewsky C, Popovsky MA. Red blood cell transfusion practices in patients undergoing orthopedic surgery: a multi-institutional analysis. Orthopedics 1998; 21:851-8.
- 13. Churchhill WH, Mcgurk S, Chapman RH, et al. The collaborative hospital transfusion study: variations in use of autologus blood account for differences in red cell use during primary hip and knee surgery. Transfusion 1998; 38:530-9.
- 14. Zago MA, Falcão RP, Pasquini R. Hematologia Fundamentos e Prática. São Paulo: Ed. Atheneu, p:414-416, 2001a.
- 15. Zago MA, Falcão RP, Pasquini R. Hematologia- Fundamentos e Prática. São Paulo: Ed. Atheneu, p:1002-101, 2001b.
- 16. Goodnough LT, Brecher ME, Kanter MH, et al. Transfusion Medicine. First of two parts. Blood Transfusion. The New England Journal of Medicine 1999; 340(6):438-47.
- 17. Buchignani MR, Deffune E, Mastranjo GC, et al. Controle de qualidade de concentrados de plaquetas (CP). Revista Brasileira de Análises Clínicas 1998; 30(3):137-40.
- 18. Johannessen B, Haugen T, Scott CS. Standardisation of platelet counting accuracy in blood banks by reference to an automated immunoplatelet procedure: comparative evaluation of Cell-Dyn CD4000 impedance and optical platelet counts. Transfusion & Apheresis Science 2001; 25(2):93-106.
- 19. Rached RA, Cavalheiro Filho C. Transfusão sangüínea em cirurgia cardíaca. Hematologia - Hemoterapia 1997; 2(1):14-28.
- 20. Valencia Salazar G, Mandujano Sánchez L, Acosta Rodriguez R, et al. Recién nacidos com poliglobulia. Tratamiento comparativo con plasma y com solución salina. Acta Pediátrica Méxicana 1996; 17(5):231-6.
Datas de Publicação
-
Publicação nesta coleção
09 Mar 2005 -
Data do Fascículo
2004
Histórico
-
Aceito
05 Jun 2004 -
Recebido
12 Abr 2004