Resumos
Este artigo descreve as estruturas e funções da membrana eritrocitária e sua importância na medicina transfusional. A membrana eritrocitária é uma das membranas mais conhecidas em termos de estrutura, função e genética. Como qualquer membrana plasmática, tem como função mediar transportes e, ainda, fornece ao eritrócito resistência e maleabilidade. De acordo com a International Society of Blood Transfusion (ISBT), são mais de 500 antígenos expressos na membrana das hemácias e, destes, cerca de 270 estão envolvidos nos casos de reação transfusional e doença hemolítica do feto e do recém-nascido. Na classificação feita pela ISBT, destaca-se a série de alta freqüência representada por antígenos presentes em mais de 99% dos indivíduos de uma população. Estes antígenos são conhecidos também como antígenos públicos e a maioria, quando ausente, determina problemas graves do ponto de vista transfusional. Como exemplo dessa problemática, uma gestante com ausência do antígeno P já sofreu seis abortos de repetição por insuficiência placentária devido ao anticorpo formado pela ausência do antígeno. Proteínas importantes são descritas nesta revisão como: banda 3, glicoforinas, espectrina e outras. A banda 3 é a mais abundante proteína integral da membrana do eritrócito e sua principal função é mediar a troca de cloro e ânions de bicarbonato através da membrana plasmática. A segunda proteína integral mais abundante é a sialoglicoproteína glicoforina A (GPA). Com um alto conteúdo de ácido siálico, a GPA contribui com a rede de carga negativa na superfície da membrana do eritrócito, minimizando, assim, a interação célula-célula e prevenindo sua agregação. Glicoforina C (GPC) é o receptor para PfEBP-2 (baebl, EBA-140), o mais novo local de ligação identificado para o Plasmodium falciparum.O complexo terciário - espectrina, actina e 4.1R - define a rede de citoesqueleto da membrana do eritrócito e é ainda responsável pela estabilidade sob mecanismos de estresse. Essa revisão da membrana eritrocitária é importante para um melhor entendimento das reações transfusionais, onde a formação de anticorpos contra antígenos de alta freqüência dificulta a transfusão compatível. O estudo da diversidade antigênica, a caracterização bioquímica de diferentes proteínas trará uma contribuição para o estabelecimento da saúde, assim como para o diagnóstico, desenvolvimento de tecnologias, como a produção de anticorpos monoclonais e conduta terapêutica para muitas enfermidades.
Membrana eritrocitária; proteínas; antígenos; glicoforinas
This article describes the structures and functions of the erythrocyte membrane and its importance in transfusional medicine. The erythrocyte membrane is one of the best known membranes in terms of structure, function and genetic disorders. As any other plasma membrane, it mediates transport functions. It also provides the erythrocytes with their resilience and deformability. According to the International Society of Blood Transfusion (ISBT), more than 500 antigens are expressed in the erythrocyte membrane, and around 270 are involved in transfusion reaction cases and hemolytic diseases of the fetus and newborn. In the ISBT classification, the high frequency series is represented by antigens in more than 99% of population (high prevalence antigen). In transfusion, the absence of these antigens determines severe problems as for example, one woman without the P antigen suffered 6 repetitive miscarriages due to placental insufficiency, which was caused by an antibody formed against the absent P antigen. Some important erythrocyte membrane proteins are described here including Band 3, Glycophorins and spectrin. The most abundant integral membrane protein is Band 3 and its main function is to mediate exchange of chloride and bicarbonate anions across the plasma membrane. The second most abundant integral membrane protein in the human erythrocyte is sialoglycoprotein glycophorin A (GPA). With its high sialic acid content, GPA is the main contributor to the net negative cell-surface charge and is thus critical for minimizing cell-cell interactions and preventing red cell aggregation. Glycophorin C (GPC) is the receptor for PfEBP-2 (baebl, EBA-140), the newly identified erythrocyte binding ligand of Plasmodium falciparum. The ternary complex of spectrin, actin and 4.1R defines the nodes of the erythrocyte membrane skeletal network, and is inseparable from membrane stability when under mechanical stress. This erythrocyte membrane review is important for a better understanding of transfusion reactions, where the antibody formation against high prevalence antigens makes compatible transfusions difficult. The study of antigen diversity and biochemical characterization of different proteins will contribute to healthcare, as well as diagnosis, development of technology such as monoclonal antibody production and the therapeutic conduct of many diseases.
Erythrocyte membrane; proteins; antigens; glycophorins
REVISÃO REVIEW
Aspectos estruturais da membrana eritrocitária
Structural aspects of the erythrocyte membrane
Priscila MuradorI; Elenice DeffuneII
IMestre em Biotecnologia Médica pelo Hemocentro da Faculdade de Medicina de Botucatu. Bióloga do Hemocentro de Botucatu
IIDoutora em Imunologia Universidade Pierre et Marie Curie IV Paris. Docente do Deptº de Urologia da Fac. de Medicina de Botucatu (Unesp)
Endereço para correspondência Correspondência: Priscila Murador Hosp. das Clínicas da Faculdade de Medicina de Botucatu Divisão Hemocentro Distrito de Rubião Jr. s/n Lab. de Engenharia Celular 18618000 BotucatuSP Brasil Email: pmurador@fmb.unesp.br
RESUMO
Este artigo descreve as estruturas e funções da membrana eritrocitária e sua importância na medicina transfusional. A membrana eritrocitária é uma das membranas mais conhecidas em termos de estrutura, função e genética. Como qualquer membrana plasmática, tem como função mediar transportes e, ainda, fornece ao eritrócito resistência e maleabilidade. De acordo com a International Society of Blood Transfusion (ISBT), são mais de 500 antígenos expressos na membrana das hemácias e, destes, cerca de 270 estão envolvidos nos casos de reação transfusional e doença hemolítica do feto e do recémnascido. Na classificação feita pela ISBT, destacase a série de alta freqüência representada por antígenos presentes em mais de 99% dos indivíduos de uma população. Estes antígenos são conhecidos também como antígenos públicos e a maioria, quando ausente, determina problemas graves do ponto de vista transfusional. Como exemplo dessa problemática, uma gestante com ausência do antígeno P já sofreu seis abortos de repetição por insuficiência placentária devido ao anticorpo formado pela ausência do antígeno. Proteínas importantes são descritas nesta revisão como: banda 3, glicoforinas, espectrina e outras. A banda 3 é a mais abundante proteína integral da membrana do eritrócito e sua principal função é mediar a troca de cloro e ânions de bicarbonato através da membrana plasmática. A segunda proteína integral mais abundante é a sialoglicoproteína glicoforina A (GPA). Com um alto conteúdo de ácido siálico, a GPA contribui com a rede de carga negativa na superfície da membrana do eritrócito, minimizando, assim, a interação célulacélula e prevenindo sua agregação. Glicoforina C (GPC) é o receptor para PfEBP2 (baebl, EBA140), o mais novo local de ligação identificado para o Plasmodium falciparum.O complexo terciário espectrina, actina e 4.1R define a rede de citoesqueleto da membrana do eritrócito e é ainda responsável pela estabilidade sob mecanismos de estresse. Essa revisão da membrana eritrocitária é importante para um melhor entendimento das reações transfusionais, onde a formação de anticorpos contra antígenos de alta freqüência dificulta a transfusão compatível. O estudo da diversidade antigênica, a caracterização bioquímica de diferentes proteínas trará uma contribuição para o estabelecimento da saúde, assim como para o diagnóstico, desenvolvimento de tecnologias, como a produção de anticorpos monoclonais e conduta terapêutica para muitas enfermidades.
Palavraschave: Membrana eritrocitária; proteínas; antígenos; glicoforinas.
ABSTRACT
This article describes the structures and functions of the erythrocyte membrane and its importance in transfusional medicine. The erythrocyte membrane is one of the best known membranes in terms of structure, function and genetic disorders. As any other plasma membrane, it mediates transport functions. It also provides the erythrocytes with their resilience and deformability. According to the International Society of Blood Transfusion (ISBT), more than 500 antigens are expressed in the erythrocyte membrane, and around 270 are involved in transfusion reaction cases and hemolytic diseases of the fetus and newborn. In the ISBT classification, the high frequency series is represented by antigens in more than 99% of population (high prevalence antigen). In transfusion, the absence of these antigens determines severe problems as for example, one woman without the P antigen suffered 6 repetitive miscarriages due to placental insufficiency, which was caused by an antibody formed against the absent P antigen. Some important erythrocyte membrane proteins are described here including Band 3, Glycophorins and spectrin. The most abundant integral membrane protein is Band 3 and its main function is to mediate exchange of chloride and bicarbonate anions across the plasma membrane. The second most abundant integral membrane protein in the human erythrocyte is sialoglycoprotein glycophorin A (GPA). With its high sialic acid content, GPA is the main contributor to the net negative cellsurface charge and is thus critical for minimizing cellcell interactions and preventing red cell aggregation. Glycophorin C (GPC) is the receptor for PfEBP2 (baebl, EBA140), the newly identified erythrocyte binding ligand of Plasmodium falciparum. The ternary complex of spectrin, actin and 4.1R defines the nodes of the erythrocyte membrane skeletal network, and is inseparable from membrane stability when under mechanical stress. This erythrocyte membrane review is important for a better understanding of transfusion reactions, where the antibody formation against high prevalence antigens makes compatible transfusions difficult. The study of antigen diversity and biochemical characterization of different proteins will contribute to healthcare, as well as diagnosis, development of technology such as monoclonal antibody production and the therapeutic conduct of many diseases.
Key words: Erythrocyte membrane; proteins; antigens; glycophorins.
A membrana da hemácia
A membrana da hemácia é o modelo primário para estudo de membrana plasmática celular animal, pelo fato de ser desprovida de núcleo e organelas. As membranas plasmáticas de um modo geral apresentamse como barreiras seletivas que asseguram a composição interna constante das células, através do controle da transferência ativa e passiva de inúmeras moléculas. Estas membranas têm um sistema estrutural complexo, citoesqueleto, que envolve tanto a forma da célula, como sua mobilidade, deformabilidade e o transporte de macromoléculas. Entre os diferentes constituintes da membrana apresentamse receptores envolvidos em funções complexas que permitem a comunicação entre as células, reconhecimento imunológico e fenômenos de adesão celular.1
A membrana eritrocitária, como as milhares de outras células do organismo humano, é essencialmente constituída de lipídeos e proteínas. A hemácia não é um simples "saco" contendo hemoglobina. Os lipídeos e proteínas estão dispostos na superfície da hemácia de forma tão complexa que são comparáveis com os mais sofisticados mosaicos bizantinos.2 Esta membrana consiste em uma bicamada fosfolipídica, que representa aproximadamente 50% de sua massa total e forma a barreira entre dois compartimentos líquidos, intra e extracelular.3 As trocas entre estes compartimentos são feitas através de bombas, canais de trocas de íons e transporte molecular como o da glicose.2 Além disso, a deformabilidade de sua membrana, a fluidez de seu citoplasma e a complexidade de sua superfície membranária, em relação ao seu volume interno, asseguram as funções de transporte de O2 dos pulmões e remoção do CO2 dos tecidos para os pulmões. Esta capacidade de transporte depende das condições de adaptação circulatória e também da hemoglobina citosólica e de um polipeptídio maior da membrana: a banda 3 ou proteína de troca de íons (anion exchanger 1, AE1). Como transportador de membrana, a AE1, ou banda 3, media as trocas de Cl/HCO3, aumentando então a capacidade sangüínea de transporte de CO2, garantindo a homeostase e o equilíbrio ácidobásico. Por interação com lipídeos e proteínas, a banda 3 multifuncional (AE1) une o complexo multiprotéico do citoesqueleto e confere aos eritrócitos propriedades mecânicas e elásticas, regulando a viscosidade sangüínea. Todas as proteínas de transporte da membrana do eritrócito são produzidas nos estágios primordiais dos eritroblastos.3
O modelo estrutural de membrana eritrocitária mais aceito é o de mosaico bilipídico e fluídico proposto e descrito por Singer e Nicolson em 19721 como representado na Figura 1.
Diversas doenças podem ser associadas a defeitos na estrutura dessa membrana que, embora a mais estudada, ainda possui várias características sem um completo entendimento. Estes defeitos podem envolver outras proteínas representadas graficamente na Figura 2.
Proteínas de membrana
As proteínas que compõem a membrana eritrocitária são estruturalmente classificadas em integrais ou transmembranárias e periféricas ou extramembranárias. Essas proteínas do citoesqueleto membranário formam uma verdadeira malha, que constitui quase uma concha para o material intracelular. Este esqueleto é responsável pela forma, bicôncava normal ou anormal, em caso de defeitos genéticos, dos glóbulos vermelhos, e representa por si só 60% da massa protéica de toda a membrana.2
As proteínas integrais penetram ou atravessam a bicamada lipídica e interagem com a porção hidrofóbica das moléculas lipídicas. Fazem parte destas as proteínas de transporte, como a banda 3, denominada proteína transportadora de íons, e as glicoforinas A, B, C, D, que possuem receptores de membrana e antígenos que participam do reconhecimento célulacélula na extremidade externa e auxiliam na estabilização do citoesqueleto através de ligações com a proteína 4.1 na face interna da membrana.5
Das diferentes proteínas da membrana eritrocitária, o domínio citoplasmático da banda 3 se destaca como um grande centro organizacional que interage com muitas outras proteínas periféricas ou ligantes: anquirina (a maior ponte para o citoesqueleto espectrinaactina), proteína 4.1, proteína 4.2, aldolase, gliceraldeído3fosfato desidrogenase (G3PD), fosfofrutoquinase (PFK), desoxihemoglobina, tirosinaquinase p72syk e hemicromos, que regulam a interação do citoesqueleto com enzimas glicolíticas.6
Proteínas integrais
Banda 3, anion exchanger 1 (AE1)7
As proteínas integrais da membrana ou transmembranárias estão incorporadas na parte mais profunda da bicamada lipídica. Seu domínio funcional pode se estender tanto nas zonas extra como intramembranárias. Exemplos disso são: a banda 3 ou anion exchanger 1 (AE1), implicada no mecanismo de transporte de muitas moléculas e situada no compartimento extramembranário, a citocromob 5redutase, que participa do mecanismo de redução da metaemoglobina.7,8
A banda 3 é considerada a principal proteína integral da membrana e seu peso molecular é de 102kDa. Representa 25%30% de todas as proteínas da membrana e tem em torno de 106 cópias por hemácia. Seu gene está localizado no cromossomo 17q21q22. A banda 3 está expressa na membrana plasmática de todos os eritrócitos e pode ser detectada também na membrana basolateral das células intercaladas nos túbulos distais e nas alças de Henle, proximal e distal. A banda 3 tem, recentemente comprovada, atuação na retirada de CO2 dos tecidos, regulando também o transporte de HCO3. Além disso, regula o metabolismo da glicose, mantém a morfologia eritrocitária e remove células senescentes. Mutações da banda 3 têm sido associadas à esferocitose hereditária e acidose tubular renal. Outras mutações foram identificadas no sudoeste da Ásia, determinando aumento da rigidez do eritrócito e resistência à infecção por malária associados à ovalocitose. Um caso registrado na literatura relata ausência de banda 3 com esferocitose hereditária e nefrocalcinose. A banda 3 tem sido considerada, ainda, como receptora para o Plasmodium. falciparum.7,9
Ela possui um domínio transmembranário de 52kDa que atravessa de 12 a 13 vezes a bicamada lipídica, e um domínio citoplasmático de 43kDa. O domínio transmembranário tem um papel primordial na troca de íons, principalmente o cloro (Cl) e bicarbonato (HCO3). O Cl é transportado 1 milhão de vezes mais rápido que o cátion correspondente o potássio (K+) e apenas 1.000 a 10.000 vezes mais rápido do que um ânion divalente como o sulfato (SO42). Este mecanismo fisiológico é muito importante quando se tem perda rápida sangüínea ou de volume através de outras vias.1,2,9 A combinação de diferentes tecnologias tais como timeresolved optical anisotropy (TOA) e saturationtransfer electron paramagnetic resonance (STEPR) spectroscopie tem sido utilizada para análise da flexibilidade do domínio citoplasmático próximo ao domínio transmembranário, onde ocorre a troca de íons.10
A forte concentração de resíduos carregados negativamente no domínio citoplasmático da banda 3 tem papel importante na interação desta proteína com outras, sendo esta a responsável pela fixação das proteínas membranárias 4.1, 4.2 e anquirina. Este segmento citoplasmático tem forte afinidade pelas hemoglobina, aldolases, G3PDH e a PFK. Estes sítios têm o significado fisiológico também na regulação da glicólise e auxiliam a formação de complexos multienzimáticos.12
Em 2003, estudos descreveram aspectos da porção N terminal da banda 3 ou AE1(CDB3) de hemácias humanas. A porção CDB3 é o substrato executor da apoptose induzida pela caspase 3. A ação da caspase 3 é observada em hemácias adultas, mas não em neócitos ou hemácias jovens. Esta descoberta esclarece a eluição de alguns antígenos eritrocitários durante o tempo de conservação das hemácias in vitro.12
No ano seguinte foi publicado um trabalho sobre a purificação e caracterização do domínio C terminal da banda 3, também denominada de HEMB3, com 33 aminoácidos. Os autores isolaram dois peptídios, C1 e KS4. O peptídeo C1, quando colocado em presença de extrato de membrana eritrocitária humana, desempenhou uma atividade de protease sobre a porção C terminal GPA. No entanto, esta atividade é inibida pela tripsina. O outro peptídeo isolado, KS4, não possui esta característica.13
Ao analisar a importante contribuição das proteínas de membrana e o formato das hemácias, o autor relacionou, por estudos dinâmicos e por microscopia eletrônica, a acantocitose não só com as alterações da banda 3, com deficiências da piruvatoquinase e pirimidina5nucleotidase. As alterações da banda 3 estão também confirmadamente relacionadas com a estomacitose hereditária, fenótipo In(Lu), coreaacantocitose e fenótipo McLeod (KX).14
Em outro trabalho foi estudado o gene AE1 de dois irmãos portadores de acidose tubular renal e nefrocalcinose. Este gene codifica a proteína transportadora de ânions (AE1) ou banda 3, expressa em hemácias e células dos túbulos renais. Os autores identificaram que uma deleção determina a mutação no códon 888 (Ala888>Leu) seguida de stop codon na posição 889, truncando a proteína em 23 aminoácidos. Os autores sugerem que a análise precoce do gene AE1 e a identificação da mutação descrita sejam decisivas para o diagnóstico de nefrocalcinose.15
Casos de malformação congênita com proeminência frontal e alterações periféricas do Sistema Nervoso Central têm sido associados à deficiência de glicosilação do tipo Ig. Esta deficiência compromete a glicosilação da proteína banda 3 da superfície da hemácia. Tratase de uma mutação do gene ALG12 que codifica a dolicholPmanose do sistema retículoendoplasmático, o que determina a hipoglicosilação da GPA e alterações estruturais da banda 3. Portanto, o estudo eletroforético desta proteína em caso de malformação congênita pode levar ao diagnóstico.16
O sucesso ou a refratariedade da esplenectomia no controle clínico da esferocitose hereditária foram analisados também. Nos estudos, os autores identificaram que os pacientes que têm sucesso com a esplenectomia mantêm menos de 60 moléculas de IgG fixadas sobre as hemácias pósprocedimento, caso estruturalmente tenham defeito na espectrina e na anquirina. Nos casos de refratariedade, observaram que as hemácias dos pacientes, após o ato cirúrgico, mantinham mais de 140 moléculas de IgG fixadas e, portanto, continuavam sendo opsonizadas. Neste caso, o paciente era portador de deficiência na banda 3.17
A interação do marcador CD47 (Integrinassociated protein/IAP) na matriz extracelular de membranas que coexpressam a integrina tem sido alvo de pesquisas. Concluiuse que este marcador nos eritrócitos é um ligante entre a banda 3 e o complexo Rh na manutenção da integridade da membrana.
Macrófagos e células dendríticas expressam o receptor SIRPa, o que os torna menos ativos, minimizando o efeito da doença autoimune. Quando as células são CD47 negativas, o efeito inibidor da opsonização não ocorre. Portanto, a interação CD47 e SIRPa tem um papel importante na limitação do processo de destruição das hemácias em casos de anemia hemolítica autoimune.18
Glicoforinas
Glicoforina A (GPA)
É a maior sialoglicoproteína transmembrana dos eritrócitos, correspondendo a 2%4% das proteínas de membrana. Em geral, as glicoforinas têm três domínios: um domínio externo, onde estão os oligossacarídeos, um segmento incluído no interior da bicamada e um segmento interno citoplasmático. O domínio externo carrega determinantes comumente conhecidos como Enª. A concentração de GPA sobre as hemácias é responsável por 80% da carga negativa destas células em função da sua constituição bioquímica composta de ácido siálico e carboidratos terminais. Essa superfície negativa celular ajuda a minimizar a interação célulacélula e prevenir a aglutinação eritrocitária. A GPA é suscetível à clivagem pela enzima tripsina, ficina e papaína na região próxima à membrana eritrocitária. Seu peso molecular é de 16kDa. A GPA parece estar presente de forma maciça nas linhagens celulares eritróides e pode ser detectada em diferentes fases da divisão celular em eritroblastos basófilos e normoblastos.1,19
Os domínios extracelulares da GPA e banda 3 são extremamente polimórficos. A associação da GPA com o AE1 ou banda 3 contribui com propriedades mecânicas na membrana eritrocitária e também apresenta relação com o grupo sangüíneo Wrb cujo sítio de ligação encontrase exatamente na região das duas proteínas. Sobre o segmento N terminal externo da GPA, estão representados os antígenos dos grupos sangüíneos M e N e os receptores de lectina, do vírus influenza e myxovirus. Esta porção da GPA atua ainda como receptora para o parasita da malária P. falciparum e para o vírus Sendai.20,21
A GPA e a GPB são pontos de ancoragem para 43 antígenos dos sistemas MNSs. Muitas anormalidades das glicoforinas estão descritas na literatura especializada. A ausência de GPA no homem determina um grupo sangüíneo denominado En (a), já a ausência de GPA e GPB no mesmo indivíduo determina um fenótipo denominado Mk, e a ausência apenas da GPB determina a falta dos antígenos S e s.21
Glicoforina B (GPB)
É uma glicoproteína transmembranária de 10kDa, é codificada pelo gene localizado no cromossomo 4q2831. Expressa determinantes para os antígenos S e s. Está presente em todas as hemácias e seus precursores. A função das hemácias parece ser normal mesmo em indivíduos com deficiência de GPA e GPB. Os indivíduos com fenótipo nulo MN: En(a) são totalmente resistentes a infecções por Plasmodium falciparum.8,9,21
Glicoforina C (GPC)
A GPC é o menor componente protéico da membrana eritrocitária. É codificada pelo gene GYPC localizado no cromossomo 2. Este mesmo gene codifica uma forma truncada conhecida como glicoforina D GPD. A GPC é uma proteína de 35kDa. As glicoforinas C e D definem os grupos sangüíneos Gerbich: Ge:1, Ge:2, Ge:3 e Ge:4. A maioria dos fenótipos expressa os quatro antígenos, no entanto alguns indivíduos que sofreram mutação podem expressar fenótipos raros como o fenótipo Leach (Ge1,2, 3,4), onde ocorre a deficiência completa tanto da GPC quanto da GPD. Todos os indivíduos de fenótipo Leach apresentam eliptocitose hereditária, destacando o papel importante da GPC e da banda 4.1 no complexo juncional.22 Informações e características das diferentes glicoforinas estão descritas no Quadro 1.
Há muito tempo acreditase que as glicoforinas servem como receptores para o P. falciparum. No entanto, a maioria dos estudos indicava a GPA como a receptora primária e a GPB como a secundária. A proteína PfEBF2 que se liga ao eritrócito humano é dependente de ácido siálico; os autores demonstraram que ela não se liga nem à GPA e tampouco à GPB. A interação com o receptor da GPC representa um terceiro caminho para a invasão.23
Outras proteínas da membrana eritrocitária
Outras proteínas maiores têm sido descritas na membrana do eritrócito. São receptores enzimáticos ou hormonais como o receptor da insulina e o transportador de glicose que corresponde a uma proteína da banda 4.5.
As proteínas periféricas formam o citoesqueleto da membrana constituindose, principalmente, por espectrina, actina, anquirina, proteína 4.1 e 4.9. Mesmo após a extração das proteínas de membrana do eritrócito em presença de detergente, o esqueleto membranário conserva a forma da célula originária. Três das proteínas já mencionadas interferem essencialmente na estrutura: a espectrina, a actina e a banda 4.1.3
Proteínas periféricas
Espectrina
A espectrina é a mais abundante proteína periférica do citoesqueleto e está presente em um número de 105 cópias por célula. Apresenta peso molecular de 285kDa. É uma proteína longa e fibrilar constituída por duas cadeias polipeptídicas a e b com peso molecular de 240 e 220kDa respectivamente, correspondendo às bandas 1 e 2 na representação esquemática da eletroforese de proteínas membranárias (Figura 3).
A espectrina recebe esse nome por servir de sustentação à membrana e ser a proteína periférica responsável pelo fenômeno dos ghosts eritrocitários. A espectrina e polipeptídios associados são responsáveis tanto pelo formato do glóbulo vermelho quanto pela sua deformabilidade, além de constituírem elementos estabilizadores da bicamada lipídica.1
Esta proteína, durante muito tempo, foi considerada específica dos glóbulos vermelhos; no entanto, sabese que ela está presente em muitos outros tecidos. Ela faz parte da família de proteínas diméricas, interage com a actina e com a calmodulina, que, por sua vez, interagem com células específicas no cérebro e polipeptídeos específicos da camada ciliar do intestino. Os estudos bioquímicos mostram que a espectrina é clivada pela tripsina em cinco segmentos: domínios a I,II,III,IV e V partindo da extremidade NH2 terminal. Na cadeia b, os domínios individualizados por ação da enzima são denominados de bI a IV a partir da extremidade C terminal, como pode ser visto no Quadro 2. Ambas as cadeias a e b são fortemente homólogas, possuindo 30% de absoluta identidade e estão associadas de forma antiparalela; o grupamento NH2 terminal a da cabeça do domínio aI fica face ao grupo C terminal do domínio bI. Os dímeros da espectrina são associados in vitro sobre a forma de tetrâmeros dependendo da força iônica e temperatura. A zona de interação do tetrâmero, que é também a forma fisiológica, é constituída pela região N terminal de uma cadeia a que está de frente para a região C terminal de uma cadeia b do dímero oposto.12
Os tetrâmeros de espectrina se unem a outros pela sua extremidade distal, através de curtos filamentos de actina que formam "nós" na malha do citoesqueleto eritrocitário. Estas interações espectrinaactina têm um elemento facilitador representado pela proteína 4.1. A rede de espectrina se fixa a um fragmento de 43kDa que emergem no citoplasma, ligado à banda 3 por intermédio da anquirina (banda 2.1).2
A anquirina, banda 2.1 ou sindeína
A anquirina possui três domínios estruturais: domínio funcional, que se liga à subunidade b da espectrina; um segundo domínio funcional que interage com a banda 3; um domínio regulador que controla a função dos dois precedentes. Esta proteína tem peso molecular de 434kDa e está representado em um número de 105 cópias por célula. Nos estudos eletroforéticos em gel de poliacrilamida, as membranas dos eritrócitos podem conter no local da corrida da anquirina (banda 2.1) bandas adicionais produtos de proteólise da banda 2.1. Estas últimas são denominadas 2.2, 2.3 etc.2
Arritmias cardíacas ocorrem devido a mutações da anquirinaB, também conhecida como anquirina 2. Essas mutações resultam, ainda, em uma desregulação na organização celular da bomba de sódio, na troca sódio/cálcio e nos receptores inositol1,4,5triphosphate, os quais reduzem os níveis e a atuação desta proteína em túbulos transversos. Alterações na sinalização de Ca2+ em cardiomiócitos adultos também ocorrem, resultando em extrasístoles. Os autores identificaram um novo mecanismo para arritmia cardíaca devido à coordenação anormal de funções múltiplas relacionadas aos canais de transporte de íons.24
Banda 4.1
A banda 4.1 é uma proteína do citoesqueleto com genética e localização típicas e diversas. Esta proteína pode ser encontrada, além da membrana plasmática, em outras localizações intracelulares e no núcleo. Possui peso molecular de 97kDa e está presente numericamente em 2x 105 cópias por célula.25
Os mecanismos de adesão celular são importantes não só para o mecanismo em si mas também para a manutenção da morfogênese do tecido. A banda 4.1 é integrante de uma família de proteínas definidas sobre a membrana do eritrócito como "organizadores" do sistema de aderência. Seu estudo eletroforético também mostra subunidades denominadas 4.1a e 4.1b. A subunidade 4.1b está localizada no compartimento basal, região de adesão da espermatogônia.26
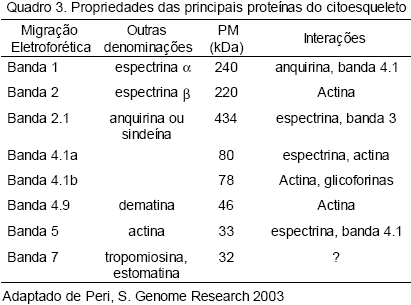
Estudos demonstram que o maior ponto de ligação da banda 4.1 na membrana do eritrócito é com a glicoforina C (GPC) e D (GPD), e que a banda 4.1 purificada pode se ligar a dois locais distintos nas glicoforinas C/D. Uma destas interações é direta, envolvendo resíduos 8298 na GPC (6177 na GPD), enquanto a outra interação é medida pela p55, uma outra proteína periférica de membrana. A proteína p55 também se liga à GPC. Não existem evidências de que ocorra interação da banda 4.1 com a banda 3 também. Acreditase que a distribuição nas ligações das três proteínas a uma membrana normal seja correspondente a 40% para p55, 40% para GPC/D e 20% para a banda 3. Uma mesma região da banda 4.1 liga GPC/D e banda 3, enquanto o local de ligação da p55 é diferente. A interação envolvendo a banda 4.1 com p55 e esta com GPC/D são de alta afinidade, enquanto a GPC/D com banda 3 é de baixa afinidade.27 O Quadro 3 mostra as propriedades das principais proteínas do citoesqueleto eritrocitário.
Banda 4.2 ou palidina
Proteína de peso molecular de 80kDa, está representada 100 mil vezes em cada hemácia e ligase com a banda 3 e com anquirina, desempenhando um papel organizacional na membrana.12 É um importante componente no citoesqueleto da membrana eritrocitária porque regula a estabilidade e flexibilidade dos eritrócitos.28
Banda 4.9 ou dematina
A Banda 4.9 é fosforilada por várias proteínas quinases (PK) do eritrócito e apresenta peso molecular de 46kDa. Ao realizar cromatografia das proteínas da membrana do eritrócito, duas proteínas com similares mobilidades no gel de eletroforese foram encontradas: a primeira com peso molecular de 49kDa e pH básico, e a segunda, com peso molecular de 50,5kDa, pH ácido. Foi verificado que a proteína de 49kDa se liga a filamentos de actina.29
Para demonstrar a versatilidade de atuação da banda 4.9, realizouse um estudo no qual os autores usaram a técnica de immunoblotting revelandoa com um anticorpo antibanda 4.9, purificado e marcado. Demonstrouse e quantificouse a presença de uma forma de reação imune na banda 4.9 nos cérebros e cristalino de aves e bovinos, no coração de aves, tanto quanto em plaquetas humanas e de mamíferos, aves, peixes e eritrócitos de anfíbios. A banda 4.9 foi encontrada, ainda, em fibras corticais de cristalino e em neurônios cerebrais de aves.30
Banda 5 ou actina
A banda 5 ou actina é o maior componente protéico do citoesqueleto da maioria das células eucariontes. É abundante e localizase logo abaixo da membrana citoplasmática. É uma proteína de 33kDa que forma o denominado complexo juncional composto por 12 moléculas de actina associadas à banda 4.1, aducina e tropomiosina. Este complexo fortalece a ligação da actina com a espectrina. Existem dois tipos de actina: actina G (globular) e actina F (funcional), sendo esta última a que se compacta para formar o complexo juncional.12
Banda 6
Corresponde à enzima gliceraldeídofosfato desidrogenase (GAPD) de peso molecular de 36kDa que se liga à banda 3 no mesmo local da hemoglobina.
Banda 7
É uma banda composta principalmente por tropomiosina de peso molecular de 32kDa. Para serem visualizadas no estudo eletroforético, o extrato membranário tem que ser tratado com MgCl2. Essa proteína integra o complexo juncional associado à actina.12
Aducina
É um heterodímero constituído de três subunidades: aducina 1, com peso molecular de 84kDa, aducina 2 com 81kDa e aducina 3, com 79kDa. Ligase às actina e espectrina. Destacase que a ligação da aducina à espectrina é inibida pela banda 4.1, provavelmente por competirem pelo mesmo sítio de ligação.12
Os quadros 4, 5 e 6 descrevem as proteínas membranárias periféricas quanto a: nome, gene, localização, PM, sinônimos, sítios de expressão e interações.31
A imunoematologia, a imunoquímica e a imunogenética são as trigêmeas do último século: elas nasceram, de fato, em Viena, em 1900, quando tudo começou com a descrição do grupo sangüíneo ABO, por Karl Landsteiner. A descoberta desse sistema permitiu, mais concretamente, o estabelecimento das bases científicas da transfusão sangüínea. Nos anos seguintes à sua descoberta, Landsteiner previu que os grupos sangüíneos permitiriam, um dia, identificar os homens tão bem, ou melhor, que as suas próprias impressões digitais.
Desde 1908, sabese cientificamente que os grupos sangüíneos pertencem ao capital hereditário que cada um de nós recebe, que eles são transmitidos dos pais aos filhos, seguindo as leis da genética, que alguns são constantes e diversos, constantes no mesmo indivíduo, diversos na coletividade, distribuídos segundo certas proporções através dos séculos. São milenares dentro de uma população dada, permanecendo os mesmos do nascimento à morte do indivíduo até o advento do transplante da medula óssea. O mosaico constituinte da membrana eritrocitária, os sistemas de grupo sangüíneo, suas coleções e séries são testemunhos inequívocos da hereditariedade. A intrincada diversidade expressa na membrana eritrocitária define a identidade biológica de cada um, reconhecendo o caráter único do ser humano.
O estudo da diversidade dos antígenos, a caracterização bioquímica das diferentes proteínas e o estabelecimento das funções desta multiplicidade antigênica trará uma substancial contribuição tanto para o estabelecimento do estado de saúde, assim como para o diagnóstico, desenvolvimento de tecnologias como a produção de anticorpos monoclonais e a conduta terapêutica de muitas enfermidades, como é o exemplo da malária.
Recebido: 08/06/2006
Aceito após modificações: 29/12/2006
Avaliação: Editor e dois revisores externos
Conflito de interesse: não declarado
- 1. Salmon C, Cartron JP, Rouger P . The human blood groups part1. New York: Masson Publishing USA; 1984. cap. 4, p.4453.
- 2. Wajcman H, Lantz B, Girot R. Les Maladies du globule rouge. Paris: Les editions INSERM. MédecineSciences Flammarion;1984. cap. 3, p.3144.
- 3. Cooper GM. The cell surface In: The cel: A molecular approach. Washington: ASM Press 1997. p.467517.
- 4. Matei H, Frentescu L, Benga Gh. Comparative studies of the protein composition of red blood cell membranes from eight mammalian species. J Cell Mol Med. 2000;4:27080.
- 5. Gallager PG, Forget BG, Lux SE. Disorders of Erythrocyte Membrane. In: Nathan DG, Oski FA, Orkin SH. Hematology of Infancy and Childhood. 5 ed. Philadelphia: WB Saunders; 1998. p.544664.
- 6. Zhang D, Kiyatkin A, Bolin JT, Low PS. Crystallographic structure and functional interpretation of the cytoplasmic domain of erythrocyte membrane band 3. Blood. 2000;96:292533.
- 7. Jarolin P, Rubin HL, Zakova D, Storry J, Reid ME. Characterization of seven low incidence blood group carried by erythrocyte band 3 protein. Blood. 1998;92:483643.
- 8. Storry J. A review: modification of red blood membrane and its application in blood groups serology. Immunology. 2000;16(3):35.
- 9. Telen MJ, Kaufman R. In: Greer JP, Foerster J, Lukens JN, Rodgers GM, Paraskevas F, Glader B Wintrobe´s Clinical Hematology. 11th ed. Philadelphia: Lippincott William & Wilkins; 2003. v. 1, cap. 8, p.21747.
- 10. Blackman SM, Hustedt EJ, Cobb CE, Beth AH. Flexibility of the cytoplasmic domain of the anion exchange protein, band 3, in human erythrocytes. Biophys J. 2001;81:336376.
- 11. Saad STO. Anemias por defeitos de membrana eritrocitária. In: Zago MA, Falcão RP, Pasquim R. Hematologia: fundamentos práticos. São Paulo: Atheneu; 2001. cap 26. p.250264.
- 12. Mandal D, BaudinCreuza V, Bhattacharyya A, Pathak S, Delaunay J, Kundu M, Basu J. Caspase 3mediated proteolysis of the Nterminal cytoplasmic domain of the human erythroid anion exchanger 1 (band 3). J Biol Chem. 2003;278(52):525518.
- 13. Fu G, Wang T, yang B, Lv F, Shi C, Jiang X, et al. Purification and characterization of human erythrocyte band 3 protein C terminal domain. Biochemistry. 2004;43:16338.
- 14. Wong P. A basis of the acanthocytosis in inherited and acquired disorders. Med Hypotheses. 2004;62:9669.
- 15. Cheidde L, Vieira TC, Lima PRM, Saad STO, Heilberg IP. A novel mutation in the anio exchanger 1 gene is associated with familial distal renal tubular acidosis and nephocalcinosis. Pediatrics. 2003; 112:13617.
- 16. Zdebska E, BaderMeunier B, Schischmanoff PO, Dupre T, Seta N, Tchernia G, et al. Abnormal glycosylation of red cell membrane band 3 in the congenital disorder of glycosylation Ig. Pediatr Res. 2003;54(2):2249.
- 17. Reliene R, Mariani M, Zanella A, Reinhart WH, Ribeiro ML, del Giudice EM. Splenectomy prolongs in vivo survival of erythrocytes differently in spectrin/ankyrin and band 3deficient hereditary spherocytosis. Blood. 2002;100:220815.
- 18. Oldenborg PA. Role of CD47 in erythroid cells and in autoimmunity. Leuk Lymphoma. 2004;45:131927.
- 19. Auffray I, Martafia S, Jong L, Lee G, Huang C, Pasztyet C, et al. Glycophorin A dimerization and band 3 interaction during erythroid membrane biogenesis: in vivo studies in human glycophorin A transgenic mice. Blood. 2001;97:28728.
- 20. Hassoun H, Hanada T, Lutchman M, Sahr KE, Palek J, Hanspal M, et al. Complete deficiency of glycophorin A in red blood cells from mice with targeted inactivation of band 3 (AE1) gene. Blood. 1998;91:214651.
- 21. Poole J, Banks J, Bruce LJ, Ring SM, Levene C, Stern H, et al. Glycophorin A mutation Ala65 Pro gives rise to a novel pair of MNS alleles ENEP (MNS39) and HAG (MNS41) and altered Wrb expression: direct evidence for GPA/band 3 interaction necessary for normal Wrb expression. Transfusion Med. 1999;9:16774.
- 22. Garraty G, Telen MJ, Petz LD. Red cell antigens as functional molecules and obstacles to transfusion. Hematology. 2002;44562.
- 23. Lobo CA, Rodriguez M, Reid M, Lustigman S. Glycophorin C is the receptor for the Plasmodium falciparum erythrocyte binding ligand PfEBP2 (baebl). Blood. 2003;101:462831.
- 24. Mohler PJ, Schott JJ, Gramolini AO, Dilly KW, Guatimosim S, DuBell WH, et al. AnkyrinB mutation causes type 4 longQT cardiac arrhythmia and sudden cardiac death. Nature. 2003;421: 587:58990.
- 25. Gascard P, Nunomura W, Lee G, Walensky LD, Krauss SW, Takakuwa Y, et al. Deciphering the nuclear import pathway for the cytoskeletal red cell protein 4.1R. Mol Biol Cell. 1999;10:178398.
- 26. Terada N, Ohno N, Yamakawa H, Baba T, Fujii Y, Zea Z, et al. Immunohistochemical study of protein 4.1B in the normal and W/W(v) mouse seminiferous epithelium. J Histochem Cytochem. 2004;52:76977.
- 27. Hemming NJ, Anstee DJ, Staricoff MA, Tanner MJA, Mohandas N. Identification of the membrane attachment sites for protein 4.1 in the human erythrocyte. J Biol Chem. 1995;270:53606.
- 28. Karacay B, Chang LS. Induction of erythrocyte protein 4.2 gene expression during differentiation of murine erythroleukemia cells. Genomics. 1999;59:617.
- 29. Horne WC, Miettinen H, Marchesi VT. Erythrocyte membrane skeleton phosphoprotein: identification of two unrelated phosphoprotein in band 4.9. Biochim Biophys Acta. 1988;944: 13543.
- 30. Faquin WC, Husain A, Hung J, Branton D. An immunoreactive form of erythrocyte protein 4.9 is present in nonerythroid cells. Eur J Cell Biol. 1988;46:16875.
- 31. Peri, S. et al Development of human protein reference database as an initial platform for approaching systems biology in humans. Genome Research. 2003;13:236371.
Datas de Publicação
-
Publicação nesta coleção
22 Nov 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Recebido
08 Jun 2006 -
Aceito
29 Dez 2006