Resumos
As recomendações sobre Leucemia Mielóide Crônica feitas em 2006 por um painel de experts, em nome do "European Leukemia Network", foram adotadas internacionalmente como um roteiro para a monitoração e tratamento da doença. Passados 18 meses de sua publicação, fazemos aqui um sumário dessas recomendações e em seguida apontamos diversas áreas em que as recomendações poderão ser aperfeiçoadas e atualizadas. Aspectos específicos relacionados à aplicação das recomendações no Brasil são também considerados.
Leucemia Mielóide Crônica; tratamento; imatinibe
The recommendations about chronic myeloid leukemia by a panel of experts in 2006 on behalf of the "European Leukemia Network" have been internationally accepted as a guide for monitoring and treatment of this disease. Eighteen months after its publication, we present here a summary of these recommendations, and point to areas in which they might be improved and updated. Specific aspects of the application of these recommendations in Brazil are also considered.
Chronic myeloid leukemia; treatment; imatinib
ARTIGO ARTICLE
Análise crítica das recomendações formuladas por um painel de experts para o cuidado clínico de pacientes com Leucemia Mielóide Crônica
Critical analysis of the recommendations from an expert panel on the management of patients with Chronic Myeloid Leukemia
Nelson Spector
Professor Titular de Hematologia da Faculdade de Medicina da Universidade Federal do Rio de Janeiro UFRJ, Rio de Janeiro-RJ.
Endereço para correspondência Correspondência: Nelson Spector Rua Maria Angélica, 326/501 Lagoa 22461-152 Rio de Janeiro-RJ Brasil E-mail: spector@ufrj.br
RESUMO
As recomendações sobre Leucemia Mielóide Crônica feitas em 2006 por um painel de experts, em nome do "European Leukemia Network", foram adotadas internacionalmente como um roteiro para a monitoração e tratamento da doença. Passados 18 meses de sua publicação, fazemos aqui um sumário dessas recomendações e em seguida apontamos diversas áreas em que as recomendações poderão ser aperfeiçoadas e atualizadas. Aspectos específicos relacionados à aplicação das recomendações no Brasil são também considerados.
Palavras-chave: Leucemia Mielóide Crônica; tratamento; imatinibe.
ABSTRACT
The recommendations about chronic myeloid leukemia by a panel of experts in 2006 on behalf of the "European Leukemia Network" have been internationally accepted as a guide for monitoring and treatment of this disease. Eighteen months after its publication, we present here a summary of these recommendations, and point to areas in which they might be improved and updated. Specific aspects of the application of these recommendations in Brazil are also considered.
Key words: Chronic myeloid leukemia; treatment; imatinib.
Introdução
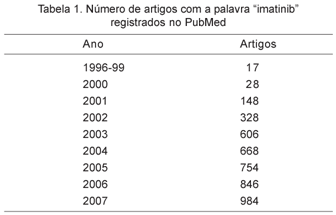
A descoberta do papel dos inibidores de tirosino quinases no tratamento da leucemia mielóide crônica foi, provavelmente, a maior inovação do tratamento hemato-oncológico da última década. Desde as duas primeiras publicações sobre o tema, em 19961,2 até o final de 2007, uma maré montante de artigos sobre imatinibe vem se acumulando na literatura médica internacional (Tabela 1).
Nesses artigos, tem-se buscado caracterizar, com a rapidez possível, as propriedades farmacológicas da nova droga, os métodos de monitoração da resposta ao tratamento, os resultados clínicos propiciados e as medidas possíveis de prevenção e manejo da resistência à droga.
Com o objetivo de sistematizar essa massa de informações e oferecer aos clínicos um roteiro adequado para o cuidado dos pacientes com leucemia mielóide crônica (LMC), um destacado grupo de autores de diversos países da Europa, EUA e Austrália publicou, em 2006, um oportuno artigo de revisão.3 Em virtude da escassez de evidências oriundas de estudos clínicos randomizados, os autores destacaram, na introdução do artigo, que o momento ainda era prematuro para a publicação de uma diretriz (guideline) baseada em evidências. A análise publicada refletiu assim a opinião consensual daqueles experts, com base na sua interpretação dos dados publicados e na sua vasta experiência clínica. Os autores, conscientes da velocidade vertiginosa com que novas informações vêm se acumulando nesta área, intitularam o artigo como "Conceitos em desenvolvimento no manejo da leucemia mielóide crônica".
Estes conceitos tornaram-se conhecidos como "recomendações da LeukemiaNet", e foram imediatamente aceitos pela comunidade médica internacional como o roteiro ideal para o cuidado de pacientes com LMC. No momento em que nos propomos a discutir um conjunto de recomendações para o manejo da LMC no Brasil, nada mais apropriado do que fazer uma pausa inicial para refletir sobre as recomendações da LeukemiaNet. Neste artigo, buscamos inicialmente sumarizar aquelas recomendações e, em seguida, apontar diversas áreas em que emendas e atualizações provavelmente serão necessárias nos próximos anos, para incorporar informações obtidas após a sua publicação.
Um breve sumário das recomendações da LeukemiaNet
A maior parte das informações que fundamentaram as recomendações da LeukemiaNet é originária do "Estudo IRIS", um ensaio clínico de fase III, ativado em junho de 2000 para comparar o imatinibe com a associação de interferon + citarabina no tratamento inicial da LMC.4 Devido ao meticuloso acompanhamento clínico-laboratorial daquela coorte inicial de 1.106 pacientes, as informações coletadas pelo estudo IRIS tornaram-se uma fonte de dados de valor inestimável.
O primeiro passo para a uniformização de uma conduta clínica é a definição de critérios objetivos de resposta ao tratamento. A Tabela 2 resume os critérios operacionais consagrados pelo estudo IRIS e adotados internacionalmente para a avaliação da resposta ao tratamento. Para estes critérios são empregados métodos clínicos (exame físico e hemograma), citogenéticos e moleculares (RT-PCR e nested-PCR).
O passo seguinte foi estabelecer a freqüência ideal de realização desses exames, de modo a capturar de forma racional a redução progressiva do clone leucêmico induzida pela inibição da tirosino quinase BCR-ABL (Tabela 3).
O principal avanço conceitual das recomendações foi a definição de categorias de resposta ao tratamento (Tabela 4). Essas categorias refletem as correlações observadas entre os vários critérios de resposta, ao longo do tratamento, e as probabilidades ulteriores de falha ou sucesso terapêutico.
O painel recomendou que a dose inicial diária de imatinibe deva ser de 400 mg. Ademais, formulou recomendações de manejo clínico em caso de resposta subótima ou falha ao tratamento (Tabela 5).
Finalmente, o painel reconheceu que as mutações são um dos mecanismos mais comuns de resistência ao imatinibe. Por esse motivo, sugeriu que uma análise mutacional deve ser feita em todos os casos de resposta subótima, de falha, ou de aumento no número de transcritos BCR-ABL, desde que esse aumento seja confirmado em duas determinações consecutivas.
Aspectos passíveis de reavaliação nas recomendações da LeukemiaNet
Adesão ao tratamento ("compliance")
É curioso observar que as recomendações da LeukemiaNet, embora se refiram à baixa adesão ao tratamento dos pacientes que usavam interferon, não tocam no tema em relação ao imatinibe. Uma proporção substancial de pacientes tratados com imatinibe não usa o medicamento na dose recomendada. Um recente estudo nos EUA indicou taxa de adesão de 75%.5 É provável que, em países em desenvolvimento, como o nosso, tenhamos taxas bem mais baixas de adesão. Seja devido aos efeitos colaterais ou à incerteza sobre a obtenção do medicamento, muitos pacientes tentam "economizar" e utilizam somente uma fração da dose total diária. Quase todas as metodologias para avaliação do compliance são imperfeitas, pois podem ser fraudadas pelo paciente. A melhor alternativa é a dosagem do nível plasmático da droga, e este procedimento, ainda de difícil execução em nosso meio, vem se tornando desejável em pacientes que apresentam resposta subótima ao tratamento.
A educação dos pacientes sobre a necessidade imperiosa de uso da dose prescrita é um dos aspectos mais importantes de todo o tratamento e deve ser reafirmada a cada consulta.
Dose inicial de imatinibe
O imatinibe é provavelmente a única droga antineoplásica utilizada em dose fixa para todos os pacientes adultos, qualquer que seja a sua idade, peso ou altura. A dose inicial de 400 mg de imatinibe foi estabelecida às pressas antes do início do estudo IRIS, com base nas evidências de que, nesta dose, 98% dos pacientes apresentavam resposta hematológica completa.6 Devido ao alto custo do medicamento, e diante das evidências de grande eficácia do imatinibe nesta dosagem, quase todos os centros mundiais a aceitaram. No entanto, há evidências de que dosagens mais altas podem ser mais eficazes. Dados preliminares apresentados em congressos pelo grupo do Hospital M. D. Anderson sugerem que o tratamento inicial com 800 mg produz respostas citogenéticas completas mais rápidas e mais freqüentes, independentemente do grupo de risco Sokal.7 Essa dose produziu também resposta molecular maior em 82% dos pacientes em três anos, contra 64% naqueles que usaram 400 mg, e uma sobrevida livre de progressão superior.7 No entanto, estas são comparações de duas coortes seqüenciais, sem randomização, o que enfraquece a evidência. Um grande estudo randomizado (SPIRIT, www.spirit-cml.org) está em andamento para esclarecer essa questão.
Informações mais recentes sobre a farmacologia do imatinibe apontam também para a provável necessidade de individualização da dose terapêutica. Há evidências de que o nível plasmático de imatinibe varia muito entre indivíduos em uso de 400 mg, e que níveis baixos parecem se correlacionar com maior probabilidade de falha ao tratamento.8 Por esse motivo, e também para a avaliação da adesão ao tratamento, a dosagem de níveis plasmáticos deverá se tornar um procedimento mais comum, recomendado para avaliar precocemente os pacientes com resposta subótima.
Por outro lado, verificou-se que o influxo intracelular do imatinibe é mediado por uma bomba de transporte ativo denominada OCT-1 (organic cation transporter).9 Na dose de 400 mg, a inibição da tirosino quinase induzida pelo imatinibe é muito variável entre os pacientes e parece se correlacionar com a atividade individual de OCT-1. Dados preliminares do grupo australiano sugerem que, nos pacientes com baixa atividade de OCT-1, doses mais altas de imatinibe proporcionam uma redução mais intensa de BCR-ABL.10
No momento atual, o uso de doses mais altas de imatinibe ao diagnóstico é inviável no nosso meio devido ao alto custo do tratamento. Caso esse custo venha a diminuir nos próximos anos, é provável que novas recomendações sejam feitas a este respeito.
Deverão ser estabelecidos novos objetivos terapêuticos após a resposta molecular maior?
O acompanhamento continuado da coorte de pacientes tratados em primeira linha com imatinibe no estudo IRIS trouxe recentemente uma nova informação: a resposta molecular continua melhorando com o passar dos anos. Após 4,5 anos de uso de imatinibe, 78% dos pacientes atingem uma resposta molecular maior, que corresponde à redução de 3 logs nos níveis de BCR-ABL. Após cinco anos, 62% dos pacientes atingem 4 logs de redução e, após seis anos, 45% dos pacientes apresentam níveis indetectáveis de BCR-ABL. O limite de detectabilidade de BCR-ABL fica provavelmente em 4,5 logs nos melhores laboratórios.
É provável que essas reduções ulteriores se correlacionem com taxas muito baixas, quase nulas, de progressão ou falha. A mais recente análise sobre o acompanhamento até seis anos dos pacientes do estudo IRIS evidenciou que as taxas de progressão diminuem a níveis quase desprezíveis após o quarto ano (Tabela 6), provavelmente devido a esta supressão progressiva dos níveis de BCR-ABL.11 É concebível, portanto, que novos objetivos terapêuticos, a serem alcançados em cinco ou seis anos, venham a ser estabelecidos e recomendados.
A eficácia dos novos inibidores
Ao longo de 2007, duas drogas foram aprovadas pelo FDA para o tratamento de pacientes que apresentam falha ao imatinibe. O dasatinibe e o nilotinibe proporcionam excelentes resultados nesse contexto, exceto nos pacientes com a mutação T315I.12,13 Um estudo cooperativo internacional, que incluiu bom número de pacientes brasileiros, comparou dasatinibe com imatinibe 800 mg/dia em pacientes com falha ao imatinibe, e sugeriu que o dasatinibe parece ser superior.14 Infelizmente, dois terços dos pacientes já haviam recebido 600 mg de imatinibe antes da inclusão no estudo, e é possível que, para esses pacientes, o aumento da dose para 800 mg tenha sido insuficiente.
É provável que as recomendações da LeukemiaNet sejam revisadas para reconhecer e especificar melhor o papel desses dois inibidores nos casos de falha ao imatinibe.
A controvérsia sobre os pacientes que apresentam respostas mais lentas
A principal característica das recomendações da LeukemiaNet foi a definição de categorias de resposta de acordo com os resultados progressivos alcançados ao longo do tratamento. No entanto, persiste um debate sobre o significado e a abordagem correta dos pacientes que apresentam respostas mais lentas do que o desejado (Tabela 4), mas ainda assim progressivas.
O maior estudo voltado para essa questão incluiu 284 pacientes em fase crônica tardia, tratados com imatinibe após falha do interferon.15 Esses pacientes foram divididos, arbitrariamente, em respondedores precoces ou tardios, de acordo com a obtenção de resposta citogenética completa no primeiro ano de tratamento. A sobrevida livre de falha e a sobrevida global em quatro anos nos dois grupos de pacientes foi semelhante, assim como a quantificação da doença por PCR. Os autores concluíram que, ao menos em pacientes em fase crônica tardia, os respondedores tardios têm evolução igual aos precoces, desde que a qualidade da resposta continue melhorando ao longo do tratamento.
Por outro lado, estudo assinado pelo grupo do M. D. Anderson, e publicado somente em forma de abstract, chegou a conclusão muito diversa.16 Dentre 258 pacientes acompanhados, os autores observaram que os pacientes que não alcançaram resposta citogenética completa em um ano tiveram risco mais alto de progressão.16
Por ora, desde que o paciente apresente uma resposta continuada e progressiva, ainda que um pouco tardia em relação ao cronograma delineado na Tabela 4, é razoável manter a dose de imatinibe e acompanhá-lo com uma expectativa positiva, sem necessidade de outra avaliação ou intervenção.
O valor preditivo da avaliação precoce da resposta molecular
O grupo de Adelaide apresentou recentemente evidências de que o RT-PCR, feito no terceiro mês de tratamento, é capaz de identificar um subgrupo de pacientes com alta probabilidade de resistência ao imatinibe. Em uma análise de 52 pacientes, eles observaram que os 10 pacientes (19%) que não obtiveram redução de ao menos 1 log do BCR-ABL em três meses tiveram uma probabilidade de progressão em trinta meses de 83%, contra 5% nos 22 pacientes que alcançaram redução de 1-2 logs, e 0% nos 20 pacientes que obtiveram redução > 2 logs (p<0.001).17
Caso estes dados se confirmem, é possível que as recomendações passem a incluir a realização de RT-PCR no terceiro mês de acompanhamento. A identificação "ultra-precoce" dos pacientes com resposta inadequada seria uma estratégia excelente para aprimorar os atuais resultados do tratamento. Nesse cenário, os pacientes com resposta inadequada em três meses teriam seus níveis plasmáticos de imatinibe avaliados, e uma análise mutacional para verificar se apresentam mutações que possivelmente já antecediam o início do tratamento.
As decisões sobre o melhor tratamento em caso de falha ao imatinibe poderão ser guiadas pelo perfil de mutações?
Na medida em que se acumula a experiência com o seqüenciamento genético para a identificação de mutações, alguns padrões de resposta vão emergindo. Há mutações que não resultam em resistência substancial ao imatinibe (por exemplo V299L, F311L), outras mutações que implicam sensibilidade apenas intermediária ao imatinibe e ao dasatinibe, mas são muito sensíveis ao nilotinibe (F317L), e ainda outras que são mais sensíveis ao dasatinibe (Y253F).18
Com a confirmação destas evidências em uma casuística mais ampla, é provável que se torne possível recomendar qual a melhor droga a ser usada para cada mutação.
O papel dos inibidores de tirosino quinases no tratamento da doença avançada (fase acelerada e blástica)
Embora estas situações clínicas não tenham sido objeto das recomendações da LeukemiaNet, cabe um comentário sobre o papel dos inibidores de tirosino quinases em pacientes que se apresentam em fase acelerada ou em crise blástica da LMC. Até hoje, esses pacientes foram tratados com doses elevadas de imatinibe (600-800 mg por dia), com resultados decepcionantes. No entanto, a experiência recente no tratamento da leucemia linfoblástica Ph+ com associações de inibidores de tirosino quinases e quimioterapia sugere fortemente que este deva ser o caminho também nos pacientes com progressão para fases avançadas da LMC.
À medida que se alonga a experiência internacional com os inibidores de tirosino quinases, algumas hipóteses antes impensáveis já são imaginadas, entre elas a possibilidade de interrupção do tratamento em indivíduos que permanecem vários anos em resposta molecular completa, e a redução da intensidade de monitoração após o quinto ano. Essas são, no momento, apenas especulações. No entanto, as oito questões aqui discutidas refletem o fascinante e mutante cenário de indagações e análises metódicas propiciado pelo advento dessa classe de medicamentos que trouxe novo alento para os pacientes com leucemia mielóide crônica.
Referências Bibliográficas
1. Druker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nat Med. 1996;2(5):561-6.
2. Buchdunger E, Zimmermann J, Mett H, et al. Inhibition of the Abl protein-tyrosine kinase in vitro and in vivo by a 2-phenylaminopyrimidine derivative. Cancer Res. 1996;56(1):100-4.
3. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood. 2006;108(6):1809-20.
4. Druker BJ, Guilhot F, O'Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006;355(23):2408-17.
5. Feng HH, Thomas S, Baladi J, Hatfield A, Goldberg GA., Cortes J. Compliance and persistency with imatinib. In American Society of Clinical Oncology 42nd Annual Meeting Program; 2006 June, Atlanta. J Clin Oncol 2006;24(18) S: Abstract 6038.
6. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001;344(14):1031-7.
7. Aoki E, Kantarjian HM, O'Brien S, Talpaz M, Giles F, Garcia-Manero G, et al. High-dose imatinib mesylate treatment in patients (Pts) with untreated early chronic phase (CP) chronic myeloid leukemia (CML): 2.5-year follow-up. In: In American Society of Clinical Oncology 42nd Annual Meeting Program; 2006 June, Atlanta. J Clin Oncol. 2006;24(18S): Abstract 6535.
8. Picard S, Titier K, Etienne G, et al. Trough imatinib plasma levels are associated with both cytogenetic and molecular responses to standard-dose imatinib in chronic myeloid leukemia. Blood. 2007; 109(8):3496-9.
9. Thomas J, Wang L, Clark RE, Pirmohamed M. Active transport of imatinib into and out of cells: implications for drug resistance. Blood. 2004;104(12):3739-45.
10. White DL, Saunders VA, Dang P, et al. OCT-1-mediated influx is a key determinant of the intracellular uptake of imatinib but not nilotinib (AMN107): reduced OCT-1 activity is the cause of low in vitro sensitivity to imatinib. Blood. 2006;108(2):697-704.
11. Hochhaus ADB, Larson RA, O'Brien SG, Gathmann I, Guilhot F. IRIS 6-year follow-up: sustained survival and declining annual rate of transformation in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib. In: American Society of Hematology 49th Annual Meeting; 2007, Atlanta. Blood 2007;110:Abstract 25.
12. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007;109(6):2303-9.
13. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood. 2007;110(10):3540-6.
14. Kantarjian H, Pasquini R, Hamerschlak N, et al. Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia after failure of first-line imatinib: a randomized phase 2 trial. Blood. 2007;109(12):5143-50.
15. Iacobucci I, Rosti G, Amabile M, et al. Comparison between patients with Philadelphia-positive chronic phase chronic myeloid leukemia who obtained a complete cytogenetic response within 1 year of imatinib therapy and those who achieved such a response after 12 months of treatment. J Clin Oncol. 2006;24(3):454-9.
16. Quintas-Cardama A, Kantarjian H, Jones D, Garcia-Manero G, O'Brien S, Shan J, et al. Delayed achievement of molecular responses is associated with increased risk of progression among patients (pts) with chronic myelogenous leukemia (cml) in chronic phase (cp) treated with imatinib. In: American Society of Hematology 48th Annual Meeting; 2006, Orlando. In: Blood 2006; 108: Abstract 432.
17. Hughes T, Branford S. Molecular monitoring of BCR-ABL as a guide to clinical management in chronic myeloid leukaemia. Blood Rev. 2006;20(1):29-41.
18. O'Hare T, Eide CA, Deininger MW. Bcr-Abl kinase domain mutations, drug resistance, and the road to a cure for chronic myeloid leukemia. Blood. 2007;110(7):2242-9.
Recebido: 11/02/2008
Aceito: 21/02/2008
Avaliação: Co-editores e um revisor externo.
Publicado após revisão e concordância do editor.
Conflito de interesse: consultoria para a Novartis
O tema apresentado e o convite ao autor constam da pauta elaborada pelos co-editores, Professor Ricardo Pasquini e Professor Cármino Antonio de Souza.
- 1. Druker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nat Med. 1996;2(5):561-6.
- 2. Buchdunger E, Zimmermann J, Mett H, et al Inhibition of the Abl protein-tyrosine kinase in vitro and in vivo by a 2-phenylaminopyrimidine derivative. Cancer Res. 1996;56(1):100-4.
- 3. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood. 2006;108(6):1809-20.
- 4. Druker BJ, Guilhot F, O'Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006;355(23):2408-17.
- 5. Feng HH, Thomas S, Baladi J, Hatfield A, Goldberg GA., Cortes J. Compliance and persistency with imatinib. In American Society of Clinical Oncology 42nd Annual Meeting Program; 2006 June, Atlanta.
- J Clin Oncol 2006;24(18) S: Abstract 6038.
- 6. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001;344(14):1031-7.
- 7. Aoki E, Kantarjian HM, O'Brien S, Talpaz M, Giles F, Garcia-Manero G, et al. High-dose imatinib mesylate treatment in patients (Pts) with untreated early chronic phase (CP) chronic myeloid leukemia (CML): 2.5-year follow-up. In: In American Society of Clinical Oncology 42nd Annual Meeting Program; 2006 June, Atlanta.
- J Clin Oncol. 2006;24(18S): Abstract 6535.
- 8. Picard S, Titier K, Etienne G, et al. Trough imatinib plasma levels are associated with both cytogenetic and molecular responses to standard-dose imatinib in chronic myeloid leukemia. Blood. 2007; 109(8):3496-9.
- 9. Thomas J, Wang L, Clark RE, Pirmohamed M. Active transport of imatinib into and out of cells: implications for drug resistance. Blood. 2004;104(12):3739-45.
- 10. White DL, Saunders VA, Dang P, et al OCT-1-mediated influx is a key determinant of the intracellular uptake of imatinib but not nilotinib (AMN107): reduced OCT-1 activity is the cause of low in vitro sensitivity to imatinib. Blood. 2006;108(2):697-704.
- 11. Hochhaus ADB, Larson RA, O'Brien SG, Gathmann I, Guilhot F. IRIS 6-year follow-up: sustained survival and declining annual rate of transformation in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib. In: American Society of Hematology 49th Annual Meeting; 2007, Atlanta.
- Blood 2007;110:Abstract 25.
- 12. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007;109(6):2303-9.
- 13. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood. 2007;110(10):3540-6.
- 14. Kantarjian H, Pasquini R, Hamerschlak N, et al. Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia after failure of first-line imatinib: a randomized phase 2 trial. Blood. 2007;109(12):5143-50.
- 15. Iacobucci I, Rosti G, Amabile M, et al Comparison between patients with Philadelphia-positive chronic phase chronic myeloid leukemia who obtained a complete cytogenetic response within 1 year of imatinib therapy and those who achieved such a response after 12 months of treatment. J Clin Oncol. 2006;24(3):454-9.
- 16. Quintas-Cardama A, Kantarjian H, Jones D, Garcia-Manero G, O'Brien S, Shan J, et al. Delayed achievement of molecular responses is associated with increased risk of progression among patients (pts) with chronic myelogenous leukemia (cml) in chronic phase (cp) treated with imatinib. In: American Society of Hematology 48th Annual Meeting; 2006, Orlando.
- In: Blood 2006; 108: Abstract 432.
- 17. Hughes T, Branford S. Molecular monitoring of BCR-ABL as a guide to clinical management in chronic myeloid leukaemia. Blood Rev. 2006;20(1):29-41.
- 18. O'Hare T, Eide CA, Deininger MW. Bcr-Abl kinase domain mutations, drug resistance, and the road to a cure for chronic myeloid leukemia. Blood. 2007;110(7):2242-9.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
09 Dez 2008 -
Data do Fascículo
Abr 2008
Histórico
-
Recebido
11 Fev 2008 -
Aceito
21 Fev 2008