Resumos
Mini-implantes ortodônticos de Ti-6Al-4V podem liberar íons metálicos devido à corrosão in vivo da liga em fluidos corporais. Os produtos de corrosão liberados podem favorecer a ocorrência de efeitos indesejáveis no corpo humano. O objetivo deste estudo foi determinar as concentrações de titânio, alumínio e vanádio nos órgãos de coelhos (rins, fígado e pulmões), após a inserção de mini-implantes ortodônticos fabricados a partir da liga Ti-6Al-4V. Dezoito coelhos da raça Nova Zelândia tiveram quatro mini-implantes inseridos em sua tíbia esquerda e cinco coelhos foram usados como controle. Após 1, 4 e 12 semanas os coelhos foram submetidos à eutanásia, os tecidos selecionados foram removidos e preparados para análise por espectroscopia de absorção atômica com forno de grafite. Quantidades variadas Ti, Al e V foram detectadas nos grupos testados comprovando que existe liberação de íons metálicos por mini-implantes ortodônticos de Ti-6Al-4V. Apesar da tendência de liberação de íons pela liga de titânio, as quantidades de metais detectadas foram extremamente baixas. Sendo assim, mini-implantes ortodônticos de Ti-6Al-4V podem ser usados com segurança como dispositivos auxiliares de ancoragem ortodôntica.
Mini-implantes; Ti-6Al-4V; liberação de íons
Ti-6Al-4V orthodontic mini-implants may release metallic ions to the human body due to the in vivo corrosion of the alloy in body fluids. The corrosion products can elicit undesirable effects in the human body. The purpose of this study was to measure the concentration of titanium, aluminum, and vanadium in rabbits’ tissues (kidney, liver and lungs) after the insertion of Ti-6Al-4V alloy orthodontic mini-implants. Eighteen New Zealand rabbits had four mini-implants inserted in their left tibia and five rabbits were used as control. After 1, 4, and 12 weeks the rabbits were euthanized, the selected tissues were extracted, and prepared to analysis by graphite furnace atomic absorption spectrometry. Varied amounts of Ti, Al, and V were detected in the tested groups proving that diffusion of these metals from Ti-6Al-4V orthodontic mini-implants exists. Despite of the tendency of ion release when using the titanium alloy, the amount of metals detected were very low. Then, Ti-6Al-4V orthodontic mini-implants are safe auxiliary orthodontic anchorage devices.
Mini-implants; Ti-6Al-4V; ion release
Liberação in vivo de íons metálicos por mini-implantes ortodônticos de Ti-6Al-4V
In vivo metal ion release from Ti-6Al-4V orthodontic mini-implants
Liliane S MoraisI,II; Glaucio G SerraI,II; Carlos A MullerIII; Elisabete F A PalermoIV; Leonardo R AndradeV; Marc A MeyersI; Carlos N EliasII
IDepartament of Mechanical and Aerospace Engineering, University of California - San Diego, UCSD, ZIP 92093-0411, San Diego, CA, United States. email: lilianesmorais@hotmail.com, mameyers@ucsd.edu IIDepartamento de Engenharia Mecânica e Ciência dos Materiais, Instituto Militar de Engenharia, IME, CEP 22290-270, Rio de Janeiro, RJ, Brasil. e-mail: gserrag@hotmail.com, elias@ime.eb.br IIIFundação Oswaldo Cruz, FIOCRUZ, Av Brasil, 4365, Manguinhos, CEP 21045-900, Rio de Janeiro, RJ, Brasil. e-mail: camuller@ioc.fiocruz.br IVLaboratório de Radioisótopos, Universidade Federal do Rio de Janeiro, UFRJ, Ilha do Fundão, Rio de Janeiro, RJ, Brasil. e-mail: elisa@biof.ufrj.br VDepartamento de Histologia e Embriologia, Universidade Federal do Rio de Janeiro, UFRJ, Ilha do Fundão, Rio de Janeiro, RJ, Brasil. e-mail: andrade@anato.ufrj.br
RESUMO
Mini-implantes ortodônticos de Ti-6Al-4V podem liberar íons metálicos devido à corrosão in vivo da liga em fluidos corporais. Os produtos de corrosão liberados podem favorecer a ocorrência de efeitos indesejáveis no corpo humano. O objetivo deste estudo foi determinar as concentrações de titânio, alumínio e vanádio nos órgãos de coelhos (rins, fígado e pulmões), após a inserção de mini-implantes ortodônticos fabricados a partir da liga Ti-6Al-4V. Dezoito coelhos da raça Nova Zelândia tiveram quatro mini-implantes inseridos em sua tíbia esquerda e cinco coelhos foram usados como controle. Após 1, 4 e 12 semanas os coelhos foram submetidos à eutanásia, os tecidos selecionados foram removidos e preparados para análise por espectroscopia de absorção atômica com forno de grafite. Quantidades variadas Ti, Al e V foram detectadas nos grupos testados comprovando que existe liberação de íons metálicos por mini-implantes ortodônticos de Ti-6Al-4V. Apesar da tendência de liberação de íons pela liga de titânio, as quantidades de metais detectadas foram extremamente baixas. Sendo assim, mini-implantes ortodônticos de Ti-6Al-4V podem ser usados com segurança como dispositivos auxiliares de ancoragem ortodôntica.
Palavras chaves: Mini-implantes, Ti-6Al-4V, liberação de íons.
ABSTRACT
Ti-6Al-4V orthodontic mini-implants may release metallic ions to the human body due to the in vivo corrosion of the alloy in body fluids. The corrosion products can elicit undesirable effects in the human body. The purpose of this study was to measure the concentration of titanium, aluminum, and vanadium in rabbits tissues (kidney, liver and lungs) after the insertion of Ti-6Al-4V alloy orthodontic mini-implants. Eighteen New Zealand rabbits had four mini-implants inserted in their left tibia and five rabbits were used as control. After 1, 4, and 12 weeks the rabbits were euthanized, the selected tissues were extracted, and prepared to analysis by graphite furnace atomic absorption spectrometry. Varied amounts of Ti, Al, and V were detected in the tested groups proving that diffusion of these metals from Ti-6Al-4V orthodontic mini-implants exists. Despite of the tendency of ion release when using the titanium alloy, the amount of metals detected were very low. Then, Ti-6Al-4V orthodontic mini-implants are safe auxiliary orthodontic anchorage devices.
Keywords: Mini-implants, Ti-6Al-4V, ion release.
1 INTRODUÇÃO
O titânio comercialmente puro (Ti cp) é amplamente utilizado na fabricação de implantes dentários e ortopédicos pois é considerado quimicamente inerte, possui propriedades mecânicas adequadas e excelente biocompatibilidade [1, 3]. No entanto, devido ao tamanho reduzido dos mini-implantes ortodônticos existe a possibilidade de ocorrerem fraturas durante os procedimentos de inserção e remoção, pois o Ti cp possui baixa resistência à fratura [1]. Para superar este problema o material de escolha para confecção de mini-implantes ortodônticos é a liga Ti-6Al-4V [3, 4], pois possui maior resistência à fadiga e à fratura [1]. Entretanto, a resistência à corrosão da liga Ti-6Al-4V é menor do que a resistência à corrosão do Ti cp [5], favorecendo a liberação de íons metálicos. Estes íons podem se acumular nos tecidos peri-implante [6, 7] e em tecidos distantes [8-11] favorecendo a ocorrência de efeitos indesejáveis no corpo humano e sendo freqüentemente responsabilizados pela falha clínica dos implantes, osteólise [6], reações alérgicas, lesões renais, citotoxicidade, hipersensibilidade e carcinogênese [12].
O objetivo deste estudo foi medir, por espectroscopia de absorção atômica com forno de grafite, as concentrações de titânio, alumínio e vanádio nos rins, fígado e pulmões de coelhos, após 1, 4 e 12 semanas da inserção de mini-implantes ortodônticos da liga Ti-6Al-4V.
2 MATERIAIS E MÉTODOS
2.1 Mini-implantes
Mini-implantes ortodônticos em forma de parafuso, com 2 mm de diâmetro, 6 mm de comprimento e cabeça sextavada, foram fornecidos pela empresa Conexão Sistemas de Próteses (SP, Brasil). Os mini-implantes foram usinados a partir da liga Ti-6Al-4V, limpos com acetona em ultra-som por 5 minutos, lavados em água destilada, secos, passivados em ácido nítrico a 30%, de acordo com a norma ASTM F-86, embalados e esterilizados. Nenhum tratamento de superfície foi realizado para modificar a rugosidade superficial (Figura 1).
2.2 Animais
Vinte e três coelhos machos da raça Nova Zelândia, pesando aproximadamente 3 kg, foram selecionados como modelo animal. Os animais foram fornecidos e mantidos pelo Centro de Criação de Animais de Laboratório da Fundação Oswaldo Cruz. Este estudo foi aprovado pelo Comitê de Ética da Fundação Oswaldo Cruz, todas as recomendações éticas e legais especificadas para a experimentação animal foram seguidas e os procedimentos operatórios foram realizados sob orientação de um veterinário. Durante o período experimental os coelhos permaneceram em gaiolas individuais de aço inoxidável, com temperatura entre 22 e 26ºC e iluminação dia e noite. A alimentação foi constituída de ração apropriada (Nuvilab coelhos) e água ad libidum.
2.3 Técnica cirúrgica
Os coelhos foram pré-anestesiados por inoculação via intramuscular de cloridrato de tiletamina (5 mg/kg) e de cloridrato de zolazepam (5 mg/kg). Após o efeito anestésico, o pêlo da superfície anterior da tíbia esquerda foi tricotomizado com um tosquiador elétrico [13]. O pêlo restante foi removido da região cirúrgica (8 a 10 cm em comprimento imediatamente abaixo da diáfise da tíbia) com uma gilete e a pele foi submetida à assepsia local com álcool 70%. Em seguida foi posicionada uma máscara para inalação constante de oxigênio e halotano volátil (Fluothane, AstraZeneca do Brasil Ltda, São Paulo, Brasil) para manutenção da anestesia, através de um vaporizador calibrado.
Uma incisão superficial, de aproximadamente 5 cm de comprimento, foi feita no tecido mole ao longo do aspecto anterior da tíbia esquerda. O tecido muscular foi dissecado, expondo o tecido ósseo. Quatro perfurações, distando 5 mm entre si, foram preparadas no osso cortical, utilizando broca de 1,6 mm de diâmetro, com rotação de 2000 rpm, até que a porção medular fosse atingida. Durante o procedimento de corte do osso, foi mantida irrigação profusa com solução salina isotônica [13]. Quatro mini-implantes estéreis foram inseridos nos orifícios com o auxílio de uma chave de inserção manual. O periósteo, o tecido muscular e a pele foram suturados por camadas com fio de sutura absorvível.
2.4 Análise química
Após uma semana, seis coelhos foram anestesiados e a eutanásia foi realizada por sangria, dando origem ao grupo 1-S. O mesmo procedimento foi realizado após 4 e 12 semanas originando os grupos 4-S e 12-S, respectivamente. Desta forma, os grupos foram nomeados em função do tempo que os mini-implantes permaneceram implantados nos coelhos. Cinco coelhos, que não tiveram mini-implantes inseridos, foram usados como grupo controle para caracterizar o conteúdo de metais nos tecidos normais, servindo como parâmetro para comparação com os animais dos grupos de 1, 4 e 12 semanas (Tabela 1).
Os rins, fígado e pulmões de cada coelho foram removidos, armazenados individualmente em potes plásticos e congelados a -30 ºC [14] por 24 horas. Em seguida, os órgãos foram colocados em estufa a 60 ºC por 24 horas para desidratação inicial, picotados para facilitar a homogeneização e mantidos em estufa a 60 ºC por 7 dias, até a desidratação final. Duas amostras de 5 mg de cada tecido foram pesadas, calcinadas a 400 ºC por 5 dias e digeridas com 2 ml de HNO3 a 65% [8].
Para garantir precisão e confiabilidade do método e a pureza dos reagentes utilizados, os mesmos procedimentos de preparo das amostras foram realizados utilizando-se uma amostra certificada (DORM-2 Dogfish muscle, Canadá) com réplica, a qual possui concentrações conhecidas de íons metálicos. Além disso, beackers vazios foram utilizados como branco. As concentrações de titânio, alumínio e vanádio foram medidas por espectroscopia de absorção atômica com forno de grafite (AAS ZEEnit® 60, CGS Analitical Instrumentation Ltda, São Paulo, SP) em todas as amostras [11].
2.5 Análise estatística
A análise estatística foi realizada obtendo-se média e desvio padrão das concentrações de Ti, Al e V nos grupos controle, 1, 4 e 12 semanas. Os dados obtidos foram analisados com o teste "1-way ANOVA" seguido pelo "post hoc" teste de Tukey, para análise da significância estatística. Os p-valores menores que 0,05 foram considerados significantes.
3 Resultados
A técnica de espectroscopia de absorção atômica permitiu a determinação das concentrações de Ti, Al e V em todos os grupos analisados. As concentrações de titânio e vanádio foram medidas em partes por bilhão (ppb), ou seja, ng/mg; enquanto as concentrações de alumínio foram aferidas em partes por milhão (ppm), ou seja, µg/mg.
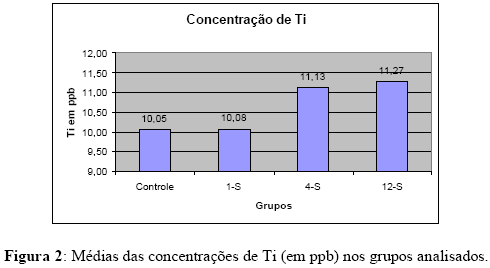
As médias e desvios padrões das concentrações de Ti nos grupos testados foram relacionados na Tabela 2 e Figura 2. O grupo controle apresentou as menores concentrações de titânio (10.05 ppb), seguido pelo grupo 1-S (10.08 ppb). Os grupos controle e 1-S não apresentaram diferença estatisticamente significante entre si (p > 0.05). Após 4 semanas a concentração de Ti medida foi de 11.13 ppb. Os maiores valores foram observados no grupo 12-S (11.27 ppb). Os grupos 4-S e 12-S não apresentaram diferença estatisticamente significante entre si (p > 0.05), porém foram estatisticamente maiores do que os grupos controle e 1-S (p < 0.05).
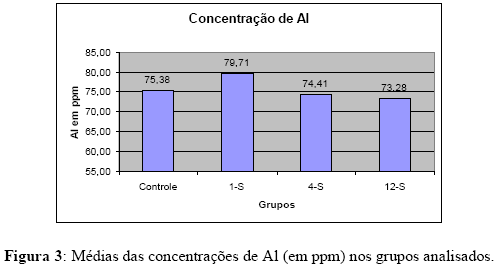
As médias e desvios padrões das concentrações de alumínio estão relacionados na Tabela 3 e Figura 3. O grupo controle apresentou média de 75,38 ppm, enquanto os grupos 1-S, 4-S e 12-S forneceram médias de 79,71 ppm, 74,41 ppm 73,28 ppm, respectivamente. Nenhum grupo apresentou diferença estatisticamente significante entre si (p > 0.05).
Para o vanádio, as médias e desvios padrões das concentrações nos grupos controle, 1-S, 4-S e 12-S estão representados na Tabela 4 e Figura 4. A média da concentração de V no grupo controle foi de 0.43 ppb, no grupo 1-S foi de 0.48 ppb, no grupo 4-S foi de 0.78 ppb e no grupo 12-S foi de 0.56 ppb. Todos os valores apresentaram diferença estatisticamente significante entre si (p < 0.05).
4 DISCUSSÃO
A biocompatibilidade do Ti cp é atribuída à sua capacidade de formar espontaneamente uma camada superficial de óxido de titânio (TiO2) [7, 15]. Na liga Ti-6Al-4V o óxido superficial é composto por TiO2 com pequenas quantidades de Al2O3, grupos hidroxílicos e água [4]. O óxido superficial da liga é menos estável que o óxido do Ti cp porque o Al e o V que são adicionados como elementos de liga para estabilizar, respectivamente, as fases a e b, desestabilizam a liga, tornando-a vulnerável à corrosão [16]. Como o vanádio não está presente no filme formado na superfície da liga Ti-6Al-4V [4], o titânio e o alumínio são os íons metálicos mais prováveis de serem liberados por superfícies de Ti-6Al-4V [17]. Essa afirmação está de acordo com os valores encontrados no presente estudo, pois Ti e Al foram encontrados em maiores quantidades do que V, apesar de quantidades mínimas de V terem sido detectadas.
Somado à desestabilização causada pelos elementos de adição, quando a liga Ti-6Al-4V é implantada no corpo humano ocorrem mudanças em sua camada protetora que influenciam a liberação de produtos de corrosão. Estas alterações ocorrem por diversos motivos, tais como: (1) a concentração de íons cloro no soro sanguíneo e nos fluidos intersticiais gera um ambiente altamente corrosivo para materiais metálicos; (2) o pH do tecido ósseo, no qual o material é implantado, diminui para aproximadamente 5,2 e só retorna ao valor normal (7,4) após 2 semanas; (3) os fluidos corporais contêm aminoácidos e proteínas que influenciam a corrosão metálica; (4) a concentração de oxigênio dissolvido nos fluidos corporais é um quarto daquela no ar, atrasando a regeneração do filme de óxido superficial; e (5) as células atuam como corpos com carga que podem influenciar a corrosão de materiais metálicos [4].
A corrosão metálica da liga Ti-6Al-4V na forma de implantes ortopédicos, placas de fixação, brackets ortodônticos tem sido relatada [6, 10, 18, 19]. Apesar de alguns autores relatarem ausência de sinais patológicos associados com a liberação de íons titânio [7-9, 12], partículas deste metal podem promover proliferação de fibroblastos, importante fator no desenvolvimento da cápsula fibrosa ao redor dos implantes. Além disso, a fagocitose das partículas pode causar osteólise peri-implante [20]. Os íons Ti também induzem a diminuição no número e atividade de osteoblastos, macrófagos e leucócitos [17], prejudicando a osteogênese.
A concentração de titânio medida nos órgãos dos coelhos, quando comparada com os valores observados no grupo controle (10.05 ppb), não aumentou após 1 semana (10.08 ppb) (Tabela 2 e Figura 2). Porém, após 4 semanas os valores foram estatisticamente maiores (11.13 ppb), mantendo-se elevado após 12 semanas (11.27 ppb). Os resultados tiveram comportamento semelhante aos resultados encontrados por FRISKEN et al. (2002) em ovelhas, apesar dos valores medidos por estes autores terem sido consideravelmente maiores. No estudo de EGENI et al. [8], a concentração de Ti nos órgãos de coelhos estava abaixo do limite de detecção após 30 dias (4 semanas). Porém, após 180 dias (25 semanas), níveis de titânio entre 1,18 e 2,95 ppm foram medidos. WEINGART et al. [9] observaram quantidades de Ti variando de 0,01 a 9,0 ppm nos órgãos de cães após 9 meses (39 semanas) de inserção de parafusos de titânio. Estes valores estão bem acima dos valores encontrados no presente estudo. Estas diferenças podem estar associadas ao maior tempo de implantação e aos diferentes tipos de implantes utilizados.
Segundo HANAWA (2004), os componentes mais nocivos dos implantes metálicos são o cobalto na liga Cr-Co, o níquel no aço inoxidável e o vanádio na liga Ti-6Al-4V. Porém, tanto o vanádio quanto o alumínio, contidos na liga Ti-6Al-4V, são potencialmente tóxicos [3, 12]. Os íons Al afetam a proliferação, atividade metabólica e diferenciação dos osteoblastos [17]. Alguns efeitos tóxicos atribuídos ao acúmulo de alumínio no corpo humano são descritos na literatura (encefalopatia e demência senil do tipo Alzheimer) [14]. O elemento pode também estar associado à osteomalácia e à granulomatose pulmonar [12].
O comportamento das concentrações de alumínio nos órgãos de coelhos, em função do tempo de implantação (Tabela 3 e Figura 3) foi diferente do comportamento do titânio. Para o alumínio, os valores do grupo controle foram elevados (75,38 ppm), mantendo-se aproximadamente no mesmo nível, sem diferenças estatisticamente significantes até 12 semanas (73,28 ppm). Isso pode estar relacionado ao fato do alumínio ser um elemento presente em fontes ambientais, como alimentação e ar [10]. Desta forma, o Al está presente em grandes quantidades no tecido pulmonar e a contribuição de Al vinda da corrosão in vivo dos mini-implantes ortodônticos não é significante.
O vanádio é um micro-elemento essencial presente na maioria das células dos mamíferos [21] e sua principal fonte são os alimentos. A diferença entre a dose essencial e a dose tóxica é pequena, por isso o V é considerado altamente tóxico entre os micro-elementos nutricionalmente necessários [18]. Dentre as ações farmacológicas e fisiológicas do vanádio, observa-se papel importante deste elemento na terapia auxiliar de pacientes diabéticos [21].
Os efeitos da intoxicação crônica e aguda por vanádio são bem documentados. O vanádio é citotóxico para macrófagos e fibroblastos [5, 22], se liga a proteínas (ferritina e transferrina), afetando sua distribuição e acúmulo no corpo humano [21, 22], estimula reações alérgicas locais e sistêmicas, inibe a proliferação celular [12] e tem o potencial de causar lesões renais. A excreção urinária é a principal via de eliminação de vanádio injetável em humanos [21].
Observando o comportamento do vanádio durante os períodos analisados pode-se observar que, comparando com os valores do grupo controle (0.43 ppb), a concentração de vanádio aumentou levemente após 1 semana (0.48 ppb), teve grande incremento após 4 semanas (0.78 ppb) e sofreu ligeiro decréscimo após 12 semanas (0.56 ppb), não alcançando porém os valores observados após 1 semana (Tabela 4 e Figura 4). Esse padrão de liberação de vanádio pode ser associado ao comportamento eletroquímico e mecânico do óxido superficial.
A concentração de vanádio medida não alcançou níveis tóxicos, pois GIOKA et al. [19] encontraram 2 ppm de V liberados por brackets ortodônticos de Ti-6Al-4V e essa quantidade foi considerada mínima. Somado a isso está o fato de que o tempo de uso de mini-implantes durante o tratamento ortodôntico é limitado. Sendo assim, os níveis mínimos de vanádio liberados pelos mini-implantes ortodônticos de Ti-6Al-4V não constituem uma situação alarmante.
Os mini-implantes ortodônticos testados no presente estudo apresentavam superfície lisa, como usinados, ou seja, não receberam tratamento para aumentar a rugosidade de superfície (Figura 1). As baixas concentrações de íons metálicos medidos neste estudo (Tabelas 2, 3 e 4) podem estar relacionadas a este fato, pois a liberação de íons metálicos está intimamente relacionada com a estrutura da superfície do implante, sua rugosidade e configuração topográfica [23]. Implantes com alta rugosidade superficial possuem menor resistência à corrosão e maior liberação de íons metálicos do que implantes com menor rugosidade superficial [2, 7].
O uso de coelhos em estudos de implantes é largamente difundido [8, 13, 14, 23] devido à correlação existente entre a fisiologia humana e a dos coelhos. Entretanto, deve-se tomar cuidado durante a extrapolação do comportamento clínico a partir de animais experimentais, pois as dimensões dos materiais testados em relação ao sistema biológico dos coelhos podem ter grande influência nos resultados [19]. Neste estudo, 4 mini-implantes ortodônticos foram implantados em cada coelho, número médio de mini-implantes utilizados durante o tratamento ortodôntico. Entretanto, o peso dos coelhos (3 kg) é cerca de 20 vezes menor do que o peso médio de um humano adulto (60 a 70 kg). Desta forma, supõe-se que as baixas concentrações de íons metálicos medidos no presente estudo são insignificantes para humanos.
5 CONCLUSÃO
Quantidades variadas de Ti, Al e V foram detectadas em todos grupos testados, comprovando que existe liberação de íons metálicos pelos mini-implantes ortodônticos de Ti-6Al-4V.
Apesar da tendência de liberação de íons pela liga de titânio, as quantidades de metais detectadas foram extremamente baixas.
Devido aos baixos valores de Ti, Al e V medidos no presente estudo, conclui-se que os mini-implantes ortodônticos de Ti-6Al-4V são dispositivos seguros para emprego como auxiliar de ancoragem no tratamento ortodôntico.
6 AGRADECIMENTOS
O presente trabalho foi realizado com apoio financeiro da CAPES, CNPq (Processo 300216/94-7, 452834/03-1, 50016/052003 e 472449/2004-4) e FAPERJ (Processo: E-26/151.970/2004).
7 BIBLIOGRAFIA
Data de envio: 26/06/06 Data de aceite: 15/09/06
- [1] NIINOMI, M., "Mechanical Properties of Biomedical Titanium Alloys", Materials Science and Engineering, v. A243, pp. 231-236, 1998.
- [2] APARICIO, C., GIL, F. J., FONSECA, C., BARBOSA, M., PLANELL, J. A., "Corrosion Behavior of Commercially pure Titanium shot Blasted with Different Materials and sizes of shot Particles for Dental Implant Applications", Biomaterials, v. 24, pp. 263-273, 2003.
- [3] LATYSH, V., KRALLICS, G., ALEXANDROV, I., FODOR, A., "Application of Bulk Nanostructured Materials in Medicine", Current Applied Physics, v. 6, pp. 262-266, 2006.
- [4] HANAWA, T., "Metal ion release from metal implants", Materials Science and Engineering C, v. 24, pp. 745-752, 2004.
- [5] TIAN, Y.S., CHEN, C.Z., LI, S.T., HUO, Q.H., "Research Progress on Laser Surface Modification of Titanium Alloys", Applied Surface Science, v. 242, pp. 177-184, 2005.
- [6] CHASSOT, E., IRIGARAY, J.L., TERVER, S., VANNEUVILLE, G., "Contamination by Metallic Elements Released from Joint Prostheses", Medical Engineering & Physics, v. 26, pp. 193-199, 2004.
- [7] MEYER, U., BÜHNER, M., BÜCHTER, A.,KRUSE-LÖSTER, B., STAMM, T., WIESMANN, H.P., "Fast Element Mapping of Titanium Wear Around Implants of Different Surface Structures", Clinical Oral Implants Research, v. 17, pp. 206-211, 2006.
- [8] EGENI, G. P., JAKSIC, M., MOSCHINI, G., PASSI, P., PIATELLI, A., ROSSI, P., RUDELLO, V., TAURO, L., "PIXE and micro-PIXE Studies of Ion Release Around Endosseous Implants in Animals", Nuclear Instruments and Methods in Physics Research Section B, v. 109/110, pp. 289-293, 1996.
- [9] WEINGART, D., STEINEMANN, S., SCHILLI, W., STRUB, J. R., HELLERICH, U., ASSENMACHER, J., SIMPSON J., "Titanium Deposition in Regional Lymph Nodes After Insertion of Titanium Screw Implants in Maxillofacial Region", International Journal of Oral and Maxillofacial Surgery, v. 23, pp. 450 452, 1994.
- [10] URBAN, R. M., JACOBS, J. J., TOMLINSON, M. J., GAVRILOVIC, J., BLACK, J., PEOCH, M., "Dissemination of Wear Particles to the Liver, Spleen, and Abdominal Lymph Nodes of Patients with Hip or Knee Replacement", Journal of Bone and Joint Surgery, v. 82A, pp. 457-477, 2000.
- [11] FRISKEN, K. W., DANDIE, G. W., LUGOWSKI, S., JORDAN, G., "A Study of Titanium Release into body Organs Following the Insertion of Single Threaded Screw Implants into the Mandibles of Sheep", Australian Dental Journal, v. 47, pp. 214-217, 2002.
- [12] SEDARAT, C., HARMAND, M. F., NAJI, A., NOWZARI, H., "In Vitro Kinetic Evaluation of Titanium Alloy Biodegradation", Journal of Periodontal Research, v. 36, pp. 269-274, 2001.
- [13] ROBERTS, E. W., SMITH, R. K., ZILBERMAN, Y., MOZSARY, P. G., SMITH, R. S., "Osseous Adaptation to Continuous Loading of Rigid Endosseous Implants", American Journal of Orthodontics, v. 86, pp. 95-111, 1984.
- [14] LIU, P., YAO, Y. N., WU, S. D., DONG, H. J., FENG, G. C., YUAN, X. Y., "The Efficacy of Deferiprone on Tissues Aluminum Removal and Copper, Zinc, Manganese Level in Rabbits", Journal of Inorganic Biochemistry, v. 99, pp. 1733-1737, 2005.
- [15] GOLDBERG, J. R., GILBERT, J. L., "The Electrochemical and Mechanical Behavior of Passivated and TiN/AlN-coated CoCrMo and Ti6Al4V alloys", Biomaterials, v. 25, pp. 851864, 2004.
- [16] MARINO, C. E. B., ROCHA-FILHO, R. C., BOCCHI, N., BIAGGIO, S. R., "Investigaçăo da Estabilidade de Materiais Biocompatíveis por Análise Microestrutural", Anais da 23Ş Reuniăo Anual da Sociedade Brasileira de Química, n. 0301, 2000. Disponível on-line em http://www.sbq.org.br/ranteriores/23/ resumos/0301/index.html
- [17] SALDAŃA, L., BARRANCO, V., GARCÍA-ALONSO, M. C., VALLÉS, G., ESCUDERO, M. L., MUNUERA, L., VILABOA, N., "Concentration-dependent Effects of Titanium and Aluminium ions Released from Thermally Oxidized Ti6Al4V Alloy on Human Osteoblasts", Journal of Biomedical Materials Research, v. 77A, pp. 220-229, 2006.
- [18] WOODMAN, J. L., JACOBS, J. J., GALANTE, J. O., URBAN, R. M., "Metal Ion Release from Titanium-Based Prosthetic Segmental Replacements of Long Bones in Baboons A long-term study", Journal of Orthopaedic Research, V. 1, PP. 421-430, 1984.
- [19] GIOKA, C., BOURAUEL, C., ZINELIS, S., ELIADES, T., SILIKAS, N., ELIADES, G., "Titanium Orthodontic Brackets: Structure, Composition, Hardness and Ionic Release", Dental Materials, v. 20, pp. 693-700, 2004.
- [20] GARCÍA-ALONSO, M. C., SALDAŃA, L., VALLÉS, G., GONZÁLEZ-CARRASCO, J. L., GONZÁLEZ-CABRERO, J., MARTÍNEZ, M. E., GIL-GARAY, E., MUNUERA, L., "In Vitro Corrosion Behaviour and Osteoblast Response of Thermally Oxidised Ti6Al4V Alloy", Biomaterials, v. 24, pp. 19-26, 2003.
- [21] HEINEMANN, G., FICHTL, B., VOGT, W., "Pharmacokinetics of Vanadium in Humans after Intravenous Administration of a Vanadium Containing Albumin Solution", British Journal of Clinical Pharmacology, v. 55, pp. 241-245, 2003.
- [22] RAE, T., "The Biological Response to Titanium and Titanium-Aluminium-Vanadium Alloy Particles", Biomaterials, v. 7, pp. 30-36, 1986.
- [23] de MAETZU, M. A., ALAVA, J. I., GAY-ESCODA, C., "Ion Implantation: Surface Treatment for Improving the Bone Integration of Titanium and Ti6Al4V Dental Implants", Clinical Oral Implants Research, v. 14, pp. 57-62, 2003.
Datas de Publicação
-
Publicação nesta coleção
12 Set 2007 -
Data do Fascículo
2007
Histórico
-
Aceito
15 Set 2006 -
Recebido
26 Jun 2006