Resumos
Neste trabalho, foram estudados sólidos do tipo LaNi1-xCuxO3 (x = 0,0; 0,3 e 0,5), com estrutura perovskita, visando a desenvolver catalisadores destinados à produção de hidrogênio de alta pureza na reforma interna de células a combustível de óxido sólido (SOFC). Observou-se que as condições experimentais usadas na preparação favoreceram a incorporação quantitativa dos cátions ao precursor e a formação dos sólidos com estrutura perovskita. Esses materiais mostraram diferentes propriedades redutoras e a presença do cobre favoreceu a estabilidade da estrutura perovskita. As propriedades catalíticas das amostras obtidas foram avaliadas na reação de deslocamento de monóxido de carbono com vapor d'água (WGSR, water gas shift reaction), uma etapa importante de purificação do hidrogênio, no processo de reforma de hidrocarbonetos. Os resultados mostraram que os catalisadores são promissores para esta reação, apresentando atividade muito superior à de um catalisador comercial de óxido de ferro contendo cromo e cobre; isto foi atribuído à tendência das amostras em favorecer o mecanismo adsortivo, provavelmente decorrente de uma alta mobilidade dos oxigênios da rede cristalina. O valor mais elevado de atividade catalítica foi apresentado pela Amostra LaNi0,5Cu0,5O3, considerada o catalisador de melhor desempenho.
Perovskita; produção de hidrogênio; conversão de CO; níquel e cobre
LaNi1-xCu xO3 (x = 0.0, 0.3 and 0.5) type solids with perovskite structure were studied in this work aiming to develop catalysts for the production of high pure hydrogen in the internal reforming of solid oxide fuel cells (SOFC). It was observed that the experimental conditions used for preparing the samples favored the quantitative incorporation of cations in the precursor and the formation of solids with perovskite structure. These materials showed different reducing properties and the copper presence favored the stability of the perovskite structure. The catalytic properties of the samples were evaluated in water gas shift reaction (WGSR), an important step for purifying hydrogen in the process of hydrocarbons reforming. The results showed that the catalysts are promising for the reaction, showing much higher activities than a iron oxide-based commercial catalyst containing chromium and copper; This was assigned to the tendency of the samples in favoring the adsorptive mechanism, probably due to a high mobility of oxygen in the crystalline lattice. The highest value of catalytic activity was shown by the LaNi0.5Cu0.5O3 sample, the catalyst with the best performance.
Perovskite; hydrogen production; CO conversion; nickel and copper
Síntese e caracterização de perovskitas do tipo LaNi1-xCuxO3 para a purificação de hidrogênio para PaCOS
Moura, J.S.I; Silva, L.A.I; Rangel, M.C.I; Araújo, G.C.II
IGECCAT - Grupo de Estudos em Cinética e Catálise - UFBA, CEP: 40179-290, Salvador, BA. e-mail: jadsonsm@ufba.br; lindaura@ufba.br; mcarmov@ufba.br
IIDepartamento de Ciências Exatas e da Terra - UNEB, CEP: 41195-001, Salvador, BA. e-mail: gcaraujo@uneb.br
RESUMO
Neste trabalho, foram estudados sólidos do tipo LaNi1-xCuxO3 (x = 0,0; 0,3 e 0,5), com estrutura perovskita, visando a desenvolver catalisadores destinados à produção de hidrogênio de alta pureza na reforma interna de células a combustível de óxido sólido (SOFC). Observou-se que as condições experimentais usadas na preparação favoreceram a incorporação quantitativa dos cátions ao precursor e a formação dos sólidos com estrutura perovskita. Esses materiais mostraram diferentes propriedades redutoras e a presença do cobre favoreceu a estabilidade da estrutura perovskita. As propriedades catalíticas das amostras obtidas foram avaliadas na reação de deslocamento de monóxido de carbono com vapor d'água (WGSR, water gas shift reaction), uma etapa importante de purificação do hidrogênio, no processo de reforma de hidrocarbonetos. Os resultados mostraram que os catalisadores são promissores para esta reação, apresentando atividade muito superior à de um catalisador comercial de óxido de ferro contendo cromo e cobre; isto foi atribuído à tendência das amostras em favorecer o mecanismo adsortivo, provavelmente decorrente de uma alta mobilidade dos oxigênios da rede cristalina. O valor mais elevado de atividade catalítica foi apresentado pela Amostra LaNi0,5Cu0,5O3, considerada o catalisador de melhor desempenho.
Palavras-chave: Perovskita, produção de hidrogênio, conversão de CO, níquel e cobre.
ABSTRACT
LaNi1-xCuxO3 (x = 0.0, 0.3 and 0.5) type solids with perovskite structure were studied in this work aiming to develop catalysts for the production of high pure hydrogen in the internal reforming of solid oxide fuel cells (SOFC). It was observed that the experimental conditions used for preparing the samples favored the quantitative incorporation of cations in the precursor and the formation of solids with perovskite structure. These materials showed different reducing properties and the copper presence favored the stability of the perovskite structure. The catalytic properties of the samples were evaluated in water gas shift reaction (WGSR), an important step for purifying hydrogen in the process of hydrocarbons reforming. The results showed that the catalysts are promising for the reaction, showing much higher activities than a iron oxide-based commercial catalyst containing chromium and copper; This was assigned to the tendency of the samples in favoring the adsorptive mechanism, probably due to a high mobility of oxygen in the crystalline lattice. The highest value of catalytic activity was shown by the LaNi0.5Cu0.5O3 sample, the catalyst with the best performance.
Keywords: Perovskite; hydrogen production; CO conversion, nickel and copper.
1 INTRODUÇÃO
Nos últimos anos, novos materiais destinados à produção de hidrogênio em células a combustível de óxido sólido (SOFC, solid oxide fuel cell) vêm sendo cada vez mais pesquisados. Uma das configurações mais convenientes desses dispositivos é aquela que permite gerar hidrogênio dentro da célula (reforma interna), abrindo a possibilidade de usar outros combustíveis, tais como gás natural ou bioetanol [1-3].
Na produção industrial de hidrogênio, via a reforma de hidrocarbonetos, o níquel é o metal mais empregado, devido às suas propriedades catalíticas e ao seu baixo custo. Por outro lado, os sólidos baseados em cobre são ativos na reação de deslocamento do monóxido de carbono com vapor d'água (WGSR, water gas shift reaction), um processo importante para purificar o hidrogênio produzido durante a reforma. A reforma de hidrocarbonetos é amplamente utilizada na obtenção de hidrogênio de alta pureza para fins industriais e este processo envolve diversas etapas, incluindo a reação de deslocamento do monóxido de carbono com vapor d'água (WGSR) [4-9]:
A fim de desenvolver catalisadores para a produção de hidrogênio, via a reforma do metano na célula de óxido sólido, foram estudados sólidos do tipo LaNi1-xCuxO3 (x = 0,0; 0,3 e 0,5), com estrutura perovskita. O uso desses catalisadores deverá permitir a produção de hidrogênio com um nível de pureza superior àquele obtido no processo convencional de reforma, uma vez que os sólidos com a estrutura perovskita constituem um sistema alternativo atrativo para catalisar a reação de deslocamento de monóxido de carbono com vapor d'água [10-12]. Estes sólidos possuem a fórmula ABO3, em que A é o cátion de tamanho maior, responsável pela resistência térmica do catalisador, enquanto B é o cátion associado com a atividade catalítica. Por apresentarem, ainda, a possibilidade da substituição parcial dos cátions A e/ou B por outro cátion metálico (permitindo o controle da atividade e da estabilidade térmica), eles são capazes de dar origem a uma vasta família de compostos com fórmula geral A1-xA'xB1-xB'xO3 (em que x é o grau de substituição parcial) [13-16]. O uso desses materiais, como catalisadores, deve-se principalmente ao fato deles possuírem oxigênio com alta mobilidade e apresentarem elevada estabilidade estrutural. Estas características os tornam sólidos adequados ao seu emprego em reações de oxidação-redução, tal como o a oxidação de monóxido de carbono [11]. Diversos estudos mostraram que o comportamento típico desses sólidos, como catalisadores de oxidação, se deve à facilidade com que as espécies de oxigênio podem ser liberadas da superfície do catalisador [17, 18]. Em estudos anteriores [4, 19], verificou-se que os catalisadores contendo níquel são sistemas promissores para a reação de WGSR. Por outro lado, o cobre está presente na formulação dos catalisadores de HTS (high temperature shift) de última geração [6-9].
2 MATERIAIS E MÉTODOS
Os sólidos do tipo perovskitas parcialmente substituídas foram preparados através do processo de decomposição térmica do precursor citrato amorfo [20]. Foi preparada uma solução concentrada (10 M) do nitrato de lantânio, de níquel e de cobre de modo a obter uma relação de La:Ni:Cu de 1:(1-x):x (sendo x o grau de substituição parcial do níquel). Preparou-se, também, uma solução concentrada (10 M) de ácido cítrico. As soluções foram misturadas em um reator de vidro. Em seguida, o sistema foi aquecido a 70 ºC, a uma pressão residual de 10 Torr até a eliminação do solvente. Os materiais obtidos foram moídos e secos a 70 ºC ao ar, por 96 h, dando origem aos precursores amorfos. Em seguida, estes compostos foram aquecidos (5 ºC.min-1) a 600 ºC, ao ar, por 4 h, para dar origem a óxidos mistos com estrutura perovskita. Foram obtidos sólidos com x = 0,0; 0,3 e 0,5.
A composição química elementar dos sólidos foi determinada suportando-os em um filme de polipropileno, transparente aos raios-X. As amostras foram analisadas em um espectrômetro de fluorescência de raios-X de energia dispersiva Shimadzu, modelo EDX 700 HS, equipado com tubo de raios-X de ródio.
Os experimentos de termogravimetria e de análise térmica diferencial foram conduzidos para monitorar a decomposição térmica dos precursores, empregando-se um equipamento Mettler Toledo, modelo TGA/SDTA 851. Utilizou-se, em cada análise, uma massa de aproximadamente 0,005 g, que foi aquecida a uma velocidade de 10 °C.min-1, sob fluxo de ar sintético (50 mL.min-1) até 1000 °C.
Os difratogramas de raios-X foram obtidos por meio de um equipamento Shimadzu, modelo XRD 6000, usando filtro de níquel e radiação CuKα (λ=1,5406 A), gerada a 40 kV e 30 mA. A velocidade de obtenção dos difratogramas foi de 2 º.min-1, numa faixa de ângulo de 10<2θ<75.
As medidas das áreas superficiais específicas dos catalisadores foram feitas usando-se um aparelho Micromeritics modelo ASAP-2000 e o método BET (Brunnauer, Emmett e Teller). As amostras foram previamente desgaseificadas a 350 ºC, durante 5 h, a uma pressão residual de 5x10-3 Torr. As medidas foram analisadas com uma mistura 30% N2/He à temperatura do nitrogênio líquido e o cálculo foi realizado tomando sete pontos na faixa de pressões relativas de 0,05 - 0,25.
Os perfis de redução à temperatura programada foram obtidos em um equipamento Micromeritics modelo TPD/TPR 2900 Analyser. Nos experimentos, utilizou-se cerca de 0,03 g de amostra e acompanhou-se o consumo de hidrogênio de uma mistura 5% H2/He, numa faixa de temperatura de 27 a 1000 ºC.
O desempenho dos sólidos, em relação à reação de WGSR, foi avaliado em um teste microcatalítico, constituído de um reator de leito fixo, contendo 0,15 g do catalisador e operando a 1 atm e 370 ºC. Utilizou-se uma vazão de alimentação de 200 mL.min-1 e razão molar vapor / gás de processo igual a 0,6. O gás de processo (10% CO, 10% CO2, 20% N2 e 60% H2) foi borbulhado em um vaso saturador contendo água a 77ºC e, em seguida, alimentado ao reator juntamente com o vapor d'água arrastado. Os efluentes gasosos foram analisados em um cromatógrafo a gás CG-35, em linha com o reator. Numa etapa prévia à reação, a amostra foi reduzida com hidrogênio a 500 ºC, por 2 h. As condições (massa de catalisador e vazão dos reagentes) foram ajustadas de modo a obter uma conversão de 10 % com um catalisador comercial, baseado em óxido de ferro contendo cromo e cobre.
3 RESULTADOS E DISCUSSÃO
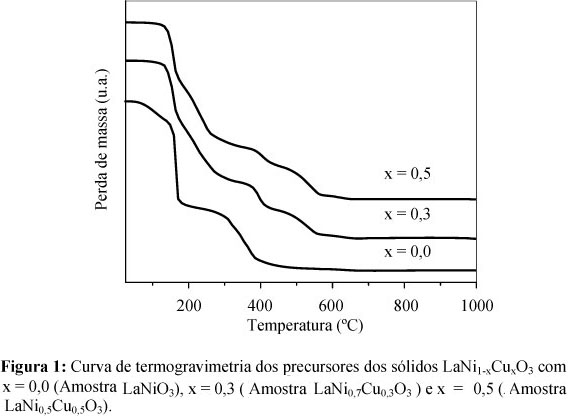
As curvas de termogravimetria dos precursores das perovskitas obtidas são apresentadas na Figura 1. Podem ser observadas, em todos os casos, quatro etapas de decomposição. A primeira, em temperaturas inferiores a 130 ºC, pode ser atribuída à eliminação de água do precursor [21]. A segunda e terceira etapas compreendidas entre 150 a 400 ºC correspondem provavelmente, à decomposição do íon nitrato ainda presente e de espécies carbonato remanescentes nos precursores [21]. A quarta etapa, em temperaturas superiores a 400 ºC, também é resultante da decomposição de espécies carbonato [21]. A partir dos resultados mostrados, foi identificada a temperatura de 600 ºC para calcinar as amostras. Esse valor foi suficiente para permitir a completa decomposição do precursor citrato e formar os sólidos com estrutura perovskita.
A Figura 2 ilustra os padrões de difração de raios-X das amostras obtidas. Observou-se a presença da fase correspondente à estrutura perovskita. O óxido não substituído LaNiO3 pertence ao sistema romboédrico, grupo espacial R3c (N167), com parâmetros hexagonais a = 0,54573 nm e c = 1,31601 nm [12]. Os sólidos parcialmente substituídos (Amostras LaNi0,7Cu0,3O3 e LaNi0,5Cu0,5O3) apresentaram o padrão com a mesma simetria do composto não substituído. As fases CuO e La2CuO4 não foram observadas, indicando que a temperatura de calcinação empregada conduziu à formação apenas da fase desejada.
Tabela 1 mostra as razões atômicas do níquel e cobre, obtidas experimentalmente e calculadas em relação ao lantânio. Nota-se que a composição dos sólidos obtida experimentalmente foi próxima à teórica, indicando que os cátions foram quantitativamente incorporados ao precursor. Isto confirma que as condições experimentais usadas na preparação foram favoráveis à formação dos precursores dos sólidos com estrutura perovskita.
A Tabela 2 mostra os resultados das medidas das áreas superficiais específicas das amostras obtidas. Nota-se que os valores são tipicamente baixos, o que é característico de sólidos com estrutura perovskita [13]. As áreas superficiais específicas dos catalisadores foram alteradas devido à presença do cobre. Nas amostras parcialmente substituídas, os valores das áreas superficiais específicas diminuíram com o aumento do teor de cobre.
Os experimentos de redução termoprogramada produziram as curvas apresentadas na Figura 3. O termograma da Amostra LaNiO3 mostrou um pico a 325 ºC, devido à redução das espécies Ni3+ a Ni2+ e outro a 455 ºC, associado à produção do níquel metálico [22]. Nos sólidos parcialmente substituídos (Amostras LaNi0,7Cu0,3O3 e LaNi0,5Cu0,5O3), os picos atribuídos à produção das espécies Ni2+ e Ni0 foram deslocados para temperaturas mais altas (a cerca de 370 e 500 ºC, respectivamente), indicando que a substituição do níquel pelo cobre favorece a estabilidade da estrutura perovskita. Nesses sólidos, o primeiro pico pode ser atribuído à formação simultânea da espécie Ni2+ e do cobre metálico. De acordo com estudos anteriores [23], as curvas de compostos com estrutura perovskita, contendo cobre, podem exibir dois picos. O primeiro, a 273 ºC se deve à redução das espécies Cu2+ a Cu1+ e o outro, a 361 ºC, pode ser atribuído à produção do cobre metálico. Os perfis de redução dos sólidos parcialmente substituídos obtidos mostraram que as espécies de cobre se reduzem em temperaturas mais altas que em um catalisador mássico comercial [24] ou em suportes convencionais [25]. Isto indica que o cobre é estabilizado, quando incorporado à rede da estrutura perovskita [25].
Os resultados de avaliação catalítica (Tabela 3) mostraram que todos os catalisadores foram ativos na reação de WGSR. A amostra não substituída (LaNiO3) apresentou valor de atividade elevado e superior à de um catalisador comercial, contendo cobre e cromo (9x10-6 mol.g-1.s-1). Quando se compara essa amostra com aquela parcialmente substituída num grau mais baixo (Amostra LaNi0,7Cu0,3O3), observa-se que não houve alteração no valor da atividade. Por outro lado, aquela parcialmente substituída num grau mais alto (Amostra LaNi0,5Cu0,5O3), apresentou-se mais ativa. Observou-se que, com os sólidos parcialmente substituídos, o valor da atividade aumentou com o teor de cobre. Isto pode ser atribuído à atividade catalítica do cobre na reação de WGSR, como observado em outros trabalhos [6, 8, 26]. A presença simultânea de níquel e cobre em quantidades equivalentes (Amostra LaNi0,5Cu0,5O3) aumenta a atividade catalítica do sólido. Os catalisadores contendo níquel e cobre apresentaram atividade muito superior à de uma amostra comercial, contendo cromo e cobre, o que pode ser atribuído a uma tendência do sólido em favorecer o mecanismo adsortivo. Segundo este mecanismo, a água e o monóxido de carbono adsorvem na superfície do catalisador, onde reagem para formar intermediários, seguida pela decomposição a produtos e dessorção da superfície [6]. Nos sólidos contendo cobre, existe um aumento dos elétrons de valência, que ocasiona um aumento na mobilidade dos átomos de oxigênio da rede cristalina, conduzindo assim a um aumento de condutividade e atividade catalítica [27, 28].
Os resultados de redução à temperatura programada mostraram que as espécies de cobre são reduzidas em temperaturas mais altas que num catalisador mássico comercial [6], indicando que o cobre é estabilizado na rede da estrutura perovskita [25]. Consequentemente, a extensão da redução é inibida e a sinterização da espécie reduzida é retardada em relação aos catalisadores mássicos ou os suportados convencionais [25].
4 CONCLUSÕES
A partir dos resultados obtidos neste trabalho, pode-se concluir que as condições experimentais usadas na preparação das amostras favoreceram a incorporação quantitativa dos cátions (cobre, níquel e lantânio) ao precursor e a formação de sólidos com estrutura perovskita. Os catalisadores obtidos, com estrutura perovskita do tipo LaNi1-xCuxO3 (x= 0,0; 0,3 e 0,5) se mostraram promissores para a reação de deslocamento de monóxido de carbono com vapor d'água (WGSR). Esses sólidos apresentaram diferentes propriedades redutoras e a presença do cobre favoreceu a estabilidade da estrutura perovskita. As amostras contendo níquel e cobre mostraram atividade catalítica superior àquela de um catalisador comercial contendo cromo e cobre, o que foi atribuído a uma tendência desses catalisadores em favorecer o mecanismo adsortivo, provavelmente por uma alta mobilidade dos oxigênios da rede cristalina. Os resultados mostraram que o melhor desempenho catalítico foi apresentado pela amostra contendo níquel e cobre em quantidades equivalentes (Amostra LaNi0,5Cu0,5O3).
5 AGRADECIMENTOS
JSM agradece ao CNPq pela bolsa de estudos concedida. Os autores agradecem ao CNPq e à FINEP pelo apoio financeiro.
6 BIBLIOGRAFIA
[12] FALCÓN, H., BARBERO, J.A., ALONSO, J.A., MARTINEZ-LOPE, M.J., FIERRO, J.L.G., "SrFeO3-δ Perovskite oxides: chemical features and performance for methane combustion", Chemistry of Materials, v. 14, pp. 2325, April, 2002.
Data de envio: 01/04/09
Data de aceite: 14/04/10
Autor Responsável: Maria do Carmo Rangel
- [1] WENDT, H., GÖTZ, M., LINARDI, M., "Tecnologia de células a combustível", Química Nova, v. 23, n. 4, pp. 538-546, 2000.
- [2] MOURA, J.S., SOUZA, M.O.G., RANGEL, M.C., "Efeito da adição de magnésio nas propriedades texturais de catalisadores à base de níquel e óxido de lantânio", Revista Matéria, v. 12, n. 1, pp. 29-38, 2007.
- [3] MOURA, J.S., SOUZA, M.O.G., RANGEL, M.C., "Effect of magnesium on the properties of nickel and lanthanum-based catalysts in steam reforming", Fuel, v. 87, n. 17-18, pp. 3627-3630, December, 2008.
- [4] NEWSOME, D.S., "The water-gas shift reaction", Catalysis Review - Science Engineering, v. 21, pp. 275, 1980.
- [5] TWIGG, M.V., LLOYD, L., RIDLER, D.E., Catayst Handbook, London, Manson Publishing Ltda, pp. 283, 1996.
- [6] ARAÚJO, G.C., RANGEL, M.C., "An environmental friendly dopant for the high-temperature shift catalysts", Catalysis Today, v. 62, pp. 201-207, November, 2000.
- [7] QUADRO, E.B., DIAS, M.L.R.M., AMORIM, A.A.M., RANGEL, M.C., "Chromium and copper-doped magnetite catalysts for the high temperature shift reaction", Journal of the Brazilian Chemical Society, v. 10, n. 1, pp. 51-59, 1999.
- [8] ARAUJO, G.C., RANGEL, M.C., "An environmental friendly catalyst for the high temperature shift reaction", Studies in Surface Science and Catalysis, v. 130, pp. 1601-1606, 2000.
- [9] COSTA, J.L.R., NOBRE, P.S.S., ARAÚJO, G.C., MARCHETTI, S.G., RANGEL, M.C., "Avaliação Catalítica de Magnetita Contendo Tório e Cobre na Reação de HTS", In: Anais do 11ş Congresso Brasileiro de Catálise e 1ş Congresso de Catálise no Mercosul, v. 1, pp. 580, Bento Gonçalves, 2001.
- [10] BARBERO, J., PEÑA, M.A., CAMPOS-MARTIN, J.M., FIERRO, J.L.G., ARIAS, P.L., "Support effect in supported Ni catalysts on their performance for methane partial oxidation", Catalysis Letters, v. 87, n. 3-4, pp. 211-218, April, 2003.
- [11] FALCÓN, H., BARBERO, J.A., ARAUJO, G., CASAIS, M.T., MARTINEZ-LOPE, M.J., ALONSO, J.A., FIERRO, J.L.G., "Double perovskite oxides A2FeMoO6-δ (A = Ca, Sr and Ba) as catalysts for methane combustion", Applied Catalysis B: Environmental, v. 53, n. 1, pp. 37-45, October, 2004.
- [13] PEÑA, M.A., FIERRO, J.L.G., "Chemical Structures and Performance of Perovskite Oxides", Chemical Reviews, v. 101, pp. 1981-2018, May, 2001.
- [14] PEÑA, A., GUTIERREZ, J., RODRIGUEZ-MARTINEZ, L.M., BARANDIARAN, J.M.T., HERNANDEZ, T., ROJO, T., "Magnetic order changes in Al substituted Sr2FeMoO6 double perovskites", Journal of Magnetism and Magnetic Materials, v. 254-255, pp. 586-588, Janeiro, 2003.
- [15] NAKAMURA, S., TANAKA, M., KATO, H., TOKURA, Y., "Mössbauer study on the ordered double perovskite A2FeReO6 (A = Ca, Sr)", Journal of Physical Society of Japan, v. 72, pp. 424, 2003
- [16] LABHSETWAR, N.K., WATANABE, A., MITSUHASHI, T., "New improved syntheses of LaRuO3 perovskites and their applications in environmental catalysis", Applied Catallysis B: Environmental, v. 40, pp. 21-30, January, 2003.
- [17] PEÑA, M.A., GOMEZ, J.P., FIERRO, J.L.G., "New catalytic routes for syngas and hydrogen production", Applied Catalysis A: General, v. 44, n. 1-2, pp. 7-57, September, 1996.
- [18] LAGO, R., BINI, G., PEÑA, M.A., FIERRO J.L.G., "Partial oxidation of methane to synthesis gas using LnCoO3 perovskites as catalyst precursors", Journal of Catalysis, v. 167, n. 1, pp. 198-209, April, 1997.
- [19] SANTOS, M.S., BERROCAL, G.J.P., FIERRO, J.L.G., RANGEL, M.C., "Effect of aluminum content on the properties of lanthana-supported nickel catalysts to WGSR", Studies in Surface Science and Catalysis, v. 167, pp. 493-498, 2007.
- [20] TASCON, J.M.D., MENDIOROZ, S., TEJUCA, L.G., "Kinetics and mechanism of CO oxidation on LaCoO3", Zeitschrift fur Physikalische Chemie Neue Folge, v. 124, pp. 249-257, 1981.
- [21] PONCE, S., PEÑA, M.A., FIERRO, J.L.G., "Surface properties and catalytic performance in methane combustion of Sr-substituted lanthanum manganites" Applied Catalisys B: Environmental, v. 24, n. 3-4, pp. 193-205, February, 2000.
- [22] CRUZ, R.M.G., FALCÓN, H., PEÑA, M.A., FIERRO, J.L.G., "Role of bulk and surface structures of La1-xSrxNiO3 perovskite-type oxides in methane combustion", Applied Catalysis. B: Environmental, v. 33, n. 1, pp. 45-55, September, 2001.
- [23] PATCAS, F., BUCIUMAN, F.C., ZSAKO, J., "Oxygen non-stoichiometry and reducibility of B-site substituted lanthanum manganites", Thermochimica Acta, v. 360, pp. 71-76, August, 2000.
- [24] ARAÚJO, G.C., RANGEL, M.C., "Influência da temperatura na atividade catalítica de óxidos de ferro dopados com cobre e alumínio", In: Anais do XVII Simpósio Ibero-americano de Catálise, Porto, Portugal, 2000.
- [25] TASCON, J.M.D., FIERRO, J.L.G., TEJUCA, L.G., Properties and applications of perovskite-type oxides, New York, Marcel Dekker, pp. 264, 1993.
- [26] IDAKIEV, V., MIHAJLOVA, D., KUNEV, B., ANDREEV, A., "Effect of copper oxide on the catalytic activity of iron-chromia catalyst for water gas shift reaction", Reaction Kinetics and Catalysis Letters, v. 33, n. 1, pp. 119-124, March, 1987.
- [27] TEJUCA, L.G, FIERRO, J.L.G., TASCON, J.M.D., "Structure and reactivity of perovskite-type oxides", Advances in Catalysis, v. 36, pp. 237-238, 1989.
- [28] PODOLSKI, W.F., KIM, Y.G., "Modeling the water-gas shift reaction", Industrial & Engineering Chemistry Process Desingn and Development, v. 13, n. 4, pp. 415-421, October, 1974.
Datas de Publicação
-
Publicação nesta coleção
21 Dez 2010 -
Data do Fascículo
2010
Histórico
-
Recebido
01 Abr 2009 -
Aceito
14 Abr 2010