Resumos
INTRODUÇÃO: Assim como em humanos, ratos diabéticos apresentam baixas quantidades de glicogênio. Entretanto, treinamento ou medicamentos podem causar diminuição da glicemia e melhorar o controle metabólico. Metformina aumenta o glicogênio enquanto diminui a glicemia em ratos normais estressados por exercício. OBJETIVO: Investigar se exercício regular e metformina melhoram o metabolismo de ratos diabéticos. MÉTODOS: Ratos Wistar diabéticos por aloxana tratados com metformina (DTM) ou não (DT) foram treinados. O treinamento consistiu de 20 sessões de 30 min de duração, cinco dias por semana. Ratos diabéticos sedentários foram usados como controle (SD e SDM). Metformina (5,6µg/ml) foi dada na água de beber. Após 48h de repouso, a glicose (mg/dl) e a insulina (ng/mL) foram medidas no plasma e o glicogênio (mg/100mg de tecido molhado) no fígado, sóleo e gastrocnêmio. RESULTADOS: A glicemia diminuiu de 435 ± 15 para 230 ± 20 no grupo DSM, para 143 ± 8,1 no grupo DT e para 138 ± 19mg/dl no grupo DTM. O grupo DSM teve proporcional aumento de glicogênio hepático de 1,69 ± 0.22 para 3,53 ± 0.24 e o treinamento aumentou para 3,36 ± 0,16mg/100mg. A metformina induziu aumento proporcional nos músculos sóleo de 0,21 ± 0,008 para 0,42 ± 0,03 e no gastrocnêmio, de 0,33 ± 0,02 para 0,46 ± 0,03, enquanto que o treinamento aumentou apenas no gastrocnêmio para 0,53 ± 0,03. Uma grande interação foi observada no fígado (o glicogênio aumentou para 6,48 ± 0,34). CONCLUSÃO: Pequenas doses orais de metformina e/ou treinamento restituíram parcialmente a glicemia e promoveram aumento de glicogênio em tecidos de ratos diabéticos. A associação com o programa de exercício foi benéfica, ajudando a diminuir a glicemia e a aumentar o armazenamento de glicogênio no fígado de ratos diabéticos.
metformina; treinamento; glicogênio
INTRODUCTION: Like in humans, lower amounts of glycogen are present in tissues of diabetic rats. However, training or drugs that lower glycemia can improve the metabolic control. Metformin increased glycogen while decreased glycemia in normal rats stressed by exercise. OBJECTIVE: In this work we investigated if regular exercise and metformin effects improve the metabolism of diabetic rats. METHODS: Alloxan diabetic Wistar rats treated with metformin (DTM) or not (DT) were trained. Training consisted of 20 sessions of 30 min, 5 days a week. Sedentary diabetic rats served as control (SD and SDM). Metformin (5.6 µg/g) was given in the drinking water. After 48 h resting, glucose (mg/dl) and insulin (ng/mL) was measured in plasma and glycogen (mg/100 mg of wet tissue) in liver, soleus and gastrocnemius. RESULTS: Glycemia decreased in DM group from 435±15 to 230±20, in DT group to 143±8.1 and in DTM group to 138±19 mg/dl. DM group had proportional increase in the hepatic glycogen from 1.69±0.22 to 3.53±0.24, and the training increased to 3.36 ± 0.16 mg/100 mg. Metformin induced the same proportional increase in the muscles (soleus from 0.21±0.008 to 0.42±0.03 and gastrocnemius from 0.33±0.02 to 0.46±0.03), while the training promoted increase on gastrocnemius to 0,53 ± 0,03, only. A high interaction was observed in liver (glycogen increased to 6.48±0.34). CONCLUSION: Very small oral doses of metformin and/or, partially restored glycemia in diabetic rats and decreased glycogen in tissues. Its association with an exercise program was beneficial, helping lower glycemia further and increase glycogen stores on liver of diabetic rats.
metformin; training; glycogen
ARTIGO ORIGINAL
Metformina interage com o treinamento físico diminuindo a glicemia e aumentando o armazenamento de glicogênio em ratos diabéticos
Metformin interacts with physical training decreasing glycemia and increasing glycogen supply in diabetic rats
Eunice da Silva-CostaI; Antonio Ari GonçalvesI; Isaura Jaqueline Lima BritoI; Carlos Alberto da SilvaII
IUniversidade Estadual de Campinas (SP), Instituto de Biologia, Laboratório de Metabolismo e Biofísica - 13083-970 - Campinas, SP - Brasil. Caixa Postal: 6109
IIUniversidade Metodista de Piracicaba, Faculdade de Ciências Matemáticas e da Natureza. Rodovia do Açucar, km 156 - Taquaral - 13400901 - Piracicaba, SP - Brasil - Caixa Postal: 68
Endereço para correspondência Endereço para correspondência: Eunice Cristina da Silva Costa Universidade Estadual de Campinas (SP), Instituto de Biologia Laboratório de Metabolismo e Biofísica Caixa Postal: 6109 13083-970 - Campinas, SP - Brasil Tel.: (55) 019 ??? - 3521-6196 Fax: (55) 019 ??? - 3521-6185 E-mail: nicrisilva@uol.com.br
RESUMO
INTRODUÇÃO: Assim como em humanos, ratos diabéticos apresentam baixas quantidades de glicogênio. Entretanto, treinamento ou medicamentos podem causar diminuição da glicemia e melhorar o controle metabólico. Metformina aumenta o glicogênio enquanto diminui a glicemia em ratos normais estressados por exercício.
OBJETIVO: Investigar se exercício regular e metformina melhoram o metabolismo de ratos diabéticos.
MÉTODOS: Ratos Wistar diabéticos por aloxana tratados com metformina (DTM) ou não (DT) foram treinados. O treinamento consistiu de 20 sessões de 30 min de duração, cinco dias por semana. Ratos diabéticos sedentários foram usados como controle (SD e SDM). Metformina (5,6µg/ml) foi dada na água de beber. Após 48h de repouso, a glicose (mg/dl) e a insulina (ng/mL) foram medidas no plasma e o glicogênio (mg/100mg de tecido molhado) no fígado, sóleo e gastrocnêmio.
RESULTADOS: A glicemia diminuiu de 435 ± 15 para 230 ± 20 no grupo DSM, para 143 ± 8,1 no grupo DT e para 138 ± 19mg/dl no grupo DTM. O grupo DSM teve proporcional aumento de glicogênio hepático de 1,69 ± 0.22 para 3,53 ± 0.24 e o treinamento aumentou para 3,36 ± 0,16mg/100mg. A metformina induziu aumento proporcional nos músculos sóleo de 0,21 ± 0,008 para 0,42 ± 0,03 e no gastrocnêmio, de 0,33 ± 0,02 para 0,46 ± 0,03, enquanto que o treinamento aumentou apenas no gastrocnêmio para 0,53 ± 0,03. Uma grande interação foi observada no fígado (o glicogênio aumentou para 6,48 ± 0,34).
CONCLUSÃO: Pequenas doses orais de metformina e/ou treinamento restituíram parcialmente a glicemia e promoveram aumento de glicogênio em tecidos de ratos diabéticos. A associação com o programa de exercício foi benéfica, ajudando a diminuir a glicemia e a aumentar o armazenamento de glicogênio no fígado de ratos diabéticos.
Palavras-chave: metformina, treinamento, glicogênio.
ABSTRACT
INTRODUCTION: Like in humans, lower amounts of glycogen are present in tissues of diabetic rats. However, training or drugs that lower glycemia can improve the metabolic control. Metformin increased glycogen while decreased glycemia in normal rats stressed by exercise.
OBJECTIVE: In this work we investigated if regular exercise and metformin effects improve the metabolism of diabetic rats.
METHODS: Alloxan diabetic Wistar rats treated with metformin (DTM) or not (DT) were trained. Training consisted of 20 sessions of 30 min, 5 days a week. Sedentary diabetic rats served as control (SD and SDM). Metformin (5.6 µg/g) was given in the drinking water. After 48 h resting, glucose (mg/dl) and insulin (ng/mL) was measured in plasma and glycogen (mg/100 mg of wet tissue) in liver, soleus and gastrocnemius.
RESULTS: Glycemia decreased in DM group from 435±15 to 230±20, in DT group to 143±8.1 and in DTM group to 138±19 mg/dl. DM group had proportional increase in the hepatic glycogen from 1.69±0.22 to 3.53±0.24, and the training increased to 3.36 ± 0.16 mg/100 mg. Metformin induced the same proportional increase in the muscles (soleus from 0.21±0.008 to 0.42±0.03 and gastrocnemius from 0.33±0.02 to 0.46±0.03), while the training promoted increase on gastrocnemius to 0,53 ± 0,03, only. A high interaction was observed in liver (glycogen increased to 6.48±0.34).
CONCLUSION: Very small oral doses of metformin and/or, partially restored glycemia in diabetic rats and decreased glycogen in tissues. Its association with an exercise program was beneficial, helping lower glycemia further and increase glycogen stores on liver of diabetic rats.
Keywords: metformin, training, glycogen.
INTRODUÇÃO
O diabetes mellitus é caracterizado pela ausência ou secreção deficiente de insulina ou pela resistência periférica ao hormônio, afetando o metabolismo de carboidratos, de lipídeos e de proteínas, resultando em hiperglicemia e glicosúria. O prejuízo na síntese de glicogênio nos músculos esqueléticos é o sinal mais precoce da patogênese do diabetes do tipo 2 ou diabetes mellitus não dependente de insulina (NIDDM)(1). A biossíntese de glicogênio no fígado e músculos tem sido associada ao estado nutricional do organismo, à atividade física e às concentrações de hormônios, como insulina, glucagon, catecolaminas e glicocorticóides(2), e ainda pode ser estimulada por algumas drogas(3-5).
A biguanida metformina, utilizada no tratamento do NIDDM, tem como função aumentar a captação de glicose pelos tecidos periféricos, sem modificar a secreção de insulina ou induzir hipoglicemia(6). Metformina protege as células β, prevenindo a desensibilização das ilhotas pancreáticas isoladas de humanos na presença de glicose. Isso é compatível com a habilidade da metformina em aumentar o conteúdo de glicogênio em ilhotas de ratos(7). Observamos, também, um efeito protetor da metformina em ratos diabéticos por aloxana, diminuindo a glicemia e aumentando o armazenamento de glicogênio nos músculos esqueléticos e no fígado, durante um curto período de tratamento(4-5,8).
Por outro lado, exercícios regulares induzem mudanças estruturais e funcionais que também modificam o perfil metabólico(2) com a finalidade de aumentar a disponibilidade de energia. O aumento do metabolismo durante o exercício promove utilização de várias fontes de energia, incluindo o glicogênio dos músculos e fígado e os triglicerídeos armazenados no tecido adiposo. O glicogênio é a principal fonte de energia utilizada durante os primeiros 20 ou 30 minutos de um exercício de intensidade moderada. Após esse período, a oxidação de lipídeos torna-se predominante. O treinamento induz adaptações metabólicas e, dentre elas, aumento do armazenamento de glicogênio em condições basais e aumento do número de mitocôndrias, melhorando, assim, a atividade oxidativa(2,9). Essas mudanças são resultantes de adaptações hormonais associadas ao exercício(10).
Exercícios de intensidade moderada são recomendados para melhorar o controle metabólico de diabéticos, particularmente daqueles resistentes à insulina, a menos que existam contra-indicações(11). Por si só, o treinamento melhora a captação de glicose pelas células e aumenta a glicogênese e, ao mesmo tempo, promove adaptações no músculo esquelético que estimulam o aumento da utilização de lipídeos(2).
Considerando os benefícios do exercício e da metformina isoladamente, é possível que a associação de ambos possa contribuir, aumentando as reservas de glicogênio em músculos e no fígado, bem como diminuindo a glicemia em ratos diabéticos por aloxana.
MÉTODOS
ANIMAIS
O Comitê de Ética em Experimentação Animal institucional aprovou o protocolo experimental sob o nº 261-1.
Foram utilizados ratos machos, albinos, Wistar (fornecidos pelo Centro de Bioterismo da Unicamp) com idade de oito semanas. Os ratos foram mantidos em ciclo fotoperiódico de 12h claro/12h escuro, a 23 ± 2ºC, no Biotério do Departamento de Fisiologia e Biofísica, sendo alimentados com ração (Purina para roedores) e água ad libitum. Os ratos foram distribuídos aleatoriamente em cinco grupos: Controle Sedentário (S) (n = 6), Sedentário Diabético (SD) (n = 6), Sedentário Diabético Metformina (SDM) (n = 8), Treinado Diabético (TD) (n = 6), Treinado Diabético Metformina (TDM) (n = 6).
O diabetes foi induzido em ratos sob anestesia (Pentobarbital, 40mg/kg de peso corporal) através de uma única injeção de aloxana (i.v., 40mg/kg de peso corporal, pH 7,4).
Os ratos tratados receberam metformina (5,6×g/ml) na água de beber durante o período de treinamento ou período proporcional em ratos sedentários.
EXERCÍCIO FÍSICO E ESQUEMA DE TREINAMENTO:
Ratos constituem um bom modelo para a observação da maioria dos efeitos metabólicos produzidos pelo treinamento(12). Para melhorar o condicionamento aeróbio é necessário que ocorra o aumento da freqüência, duração ou intensidade da atividade física, sem sobrepor duas variáveis ao mesmo tempo. Normas do American College of Sports Medicine(13) estabelecem que o exercício aeróbio deve durar de 20 a 60 minutos, em três a cinco sessões por semana. Neste trabalho, utilizamos a variável intensidade, isto é, aumento progressivo de carga para aumentar o condicionamento aeróbio. Para isso, adicionamos um peso ao rato, que foi aumentado semanalmente, correspondendo ao máximo de 3% do peso corporal.
Antes da indução do diabetes, os ratos dos grupos Treinado Diabético e Treinado Diabético Metformina foram adaptados à natação para redução do estresse associado. Este período iniciou-se com uma sessão de cinco minutos, aumentando progressivamente 5 min em cada sessão até completar 30 min, cinco vezes por semana.
Após a indução do diabetes, os ratos dos grupos treinados iniciaram o período de treinamento nadando em um tanque (95 x 50 x 50cm), contendo água a 30º ± 2ºC. Após privação de alimento por 1h, nadaram sem adição de peso, por 30 minutos durante a primeira semana. Da 6ª até a 10ª sessão de treinamento, cada rato nadou com um peso equivalente a 1% do peso corporal; da 11ª até a 15ª sessão o peso correspondeu a 2% do peso corporal e da 16ª até o final, com 3% do peso corporal, totalizando 20 sessões.
AMOSTRAS E MEDIDA DE PARÂMETROS METABÓLICOS
Após a última sessão de exercício, os ratos foram mantidos em repouso por 48 horas. Amostras de sangue e tecidos foram retiradas sob anestesia com Pentobarbital sódico (40mg/kg de peso corporal, i.p.). A glicose (mg/dL) foi medida no plasma e o glicogênio (mg/100mg de tecido molhado), em amostras do lobo superior do fígado e dos músculos sóleo e gastrocnêmio.
Amostras de tecido foram digeridas em KOH a 30% a quente e precipitado em duas etapas com etanol. O glicogênio foi obtido através da hidrólise ácida na presença de fenol. O conteúdo de glicogênio foi expresso como unidades de glicose (mg/100mg de tecido molhado) e lido em espectrofotômetro com absorbância de 490nm(14).
A glicose sangüínea foi determinada pelo método da glicose oxidase(15) através do uso de kit comercial (Laborlab, São Paulo).
A insulina foi determinada em alíquotas de plasma por radioimunoensaio(16).
ESTATÍSTICA
Os resultados foram relatados como média ± EPM. A significância dos dados foi determinada através da análise de variância para dois fatores, seguida, quando necessário, por pós-teste de Tukey com nível de significância de p < 0,05.
RESULTADOS
INSULINEMIA E GLICEMIA
Na figura 1 observamos os efeitos do treinamento e do tratamento com metformina sobre a concentração plasmática de insulina. A concentração de insulina plasmática foi significativamente menor no grupo Diabetes Sedentário (SD) em relação ao grupo Controle Sedentário (S) (de 2,18 ± 0,16ng/mL para 1,28 ± 0,16ng/mL; p < 0,003). Porém, o tratamento com metformina, bem como o treinamento físico, não promoveu alterações nas concentrações plasmáticas de insulina.
A figura 2 demonstra os resultados obtidos para as concentrações plasmáticas de glicose. A glicemia foi significativamente maior (p < 0,01) no grupo Diabetes Sedentário (SD) (435 ± 15mg/dL) quando comparado com o grupo Controle Sedentário (C) (129 ± 7mg/dL). A figura 2 também mostra que o treinamento físico diminuiu significativamente a glicemia no grupo Diabetes Treinado (TD) em 68,8%. Similarmente, o tratamento com metformina diminuiu significativamente a concentração plasmática de glicose no grupo Diabetes Sedentário Metformina (SDM) em 61%. A associação do tratamento e do treinamento promoveu diminuição da glicemia a valores semelhantes ao apresentado pelo grupo Diabetes Treinado (TD). Entretanto, o tratamento e/ou o treinamento físico não foram eficientes em restituir a glicemia a valores apresentados pelo grupo controle (118,8 ± 6,2mg/dl).
GLICOGÊNIO
No fígado encontramos significativo aumento de glicogênio no grupo Diabetes Sedentário Metformina (SDM) (3,53 ± 0,24mg/100mg), assim como no grupo Diabetes Treinado (TD) (3,36 ± 0,16mg/100mg), restabelecendo a níveis equivalentes ao apresentado pelo grupo Controle Sedentário (S) (3,16 ± 0,18mg/100mg). Quando o tratamento e o treinamento foram aplicados ao mesmo tempo, houve grande interação, promovendo aumento do glicogênio hepático em 412% (6,48 ± 0,34mg/100mg), tal como pode ser observado na figura 3.
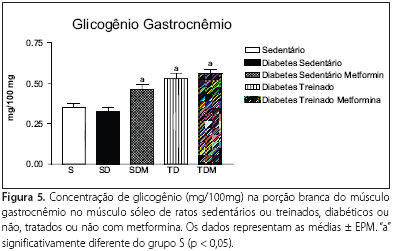
Além disso, o tratamento com metformina promoveu aumento (p < 0,01) do armazenamento de glicogênio nos músculos sóleo (0,42 ± 0,03mg/100mg; fig 4) e gastrocnêmio (0,46 ± 0,03mg/100mg; figura 5) em ratos diabéticos sedentários (SDM) quando comparados com o grupo sem tratamento (SD) (0,21 ± 0,008mg/100mg e 0,33 ± 0,02mg/100mg, respectivamente). Por outro lado, o treinamento (TD) apenas foi eficiente em aumentar o glicogênio no gastrocnêmio (0,53 ± 0,03mg/100mg).
Entretanto, apesar dos efeitos benéficos apresentados isoladamente pelo tratamento ou treinamento, as figuras 4 e 5 mostram que não houve interação entre ambos, quando associados, nos músculos sóleo e gastrocnêmio, tal como foi demonstrado no fígado (figura 3).
DISCUSSÃO
A literatura tem demonstrado uma renovação de interesses pelo papel desempenhado pela síntese e degradação de glicogênio no controle do metabolismo de glicose e as conseqüências de defeitos nesta via. O fígado, os músculos esqueléticos e o tecido adiposo desempenham função central no controle do armazenamento e conversão de energia. O metabolismo desses tecidos pode ser afetado pela baixa secreção ou pela resistência à insulina. A conseqüência final para essas células é aumentar a produção hepática de glicose, causada pelo aumento da gliconeogênese e da glicogenólise, e diminuir a captação periférica de glicose, principalmente nos tecidos muscular e adiposo, resultando em aumento da glicemia e diminuição do armazenamento de glicogênio. Além disso, com a necessidade de buscar fontes alternativas de energia, haverá aumento da lipólise no fígado e nos adipócitos, resultando em aumento de glicerol e ácidos graxos livres no plasma, e aumento da degradação protéica(1,17-18). Esse quadro de deficiência metabólica apresentado pelos diabéticos pode ser corrigido ou minorado através do uso de medicamentos ou de um programa de exercícios físicos(2-5).
Neste estudo, avaliamos os efeitos de ambas as formas de tratamento, ou seja, verificamos os efeitos do anti-hiperglicemiante metformina associado ao exercício físico sobre a glicemia e o glicogênio armazenado nos tecidos de ratos diabéticos.
O exercício físico é benéfico aos diabéticos se moderado e ajustado para sua condição física(1) e nossos resultados confirmam os benefícios do exercício regular em ratos diabéticos. Como esperado, a concentração de insulina e a de glicose plasmática diminuíram (figuras 1 e 2) em ratos diabéticos treinados. Provavelmente, essa redução da glicemia é resultante do aumento da ação da insulina e da diminuição da liberação de glicose pelo fígado, além do aumento da captação de glicose, principalmente pelos músculos esqueléticos(18). O aumento da captação de glicose resultou em aumento do armazenamento de glicogênio no fígado (figura 3) e em músculos (figuras 4 e 5). Similarmente à insulina, o exercício aumenta a síntese de GLUT4, assim como, sua translocação para a membrana, aumentando o armazenamento de glicogênio em condições basais(18-19).
Entretanto, a resposta dos ratos diabéticos ao treinamento diferiu consideravelmente entre os músculos gastrocnêmio e sóleo. Em ambos, o treinamento aumentou o conteúdo de glicogênio em relação aos diabéticos sedentários, porém, em proporções diferentes, sendo maior no gastrocnêmio do que no sóleo. Essa diferença pode ser decorrente da predominância de fibras de contração lenta no músculo sóleo, as quais são mais sensíveis à insulina do que o gastrocnêmio(18,20).
Outra forma de diminuir os efeitos deletérios do diabetes é a utilização de medicamentos que estimulem, direta ou indiretamente, o transporte, o metabolismo e a incorporação de glicose aos estoques de glicogênio(3). A metformina é uma biguanida anti-hiperglicemiante que não induz hipoglicemia e não aumenta a secreção de insulina(3,6). O modelo que utilizamos no estudo não é de diabetes tipo 2. Entretanto, ratos diabéticos por aloxana ainda tem um pouco de insulina no plasma, como pode ser observado na figura 1 e comprovado por outros autores(21), sendo então favorável para o efeito da metformina em diminuir a glicemia (figura 2). A literatura aponta que a principal causa da diminuição dos níveis de glicose durante o tratamento com metformina parece ser o aumento da ação da insulina sobre os tecidos periféricos e fígado. Além disso, é responsável pela diminuição da liberação de ácidos graxos livres do tecido adiposo(3,6,22). Esses efeitos resultam em diminuição da liberação de glicose pelo fígado, devido à inibição da gliconeogênese, ao aumento da sensibilidade dos hepatócitos à insulina, além do estimulo à captação de glicose por tecidos sensíveis ou não à insulina. Isso poderia estimular a enzima glicogênio sintetase e aumentar a quantidade de glicogênio em músculos e hepatócitos(3,6,22). E nossos dados sugerem que houve aumento do transporte de glicose em músculos esqueléticos e hepático, com conseqüente ativação da síntese de glicogênio (figuras 3, 4 e 5), estando de acordo com outro estudo da área(6).
Um último comentário deve ser feito sobre a interação entre os efeitos da metformina e do exercício. Considerando que não estudamos os efeitos da sua associação em outros tecidos, não houve danos ao animal ou ao seu desempenho durante o exercício nos tecidos estudados. No grupo diabético que recebeu ambos os tratamentos simultaneamente, houve interação dos efeitos apenas no tecido hepático, aumentando os benefícios demonstrados por cada um isoladamente. Nesse tecido, o tratamento com metformina ou o programa de treinamento promoveram aumento proporcional de um pouco mais que 150%. Ambos juntos aumentaram em 412% esse armazenamento em comparação com os ratos diabéticos usados como controle. Entretanto, a glicemia diminuiu, mas continuou ainda superior aos valores apresentados pelos ratos sedentários não diabéticos.
Os presentes dados sugerem que houve associação entre os tratamentos, ajudando a diminuir a glicemia e a aumentar os estoques de glicogênio em hepatócitos.
Agradecimentos: Agradecemos à agência de fomento Fundação de Amparo à Pesquisa do Estado de São Paulo - Fapesp.
Submetido em 18/08/2007
Versão final recebida em 07/10/2008
Aceito em 26/01/2008
Todos os autores declararam não haver qualquer potencial conflito de interesses referente a este artigo.
- 1. Petersen KF, Shulman GI. Pathogenesis of skeletal muscle insulin resistance in type 2 diabetes mellitus. Am J Cardiol 2002;90:11G-8G.
- 2. Corigliano G, Lazzeta N, Corigliano M, Strollo F. Blood glucose changes in diabetic children and adolescents engaged in most common sports activities. Acta Biomed 2006;77:S26-33.
- 3. Levetan C. Oral antidiabetic agents in type 2 diabetes. Curr Med Res Opin 2007;23:945-52.
- 4. Da Silva CA, Gonçalves AA. Metformin restores the hepatic stores in aloxan diabetic rats. In Tematic Module: Liver Metabolism, IX Ann Meet of Brazilian Federation of Experimental Biology Soc. August 1994, Caxambú, MG, Brazil, p. XCIII.
- 5. Da Silva CA, Gonçalves AA. Partial recovery of erythrocyte glycogen in diabetic rats treated with phenobarbital. Braz J Med Biol Res 1997;30:657-61.
- 6. Krentz AJ, Bailey CJ. Oral antidiabetic agents: current role in type 2 diabetes mellitus. Drugs 2005;65:385-411.
- 7. Marchetti P, Del Guerra S, Marselli L, Lupi R, Masini M, Pollera M, et al. Pancreatic islets from type 2 diabetic patients have functional defects and increased apoptosis that are ameliorated by metformin. J Clin Endocrinol Metab 2004;89:5535-41.
- 8. Giannarelli R, Aragona M, Coppelli A, Del Parato S. Reducing insulin resistance with metformin: the evidence today. Diabetes Metab 2003;29:6S28-35.
- 9. Arkinstall MJ, Bruce CR, Clark SA, Rickards CA, Burke LM, Hawley JA. Regulation of fuel metabolism by preexercise muscle glycogen content and exercise intensity. J Appl Physiol 2004;97:2275-83.
- 10. Koyama Y, Coker RH, Denny JC, Lacy DP, Jabbour K, Williams PE, et al. Role of carotid bodies in control of the neuroendocrine response to exercise. Am J Physiol Endocrinol Metab 2001;281:E742-8.
- 11. Ostergard T, Jessen N, Schmitz O, Mandarino LJ. The effect of exercise, training, and inactivity on insulin sensitivity in diabetics and their relatives: what is new? Appl Physiol Nutr Metab 2007;32:541-8.
- 12. Ostman-Smith I. Adaptative changes in the simpathetic nervous system an some effector organs of the rat following long term exercise or cold acclimation and the role of cardiac simpathetic nerves in the genesis of compensatory cardiac hypertrophy. Acta Physiol Scand 1979;47:S1-40.
- 13. Lippincott WW. American College of Sports Medicine. ACSM's Guidelines for Exercise Testing and Prescription. 6th ed. 2000. Baltimore, MD.
- 14. Lo Siu JCR, Russeau JC, Taylor AW. Determination of glycogen in small tissue samples. J Appl Physiol 1970;28:234-46.
- 15. Trinder R. Determination of glucose in blood using glucose oxidase with alternative oxygen acceptor. Ann Clin Biochem 1969;6:24.
- 16. Herbert V, Lau KS, Gottlieb CW, Bleicher SJ. Coated charcoal immunoassay of insulin. J Clin Endocrinol Metab 1965;25:1375-84.
- 17. Carvalheira JBC, Zecchin HG, Saad MJA. Vias de sinalização da insulina. Arq Bras Endocrinol Metab 2002;46:419-25.
- 18. Sigal RJ, Kenny GP, Wasserman DH, Castaneda-Sceppa C. Physical activity/exercise and type 2 diabetes. Diabetes Care 2004;27:2518-39.
- 19. McGee SL, Hargreaves M. Exercise and skeletal muscle glucose transporter 4 expression: molecular mechanisms. Clin Exp. Pharmacol Physiol 2006;33:395-9.
- 20. Song XM, Kawano Y, Krook A, Ryder JW, Efendic S, Roth RA, et al. Muscle fiber type-specific defects in insulin signal transduction to glucose transport in diabetic GK rats. Diabetes 1999;48:664-70.
- 21. Luciano E. Atividade física e metabolismo lipídico em ratos diabéticos experimentais. Revista Brasileira de Atividade Física e Saúde 1996;1:19-26.
- 22. Karlsson HK, Hällsten K, Björnholm M, Tsuchida H, Chibalin AV, Virtanen KA, et al Effects of metformin and rosiglitazone treatment on insulin signaling and glucose uptake in patients with newly diagnosed type 2 diabetes: a randomized controlled study. Diabetes 2005;54:1459-67.
Datas de Publicação
-
Publicação nesta coleção
22 Set 2008 -
Data do Fascículo
Ago 2008
Histórico
-
Revisado
07 Out 2008 -
Recebido
18 Ago 2007 -
Aceito
26 Jan 2008