Resumos
INTRODUÇÃO: Durante o último século, o homem tornou-se menos ativo fisicamente, adotando hábitos cada vez mais sedentários. Isto promoveu aumento na incidência de doenças crônicas tais como doenças cardiovasculares, diabetes do tipo 2 e síndrome metabólica. A prática de atividade física pode influenciar o estado de higidez alterando estados metabólicos e também o sistema imunológico. OBJETIVO: Revisar na literatura estudos que abordem os efeitos promovidos pelo exercício físico no desenvolvimento da resposta imunológica e suas possíveis vias de transdução de sinais. MÉTODOS: Foram consultadas as bases de dados SciELO e PubMed. RESULTADOS: A literatura disponível mostra que durante a prática de exercício, várias subpopulações de leucócitos são alteradas de acordo com a intensidade e duração da atividade desempenhada. Exercícios de intensidade moderada estimulam uma resposta pró-inflamatória, enquanto aqueles de alta intensidade tendem a promover respostas anti-inflamatórias visando diminuir os danos na musculatura esquelética. Tais alterações são vistas em células apresentadoras de antígeno (como macrófagos e células dendríticas), neutrófilos, células natural killers (NK) e em moléculas de superfície como os receptores do tipo Toll (TLR) e do complexo principal de histocompatibilidade de classe II (MHC II), além das modificações promovidas em todo o repertório de citocinas. CONCLUSÃO: O estado atual do conhecimento permite considerar que as alterações no sistema imune são dependentes dos parâmetros inerentes ao exercício e que para que todas estas alterações ocorram, algumas cascatas de sinalização celular são acionadas, dando origem a um complexo processo de fosforilação/desfosforilação que culmina em ativação de fatores de transcrição, tradução de RNAm, síntese proteica e proliferação celular.
atividade física; citocinas; células efetoras; sinalização celular
INTRODUCTION: Over the last century, people have become less active, adopting more sedentary habits. This scenario has increased the incidence of chronic diseases such as cardiovascular diseases, type 2 diabetes and metabolic syndrome. The practice of physical activities can influence healthiness by altering the metabolic state and also the immune system. OBJECTIVE: To review the literature for studies that address the effects promoted by physical exercise on the development of immune responses and the possible signal transduction pathways. METHODS: The SciELO and PubMed data bases were consulted. RESULTS: The available literature shows that during the practice of exercise, various subpopulations of leukocytes are altered in accordance with the intensity and duration of the activity performed. Exercise of moderate intensity stimulates a pro-inflammatory response, while those of high intensity tend to promote anti-inflammatory responses with the purpose to decrease damage to skeletal muscle. Such alterations are observed in cells that present antigens (such as macrophages and dendritic cells), neutrophils, natural killer cells (NK) and in surface molecules like Toll-like receptors (TLR) and major histocompatibility complex class II, as well as the entire repertoire of cytokines. CONCLUSION: The current state of knowledge suggests that the alterations in the immune system are dependent on parameters inherent to exercise and that in order to have all these alterations occurring, some cell signaling cascades are activated, giving rise to a complex process of phosphorylation/dephosphorylation that culminates in the activation of transcription factors, translation of mRNA's, protein synthesis and cell proliferation.
physical activity; cytokines; effector cells; cell signaling
ARTIGO ORIGINAL
CIÊNCIAS DO EXERCÍCIO E DO ESPORTE
Efeito do exercício no sistema imune: resposta, adaptação e sinalização celular
Rodrigo TerraI,IV; Sílvia Amaral Gonçalves da SilvaII; Verônica Salerno PintoIII; Patrícia Maria Lourenço DutraI
ILaboratório de Imunofisiologia do Exercício, Departamento de Microbiologia, Imunologia e Parasitologia, Faculdade de Ciências Médicas, UERJ Rio de Janeiro, RJ
IILaboratório de Imunofarmacologia Parasitária, Departamento de Microbiologia, Imunologia e Parasitologia, Faculdade de Ciências Médicas, UERJ Rio de Janeiro, RJ
IIILaboratório de Bioquímica do Exercício e Motores Moleculares, Departamento de Biociências da Atividade Física, Escola de Educação Física e Desporto, UFRJ Rio de Janeiro, RJ
IVAluno do Programa de Pós-Graduação em Biodinâmica do Movimento, EEFD, UFRJ
Correspondência Correspondência: Verônica Salerno Pinto Universidade Federal do Rio de Janeiro - Escola de Educação Física e Desportos. Av. Carlos Chagas Filho, 540 21941-599 Cidade Universitária Rio de Janeiro, RJ. E-mail: vpsalerno@yahoo.com.br
RESUMO
INTRODUÇÃO: Durante o último século, o homem tornou-se menos ativo fisicamente, adotando hábitos cada vez mais sedentários. Isto promoveu aumento na incidência de doenças crônicas tais como doenças cardiovasculares, diabetes do tipo 2 e síndrome metabólica. A prática de atividade física pode influenciar o estado de higidez alterando estados metabólicos e também o sistema imunológico.
OBJETIVO: Revisar na literatura estudos que abordem os efeitos promovidos pelo exercício físico no desenvolvimento da resposta imunológica e suas possíveis vias de transdução de sinais.
MÉTODOS: Foram consultadas as bases de dados SciELO e PubMed.
RESULTADOS: A literatura disponível mostra que durante a prática de exercício, várias subpopulações de leucócitos são alteradas de acordo com a intensidade e duração da atividade desempenhada. Exercícios de intensidade moderada estimulam uma resposta pró-inflamatória, enquanto aqueles de alta intensidade tendem a promover respostas anti-inflamatórias visando diminuir os danos na musculatura esquelética. Tais alterações são vistas em células apresentadoras de antígeno (como macrófagos e células dendríticas), neutrófilos, células natural killers (NK) e em moléculas de superfície como os receptores do tipo Toll (TLR) e do complexo principal de histocompatibilidade de classe II (MHC II), além das modificações promovidas em todo o repertório de citocinas.
CONCLUSÃO: O estado atual do conhecimento permite considerar que as alterações no sistema imune são dependentes dos parâmetros inerentes ao exercício e que para que todas estas alterações ocorram, algumas cascatas de sinalização celular são acionadas, dando origem a um complexo processo de fosforilação/desfosforilação que culmina em ativação de fatores de transcrição, tradução de RNAm, síntese proteica e proliferação celular.
Palavras-chave: atividade física, citocinas, células efetoras, sinalização celular.
INTRODUÇÃO
Durante o último século, a população dos países desenvolvidos e em desenvolvimento tornou-se menos ativa fisicamente, seja pela mudança no tipo de trabalho, seja por adoção de novos hábitos cada vez mais sedentários. Esta mudança tem levado a um pronunciado aumento na incidência de doenças crônicas, tais como doenças cardiovasculares e diabetes do tipo 2, assim como tem promovido um aumento na obesidade, em desordens musculoesqueléticas, em doenças pulmonares, em certos tipos de câncer e em desordens neurológicas. Independente do estado de higidez, o sedentarismo também vem afetando a qualidade e a expectativa de vida dessas populações1.
As respostas promovidas pelo exercício, tanto agudamente quanto em sua cronicidade, afetam diversos componentes do sistema imune. O exercício de intensidade moderada pode estimular parâmetros relacionados à imunidade celular e assim diminuir o risco de infecção, enquanto o exercício de alta intensidade pode promover um decréscimo destes mesmos parâmetros, aumentando assim o risco de doenças infecciosas2-4.
Segundo o Colégio Americano de Medicina Esportiva (ACSM) atividades aeróbias variando entre 40 e 59% do  O2máx, 55 e 69% da frequência cardíaca máxima e 12-13 na escala de percepção subjetiva de esforço de Borg são consideradas de intensidade moderada, enquanto que atividades aeróbias variando entre 60 e 84% do
O2máx, 55 e 69% da frequência cardíaca máxima e 12-13 na escala de percepção subjetiva de esforço de Borg são consideradas de intensidade moderada, enquanto que atividades aeróbias variando entre 60 e 84% do  O2máx, 70 e 89% da frequência cardíaca máxima e 14-16 na escala de percepção subjetiva de esforço de Borg são consideradas de alta intensidade5,6. A Sociedade Internacional de Exercício e Imunologia (ISEI), em seu posicionamento oficial, preconiza que a disfunção imune observada após o exercício é mais pronunciada quando o exercício é contínuo, prolongado (> 1,5h) e realizado em intensidade variando de moderada a alta (55 e 75% do
O2máx, 70 e 89% da frequência cardíaca máxima e 14-16 na escala de percepção subjetiva de esforço de Borg são consideradas de alta intensidade5,6. A Sociedade Internacional de Exercício e Imunologia (ISEI), em seu posicionamento oficial, preconiza que a disfunção imune observada após o exercício é mais pronunciada quando o exercício é contínuo, prolongado (> 1,5h) e realizado em intensidade variando de moderada a alta (55 e 75% do O2máx)7. Apesar dessas recomendações, nem todos os artigos utilizados nesta revisão utilizam estes parâmetros para o controle do exercício (
O2máx)7. Apesar dessas recomendações, nem todos os artigos utilizados nesta revisão utilizam estes parâmetros para o controle do exercício ( O2, FC, percepção subjetiva de esforço) e os indivíduos avaliados apresentam uma grande diversidade (atletas, não atletas), além de muitos estudos serem realizados com animais experimentais. Esses estudos foram classificados em relação à intensidade do exercício (moderado e intenso) segundo sua descrição no artigo original.
O2, FC, percepção subjetiva de esforço) e os indivíduos avaliados apresentam uma grande diversidade (atletas, não atletas), além de muitos estudos serem realizados com animais experimentais. Esses estudos foram classificados em relação à intensidade do exercício (moderado e intenso) segundo sua descrição no artigo original.
O presente estudo tem como objetivo revisar de forma sistemática os efeitos do exercício em células do sistema imunológico, bem como nas possíveis vias de transdução de sinais que direcionam a resposta imune.
Considerações básicas na resposta imune
A resposta imunológica pode ser compreendida em duas etapas: resposta inata e resposta adaptativa. A resposta inata inclui barreiras físicas (ex.: pele), químicas (ex.: lágrima, sistema complemento) e a participação de células como macrófagos, neutrófilos, células dendríticas, células natural killers (NK) e moléculas microbicidas como o óxido nítrico (NO) e ânion superóxido (O2-). A resposta imune adaptativa envolve principalmente linfócitos T (TCD4+ e TCD8+) e B e seus produtos, citocinas e anticorpos, respectivamente. Pode ser dividida em resposta imune humoral (mediada por anticorpos) e resposta imune celular (mediada por células, tais como linfócitos T e macrófagos). Os linfócitos TCD4+ (auxiliares/helper-Th0) podem se diferenciar em diversas subpopulações dentre as quais destacam-se as células Th1 (T helper tipo 1) e as células Th2 (T helper tipo 2), que produzem padrões diferentes de citocinas8,9. A diferenciação de linfócitos TCD4+ em Th1 pode ser estimulada pela interleucina 12 (IL-12), produzida por células apresentadoras de antígenos (macrófagos e células dendríticas), enquanto que a diferenciação em Th2 é induzida por ação autócrina da IL-4, produzida por TCD4+. As células Th1 produzem predominantemente interferon-gama (IFN-γ) e estão relacionadas à resposta imune celular e ao controle de infecções causadas por microrganismos intracelulares. As células Th2 produzem principalmente IL-4 e são correlacionadas com a resposta imune humoral e controle das infecções extracelulares. Vários fatores, tais como citocinas predominantes no microambiente de ativação, moléculas co-estimulatórias, o tipo de antígeno e eventos precoces que ocorrem durante a resposta imune inata envolvendo as células dendríticas e as células NK podem direcionar o tipo de resposta predominante, determinando assim o controle ou não de uma infecção9,10.
Citocinas
As citocinas são glicoproteínas, que, em geral, apresentam baixo peso molecular (entre 5.000 e 30.000)11 e desempenham um papel central na mediação e regulação das respostas imunológicas12. Elas atuam como mensageiras entre as células do sistema imune, hematopoiético e neuroendócrino13.
As citocinas têm sido classificadas como pró ou anti-inflamatórias, de acordo com as funções desempenhadas. As principais citocinas anti-inflamatórias são IL-10 e TGF-beta (fator de transformação de crescimento β) as quais podem, entre outras funções, inibir a produção de citocinas pró-inflamatórias14. Dentre as citocinas pró-inflamatórias podemos citar IL-1, IL-2, IL-12, IL-18, IFN-γ e TNF-α. Alguns antagonistas competitivos são ditos anti-inflamatórios, tais como o antagonista do receptor de IL-1 (IL-1ra) que impede a ligação de IL-1 ao seu receptor15. Já a IL-12, que é reconhecidamente uma citocina pró-inflamatória14, apresenta uma subunidade chamada p40, que, quando livre, pode inibir a ação da IL-12, apresentando indiretamente uma propriedade anti-inflamatória16. A quimiocina, proteína quimiotática de monócitos (MCP-1), também pode agir indiretamente como anti-inflamatória por inibir a produção de IL-1217.
A produção de citocinas anti-inflamatórias é regulada por uma variedade de fatores14. Catecolaminas e glicocorticoides estimulam a produção de IL-4, IL-10 e IL-13 in vitro18-21, assim como prostaglandina E2 (PGE2) também aumenta a produção de IL-10, IL-12p40 e IL-1322,23. Já in vivo, catecolaminas promovem um aumento da síntese de IL-10 e IL-1ra24,25.
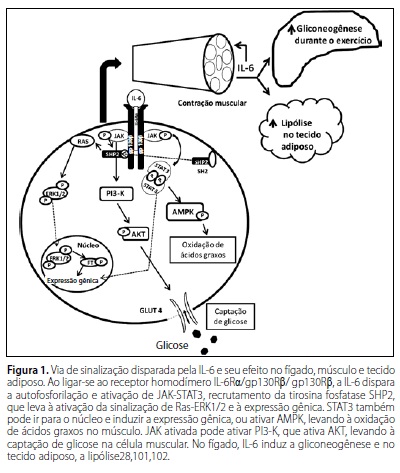
A IL-6, também conhecida como "citocina gp130", é uma citocina que participa do processo inflamatório, sendo considerada uma interleucina responsiva à inflamação26. Entretanto, apresenta ação anti-inflamatória indireta por estimular a síntese de IL-1ra e de IL-1027,28. Esta citocina tem sido denominada miocina, visto que a contração de músculos esqueléticos durante exercícios prolongados libera grandes concentrações desta na circulação28-35. A IL-8 e IL-15 também foram descritas por alguns estudos como miocinas28,32,36,37 (tabela 1).
Efeito do exercício físico em células do sistema imune
Neutrófilos
Neutrófilos são fagócitos que desempenham um importante papel na resposta imune inata, sendo geralmente a primeira célula recrutada para o sítio da infecção. Portanto, estão envolvidos em diversos processos inflamatórios, inclusive o do tecido muscular promovido pelo exercício. A sequência de eventos que ocorre na resposta neutrofílica inclui aderência, quimiotaxia, fagocitose, burst oxidativo, desgranulação e eliminação do microrganismo38.
Diversos elementos estão envolvidos no comportamento dos neutrófilos e na resposta imune ao exercício, influenciando mediadores neuroendócrinos, liberação de esteroides, produção de citocinas e processos de oxirredução associados com a produção de radicais livres39. A ativação da fibra muscular aumenta a liberação de cálcio (Ca2+), levando à síntese de citocinas pró-inflamatórias, como o fator de necrose tumoral alfa (TNF-α) e IL-1β, que regulam a expressão de selectinas pelas células endoteliais, atraindo neutrófilos para a região. As citocinas IL-6 e IL-8, secretadas após o dano tecidual, estimulam a via de sinalização que ativa a NADPH-oxidase culminando com a liberação de espécies reativas de oxigênio40.
Wolach et al.41 examinaram o efeito do exercício anaeróbio (teste de Wingate) e aeróbio, realizado a 70-80% do FCmáx, na função neutrofílica em mulheres judocas e sedentárias. Houve um decréscimo significativo na quimiotaxia de neutrófilos 24h após exercício aeróbio, em ambos os grupos, mas não houve diferença na atividade bactericida ou na liberação de superóxido. Os autores também não observaram mudanças significativas na função neutrofílica após exercício anaeróbio, em ambos os grupos. O decréscimo na rede quimiotática, somente em exercício aeróbio, sugeriu que esta é alterada devido à interdependência existente entre volume e intensidade e não somente pela intensidade em si. Embora o efeito na redução da ação quimiotática de neutrófilos seja transitório e revertido em 48h após exercício, é possível gerar uma "janela de oportunidade" na qual o risco de infecção aumentado deve ser considerado42.
O exercício físico intenso promove desgranulação de neutrófilos aumentando a concentração de enzimas como a mieloperoxidase (MPO), que funciona como marcador de migração de neutrófilos para o músculo e da desgranulação destes no soro43.
A infiltração de neutrófilos, em ratos submetidos a cinco semanas de atividade natatória, foi mais pronunciada em fibras oxidativas (vermelhas) do que em fibras glicolíticas (brancas). Não foi observada diferença significativa na concentração de marcadores proteicos de ação neutrofílica (MPO), em repouso, entre animais treinados e não treinados. Porém, uma única sessão de exercício exaustivo produziu um aumento significativo de MPO em animais não treinados comparado com o grupo treinado, sugerindo um possível efeito protetor do treinamento no tecido muscular44.
Células apresentadoras de antígeno
Linfócitos T reconhecem antígenos apenas quando células apresentadoras (células dendríticas, macrófagos e linfócitos B) expõem antígenos em sua superfície associados a moléculas do complexo principal de histocompatibilidade (MHC major histocompatibility complex). Exercícios aeróbios prolongados e extenuantes diminuem a expressão de receptores do tipo Toll (Toll-like receptor TLRs) em macrófagos e comprometem a apresentação de antígenos para os linfócitos T, impedindo, sobretudo, a resposta inflamatória Th1. Esse efeito anti-inflamatório impede o dano tecidual causado pelos mediadores inflamatórios e reduz o risco de doenças inflamatórias crônicas, mas aumenta a susceptibilidade de infecções por microrganismos intracelulares45.
Macrófagos de camundongos submetidos a treinamento aeróbio de intensidade moderada realizado em esteira rolante aumentaram sua capacidade microbicida e a produção de IFN-γ, TNF-α e NO, sendo capazes de diminuir a infecção por Listeria monocytogenes. Observou-se também uma redução na produção de IL-10. Ainda nestas células, o treinamento promoveu uma diminuição de receptores β2-adrenérgicos (β2AR)46, assim como já foi visto em linfócitos após treinamento de resistência47. O β2AR é um membro da família de receptores acoplados à proteína G e funciona como chave de ligação para regulação do sistema imune via sistema nervoso simpático48 e está envolvido com a inibição da enzima NO sintase induzida (iNOS). A diminuição desses receptores é um dos fatores que contribuem para o aumento da atividade microbicida de macrófagos promovida pelo treinamento moderado46.
Células dendríticas têm a capacidade de internalizar antígenos e expressar um grande número de moléculas co-estimulatórias sendo uma importante célula apresentadora de antígenos para as células T, estimulando a sua expansão clonal49. Chiang et al.50 observaram em roedores que, após cinco semanas de treinamento na esteira com incrementos na velocidade e inclinação ao longo das semanas, houve um aumento no número de células dendríticas, em sua expressão de MHC de classe II e produção de IL-12, sugerindo a capacidade de indução de resposta imune celular.
Células NK
As células NK são linfócitos com citotoxicidade natural para células infectadas por vírus e células tumorais, dispensando sensibilização primária e independente de apresentação via MHC. Essas células apresentam como marcadores de superfície o receptor III para região constante (Fc) de IgG, o Fcg (CD16) e uma molécula de adesão de células neuronais (CD56)51, responsável por adesão homotípica52. Baseado na expressão de CD56, essas células podem ser divididas em duas subpopulações: CD56dim, as quais apresentam altos níveis de CD16, são mais citotóxicas e correspondem a 90% das células NK presentes na circulação periférica; e CD56bright, cujos níveis de CD16 são menores ou inexistentes e correspondem a cerca de 10% do total de células NK circulantes53,54. O fenótipo CD56bright apresenta a capacidade de produzir uma variedade de citocinas (principalmente IFN-γ e TNF-α) que estão envolvidas na interface entre a resposta imune inata e adaptativa, principalmente pela produção de IFN-γ que induz a polarização de TCD4+ em Th153-56. Uma vez ativadas, as células CD56bright tornam-se tão citotóxicas quanto as da subpopulação CD56dim 57, sugerindo que as células CD56bright sejam as precursoras imediatas das CD56dim 52. O repertório de moléculas de adesão e de receptores de quimiocinas expressos por essas subpopulações é peculiar, o que ocasiona diferentes sítios de migração. CD56dim migra preferencialmente para os sítios de inflamação aguda, enquanto CD56bright para os órgãos linfoides secundários52,58.
As células NK apresentam notável sensibilidade ao estresse promovido pelo exercício físico, o qual promove sua redistribuição do sangue periférico para os outros tecidos, sugerindo que a NK pode ser um potencial elo entre a atividade física regular e o estado de saúde geral59. A mobilização da circulação periférica pode ocorrer via mecanismos que incluem estresse por aumento substancial do fluxo sanguíneo periférico e expressão diminuída de moléculas de adesão induzida por catecolamina60, cuja produção é estimulada pelo exercício físico61. Entretanto, durante exercício muito prolongado (maior que 3h) a concentração de células NK circulantes pode retornar ao nível pré-exercício, ou mesmo tornar-se ainda menor do que este62. Uma hipótese para essa diminuição seria a migração dessas células para sítios de injúria muscular63. Alguns estudos demonstram que os dois subgrupos, CD56bright e CD56dim, aumentam durante o exercício; entretanto, existe uma mobilização diferencial entre eles. A razão CD56bright:CD56dim varia entre o período de repouso, durante o exercício e no período de recuperação, sendo menor nos dois primeiros momentos e aumentando no terceiro. Isso demonstra que este balanço durante a recuperação do estresse fisiológico favorece o subgrupo CD56bright 64-66. É neste período que ocorre a recuperação da homeostase e adaptação tecidual67, sugerindo que este subgrupo pode ter um importante papel neste processo59. Embora as células NK CD56bright sejam principalmente encontradas em órgãos linfoides secundários52,58, estas células também são encontradas em sítios inflamatórios58,68, o que pode ser explicado por possuírem uma grande capacidade de produção de citocinas e por apresentarem expressão de moléculas de adesão, que podem direcioná-las ao tecido que sofreu injúria58. Além da produção de citocinas a CD56bright libera vários fatores de crescimento angiogênicos na circulação uterina69, sugerindo que, somado a outros fatores, estes podem contribuir para a angiogênese, que é uma adaptação fisiológica ao exercício regular59.
Apesar desses achados, é necessária uma melhor investigação do papel das células NK associado ao exercício.
Subpopulações de linfócitos
A concentração de todas as subpopulações linfócitos aumenta no compartimento vascular durante o exercício e diminui, a níveis menores que aqueles apresentados no período pré-exercício, após trabalho físico de longa duração70,71. Durante o exercício, a razão CD4+:CD8+ diminui, refletindo um maior aumento nas células TCD8+ em relação a TCD4+ 26. Embora a concentração de todas as subpopulações de linfócitos aumente, a percentagem de células TCD4+ declina pelo fato de as células NK aumentarem mais do que qualquer outra subpopulação26,59.
O decréscimo na concentração de linfócitos no período pós-exercício pode ser consequência, pelo menos em parte, de um mecanismo de apoptose72. Um percentual maior de apoptose de linfócitos em humanos tem sido descrito imediatamente após a realização de exercícios de alta intensidade72-74.
O índice de apoptose de linfócitos quando o exercício é realizado a 38%  O2máx (6,9 ± 0,5%) é semelhante aos níveis basais (6,2 ± 0,2%) e aumenta significativamente quando a intensidade do exercício alcança 61%
O2máx (6,9 ± 0,5%) é semelhante aos níveis basais (6,2 ± 0,2%) e aumenta significativamente quando a intensidade do exercício alcança 61%  O2máx (10,4 ± 0,6%). Um aumento significativo nos índices de apoptose induzida pelo exercício é observado com o incremento gradual da carga, alcançando o pico máximo imediatamente após exercício exaustivo (100%
O2máx (10,4 ± 0,6%). Um aumento significativo nos índices de apoptose induzida pelo exercício é observado com o incremento gradual da carga, alcançando o pico máximo imediatamente após exercício exaustivo (100%  O2máx), atingindo um percentual de apoptose de 22,4 ± 0,4%. Após 20 minutos de recuperação, o índice apoptótico é significativamente menor, caindo ainda mais após 40 min, e chegando aos níveis basais após 60 min pós-exercicio72. O exercício intenso também é capaz de diminuir a concentração de glutationa (GSH) de linfócitos, induzindo o estresse oxidativo, enquanto o conteúdo de caspases 8, 9 e 3 ativas e a fragmentação de DNA parecem ser aumentados75. Alguns autores tendem a associar o exercício intenso à apoptose devido à ação dos altos níveis de catecolaminas produzidos72, enquanto outros associam ao aumento do estresse oxidativo75,76.
O2máx), atingindo um percentual de apoptose de 22,4 ± 0,4%. Após 20 minutos de recuperação, o índice apoptótico é significativamente menor, caindo ainda mais após 40 min, e chegando aos níveis basais após 60 min pós-exercicio72. O exercício intenso também é capaz de diminuir a concentração de glutationa (GSH) de linfócitos, induzindo o estresse oxidativo, enquanto o conteúdo de caspases 8, 9 e 3 ativas e a fragmentação de DNA parecem ser aumentados75. Alguns autores tendem a associar o exercício intenso à apoptose devido à ação dos altos níveis de catecolaminas produzidos72, enquanto outros associam ao aumento do estresse oxidativo75,76.
Kruger et al.77 mostraram que a redistribuição de leucócitos, mecanismo fundamental de regulação da hematopoiese, está ativa durante a alteração na concentração de linfócitos promovida pelo exercício. O aumento de catecolaminas promovido pelo exercício pode estar associado a essa redistribuição, uma vez que os linfócitos apresentam receptores α e β adrenérgicos, sugerindo assim uma regulação neurohormonal.
Linfócitos T helper (Th)
Os linfócitos TCD4+ virgens expressam a molécula co-estimulatória CD28 em sua superfície que interage com seu ligante, a molécula B7, na superfície da célula apresentadora de antígeno. A ligação CD28-B7 dispara a sinalização para a síntese de IL-2 e a expressão de seu receptor (IL-2R) pela célula T, ocasionando assim a sua proliferação e diferenciação78,79. Com o avanço da idade dos indivíduos o número absoluto de linfócitos T diminui, assim como a expressão de moléculas CD28 e a produção de citocinas do padrão Th1 (IL-2 e IFN-γ), enquanto há um aumento da produção de citocinas do tipo Th2 (IL-4). Esta alteração no balanço Th1/Th2 pode contribuir para a vulnerabilidade maior dos idosos a certas infecções80.
Um estudo feito com 28 idosos mostrou que após seis meses de treinamento com exercício de intensidade moderada o número absoluto de linfócitos TCD4+ (CD28+CD4+) aumentou, assim como o das células produtoras de IFN-γ (Th1), enquanto as células T produtoras de IL-4 (Th2) não sofreram alterações significativas81. Outros estudos corroboram estes dados demonstrando que o número absoluto de linfócitos T e de células TCD4+ 82 e a expressão de IL-2R em células T83 aumentou em idosos submetidos a exercícios de intensidade moderada combinados (resistência e força) ou programa de treinamento de resistência81. Assim sendo, esta expressão aumentada favoreceria uma resposta do tipo Th1, prevenindo infecções principalmente aquelas causadas por microrganismos intracelulares.
Efeito do exercício físico na produção de citocinas
A produção de citocinas pode ser modulada por uma série de estímulos, dentre os quais podemos citar estresse hormonal, estresse oxidativo e exercício extenuante15. O primeiro estudo sugerindo que o exercício físico induzia um aumento das concentrações plasmáticas de citocinas foi publicado em 1983 e mostrou que o plasma obtido de seres humanos após a prática de exercício, quando injetado intraperitonialmente em ratos, promovia o aumento da temperatura retal destes animais84.
Vários autores têm relatado um aumento nas concentrações séricas de citocinas anti-inflamatórias após diferentes formas de exercício. O aumento de IL-6 foi associado ao exercício extenuante em um maratonista85, assim como em resposta a outros tipos de exercícios, nos quais foi observado um aumento de cerca de 100 vezes em sua concentração plasmática26,28-33. O aumento de IL-6 está intimamente ligado à intensidade do exercício27,28, a qual representa indiretamente a massa muscular envolvida na atividade contrátil28. Exercícios que envolvam uma massa muscular limitada, como, por exemplo, músculos das extremidades superiores, podem ser insuficientes para aumentar as concentrações plasmáticas de IL-6 acima dos níveis pré-exercício. Por outro lado, a corrida, que envolve uma grande quantidade de grupos musculares, é a modalidade de exercício em que observou-se o mais pronunciado aumento de IL-628. O pico dos níveis séricos desta citocina é alcançado no final da realização do exercício ou em um curto período após este, seguido por um rápido decréscimo voltando para os níveis do período pré-exercício35. Deste modo, a combinação entre a modalidade, a intensidade e a duração da atividade física determinam a magnitude do aumento da concentração plasmática de IL-6 induzido pelo exercício28. Além de seu efeito imunomodulador, esta miocina também apresenta importantes efeitos metabólicos, tais como o aumento da captação de glicose e da oxidação de ácidos graxos pelo músculo esquelético, aumento da gliconeogênese hepática e lipólise no tecido adiposo (figura 1). Na mesma linha, a miocina IL-8 parece exercer efeitos angiogênicos28,36,37 e a IL-15, também produzida pela contração muscular, parece ter efeitos anabólicos e na redução da adiposidade36,37,86. Apesar de alguns estudos não mostrarem aumentos significativos na IL-15 plasmática após o exercício87,88, Tamura et al.89 observaram este aumento em indivíduos submetidos a 30 minutos de exercício na esteira com intensidade de 70% da FCmáx predita pela idade (FCmáx = 220 idade). Os autores atribuem a falta de consenso na literatura aos diferentes desenhos experimentais e principalmente aos momentos da medida da IL-15 após o exercício.
O aumento nas concentrações de IL-1ra, IL-4, IL-10, IL-12p40 e MCP-1 foi observado após a realização de exercício máximo90, exercício de resistência91,92, corridas do tipo downhill63, ciclismo intenso93, corridas e ciclismo de resistência92.
Em um estudo realizado envolvendo indivíduos do sexo masculino, corredores e triatletas, foi observado um aumento de 60% na concentração plasmática de IL-1ra imediatamente após a realização de exercício de intensidade moderada (EIM) (1h de corrida na esteira, 60%  O2máx), enquanto que a corrida downhill (CD) (45min [10% de gradiente], 60%
O2máx), enquanto que a corrida downhill (CD) (45min [10% de gradiente], 60%  O2máx) promoveu um aumento de 100% nesta concentração e a atividade física de alta intensidade (EAI) (1h de corrida na esteira, 85%
O2máx) promoveu um aumento de 100% nesta concentração e a atividade física de alta intensidade (EAI) (1h de corrida na esteira, 85%  O2máx) promoveu um aumento de 120%. Estes valores foram ainda maiores após uma hora do final da atividade física, sendo 1,3 vezes maiores que a concentração plasmática pré-exercíco, no caso de EIM, 2,4 vezes maiores, na CD e cinco vezes maiores no EAI. A concentração de IL-10 aumentou apenas imediatamente após o EAI (6,3 vezes) e uma hora após esta atividade (sete vezes), permanecendo inalterada nos dois outros tipos de treinamento, EIM e CD. Os níveis plasmáticos de IL-12p40 foram 30% maiores imediatamente após a realização do EAI, enquanto 1h após a realização dos três tipos de exercício, aumentaram apenas 10%, no caso de EIM, 15%, na CD e 25% no EAI12.
O2máx) promoveu um aumento de 120%. Estes valores foram ainda maiores após uma hora do final da atividade física, sendo 1,3 vezes maiores que a concentração plasmática pré-exercíco, no caso de EIM, 2,4 vezes maiores, na CD e cinco vezes maiores no EAI. A concentração de IL-10 aumentou apenas imediatamente após o EAI (6,3 vezes) e uma hora após esta atividade (sete vezes), permanecendo inalterada nos dois outros tipos de treinamento, EIM e CD. Os níveis plasmáticos de IL-12p40 foram 30% maiores imediatamente após a realização do EAI, enquanto 1h após a realização dos três tipos de exercício, aumentaram apenas 10%, no caso de EIM, 15%, na CD e 25% no EAI12.
O aumento da produção de citocinas anti-inflamatórias durante o exercício possivelmente se dá para restringir reações pró-inflamatórias em resposta ao dano na musculatura esquelética causadas pelo exercício93, podendo ainda inibir a produção de citocinas pró-inflamatórias associadas ao desenvolvimento de estados patológicos, tais como diabetes do tipo 2, doenças cardiovasculares e síndrome metabólica94. Por outro lado, a produção de citocinas anti-inflamatórias durante o exercício pode resultar no aumento da susceptibilidade à infecções90. Entretanto, vários trabalhos têm mostrado que a prática de exercícios de intensidade moderada induz uma resposta do tipo Th1, com produção de citocinas pró-inflamatórias48,59,81. Exercícios de resistência de intensidade moderada induzem uma resposta inflamatória sistêmica leve, que é caracterizada, pelo menos em parte, pela elevação dos níveis séricos de citocinas inflamatórias, tais como IL1β e TNF-α95,96.
Keller et al.97 mostraram que a superexpressão de TNF-α retornou às concentrações normais após 1h de exercício natatório agudo em camundongos cujo gene do receptor de TNF-α (TNFR) foi deletado. Além disso, exercício crônico parece suprimir citocinas pró-inflamatórias, tais como TNF-α e IL-6, e aumentar citocinas anti-inflamatórias incluindo IL-4, IL-10 e TGF-β98,99.
Efeito do exercício físico nas vias de sinalização envolvidas na resposta imune
As interações moleculares que ocorrem na superfície das células, tipo interação ligante-receptor, dispara uma cascata de sinalizações bioquímicas citoplasmáticas envolvendo diversas vias de transdução de sinais. Essas sinalizações podem resultar na produção de proteínas, citocinas, expressão de receptores e proliferação. Durante a ligação antígeno/receptor em linfócitos, a agregação do receptor de antígeno leva à ativação de proteínas tirosinas cinases associadas aos receptores na porção citoplasmática da membrana celular. Isso inicia a sinalização intracelular pela fosforilação de resíduos de tirosina nas caudas dos receptores agregados. Outras tirosinas cinases do citosol podem ser ativadas e passam a fosforilar novos alvos, até que fatores de transcrição sejam ativados e atuem no núcleo, induzindo a transcrição de determinados genes100.
A sinalização de IL-6 se assemelha à de leptina devido ao receptor de leptina (LRb) e a gp130Rβ compartilharem um alto grau de homologia em suas sequências e ambos ativarem a via de sinalização do complexo formado pela proteína cinase ativada por Janus (JAK)-transdutor de sinal e ativador de transcrição (STAT). Quando a IL-6 se liga ao receptor homodimerizado IL-6Rα/gp130Rβ, resulta em uma cascata de sinalização que é iniciada por autofosforilação e ativação de JAK, seguido de recrutamento de domínio SH2, que contém a proteína tirosina fosfatase SHP2, que leva a ativação da cascata de sinalização Ras-ERK1/228. A IL-6 pode exercer funções no sistema imunológico, estimulando a síntese de IL-1ra e de IL-1027,28, assim como pode interferir em vários processos metabólicos via sinalização por AMPK e PI3K-AKT28 (figura 1).
A proteína mTOR (proteína alvo de rapamicina em mamíferos droga imunossupressora) é uma serina/treonina cinase envolvida em vários processos celulares, os quais incluem metabolismo, crescimento (hipertrofia e hiperplasia), sobrevivência, envelhecimento, plasticidade sináptica e memória103. A via de sinalização desta enzima pode ser ativada por: 1) prática de exercício físico; 2) baixos níveis de energia na célula, via AMPK (proteína cinase ativada por AMP); 3) fatores de crescimento como insulina e IGF-1; 4) aminoácidos, via Rag GTPases; 5) sinais da família Wnt via glicogênio sintase cinase 3 (GSK3)104. No sistema imunológico, a sinalização envolvendo mTOR é disparada pela ligação de antígenos a seus receptores específicos em células T e B ou à TLR e pela ligação de interleucinas a seus receptores104,105.
Esta enzima cinase pode apresentar-se na forma de dois complexos: mTORC1 e mTORC2. A mTOR e a LST8 (também chamado GβL), juntamente com a proteína associada reguladora de mTOR (RAPTOR) formam o complexo mTORC1. RAPTOR é essencial para a atividade de mTORC1. O complexo mTORC2 também apresenta LST8, mas, ao invés de RAPTOR, está associado com RICTOR (uma estrutura insensível ao imunossupressor rapamicina) e possivelmente a uma MAPKAP1 (proteína cinase ativada por mitógenos associada à proteína 1, também conhecida como SIN1)105.
O complexo mTORC1 estimula a síntese de proteína e a proliferação celular, enquanto o complexo mTORC2, a organização do citoesqueleto. O complexo de esclerose tuberosa 1 (TSC1) e 2 (TSC2) juntos formam um complexo funcional que age como um inibidor de mTORC1. A prática de exercícios pode gerar a produção de fatores de crescimento e citocinas, estas últimas, juntamente com moléculas co-estimulatórias e receptores de antígenos ativam PI3K, que ativa subsequentemente AKT (PKB). Esta enzima completamente ativada inibe TSC2 por fosforilação da mesma, permitindo a ativação de mTORC1. Alternativamente, estresse celular e danos no DNA, os quais também podem se promovidos por atividade física, podem inibir mTORC1 por promover a capacidade reguladora de TSC1-TSC2. Este complexo age via inibição de RHEB (uma GTPase homóloga a Ras, abundante no cérebro), que é um estimulador de mTORC1 (figura 2)105.
A inibição de mTORC1 leva a um efeito pró-inflamatório em células fagocíticas, aumentando sua capacidade de produzir citocinas, tais como IL-6, IL-12 e IL-23 e diminuindo a produção de citocinas anti-inflamatórias como IL-10. Esta inibição ainda é capaz de estimular respostas do tipo Th1 e Th17, que são tipicamente inflamatórias106. A via de mTORC1 pode ser ativada em fagócitos em resposta à infecção bacteriana ou após exposição à lipopolissacarídios (LPS), ou ainda durante prática de exercícios físicos107.
CONCLUSÃO
A prática regular de exercício físico pode ser benéfica para a saúde, porém, parâmetros como volume e intensidade devem ser observados em sua prescrição para que dele se obtenha melhores resultados. De uma maneira geral, o exercício de intensidade moderada promove proteção contra infecções causadas por microrganismos intracelulares, pois direciona a resposta imune para a predominância de células Th1. Em contrapartida, atividades de alta intensidade geram aumento das concentrações de citocinas anti-inflamatórias (padrão Th2), visando diminuição dos danos no tecido muscular resultantes da inflamação, embora isto possa resultar no aumento da susceptibilidade a infecções. A figura 3 resume os principais efeitos do exercício físico no sistema imunológico.
Todos os autores declararam não haver qualquer potencial conflito de interesses referente a este artigo.
- 1. Handschin C, Spiegelman BM. The role of exercise and PGC1α in inflammation and chronic disease. Nature 2008;454:463-9.
- 2. Pedersen BK, Hoffman-Goetz L. Exercise and the immune system: Regulation integration and adaption. Physiol Reviews 2000;80:1055-81.
- 3. Rosa LF, Vaisberg MW. Influências do exercício na reposta imune. Rev Bras Med Esporte 2002;8:167-72.
- 4. Leandro CG, Castro RM, Nascimento E, Pithon-Curi TC, Curi R. Mecanismos adaptativos do sistema imunológico em resposta ao treinamento físico. Rev Bras Med Esporte 2007;13:343-48.
- 5. Pollock ML, Gaesser GA, Butcher JD, Després J-P, Dishman RK, Franklin BA, et al. ACSM Position Stand: The Recommended Quantity And Quality Of Exercise For Developing And Maintaining Cardiorespiratory And Muscular Fitness, And Flexibility In Healthy Adults. Med Sci Sports Exerc 1998;30:975-91.
- 6. Haskell WL, Lee I-M, Pate RR, Powell KE, Blair SN, Franklin BA, et al. Physical Activity and Public Health: Updated Recommendation for Adults from the American College of Sports Medicine and the American Heart Association. Med Sci Sports Exerc 2007;39:1423-34.
- 7. Walsh NP, Gleeson M, Pyne DB, Nieman DC, Dhabhar FS, Shephard RJ, et al. Position Statement Part two: Maintaining immune health. Exerc Immunol Rev 2011;17:64-103.
- 8. Romagnani S. Type 1 T helper and type 2 T helper cells: functions, regulation and role in protection and disease. Int J Clin Lab Res 1991;21:152-8.
- 9. Del Prete G. The complexity of the CD4 T-cell responses: old and new T-cell subsets. Parassitologia 2008;50:9-16.
- 10. Moretta A, Marcenaro E, Parolini S, Ferlazzo G, Moretta L. NK cells at the interface between innate and adaptive immunity. Cell Death Differ 2008;15:226-33.
- 11. Dinarello CA, Mier JW. Interleukins Annu Rev Med 1986;37:173-8.
- 12. Peake JM, Suzuki K, Hordern M, Wilson G, Nosaka K, Coombes JS. Plasma cytokine changes in relation to exercise intensity and muscle damage. Eur J Appl Physiol 2005;95:514-21.
- 13. Vilcek J, Feldman M. Historical review: cytokines as therapeutic and targets of therapeutics. Trends Pharmacol Sci 2004;25:201.
- 14. Elenkov IJ, Chrousos GP, Wilder RL. Neuroendocrine regulation of IL-12 and TNF-alpha/IL-10 balance. Clinical implications. Ann NY Acad Sci 2000;917:94-105.
- 15. Cannon JG. Infammatory cytokines in nonpathological states. News Physiol Sci 2000;15:298-303.
- 16. Heinzel F, Hujer A, Ahmed F, Rerko R. In vivo production and function of IL-12p40 homodimers. J Immunol 1997;158:4381-8.
- 17. Omata N, Yasutomi M, Yamada A, Iwasaki H, Mayumi M, Ohshima Y. Monocyte chemoattractant protein-1 selectively inhibits the acquisition of CD40 ligand-dependent IL-12-producing capacity of monocyte-derived dendritic cells and modulates Th1 immune response. J Immunol 2002;169:4861-6.
- 18. Elenkov IJ, Papanicolaou DA, Wilder RL, Chrousos GP. Modulatory effects of glucocorticoids and catecholamines on human interleukin-12 and interleukin-10 production: clinical implications. Proc Assoc Am Physicians 1996;108:374-81.
- 19. Ramirez F, Fowell DJ, Puklavec M, Simmonds S, Mason D. Glucocorticoids promote a Th2 cytokine response by CD4+ T cells in vitro. J Immunol 1996;156:2406-12.
- 20. Blotta MH, DeKruy RH, Umetsu DT. Corticosteroids inhibit IL-12 production in human monocytes and enhance their capacity to induce IL-4 synthesis in CD4+ lymphocytes. J Immunol 1997;158:5589-95.
- 21. Agarwal SK, Marshall GD. Beta-adrenergic modulation of human type-1/type-2 cytokine balance. J Allergy Clin Immunol 2000;105:91-8.
- 22. Demeure CE, Yang LP, Desjardins C, Raynauld P, Delespesse G. Prostaglandin E2 primes naive T cells for the production of anti-inflammatory cytokines. Eur J Immunol 1997;27:3526-31.
- 23. Kalinski P, Vieira PL, Schuitemaker JH, De Jong EC, Kapsenberg ML. Prostaglandin E2 is a selective inducer of interleukin-12 p40 (IL-12p40) production and an inhibitor of bioactive IL-12p70 heterodimer. Blood 2001;97:3466-9.
- 24. Sondergaard SR, Ostrowski K, Ullum H, Pedersen BK. Changes in plasma concentrations of interleukin-6 and interleukin-1 receptor antagonists in response to adrenaline infusion in humans. Eur J Appl Physiol 2000;83:95-8.
- 25. Steensberg A, Fischer CP, Keller C, Moller K, Pedersen BK. IL-6 enhances plasma IL-1ra, IL-10, and cortisol in humans. Am J Physiol 2003;285:E433-7.
- 26. Pedersen BK, Hoffman-Goetz L. Exercise and the immune system: regulation integration and adaption. Physiol Rev 2000;80:1055-81.
- 27. Ostrowski K, Rohde T, Asp S, Schjerling P, Pedersen BK. Pro and anti-inflammatory cytokine balance in strenuous exercise in humans. J Physiol 1999;515:287-91.
- 28. Pedersen BK, Febbraio MA. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiol Rev 2008;88:1379-406.
- 29. Pedersen BK, Steensberg A, Schjerling P. Muscle derived interleukin-6: possible biological effects. J Physiol 2001;536:329-37.
- 30. Febbraio MA, Pedersen BK. Muscle-derived interleukin-6: mechanisms for activation and possible biological roles. FASEB J 2002;16:1335-47.
- 31. Pedersen BK, Steensberg A, Fischer C, Keller C, Keller P, Plomgaard P, et al. Searching for the exercise factor is IL-6 a candidate? J Mus Res Cell Motil 2003;24:113-9.
- 32. Febbraio MA, Pedersen BK. Contraction-induced myokine production and release: is skeletal muscle an endocrine organ? Exerc Sport Sci Rev 2005;33:114-9.
- 33. Pedersen BK, Fischer CP. Physiological roles of muscle-derived interleukin-6 in response to exercise. Curr Opin Clin Nutr Metab Care 2007;10:265-71.
- 34. Steensberg A, van Hall G, Osada T, Sacchetti M, Saltin B, Klarlund PB. Production of interleukin-6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma interleukin-6. J Physiol 2000;529:237-42.
- 35. Fischer CP, Hiscock N, Basu S, Vessby B, Kallner A, Sjoberg LB, et al. Supplementation with vitamins C and E inhibits the release of interleukin-6 from contracting human skeletal muscle. J Physiol 2004;558:633-45.
- 36. Nielsen S, Pedersen BK. Skeletal muscle as an immunogenic organ. Curr Opin Pharmacol 2008;8:346-51.
- 37. Pedersen, B.K. Muscles and their myokines. J Exp Biol 2011;214:337-46.
- 38. Gavriele, Ashlagi-Amiri RT, Eliakim A, Nemet D, Zigel L, Berger-Achituv S, et al. The Effect of Aerobic Exercise on Neutrophil Functions. Med Sci Sports Exerc 2008;40:1623-8.
- 39. Butterfield TA, Best TM, Merrick MA. The Dual Roles of Neutrophils and Macrophages in Inflammation: A Critical Balance Between Tissue Damage and Repair. J Athle Training 2006;41:457-65.
- 40. Brickson S, Hollander J, Corr DT, Ji LL, Best TM. Oxidant production and immune response after stretch injury in skeletal muscle. Med Sci Sports Exerc 2001;33:2010-5.
- 41. Wolach B, Falk B, Gavrieli R, Kodesh E, Eliakim A. Neutrophil function response to aerobic and anaerobic exercise in female judoka and untrained subjects. Br J Sports Med 2000;34:23-7.
- 42. Wolach B, Gavrieli R, Ben-Dror SG, Zigel L, Eliakim A, Falk B. Transient decrease of neutrophil chemotaxis following aerobic exercise. Med Sci Sports Exerc 2005;37:949-54.
- 43. Walsh, N. Effect of oral glutamine supplementation on human neutrophil lipopolysaccharide-stimulated degranulation following prolonged exercise. Int J Sport Nutr Exerc Metab 2000 ;10 :39-50.
- 44. Morozov VI, et al. The effects of high-intensity exercise on skeletal muscle neutrophil myeloperoxidase in untrained and trained rats. Eur J Appl Physiol 2006;97:716-22.
- 45. Gleeson M, McFarlin B, Flynn, M. Exercise and Toll-like receptors. Exerc Immunol Rev 2006;12:34-5.
- 46. Kizaki T, Takemasa T, Sakurai T, Izawa T, Hanawa T, Kamiya T, et al. Adaptation of macrophages to exercise training improves innate immunity. Biochem Biophys Res Communic 2008;372:152-6.
- 47. Jost J, Weiss M, Weicker R. Sympathoadrenergic regulation and the adrenoceptor system. J Appl Physiol 1990;68:897-904.
- 48. Kohm AP, Sanders VM. Norepinephrine: a messenger from the brain to the immune system. Immunol Today 2000;21:539-42.
- 49. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000;18:767-811.
- 50. Chiang LM, Chen YJ, Chiang J, Lai LY, Chen YY, Liao HF. Modulation of Dendritic Cells by Endurance Training. Int J Sports Med 2007;28:798-803.
- 51. Cooper MA, Fehniger TA, Caligiuri MA. The biology of human natural killer cell subsets. Trends Immunol 2001;22:633-40.
- 52. Poli A, Michel T, Thérésine M, Andrès E, Hentges F, Zimmer J. CD56bright natural killer (NK) cells: an important NK cell subset. Immunology 2009;126:458-65.
- 53. Lanier LL, Le AM, Civin CI, Loken MR, Phillips JH. The relationship of CD16 (Leu-11) and Leu-19 (NKH-1) antigen expression on human peripheral blood NK cells and cytotoxic T lymphocytes. J Immunol 1986;136:4480-6.
- 54. Caligiuri MA. Human natural killer cells. Blood 2008;112:461-9.
- 55. Fehniger TA, Cooper MA, Nuovo GJ, Cella M, Facchetti F, Colonna M, et al. CD56bright natural killer cells are present in human lymph nodes and are activated by T cell-derived IL-2: a potential new link between adaptive and innate immunity. Blood 2003;101:3052-7.
- 56. Mocikat R, Braumuller H, Gumy A, Egeter O, Ziegler H, Reusch U, et al. Natural killer cells activated by MHC class I (low) targets prime dendritic cells to induce protective CD8 T cell responses. Immun 2003;19:561-9.
- 57. Nagler A, Lanier LL, Cwirla S, Phillips JH. Comparative studies of human FcRIII- positive and negative natural killer cells. J Immunol 1989;143:3183-91.
- 58. Cooper MA, Fehniger TA, Turner SC, Chen KS, Ghaheri BA, Ghayur T, Carson WE, Caligiuri MA. Human natural killer cells: a unique innate immunoregulatory role for the CD56(bright) subset. Blood 2001;97:3146-51.
- 59. Timmons BW, Cieslak T. Human Natural Killer Cell Subsets and Acute Exercise: A Brief Review. Exerc Immunol Rev 2008;14:8-23.
- 60. Nagao F, Suzui M, Takeda K, Yagita H, Okumura K. Mobilization of NK cells by exercise: downmodulation of adhesion molecules on NK cells by catecholamines. Am J Physiol Regul Integr Comp Physiol 2000;279:R1251-6.
- 61. Dela F, Mikines KJ, Von Linstow M, Galbo H. Heart rate and plasma catecholamines during 24 h of everyday life in trained and untrained men. J Appl Physiol 1992;73:2389-95.
- 62. Gannon GA, Rhind SG, Suzui M, Shek PN, Shephard RJ. Circulationg levels of peripheral blood leukocytes and cytokines following competitive cycling. Can J Appl Physiol 1997;22:133-47.
- 63. Malm C, Sjodin TL, Sjoberg B, Lenkei R, Renstrom P, Lundberg IE, et al. Leukocytes, cytokines, growth factors and hormones in human skeletal muscle and blood after uphill or downhill running. J Physiol 2004;556:983-1000.
- 64. Timmons BW, Tarnopolsky MA, Bar-Or O. Sex-based effects on the distribution of NK cell subsets in response to exercise and carbohydrate intake in adolescents. J Appl Physiol 2006;100:1513-9.
- 65. Timmons BW, Tarnopolsky MA, Snider DP, Bar-Or O. Puberty effects on NK cell responses to exercise and carbohydrate intake in boys. Med Sci Sports Exerc 2006;38:864-74.
- 66. Timmons BW, Bar-Or O. Evidence of sex-based differences in natural killer cell responses to exercise and carbohydrate intake in children. Eur J Appl Physiol 2007;101:233-40.
- 67. Mahoney DJ, Parise G, Melov S, Safdar A, Tarnopolsky MA. Analysis of global mRNA expression in human skeletal muscle during recovery from endurance exercise. FASEB J 2005;19:1498-500.
- 68. Dalbeth N, Gundle R, Davies RJ, Lee YC, McMichael AJ, Callan MF. CD56bright NK cells are enriched at inflammatory sites and can engage with monocytes in a reciprocal program of activation. J Immunol 2004;173:6418-26.
- 69. Lash GE, Schiessl B, Kirkley M, Innes BA, Cooper A, Searle RF et al. Expression of angiogenic growth factors by uterine natural killer cells during early pregnancy. J Leukoc Biol 2006;80:572-80.
- 70. Oshida Y, Yamanouchi K, Hayamizu S, Sato Y. Effect of acute physical exercise on lymphocyte subpopulations in trained and untrained subjects. Int J Sports Med 1988;9:137-40.
- 71. Hansen JB, Wilsgard L, Osterud B. Biphasic changes in leukocytes induced by strenuous exercise. Eur J Appl Physiol 1991;62:157-61.
- 72. Navalta, JW, Sedlock DA, Park KS. Effect of Exercise Intensity on Exercise-Induced Lymphocyte Apoptosis. Int J Sports Med 2007;28:539-42.
- 73. Hsu T-G, Hsu K-M, Kong C-W, Lu F-J, Cheng H, Tsai K. Leukocyte mitochondria alterations after aerobic exercise in trained human subjects. Med Sci Sports Exerc 2002;34:438-42.
- 74. Steensberg A, Morrow J, Toft AD, Bruunsgaard H, Pedersen BK. Prolonged exercise, lymphocyte apoptosis and F2-isoprostanes. Eur J Appl Physiol 2002;87:38-42.
- 75. Jong-Shyan Wang & Yu-Hsiang Huang. Effects of exercise intensity on lymphocyte apoptosis induced by oxidative stress in men. Eur J Appl Physiol 2005;95:290-7.
- 76. Levada-Pires AC, Cury-Boaventura MF, Gorjao R, Hirabara SM, Puggina EF, Peres CM, et al. Neutrophil Death Induced by a Triathlon Competition in Elite Athletes. Med Sci Sports Exerc 2008;40:1447-54.
- 77. Kruger K, Lechtermann A, Fobker M, Volker K, Mooren, FC. Exercise-induced redistribution of T lymphocytes is regulated by adrenergic mechanisms. Brain Behave Immun 2008;22:324-38.
- 78. Jenkins MK, Taylor PS, Norton SD, Urdahl KB. CD28 delivers a costimulatory signal involved in antigen-specific IL-2 production by human T cells. J Immunol 1991;147:2461-6.
- 79. Cerdan C, Martin Y, Courcoul M, Brailly H, Mawas C, Birg F, et al. Prolonged IL-2 receptor á/CD25 expression after T cell activation via the adhesion molecules CD2 and CD28. Demonstration of combined transcriptional and posttranscriptional regulation. J Immunol 1992;149:2255-61.
- 80. Utsuyama M, Hirokawa K, Kurashima C, Fukayama M, Inamatsu T, Suzuki K et al. Differential age-change in the numbers of CD4+CD45RA+ and CD4+CD29+ T cell subsets in human peripheral blood. Mech Ageing Dev 1992;63:57-68.
- 81. Shimizu K, Kimura F, Akimoto T, Akama T, Tanabe K, Nishijima, et al. Effect of moderate exercise training on T-helper cell subpopulations in elderly people. Exerc Immunol Rew 2008;14:24-37.
- 82. Koizumi K, Kimura F, Akimoto T, Akama T, Kumai Y, Tanaka H, et al. Effects of long-term exercise training on peripheral lymphocyte subsets in elderly subjects. Jpn J Phys Fitness Sports Med 2003;52:193-202.
- 83. Kohut ML, Senchina, DS. Reversing age-associated immunosenescence via exercise. Exerc Immunol Rev 2004;10:6-41.
- 84. Cannon JG, Kluger MJ. Endogenous pyrogen activity in human plasma after exercise. Sci 1983;220:617-9.
- 85. Northoff H, Berg A. Immunologic mediators as parameters of the reaction to strenuous exercise. Int J Sports Med 1991;12:9-15.
- 86. Barra NG, Reid S, MacKenzie R, Werstuck G, Trigatti BL, Richards C, Holloway AC, Ashkar AA. Interleukin-15 contributes to the regulation of murine adipose tissue and human adipocytes. Obesity (Silver Springs) 2010;18:1601-7.
- 87. Wunderlich FT, Strohle P, Konner AC, Gruber S, Tovar S, Bronneke HS, et al. Interleukin-6 signaling in liver-parenchymal cells suppresses hepatic inflammation and improves systemic insulin action. Cell Metab 2010;12:237-49.
- 88. Inoue S, Unsinger J, Davis CG, Muenzer JT, Ferguson TA, Chang K, et al. IL-15 prevents apoptosis, reverses innate and adaptive immune dysfunction, and improves survival in sepsis. J Immunol 2010;184:1401-9.
- 89. Tamura Y, Watanabe K, Kantani T, Hayashi J, Ishida N, Kaneki M. Upregulation of circulating IL-15 by treadmill running in healthy individuals: Is IL 15 an endocrine mediator of the beneficial effects of endurance exercise? Endocr J 2011;58:211-5.
- 90. Suzuki K, Nakaji S, Kurakake S, Totsuka M, Sato K, Kuriyama T, et al. Exhaustive exercise and type-1/type-2 cytokine balance with special focus on interleukin-12 p40/p70. Exerc Immunol Rev 2003;9:48-57.
- 91. Hirose L, Nosaka K, Newton M, Laveder A, Kano M, Peake JM, et al. Changes in inflammatory mediators following eccentric exercise of the elbow flexors. Exerc Immunol Rev 2004;10:75-90.
- 92. Nieman DC, Davis JM, Brown VA, Henson DA, Dumke CL, Utter AC, et al. Influence of carbohydrate ingestion on immune changes after 2 h of intensive resistance training. J Appl Physiol 2004;96:1292-8.
- 93. Toft AD, Jensen LB, Bruunsgaard H, Ibfelt T, Halkjaer-Kristensen J, Febbraio M, et al. Cytokine response to eccentric exercise in young and elderly humans. Am J Physiol 2002;283:C289-95.
- 94. Petersen AM, Pedersen BK. The anti-infammatory effect of exercise. J Appl Physiol 2005;98:1154-62.
- 95. Drenth JP, Krebbers RJ, Bijzet J, van der Meer JW. Increased circulating cytokine receptors and ex vivo interleukin-1 receptor antagonist and interleukin1b production but decreased tumour necrosis factor-a production after a 5-km run. Eur J Clin Invest 1998;28:866-72.
- 96. Moldoveanu AI, Shephard RJ, Shek PN. Exercise elevates plasma levels but not gene expression of IL-1b, IL-6, and TNF-α in blood mononuclear cells. J Appl Physiol 2000;89:1499-504.
- 97. Keller C, Keller P, Giralt M, Hidalgo J, Pedersen BK. Exercise normalises overexpression of TNF-α in knockout mice. Biochem. Biophys Res Commun 2004;321:179-82.
- 98. Bruunsgaard H. Physical activity and modulation of systemic low-level inflammation. J Leuk Biol 2005;78:819-35.
- 99. Flynn M, McFarlin BK, Markofski MA. The anti-inflammatory actions of exercise training. Am J Lifestyle Med 2007;1:220-35.
- 100. Janeway CA, Travers P, Walport M, Capra J. Imunobiologia: O sistema imune na saúde e na doença 6 ed. 2007; Editora Artmed.
- 101. Peter C. Heinrich, Iris Behrmann, Serge Haan, Heike M. Hermanns, Gerhard Muller-Newen & Fred Schaper. Principles of interleukin (IL)-6-type cytokine signalling and its regulation. Biochem J 2003;374:1-20.
- 102. Robson-Ansley P, Cockburn E, Walshe I, Stevenson E, Nimmo M. The effect of exercise on plasma soluble IL-6 receptor concentration: a dichotomous response. Exerc Immunol Rev 2010;16:56-76.
- 103. Wullschleger S, et al. TOR signaling in growth and metabolism. Cell 2006;124:471-84.
- 104. Yang Q, Guan KL. Expanding mTOR signaling. Cell Res 2007;17:666-81.
- 105. Thomson AW, Turnquist HR, Raimondi G. Immunoregulatory functions of mTOR inhibition. Nat Immunol Rev 2009;324-37.
- 106. Weichhart T, et al. The TSCmTOR signaling pathway regulates the innate inflammatory response. Immun 2008;29:565-77.
- 107. Atherton PJ, Babraj JA, Smith K, Singh J, Rennie MJ, Wackerhage H. Selective activation of AMPK-PGC-1α or PKB-TSC2-mTOR signaling can explain specific adaptive responses to endurance or resistance training-like electrical muscle stimulation. FASEB J 2005;1-23.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
30 Ago 2012 -
Data do Fascículo
Jun 2012