Resumos
A ação de Metarhizium anisopliae var. anisopliae e Metarhizium anisopliae var. acridum sobre o cupim de montículo Nasutitermes coxipoensis (Holmgren) e a produção de conídios sobre os insetos mortos foram estudadas em laboratório. Doses infectivas foram determinadas através do contato direto dos insetos com a cultura fúngica após 12 dias de crescimento e quantificação dos conídios em câmara de Neübauer. Foram utilizadas as doses 0,5 x 10(6) e 1,6 x 10(7) conídos/ml, para M. anisopliae var. anisopliae, e 1,4 x 10(5) e 1,8 x 10(6) conídios/ml para M. anisopliae var. acridum, nominadas dose A e dose B, respectivamente. As doses corresponderam a 3 min. e 15 min. de contato direto de 20 cupins com a cultura fúngica. A produção de conídios foi avaliada utilizando-se insetos inoculados com o fungo, 10 dias após a morte. Os bioensaios foram realizados em triplicata. Os percentuais de mortalidade acumulada de N. coxipoensis tratados com M. anisopliae, no terceiro dia após a inoculação, foram: controle, 15,7%; dose A 95,7% e dose B 100%; para M. anisopliae var. acridum foram: controle, 13,3%; dose A 66,4 e dose B 88,8%. A média da produção de conídios foi mais elevada para M. anisopliae var. anisopliae do que para M. anisopliae var. acridum. Os resultados mostraram que M. anisopliae var. anisopliae apresentou maior potencial para o controle biológico de N. coxipoensis.
Controle biológico; patógeno de insetos; controle microbiano; cupim
The action of Metarhizium anisopliae var. anisopliae and Metarhizium anisopliae var. acridum on the mound termite Nasutitermes coxipoensis (Holmgren) and the conidia production on dead insects were studied in laboratory. Infective doses were determined through direct contact of the insects with the fungi cultures with 12 days of growth followed by conidia quantification in Neübauer camera. The doses of 0.5 x 10(6) and 1.6 x 10(7) conidia/ml of M. anisopliae var. anisopliae, and 1.4 x 10(5) e 1.8 x 10(6) conidia/ml of M. anisopliae var. acridum were named dose A and dose B, for each fungus, respectively. These doses corresponded to 3-min and 15-min direct contact of 20 insects with the fungi cultures. Conidia production was evaluated using the insects inoculated with fungi. The bioassays were carried out in triplicate. The percentage of accumulated mortality of N. coxipoensis treated with M. anisopliae var. anisopliae on the third day after inoculation were: control, 15.7%; dose A 95.7% and dose B 100%; for M. anisopliae var. acridum: control, 13.3%; dose A 66.4% and dose B 88,8%. The average of conidia production was higher for M. anisopliae var. anisopliae than M.anisopliae var. acridum. The results showed that M. anisopliae var. anisopliae presented better potential for the biological control of N. coxipoensis.
Biological control; insect pathogen; microbial control; termite
BIOLOGICAL CONTROL
Patogenicidade de Metarhizium anisopliae var. anisopliae e Metarhizium anisopliae var. acridum sobre Nasutitermes coxipoensis (Holmgren) (Isoptera: Termitidae)
Pathogenicity of Metarhizium anisopliae var. anisopliae and Metarhizium anisopliae var. acridum on Nasustitermes coxipoensis (Holmgren) (Isoptera: Termitidae)
Auristela C. AlbuquerqueI; Karla C.A. PereiraI; Franklin M. CunhaII; Antonio F.S.L. VeigaII; Ana C.R. AthaydeIII; Elza A.L.A. LimaI
ILab. Controle Biológico, Depto. Micologia/CCB/UFPE, Av. Prof. Nelson Chaves, Cidade Universitária, 50670-420, Recife, PE
IILab. Entomologia, Depto. Biologia, UFRPE, Av. Dom Manoel de Medeiros S/N, Dois Irmãos, 52171-900, Recife, PE
IIIDepto. Medicina Veterinária - Centro de Saúde e Tecnologia Rural UFCG/CSTR/Campus de Patos, Rodovia Patos-Teixeira, Bairro Jatobá, 58700-000, Patos, PB
RESUMO
A ação de Metarhizium anisopliae var. anisopliae e Metarhizium anisopliae var. acridum sobre o cupim de montículo Nasutitermes coxipoensis (Holmgren) e a produção de conídios sobre os insetos mortos foram estudadas em laboratório. Doses infectivas foram determinadas através do contato direto dos insetos com a cultura fúngica após 12 dias de crescimento e quantificação dos conídios em câmara de Neübauer. Foram utilizadas as doses 0,5 x 106 e 1,6 x 107 conídos/ml, para M. anisopliae var. anisopliae, e 1,4 x 105 e 1,8 x 106 conídios/ml para M. anisopliae var. acridum, nominadas dose A e dose B, respectivamente. As doses corresponderam a 3 min. e 15 min. de contato direto de 20 cupins com a cultura fúngica. A produção de conídios foi avaliada utilizando-se insetos inoculados com o fungo, 10 dias após a morte. Os bioensaios foram realizados em triplicata. Os percentuais de mortalidade acumulada de N. coxipoensis tratados com M. anisopliae, no terceiro dia após a inoculação, foram: controle, 15,7%; dose A 95,7% e dose B 100%; para M. anisopliae var. acridum foram: controle, 13,3%; dose A 66,4 e dose B 88,8%. A média da produção de conídios foi mais elevada para M. anisopliae var. anisopliae do que para M. anisopliae var. acridum. Os resultados mostraram que M. anisopliae var. anisopliae apresentou maior potencial para o controle biológico de N. coxipoensis.
Palavras-chave: Controle biológico, patógeno de insetos, controle microbiano, cupim
ABSTRACT
The action of Metarhizium anisopliae var. anisopliae and Metarhizium anisopliae var. acridum on the mound termite Nasutitermes coxipoensis (Holmgren) and the conidia production on dead insects were studied in laboratory. Infective doses were determined through direct contact of the insects with the fungi cultures with 12 days of growth followed by conidia quantification in Neübauer camera. The doses of 0.5 x 106 and 1.6 x 107 conidia/ml of M. anisopliae var. anisopliae, and 1.4 x 105 e 1.8 x 106 conidia/ml of M. anisopliae var. acridum were named dose A and dose B, for each fungus, respectively. These doses corresponded to 3-min and 15-min direct contact of 20 insects with the fungi cultures. Conidia production was evaluated using the insects inoculated with fungi. The bioassays were carried out in triplicate. The percentage of accumulated mortality of N. coxipoensis treated with M. anisopliae var. anisopliae on the third day after inoculation were: control, 15.7%; dose A 95.7% and dose B 100%; for M. anisopliae var. acridum: control, 13.3%; dose A 66.4% and dose B 88,8%. The average of conidia production was higher for M. anisopliae var. anisopliae than M.anisopliae var. acridum. The results showed that M. anisopliae var. anisopliae presented better potential for the biological control of N. coxipoensis.
Key words: Biological control, insect pathogen, microbial control, termite
Os cupins constituem uma das mais sérias pragas da cultura canavieira, ocorrendo em todos os países onde a mesma é cultivada; têm importância econômica na Ásia, Austrália, região do Caribe e América do Sul (Pizano 1995a, Mendonça 1996).
O rendimento industrial e a produtividade da cana-de-açúcar podem ser afetados por diversos fatores, salientando-se aqueles de ordem fitossanitária, com destaque para os cupins, englobando diferentes gêneros e espécies. Esses insetos estão presentes em todas as áreas tropicais do mundo onde a cana-de-açúcar é cultivada e, no Brasil podem ocasionar perdas superiores a 10 t/ha no ano, o que representa cerca de 60 toneladas por ha durante o ciclo da cultura (Novaretti & Fontes 1998). Os principais danos ocasionados pela infestação de cupins são causados aos toletes destinados aos novos plantios. Penetrando pelas extremidades, os cupins destroem o tecido parenquimatoso e as gemas, causando falhas na lavoura. Abrem galerias nos entrenós basais na cana adulta e, nas soqueiras, quando ocorrem altas infestações, atacam severamente constituindo focos no plantio seguinte (Pizano 1995b). Foram identificadas em cana-de-açúcar, as espécies Amintermes nordestinus Melo & Fontes, Cylindrotermes nordenskioeldi Holmgren, Nasutitermes coxipoensis (Holmgren) e Syntermes nanus Constantino (Miranda et al. 2004).
O uso de fungos entomopatogênicos no controle de insetos tem sido objeto de pesquisas importantes com a finalidade de melhor preservar o meio ambiente. A espécie Metarhizium anisopliae (Metsch.) Sorokin é amplamente distribuída na natureza, podendo ser encontrada facilmente nos solos, onde sobrevive por longos períodos. Os insetos atacados tornam-se mumificados e cobertos por uma camada pulverulenta de cor verde, formada pela aglomeração de conídios. M. anisopliae é utilizado no controle de pragas que causam sérios prejuízos a culturas de interesse agronômico, em quase todos os países do mundo, principalmente nos tropicais (Azevedo 2001, Milner 2003). Estudos de laboratório e de campo foram realizados na Austrália visando à transmissão entre indivíduos e a indução de epizootia em colônias de Nasutitermes exitiosus (Hill). Altos níveis de mortalidade em grupos de cupins em laboratório foram obtidos pela adição de operários contaminados com M. anisopliae (Hanel 1981). A seleção de espécies de fungos entomopatogênicos para controle de N. exitiosus foi efetuada através de experimentos de laboratório, bem como o estudo do ciclo de vida de um isolado de M. anisopliae, com patogenicidade comprovada (Hanel 1982a,b). Este fungo pulverizado dentro das colônias no campo ou em locais de coleta de alimento foi capaz de iniciar epizootias. Através de amostragens dos indivíduos dessas colônias, constatou-se que a doença persistiu nos cupinzeiros por até 15 semanas (Hanel & Watson 1983). Pesquisas avaliando a patogenicidade de M. anisopliae e Beauveria bassiana (Bals.) Vuill. sobre Nasutitermes sp. foram desenvolvidas por Malagodi & Veiga (1994) e indicaram que ambos foram patogênicos em condições de laboratório. Milner et al. (1997) estudaram os efeitos da umidade relativa do ar na germinação e infecção de isolados de M. anisopliae em cupins N. exitiosus e Coptotermes acinaciformis (Froggat) e verificaram que a mortalidade dos cupins ocorreu em todas as umidades testadas (entre 90 e 100%) e que a esporulação do fungo nos cupins mortos ocorreu apenas em umidades relativas acima de 93%.
Driver et al. (2000) reavaliaram a taxonomia de Metarhizium com base em dados moleculares de RAPD e análise de ITS (Internal Transcribes Space) e descreveram dez classes para o grupo. M. anisopliae var. acridum, incluiu a espécie M. flavoviride var. flavoviride isolada de Acrididae (Arthus & Thomas 2001, Blanford & Thomas 2001, Screen et al. 2001, Magalhães et al. 2003, Ouedraogo et al. 2003).
O presente trabalho teve como objetivo avaliar a ação de M. anisopliae var. anisopliae e M. anisopliae var. acridum sobre N. coxipoensis, cupim de montículo de ocorrência generalizada em cana-de-açúcar no Nordeste do Brasil, em condições de laboratório, a fim de verificar o potencial dos fungos como agentes biocontroladores dessa espécie de inseto, bem como quantificar a esporulação sobre os insetos mortos.
Material e Métodos
Os experimentos in vitro foram realizados no Laboratório de Controle Biológico do Departamento de Micologia da Universidade Federal de Pernambuco e no Laboratório de Entomologia do Departamento de Biologia da Universidade Federal Rural de Pernambuco. A criação dos cupinzeiros foi mantida em casa-de-vegetação no Departamento de Agronomia da UFRPE.
Criação de N. coxipoensis em Casa de Vegetação. Foram removidos cupinzeiros vivos do campo experimental localizado na Usina Central Olho D'água, município de Itambé, PE e instalados em casa-de-vegetação com a finalidade de manter os insetos vivos para a utilização nos experimentos dos fungos entomopatogênicos no laboratório.
Linhagens Fúngicas Utilizadas.M. anisopliae var. anisopliae (PL43) isolada originariamente de Mahanarva posticata (Stål), em Alagoas e M. anisopliae var. acridum (CG291) isolada originariamente de Austracnis guttulosa (Walker), Austrália. Os isolados estão depositados na Micoteca do Departamento de Micologia da UFPE sob os seguintes números de acesso: M. anisopliae var. anisopliae (URM-3185) e M. anisopliae var. acridum (URM-4412)
Determinação das Doses Infectivas a Serem Utilizadas nos Bioensaios. Foram utilizadas culturas fúngicas com 12 dias de crescimento obtidas através da inoculação de 1 ml de suspensão fúngica na concentração 1,0 x 108, espalhada uniformemente com alça de Drigalsky em placas de Petri com BDA e mantidas em estufa incubadora (BOD) durante 12 dias. Em seguida, foram colocados 20 cupins (quatro soldados e 16 operários), proporção indicada por Vasconcellos (1999), em cada placa de Petri e manipulados a cada 3, 6, 9, 12 e 15 min. Após cada tempo de contato foram retirados dois cupins/placa (um soldado e um operário) os quais foram colocados em tubo de ensaio contendo 2 ml solução Tween 80 (0,01%), para posterior quantificação dos conídios em câmara de Neübauer, segundo Alves & Moraes (1998). Foram realizadas cinco leituras de cada amostra. A média obtida foi dividida por dois e correspondeu à estimativa do número de conídios/inseto em relação a cada tempo específico de contato. As doses determinadas correspondem ao potencial de inóculo/indivíduo, sendo, portanto, um número aproximado, já que muitos conídios podem ficar aderidos à superfície do inseto (Alves et al. 1998). Ocorreu um aumento na quantidade de conídios com relação ao tempo de contato para ambos os fungos (Tabela 1). Para M. anisopliae var. anisopliae o percentual do número de conídios foi sempre crescente até o tempo de 15 min., enquanto que para M. anisopliae var. acridum ocorreram pequenas variações. As equações do número de conídios em função do tempo foram obtidas através da fórmula: Y = a.bT, onde Y = número de conídios, a e b são coeficientes da equação e T é o tempo de contato.
Método de Inoculação e Bioensaio em Laboratório. Os bioensaios foram realizados após a determinação das doses infectivas, de acordo com os diferentes tempos de contato. A parcela experimental foi constituída de um recipiente de plástico transparente com 5 cm de diâmetro por 5,5 cm de altura, com fundo forrado com papel filtro, contendo 20 g de fragmentos de ninho de cupinzeiro e um rolete de cana de açúcar. Em cada recipiente foram colocados 20 cupins (operários e soldados, na proporção de 4:1 respectivamente), provenientes das colônias mantidas em casa de vegetação e após o contato direto dos mesmos com a cultura fúngica nos tempos correspondentes às doses previamente determinadas. Após a inoculação, os recipientes foram cobertos com tecido de algodão e mantidos em BOD, com temperatura e umidade relativa controlada. Para cada bioensaio foram utilizados 300 insetos, assim divididos: 100 para testemunha, 100 para dose A e 100 para a dose B, para cada variedade de fungo. A mortalidade acumulada foi calculada utilizando-se os dados dos três bioensaios juntos, para cada fungo. A avaliação foi efetuada a partir do segundo dia após a inoculação. Os insetos mortos foram retirados, contados e mantidos em câmara úmida para comprovação da infecção pelo fungo através da esporulação sobre o cadáver e verificação da produção de conídios. O bioensaio foi realizado em triplicata. As freqüências de mortes acumuladas foram obtidas para a testemunha, dose A e dose B e analisadas segundo Zar (1999).
Produção de Conídios de M. anisopliae var. anisopliae e M. anisopliae var. acridum Obtidos dos Cadáveres de N. coxipoensis. A produção de conídios de ambas variedades de fungo sobre N. coxipoensis foi quantificada utilizando-se os insetos mortos dos bioensaios. Os conídios foram coletados através da lavagem de dois cupins (um operário e um soldado) separadamente em tubos de ensaio contendo 2 ml de solução Tween 80. Os tubos de ensaio foram submetidos a três minutos de agitação em Vortex. Em seguida, foi feita a quantificação em Câmara de Neübauer. Foram utilizados 20 cupins (10 soldados e 10 operários) para cada repetição, sendo o experimento realizado em triplicata e os dados analisados através do programa SPSS (Statistical Package for the Social Sciences).
Resultados e Discussão
Bioensaios com M. anisopliae var. anisopliae Sobre o Cupim N. coxipoensis. Foi determinado o percentual de mortalidade acumulada de N. coxipoensis tratada com M. anisopliae, em doses distintas utilizadas segundo o tempo de contato direto com o fungo e avaliado diariamente através do acompanhamento da mortalidade.
A Fig. 1 apresenta a freqüência acumulada de cupins mortos após inoculação com M. anisopliae var. anisopliae, no período de um a quatro dias, durante o qual foram analisados 900 insetos, para três bioensaios realizados. O percentual acumulado de insetos mortos para cada dia foi relativamente baixo na testemunha e o maior percentual foi registrado na dose de 1,6 x 107 conídios/ ml, com 100% de mortalidade no terceiro dia de avaliação. Para a dose 0,5 x 106 conídios/ml, esse percentual de mortalidade ocorreu no quarto dia após a inoculação.
A ocorrência da mortalidade de 100% dos insetos testados no 3º e 4º dias após a inoculação difere, com relação ao tempo, do obtidos por Hanel (1981), que observou que M. anisopliae foi patogênica para N. exitiosus, ocasionando 100% de mortalidade dos insetos testados 11 dias após a inoculação. Experimentos com Heterotermes tenuis (Hagen) com diferentes isolados de M. anisopliae demonstraram baixa mortalidade mesmo em altas concentrações (Fernandes 1991). Provavelmente, diferenças bioquímicas e imunológicas entre H. tenuis e N. coxipoensis interferiram no desenvolvimento da doença, e conseqüentemente na patogenicidade do fungo (Traniello et al. 2002). Por outro lado Malagodi & Veiga (1994) obtiveram 100% de mortalidade de Nasutitermes sp. utilizando o fungo em altas concentrações (1x109 e 1x1010 conídios/ml). Taxa menor de mortalidade (20,5 e 34%) foi observada na concentração 1 x 107 conídios/ml, pelos mesmos autores.
A mortalidade acumulada (Fig. 1) atingiu 100% no terceiro dia na dose B (1,6 x 107) e no quarto dia na dose A (0,5 x 106). Resultados semelhantes foram obtidos por Milner et al. (1998) quando avaliaram a mortalidade de N. existiosus com M. anisopliae. Todavia, esses resultados podem ter sido influenciados pelo método de inoculação utilizado, que consistiu no contato entre cupins tratados diretamente com o fungo e, logo após, associação desses insetos a cupins não tratados, a fim de que ocorresse o grooming, tipo de limpeza realizada por esses animais, que facilita a disseminação dos conídios na população testada. Esses resultados indicam que o método de inoculação por contato direto é bastante eficiente para o desenvolvimento e evolução da doença.
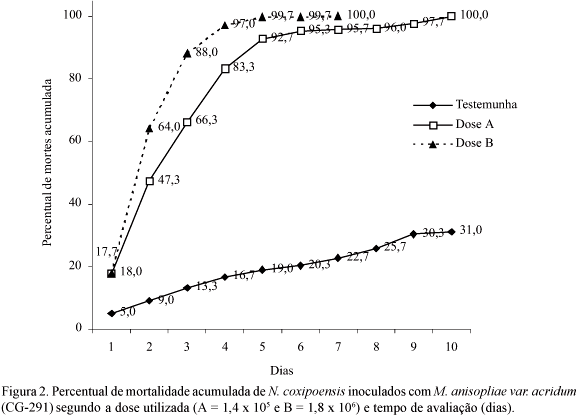
Bioensaios com M. anisopliae var. acridum Sobre o Cupim N. coxipoensis. O percentual acumulado de mortalidade dos insetos causado por M. anisopliae var. acridum, para cada avaliação no período de 1 a 10 dias, foi discreto (31,0%) na testemunha, representando a mortalidade natural (Fig. 2). Entre as doses testadas, o maior percentual de mortalidade foi registrado quando se utilizou a dose mais elevada (1,8 x 106 conídios/ml), exceto na avaliação do primeiro dia que apresentou percentuais bastante aproximados (18 e 17,7%), para as doses 1,4 x 105 e 1,8 x 106 conídios/ml, respectivamente. Destaca-se 99,7% de mortalidade até o 6º dia e 100% até o 8º, quando foi utilizada a dose de 1,8 x 106 conídios/ml. Para a dose 1,4 x 105 conídios/ml, 100% de mortalidade ocorreu no 10º dia de avaliação.
Comparando-se a mortalidade acumulada de N. coxipoensis inoculada com M. anisopliae (Fig. 1) com a mortalidade acumulada causada por M. anisopliae var. acridum (Fig. 2), verifica-se que o segundo fungo foi patogênico para N. coxipoensis, porém menos virulento, provocando a mortalidade em tempo mais prolongado. Outro fator a ser observado são as doses determinadas pelo método de inoculação por contato direto, cujos valores demonstram que M. anisopliae teve maior adesão ao tegumento dos insetos do que M. anisopliae var. acridum. Segundo Alves (1998), para alguns fungos a adesão dos conídios ao tegumento apresenta-se como processo simples, mas, para outros, esse fenômeno só pode ser explicado através de interações moleculares entre o patógeno e a superfície do hospedeiro. Processos enzimáticos também estão correlacionados com a agressividade de certos fungos para determinados hospedeiros, entretanto, a morte do inseto é ocasionada por uma série complexa de eventos, o que dificulta o estudo dessa correlação.
A análise dos resultados do experimento de M anisopliae var. acridum demonstrou a patogenicidade sobre N. coxipoensis, tendo ocorrido a mortalidade de 100% dos insetos após o 6º e o 10º dias para as doses A e B, respectivamente. Trabalhos específicos sobre a patogenicidade de M. anisopliae var. acridum sobre N. coxipoensis não foram localizados na literatura. Os resultados obtidos demonstraram que M. anisopliae var. acridum apresenta potencial para ser empregado no controle biológico desses cupins.
Produção de Conídios de M. anisopliae var. anisopliae e M. anisopliae var. acridum Sobre N. coxipoensis. A Tabela 2 mostra os resultados da esporulação de M. anisopliae var. anisopliae sobre cadáveres de N. coxipoensis nos diferentes tratamentos. O valor médio e a mediana foram mais elevados na dose B do que na dose A. O teste t-Student revelou diferença significativa entre as duas doses testadas, em relação ao logaritmo do número médio de conídios (P < 0,05). As médias da produção de conídios de M. anisopliae var. anisopliae sobre N. coxipoensis foram de 385 x 104 e 550 x 104 conídios/ml, para as dose A e B, respectivamente (Tabela 2) apresentando diferença estatística significativa, indicando a dose B (1,6 x 106 conídios/ml) como a mais eficiente para utilização no controle desse cupim com essa variedade de fungo. O mesmo não ocorreu com M. anisopliae var. acridum, que não apresentou diferença estatística significativa na produção de conídios entre as doses testadas (Tabela 3).
A esporulação de M. anisopliae sobre cadáveres de vários insetos é de grande interesse para as pesquisas sobre controle biológico, porque está diretamente relacionada à sobrevivência do fungo sobre o inseto. Hanel (1982b), em experimentos conduzidos sobre a esporulação de M. anisopliae sobre N. exitiosus, também obteve 100% de mortalidade. O mesmo ocorreu com Malagodi & Veiga (1994), quando estudaram a esporulação de M. anisopliae e B. bassiana sobre Nasuitermes sp., tendo obtido bons resultados.
O método por contato direto possibilitou maior adesão de conídios do fungo no inseto, indicando um alto potencial de inóculo. Fatores diversos podem ter atuado na adesão dos esporos ao tegumento dos insetos, desde a textura e as estruturas presentes (cerdas ou pêlos) até diferenças genéticas entre as linhagens fúngicas utilizadas, relacionadas à produção de enzimas e toxinas que interferem no processo de instalação e desenvolvimento da doença. Sun et al. (2002) também avaliaram a esporulação de M. anisopliae e B. bassiana sobre cadáveres de cupins C. formosanus e verificaram que essa produção aumentou significativamente após o 11º dia.
A formação micelial em N. coxipoensis tratada com M. anisopliae var. anisopliae foi observada entre o 2º e o 3º dias. O micélio emergiu inicialmente em torno das peças bucais, próximo à base das antenas e no cérvix e, logo após, nas membranas intersegmentais e ao redor das pernas. Para M. anisopliae var. acridum, a formação micelial foi verificada no 5º dia após a morte do inseto, indicando ação mais lenta desse fungo quando comparado com M. anisopliae var. anisopliae. Sun et al. (2002) também verificaram a presença de micélio dois dias após a morte dos insetos. Eventualmente os cadáveres foram totalmente cobertos com micélio e conídios entre oito e dez dias após a morte.
Estudos relacionados com a multiplicação de fungos entomopatogênicos em insetos são de grande importância, pois informam a capacidade de tais agentes biocontroladores em aumentar o potencial de inóculo no ambiente dos hospedeiros, além de mostrarem a probabilidade da transmissão e disseminação dos conídios nas populações de insetos.
O presente estudo mostrou que o método de inoculação por contato direto dos insetos com a cultura fúngica foi eficiente, tendo ocasionado 100% de mortalidade nas doses testadas, o que comprovou a patogenicidade e a virulência de M. anisopliae var. anisopliae para N. coxipoensis, enquanto que M. anisopliae var. acridum, apesar de sido patogênico, mostrou-se menos virultento em condições de laboratório. A produção de conídios de M. anisopliae var. anisopliae sobre os insetos mortos confirmou o potencial desse fungo como biocontrolador, garantindo a manutenção do inóculo no ambiente por maior período de tempo.
Agradecimentos
A Dr. Adelmar Gomes Bandeira pelas orientações na manutenção das populações de cupins em laboratório. A Dr. Alexandre Vasconcelos pela identificação da espécie de cupim estudada.
Literatura Citada
Received 03/II/05. Accepted 20/IV/05.
- Alves, S.B. 1998. Patologia e controle microbiano: Vantagens e desvantagens, p.21-37. In S.B. Alves (ed.), Controle microbiano de insetos. Piracicaba, FEALQ, 1163p.
- Alves, S.B., A. Moino Jr. & J.E.M. Almeida. 1998. Produtos fitossanitários e entomopatógenos, p.17-238. In S.B. Alves (ed.), Controle microbiano de insetos. Piracicaba, FEALQ, 1163p.
- Alves, S.B. & S.A. Moraes. 1998. Quantificação de inoculo de patógenos de insetos, p. 765-777. In S.B. Alves (ed.), Controle microbiano de insetos. Piracicaba, FEALQ, 1163p.
- Arthus, S. & M. Thomas. 2001. Effects of temperature and relative humidity on sporulation of Metarhizium anisopliae var. acridum in mycosed cadavers of Schistocerca gregaria J. Invertebr. Pathol. 78: 59-65.
- Azevedo, J.L. 2001. O uso dos fungos em biotecnologia, p.93-149. In L.A. Serefine, M.N. Barros & J.L. Azevedo (eds), Biotecnologia: Avanços na agricultura e na agroindústria. Guaíba, Livraria e Editora Agropecuária, 433p.
- Blanford, S. & M.B. Thomas. 2001. Adult survival, maturation, and reproduction of the desert locust Schistocerca gregaria infected with the fungus Metarhizium anisopliae var. acridum. J. Invertebr. Pathol. 78: 1-8.
- Driver, F., R.F. Milner & W.H. Trueman. 2000. A taxonomic revision of Metarhizium based on a phylogenetic analysis of ribosomal DNA sequence data. Mycol. Res. 104: 134-150.
- Fernandes, P.M. 1991. Controle microbiano de Cornitermes cumulans (Kollar, 1832) (Isoptera - Termitidae) utilizando Beauveria bassiana (Bals.) Vuill e Metarhizium anisopliae (Metsch.) Sorokin. Tese de doutorado, ESALQ, Piracicaba, 114p.
- Hanel, H. 1981. A biossay for measuring the virulence of the insect pathogenic fungus Metarhizium anisopliae (Metsch.) Sorokin (Fungi Imperfect) against the Nasutitermes exitiosus (Hill) (Isoptera, Termitidae). Z. Ang. Entomol. 92: 9-18.
- Hanel, H. 1982a. Selection of a fungus species, suitable for the biological control of the termite Nasutitermes exitiosus (Hill) (Isoptera, Termitidae). Z. Ang. Entomol. 94: 237-245.
- Hanel, H. 1982b. The life cycle of a fungus species, suitable for the biological control of the termite Nasutitermes exitiosus (Hill). Mycopathologia 80: 137-145.
- Hanel, H. & J.A.L. Watson. 1983 Preliminary field test on the use of Metarhizium anisopliae for the control of Nasutitermes exitiosus (Hill) (Isoptera: Termitidae). Bull. Entomol. Res. 73: 305-313.
- Magalhães, B.P., M.S. Tigano, I. Martins, H. Frazão & H.G. Raminez. 2003. Characterization of a Peruvian isolate of Metarhizium anisopliae var. acridum, a pathogen of grasshoppers. Pesq. Agrop. Bras. 38: 1469-1475.
- Malagodi, M. & A.F.S.L. Veiga. 1994. Patogenicidade de Metarhizium anisopliae (Metsch) Sorokin e Beauveria bassiana (Bals) Vuill sobre o cupim Nasutitermes (Dudley) (Isoptera-Termitidae) em laboratório. An. Soc. Entomol. Brasil 24: 315-322.
- Mendonça, A.F. 1996. Guia das principais pragas da cana-de-açúcar, p.3-48. In A.F. Mendonça (ed.). Pragas da cana-de-açúcar. Alagoas, Insetos & Cia., 239p.
- Milner, R.J. 2003. Application of biological control agents in mound building termites (Isoptera: Termitidae). Experiences with Metarhizium anisopliae. Sociobiology 41: 419-428.
- Milner, R.J., J.A Staples & G.G. Lutton. 1997.The effect of humidity on germination and infection of termites by the hyphomycete, Metarhizium anisopliae J. Invertebr. Pathol. 69: 64-69.
- Milner, R.J., J.A. Staples, T.R. Hartley, G.G. Lutton, F. Driver & J.A.L. Watson. 1998. Occurrence of Metarhizium anisopliae in nests and feeding sites of Australian termites. Mycol. Res. 102: 216-220.
- Miranda, C.S., A. Vasconcelos & A.G. Bandeira. 2004. Termites in sugar cane in Northeast Brazil: Ecological aspects and pest status. Neotrop. Entomol. 33: 237-241.
- Novaretti, W.R.T. & L.R Fontes. 1998. Cupins: Uma grave ameaça à cana-de-açúcar no Nordeste do Brasil, p.163-172. In L.R. Fontes & E. Berti Filho (eds.), Cupins: O desafio do conhecimento. Piracicaba, FEALQ, 512p.
- Ouedraogo, R.M., M. Cusson, M.S. Goettel & J. Brodeur. 2003. Inhibition of fungal growth in thermoregulating locusts, Locusta migratoria, infected by the fungus Metarhizium anisopliae var. acridum. J. Invertebr. Pathol. 82: 103-109.
- Pizano, M.A. 1995a. Cupins em área canavieira, p.103-113. In E. Berti Filho & L.R. Fontes (eds.), Alguns aspectos atuais da biologia e controle de cupins. Piracicaba, FEALQ, 183p.
- Pizano, M.A. 1995b. Controle de cupins de cana-de-açúcar, p.115-120. In E. Berti Filho & L.R. Fontes (eds.), Alguns aspectos atuais da biologia e controle de cupins. Piracicaba, FEALQ, 183p.
- Screen, S.E., G. Hu & R.J. St. Leger. 2001. Transformants of Metarhizium anisopliae sf. anisopliae overexpressing chitinase from Metarhizium anisopliae sf. acridum show early induction of native chitinase but are not altered in pathogenicity to Manduca sexta. J. Invertebr. Pathol. 78: 260-266.
- Sun, J., J.R. Fuxa & G. Henderson. 2002. Sporulation of Metarhizium anisopliae and Beauveria bassiana on Coptotermes formosanus in vivo and in vitro J. Invertebr. Pathol. 81: 78-85.
- Traniello, J.F.A., R.B. Rosengaus & K. Savoie. 2002. The development of immunity in a social insect: Evidence for the group facilitation of disease resitance. Proc. Acad. Sci. 99: 6838-42.
- Vasconcelos, A. 1999. Estrutura e dinâmica de ninhos policálicos de uma espécie de Nasutitermes (Isoptera, Termitidae) em Mata Atlântica e no meio urbano de João Pessoa, Paraíba. Mestrado em Ciências Biológicas, Universidade Federal da Paraíba, João Pessoa, 84p.
- Zar, J.H. 1999. Biostatistical analysis. New Jersey, Prentice Hall, 929p.
Datas de Publicação
-
Publicação nesta coleção
26 Set 2005 -
Data do Fascículo
Ago 2005
Histórico
-
Aceito
20 Abr 2005 -
Recebido
03 Fev 2005