Resúmenes
Prosapia simulans (Walker) es una especie de salivazo que ataca los pastos del género Brachiaria (Trin.) Griseb. desde México hasta Colombia y ocasiona pérdidas económicas a la industria ganadera. El desarrollo de cultivares resistentes es considerado el mejor método de control del salivazo. Este trabajo tuvo los siguientes objetivos: corroborar la identificación de P. simulans originarias de México y Colombia, probar nuevos híbridos de Brachiaria por resistencia a esta especie y caracterizar los mecanismos de resistencia presentes en ellos. Mediante la combinación de caracteres morfológicos (uso de claves taxonómicas, disección de la genitalia del macho) y técnicas moleculares (RAPD-PCR) se logró corroborar que P. simulans es plaga de Brachiaria spp. desde México hasta Colombia. Para probar híbridos de Brachiaria y caracterizar los mecanismos de resistencia se realizó un ensayo de selección donde se sometieron 34 híbridos al ataque del salivazo. La metodología utilizada fue desarrollada en el CIAT. En el ensayo se infestó con seis huevos maduros de la especie P. simulans por planta. Se usaron diez repeticiones por genotipo en un diseño completamente al azar. En el ensayo de selección de los híbridos se detectaron siete híbridos susceptibles, 16 con resistencia intermedia y 11 resistentes. El mecanismo de resistencia que se expresó en los híbridos resistentes y en los testigos CIAT 6294 y CIAT 36062 fue el de antibiosis. BRX 4402 y CIAT 0606 fueron clasificados como muy susceptibles.
Mosca pinta; mejoramiento; antibiosis; tolerancia; gramínea forrajera
Prosapia simulans (Walker) is an important spittlebug species that attacks forage grasses of the genus Brachiaria (Trin.) Griseb. from Mexico to Colombia. This, and several other species of spittlebugs, cause important economic losses to the livestock production industry. Development of resistant cultivars is regarded as the best method of control. In the present study we used taxonomic keys, dissection of male genitalia and RAPD-PCR patterns to reconfirm the identity of P. simulans specimens collected in Colombia and Mexico. We were able to reconfirm that P. simulans occurs as a pest of Brachiaria from Mexico to Colombia. We also studied the levels and mechanisms of resistance present in 34 Brachiaria hybrids developed by CIAT. Infestations were made with six eggs per plant. We used 10 replications (plants) per genotype in a completely randomized design. Seven hybrids were found to be susceptible, 16 showed intermediate resistance and 11 were resistant. Antibiosis was the mechanism of resistance expressed in resistant hybrids as well as in the resistant checks CIAT 6294 and CIAT 36062. Tolerance was absent. The genotypes BRX 4402 and CIAT 0606 were classified as highly susceptible.
Froghopper; antibiosis; breeding; tolerance; forage grass
CROP PROTECTION
Identificación morfológica y molecular de Prosapia simulans (Walker) (Hemiptera: Cercopidae), y selección y mecanismos de resistencia a este salivazo en híbridos de Brachiaria
Morphological and molecular identification of Prosapia simulans (Walker) (Hemiptera: Cercopidae), and screening and mechanisms of resistance to this spittlebug in Brachiaria hybrids
Ulises CastroI; Cesar CardonaI; Jorge Vera-GrazianoII; John MilesI; Ramón Garza-GarciaIII
ICentro Internacional de Agricultura Tropical - CIAT, Apartado Aéreo 6713, Cali, Colombia ucastro@colpos.mx, c.cardona@cgiar.org, jmiles@cgiar.org
IIColegio de Postgraduados, km 36.5 Carr. México-Texcoco, Montecillos Edo. de México México C.P. 56230, graziano@colpos.mx
IIIINIFAP Campo Experimental Valle de México. Carr. Los Reyes-Lechería km 18.5 Chapingo. Texcoco Edo. de México, C.P. 56230, rgarzagarcia@yahoo.com.mx
RESUMEN
Prosapia simulans (Walker) es una especie de salivazo que ataca los pastos del género Brachiaria (Trin.) Griseb. desde México hasta Colombia y ocasiona pérdidas económicas a la industria ganadera. El desarrollo de cultivares resistentes es considerado el mejor método de control del salivazo. Este trabajo tuvo los siguientes objetivos: corroborar la identificación de P. simulans originarias de México y Colombia, probar nuevos híbridos de Brachiaria por resistencia a esta especie y caracterizar los mecanismos de resistencia presentes en ellos. Mediante la combinación de caracteres morfológicos (uso de claves taxonómicas, disección de la genitalia del macho) y técnicas moleculares (RAPD-PCR) se logró corroborar que P. simulans es plaga de Brachiaria spp. desde México hasta Colombia. Para probar híbridos de Brachiaria y caracterizar los mecanismos de resistencia se realizó un ensayo de selección donde se sometieron 34 híbridos al ataque del salivazo. La metodología utilizada fue desarrollada en el CIAT. En el ensayo se infestó con seis huevos maduros de la especie P. simulans por planta. Se usaron diez repeticiones por genotipo en un diseño completamente al azar. En el ensayo de selección de los híbridos se detectaron siete híbridos susceptibles, 16 con resistencia intermedia y 11 resistentes. El mecanismo de resistencia que se expresó en los híbridos resistentes y en los testigos CIAT 6294 y CIAT 36062 fue el de antibiosis. BRX 4402 y CIAT 0606 fueron clasificados como muy susceptibles.
Palabras clave: Mosca pinta, mejoramiento, antibiosis, tolerancia, gramínea forrajera
ABSTRACT
Prosapia simulans (Walker) is an important spittlebug species that attacks forage grasses of the genus Brachiaria (Trin.) Griseb. from Mexico to Colombia. This, and several other species of spittlebugs, cause important economic losses to the livestock production industry. Development of resistant cultivars is regarded as the best method of control. In the present study we used taxonomic keys, dissection of male genitalia and RAPD-PCR patterns to reconfirm the identity of P. simulans specimens collected in Colombia and Mexico. We were able to reconfirm that P. simulans occurs as a pest of Brachiaria from Mexico to Colombia. We also studied the levels and mechanisms of resistance present in 34 Brachiaria hybrids developed by CIAT. Infestations were made with six eggs per plant. We used 10 replications (plants) per genotype in a completely randomized design. Seven hybrids were found to be susceptible, 16 showed intermediate resistance and 11 were resistant. Antibiosis was the mechanism of resistance expressed in resistant hybrids as well as in the resistant checks CIAT 6294 and CIAT 36062. Tolerance was absent. The genotypes BRX 4402 and CIAT 0606 were classified as highly susceptible.
Key words: Froghopper, antibiosis, breeding, tolerance, forage grass
En las tierras húmedas bajas de Brasil, Venezuela y Colombia ha ocurrido un incremento sustancial de la producción de carne y leche, al aumentar la capacidad de carga en las pasturas por la introducción de gramíneas del género Brachiaria. Las especies B. decumbens (Stapf) y B. humidicola (Rendle) Schweick son las de mayor adopción por parte de los ganaderos en las sabanas del trópico americano. La especie B. decumbens cv Basilisk está bien adaptada a los suelos pobres, ácidos y con alto contenido de aluminio intercambiable (Miles et al. 2004). Además, B. decumbens mejora los suelos cuando se rota con otros cultivos y puede reducir la erosión en suelos de ladera.
Se estima que en Brasil hay cerca de 154,000,000 ha sembradas con Brachiaria llamada marandu (EMBRAPA 2006). En Colombia existen cerca de 5,860,000 ha sembradas con B. decumbens tanto en el trópico bajo húmedo como en el seco (Holmann & Peck 2002). En México, hay entre 22.8 y 30.8 millones de ha dedicadas a la ganadería vacuna en el trópico húmedo en los estados de Campeche, Veracruz, Yucatán, Quintana Roo y parte del estado de Chiapas (Suárez-Domínguez & López-Tirado 2005, SAGARPA 2005) y se estima que es una área apropiada para la siembra de estas gramíneas.
Sin embargo, todas las ventajas económicas y ambientales proporcionadas por la introducción de las gramíneas comerciales del género Brachiaria sufren una seria limitación fitosanitaria como consecuencia de los daños causados por un complejo de cercópidos conocidos en su conjunto como "mosca pinta de los pastos" o "salivazo de los pastos" (Valério et al. 2001). El salivazo surge en la época de las lluvias, justo cuando el ganadero espera que sus praderas se recuperen. La distribución geográfica del salivazo se extiende desde el sur de los Estados Unidos de América hasta el norte de la Argentina y desde cero hasta 3000 msnm (Peck 2001).
La especie Prosapia simulans (Walter) se registró en el año 2001 en Suramérica lo que la hace la especie de mayor distribución en el neotrópico porque se encuentra desde México hasta Colombia y Venezuela (Peck et al. 2001). Holmann & Peck (2002), al usar un modelo de simulación y con base en datos obtenidos por Valério & Nakano (1988), calcularon los daños económicos causados por el salivazo en Colombia. Los autores observaron que con una población de 10 adultos/m2, con el 25% y 100% del área ganadera infestada y ubicada en el trópico húmedo, las pérdidas que pueden ocurrir oscilan entre US$ 1.4 y US$ 5.7 millones. Asimismo, en el trópico seco las pérdidas pueden alcanzar US $ 7.1 a US$ 28.3 millones.
La amplia distribución geográfica del salivazo en América, la generalización de la información biológica disponible a todas las especies del insecto, la poca eficiencia y bajo nivel de adopción por parte de los ganaderos de las medidas de manejo, son factores que han incidido en la carencia de un manejo integrado de plagas (MIP) confiable. Además, la mayoría de variedades comerciales son altamente susceptibles al daño causado por el salivazo. Esto ha hecho que los esfuerzos por combatir esta problemática se enfoquen al uso de la resistencia varietal al salivazo en híbridos de Brachiaria, como un pilar importante en el diseño e implementación de un MIP para resolver este problema.
Se considera de vital importancia la creación y liberación de genotipos de Brachiaria spp. que se adapten a los suelos poco fértiles y que sean resistentes al ataque del salivazo en la América tropical para aumentar la producción de carne y leche (Miles et al. 2004). Estos genotipos tienen como destino áreas del trópico americano tales como las regiones costeras de México y Centro América, la región de los cerrados en Brasil, los llanos de la Orinoquía de Colombia y Venezuela, zonas en las cuales la presencia del salivazo es limitante para la persistencia y producción de las pasturas. Para cumplir con este propósito, el CIAT ha desarrollado un método confiable que permite la evaluación simultánea y masiva de híbridos de Brachiaria por resistencia a cinco especies de salivazo que ocurren en Colombia: Aeneolamia varia (F.), A. reducta (Lallemand), Mahanarva trifissa (Jacobi), Zulia carbonaria (Lallemand) y Z. pubescens (F.) (Cardona et al. 1999, 2004). Se han identificado híbridos resistentes a varias de estas especies pero los estudios también han mostrado que la resistencia a una especie no necesariamente actúa para otras (Valério et al 1996, Cardona et al. 2004), lo cual implica que los híbridos deben ser probados por resistencia a tantas especies como sea posible.
Dada la importancia de estudiar la respuesta de los nuevos híbridos producidos en el CIAT al ataque de las diferentes especies de salivazo para el diseño de las estrategias de mejoramiento vegetal, se propusieron como objetivos fundamentales de esta investigación corroborar la identificación de especimenes de P. simulans colectados en México y Colombia, seleccionar genotipos de Brachiaria spp. resistentes a la especie P. simulans y establecer cuál mecanismo de resistencia al insecto se expresa en ellos.
Materiales y Métodos
Identificación taxonómica y molecular de P. simulans de México y Colombia. Uno de los requisitos básicos en cualquier trabajo de resistencia varietal es la plena identificación del insecto con el cual se tiene interés en trabajar (Panda & Khush 1995). Por esta razón, se tomaron muestras de los especímenes considerados como posiblemente pertenecientes a la especie P. simulans en los municipios de La Antigua y Soyula de Alemán en el estado de Veracruz y Matías Romero en el estado de Oaxaca en México. Asimismo, se colectaron muestras de P. simulans en los municipios de Darién y El Cerrito en el departamento del Valle del Cauca en Colombia. La identificación de los especímenes se hizo con la asesoría del Dr. Daniel Peck en el Departamento de Entomología en la Universidad de Cornell. Los especímenes fueron identificados por comparación con insectos colectados en Costa Rica, Honduras, Nicaragua, y Guatemala que reposan en la colección entomológica de la Universidad de Cornell y por disección de la genitalia masculina de al menos 10 especímenes por sitio. También se recurrió a la literatura y claves disponibles de la especie (Walker 1858, Fennah 1953, Hamilton 1977, Carvalho & Webb 2005). Además, se tomaron fotografías de los especímenes y de la genitalia de los machos.
Por otra parte, para la identificación molecular a través de PCR (RAPDs) se enviaron adultos de P. simulans conservados en etanol del 94% al CIAT (Centro Internacional de Agricultura Tropical) en Colombia. Los adultos se recolectaron de plantas de Brachiaria spp. en el rancho CIPAT, agencia Santa Helena, municipio de Tonameca, estado de Oaxaca, México. Los insectos de México se compararon contra otros provenientes de Costa Rica y Colombia. Se usó el método de extracción de ADN propuesto por Gilbertson et al. (1991) y como cebador el "primer" OPA-10 para la amplificación del PCR (RAPDs).
Ubicación de los ensayos. La investigación sobre evaluación de genotipos y determinación de mecanismos de resistencia se realizó en el municipio de Palmira, Departamento del Valle del Cauca, Colombia. Los trabajos se adelantaron en el laboratorio e invernadero de Entomología de Forrajes Tropicales del Centro Internacional de Agricultura Tropical (CIAT), ubicado a 3.517º N y 76 267º W sobre una altitud de 965 msnm. Las condiciones ambientales en invernadero fueron: temperatura promedio 24ºC (rango: 19-27ºC), humedad relativa promedio 75% (rango: 70-90%).
Descripción de la técnica de evaluación. La unidad de evaluación empleada para el ensayo fue la llamada "técnica del tubo sencillo", diseñada por Cardona et al. (1999), en la cual se utiliza un tubo de P.V.C. de 6.5 cm de altura y 5.3 cm de diámetro exterior; un disco de plástico delgado de 5.3 cm de diámetro, el cual se fija a la parte inferior del tubo con cinta adhesiva, para alojar la tierra y permitir la salida del exceso de agua; un buje de P.V.C. con un orificio central de 2.2 cm, de 3 cm de longitud y 4.8 cm diámetro exterior usado como tapa, a través del cual pasa el tallo. Para la siembra, se depositó en cada unidad un tallo del material vegetativo de Brachiaria y se le adicionó 36 g de suelo esterilizado. Una semana después de la siembra, el material se fertilizó con urea (2 gm L-1). Dos semanas después de la siembra, se invirtió la unidad, durante ocho días, sobre una estructura diseñada para dicho fin, con el propósito de promover la proliferación de las raíces superficiales (necesarias para la alimentación de las ninfas). Después de los ocho días la unidad y la planta invertida se retornaron a la posición original. Si la propagación fue exitosa, las plantas se infestaron con seis huevos del insecto próximos a eclosionar seleccionados bajo el estereoscopio en el laboratorio. Los huevos fueron revisados 24h después y aquellos que no eclosionaron fueron reemplazados.
Selección de los híbridos de Brachiaria por resistencia a la especie P. simulans. Treinta y cuatro híbridos de Brachiaria desarrollados por el programa de mejoramiento de Brachiaria del CIAT y seleccionados por su buena adaptación a las condiciones de producción en México (CIAT 2001) fueron usados para realizar el tamizado con P. simulans. Se incluyeron como testigos los genotipos de Brachiaria CIAT 6294 (cultivar Marandú) y CIAT 36062 (un híbrido seleccionado en CIAT) resistentes a la especie de salivazo A. varia y los genotipos susceptibles CIAT 0606 y BRX 4402. El diseño experimental fue completamente al azar con diez repeticiones por genotipo.
El criterio inicial de evaluación y selección fue la escala visual de daño propuesta por Cardona et al. (1999) donde: 1, no hay daño visible; 2, 25% del área foliar afectada; 3, 50% del área foliar afectada; 4, 75% del área foliar afectada y 5, toda el área foliar está afectada y seca. Los datos fueron sometidos a análisis de varianza (Anova) y cuando la F fue significativa, se hizo la separación de medias de los genotipos por medio de la diferencia media significativa (DMS), con una a = 0.05.
La supervivencia fue calculada al clasificar el tamaño de las ninfas entre grandes, pequeñas (mitad del tamaño de una ninfa normal de quinto ínstar) y diminutas (un cuarto del tamaño de una ninfa normal de quinto ínstar) y determinar el instar de cada tamaño. El análisis estadístico de supervivencia se hizo solo con ninfas del quinto instar ya que aquellas en otros ínstares no llegan al estado adulto por efecto de la antibiosis presente en genotipos genuinamente resistentes (Cardona et al. 2004). Los datos de porcentaje de supervivencia de las ninfas se transformaron a arcoseno raíz de proporción, pero en la gráfica y las tablas se presentan los datos no trasformados de las medias. Los datos fueron sometidos a análisis de varianza (Anova) y la separación de medias de los genotipos por medio de los DMS, con una a = 0.05. Se calcularon correlaciones simples y de rango entre daño y porcentaje de supervivencia. También se hizo análisis visual en un gráfico al cruzar la información entre daño contra porcentaje de supervivencia para confirmar la selección de los mejores híbridos así como también la descripción de los posibles mecanismos de defensa. La metodología de selección utilizada fue la propuesta por Cardona et al. (1999) donde cada genotipo fue arbitrariamente clasificado como resistente, intermedio y susceptible con base a la calificación de daño y porcentaje de supervivencia. Para el promedio de daño se clasificó de la siguiente manera: 1-2, resistente; 2.1-3.0, intermedio; > 3.0, susceptible. Para el promedio de supervivencia: resistente (< 30%); intermedio (30.1-50%); susceptible (> 50%). Los análisis estadísticos se hicieron con el paquete estadístico Statistix (Analytical Software 2000).
Resultados y Discusión
Identificación taxonómica y molecular de P. simulans de México y Colombia. Se pudo lograr la plena identificación de la especie P. simulans a través de la disección de machos y examen de su genitalia y por comparación de características morfológicas de los machos de acuerdo con las claves disponibles en la literatura (Walker 1858, Fennah 1953, Hamilton 1977, Carvalho & Webb 2005). Los especímenes fueron asignados como contramuestras (vouchers) en el lote No.1227 de la colección taxonómica de la Universidad de Cornell. Hay que anotar que tanto machos como hembras presentan en el centro del pronoto la típica banda del género Prosapia la cual es del mismo color que el de las bandas exhibidas en las alas (Carvalho & Webb 2005). Los especímenes de P. simulans de México, Guatemala, Honduras y Costa Rica presentan una variación en el color del cuerpo con relación a los de Colombia: independiente del sexo, los insectos originarios de Centroamérica y México tienen la cabeza, el pronoto, el escutelo y las alas de color negro; el pronoto es cruzado por una banda y las alas están cruzadas por dos bandas transversales que son de color amarillo hasta naranja y pueden ser anchas o estrechas y estar completas o incompletas. En las hembras, también las bandas de las alas pueden estar reducidas o carecer de ellas y presentar coloración más oscura en el cuerpo. Por el contrario, los especímenes machos de Colombia tienen la cabeza, el pronoto, el escutelo y las alas de color café claro; el pronoto y las alas son cruzadas por bandas transversales de color amarillo claro; en las alas, las dos bandas son estrechas en relación a las exhibidas por los insectos de Centroamérica y México. Además, la banda posterior puede estar completa o reducida. Las hembras tienen la cabeza, el pronoto, el escutelo y las alas de color café oscuro y las bandas del pronoto y las alas muy reducidas o carecen de ellas.
La genitalia del macho de P. simulans presenta dos largas estructuras correspondientes al escudo genital, que terminan en la parte distal con una punta muy esclerosada; en vista ventral se alcanza a apreciar un pliegue y los parámeros apoyados sobre el escudo genital. Por su parte, los parámeros son los típicos del género Prosapia: terminan con una especie de gancho pero no tan agudo como en A. albofasciata; el edeago tiene dos típicos dientes del género Prosapia, pequeños y cortos, incrustados en la parte apical del edeago. La salida del gonóforo es preapical. Estas características son las mismas tanto para los machos colectados en México (Fig. 1A) como en Colombia (Fig. 1B) lo cual confirma que son la misma especie.
La prueba molecular a través de PCR (RAPDs) permitió detectar las mismas bandas diagnósticas en las muestras colectadas en México, Costa Rica y Colombia (Fig. 1C). Estos patrones de bandas sirvieron para confirmar la identidad de P. simulans tal y como lo hizo Cardona et al. (2002) para otras especies de salivazo en Colombia. En otras palabras, la identidad de P. simulans fue reconfirmada mediante análisis morfológico, comparación de características de la genitalia de machos y amplificación de ADN por RAPDs-PCR.
Como lo sugiere Panda & Khush (1995) la plena identificación y cantidad necesaria de la especie del insecto con el que se quiera trabajar es un requisito indispensable en cualquier trabajo de resistencia varietal u otros en la especialidad de entomología. Es por esto, que el resultado de la identificación plena de la especie que se usó en este trabajo permite tener confianza en la validez de los resultados de esta investigación.
Selección de los híbridos de Brachiaria por resistencia a la especie P. simulans. La prueba de Bartlett para los residuales no mostró homogeneidad de varianza para la variable daño (Gl = 41; P < 0.001); no se hizo esta prueba para la variable supervivencia porque uno de los tratamientos fue cero. El análisis de varianza para la variable daño dió diferencia significativa (F = 9.17; Gl = 41; P < 0.00001). Asimismo, se procedió a realizar el análisis de varianza para la variable porcentaje de supervivencia de las ninfas y se encontró diferencia significativa (F= 9.42; Gl = 41; P < 0.00001). Estos resultados indicaron que, con relación a las variables evaluadas, al menos uno o varios genotipos se comportaron mejor que los testigos susceptibles y/o fueron superiores o iguales que los testigos resistentes (Tabla 1).
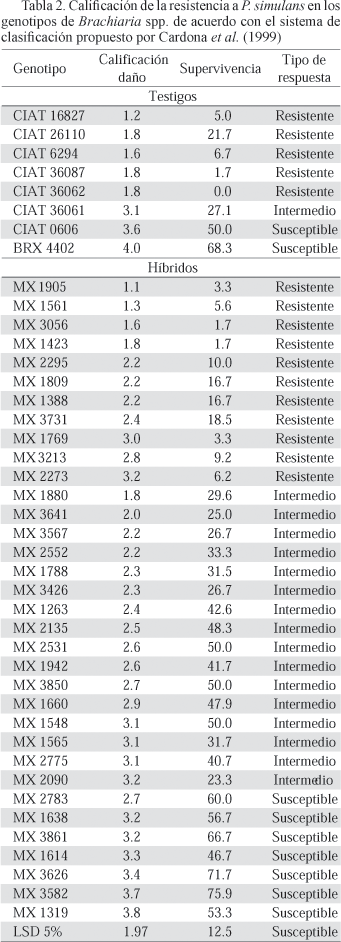
Al utilizar el criterio de selección propuesto por Cardona et al. (1999) se pudo hacer una calificación de resistencia en los diferentes genotipos (Tabla 2). El resultado de este enfoque mostró nueve genotipos susceptibles, 17 con resistencia intermedia y 16 resistentes. Entre los genotipos susceptibles se detectaron híbridos MX con calificaciones similares o superiores que los testigos susceptibles CIAT 0606 y BRX 4402 para las dos variables evaluadas. Por otro lado, en el grupo de genotipos resistentes se observaron 11 genotipos MX con calificaciones similares o iguales a los testigos resistentes. En este grupo sobresalieron los híbridos MX 1905, MX 1561, MX 3056 y MX 1423.
Al hacer una gráfica con las variables daño y porcentaje de supervivencia se pudo visualizar mejor la calificación de resistencia para los diferentes genotipos (Fig. 2). En la gráfica se observan 16 puntos en el cuadrante inferior izquierdo. Estos corresponden a cinco testigos resistentes y los 11 genotipos calificados como resistentes al ataque de P. simulans. También, esta gráfica permitió la clasificación de los genotipos de acuerdo a los diferentes mecanismos que gobiernan la resistencia en Brachiaria spp. Para los 16 genotipos anteriores puede mencionarse que poseen el mecanismo de defensa llamado de antibiosis a causa de la baja supervivencia de ninfas, lo cual se tradujo en bajas calificaciones de daño. Los genotipos en el cuadrante superior izquierdo se clasificaron como tolerantes por tener alta supervivencia de ninfas pero baja calificación de daño en comparación a los testigos susceptibles. Los genotipos que están en los otros dos cuadrantes son clasificados como susceptibles por presentar alta calificación de daño y alta supervivencia (Painter 1968, Smith 1989, Panda & Khush 1995, Cardona et al. 1999). También, Cardona et al. (2004) indican que los genotipos CIAT 36062 y CIAT 6294 pueden expresar el mecanismo de tolerancia cuando son atacados por las especies Z. carbonaria y Z. pubescens mientras que son resistentes al ataque de las especies A. varia y M. trifissa por el mecanismo de antibiosis. Según este análisis, puede decirse que el mecanismo que rige la resistencia en los genotipos MX resistentes es el de antibiosis pero que también existen genotipos en los cuales el mecanismo que se expresa es el de tolerancia.
Panda & Khush (1995) expresan que el objetivo fundamental de todo programa de fitomejoramiento, en la mayoría de los cultivos, es obtener genotipos resistentes. Entonces, el resultado de seleccionar genotipos resistentes a P. simulans es muy importante porque se puede continuar con el trabajo de fitomejoramiento para otros atributos agronómicos deseables en los híbridos MX, junto con la resistencia varietal a las otras especies de salivazo de importancia económica en México tales como A. albofasciata (Lallemand) y A. contigua (Walker) (CIAT 2004). Además, los genotipos MX resistentes a P. simulans tienen calificaciones muy cercanas para las variables evaluadas (daño y supervivencia) al de los testigos resistentes CIAT 6294 y CIAT 36062, pero también a los genotipos e híbridos de Brachiaria que en el CIAT se han observado como resistentes a otras especies colombianas de salivazo durante varios años de evaluación (CIAT 2004).
Al cumplir el objetivo fundamental de obtener genotipos resistentes a la especie de interés, se podrán reducir las pérdidas ocasionadas por el insecto, una vez que se logre la liberación de un genotipo superior a los que hay disponibles en el mercado. Con la ventaja de poder integrar la resistencia varietal como un pilar importante en el manejo integrado del salivazo para los géneros y especies de Aeneolamia, Mahanarva, Zulia y con el conocimiento de la nueva información para el género y especies de Prosapia. Además, se coincide con lo expresado por Valério & Koller (1993) y Cardona et al. (2004) en el sentido de que es deseable que este genotipo tenga como mecanismo de defensa la antibiosis. Un genotipo antibiotico interfiere con el desarrollo y la supervivencia así como con el potencial reproductivo del salivazo y causa disminución en el daño de los pastizales, disminución en el impacto ambiental así como un aumento en las ganancias para los ganaderos. Si bien la tolerancia es un mecanismo deseable, no es el más adecuado para un insecto que ocupa millones de hectáreas en un cultivo perenne como es la Brachiaria. En este sentido, Ferrufino & Lapointe (1989), Lapointe et al. (1992), Valério et al. (2001) y Cardona et al. (2004) coinciden en que la tolerancia es un mecanismo riesgoso porque podría originar poblaciones muy altas de salivazo que abrumarían la resistencia. Estos autores citan los casos de cultivares de Brachiaria tolerantes a salivazo que fueron liberados en Colombia y Brasil. El resultado final en amplias zonas fue un crecimiento enorme de la población de salivazo que terminó con dar al traste con la tolerancia. Se concuerda entonces con Cardona et al (2004) quienes postulan la necesidad de desarrollar híbridos antibióticos a ninfas de salivazo que tengan en lo posible tolerancia al daño causado por adultos.
Agradecimientos
En CIAT-Colombia, a Carlos Lascano, líder del proyecto de Forrajes y Leguminosas Tropicales, Beatriz Arenas, Guillermo Sotelo, Gilberto Córdoba, Reinaldo Pareja, Paola Andrea Sotelo e Isaura Rodríguez (Entomología de Fríjol). En México a Andrei Nicolayevsky, Eduardo Stern, Eduardo Sáenz y Rodolfo Ruiz de Semillas Papalotla S.A. de C.V. y a los Profesores Celina Llanderal-Cazares, Jorge Valdéz-Carrasco y José López-Collado en el Colegio de Postgraduados. En la Universidad de Cornell-USA a Daniel C. Peck y Anuar Morales.
Received 07/III/06. Accepted 07/II/07.
- Analytical Software. 2000. Statistis7. User's manual. Analytical Software. Tallahassee, Florida, 359p.
- Cardona, C., J.W. Miles & G. Sotelo. 1999. An improved methodology for massive screening of Brachiaria spp. genotypes for resistance to Aeneolamia varia (Homoptera: Cercopidae). J. Econ. Entomol. 92: 490-496.
- Cardona, C., G. Sotelo, A. Pabón, P. Fory & J. Miles. 2002. The effect of mixed infestations on resistance expression. http://www.ciat.cgiar.org/forrajes/pdf/output2_2002.pdf (consultado el 15 julio 2007).
- Cardona, C., P. Fory, G. Sotelo, A. Pabón, G. Díaz & J.W. Miles. 2004. Antibiosis and tolerance to five species of spittlebug (Homoptera: Cercopidae) in Brachiaria spp.: implications for breeding for resistance. J. Econ. Entomol. 97: 635-445.
- Carvalho, G.S. & M.D. Webb. 2005. Cercopid spittle bugs of the New World (Hemiptera, Auchenorrhyncha, Cercopidae). Pensoft Series Faunistica No. 49. Sofia-Moscow. 280p.
- CIAT. 2001. Establishment of crossing blocks at CIAT - Popayán. http://www.ciat.cgiar.org/forrajes/pdf/output2.pdf, (consultado el 13 de octubre de 2005).
- CIAT. 2004. Annual report 2004, Project IP-5. Tropical grasses and legumes: Optimizing genetic diversity for multipurpose use.CIAT, Cali, Colombia. 233p.
- EMBRAPA. 2006. Morte de capim-marandu. Empresa Brasileira de Pesquisa Agropecuária, Centro Nacional de Pesquisa de Gado de Corte, EMBRAPA/CNPGC. Campo Grande, MS, Brazil, 288p.
- Fennah, R.G. 1953. Revisionary notes on neotropical monecphorene Cercopoidea (Homoptera). Ann. Magaz. Nat. Hist., Series 12 6: 337-360.
- Ferrufino, A. & S.L. Lapointe. 1989. Host plant resistance in Brachiaria grasses to the spittlebug Zulia colombiana Entomol. Exp. Appl. 51: 155-162.
- Gilbertson, R.L., M.R. Rojas, D. Russell & D.P. Maxwell. 1991. The use of the asymmetric polymerase chain reaction and DNA sequencing to determinate genetic variability among isolates of bean golden mosaic geminivirus in the Dominican Republic. J. Gen. Virol. 72: 2843-2848.
- Hamilton, K.G.A. 1977. Review of the world species of Prosapia Fennah (Rhynchota: Homoptera: Cercopidae). Can. Entomol. 109: 621-630.
- Holmann, F. & D.C. Peck. 2002. Economic damage cause by spittlebug (Homoptera: Cercopidae) in Colombia: A first approximation of impact on animal production in Brachiaria decumbens pastures. Neotrop. Entomol. 31: 275-284.
- Lapointe, S. L., M.S. Serrano, G.L. Arango, G. Sotelo & F. Córdoba. 1992. Antibiosis to spittlebugs (Homoptera: Cercopidae) in accessions of Brachiaria spp. J. Econ. Entomol. 85: 1485-1490.
- Miles, J.W., C.B. do Valle, I. Rao & V.P.B. Euclides. 2004. Brachiariagrasses. Warm Season (C4) Grasses, p.745-783. In American Society of Agronomy, Crop Science Society of America, and Soil Science Society of America. Segoe Rd. Madison.Wisconsin, 1171p.
- Painter, R.H. 1968. Insect resistance in crop plants. McMillan, New York, 520p.
- Panda, N. & G.S. Khush. 1995. Host plant resistance to insects. CAB International in association with the International Rice Research Institute (IRRI), Wallingford, 431p.
- Peck, D.C. 2001. Diversidad y distribución geográfica del salivazo (Homoptera: Cercopidae) asociado con gramíneas en Colombia y Ecuador. Rev. Colomb. Entomol. 27: 129-136.
- Peck, D., U. Castro, F. López, A. Morales & J. Rodríguez. 2001. First record of the sugar cane and forage grass pest, Prosapia simulans (Homoptera: Cercopidae), from South America. Fla. Entomol. 84: 402-409.
- SAGARPA. 2005. http://www.sagarpa.gob.mx/cgcs/boletines/2005/junio/B184.htm (consultado el 23 de agosto de 2005).
- Smith, C.M. 1989. Plant resistance to insects: A fundamental approach. John Wiley and Sons, N.Y., 286p.
- Suárez-Domínguez, H. & Q. López-Tirado. 2005. La ganadería bovina productora de carne en México. Situación actual. http://agrinet.tamu.edu/trade/papers/hermilo.pdf (consultado el 23 de agosto de 2005).
- Valério, J.R., C. Cardona, D.C. Peck & G. Sotelo. 2001. Spittlebugs: Bioecology, host plant resistance and advances in IPM, p.217-221 In Proceedings 19th International Grassland Congress, 11-21 February 2001, São Pedro, São Paulo, Brazil.
- Valério, J.R. & O. Nakano. 1988. Dano causado pelo adulto da cigarrinha Zulia entreriana na producão e qualidade de Brachiaria decumbens Pesq. Agropec. Bras. 23: 447-453.
- Valério, J.R., S.L. Lapointe, S. Kelemu, C. Fernandez & F. Morales. 1996. Pests and diseases of Brachiaria species, p.87-105. In J.W. Miles, B.L. Maass & C.B. do Valle (eds.), Brachiaria: Biology, agronomy, and improvement. Centro Internacional de Agricultura Tropical, CIAT, Cali and Empresa Brasileira de Pesquisa Agropecuária, Centro Nacional de Pesquisa de Gado de Corte, EMBRAPA/CNPGC, Campo Grande, MS, Brazil, 288p.
- Valério, J.R. & W.W. Koller. 1993. Proposição para manejo integrado das cigarrinha-das-pastagens. Past. Trop. 15: 10-16.
- Walker, F. 1858. List of the specimens of Homopterous insects in the collection of the British Museum, Supplement. London, p.1-307.
Fechas de Publicación
-
Publicación en esta colección
02 Oct 2007 -
Fecha del número
Ago 2007
Histórico
-
Acepto
07 Feb 2007 -
Recibido
07 Mar 2006