Resumos
Este estudo avaliou os efeitos de remanescentes de Mata Atlântica no controle biológico natural de Euselasia apisaon (Dahman) pelo parasitóide Trichogramma maxacalii (Voegelé e Pointel) em plantios de Eucalyptus. O número de ovos de E. apisaon por folha foi maior no centro que nas bordas dos talhões (23,5 ± 7,61 versus 14,8 ± 3,14), mas o padrão inverso foi observado para as taxas de parasitismo (72,4% no centro e 80,5% na borda). Os resultados sugerem que a regulação natural de E. apisaon por T. maxacalii pode ser aumentada com a preservação de fragmentos de vegetação nativa no entorno de plantios de eucalipto.
Eucalyptus; controle de pragas; desfolhador; parasitóde; conservação da biodiversidade
This study evaluated the effects of Atlantic Rain Forest remnants on the natural biological control of Euselasia apisaon (Dahman) by the parasitoid Trichogramma maxacalii (Voegelé e Pointel) in Eucalyptus plantations. The number of E. apisaon eggs/leaf was higher in the center than in the edge of the plantations (23.5 ± 7.61 vs. 14.8 ± 3.14), but parasitism showed the reversed pattern (72.4% in the center and 80.5% in the edge). The results indicated that natural regulation exerted by T. maxacalii on populations of E. apisaon may be enhanced by the preservation of fragments of native vegetation surrounding Eucalyptus plantations.
Eucalyptus; pest control; defoliator; parasitoid; biodiversity conservation
SCIENTIFIC NOTE
Efeitos de remanescentes de Mata Atlântica no controle biológico de Euselasia apisaon (Dahman) (Lepidoptera: Riodinidae) por Trichogramma maxacalii (Voegelé e Pointel) (Hymenoptera: Trichogrammatidae)
Influence of Atlantic Rain Forest remnants on the biological control of Euselasia apisaon (Dahman) (Lepidoptera: Riodinidae) by Trichogramma maxacalii (Voegelé e Pointel) (Hymenoptera: Trichogrammatidae)
Aline F. MurtaI; Fabrício T.O. KerI; Dalbert B. CostaI; Mário M. Espírito-SantoII; Maurício L. FariaII
ILab. Controle Biológico de Pragas, Centro Universitário do Leste de Minas Gerais UnilesteMG Av Tancredo Neves, 3500, Bairro Universitário, 35170-056, Coronel Fabriciano, MG
IIDepto. Biologia Geral, Centro de Ciências Biológicas e da Saúde, Univ. Estadual de Montes Claros C. postal 126, 39401-089, Montes Claros, MG
RESUMO
Este estudo avaliou os efeitos de remanescentes de Mata Atlântica no controle biológico natural de Euselasia apisaon (Dahman) pelo parasitóide Trichogramma maxacalii (Voegelé e Pointel) em plantios de Eucalyptus. O número de ovos de E. apisaon por folha foi maior no centro que nas bordas dos talhões (23,5 ± 7,61 versus 14,8 ± 3,14), mas o padrão inverso foi observado para as taxas de parasitismo (72,4% no centro e 80,5% na borda). Os resultados sugerem que a regulação natural de E. apisaon por T. maxacalii pode ser aumentada com a preservação de fragmentos de vegetação nativa no entorno de plantios de eucalipto.
Palavras-chave:Eucalyptus, controle de pragas, desfolhador, parasitóde, conservação da biodiversidade
ABSTRACT
This study evaluated the effects of Atlantic Rain Forest remnants on the natural biological control of Euselasia apisaon (Dahman) by the parasitoid Trichogramma maxacalii (Voegelé e Pointel) in Eucalyptus plantations. The number of E. apisaon eggs/leaf was higher in the center than in the edge of the plantations (23.5 ± 7.61 vs. 14.8 ± 3.14), but parasitism showed the reversed pattern (72.4% in the center and 80.5% in the edge). The results indicated that natural regulation exerted by T. maxacalii on populations of E. apisaon may be enhanced by the preservation of fragments of native vegetation surrounding Eucalyptus plantations.
Key words:Eucalyptus, pest control, defoliator, parasitoid, biodiversity conservation
Atualmente, a preocupação com os impactos da substituição de formações vegetais nativas por monoculturas tem levado à pesquisa e desenvolvimento de técnicas que visem manter a produção agrícola com o menor impacto possível ao meio ambiente (Burel et al. 1998).
Há muitas evidências de que a preservação da biodiversidade dentro e no entorno de agroecossistemas tem um papel fundamental na manutenção das dinâmicas populacionais de inimigos naturais de pragas (Altieri 1999). O controle biológico natural baseia-se no aumento da heterogeneidade e diversidade do agroecossistema, que diminuem a concentração de recursos para as pragas (Root 1973) e aumentam a riqueza e eficácia de inimigos naturais, devido a melhores condições climáticas e existência de locais de forrageamento, descanso e oviposição (Andow 1991, Altieri et al. 1993, Thies et al. 2003). Dessa forma, o manejo da estrutura da paisagem agrícola, com a manutenção de áreas nativas no entorno de cultivos, pode ser uma excelente estratégia de controle biológico, uma vez que não implica em gastos com a importação, criação massal e liberação de inimigos naturais. Além disso, aumenta a preservação da vegetação nativa, diminuindo o desmatamento e vários outros impactos ambientais decorrentes dessa atividade.
Este estudo teve como objetivo verificar se a presença de remanescentes de Mata Atlântica no entorno de plantios de eucalipto afeta as taxas de infestação de Euselasia apisaon (Dahman) e de parasitismo de seus ovos. Essa borboleta nativa é comumente encontrada em eucaliptais, onde é considerada praga em épocas de surtos populacionais, mais comuns durante a estação seca do ano (Santos et al. 1996). Seus ovos são comumente parasitados por Trichogramma maxacalii (Voegelé e Pointel), que possui potencial para infligir alta mortalidade à essa borboleta (Oliveira et al. 2000).
O estudo foi realizado entre maio e junho de 2005, em plantios de Eucalyptus grandis Hill ex Maiden (Myrtaceae) da Cenibra SA. no município de Belo Oriente, MG. A vegetação original na região é de mata estacional semi-decídua, pertencente ao bioma Mata Atlântica. A temperatura anual média é de 24,7ºC e a precipitação anual média é de cerca de 1.220 mm (Estação Meteorológica da Cenibra SA, Belo Oriente).
Foram escolhidos dois talhões de eucalipto de mesma idade (~5 anos) e de mesma área (15 ha), ambos parcialmente em contato com remanescentes de Mata Atlântica em suas bordas. Com o auxílio de GPS, o centro de cada talhão foi demarcado, bem como o ponto central da zona de contato do talhão com a mata nativa. Em cada uma das quatro áreas (centro e borda de dois talhões), foram marcadas aleatoriamente 15 árvores de E. grandis, distantes entre si por pelo menos 10 metros. Nas árvores marcadas, o ramo mais baixo foi coletado, ensacado e levado ao laboratório para contagem do número de folhas em cada ramo e do número de ovos em cada postura de E. apisaon.
As posturas com todos os ovos já eclodidos foram utilizadas para determinar a taxa de parasitismo de ovos de E. apisaon. Quando eclodidos, os ovos parasitados podem ser facilmente diferenciados dos ovos sadios pelo furo de emergência deixado pelos parasitóides, diferente daquela deixado pelas lagartas. As lagartas comem toda a parte superior do ovo e deixam uma casca transparente ao sair dos ovos. Já os parasitóides escavam um furo pequeno na parte superior do ovo e, após sua saída, a casca permanece negra com um halo cinza na parte superior (Fig. 1). Todos os parasitóides e lagartas capturados foram identificados até o menor nível taxonômico possível. Para verificar os efeitos dos remanescentes de vegetação nativa no controle biológico desta praga, o número de ovos de E. apisaon por folha de E. grandis foi comparado entre centro e borda dos plantios através de teste t de Student (Zar 1996). Essa variável foi normalizada através de transformação em logaritmo. A taxa de parasitismo por postura foi comparada entre áreas através de teste U de Mann-Whitney (Zar 1996), uma vez que essa variável não apresentou distribuição normal.
A ocorrência de parasitismo dependente da densidade de ovos em E. apisaon foi verificada em duas escalas: posturas e ramos. Na primeira escala, foram realizadas análises de correlação de Spearman (Zar 1996) entre a taxa de parasitismo dos ovos em cada postura e o número total de ovos por postura. Posteriormente, os ovos foram agrupados por ramo e foi verificada a relação entre a taxa de parasitismo e o número total de ovos por ramo, através de correlação de Spearman (Zar 1996). Em ambas as escalas, essas análises foram adotadas porque os dados não apresentaram distribuição normal.
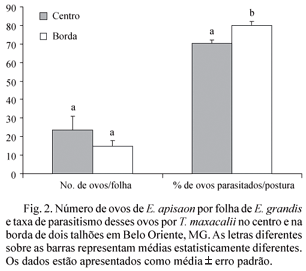
Em 60 ramos de E. grandis coletados, foram encontrados 88.925 ovos em 2.008 posturas de E. apisaon (44,3 ± 5,38 ovos por postura). Foram encontrados, em média, 19,2 ± 4,12 ovos por folha. Considerando os dois talhões juntos, o centro apresentou 43.813 ovos e a borda apresentou 45.112 ovos. O número de ovos por folha foi 1,6 vez maior no centro que nas bordas dos talhões (Fig. 2), apesar de a diferença não ter sido estatisticamente significativa (teste t de Student, P > 0,05, GL = 58, t = -0,012). Do total de ovos, 51.202 (57,6%) larvas já tinham eclodido ou eclodiram durante a triagem, permitindo a determinação de sua sobrevivência ou parasitismo e a captura de lagartas e parasitóides adultos no momento da eclosão. Destes, 36.085 (70,5%) estavam parasitados. Todos os parasitóides adultos obtidos a partir desses ovos pertenciam à espécie T. maxacalii.
As taxas de parasitismo observadas neste estudo em condições de campo podem ser consideradas altas. Em um estudo realizado em laboratório com ovos de Anagasta kuehniella (Zeller) (Lepidoptera: Pyralidae), um hospedeiro alternativo de T. maxacalii, foram observadas taxas de parasitismo entre 63,1% e 76,9% (Oliveira et al. 2000). Considerando apenas as 836 posturas, das quais todas as larvas haviam eclodido, a taxa média de parasitismo por postura foi de 73,8 ± 1,4%. Nas posturas localizadas na borda de plantios com vegetação nativa, a eficiência de T. maxacalii foi ainda maior, com a taxa média de parasitismo de 80,5% (Fig. 2).
A taxa média de parasitismo dos ovos por postura foi significativamente maior na borda dos talhões de eucalipto com a Mata Atlântica do que no centro deles (Fig. 2; Mann-Whitney U test, U = 62044,5, P < 0,001). Vários estudos já descreveram maior abundância e diversidade de parasitóides em plantios com maior heterogeneidade ambiental (Altieri et al. 1993, Altieri 1999, Thies et al. 2003). Parasitóides adultos alimentam-se de substâncias açucaradas, como néctar (Vinson & Barbosa 1987), e certamente encontram maior disponibilidade de alimento em fragmentos de Mata Atlântica com alta diversidade de espécies vegetais do que no centro de uma monocultura. Além disso, a longevidade e a fecundidade de fêmeas de parasitóides são expressivamente aumentadas quando recebem alimentação adicional. Oliveira e colaboradores (2000, 2003) demonstraram experimentalmente que adultos de T. macaxalii alimentados com mel apresentaram maiores taxas de parasitismo e longevidade que parasitóides não-alimentados. Desta forma, é bastante provável que a eficiência de parasitóides nas bordas seja maior que no centro de plantios, devido à maior quantidade de alimento encontrada em espécies vegetais nativas da Mata Atlântica.
A importância da manutenção de remanescentes de vegetação nativa no controle biológico de pragas de eucalipto já foi evidenciada em outros estudos no Brasil. Em floresta de eucalipto no norte do Espírito Santo, Bragança e colaboradores (1998a e 1998b) demonstraram que a diversidade de adultos de lepidópteros desfolhadores é menor e a diversidade de himenópteros parasitóides é maior em plantios de E. grandis e E. saligna mais próximos de fragmentos de Mata Atlântica. A mesma tendência foi observada para adultos de Oxydia vesulia (Cramer) (Lepidoptera: Geometridae) (Santos et al. 2002) e para Lepidoptera em geral (Zanuncio et al. 1998) em E. cloeziana no cerrado brasileiro.
O número de ovos de E. apisaon apresentou grande variação entre posturas (de um a 173 ovos) e entre ramos (10 a 7.905 ovos), mas o parasitismo foi independente da densidade em ambas as escalas tanto no centro como na borda dos talhões (teste de correlação de Spearman, P > 0,05 para todas as análises). O fato de o parasitismo de E. apisaon por T. maxacalii não ser dependente da densidade na população analisada não torna esse parasitóide menos adequado para programas de controle biológico. Há considerável controvérsia sobre a necessidade de processos dependentes da densidade para a regulação bem-sucedida de populações de insetos por parasitóides (Stiling 1987, Brown 1989, Matsumoto et al. 2004).
Apesar de ainda faltarem dados sobre a mortalidade de pupas e adultos, as taxas de parasitismo dos ovos de E. apisaon mostraram que T. maxacalii exerce um importante papel na regulação natural desse herbívoro. Esses resultados reforçam a necessidade de se conhecer a biologia de parasitóides e hospedeiros e sua dinâmica populacional em campo para o delineamento de estratégias de controle biológico. O manejo do entorno dos plantios de eucalipto, com a preservação de remanescentes de vegetação nativa, pode ser uma alternativa melhor que a criação do parasitóide em laboratório e sua posterior liberação em campo. Além disso, essa estratégia de "controle biológico conservacionista" (Landis et al. 2000, Kean et al. 2003) pode trazer várias outras vantagens: manutenção de outras pragas de eucaliptais em baixas densidades; preservação da biodiversidade em ecossistemas extremamente ameaçados, como a Mata Atlântica; estabelecimento de corredores de fauna; e preservação de diversos serviços do ecossistema, como prevenção de erosão, seqüestro de carbono e manutenção da qualidade da água e do solo.
Agradecimentos
Agradecemos à Celulose Nipo-Brasileira CENIBRA SA. pelo apoio logístico, em especial a Alex Giovanny de Barros Medeiros e Osvaldo Navegante Câncio.
Received 07/XI/06. Accepted 21/IV/07.
- Altieri, M.A. 1999. The ecological role of biodiversity in agroecosystems. Agric. Ecosyst. Environ. 74: 19-31.
- Altieri, M.A., J.R. Cure & M.A. Garcia. 1993. The role of enhancement of parasitic Hymenoptera biodiversity in agroecosystems, p. 257-275. In J. LaSalle & I.D. Gauld (eds.), Hymenoptera and biodiversity. Wallingford, CAB International, 348p.
- Andow, D.A. 1991. Vegetational diversity and arthropod population response. Annu. Rev. Entomol. 36: 561-586.
- Bragança, M.A.L., J.C. Zanuncio, M. Picanço & A.J. Laranjeiro. 1998a. Effects of environmental heterogeneity on Lepidoptera and Hymenoptera populations in Eucalyptus plantations in Brazil. For. Ecol. Manag. 103: 287-292.
- Bragança, M.A.L., O. DeSouza & J.C. Zanuncio. 1998b. Environmental heterogeneity as a strategy for pest management in Eucalyptus plantations. For. Ecol. Manag. 102: 9-12.
- Brown, M.W. 1989. Density-dependence in insect host-parasitoid systems: a comment. Ecology 70: 776-779.
- Burel, F., J. Baudry, A. Butet, P. Clergeau, Y. Delettre, D. Le Coeur, F. Dubs, N. Morvan, G. Paillat, S. Petit, C. Thenail, E. Brunel & J.C. Lefeuvre. 1998. Comparative biodiversity along a gradient of agricultural landscapes. Acta Oecol. 19: 47-60.
- Kean, J., S. Wratten, J. Tylianakis & N. Barlow. 2003. The population consequences of natural enemy enhancement, and implications for conservation biological control. Ecol. Lett. 6: 604-612.
- Landis, D.A., S.T. Wratten & G.M. Gurr. 2000. Habitat management to conserve natural enemies of arthropod pests in agriculture. Annu. Rev. Entomol. 45: 175-201.
- Matsumoto, T., T. Itioka & T. Nishida. 2004. Is spatial density-dependent parasitism necessary for successful biological control? Testing a stable host-parasitoid system. Entomol. Exp. Appl. 110: 191-200.
- Murdoch, W.W., J.D. Reeve, C.B. Huffaker & P.LC.E. Kennett. 1984. Biological control of olive scale and its relevance to ecological theory. Am. Nat. 123: 371-392
- Oliveira, H.N., J.C. Zanuncio, D. Pratissoli & I. Cruz. 2000. Parasitism rate and viability of Trichogramma maxacalii (Hym.: Trichogrammatidae) parasitoid of the Eucalyptus defoliator Euselasia apison (Lep.: Riodinidae), on eggs of Anagasta kuehniella (Lep.: Pyralidae). For. Ecol. Manag. 130: 1-6.
- Oliveira, H.N., J.C. Zanuncio, D. Pratissoli & M.C. Picanço. 2003. Biological characteristics of Trichogramma maxacalii (Hymenoptera: Trichogrammatidae) on eggs of Anagasta kuehniella (Lepidoptera: Pyralidae). Braz. J. Biol. 63: 647-653.
- Ruberson J.R., M.J. Tauber, C.A. Tauber & B. Gollands. 1991. Parasitization by Edovum puttleri (Hymenoptera: Eulophidae) in relation to host density in the field. Ecol. Entomol. 16: 81-89.
- Santos, G.P., J.C. Zanuncio & T.V. Zanuncio. 1996. Pragas do eucalipto. Inf. Agropec. 18: 63-71.
- Santos, G.P., T.V. Zanuncio, E. Vinha & J.C. Zanuncio. 2002. Influência de faixas de vegetação nativa em povoamentos de Eucalyptus cloeziana sobre a população de Oxydia vesulia (Lepidoptera: Geometridae). Rev. Árvore 26: 499-504.
- Stiling, P.D. 1987. The frequency of density-dependence in insect host-parasitoid systems. Ecology 68: 844-856.
- Thies, C., I. Steffan-Dewenter & T. Tscharntke. 2003. Effects of landscape context on herbivory and parasitism at different spatial scales. Oikos 101: 18-25.
- Thorarinsson, K. 1990. Biological control of the cottony-cushion scale: Experimental tests of the spatial density-dependence hypothesis. Ecology 71: 635644.
- Vinson, S.B. & P. Barbosa. 1987. Interrelationship of nutritional ecology of parasitoids, p.673-693. In F. Slansky Jr. & J.G. Rodriguez (eds.), Nutritional ecology of insects, mites, spiders and related invertebrates. New York, John Wiley & Sons, 1016p.
- Zanuncio, J.C., J.A. Mezzomo, R.N.C. Guedes & A.C. Oliveira. 1998. Influence of native vegetation on Lepidoptera associated with Eucalyptus cloeziana in Brazil. For. Ecol. Manag. 108: 85-90.
- Zar, J.H. 1996. Biostatistical analysis. Englewood Cliffs, Prentice-Hall, 662p.
Datas de Publicação
-
Publicação nesta coleção
14 Maio 2008 -
Data do Fascículo
Abr 2008
Histórico
-
Aceito
21 Abr 2007 -
Recebido
07 Nov 2006