Resumos
O monitoramento da suscetibilidade de pragas a praguicidas é essencial para programas de manejo da resistência. O objetivo deste trabalho foi verificar a variabilidade genética de populações de Bemisia tabaci (Gennadius), oriundas de diferentes áreas agrícolas, quanto a suscetibilidade a inseticidas no Brasil, por meio de dois testes diferentes. Quatro populações de mosca-branca foram testadas em relação a uma população suscetível de referência (SusIAC); duas oriundas de Goiás (GO-1 e GO-2) e outras duas da Bahia (BA-1 e BA-2). Uma técnica de bioensaio do tipo contato residual foi empregada para realização dos testes: 1) teste diagnóstico da resistência; e 2) teste para obtenção das linhas de suscetibilidade das populações. Os produtos utilizados foram acetamipride, imidaclopride, tiametoxam, clorpirifós e endosulfam. Utilizaram-se insetos adultos não separados por sexo e nem por idade nos testes. As avaliações foram realizadas em 24h, para o teste com endosulfam, e em 48h, para os demais produtos. Ambos os testes revelaram variabilidade genética quanto à suscetibilidade de mosca-branca aos inseticidas. No entanto, a discriminação entre as populações de B. tabaci foi mais evidente com o uso de testes diagnósticos. A população GO-2 foi significativamente menos suscetível aos produtos testados que a SusIAC, principalmente em relação aos neonicotinóides. A situação mais crítica de resistência de mosca-branca foi com tiametoxam, seguida pelo imidaclopride.
Mosca-branca; biótipo B; linha básica de referência; controle químico; manejo da resistência
Monitoring the susceptibility of a pest population to pesticides is essential for resistance management programs. The objective of this research was to evaluate the genetic variability in pesticide susceptibility in populations of Bemisia tabaci (Gennadius) collected from different Brazilian agricultural regions through the use of two different tests. Four whitefly populations, two from Goiás state (GO-1 and GO-2) e two from Bahia state (BA-1 and BA-2), were tested against a susceptible reference one (SusIAC). A residual contact bioassay was used to evaluate the pesticide susceptibility of each population by using diagnostic concentration bioassays and by estimating the baseline susceptibility data to each one of the tested insecticides, acetamiprid, imidacloprid, thiamethoxam, chlorpyrifos and endosulfan. Adult insects of unknown age and sex were tested. Evaluations were performed after 24h for endosulfan and 48h for the other chemicals. Both procedures showed significant differences in the susceptibility to the pesticides among B. tabaci populations. However, the discrimination among B. tabaci populations was more evident with the use of diagnosis tests. The population GO-2 was significantly less susceptible to the tested pesticides than SusIAC, mainly to neonicotinoids. The most critical resistance situation of B. tabaci was detected to thiamethoxam, followed by imidacloprid.
Whitefly; biotype B; baseline susceptibility; chemical control; monitoring resistance
CROP PROTECTION
Monitoramento da suscetibilidade a inseticidas em populações de Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae) no Brasil
Monitoring the susceptibility to insecticides in Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae) populations from Brazil
Leonardo D SilvaI; Celso OmotoII; Ervino BleicherI; Patrick M DouradoII
IUniv. Federal do Ceará, Mister Hull, 2977, Campus do Pici, Bloco 805, 60021-970, Fortaleza, CE; dantasleo@yahoo.com.br, ervino@ufc.br
IILab. Resistência de Artrópodes a Pesticidas, Escola Superior de Agricultura "Luiz Queiroz", Av. Pádua Dias, 11, C. Postal 9, 13418-900, Piracicaba, SP; celomoto@esalq.usp.br
RESUMO
O monitoramento da suscetibilidade de pragas a praguicidas é essencial para programas de manejo da resistência. O objetivo deste trabalho foi verificar a variabilidade genética de populações de Bemisia tabaci (Gennadius), oriundas de diferentes áreas agrícolas, quanto a suscetibilidade a inseticidas no Brasil, por meio de dois testes diferentes. Quatro populações de mosca-branca foram testadas em relação a uma população suscetível de referência (SusIAC); duas oriundas de Goiás (GO-1 e GO-2) e outras duas da Bahia (BA-1 e BA-2). Uma técnica de bioensaio do tipo contato residual foi empregada para realização dos testes: 1) teste diagnóstico da resistência; e 2) teste para obtenção das linhas de suscetibilidade das populações. Os produtos utilizados foram acetamipride, imidaclopride, tiametoxam, clorpirifós e endosulfam. Utilizaram-se insetos adultos não separados por sexo e nem por idade nos testes. As avaliações foram realizadas em 24h, para o teste com endosulfam, e em 48h, para os demais produtos. Ambos os testes revelaram variabilidade genética quanto à suscetibilidade de mosca-branca aos inseticidas. No entanto, a discriminação entre as populações de B. tabaci foi mais evidente com o uso de testes diagnósticos. A população GO-2 foi significativamente menos suscetível aos produtos testados que a SusIAC, principalmente em relação aos neonicotinóides. A situação mais crítica de resistência de mosca-branca foi com tiametoxam, seguida pelo imidaclopride.
Palavras-chave: Mosca-branca, biótipo B, linha básica de referência, controle químico, manejo da resistência
ABSTRACT
Monitoring the susceptibility of a pest population to pesticides is essential for resistance management programs. The objective of this research was to evaluate the genetic variability in pesticide susceptibility in populations of Bemisia tabaci (Gennadius) collected from different Brazilian agricultural regions through the use of two different tests. Four whitefly populations, two from Goiás state (GO-1 and GO-2) e two from Bahia state (BA-1 and BA-2), were tested against a susceptible reference one (SusIAC). A residual contact bioassay was used to evaluate the pesticide susceptibility of each population by using diagnostic concentration bioassays and by estimating the baseline susceptibility data to each one of the tested insecticides, acetamiprid, imidacloprid, thiamethoxam, chlorpyrifos and endosulfan. Adult insects of unknown age and sex were tested. Evaluations were performed after 24h for endosulfan and 48h for the other chemicals. Both procedures showed significant differences in the susceptibility to the pesticides among B. tabaci populations. However, the discrimination among B. tabaci populations was more evident with the use of diagnosis tests. The population GO-2 was significantly less susceptible to the tested pesticides than SusIAC, mainly to neonicotinoids. The most critical resistance situation of B. tabaci was detected to thiamethoxam, followed by imidacloprid.
Key words: Whitefly, biotype B, baseline susceptibility, chemical control, monitoring resistance
Desde 1991, grandes surtos da mosca-branca Bemisia tabaci (Gennadius) ocorreram em áreas agrícolas de todo o mundo (Prabhaker et al 2005). A partir de então, a espécie tem se destacado como uma das principais pragas em vários cultivos de regiões tropicais e subtropicais da África, Ásia, Europa e Américas (Ahmad et al 2002, Nauen & Deholm 2005).
A mosca-branca é capaz de provocar tanto danos diretos quanto indiretos a várias culturas de importância econômica, como por exemplo, melão, algodão, soja, feijão, tomate e diversas outras olerícolas. Causa danos diretos devido à sucção da seiva da planta, deixando-a debilitada, e devido à injeção de toxinas contida em sua saliva durante a alimentação, o que pode provocar, por exemplo, o amadurecimento irregular de tomate. Pode ainda reduzir a qualidade do produto, como a fibra de algodão, devido à excreção de substância açucarada ou honeydew (Lourenção & Nagai 1994, Ellsworth et al 1999). Indiretamente, os principais danos são ocasionados porque a mosca-branca é vetor de muitas espécies de vírus; além disso, a mosca-branca propicia condições favoráveis à fumagina, fungo que se desenvolve sobre o honeydew e que pode depreciar o valor comercial de frutos, como melão e tomate (Morales 2001, Ahmad et al 2002, Jones 2003, De Barro 2005).
O controle da praga tem dependido principalmente de inseticidas, que são aplicados praticamente durante todo o ano (Prabhaker et al 1996, Toscano et al 2001). Entretanto, estudos já confirmaram o desenvolvimento de resistência, em condições de campo ou de laboratório, de B. tabaci a inseticidas de diversos grupos químicos, tais como organofosforados (Ahmad et al 2002, Omer et al 1993a, b), carbamato (Omer et al 1993a), piretróides (Omer et al 1993a, Cahill et al 1995, Ahmad et al 2002), ciclodieno (Perry 1985, Ahmad et al 1987), reguladores de crescimento (Cahill et al 1994, 1996b, Dennehy & Williams 1997) e neonicotinóides (Cahill et al 1996a, Elbert & Nauen 2000, Dennehy et al 2005).
B. tabaci é considerada um complexo de espécies com 24 biótipos já determinados (Perring 2000). De acordo com ffrench-Constant & Roush (1990), a suscetibilidade a inseticidas pode variar dentro de um complexo de espécies. Estudos já confirmaram a suscetibilidade diferenciada a inseticidas em função do biótipo de B. tabaci ser A, B ou Q (Costa et al 1993, Dennehy et al 2005). Desta maneira, em um programa de monitoramento e manejo de resistência de B. tabaci há a necessidade de se confirmar o biótipo usado nos testes.
O manejo da resistência tem como finalidade retardar ou reverter a evolução da resistência em pragas (Omer et al 1993a). O sucesso de qualquer programa de manejo da resistência está relacionado a meios rápidos e eficientes para detectar e monitorar a resistência em populações de pragas no campo (Bush et al 1993).
Estudos sobre a determinação de linhas básicas de suscetibilidade e detecção de resistência de populações de mosca-branca a inseticidas já foram realizados em alguns países, tais como EUA, Israel, Sudão, Espanha, Reino Unido e Paquistão (Dittrich et al 1985, Prabhaker et al 1985, Abdeldaffie et al 1987, Horowitz & Ishaaya 1994, Cahill et al 1996a, Horowitz et al 2004). No Brasil, a pesquisa ainda é incipiente, apesar de a praga ser considerada de grande importância econômica em muitos cultivos. Assim sendo, o objetivo deste trabalho foi o de verificar a variabilidade genética de populações de B. tabaci de diferentes áreas agrícolas do Brasil quanto à suscetibilidade a inseticidas mediante o uso de dois tipos de teste para fins de monitoramento da resistência B. tabaci.
Material e Métodos
Populações de B.tabaci. Foram realizados bioensaios com uma população de B. tabaci suscetível de referência (SusIAC) e quatro diferentes populações de plantios comerciais, sendo as mesmas coletadas em Goiás e na Bahia, sendo uma em tomateiro de cultivo protegido (GO-2 - Hidrolândia) e as demais em campos abertos de cultivo, sendo BA-1 (São Desidério) e GO-1 (Cristalina) coletadas em feijoeiro e BA-2 (Roda Velha) em algodoeiro. A coleta foi feita através da retirada de folhas infestadas, as quais foram armazenadas em sacos plásticos, acondicionadas em caixa de isopor e transportadas imediatamente ao laboratório.
Após o recebimento, as folhas infestadas com os insetos foram transferidas para gaiolas de tela antiafídica e acrílico (40 ×40 ×50 cm) contendo quatro vasos com plantas de algodão 'Delta Opal'. Foram cultivadas duas ou três plantas de algodão por vaso, seguindo o modo de cultivo das plantas utilizadas na criação da população SusIAC.
Os insetos da população SusIAC foram provenientes de uma população criada em plantas de soja e couve no Instituto Agronômico de Campinas (IAC), Campinas, SP, que não havia sofrido nenhuma aplicação de inseticidas há pelo menos cinco anos. A população SusIAC foi mantida em plantas de algodão (Gossypium hirsutum 'Delta Opal') cultivadas em vasos da marca Nutriplan® número 4 (3,75 L) preenchidos com uma mistura de solo e substrato comercial para produção de mudas de hortaliças (Plantimax HT® - Eucatex Ltda., Paulínia, SP) na proporção de 2:3 (solo:substrato comercial) em condições de casa de vegetação. Durante o tempo de realização deste trabalho, nenhuma aplicação de inseticida foi feita sobre as plantas de criação de B. tabaci.
Para determinação do biótipo de B. tabaci, 20 a 50 insetos adultos de cada população foram enviados à Embrapa Hortaliças, Brasília, DF. A técnica empregada para a determinação foi a de amplificação de DNA via PCR (Sseruwagi et al 2005).
Bioensaios. A técnica de bioensaio utilizada foi a do tipo contato residual baseada naquela de Dittrich et al (1985) com adultos de mosca-branca. Discos de folhas do tipo trifoliada de plantas de feijão-de-porco, Canavalia ensiformis, foram usados como substrato do bioensaio. Para isso, plantas de feijão-de-porco foram cultivadas em vaso da marca Nutriplan® n. 2 (0,9 L), em condições de casa de vegetação e livre de infestação de inseto, com a mesma mistura usada para o cultivo de plantas de algodão. Folhas provenientes de plantas de feijão-de-porco com idade entre quatro e dez semanas após a germinação foram retiradas, lavadas em água corrente e imersas em água por 10 min. Em seguida, as folhas foram enxugadas com papel toalha e cortadas em forma de discos de 2,1 cm de diâmetro. Os discos foram postos sobre uma bandeja com papel toalha umedecido com água destilada, deixando-se a parte abaxial da folha em contato com o papel umedecido.
Quatro discos foliares de feijão-de-porco foram tratados por imersão (5 s) para cada concentração de um dos cinco inseticidas testados. O controle constou da imersão de quatro discos em água com surfactante. Posteriormente, os discos foram postos a secar, com a face abaxial do disco virada para cima, sobre uma bandeja forrada com folhas de papel toalha seca. Cada disco tratado foi colocado sobre uma camada de 1,2 ml de solução ágar-água a 2,8% no fundo de um tubo de vidro de fundo chato (Covadis®, Piracicaba, SP) (diâmetro = 23 mm e comprimento = 83 mm) de forma que a face adaxial do disco ficasse em contato com a solução ágar-água.
O excesso da solução ágar-água que eventualmente ficava na borda do disco foliar tratado e/ou na parede interna do tubo do bioensaio foi retirado com auxílio de uma pinça e papel higiênico, para evitar que os insetos ficassem aderidos ao mesmo e, consequentemente, evitar a mortalidade causada pela umidade no interior do tubo. Para cada inseticida, o bioensaio foi repetido três ou quatro vezes, dependendo da quantidade de insetos disponíveis.
Dentro de 4h após o preparo dos tubos de bioensaio, procedeu-se à infestação com adultos de B. tabaci. Os tubos foram tampados com um disco de papel toalha e sobre este uma lâmina de filme de PVC para auxiliar na fixação do disco de papel. Os ensaios foram conduzidos em condições controladas de temperatura de 25 ± 2ºC e fotoperíodo de 14:10 (horas de luz:escuro).
Inseticidas testados. Cinco inseticidas foram utilizados, sendo três neonicotinóides (acetamipride, imidaclopride e tiametoxam), um organofosforado (clorpirifós) e um ciclodieno (endosulfam) (Tabela 1). Para os testes diagnósticos da resistência apenas uma única concentração (concentração diagnóstica) de cada produto mais um controle foram preparadas. Para os testes com o objetivo de caracterizar as linhas de suscetibilidade, cinco a sete concentrações logaritmicamente espaçadas foram preparadas, proporcionando mortalidade entre 10% e 95%, mais um controle (água destilada). Para todas as concentrações inseticidas mais o controle de cada bioensaio foi adicionado 0,1% de surfactante (Triton®).
Testes diagnósticos da resistência. As concentrações letais para 95% da SusIAC (CL95's) dos diferentes produtos, estimadas em estudos prévios, foram usadas como concentrações diagnósticas com o objetivo de comprovar a variabilidade genética quanto à sucetibilidade das diferentes populações de B. tabaci provinientes de campo aos diferentes inseticidas em relação à população suscetível de referência (SusIAC).
As concentrações diagnósticas usadas foram: 320 ppm para acetamipride, 140 ppm para imidaclopride, 80 ppm para tiametoxam, 600 ppm para clorpirifós e 320 ppm para endosulfam. Cada bioensaio foi repetido três ou quatro vezes. O número de insetos adultos por tubo variou de 7 a 21, sendo a média de 13 insetos adultos por tubo.
Testes para obtenção das linhas de suscetibilidade das populações de campo. Foi utilizado o mesmo método de bioensaio descrito anteriormente, avaliando-se de cinco a sete concentrações de cada inseticida mais o controle. Em cada bioensaio foram utilizados três ou quatro repetições. O número de insetos adultos por tubo variou de 6 a 25, sendo a média de 11 insetos adultos por tubo.
Avaliação dos bioensaios e análise dos dados. A mortalidade foi avaliada 24h após a infestação dos discos foliares tratados nos bioensaios com o endosulfam, e 48h para os demais produtos, baseando-se nos estudos realizados por Cahill et al (1996a), Prabhaker et al (1996) e (2005) e Dennehy et al (2005). Como critério de mortalidade estabeleceu-se que, no momento da avaliação, o inseto que não apresentasse sinal de movimento ou apresentasse movimentos lentos e desordenados (moribundo), após ser tocado levemente por um pincel de cerdas finas, era considerado morto.
Os dados obtidos nos testes de diagnósticos da suscetibilidade foram submetidos à análise de variância (SAS Institute 1989), sendo as médias comparadas pelo teste de Tukey (P < 0,05). Os dados de mortalidade foram submetidos à análise de Probit, mediante o uso do programa Polo-PC (Leora Software 1987), a partir do qual foram estimadas as concentrações letais 50 (CL50) e 95 (CL95), o coeficiente angular e χ2 (valor do qui-quadrado). O valor do qui-quadrado (χ2) calculado pelo programa Polo-PC foi comparado ao valor do χ2 pré-estabelecido em tabela. Quando o valor do χ2 calculado foi igual ou menor do que o χ2 tabelado, os dados do bioensaio foram considerados adequados ao modelo probit. A diferença dos valores de CL50 ou CL95 foi considerada significativa (P < 0,05) quando não houve sobreposição dos intervalos de confiança a 95%. A razão de resistência (RR) de cada população de campo foi calculada dividindo-se a respectiva CL50 (ou CL95) pelo valor da CL50 (ou CL95) da população SusIAC.
Resultados e Discussão
Biótipo de B. tabaci. O resultado da amplificação de DNA via PCR revelou que todas as amostras de B. tabaci eram compostas pelo biótipo B. O biótipo de B. tabaci afeta sua tolerância a inseticidas, pois o biótipo B é mais tolerante a inseticidas do que o biótipo A (Guirão et al 1997), apesar de menos tolerante do que o Q (Dennehy et al 2005, Horowitz et al 2005). Dessa forma, a informação de que todas as populações de B. tabaci estudadas eram compostas pelo mesmo biótipo (B) tem importância para se afirmar que a diferença na suscetibilidade dessas populações aos inseticidas não foi influenciada pelo fator biótipo.
Diagnósticos da resistência de mosca-branca a inseticidas. Em relação à concentração diagnóstica de acetamipride, apenas a população de B. tabaci oriunda de cultivo de tomate em estufa (GO-2) diferiu significativamente da população suscetível de referência (SusIAC), com 35,6% de sobrevivência, enquanto que a sobrevivência foi de 7,8% na SusIAC. Nas demais populações, a sobrevivência variou de 17,9%, para a população BA-2, a 4,2%, para a população GO-1 (Fig 1).
Para imidaclopride, apenas a população BA-1, com sobrevivência de 18,6% dos adultos na concentração diagnóstica, foi semelhante à população SusIAC, cuja sobrevivência atingiu 9,6%. Entre as demais populações testadas com a concentração diagnóstica de imidaclopride, a sobrevivência chegou a 52,7%para a população GO-2.
No teste com tiametoxam, observou-se que a única população com sobrevivência semelhante a SusIAC (12,97% de sobrevivência) foi também BA-1, com 13,2% de sobrevivência. Entre as outras populações testadas com tiametoxam, GO-2 (população de estufa) destacou-se como a mais resistente a tiametoxam, com 82,9% de sobrevivência.
No teste com endosulfam, a população GO-1 foi a única quese mostrou semelhante a SusIAC (3,34% de sobrevivência). A população GO-2 se revelou mais resistente à concentração diagnóstica de endosulfam do que SusIAC e GO-1, porém mais sensível do que as populações oriundas da Bahia.
No teste diagnóstico com clorpirifós, todas as populações tiveram sobrevivência igual à de SusIAC (3,08%), exceto GO-2, que apresentou sobrevivência de 26,2%. Nas outras populações de B. tabaci, a sobrevivência máxima foi de 10,8% para a população BA-1.
De modo geral, a população BA-1 foi a que mais se assemelhou a SusIAC em relação a suscetibilidade às concentrações diagnósticas dos inseticidas testados. A sobrevivência de BA-1 diferiu da SusIAC somente no teste com endosulfam. A população BA-2 mostrou-se mais tolerante a dois neonicotinóides (imidaclopride e tiametoxam) e endosulfam. A população GO-1 apresentou maior tolerância a esses dois neonicotinóides e suscetibilidade semelhante a SusIAC nos testes com os demais inseticidas. Entretanto, a população GO-2 destacou-se como a população mais resistente aos inseticidas testados. Nos testes com todos os produtos, GO-2 apresentou sobrevivência superior a SusIAC, o que foi evidenciado no teste diagnóstico com tiametoxam. As maiores sobrevivências de adultos de mosca-branca foram obtidas com tiametoxam.
Linhas de suscetibilidade das populações de campo. Todos os valores de χ2 calculados estiveram dentro dos limites pré-estabelecidos, ou seja, foram inferiores aos valores de χ2 tabelados. Sendo assim, os dados analisados adequaram-se ao modelo probit (Robertson & Preisler 1992).
Os valores das CL50's de acetamipride para as populações BA-2 e GO-2 diferiram da CL50 para a SusIAC, não havendo sobreposição de seus intervalos de confiança (IC 95%) (Tabela 2). Apesar dessa diferença, a razão de resistência à CL50 da população BA-2 foi de apenas 2,0, enquanto a RR à CL50 da população GO-2 foi de 5,6. Entretanto, apenas a população BA-2 apresentou valor de CL95 diferente de SusIAC, com RR a CL95 de 3,6. Todas as populações de B. tabaci de campo e SusIAC tiveram coeficientes angulares da regressão linear inferiores a 2,0, o que, de acordo com Robertson & Preisler (1992), seria a resposta de uma população geneticamente heterogênea quanto à sua suscetibilidade ao inseticida, no caso, ao acetamipride. A obtenção de valores baixos de coeficiente angular da regressão (< 2,0) é o comportamento típico de uma população de campo e indica heterogeneidade genética de resposta para o desenvolvimento de resistência (Ahmad et al 2002).
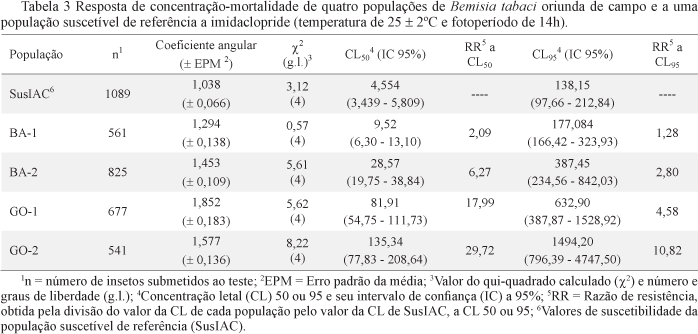
As CL50's de imidaclopride para as populações de campo diferiram da CL50 de SusIAC (Tabela 3). O imidaclopride foi menos tóxico às populações de Goiás que às da Bahia. Apesar disso, a RR da BA-1 foi relativamente baixa (RR = 2,1). As CL95's de imidaclopride para todas as populações de campo também diferiram da CL95 para SusIAC, exceto para a população BA-1. Em relação a CL95, as populações GO-2 e GO-1 foram as que apresentaram a maior razão de resistência a imidaclopride, com RR's de 10,8 e 4,6, respectivamente. Todas as linhas de suscetibilidade das populações de B. tabaci de campo e da SusIAC também apresentaram coeficientes angulares inferiores a 2,0.
Em relação à CL50 de tiametoxam, todas as populações diferiram de SusIAC e, com exceção da população BA-1, todas apresentaram elevados valores de RR (Tabela 4). A população GO-2 foi a mais resistente a tiametoxam (Tabela 4). Os coeficientes angulares também foram inferiores a 2,0 nas populações SusIAC e BA-1; porém, as demais populações apresentam valores de coeficiente angular maior que 2,0 (Tabela 4), o que indica maior homogenidade genética nas populações BA-2, GO-1 e GO-2 quanto à resposta dessas populações ao aumento na concentração do tiametoxam.
Tomando-se a CL50 de clorpirifós como parâmetro de resistência de B. tabaci, todas as populações de campo foram tão suscetíveis quanto a população SusIAC (CL50 = 246,59 ppm), apresentando baixos valores de RR (< 1,1) (Tabela 5). As RR à CL95 das populações de B. tabaci de campo apresentaram baixos valores (< 2,0). Os coeficientes angulares de todas as populações, inclusive SusIAC, foi superior a 2,0, o que reflete a homogeneidade dessas populações em relação à resposta das mesmas ao clorpirifós.
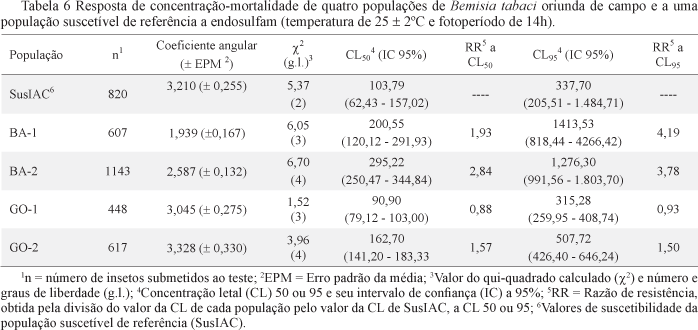
A CL50 de endolsulfan para a população BA-2 foi a única a diferir de SusIAC (Tabela 6), sendo a mesma mais tolerante do que GO-1. Em termos de CL95 de endosulfam, nenhuma das populações de campo diferiu de SusIAC. Entretanto, em relação a CL95, as populações oriundas da Bahia foram menos suscetíveis do que as populações de Goiás (Tabela 6). Os coeficientes angulares de todas as populações foi superior a 2,0, com exceção da população BA-1.
Adotando um fator mínimo de resistência (RR > 5,0), além da sobreposição nos intervalos de confiança das CL50's dos inseticidas das populações de campo em relação à CL50 de SusIAC, foram observadas similaridades entre os resultados das linhas de suscetibilidade e os obtidos nos testes diagnósticos para os três inseticidas neonicotinóides: a população BA-1 mostrou-se igualmente suscetível a SusIAC a todos os inseticidas testados; as populações BA-2 e GO-1 apresentaram indícios de problema para serem controladas com imidaclopride e tiametoxam; e a população GO-2 revelou indício de problema de resistência para ser controlada com os neonicotinóides avaliados. De acordo com as linhas de sustentabilidade, endosulfam e clorpirifós mostraram-se igualmente eficientes no controle de todas as populações, o que não foi verdadeiro nos testes diagnósticos. Entretanto, mediante os testes diagnósticos, os quais revelaram diferenças entre as populações para os dois produtos (Fig 1).
Tradicionalmente, o monitoramento da resistência de pragas a inseticidas tem envolvido a comparação de concentrações letais (por exemplo, CL50 e CL95) e coeficientes angulares entre populações suscetíveis de laboratório e de campo (ffrench-Constant & Roush 1990). Entretanto, em alguns casos, para a distinção precisa de populações suscetíveis das supostamente resistentes, o uso de CL's e coeficientes angulares tem sido ineficiente quando comparado aos testes diagnósticos, por serem, tanto as CL's quanto os coeficientes angulares, insensíveis a pequenas mudanças na freqüência de indivíduos resistentes, particularmente no início da evolução da resistência, ou seja, quando a frequência de resistência ainda é baixa (Roush & Miller 1986). Outras desvantagens do uso de CL50's são o tempo e o número de indivíduos usados para obtenção desses valores (Halliday & Burnham 1990). O tempo para a obtenção dos resultados de testes diagnósticos é mais curto do que para obtenção dos valores de CL's e coeficientes angulares. Nos testes diagnósticos todos os indivíduos são testados numa determinada concentração, não sendo desperdiçados indivíduos com outras concentrações, cujas percentagens de mortalidade não seriam de interesse (ffrench-Constant & Roush 1990). Em termos práticos, o teste diagnóstico poderia ser usado para indicar a suscetibilidade de populações de B. tabaci, principalmente numa situação em que há restrição de tempo e de insetos disponíveis para realização de outros tipos de testes.
A mais provável causa de as populações de campo terem apresentado diferença em relação a SusIAC é que as populações de campo sofreram pressão de seleção local com o intenso uso de inseticidas, principalmente de neonicotinóides. A região de Barreiras, na Bahia, é caracterizada pelo cultivo em larga escala de diversas espécies de grandes culturas, tais como, algodão, soja, milho e feijão. Nessa região, em 2006, ocorreram grandes surtos de mosca-branca em plantios de algodão, feijão e soja. O uso de neonicotinóides, tais como acetamipride e tiametoxam, além de carbosulfano, diafentiurom, endosulfam, lambda-cialotrina e zeta-cipermetrina, foram intenso no combate a pragas (B. tabaci, Aphis gossypii Glover, e Anthonomus grandis Boheman) na safra 2005/06 de algodão dessa região. Apesar de pertencerem à mesma região, as populações BA-1 e BA-2 apresentaram suscetibilidades diferentes aos inseticidas. Isso poderia ser devido ao fato de que BA-1 foi coletada em cultivo de feijão e dois meses antes de BA-2, que foi coletada em algodoeiro. O fato de haver sido coletada mais cedo no ano agrícola é um indicativo de que BA-1 tenha sofrido menor pressão de seleção pelos inseticidas. Como mostra o trabalho de Sivasupramaniam et al (1997), há uma tendência no aumento da resistência de mosca-branca a inseticidas do início para o fim da safra se não houver um manejo adequado de inseticidas. O outro fato é que, geralmente, na região de Barreiras, em razão de uma maior gama de pragas e do maior valor agrícola, o cultivo de algodoeiro recebe mais aplicações de inseticidas que o feijoeiro.
As áreas de coleta da mosca-branca em Goiás eram caracterizadas também pelo uso intensivo de inseticidas para o controle de pragas, principalmente a de Hidrolândia (cultivo de tomate em estufa). A população de mosca-branca que caracterizou a situação mais crítica de resistência foi GO-2, coletada em tomateiro sob sistema de cultivo protegido (estufa) na região de Hidrolândia. Nesse cultivo, tiametoxam e imidaclopride eram os dois principais produtos utilizados para o controle de mosca-branca, sendo que outros produtos, como o clorpirifós, não eram usados por não serem mais tão eficientes contra a praga naquela localidade.
Georghiou & Taylor (1977a) argumentam que o refúgio da praga pode ser um fato especialmente importante no retardamento da evolução da resistência. Sob intensa pressão de seleção, a evolução da resistência ocorre mais rapidamente em populações isoladas (Georghiou & Taylor 1977b). Sob condições de cultivo protegido, a população de mosca-branca pode ser considerada isolada, uma vez que é menor a imigração de indivíduos suscetíveis em relação a cultivos em condições de campo. Além disso, em estufa é menos provável que a mosca-branca encontre refúgio durante as aplicações de inseticidas. Nos EUA, segundo Sivasupramaniam et al (1997), populações de mosca-branca de cultivo de poinsétia em condições de casa de vegetação (estufa) apresentaram altos níveis de resistência a inseticidas. Isso pode explicar a razão de a população GO-2, oriunda de cultivo de tomate em estufa, ter se destacado como a menos suscetível aos neonicotinóides, principalmente nos testes com concentrações diagnósticas.
A população oriunda do cultivo de tomate em estufa foi mais resistente até mesmo a acetamipride, inseticida que não tinha sido usado para o controle de mosca-branca naquele local. A ocorrência de resistência cruzada poderia explicar isso, uma vez que outros dois neonicotinóides (tiametoxam e imidaclopride) foram muito usados para o controle da praga na área onde GO-2 foi coletada. Problemas de resistência cruzada de populações de mosca-branca a inseticidas neonicotinóides já foram registrados por Prabhaker et al (2005). Esses autores verificaram que, entre quatro inseticidas neonicotinóides, algumas populações de B. tabaci apresentavam níveis elevados de resistência a tiametoxam e, principalmente, a imidaclopride nos EUA. Diversas outras pesquisas, nas quais bioensaios foram utilizados, também revelaram diferenças entre populações de mosca-branca a neonicotinóides em vários lugares, tais como Paquistão (Ahmad et al 2002), Reino Unido (Rowland et al 1991; Cahill et al 1996a, b), Sudão (Ahmad et al 1987) e Israel (Horowitz & Ishaaya 1994, Horowitz et al 2004) e, também, nos EUA (Dennehy & Williams 1997, Dennehy et al 2005).
Deve ser ressaltado também que os bioensaios foram realizados de dois a cinco meses após a data de captura do inseto. Assim, há possibilidade de ocorrência de diminuição da frequência da resistência durante esse período, pois, segundo Ranasighe & Georghiou (1979), na ausência de pressão de seleção, pode ocorrer redução na tolerância a inseticida numa criação de insetos em laboratório após várias gerações. Havendo instabilidade da resistência da mosca-branca a um determinado inseticida, os resultados aqui apresentados poderiam não condizer com a realidade em campo, já que as populações de laboratório são mantidas na ausência da pressão de seleção. Entretanto, a remoção da pressão de seleção e a criação contínua em laboratório não afetou a resposta de populações de mosca-branca a bifentrina e ao azinfosmetil (Bush et al 1993, Riley & Tan 2003).
Por isso, o desenvolvimento e uso de técnicas de bioensaios que melhor reflitam a realidade no campo é fundamental para o monitoramento e manejo da resistência de mosca-branca a inseticidas, no tempo e no espaço, num país de importância agrícola como o Brasil. Tem sido justamente mediante o emprego dessas técnicas que, há mais de uma década, pequisas em vários países têm conseguido monitorar e manejar a resistência de mosca-branca a inseticidas em diversos cultivos. Por consequência, pode-se afirmar que essas pesquisas norteiam produtores agrícolas ao uso mais racional dos inseticidas, prolongando sua vida útil e evitando prejuízos que a má utilização desses produtos possam ocasionar.
Baseado nos resultados aqui obtidos, para o controle de B. tabaci, poder-se-ia recomendar: o uso de qualquer um dos três neonicotinóides e de clorpirifós na área de cultivo de feijão do município de São Desidério, onde a população BA-1 foi coletada; o uso de apenas acetamipride e de clorpirifós na área de algodão do município de Roda Velha, onde a população BA-2 foi coletada; a utilização de apenas acetamipride e de clorpirifós na área de feijão do município de Cristalina, uma vez que o uso de endosulfam não é recomendado para uso nessa cultura; e o uso de apenas clorpirifós e endosulfam na área de cultivo de tomate em estufa no município de Hidrolândia, local de coleta da população GO-2. Além disso, outros produtos, com modos de ação diferentes, e outras táticas de controle, tais como a de controle biológico e a de controle cultural, devem ser testadas e incluídas no manejo da mosca-branca.
Conclui-se que há variabilidade genética entre as populações de B. tabaci provenientes de diferentes regiões agrícolas do Brasil quanto à suscetibilidade aos inseticidas acetamipride, imidaclopride, tiametoxam, clorpirifós e endosulfam. Essa variabilidade genética é mostrada tanto pelo teste diagnóstico quanto pelo teste para obtenção das linhas de suscetibilidade, sendo, porém, mais percetível no primeiro teste. Para os inseticidas testados, o problema de resistência de B. tabaci é maior para tiametoxam, seguido por imidaclopride.
Agradecimentos
Às pesquisadoras Geni L Villas Boas e Maria Esther de N F Boiteux da Embrapa Hortaliças, pela identificação do biótipo das populações de B. tabaci usadas neste trabalho. Ao Departamento de Entomologia, Fitopatologia e Zoologia Agrícola da Esalq/USP, por conceder o uso de seus equipamentos e instações para realização desse trabalho. Ao CNPq e à UFC, pela bolsa de doutorado concedida ao primeiro autor.
Received 09/V/07. Accepted 02/I/09.
Edited by Herbert Álvaro Abreu de Siqueira - UFRP
- Abdeldaffie E Y A, Elhag E A, Bashir N H H (1987) Resistance in the cotton whitefly, Bemisia tabaci (Genn.), to insecticide recently introduced into Sudan Gezira. Trop Pest Manag 33: 283-286.
- Ahmad A H M, Elhag E A, Bashir N H H (1987) Insecticide resistance in the cotton whitefly (Bemisia tabaci Genn.) in the Sudan Gezira. Trop Pest Manag 33: 67-72.
- Ahmad M, Arif M I, Ahmad Z, Denholm I (2002) Cotton whitefly (Bemisia tabaci) resistance to organophosphate and pyrethroid insecticides in Pakistan. Pest Manag Sci 58: 203-208.
- Bush M R, Abdel-Aal Y A I , Saito K, Rock G C (1993) Azinphosmethyl resistance in the tufted apple bud moth (Lepidoptera: Tortricidae): reversion, diagnostic concentrations, associated esterases, and glutathione transferases. J Econ Entomol 86: 213-225.
- Cahill M, Byene F J, Denholm I, Devoshire A L, Gorman K J (1994) Insecticide resistance in Bemisia tabaci Pestic Sci 42: 137-139.
- Cahill M, Byene F J, Gorman K J, Denholm I, Devoshire A L (1995) Pyrethroid and organophosphate resistance in the tobacco whitefly Bemisia tabaci (Homoptera: Aleyrodidae). Bull Entomol Res 85: 181-187.
- Cahill M, Gorman K, Day S, Denholm I, Elbert A, Nauen R (1996a) Baseline determination and detection of resistance to imidacloprid in Bemisia tabaci (Homoptera: Aleyrodidae). Bull Entomol Res 86: 343-349.
- Cahill M, Jarvis W, Gorman K, Denholm I (1996b) Resolution of baseline responses and documentation to buprofezin in Bemisia tabaci (Homoptera: Aleyrodidae). Bull Entomol Res 86: 117-122.
- Costa H S, Brown J K, Sivasupramaniam S, Bird J (1993) Regional distribution, insecticide resistance and reciprocal crosses between the 'A' and 'B' biotypes of Bemisia tabaci Insect Sci Appl 14: 255-266.
- De Barro J P (2005) Genetic structure of the whitefly Bemisia tabaci in the Asia-Pacific region revealed using microsatellite markers. Mol Ecol 14: 3695-3718.
- Dennehy T J, Degain B A, Harpold V S, Brown J K, Morin S, Fabrick J A, Nichols R L (2005) New challenges to management of whitefly resistance to insecticides in Arizona. Cooperative Extension, The University of Arizona, 32p.
- Dennehy T J, Williams L (1997) Management in Bemisia in Arizona cotton. Pestic Sci 51: 398-406.
- Dittrich V, Hassan S O, Ernst G H (1985) Sudanese cotton and the whitefly: a case study o f the emergence of a new primary pest. Crop Prot 4: 161-176.
- Elbert A, Nauen R (2000) Resistance of Bemisia tabaci (Homoptera: Aleyrodidae) to insecticides in southern Spain with special reference to neonicotinoids. Pest Manag Sci 56: 60-64.
- Ellsworth P C, Tronsta R, Leser J, Goodell P B, Godfrey L D, Henneberry T J, Hendrix D, Brushwood D, Naranjo S E, Castle S, Nichols R L (1999) Sticky cotton sources & solution. The University of Arizona, Cooperative Extension, IMP Series n. 13, 4p.
- ffrench-Constant R H, Roush R T (1990) Resistance detection and documentation: the relative roles of pesticidal and biochemical assays, p.4-38. In Roush R T, Tabashnik B E (eds), Pesticide resistance in arthropods. New York, Chapman & Hall, 309p.
- Georghiou G P, Taylor C E (1977a) Genetic and biological influences in the evolution of insecticide resistance. J Econ Entomol 70: 319-323.
- Georghiou G P, Taylor C E (1977b) Operational influences in the evolution of insecticide resistance. J Econ Entomol 70: 653-658.
- Guirão P, Beitia F, Cenis J L (1997) Biotype determination of Spanish population of Bemisia tabaci (Hemiptera: Aleyrodidae). Bull Entomol Res 87: 587-593.
- Halliday W R, Burnham K P (1990) Choosing the optimal diagnostic dose for monitoring insecticide resistance. J Econ Entomol 83: 1151-1159.
- Horowitz A R, Ishaaya I (1994) Management resistance to insect growth regulators in the sweetpotato whitefly (Homoptera: Aleyrodidae). J Econ Entomol 87: 866-871.
- Horowitz A R, Kontsedalov S, Ishaaya I (2004) Dynamics of resistance to the neonicotinoids acetamiprid and thiamethoxam in Bemisia tabaci (Homoptera: Aleyrodidae).J Econ Entomol 97: 2051-2056.
- Horowitz A R, Kontsedalov S, Khasdan V, Ishaaya I (2005) Biotypes B and Q of Bemisia tabaci and their relevance to neonicotinoid and pyriproxyfen resistance. Arch Insect Biochem Physiol 58: 216-225.
- Jones D R (2003) Plant viruses transmitted by whiteflies. Eur J Plant Pathol 109: 195-219.
- Leora Software (1987) Polo PC: a user's guide to Probit or Logit Analysis. Leora Software, Berkeley, CA, 20p.
- Lourenção A L, Nagai H (1994) Surtos populacionais de Bemisia tabaci no estado de São Paulo. Bragantia 53: 53-59.
- Mink J S, Boethel D J (1992) Development of a diagnostic technique for monitoring permethrin resistance in soybean looper (Lepidoptera: Noctuidae) larvae. J Econ Entomol 85: 1056-1062.
- Morales F J (2001) Conventional breeding for resistance to Bemisia tabaci-transmitted geminiviruses. Crop Prot 20: 825-834.
- Nauen R, Denholm I (2005) Resistance of insect pests to neonicotinoid insecticides: current status and future prospects. Arch Insect Biochem Physiol 58: 200-215.
- Omer A D, Johnson M W, Tabashnik B E, Costa H S, Ullman D E (1993a) Sweetpotato whitefly resistance to insecticides in Hawaii: intra-island variation is related to insecticides use. Entomol Exp Appl 67: 173-182.
- Omer A D, Tabashnik B E, Johnson M W, Costa H S, Ullman D E (1993b) Genetic and environmental influences on susceptibility to acephate in sweetpotato whitefly (Homoptera: Aleyrodidae). J Econ Entomol 86: 652-659.
- Perry A S (1985) The relative susceptibility to several insecticides of adult whiteflies (Bemisia tabaci) from various cotton-growing areas in Israel. Phytoparasitica 13: 77-78.
- Prabhaker N, Castle S, Henneberry T J, Toscano N C (2005) Assessment of cross-resistance potential to neonicotinoid insecticides in Bemisia tabaci (Hemiptera: Aleyrodidae). Bull Entomol Res 95: 535-543.
- Prabhaker N, Coudriet D L, Meyerdirk D E (1985) Insecticide resistance in the sweetpotato whitefly, Bemisia tabaci (Homoptera: Aleyrodidae). J Econ Entomol 78: 748-752.
- Prabhaker N, Toscano N C, Henneberry T J, Castle S J, Weddle D (1996) Assessment of two bioassay techniques for resistance monitoring of sweetpotato whitefly (Homoptera: Aleyrodidae) in California. J Econ Entomol 89: 805-815.
- Ranasinghe L E, Georghiou G P (1979) Comparative modification of insecticide-resistance spectrum of Culex pipiens fatigans Wied. by selection with temephos and temephos / synergist combination. Pestic Sci 10: 502-508.
- Riley D G, Tan W (2003) Host plant effects on resistance to bifenthrin in silverleaf whitefly (Homoptera: Aleyrodidae). J Econ Entomol 96: 1315-1321.
- Robertson J L, Preisler H K (1992) Pesticide bioassays with arthropods. CRC, Boca Raton, 127p.
- Roush R T, Miller G L (1986) Considering for design of insecticide resistance monitoring programs. J Econ Entomol 79: 293-298.
- Rowland M, Hackett B, Stribley M (1991) Evaluation of insecticides in field-control simulators and standard laboratory bioassays against resistance and susceptible Bemisia tabaci (Homoptera: Aleyrodidae) from Sudan. Bull Entomol Res 81: 189-199.
- Sas Institute (1989) SAS/STAT User's guide, version 6, 4th ed SAS institute Inc., Cary, NC.
- Sivasupramaniam S, Johnson S, Watson T F, Osman A A, Jassim R (1997) A glass-vial technique for monitoring tolerance of Bemisia argentifolii (Homoptera: Aleyrodidae) to selected insecticides in Arizona. J Econ Entomol 90: 66-74.
- Sseruwagi P, Legg J P, Maruthi M N, Colvin J, Rey M E C, Brown J K (2005) Genetic diversity of Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae) population and presence of the B biotype and a non-B biotype that can induce silverleaf symptoms in squash, in Uganda. Ann Appl Biol 147: 253-265.
- Toscano N C, Prabhaker N, Castle S, Henneberry T J (2001) Inter-regional differences in baseline toxicity of Bemisia argentifolii (Homoptera: Aleyrodidae) to the two insect growth regulator, buprofezim and pyriproxyfen. J Econ Entomol 94: 1538-1546.
Datas de Publicação
-
Publicação nesta coleção
27 Mar 2009 -
Data do Fascículo
Fev 2009
Histórico
-
Recebido
09 Maio 2007 -
Aceito
02 Jan 2009