Resumos
Plutella xylostella (L.) é uma praga de difícil controle em virtude de seu alto potencial reprodutivo e de causar danos, e ampla distribuição geográfica, além de apresentar resistência a inseticidas. No entanto, as fases de larva e pupa dessa praga são naturalmente parasitadas por Oomyzus sokolowskii (Kurdjumov), favorecendo o incremento do parasitismo natural. Este estudo investigou o efeito da idade do parasitóide, disponibilidade de hospedeiro e fotoperíodo no comportamento reprodutivo de O. sokolowskii. O número de encontros entre parasitóide e hospedeiro e a taxa de parasitismo aumentaram com a idade das fêmeas até 96h. O parasitismo foi maior quando fêmeas do parasitóide receberam diariamente um número constante de hospedeiros comparado à disponibilidade randômica (13,3 versus 8,9 lagartas). A atividade de parasitismo ocorreu até 20 dias de idade e com longevidade semelhante entre os tratamentos (constante = 33,5 d; randômico = 34,7 d). O número de descendentes por fêmea, no entanto, decresceu com a sua idade, sendo o mesmo observado para o número de parasitóides emergidos por lagarta parasitada. A exposição contínua do hospedeiro à luz ou ao escuro por 12h não afetou a taxa de parasitismo; porém, parasitóides apresentaram maior atividade após 3h de exposição à luz. Assim, futuros estudos e possível utilização de O. sokolowskii, em campo, devem considerar a liberações de parasitóides com idade entre 48h e 72h e, preferencialmente, na madrugada para maiores chances de sucesso de parasitismo.
Traça das crucíferas; Plutella xylostella; localização de hospedeiro; maturação sexual; controle biológico
The high reproduction rate, potential to cause damage, wide geographic distribution and resistance to insecticides of Plutella xylostella (L.) makes difficult its efficient control. However, larvae and pupae of this pest are naturally parasitized by Oomyzus sokolowskii (Kurdjumov), providing opportunities to improve the natural parasitism. This study investigated the effects of the age of adult parasitoids, host availability and time of exposure on O. sokolowskii parasitism behavior. The number of larvae encounters by parasitoid females and the parasitism rate increased with parasitoid age up to 96h. The parasitization was higher when wasps received a constant number of hosts daily in comparison with a random number (13.3 versus 8.9 larvae parasitized). Female parasitization activity was maintained up to the age of 20 days in both treatments and exhibited similar longevity (constant host = 33.5 d; and random host = 34.7 d). The progeny produced per female and the number of parasitoids emerged per host significantly decreased as wasps aged. There was no significant effect of the light regime (12h darkness or 12h light exposure) on the parasitization, although parasitoid was more active after 3h of light exposure. Therefore, further studies on field application of O. sokolowskii should consider the release of 48h- to 72h-old parasitoids at dawn as a way to increase the success of host parasitization.
Diamondback moth; Plutella xylostella; host searching; sexual maturation; biological control
BIOLOGICAL CONTROL
Efeito da idade, fotoperíodo e disponibilidade de hospedeiro no comportamento de parasitismo de Oomyzus sokolowskii Kurdjumov (Hymenoptera: Eulophidae)
Effect of age, photoperiod and host availability on the parasitism behavior of Oomyzus sokolowskii Kurdjumov (Hymenoptera: Eulophidae)
Christian S A Silva-Torres; Reginaldo Barros; Jorge B Torres
Depto. de Agronomia-Entomologia, Univ. Federal Rural de Pernambuco, Av Dom Manoel de Medeiros s/n, Dois Irmãos, 52171-900, Recife, PE; sherleyjbt@yahoo.com
RESUMO
Plutella xylostella (L.) é uma praga de difícil controle em virtude de seu alto potencial reprodutivo e de causar danos, e ampla distribuição geográfica, além de apresentar resistência a inseticidas. No entanto, as fases de larva e pupa dessa praga são naturalmente parasitadas por Oomyzus sokolowskii (Kurdjumov), favorecendo o incremento do parasitismo natural. Este estudo investigou o efeito da idade do parasitóide, disponibilidade de hospedeiro e fotoperíodo no comportamento reprodutivo de O. sokolowskii. O número de encontros entre parasitóide e hospedeiro e a taxa de parasitismo aumentaram com a idade das fêmeas até 96h. O parasitismo foi maior quando fêmeas do parasitóide receberam diariamente um número constante de hospedeiros comparado à disponibilidade randômica (13,3 versus 8,9 lagartas). A atividade de parasitismo ocorreu até 20 dias de idade e com longevidade semelhante entre os tratamentos (constante = 33,5 d; randômico = 34,7 d). O número de descendentes por fêmea, no entanto, decresceu com a sua idade, sendo o mesmo observado para o número de parasitóides emergidos por lagarta parasitada. A exposição contínua do hospedeiro à luz ou ao escuro por 12h não afetou a taxa de parasitismo; porém, parasitóides apresentaram maior atividade após 3h de exposição à luz. Assim, futuros estudos e possível utilização de O. sokolowskii, em campo, devem considerar a liberações de parasitóides com idade entre 48h e 72h e, preferencialmente, na madrugada para maiores chances de sucesso de parasitismo.
Palavras-chave: Traça das crucíferas, Plutella xylostella, localização de hospedeiro, maturação sexual, controle biológico
ABSTRACT
The high reproduction rate, potential to cause damage, wide geographic distribution and resistance to insecticides of Plutella xylostella (L.) makes difficult its efficient control. However, larvae and pupae of this pest are naturally parasitized by Oomyzus sokolowskii (Kurdjumov), providing opportunities to improve the natural parasitism. This study investigated the effects of the age of adult parasitoids, host availability and time of exposure on O. sokolowskii parasitism behavior. The number of larvae encounters by parasitoid females and the parasitism rate increased with parasitoid age up to 96h. The parasitization was higher when wasps received a constant number of hosts daily in comparison with a random number (13.3 versus 8.9 larvae parasitized). Female parasitization activity was maintained up to the age of 20 days in both treatments and exhibited similar longevity (constant host = 33.5 d; and random host = 34.7 d). The progeny produced per female and the number of parasitoids emerged per host significantly decreased as wasps aged. There was no significant effect of the light regime (12h darkness or 12h light exposure) on the parasitization, although parasitoid was more active after 3h of light exposure. Therefore, further studies on field application of O. sokolowskii should consider the release of 48h- to 72h-old parasitoids at dawn as a way to increase the success of host parasitization.
Key words: Diamondback moth, Plutella xylostella, host searching, sexual maturation, biological control
Parasitóides liberados em campo nem sempre são capazes de encontrar imediatamente seus hospedeiros, os quais podem estar presentes em níveis muito reduzidos ou até mesmo indisponíveis, i.e. previamente parasitados, doentes, em idade inadequada etc. O fator que determina a eficiência de um parasitóide está intimamente ligado à sua capacidade de encontrar o hospedeiro em campo, manipular o número de ovos a serem depositados por hospedeiro e sua sobrevivência, em resposta à disponibilidade de hospedeiros. Nessas condições, o estado fisiológico do parasitóide tem implicações importantes para seu sucesso reprodutivo (Hohmann & Luck 2004).
Em geral, organismos, incluindo parasitóides, necessitam atingir a maturidade sexual para iniciar sua reprodução. Assim, o potencial de ação de parasitóides pode ser mais ou menos favorecido com o aumento da sua idade (Honda & Kainoh 1998, Persad & Hoy 2003, Amalin et al 2005). Sabe-se também que a idade do parasitóide pode afetar sua capacidade de aprendizado e, consequentemente, a localização do hospedeiro. Por exemplo, Honda & Kainoh (1998) mostraram que fêmeas mais velhas do parasitóide Ascogaster reticulatus Watanabe, são capazes de depositar maior número de ovos bem como associar odores de plantas ao hospedeiro. Além disso, fatores como fotoperíodo, temperatura e disponibilidade de hospedeiros podem afetar tanto o comportamento de parasitóides, interferindo na sua atividade e capacidade de busca pelo hospedeiro, como o seu ciclo biológico, afetando sua longevidade, fecundidade e diapausa (Bai & Smith 1993, Sagarra et al 2000, Tatsumi & Takada 2005, Larios et al 2007).
O parasitóide gregário Oomyzus sokolowskii (Kurdjumov) parasita lagartas de Plutella xylostella (L.), preferencialmente nos últimos instares (Talekar & Hu 1996), e também a pupa (Wang et al 1999). Ele vem sendo registrado exercendo controle natural de P. xylostella em diferentes regiões produtoras de brássicas do mundo (Ooi 1988, Mushtaque 1990, Talekar & Hu 1996, Wang et al 1999). No Brasil, O. sokolowskii foi encontrado no Rio Grande do Sul (Ferronato & Becker 1984), Pernambuco (Loges 1996) e Distrito Federal (Castelo Branco & Medeiros 2001). Em Pernambuco, Loges (1996) relatou parasitismo de até 97% de P. xylostella no final do ciclo da cultura do repolho. Finton & Walker (1992) relataram que O. sokolowskii seria o único calcidóideo com real potencial de controle de P. xylostella.
Plutella xylostella, também conhecida como traça das crucíferas, é a mais importante praga das brássicas no mundo (Talekar 1992). No Brasil, ela tem causado perdas elevadas na produção das brássicas, particularmente em repolho, reduzindo de 58% a 100% a qualidade final do produto; seu controle pode atingir até 30% dos custos totais de produção (Castelo Branco & Guimarães 1990, Barros et al 1993, Castelo Branco et al 2001). Assim, pesquisas buscando estabelecer táticas para o controle dessta praga devem ser adequadas à diversidade de ambientes e sistemas de cultivo.
Apesar de O. sokolowskii apresentar potencial para o controle de P. xylostella já evidenciados em estudos de laboratório e campo no Brasil (Loges 1996, Ferreira et al 2003) e em outros países (Talekar & Hu 1996, Wang et al 1999), pouco se conhece sobre seu comportamento. Segundo Wang et al (1999) e Ooi (1988), fêmeas de O. sokolowskii com menos de 24h de idade parasitam maior número de lagartas a 25ºC e apresentam decréscimo de fecundidade com o aumento da idade da fêmea, chegando a produzir descendentes até no máximo 13 dias, se receberem um número constante de hospedeiros. Por outro lado, o número de hospedeiros encontrados por parasitóides diariamente no campo pode ser variável, podendo influenciar a taxa de parasitismo e sua longevidade (Hohmann & Luck 2004). Portanto, a relação existente entre a densidade do hospedeiro e a taxa de ataque do inimigo natural é um componente essencial da associação hospedeiro-parasitóide (Wang & Ferro 1998).
Assim, o objetivo deste estudo foi determinar a idade ideal, o ritmo diário de atividade de busca e parasitismo, e o efeito da disponibilidade de hospedeiro na longevidade e capacidade de parasitismo de fêmeas de O. sokolowskii sobre lagartas de P. xylostella. Espera-se que fêmeas de O. sokolowskii sejam mais ativas durante as primeiras horas da fotofase, quando lagartas de P. xylostella também se mostram ativas. Consequentemente, espera-se também que O. sokolowskii tenha maior taxa de parasitismo diurno, com decréscimo de sua capacidade de parasitismo com o envelhecimento das vespas.
Material e Métodos
Lagartas de P. xylostella foram obtidas da colônia previamente estabelecida no Laboratório de Biologia de Insetos da UFRPE, de acordo com Barros & Vendramim (1999). A colônia do parasitóide O. sokolowskii foi estabelecida de espécimes oriundos de lagartas de P. xylostella coletadas em plantio orgânico de couve chinesa (Brassica campestris; Brassicaceae) no Município de Chã-Grande, Agreste de Pernambuco. Após a emergência do parasitóide, a sua multiplicação foi feita empregando o hospedeiro P. xylostella, ambos criados a 25,5 ± 1,17ºC, 67 ± 12% UR e fotofase de 12h.
Criação do parasitóide O. sokolowskii. Lagartas de terceiro-quarto instar de P. xylostella, criadas em couve comum (Brassica oleracea var. acephala; Brassicaceae), foram utilizadas como hospedeiro para o parasitóide. Pedaços de folhas de couve contendo, em média, 15 lagartas de P. xylostella foram expostas a 15 fêmeas para o parasitismo durante 96h no interior de recipientes plásticos de 500 ml. Como alimento para os parasitóides foi oferecida solução de mel a 30%. As pupas de P. xylostella obtidas foram transferidas para tubos de vidro (1 x 7,5 cm) até a emergência de adultos dos parasitóides, os quais foram alimentados com solução de mel oferecido na parede interna do tubo. A população do parasitóide completou quatro gerações em laboratório por ocasião do início dos experimentos.
Produção da planta hospedeira. Folhas de couve utilizadas na criação de P. xylostella foram oriundas de plantas cultivadas sem o uso de inseticidas de cultivo estabelecido em Aldeia, Camaragibe, PE. As plantas de repolho utilizadas nos experimentos foram cultivadas em telado. Sementes de repolho 242 cultivar repolho 60 dias (Isla S.A., Porto Alegre, RS) foram semeadas em potes plásticos transparentes de 300 ml (Copobras, São Ludgero, SC), contendo solo e húmus. As plantas foram irrigadas diariamente e quando possuíam cinco a sete folhas foram utilizadas nos experimentos.
Atividade de parasitismo em relação à idade de O. sokolowskii. Fêmeas do parasitóide de diferentes idades: < 24h, 24-48h, 48-72h e 72-96h após emergência, previamente alimentadas, acasaladas e sem experiência de parasitismo, foram testadas individualmente. Inicialmente, foi introduzido em um tubo de vidro (2 cm de diâmetro x 8,5 cm de altura) um pedaço de folha de couve comum (2 x 1 cm) sobre papel de filtro do mesmo tamanho. Os pedaços de couve foram infestados com cinco lagartas de P. xylostella de terceiro e quarto ínstares, pois larvas são preferidas pelo parasitóide em comparação a pupas (Nakamura & Noda 2001). Em seguida, fêmeas de O. sokolowskii (n = 30) foram liberadas individualmente em cada tubo e observadas por 30 min. Após o término da observação, os tubos contendo o material biológico foram mantidos em laboratório até a formação das pupas, para a determinação da taxa de parasitismo.
O número de fêmeas que localizou-ovipositou o hospedeiro durante o período de observação, bem como a taxa de parasitismo das lagartas expostas aos parasitóides no período, foram comparados entre as diferentes idades das fêmeas liberadas com o objetivo de identificar a idade de maior atividade de parasitismo. Assim, a proporção de fêmeas observadas (n = 30) localizando o hospedeiro foi comparada entre as idades das mesmas utilizando o PROC FREQ do SAS mediante teste de χ2. A porcentagem de lagartas parasitadas do total de lagartas ofertadas às fêmeas de diferentes idades foi submetida à análise de variância utilizando o PROC GLM do SAS, com subsequente Teste de Tukey HSD para a comparação de médias (SAS Institute 2000).
Capacidade de parasitismo de O. sokolowskii de acordo com a densidade de hospedeiro. Fêmeas acasaladas do parasitóide com menos de 24h de idade foram inseridas individualmente em recipientes plásticos de 250 ml (Plaszom, Orleans, SC), com tampas apresentando abertura circular de 5 cm fechada com tela antiafídica. No interior dos potes foi colocado um disco de papel de filtro no fundo, sobre o qual foi colocado um pedaço (2 x 1 cm) de folha de couve manteiga da Georgia (Isla S.A., Porto Alegre, RS) e um filete de mel na parede do pote, sendo os parasitóides submetidos aos seguintes tratamentos: testemunha, caracterizada pela disponibilidade constante de hospedeiro (quatro lagartas/dia de 3o-4o instar de P. xylostella), e tratamento com disponibilidade randômica de hospedeiro, o qual consistiu em zero, uma, duas ou quatro lagartas de 3o-4o ínstares de P. xylostella, diariamente.
A cada 24h, a partir do primeiro dia de vida, cada fêmea recebeu ou não hospedeiros, de acordo com o seu tratamento. Para o tratamento randômico, foi construída uma tabela, via sorteio, onde foi determinado o número de lagartas oferecidas diariamente aos parasitóides. Por outro lado, os parasitóides do tratamento hospedeiro constante receberam diariamente o mesmo número de lagartas até a sua morte. Foi testado o total de 10 e 15 fêmeas para o tratamento hospedeiro constante e tratamento hospedeiro randômico, respectivamente.
Após a exposição ao parasitóide por 24h, as lagartas foram coletadas e acondicionadas em tubos de vidro contendo um pedaço de couve manteiga até a formação das pupas, para a determinação da taxa de parasitismo, do número de descendentes produzidos por hospedeiro parasitado e da mortalidade do parasitóide. Todas as pupas inviáveis, sem emergência do parasitóide ou mariposa, foram dissecadas para determinação da ocorrência ou não do parasitismo.
A sobrevivência dos parasitóides durante o experimento foi comparada entre tratamentos hospedeiro constante e randômico pelos testes de Log-Rank e Wilcoxon utilizando-se do método Kaplan-Meyer via Proc LIFETEST do SAS. O número de lagartas parasitadas por O. sokolowskii foi submetido ao teste t, usando o PROC TTEST do SAS. O número de descendentes produzidos por lagarta parasitada foi submetido à análise de variância com medidas repetidas no tempo, utilizando o PROC ANOVA do SAS (SAS Institute 2000).
Atividade de O. sokolowskii de acordo com a fotofase e escotofase. O horário de maior atividade de parasitismo das fêmeas do parasitóide frente às condições de luz e escuro foi avaliado em 100 fêmeas do parasitóide com 42-72h de idade e provenientes das condições de luz estabelecidas para o experimento. Assim, 50 fêmeas após 12h de escuro (noite anterior) foram submetidas ao parasitismo por 12h de luz (dia consecutivo) e, da mesma maneira, 50 fêmeas do parasitóide mantidas em 12h de luz foram submetidas ao parasitismo de lagartas durante as 12h seguintes de escuro (noite consecutiva). As condições de luz e escuro foram obtidas mantendo os parasitóides em câmaras climatizadas com fotoperíodo ajustado às condições desejadas.
As fêmeas foram liberadas em arenas compostas de recipientes de plástico transparente de 500 ml (Copobras, São Ludgero, SC). No interior da arena foi introduzido um disco de folha de couve, com aproximadamente 8 cm de diâmetro, colocado sobre um disco de papel de filtro. Cada disco de folha de couve foi infestado com cinco lagartas de 3o-4o ínstares de P. xylostella. Foram utilizadas 10 repetições (cinco lagartas/recipiente, correspondendo cada recipiente a uma repetição) com a exposição total de 50 lagartas/tratamento. As fêmeas do parasitóide possuíam 48h de idade, estavam previamente acasaladas e alimentadas.
Com o término das 12h de exposição (luz ou escuro), as fêmeas foram retiradas e as lagartas mantidas no recipiente até a formação das pupas. Em seguida, as pupas foram individualizadas para a avaliação do parasitismo. Os dados obtidos foram submetidos ao teste t utilizando o PROC TTEST do SAS para a comparação do parasitismo entre os regimes de exposição de luz ou escuro (SAS Institute 2000).
Atividade de parasitismo de O. sokolowskii ao longo da fotofase. Fêmeas do parasitóide com 48-72h de idade, previamente acasaladas e alimentadas com mel, foram submetidas à luz artificial nos diferentes intervalos de duração de fotofase após a escotofase (12h). A exposição do parasitóide a diferentes intervalos de luz foi obtida logo após o início da exposição à luz (dia): < 1, 3, 6 e 10h de exposição à luz após início do dia.
Após a exposição ao regime de luz específico, 30 fêmeas do parasitóide foram liberadas individualmente em tubo de vidro (2 cm de diâmetro x 8,5 cm de altura) contendo um pedaço de folha de couve comum (2 x 1 cm) sobreposto em papel de filtro do mesmo tamanho e observadas por 30 min. Esses pedaços de couve foram infestados com cinco lagartas de P. xylostella de 3º-4º ínstares. O número de fêmeas que localizou-ovipositou o hospedeiro foi comparado entre os diferentes grupos de fêmeas liberadas com o objetivo de identificar qual seria o período de maior atividade de parasitismo. Assim, a proporção de fêmeas (n = 30) expostas a cada tempo de luz após escuro localizando o hospedeiro foi comparada utilizando o PROC FREQ do SAS mediante teste de χ2 (SAS Institute 2000).
Resultados
Fêmeas de O. sokolowskii foram capazes de localizar e parasitar lagartas de 3º-4º ínstares de P. xylostella alimentando-se de couve por 30 min, condições em que o número de hospedeiros disponíveis é constante e variável.
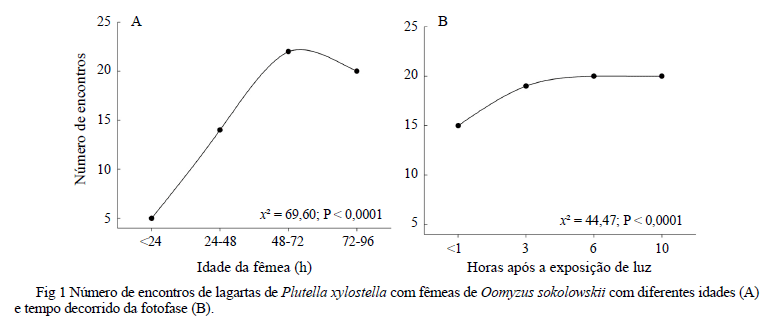
Atividade de parasitismo em relação à idade de O. sokolowskii. A atividade de parasitismo de O. sokowloski está relacionada à sua idade após emergência (Fig 1A). Na maioria dos casos, o número de encontros entre fêmeas de O. sokolowskii e lagartas de P. xylostella aumentou com o aumento da idade das fêmeas, sendo que aquelas com mais de 48h e até 96h de idade apresentaram maior número de encontros com o hospedeiro (χ2 = 69,60; P < 0,0001) (Fig 1A). O maior número de encontros realizados entre 48h e 96h também resultou em maior porcentagem de parasitismo (Tabela 1).
Capacidade de parasitismo de O. sokolowskii de acordo com a densidade de hospedeiro. O número médio (±EP) de lagartas parasitadas por O. sokolowskii foi maior quando as vespas receberam diariamente um número constante de hospedeiro (13,3 ± 1,72; máximo de 19 lagartas), comparado ao encontro randômico de hospedeiro (8,9 ± 1,02; máximo de 15 lagartas) (t = 2,35; gl = 23; P = 0,0275). Entretanto, em ambos os tratamentos, fêmeas foram capazes de parasitar lagartas até 20 dias após a emergência (Fig 2A).
O número de descendentes produzidos por fêmea decresceu com o avanço da sua idade, mas foi semelhante entre os tratamentos hospedeiro constante e randômico (Fig 2B, C ). Da mesma forma, não houve diferença entre as condições de exposição de hospedeiro para o número de descendentes produzidos por lagarta parasitada (F1, 19 = 0,34; P = 0,5670) (Fig 2C ).
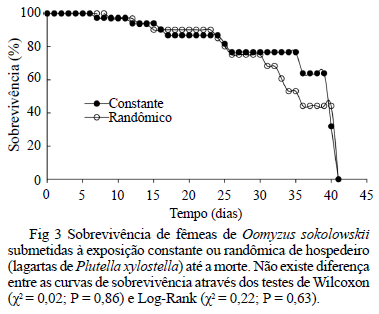
A longevidade média dos parasitóides foi de 33,5 e 34,7 dias para os tratamentos randômico e constante, respectivamente, não havendo diferença entre as curvas de sobrevivência pelos testes de Wilcoxon (χ2 = 0,02; P = 0,86) e Log-Rank (χ2 = 0,22; P = 0,63) (Fig 3).
Atividade de O. sokolowskii de acordo com a fotofase e escotofase. O número médio (± EP) de lagartas de P. xylostella parasitadas por O. sokolowskii durante 12h de luz e 12h de escuro foi, em média, 2,6 vezes maior no período de luz do que no de escuro (1,3 ± 0,30 versus 0,5 ± 0,34 lagartas), diferindo apenas a 10% de significância (F1, 18 = 3,10; P = 0,0901).
Atividade de parasitismo de O. sokolowskii ao longo da fotofase. O tempo após exposição à luz afetou a atividade de parasitismo de O. sokowloskii. O número de vespas que realizou ao menos um encontro e parasitou uma lagarta aumentou com o número de horas de exposição à luz, atingindo assíntota entre 3h e 6h de exposição à luz (χ2 = 44,47; P < 0,0001) (Fig 1B).
Discussão
A maior atividade de O. sokolowskii e o aumento na taxa de encontro com o hospedeiro após certo desenvolvimento na fase adulta indicam que esse parasitóide necessita de um período de maturação sexual para que possa responder mais eficientemente ao hospedeiro, como observado para outras espécies (Persad & Hoy 2003, Amalin et al 2005). Enquanto a idade ideal para parasitar com sucesso lagartas de Spodoptera frugiperda (Smith) varia de 48h a 96h para Cotesia marginiventris (Cresson) (Rajapakse 1992), para Ceratogramma etiennei Delvare, a idade ideal varia de um a dois dias após emergência (Amalin et al 2005). Portanto, é importante saber a idade em que os parasitóides estão mais ativos e fecundos para tomar a decisão adequada sobre a idade ideal dos parasitóides a serem liberados em campo para obtenção de níveis significativos de parasitismo, bem como em estudos de comportamento em que a oviposição faz parte das variáveis em observação.
A exposição das fêmeas de O. sokolowskii a pelo menos 3h de luz, início da fotofase, serviu como estímulo para que elas aumentassem a atividade de busca pelo hospedeiro. Após o período inicial de exposição à luz, a atividade de busca se estabiliza durante o decorrer da fotofase, sendo a fêmea capaz de localizar o hospedeiro com eficiência durante o decorrer do dia, o que reforça a importância da consideração do tempo de exposição à luz para esse parasitóide. Além disso, mesmo não havendo diferenças entre a atividade de parasitismo na fotofase e escotofase para O. sokolowskii, possivelmente pela grande variação nos dados, os resultados indicam maior atividade diurna do parasitóide, já que o número médio de lagartas parasitadas na fotofase foi 2,3 vezes maior do que durante a escotofase. Similarmente, maior atividade diurna de parasitismo foi observada para vários Hymenoptera Parasitica (Gauld 1991, Jervis & Copland 1996, Lewis & Whitfield 1999, Tunçbilek & Ayvaz 2003). Assim, é mais provável que, no campo, o parasitismo de P. xylostella por O. sokolwskii ocorra mais intensamente durante a fotofase, especialmente, no seu início, visto que outros fatores abióticos não testados, como o aumento da temperatura e do vento com o decorrer do dia, podem afetar a atividade de parasitóides (Saavedra et al 1997, Sagarra et al 2000).
A simulação de imprevisilibilidade de hospedeiros por encontros randômicos não interferiu no comportamento de parasitismo como esperado. O número de hospedeiros parasitados não aumentou após as fêmeas serem submetidas à escassez de hospedeiros nos dias anteriores (dado não apresentado para fêmeas recebendo diferentes números de hospedeiros randomicamente). A estratégia de parasitismo foi similar entre tratamentos randômico e constante, com decrescente número de lagartas parasitadas ao longo do tempo, e não apresentando resposta de incremento da taxa de parasitismo após serem submetidos à condição de escassez de hospedeiros em resposta à imprevisibilidade de encontros com hospedeiros viáveis. Esse fato poderia explicar o maior número de lagartas parasitadas por O. sokolowskii na presença diária de um número constante de hospedeiros a partir da emergência, pois o número de hospedeiros parasitados por dia sempre variou abaixo do total de hospedeiros ofertados, seja na condição de disponibilidade constante ou randômica.
Por outro lado, não houve diferença na produção de descendentes entre os tratamentos, indicando a reposta de compensação do parasitóide pela inconstância na disponibilidade de hospedeiro, depositando mais ovos quando hospedeiros estão disponíveis. Esses resultados foram similares aos encontrados por Wang et al (1999) (média de 13,2 lagartas parasitadas), quando fêmeas de O. sokolowskii receberam o número constante de cinco lagartas por dia a 25ºC. Sabe-se que parasitóides são capazes de ajustar o número de ovos depositados e a razão sexual de seus descendentes de acordo com a disponibilidade de hospedeiro (Godfray 1994). Em condições de campo, é mais provável que os parasitóides encontrem um número variável de hospedeiros disponíveis em função da sua abundância, idade apropriada ao parasitismo, de estarem parasitados ou, até mesmo, infectados por organismos entomopatogênicos. Isso pode resultar em menor taxa de parasitismo, mudança da razão sexual dos descendentes, mas ser compensado em maior número de descendentes produzidos por hospedeiro.
Ao contrário do que se esperava, a disponibilidade do hospedeiro não afetou a longevidade e atividade de parasitismo dos parasitóides. Além disso, a ocorrência do mesmo padrão de parasitismo entre tratamento constante e randômico mostrou que fêmeas de O. sokolowskii parasitam poucas lagartas por dia, independente da variabilidade de encontro com o hospedeiro. Isso pode significar que O. sokolowski exibe uma estratégia de baixo parasitismo diário, indicando uma adaptação à condição de imprevisibilidade de hospedeiros no campo. Outra hipótese relacionada à condição de baixa taxa de parasitismo diário é a produção e maturação de ovos ao longo da vida adulta, como no caso de parasitóides sinovigênicos (Quicke 1997, Papaj 2000), não havendo, portanto, interferência da variabilidade da disponibilidade de hospedeiros.
No entanto, em condições de campo é possível que a escassez de hospedeiros viáveis ao parasitismo estimule o parasitóide a continuar procurando por hospedeiros por um período maior de tempo, controlando a ovulação e a reabsorção de seus ovos, e aumentando sua longevidade. Estudos com diferentes insetos têm mostrado que organismos que investem mais em reprodução podem ter redução na longevidade como resultado de um balanço energético entre reprodução e sobrevivência (Reznick 1985, Bell & Koufopanou 1986, Stearns 1992). Apesar de existir pouca evidência da existência desse balanço em Hymenoptera Parasitica, Hohmann & Luck (2004) mostraram que ele existe em Trichogramma platneri Nagarkatti, sugerindo que parasitóides devem alocar mais recursos para sobrevivência para aumentar o tempo de busca do hospedeiro quando tais hospedeiros são escassos. No caso de O. sokolwskii, ainda são necessários mais estudos para se confirmar ou não a existência desse balanço.
Wang et al (1999) e Ooi (1988) encontraram que fêmeas de O. sokolowskii viveram em média 12,4 e 11,1 dias e produziram descendentes até o 13o e 10o dia, respectivamente. Essa menor longevidade e reprodução em relação aos nossos resultados podem estar associadas às diferenças na história de vida das diferentes linhagens do parasitóide utilizadas nos estudos, bem como a variáveis experimentais não controladas, como a manipulação do material biológico. Populações de O. sokolowiskii de Hangzhou, China, entram em quiescência durante o inverno (Liu et al 1997), diferentemente da linhagem do Agreste de Pernambuco, que não deve apresentar quiescência devido à baixa variabilidade das condições climáticas durante o ano, e também pelo fato de ser constatado parasitismo de P. xylostella em todas as estações, indicando possíveis diferenças de estratégia de vida entre linhagens.
Com base nos resultados encontrados, caso seja necessário liberar O. sokolowskii no campo para o controle da traça-das-crucíferas, as liberações devem considerar a utilização de parasitóides de 48-72h de idade e conduzidas antes das primeiras horas de luz, facilitando a adaptação do parasitóide às condições ambientais pelo aumento gradativo da temperatura e luminosidade na madrugada do dia seguinte, e estimulando sua dispersão gradual em busca de hospedeiros na área alvo, no entorno ao ponto de liberação. Por questões práticas, no Agreste de Pernambuco, sugere-se a liberação de fêmeas de 48-72h de idade O. sokolowskii, levadas ao campo na noite anterior e acondicionadas em recipientes abertos apenas no momento de sua colocação em áreas experimentais de repolho e couve orgânica. Essa técnica de liberação evita a dispersão imediata das fêmeas do parasitóide, uma vez que as mesmas são inativas durante a escotofase.
Agradecimentos
A Maria T Lavor e José Menezes Jr pela ajuda nas observações, a Manoel Guedes C Gondim Jr (UFRPE) e ao editor da revista pelas sugestões no manuscrito. A FACEPE pela bolsa BPD-0013-5.01/05 e a CAPES pelo apoio via projeto PROCAD No. 83054.
Received 10/VI/07.
Accepted 24/VI/09.
Edited by Luiz Amilton Forster - UFPR
- Amalin D M, Peña J E, Duncan R E (2005) Effects of host age, female parasitoid age, and host plant on parasitism of Ceratogramma etiennei (Hymenoptera: Trichogrammatidae). Fla Entomol 88: 77-82.
- Bai B, Smith S M (1993) Effect of host availability on reproduction and survival of the parasitoid wasp Trichogramma minutum Ecol Entomol 18: 279-286.
- Barros R, Albert Jr I B, Oliveira A J, Souza A C F, Loges V (1993) Controle químico da traça-das-crucíferas, Plutella xylostella L. (Lepidoptera: Plutellidae) em repolho. An Soc Entomol Brasil 22: 463-469.
- Barros R, Vendramim J D (1999) Efeito de cultivares de repolho, utilizadas para criação de Plutella xylostella (L.) (Lepidoptera: Plutellidae), no desenvolvimento de Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae). An Soc Entomol Brasil 28: 469-476.
- Bell G, Koufopanou V (1986) The cost of reproduction. Oxford Surv Evol Biol 3: 83-131.
- Castelo Branco M, França F H, Medeiros M A, Leal J G T (2001) Uso de inseticidas para o controle da traça-do-tomateiro e traça-das-crucíferas: um estudo de caso. Hortic Bras 9: 60-63.
- Castelo Branco M, Guimarães A L (1990) Controle da traça-das-crucíferas em repolho. Hortic Bras 8: 24-25.
- Castelo Branco M, Medeiros M A (2001) Impact of insecticides on diamondback moth parasitoids on cabbage fields in the Federal District of Brazil. Pesq Agropec Bras 36: 7-13.
- Ferreira S W J, Barros R, Torres J B (2003) Exigências térmicas e estimativa do número de gerações de Oomyzus sokolowskii (Kurdjumov) (Hymenoptera: Eulophidae), para regiões produtoras de crucíferas em Pernambuco. Neotrop Entomol 32: 407-411.
- Ferronato E M O, Becker M (1984) Abundância e complexo de parasitóides de Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae) em Brassica oleracea L. Var. Acephala D.C. An Soc Entomol Brasil 13: 261-278.
- Finton M, Walker A (1992) Hymenopterous parasitoids associated with diamondback moth: the taxonomic dilemma, p.225-232. In Talekar N S (ed) Diamondback moth and other crucifer pests. Proceedings of the Second International Workshop. Asian Vegetable Research and Development Center, Taipei.
- Gauld I D (1991) The Ichneumonidae of Costa Rica, 1. Mem Am Entomol Inst 47: 1-589.
- Godfray H C J (1994) Parasitoids. Princeton University Press, Princeton, 473p.
- Hohmann C L, Luck R (2004) Effect of host availability and egg load in Trichogramma platneri Nagarkatti (Hymenoptera: Trichogrammatidae) and its consequences on progeny quality. Braz Arch Biol Technol 47: 413-422.
- Honda T, Kainoh Y (1998) Age-related fecundity and learning ability of the egg-larval parasitoid Ascogaster reticulatus Watanabe (Hymenoptera: Braconidae). Biol Control 13: 177-181.
- Jervis M A, Copland M J W (1996) The life cycle, p.63-160. In Jervis M A, Kidd N (ed) Insect natural enemies: practical approaches to their study and evaluation. London, Chapman & Hall, 491p.
- Larios G L B, Ohno K, Fukuhara F (2007) Effects of photoperiod and temperature on preimaginal development and summer diapause of Chrysocharis pubicornis (Zetterstedt) (Hymenoptera: Eulophidae), a pupal parasitoid of leafminers (Diptera: Agromyzidae). Appl Entomol Zool 42: 189-197.
- Lewis C N, Whitfield J B (1999) Braconid wasp (Hymenoptera: Braconidae) diversity in forest plots under different silvicultural methods. Environ Entomol 28: 986-997.
- Liu S S, Wang X G, Guo S J, He J H, Song H M (1997) A survey of insect parasitoids of Plutella xylostella and the seasonal abundance of the major parasitoids in Hangzhou, China, p.61-66. In The management of diamondback moth and other crucifer pests - Proceedings of the Third Workshop. MARDI, Malaysia.
- Loges V (1996) Danos causados pela traça-das-crucíferas Plutella xylostella (Linnaeus, 1758) em cultivares de repolho Brassica oleracea var. capitata (L.) e efeito sobre a população da praga e do parasitóide Oomyzus sokolowskii (Kurdjumov, 1912), em condições de campo. Dissertação de Mestrado, Recife, UFRPE, 98p.
- Mushtaque M (1990) Some studies on Tetrastichus sokolowskii Kurd (Eulophidae: Hymenoptera), a parasitoid of diamondback moth in Pakistan. Pak J Zool 22: 37-43.
- Nakamura A, Noda T (2001) Host-age effects on oviposition behavior and development of Oomyzus sokolowskii (Hymenoptera: Eulophidae), a larval-pupal parasitoid of Plutella xylostella (Lepidoptera: Yponomeutidae). Appl Entomol Zool 36: 367-372.
- Ooi P A C (1988) Laboratory studies of Tetrastichus sokolowskii Entomophaga 33: 145-152.
- Papaj D R (2000) Ovarian dynamics and host use. Annu Rev Entomol 45: 423-448.
- Persad A B, Hoy M A (2003) Manipulation of female parasitoid age enhances laboratory culture of Lysiphlebus testaceipes (Hymenoptera: Aphidiidae) reared on Toxoptera citricida (Homoptera: Aphididae). Fla Entomol 86: 429-436.
- Quicke D L J (1997) Parasitic wasps. London, Chapman & Hall, 470p.
- Rajapakse R H S (1992) Effect of host age, parasitoid age, and temperature on interspecific competition between Chelonus insularis Cresso, Cotesia marginiventris Cresson and Microplitis manilae Ashmead. Insect Sci Appl 13: 87-94.
- Reznick D (1985) Costs of reproduction: an evaluation of the empirical evidence. Oikos 44: 257-267.
- Saavedra J L D, Torres J B, Ruiz M G (1997) Dispersal and parasitism of Heliothis virescens eggs by Trichogramma pretiosum (Riley) in cotton. Int J Pest Manage 43: 169-171.
- Sagarra L A, Vincent C, Peters N F, StewartR K (2000) Effect of host density, temperature, and photoperiod on the fitness of Anagyrus kamali, a parasitoid of the hibiscus mealybug Maconellicoccus hirsutus. Entomol Exp Appl 96: 141-147.
- SAS Institute (2000) SAS User`s guide: statistic version 8 for Windows. Cary, North Carolina, SAS Institute.
- Stearns S C (1992) The evolution of life histories. Oxford, Oxford University Press, 262p.
- Talekar N S (1992) Diamondback moth and other crucifer pests. Proceedings of the Second International Workshop, 1990. Shanhua, Taiwan, Asian Vegetable Research and Development Center, 603p.
- Talekar N S, Hu W J (1996) Characteristics of parasitism of Plutella xylostella (Lep., Plutellidae) by Oomyzus sokolowskii (Hym., Eulophidae). Entomophaga 41: 45-52.
- Tatsumi E, Takada H (2005) Effects of photoperiod and temperature on adult oligopause of Aphelinus asychis and larval diapause of A. albipodus (Hymenoptera: Aphelinidae). Appl Entomol Zool 40: 447-456.
- Tunçbilek A S, Ayvaz A (2003) Influences of host age, sex ratio, population density, and photoperiod on parasitism by Trichogramma evanescens Westw. (Hym., Trichogrammatidae). J Pest Sci 76: 176-180.
- Wang B, Ferro D N (1998) Functional response of Trichogramma ostiniae (Hymenoptera: Trichogrammatidae) to Ostrinia nubilalis (Lepidoptera: Pyralidae) under laboratory and field conditions. Environ Entomol 27: 752-758.
- Wang X, Liu S, Guo S, Lin W (1999) Effect of host stages and temperature on population parameters of Oomyzus sokolowskii , a larval-pupal parasitoid of Plutella xylostella Biocontrol 44: 391-402.
Datas de Publicação
-
Publicação nesta coleção
14 Set 2009 -
Data do Fascículo
Ago 2009
Histórico
-
Recebido
10 Jun 2007 -
Aceito
24 Jun 2009