Resumen
In two field-collected populations of de Bemisia tabaci (Gennadius) B biotype previously selected with the neonicotinoid insecticide thiamethoxam (NEO-R, NEO-N), and a population susceptible to insecticides (SUSC), the level of response to the insecticide thiametoxam, as well as the life and fertility tables were determined. At LC95, the NEO-R population showed a resistance ratio (RR95) value of 8.8-fold, an intrinsic rate of increase (r m) of 0.72. The fitness of the NEO-R and NEO-N populations in relation to the SUSC was 1.5 and 2.0, respectively. The RR95 value for NEO-N was 1.9-fold; it's r m value was 0.082, while in the SUSC population was 0.041. The developmental time of egg and adult were longer in NEO-R population, while the nymph and pupa lasted longer in the NEO-N and SUSC populations. The developmental time was different in the three NEO-R, NEO-N, and SUSC populations with 19.7 d (315.84 degree days or dd), 15.7 d (250.4 dd) and 18.5 d (296.6 d), respectively. The populations previously selected with thiamethoxam did not reproduce faster than their susceptible counterpart.
Neonicotinoid; life table; fertility table
Neonicotinoid; life table; fertility table
PEST MANAGEMENT
Aptitud biológica de poblaciones de Bemisia tabaci (Gennadius) Biotipo B (Hemiptera: Aleyrodidae) con diferente susceptibilidad al insecticida thiametoxam
Fitness of Bemisia tabaci (Gennadius) B Biotype (Hemiptera: Aleyrodidae) populations with different levels of susceptibility to the thiametoxam insecticide
Aidee Campuzano-MartínezI; J Concepcion Rodríguez-MacielI; Ángel Lagunes-TejedaI; Celina Llanderal-CázaresI; Antonio P Terán-VargasII; Jorge Vera-GrazianoI; Humberto Vaquera-HuertaI; Gonzalo Silva-AguayoIII
ICampus Montecillo, Colegio de Postgraduados, 56230 Montecillo, Estado de México, Mexico; concho@colpos.mx
IIInstituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias, Campo experimental Sur de Tamaulipas, km 55 carretera Tampico-Mante, 89610 Estación Cuauhtémoc, Tamaulipas, Mexico
IIIDepto de Protección vegetal, Facultad de Agronomía, Univ de Concepción, Chillán, Chile
ABSTRACT
In two field-collected populations of de Bemisia tabaci (Gennadius) B biotype previously selected with the neonicotinoid insecticide thiamethoxam (NEO-R, NEO-N), and a population susceptible to insecticides (SUSC), the level of response to the insecticide thiametoxam, as well as the life and fertility tables were determined. At LC95, the NEO-R population showed a resistance ratio (RR95) value of 8.8-fold, an intrinsic rate of increase (rm) of 0.72. The fitness of the NEO-R and NEO-N populations in relation to the SUSC was 1.5 and 2.0, respectively. The RR95 value for NEO-N was 1.9-fold; it's rm value was 0.082, while in the SUSC population was 0.041. The developmental time of egg and adult were longer in NEO-R population, while the nymph and pupa lasted longer in the NEO-N and SUSC populations. The developmental time was different in the three NEO-R, NEO-N, and SUSC populations with 19.7 d (315.84 degree days or dd), 15.7 d (250.4 dd) and 18.5 d (296.6 d), respectively. The populations previously selected with thiamethoxam did not reproduce faster than their susceptible counterpart.
Key words: Neonicotinoid, life table, fertility table
La aptitud biológica es la capacidad de un organismo, en virtud de su genotipo, para competir con éxito y contribuir con sus genes a las generaciones posteriores (Solomon et al 2001). En insectos fitófagos dicha característica influye en el potencial para modificar la densidad poblacional y convertirse en plagas importantes de las plantas cultivadas (Gould 1991). La aptitud biológica se puede alterar debido a la exposición a insecticidas o a diferentes niveles de resistencia a éstos (Roush & McKenzie 1987, Croft 1990, Arnaud & Haubruge 2002). En algunos casos, la interacción de los insectos con insecticidas puede disminuir la aptitud biológica (Li et al 2002, Elzen 2001) y en otros incrementarla (Lowry & Sears 1986, Morze & Zareh 1991). Estas alteraciones pueden deberse a la hormesis, es decir, a los incrementos o decrementos en los diversos componentes de la aptitud biológica derivados de la exposición a dosis subletales de sustancias tóxicas (Luckey 1968, Croft 1990). Sin embargo, existen estudios que documentan el efecto de la expresión de genes de resistencia sobre la aptitud biológica (Guedes et al 2006, Oliveira et al 2007), y por tanto del efecto que tiene sobre el grado de estabilidad de la resistencia en ausencia de presión de selección.
Los insecticidas neonicotinoides, entre los que destaca el thiamethoxam, se han utilizado a nivel mundial para el combate de insectos chupadores que transmiten enfermedades a las plantas, tales como pulgones, triózidos, y moscas blancas (Tomizawa & Casida 2003). La mosca blanca Bemisia tabaci (Gennadius) biotipo B es una de las plagas más importante que se combate con dicho insecticida y no existen estudios que evalúen la aptitud biológica en poblaciones de esta especie que se encuentran en etapas iniciales del desarrollo de la resistencia a thiamethoxam. Por tanto, el objetivo de la presente investigación consistió en determinar los parámetros poblacionales de vida y de fertilidad en poblaciones de mosquita blanca B. tabaci biotipo B susceptibles o en etapas tempranas del desarrollo de resistencia al insecticida thiamethoxam.
Material y Métodos
Insectos. Se emplearon tres poblaciones de B. tabaci biotipo B con diferentes niveles de susceptibilidad a thiamethoxam: NEO-R, NEO-N y SUSC. En octubre del 2005, Gutiérrez-Olivares et al (2007) recolectó individuos de B. tabaci biotipo B en plantas de tomate de cáscara Physalis philadelphica, en la región agrícola de Ciudad del Maíz, San Luis Potosí (S.L.P), México. Este grupo se dividió en dos subgrupos de alrededor de 1000 individuos cada uno. El primero de los cuales, denominado población NEO-R, se seleccionó en cada una de las 15 generaciones siguientes con 600 ppm de thiamethoxam, que eliminó en promedio, entre 40% y 50% de los individuos tratados. Al segundo grupo se le denominó población NEO-N y sus individuos se reprodujeron durante 15 generaciones sin presión de selección. Para exponer los individuos a thiamethoxam se utilizó la metodología que se presenta en este documento y en cada generación se seleccionaron de 500 a 1000 individuos. En todos los casos, las generaciones de insectos se reprodujeron sobre plantas de berenjena, Solanum melongena, bajo condiciones de invernadero.
Las poblaciones NEO-N y NEO-R tienen el mismo origen, lo que permite hacer comparaciones más robustas del impacto de las diferencias de susceptibilidad a thiamethoxam sobre la aptitud biológica, como lo sugiere Uyenoyama (1986) y Scout (1990).
Como población susceptible de referencia (SUSC) se utilizaron individuos de B. tabaci biotipo B que se recolectaron de plantas silvestres en Montecillo, Estado de México, los cuales se han mantenido por 60 generaciones sobre plantas de berenjena, libres de presión de selección con insecticidas. La identificación del biotipo de mosca blanca utilizado se realizó por investigadores de la Dirección General de Sanidad Vegetal de México.
Caracterización de poblaciones. Se determinó la línea de respuesta Log-dosis Probit al insecticida thiamethoxam (Actara® 250 WG, Syngenta Crop Protection Inc. México) en las poblaciones NEO-R, NEO-N y SUSC mediante el método de ensayo propuesto por Cahill et al (1996) con algunas modificaciones. Se utilizaron discos de hoja de frijol Phaseolus vulgaris var. Canario 107 de 13 a 18 cm de altura, con el primer par de foliolos desarrollados y sin hojas verdaderas, en lugar de discos de hoja de algodonero (Gossypium hirsutum). Las raíces de las plantas de frijol se lavaron con agua corriente para eliminar el exceso de suelo, se secaron con papel absorbente y se sumergieron 24h en 100 ml de thiamethoxam a la dosis requerida. En el testigo sin tratar, las raíces se sumergieron en agua destilada durante 24h.
De las plantas expuestas al insecticida y del testigo sin tratar, se cortaron discos de hoja de 4 cm de diámetro y se colocaron con el envés hacia arriba en cajas Petri del mismo diámetro, que contenían 3 ml de agar al 2% en agua destilada para mantener hidratado el disco foliar.
De cada población se seleccionaron al azar adultos sin sexar de B. tabaci biotipo B y se anestesiaron con CO2 a 20 Psi de presión durante 15 s. En cada una de las cajas Petri que contenían el disco foliar, se colocaron los individuos de B. tabaci y después de 15 min se eliminaron aquellos dañados o muertos por la manipulación. El tamaño de muestra por repetición fue de 19 a 24 adultos. Las cajas Petri se mantuvieron en posición invertida para que las moscas blancas estuvieran sobre el envés, en la posición que normalmente tienen en las hojas. Las unidades experimentales se mantuvieron a 27 ± 1ºC, fotoperiodo de 13:11h (luz: oscuridad) y humedad relativa de 60% a 80%.
Inicialmente se determinó el rango de concentraciones que abarcara del cero al 100% de mortalidad, posteriormente se agregaron cinco concentraciones seriales intermedias que cubrieran dicho rango y se realizaron tres repeticiones en días diferentes, cada una de las cuales incluyó un testigo sin tratar. A las 72h de exposición al tóxico se contabilizó el porcentaje de mortalidad. Se consideró muerto al insecto que no presentaba movimientos o que no respondía al tocarlo con una aguja de disección. La mortalidad en los testigos sin tratar fue inferior a 10% y se corrigió mediante la fórmula de Abbott (Abbott 1925).
Tablas de vida. De cada población se utilizaron 21 hembras y 11 machos de cero a cuatro días de edad que se introdujeron a una jaula entomológica que contenía una planta de berenjena de 15 cm a 20 cm de altura (30 a 40 d de edad). A las 48h se retiraron los adultos, se contabilizó el número de huevos depositados y con éstos se inició la tabla de vida de la cohorte respectiva. En las poblaciones NEO-R, NEO-N y SUSC la cohorte se inició con 421, 104 y 280 individuos, respectivamente. Cada tercer día se registró el número de individuos vivos y su estadio. Las plantas con las cohortes permanecieron en cámara bioclimática (Lab-line ® biotronette plant growth chamber, III, U.S.A.) a 27 ± 1ºC, fotoperiodo de 13:11h (luz: oscuridad) y humedad relativa de 60% a 80%.
Tablas de fertilidad. La tabla de fertilidad se realizó con los individuos que llegaron al estado adulto en los estudios de la tabla de vida. Los adultos se colectaron con ayuda de un aspirador, se anestesiaron con CO2 a 20 Psi de presión, durante 15 s y se observaron con un microscopio estereoscópico para determinar la proporción sexual y se utilizaron en esa misma proporción. Las hembras tienen el abdomen redondeado, mientras que en los machos termina en punta y es más angosto. Posteriormente se colocaron en, grupos de 10 a 15 en cajas Petri de cuatro cm de diámetro, que contenían agar y un disco foliar de berenjena y se determinó la fecundidad mediante el registro de los huevos viables depositados. El disco foliar se cambió cada tercer día con la finalidad de que los individuos tuvieran alimento en buen estado. El material biológico permaneció en la cámara bioclimática en las condiciones ambientales antes indicadas. La determinación del número de huevos depositados se realizó hasta que murió la última hembra bajo estudio.
Análisis estadístico. Para el cálculo de los valores de las concentraciones letales (CL50 y CL95), límites de confianza (LC) al 95% y proporción de resistencia (PR), se utilizó el procedimiento PROC PROBIT de SAS (SAS Institute 1997). Se consideró que a un nivel determinado de mortalidad, la respuesta era diferente si sus límites de confi anza al 95% no se traslapaban. La PR se obtuvo al dividir el valor observado de la CL50 o de la CL95 de las poblaciones NEO-R ó NEO-N, entre los valores respectivos que se observaron en la población SUSC.
Para determinar diferencias estadísticas de las curvas de supervivencia entre las poblaciones evaluadas, se utilizó la prueba no paramétrica de Logrank (α = 0.05) (Méndez et al 2004) mediante el uso del programa SUFERTI (Colunga & Vera 1991). Con el programa Excel (Microsoft Excel® 2003) se calculó la tasa intrínseca de incremento natural (rm), la tasa de reproducción neta (Ro), el tiempo generacional (T), y la tasa finita de incremento (λ). También se calcularon las tasas de supervivencia (lx), según la edad de los insectos, y con éstas se calcularon las curvas de supervivencia.
Para comparar los valores de rm entre las poblaciones de mosca blanca, se utilizó la prueba de Traslapo de Intervalos (Vera & Sotres 1991). Los valores de rm de las poblaciones comparadas se consideraron diferentes cuando los límites de confianza no se traslaparon.
Se calculó el desarrollo promedio de cada estado biológico y el total del ciclo de vida en días y en grados día, para cada población. Los grados día se calcularon con el programa Degree-Days (University of California 2007).
El promedio total y por estadios del tiempo de desarrollo se compararon entre poblaciones mediante un análisis de supervivencia, con el modelo de Weibull. Para conocer si hubo diferencias entre poblaciones se utilizó la prueba de Bonferroni (α = 0,05), con el programa MINITAB® RELEASE 14, Statistical Program (Ryan et al 2004). La aptitud biológica relativa se obtuvo dividiendo los valores de rm de las poblaciones NEO-R ó NEO-N entre el valor de rm de la población SUSC.
Resultados y Discusión
A nivel de la CL50, no hubo diferencias estadísticas en la respuesta a thiamethoxam entre la población NEO-R y SUSC (Tabla 1). La población NEO-N manifestó CL50estadísticamente inferior a las poblaciones NEO-R y SUSC con valor de PR50 de 0,5×. En ocasiones las poblaciones de campo muestran valores de CL50 ó CL95 estadísticamente inferiores a los que presenta la población susceptible que se utiliza como referencia de comparación. Esto se debe a que la susceptibilidad a insecticidas tiene distribución normal (Sawicki 1987); además, las poblaciones susceptibles y las resistentes pueden diferir en su respuesta a insecticidas debido a factores ajenos a la presencia o ausencia de genes de resistencia (Heather 1982, Roush & Croft 1986). A nivel de la CL95, solamente la población NEO-R fue diferente de SUSC con PR95 de 8,8×. En condiciones de campo, para que una población de B. tabaci Biotipo B presente problemas de control a thiamethoxam, los valores de PR95 deben ser >35× (J. Concepción Rodríguez Maciel, com pers), por tanto se considera que una PR95 de 8,8× corresponde a las etapas iniciales de desarrollo de resistencia a dicho insecticida. Las diferencias en respuesta a nivel de la CL95 entre la población NEO-R y NEO-N se atribuyen a que la resistencia a thiamethoxam en esta especie es inestable (Gutiérrez-Olivares et al 2007).
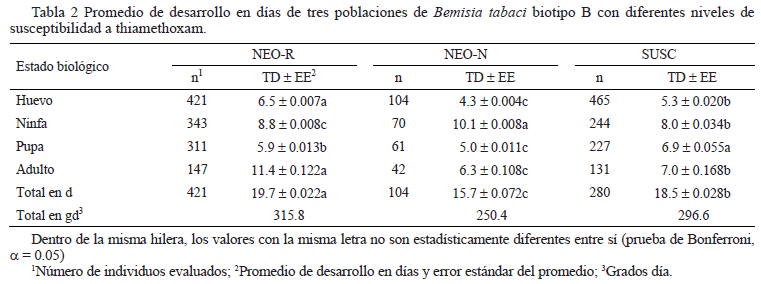
El huevo (6,5 d) y el adulto (11,4 d) tardaron más tiempo en desarrollarse en la población NEO-R; mientras que la ninfa y la pupa duraron más tiempo en las poblaciones NEO-N y SUSC, respectivamente (Tabla 2). El tiempo total de desarrollo mostró diferencias significativas para las tres poblaciones (P < 0,05), con mayor duración para la NEO-R (Tabla 2).
Las tablas de fertilidad se iniciaron con los sobrevivientes de las tablas de reproducción de cada población. Por tanto, para las poblaciones SUSC, NEO-R y NEO-N las tablas de fertilidad se iniciaron con 114: 110, 136:45 y 33:32 hembras: machos, respectivamente. Se presentaron diferencias estadísticas entre las curvas de supervivencia de las poblaciones NEO-R y NEO-N, entre NEO-N y SUSC pero no entre NEO-R y SUSC (prueba de logrank, P <0,05; Fig 1). No hubo diferencias estadísticas entre los valores de rm de las poblaciones NEO-R y NEO-N, pero sí entre éstas y la población SUSC (prueba de traslapo de intervalos, P < 0,05) (Tabla 3).
El efecto del genotipo o de la presencia de genes de resistencia a insecticidas en poblaciones de insectos plaga sobre la aptitud biológica se ha documentado en varias especies de insectos (Ferrari & Georghiou 1981, McKenzie et al 1982, El-Khatib & Georghiou 1985). La exposición previa o la expresión de genes de resistencia puede no afectar (Fournier et al 1988, Haubruge & Arnaud 2001), aumentar (James & Price 2002) o disminuir (Ako et al 2004) la aptitud biológica. En algunos casos, los individuos homocigotos susceptibles y los heterocigotos no presentan diferencias en la aptitud biológica entre ellos (Ferrari & Georghiou, 1981, Roush & Plapp 1982, Argentine et al 1989). Carrière et al (2001) encontraron que en dos poblaciones de gusano rosado, Pectinophora gossypiella (Saunders), resistentes a la toxina Cry1Ac de Bacillus thuringiensis (Bt), la supervivencia se redujo 51,5% en promedio respecto a las poblaciones susceptibles.
Algunos estudios han explicado con detalle las causas del impacto de la expresión de genes de resistencia sobre la aptitud biológica. Guedes et al (2006) investigó en Sitophilus zeamais, la aptitud biológica de una población susceptible y dos de campo resistentes a insecticidas. Una de las poblaciones de campo era altamente resistente a insecticidas piretroides (>500×) y su aptitud biológica inferior a la susceptible. La otra población de campo era resistente a DDT y piretroides y su aptitud biológica era similar a la susceptible. Dichos investigadores demostraron que la población de campo cuya aptitud biológica era baja, tenía las células del tejido graso agrandadas y modificadas para almacenar más energía y su tasa de respiración era más alta. Esta energía adicional que utilizan algunas poblaciones de insectos resistentes, la obtienen a expensas de otras funciones biológicas; lo que se traduce en disminuciones significativas de la aptitud biológica. En consecuencia, la Resistencia es inestable dado que los insectos resistentes tienen desventajas competitivas en relación a sus contrapartes susceptibles (Oliveira et al 2007) y se podría aprovechar esta característica en el manejo de la resistencia en campo. En la población de campo resistente a insecticidas, pero con aptitud biológica similar a la susceptible, no se mostraron alteraciones significativas en el tejido graso o en la tasa de respiración en relación a la población sin exposición histórica a insecticidas. En este caso es probable que hayan evolucionado genes modificadores que mitigaron el impacto negativo de la resistencia sobre la aptitud biológica, como lo sugieren Ribeiro et al 2007.
Los estudios que relacionan el genotipo con la aptitud biológica revelan información importante sobre la contribución de genes de cada uno de éstos a las generaciones subsecuentes y por tanto del grado de estabilidad de la resistencia en ausencia de selección. Sin embargo, en campo rara vez se presenta una población con un solo genotipo. Lo común es observar una mezcla de varios de ellos y es importante conocer si en etapas tempranas del desarrollo de la resistencia, como ocurre con la población NEO-R, la población incrementa su aptitud biológica y por tanto su crecimiento poblacional, por unidad de tiempo, en comparación con otra población de la misma especie que no haya sido expuesta a insecticidas.
Miyo y Oguma (2002) indican que los componentes de dicha aptitud pueden alterarse por factores independientes a la resistencia a estos productos, en apoyo a las diferencias en aptitud biológica que se observaron entre la población SUSC y las que habían tenido exposición previa a thiamethoxam (NEO-R y NEO-N). Además, los alelos específi cos que determinan el mecanismo de resistencia pueden infl uir de diferente manera en la capacidad biótica (Agnew et al 2004) y pueden existir otras mutaciones o genes modifi cadores que compensan los costos de la resistencia (Roush & McKenzie 1987, Arnaud & Haubruge 2002, Agnew et al 2004).
Estas contradicciones aparentes respecto al impacto de la selección previa a tóxicos sobre la aptitud biológica se debe a que la exposición a insecticidas o la expresión de genes de resistencia en algunos casos afectan el funcionamiento normal de la fisiología del insecto (Georghiou et al 1982, Uyenoyama 1986) y en otros no (Wilkinson 1983); además, este efecto debe ponderarse por la proporción relativa de cada genotipo en la población. El conocimiento del impacto que tiene el nivel de susceptibilidad a thiamethoxam sobre la aptitud biológica a nivel poblacional, permite estimar si el uso del citado insecticida puede contribuir a que se den condiciones para que en las etapas iniciales de desarrollo de resistencia, la población puedan incrementar su densidad en una tasa superior a la que ocurriría en una población susceptible de la misma especie. Los datos de este estudio indican, como conclusión, que en B. tabaci Biotipo B de Ciudad del Maíz, San Luis Potosí (SLP), México, una PR95de 8,8× a thiamethoxam (NEO-R), que corresponde a etapas iniciales del desarrollo de la resistencia, no afecta la aptitud biológica y por tanto la población no se reproduce con mayor rapidez que su contraparte susceptible (NEO-N).
Received 06/XI/08.
Accepted 24/VII/09.
Edited by Madelaine Venzon - EPAMIG
- Abbott W S (1925) A method of computing the effectiveness of an insecticide. J Econ Entomol 18: 265-267.
- Agnew P, Berticat C, Bedhomme S, Sidobre C, Michalakis Y (2004) Parasitism increases and decreases the costs of insecticide resistance in mosquitoes. Evolution 58: 579-586.
- Ako M, Borgemeister C, Poehling H, Elbert A, Nauen R (2004) Effects of neonicotinoid insecticides on the bionomics of twospotted spider mite (Acari: Tetranychidae). J Econ Entomol 97: 1587-1594.
- Argentine J A, Marshall J, Ferro D N (1989) Relative fi tness of insecticide-resistant Colorado potato beetle strains (Coleoptera: Chrysomelidae). Environ Entomol 18: 705-710.
- Arnaud L, Haubruge E (2002) Insecticide resistance enhances male reproductive success in a beetle. Evolution 56: 2435-2444.
- Cahill M, Gorman K, Day S, Delhom I, Elbert A, Nauen R (1996) Baseline determination and detection of resistance to imidacloprid in Bemisia tabaci (Homoptera: Aleyrodidae). Bull Entomol Res 86: 343-349.
- Carrière Y, Ellers-Kirk C, Liu Y, Sims M A, Patin A L, Dennehy T J, Tabashnik B E (2001) Fitness cost and maternal effects associated with resistance to transgenic cotton in the Pink bollworm (Lepidoptera: Gelechiidae). J Econ Entomol 94: 1571-1576.
- Colunga G M, J Vera G (1991) SUFERTI: programa de computación para estimar y comparar algunos estadísticos demográfi cos en insectos, p.137-138. In Memorias del XXVI Congreso Nacional de Entomología del 19-22 de mayo de 1991. Sociedad Mexicana de Entomología. Veracruz, Ver. México.
- Croft B A (1990) Arthropod biological control agents and pesticides. Wiley-Interscience Publication, New York, 723p.
- El-Khatib Z I, Georghiou G P (1985) Comparative fi tness of temephos-resistant, susceptible, and hybrid phenotypes of the southern house mosquito (Diptera: Culicidae). J Econ Entomol 78: 1023-1029.
- Elzen G W (2001) Lethal and sublethal effects of insecticide residues on Orius insidiosus (Hemiptera: Anthocoridae) and Geocoris punctipes (Hemiptera: Lygaeidae). J Econ Entomol 94: 55-59.
- Ferrari J A, Georghiou G P (1981) Effects on insecticidal selection and treatment on reproductive potential of resistant, susceptible, and heterozygous strains of the Southern house mosquito. J Econ Entomol 74: 323-327.
- Fournier D, Pralavorio M, Coulon J, Bergé J B (1988) Fitness comparison in Phytoseiulus persimilis strains resistant and susceptible to methidation. Exp Appl Acarol 5: 55-64.
- Georhiou G P, Lagunes A, Baker J D (1982) Effect of insecticide rotation on the evolution of resistance, p.183-189. In Matsukana S, Hutson D H, Murphy D (eds) Pesticide chemistry: human welfare and environment. Proc 5th Int Cong Pestic Chem Kyoto, August 29th September 4th Int Union of Pure & Appl Chem, Pergamon Press, Kyoto.
- Gould F (1991) The evolutionary potential of crop pest. Am Sci 74: 496-507.
- Guede, R N C, Oliveira E E, Guedes N M P, Ribeiro B, Serrão J E (2006) Cost and mitigation of insecticide resistance in the maize weevil, Sitophilus zeamais Physiol Entomol 31: 30-38.
- Gutiérrez-Olivares M, Rodríguez-Maciel J C, Llanderal-Cázares C, Terán-Vargas A P, Lagunes-Tejeda A, Díaz-Gómez O (2007) Estabilidad de la resistencia a neonicotinoides en Bemisia tabaci (Gennadius) biotipo B de San Luis Potosí, México. Agrociencia 41: 913-920.
- Haubruge E, Arnaud L (2001) Fitness consequences of malathionspecific resistance in red flour beetle (Coleoptera: Tenebrionidae) and selection for resistance in the absence of malathion. J Econ Entomol 94: 552-557.
- Heather N W (1982) Comparison of population growth rates of malathion resistant and susceptible populations of the rice weevil, Sitophilus oryzae (Linnaeus) (Coleoptera: Curculionidae). Queensland J Agric Anim Sci 39: 61-68.
- James D F, Price T S (2002) Fecundity in twospotted spider mite (Acari: Tetranychidae) is increased by direct and systemic exposure to imidacloprid. J Econ Entomol 95: 729-732.
- Li X, L M, Sun L, Zhu C (2002) Biotic characteristics in the deltamethrin-susceptible and resistant strains of Culex pipiens pallens (Diptera: Culicidae) in China. Appl Entomol Zool 37: 305-308.
- Lowry D T, Sears M K (1986) Stimulation of reproduction of the green peach aphid (Homoptera: Aphididae) by azinphosmethyl applied to potatoes. J Econ Entomol 79: 1530-1533.
- Luckey T D (1968) Insect hormoligosis. J Econ Entomol 61: 7-12.
- McKenzie J A, Whitten M J, Adena M A (1982) The effect of genetic background on the fitness of diazinon resistance genotypes of the Australian sheep blowfly, Lucilia cuprina Heredity 49: 1-9.
- Méndez R I, Namihira G D, Moreno A L, Sosa C (2004) El protocolo de investigación. Editorial Trillas. 9Ş reimpresión, Ed. Trillas, México, 210p.
- Miyo T, Oguma Y (2002) Negative correlations between resistance to three organophosphate insecticides and productivity within a natural population of Drosophila melanogaster (Diptera: Drosophilidae). J Econ Entomol 95: 1229-1238.
- Oliveira E E, Guedes R N C, Tótola M R, De Marco Jr P (2007) Competition between insecticide-susceptible and resistant populations of the maize weevil, Sitophilus zeamais Chemosphere 69: 17-24.
- Morse J G, Zareh N (1991) Pesticide-induced hormoligosis of citrus thrips (Thysanoptera: Thripidae) fecundity. J Econ Entomol 84: 1169-1174.
- Ribeiro B, Guedes R N C, Correã A S, Santos C T (2007) Fluctuating asymmetry in insecticide-resistant and susceptible strains of the maize weevil, Sitophilus zeamais (Coleoptera: Curculionidae). Arch Environ Cont Toxicol 53: 77-83.
- Roush R T, Croft B A (1986) Experimental population genetics and ecological studies of pesticide resistance in insects and mites, p.257-270. In National Academy of Sciences (ed) Pesticide resistance strategies and tactics for management. National Academy Press, Washington, D. C., 471p.
- Roush R T, McKenzie J A (1987) Ecological genetics of insecticide and acaricide resistance. Annu Rev Entomol 32: 361-380.
- Roush R T, Plapp F W (1982) Effects of insecticide resistance on biotic potential of the house fly (Diptera: Muscidae). J Econ Entomol 75: 708-713.
- Ryan B F, Joiner B L, Cryer J D (2004) Minitab handbook: updated for release 14. Duxbury Press, 528p.
- SAS (1997) SAS/STAT user's guide. SAS Institute, Cary, NC, 1028p.
- Sawicki R M (1987) Definition and documentation of insecticide resistance, p.105-117. In Ford M G, Holloman D W, Khambay B P S, Sawicki R M (eds) Combating resistance to xenobiotics: biological and chemical approaches. Ellis Horwood, Chinchester, 320p.
- Scout J G (1990) Investigating mechanisms of insecticide resistance: methods, strategies, and pitfalls, p.39-57. In Roush R T, Tabashnik B E (eds) Pesticide resistance in arthropods, Chapman and Hall, 352p.
- Solomon P E, Berg L R, Martin D W (2001) Biología. Quinta edición en Español. McGraw-Hill Interamericana, México, D.F., 1237p.
- Tomizawa M, Casida J E (2003) Selective toxicity of neonicotinoids attributable to specificity of insect and mammalian nicotine receptors. Annu Rev Entomol 48: 339-364.
- University of California (2007) Customom calculation. Disponible en línea en http://www.ipm.ucdavis.edu/WEATHER/ddretrieve.html Revisado el 03/abril/2007.
- Uyenoyama M K (1986) Pleiotropy and the evolution of genetic systems conferring resistance to pesticides, p.207-221. In National Academy of Sciences (ed.), Pesticide resistance strategies and tactics for management. National Academy Press, Washington, D. C., 471p.
- Vera G J, Sotres D (1991) Prueba de traslape de intervalos para comparar tasas instantáneas de desarrollo poblacional. Agrociencia, Ser Protec Veg 2: 7-13.
- Wilkinson C F (1983) Role of mixed-function oxidases in insecticide resistance, p.175-225. In Georghiou G P, Saito T (eds), Pest resistance to pesticides. Plenum Press, New York, 767p.
Fechas de Publicación
-
Publicación en esta colección
22 Jul 2010 -
Fecha del número
Jun 2010
Histórico
-
Acepto
24 Jul 2009 -
Recibido
06 Nov 2008