Resumos
Neste estudo são apresentados os resultados de amostragem de Squamata do Parque Nacional Grande Sertão Veredas, MG, na área nuclear do Cerrado brasileiro, através de metodologia padronizada. A riqueza, diversidade e distribuição das espécies são comentadas e comparadas com os resultados em outras regiões do Cerrado. A fauna de Squamata na região inclui pelo menos 50 espécies, dentre as quais 25 lagartos, três anfisbenas e 22 serpentes, distribuídas em 12 famílias: Polychrotidae (1), Tropiduridae (3), Scincidae (4), Teiidae (3), Gymnophthalmidae (6), Anguidae (1), Amphisbaenidae (3), Anomalepididae (1), Leptotyphlopidae (1), Boidae (2), Colubridae (16) e Viperidae (2). A riqueza registrada e estimada indica que a região pode figurar entre as mais ricas em todo o Cerrado. As espécies de Squamata parecem possuir preferências previsíveis sobre os diferentes hábitats disponíveis, e admite-se a grande influência de fatores histórico-filogenéticos na distribuição espacial das espécies. A fisionomia do carrasco destacou-se por abrigar duas espécies restritas à região, Stenocercus quinarius e Psilophthalmus sp., sendo promissora para novos estudos. Os ambientes abertos, especialmente as fisionomias savânicas típicas do Cerrado, apresentaram maior riqueza, em concordância com outros locais estudados, e com implicações diretas na conservação da diversidade biológica do Cerrado.
Cerrado; Squamata; lagartos; diversidade; conservação
We present the results of an inventory of squamate reptiles from Grande Sertão Veredas National Park region, in the Brazilian Cerrado hotspot. We used standardized sampling methods to provide richness, diversity and distribution data and compared our results with those from other Cerrado localities. The regional squamate fauna is composed of at least 50 species, of which 25 lizards, three amphisbaenians and 22 snakes, distributed in 12 families: Polychrotidae (1), Tropiduridae (3), Scincidae (4), Teiidae (3), Gymnophthalmidae (6), Anguidae (1), Amphisbaenidae (3), Anomalepididae (1), Leptotyphlopidae (1), Boidae (2), Colubridae (16) e Viperidae (2). Recorded and estimated richness indicates that the region can be one of the richest in the Brazilian Cerrado. The recorded species present predictable abundance variations among different available habitats, a probable result of the influence of phylogenetic factors in the spatial distribution of the species. The "carrasco" habitat was distinguished for harboring two restricted species to the region: Stenocercus quinarius and Psilophthalmus sp., and should receive further attention in future studies. The open habitats, especially the typical open physiognomies of Cerrado, present the highest richness levels, in agreement with results in other Cerrado localities, a fact with direct implications for the conservation of central Brazilian savannas.
Cerrado; Squamata; lizards; diversity; conservation
INVENTÁRIOS
Composição e diversidade de répteis Squamata na região sul do Parque Nacional Grande Sertão Veredas, Brasil Central
Diversity and composition of squamate reptiles in the southern portion of Grande Sertão Veredas National Park, Central Brazil
Renato RecoderI; Cristiano NogueiraII, 1 1 Autor para correspondência: Cristiano Nogueira, e-mail: c.nogueira@conservation.org.br, http://www.conservation.org.br
IInstituto de Biociências, Universidade de São Paulo USP, CP 11461, CEP 05422-970, São Paulo, SP, Brasil
IIConservation International, Cerrado Program, SAUS Qd. 3 Lt. 2 Bl. C Ed. Business Point Sala 715-722, CEP 70070-934 Brasília, DF, Brasil
RESUMO
Neste estudo são apresentados os resultados de amostragem de Squamata do Parque Nacional Grande Sertão Veredas, MG, na área nuclear do Cerrado brasileiro, através de metodologia padronizada. A riqueza, diversidade e distribuição das espécies são comentadas e comparadas com os resultados em outras regiões do Cerrado. A fauna de Squamata na região inclui pelo menos 50 espécies, dentre as quais 25 lagartos, três anfisbenas e 22 serpentes, distribuídas em 12 famílias: Polychrotidae (1), Tropiduridae (3), Scincidae (4), Teiidae (3), Gymnophthalmidae (6), Anguidae (1), Amphisbaenidae (3), Anomalepididae (1), Leptotyphlopidae (1), Boidae (2), Colubridae (16) e Viperidae (2). A riqueza registrada e estimada indica que a região pode figurar entre as mais ricas em todo o Cerrado. As espécies de Squamata parecem possuir preferências previsíveis sobre os diferentes hábitats disponíveis, e admite-se a grande influência de fatores histórico-filogenéticos na distribuição espacial das espécies. A fisionomia do carrasco destacou-se por abrigar duas espécies restritas à região, Stenocercus quinarius e Psilophthalmus sp., sendo promissora para novos estudos. Os ambientes abertos, especialmente as fisionomias savânicas típicas do Cerrado, apresentaram maior riqueza, em concordância com outros locais estudados, e com implicações diretas na conservação da diversidade biológica do Cerrado.
Palavras-chave: Cerrado, Squamata, lagartos, diversidade, conservação.
ABSTRACT
We present the results of an inventory of squamate reptiles from Grande Sertão Veredas National Park region, in the Brazilian Cerrado hotspot. We used standardized sampling methods to provide richness, diversity and distribution data and compared our results with those from other Cerrado localities. The regional squamate fauna is composed of at least 50 species, of which 25 lizards, three amphisbaenians and 22 snakes, distributed in 12 families: Polychrotidae (1), Tropiduridae (3), Scincidae (4), Teiidae (3), Gymnophthalmidae (6), Anguidae (1), Amphisbaenidae (3), Anomalepididae (1), Leptotyphlopidae (1), Boidae (2), Colubridae (16) e Viperidae (2). Recorded and estimated richness indicates that the region can be one of the richest in the Brazilian Cerrado. The recorded species present predictable abundance variations among different available habitats, a probable result of the influence of phylogenetic factors in the spatial distribution of the species. The "carrasco" habitat was distinguished for harboring two restricted species to the region: Stenocercus quinarius and Psilophthalmus sp., and should receive further attention in future studies. The open habitats, especially the typical open physiognomies of Cerrado, present the highest richness levels, in agreement with results in other Cerrado localities, a fact with direct implications for the conservation of central Brazilian savannas.
Keywords: Cerrado, Squamata, lizards, diversity, conservation.
Introdução
Apesar de ser considerado uma das 25 regiões prioritárias para o estudo e conservação da biodiversidade no mundo (Myers et al. 2000), o Cerrado, segundo maior domínio fitogeográfico da América do Sul (Ab'Sáber 1977), ainda é muito pouco estudado em relação a sua diversidade biológica e seus processos ecológicos (Vanzolini 1988, Colli et al. 1998, Nogueira 2001, Colli et al. 2002).
O conhecimento da herpetofauna do Cerrado é ainda incipiente, havendo a necessidade de estudos intensivos e detalhados sobre diversidade local (Nogueira 2001, Colli et al. 2002, Rodrigues 2005b) e sobre a representação geográfica das espécies (Rodrigues 2005a). Ao longo das últimas décadas, a vegetação e os hábitats originais do Cerrado vêm sendo severamente impactados, dando espaço principalmente à expansão agrícola dominada por monoculturas (Ratter et al. 1997, Silva & Bates 2002, Klink & Machado 2005, Silva et al. 2006). Muitas espécies, incluindo algumas até recentemente desconhecidas pela ciência, ocorrem em regiões sob intensa pressão de destruição de hábitat (Colli et al. 2003a). Deste modo, estudos básicos sobre diversidade são de urgente importância para apoiar políticas de conservação no Cerrado (Colli et al. 1998, Silva & Bates 2002).
Estudos anteriores apontavam que a fauna do Cerrado não possuía uma identidade, que as comunidades de animais do domínio eram compostas essencialmente por espécies generalistas e de ampla distribuição geográfica em formações abertas (Sick 1965, Vanzolini 1963, 1976, 1988), e considerava-se a fauna de lagartos do Cerrado pobre em relação a outras regiões do continente (Vitt 1991). Mais recentemente, com a publicação de revisões taxonômicas, com o emprego de técnicas mais eficientes na amostragem, e com a constante descoberta de novas espécies (Colli et al. 2003b, Ferrarezzi et al. 2005, Nogueira & Rodrigues 2006), têm-se demonstrado que a fauna de répteis do Cerrado é regionalmente e localmente muito rica, e que, ao contrário de interpretações anteriores, há um número subestimado de riqueza e endemismos (Colli et al. 2002, Nogueira et al. 2005, Nogueira 2006).
Foi sugerido que um dos principais fatores determinantes na diversidade da herpetofauna do Cerrado é a estratificação horizontal de hábitats, havendo um mosaico de diferentes fisionomias justapostas, cada uma contendo uma composição distinta de espécies (Colli et al. 2002). Estudos recentes com a fauna de lagartos no Brasil central corroboram esta predição, e foram observados padrões de distribuição local não-aleatórios entre as espécies e os diferentes hábitats disponíveis (Valdujo 2003, Nogueira et al. 2005). Estes padrões foram interpretados como resultado de diferenças históricas acumuladas entre as linhagens presentes na área (Vitt et al. 1999, 2003, Nogueira et al. 2005).
O objetivo do presente projeto é apresentar os resultados da amostragem de espécies de Squamata da porção sul do Parque Nacional Grande Sertão Veredas, com técnicas padronizadas que permitem comparações com outras áreas do Cerrado, estudadas com metodologia semelhante. Adicionalmente, pretende-se analisar a riqueza, abundância e distribuição local da fauna de lagartos, anfisbenas e serpentes, contribuindo para o conhecimento do padrão de distribuição local das espécies no domínio, descrevendo a composição das taxocenoses, e sua associação com os hábitats disponíveis.
Material e Métodos
1. Área de estudo
O Parque Nacional Grande Sertão Veredas (15° 23' S e 45° 54' W), com área de 230.714 ha (Figura 1), está localizado dentro do Domínio Morfoclimático do Cerrado (Ab'Saber 1977), na divisa dos estados de Minas Gerais e Bahia. Situa-se na parte sul do "Chapadão Central", unidade geomorfológica pertencente ao Planalto Divisor São Francisco-Tocantins, também conhecida como a região dos Gerais. A região é de planalto sedimentar arenoso (600-850 m), com um relevo plano a suave ondulado (Radam 1982, Felfili & Silva Júnior 2001). Predominam os solos do tipo latossolo vermelho-amarelo, e areias quatzosas distróficas desenvolvidas de arenitos cretáceos da formação Urucuia. O Clima é do tipo Aw de Köppen, com temperaturas médias anuais amenas, chuvas concentradas no verão e estação seca de 3 a 5 meses no inverno (Radam 1982). A paisagem é dominada por vegetação do tipo savânica, com a presença irregular de campos de gramíneas, e de veredas acompanhando os rios (Radam 1982). O estudo foi conduzido na porção sul do Parque, no estado de Minas Gerais.
2. Hábitats amostrados
Foram amostrados na região cinco tipos de ambientes, incluindo as principais fitofisionomias típicas do Cerrado (Oliveira-Filho & Ratter 2002), sendo uma unidade de amostragem (40 baldes com disposição padronizada, em 10 conjuntos amostrais) utilizada para o levantamento em cada hábitat estudado, localizados de acordo com a Figura 1.
Cerrado sensustricto na drenagem do Ribeirão Mato Grande, bacia do Carinhanha (conjuntos amostrais 1-10, 15° 20' 38" S e 45° 57' 01" W). Ponto B. Ambiente de vegetação semi-aberta, com predominância de vegetação arbórea e arbustiva, formando um dossel descontínuo, e estrato herbáceo-graminoso medianamente desenvolvido, deixando espaços de solo nu. O solo é predominantemente do tipo latossolo vermelho-amarelo, com esparsa cobertura de serapilheira.
Campo sujo na drenagem do Ribeirão Mato Grande, bacia do Carinhanha (conjuntos 11-20, 15° 18' 25" S e 45° 56' 29" W). Ponto C. Ambiente com solo avermelhado, argilo-arenoso coberto por gramíneas em grande densidade, com a presença irregular de arbustos, palmeiras e pequenas árvores isoladas.
Campo sujo em solo arenoso na drenagem do Rio Preto (conjuntos 31-40, 15° 13' 24" S e 45° 48' 44" W). Ponto F. Ambiente com solo arenoso coberto por pequena quantidade de serapilheira. Vegetação predominantemente herbácea com a presença esparsa de arbustos, palmeiras e árvores de até 5 m, isoladas. A vegetação neste ponto sofre forte influência de campos úmidos, que circundam o campo sujo, cobrindo as partes mais baixas e menos drenadas do solo próximas à calha do Rio Preto, um dos principais cursos d'água do PNGSV.
Mata de galeria em afluente do Ribeirão Mato Grande, bacia do Carinhanha (conjuntos 21-30, 15° 18' 30" S e 45° 57' 37" W). Ponto D. Ambiente com formação florestal, adjacente a um pequeno rio com cerca de 3 m de largura, O solo é rico em matéria orgânica, e coberto por grande quantidade de serapilheira. Possui sub-bosque fechado, com muitos arbustos, lianas e árvores de diversos tamanhos formando um dossel descontínuo.
Carrasco na região do divisor de águas entre a Bacia do Preto e Carinhanha (conjuntos 41-50, 15° 15' 13" S e 45° 53' 20" W). Ponto E. Nome local para formação de savana densa e seca de topo de planalto (ver descrições detalhadas em Lombardi et al. 2005). Ambiente com dossel descontínuo de cerca de 4 a 6 m e predomínio de espécies arbóreas, com pouco espaçamento entre caules, geralmente finos e pouco retorcidos, mesclando espécies do Cerrado e da Caatinga. Sub-bosque com arbustos altos, palmeiras, cactáceas e bromeliáceas. O solo é arenoso, de coloração vermelho-amarelado, coberto por pequena quantidade de serapilheira e poucas gramíneas.
3. Métodos de amostragem
A fauna de répteis Squamata foi amostrada com a utilização de armadilhas de queda com cercas-guia (pitfall traps with drift fences, ver métodos em Nogueira et al. 2005), complementada por busca ativa com coleta manual nas proximidades dos conjuntos amostrais (Tabela 1). Cada unidade amostral consistiu de 40 baldes de 35 litros (10 conjuntos de 4 baldes), dispostos em formação radial, unidos por lona plástica de 5 m de extensão e 0,5 m de altura. O esforço total despendido foi de 3.400 dias-balde, complementados por 14,2 horas-homem de procura ativa, em amostragem efetiva de 18/10 a 03/11/2001. Os exemplares-testemunho foram tombados na coleção herpetológica do Museu de Zoologia da USP (MZUSP) e Instituto Butantan (IB), (Apêndice 1Apêndice 1). As coletas de dados em campo fizeram parte de um projeto mais amplo visando obter dados de diversidade, distribuição e endemismo de lagartos, anfisbenas e serpentes da região do Cerrado (resultados parciais em Nogueira 2006, Costa et al. 2007).
4. Análise de dados
Para avaliar o esforço de coleta e permitir comparações da riqueza entre diferentes localidades do Cerrado, foi produzida uma curva de acumulação de espécies (Gotelli & Colwell 2001), com o programa EstimateS v.7.5.0. (Colwell 2005), através de 1.000 aleatorizações, baseada no esforço de coleta da amostra original. A curva foi re-escalonada em função do número de indivíduos, para permitir comparações entre localidades independentes do sucesso de captura (ver Gotelli & Colwell 2001). A partir da curva de acumulação de espécies, a riqueza de répteis Squamata do PNGSV foi estimada, e dentre as estimativas, optou-se pela obtida com Jacknife II, um estimador de riqueza não-paramétrico considerado acurado (Nogueira 2006), usando o programa EstimateS (Colwell 2005). A riqueza estimada foi comparada com a riqueza conhecida para uma área mais ampla, de 50 km de raio, através de exemplares-testemunho tombados em coleções científicas (MZUSP, CHUNB e IB). A riqueza nesta região mais ampla indicaria a riqueza regional de espécies, tendo sido a principal fonte de dados de riqueza para serpentes e anfisbenas, uma vez que amostragens de curto prazo para estes grupos tendem a subestimar a riqueza local. Portanto, ao investigar a riqueza e composição regional de espécies temos uma visão de espécies com ocorrência altamente provável nas áreas amostradas diretamente.
A distribuição das espécies entre os hábitats disponíveis foi estudada através da análise de modelos nulos, com 5.000 aleatorizações da matriz original de capturas para cada hábitat, utilizando-se o módulo de co-ocorrência do programa Ecosim v.7.72 (Gotelli & Entsminger 2005), com o índice C-score (ver análises similares em Gainsbury & Colli 2003 e Nogueira et al. 2005).
A diversidade de espécies em cada hábitat foi calculada através do índice de diversidade de Shannon (H'), com o programa Ecosim v. 7.72 (Gotelli & Entsminger 2005), e o índice de diversidade de Simpson (1-D), conforme Magurran (2004), para que fossem comparados. Foi realizada uma análise de agrupamento com os resultados de cada unidade amostral, para comparar a composição de espécies entre os diferentes hábitats, usando UPGMA como o algorítmo de agrupamento e o índice modificado de Morisita Horn como a medida de similaridade (Magurran 2004), através do programa MVSP 3.1 (Kovach 2000). As diferenças na composição e abundância de Squamata entre os diferentes hábitats foram comparadas com resultados obtidos para outras localidades estudadas no Cerrado (Nogueira et al. 2005, Nogueira 2006).
Resultados
No total, 50 espécies de Squamata são registradas para o PNGSV e entorno no presente estudo (Tabela 1), dentre as quais 25 lagartos, três anfisbenas e 22 serpentes, divididas em sete famílias de lagartos, cinco de serpentes e uma de anfisbenas. A fauna de Squamata amostrada em campo inclui 29 espécies (Tabela 2), das quais 21 foram coletadas em armadilhas de queda, e oito foram amostradas apenas em coletas manuais, não sendo consideradas nas discussões de abundância. Adicionalmente, 21 outras espécies são conhecidas de localidades próximas ao Parque (exemplares testemunho, ver apêndiceApêndice 1), e têm grande probabilidade de ocorrência no interior da área protegida.
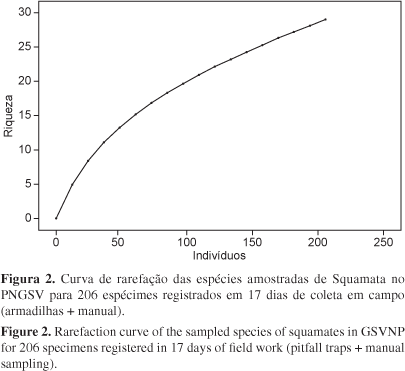
A curva de acumulação de espécies de Squamata (Figura 2) baseada em esforço de coleta e re-escalonada pra número de indivíduos, não atinge uma assíntota, mesmo passados 17 dias de amostragem. O estimador de riqueza Jacknife II retornou uma riqueza local de 53 espécies de Squamata para o PNGSV, comparável à riqueza observada (espécies coletadas, mais testemunhos de coleções) de 50 espécies.
Entre os lagartos, as espécies mais abundantes foram respectivamente Vanzosaura rubricauda, Cnemidophorus cf. ocellifer e Ameiva ameiva, seguidas pelas espécies com média abundância Mabuya heathi, Mabuya frenata e Colobosaura modesta. Estas seis espécies juntas corresponderam a 84% do total de indivíduos de Squamata amostrados, sendo que as nove espécies restantes de lagartos tiveram baixa abundância, com menos de cinco indivíduos amostrados com as armadilhas de queda (Figura 3). Das quatro espécies de Iguania (sensu Frost et al. 2001), nenhuma teve mais de três indivíduos amostrados em armadilhas de queda, e nenhuma espécie da família Gekkonidae foi amostrada. Dentre as espécies de serpentes e anfisbenas, apenas Leptotyphlops koppesi se destacou em abundância, com cinco indivíduos coletados.
Através da análise de co-ocorrência, não foi possível detectar um padrão estruturado de distribuição das espécies, sendo que o índice Cscore observado não foi maior que o esperado por uma distribuição ao acaso em 5000 simulações [observado: 1,000; simulado (média): 1,001; p > 0,476 ]. De fato, entre as quatro espécies dominantes em abundância (Vanzosaura rubricauda, Cnemidophorus cf. ocellifer, Ameiva ameiva e Mabuya heathi), não houve uma especificidade de hábitat conspícua, revelada pelos padrões de presença e ausência. No entanto, é possível observar maior abundância das espécies em ambientes abertos (campestres e savânicos) em relação aos ambientes florestais (Figura 4), e, portanto, um uso diferencial dos principais tipos de hábitats disponíveis por parte destas espécies. Através da análise de agrupamento (Figura 5) é possível observar a grande similaridade faunística entre os hábitats campestres (campo sujo e campo sujo arenoso), e entre as formações savânicas ou semi-abertas (cerrado sensu stricto e carrasco), e a baixa similaridade entre estes hábitats e a formação florestal (mata de galeria).
Dentre as fitofisionomias estudadas, a que apresentou a maior riqueza de lagartos foi o cerrado sensu stricto, seguido de carrasco e campo sujo arenoso (Tabela 3). O cerrado sensu stricto e carrasco destacaram-se também por apresentar cinco espécies exclusivas cada.
Apesar dos muitos problemas e limitações do índice de Shannon (ver Magurran 2004) ele foi usado por enfatizar o componente riqueza da diversidade, e por dar mesmo peso a espécies raras e abundantes (Magurran 2004). Através dele (Tabela 3) pode-se observar a maior diversidade nos hábitats savânicos (cerrado sensu stricto e carrasco) e mata de galeria, onde houve baixa dominância. O índice de Simpson por outro lado, fornece uma boa medida de heterogeneidade (Magurran 2004). Este, porém, aparentemente subestimou a diversidade das fisionomias ao ignorar as espécies representadas por apenas um indivíduo ("singletons"), e superestimou a diversidade da mata de galeria, provavelmente pela equitatividade na abundância relativa entre as espécies presentes, mesmo com o baixo número de indivíduos e espécies coletados neste hábitat.
Discussão
O Parque Nacional Grande Sertão Veredas mostrou uma alta riqueza de Squamata, e a observação de 25 espécies de lagartos concorda com a estimativa de riqueza de 13 a 28 espécies em localidades bem amostradas do Cerrado (Colli et al. 2002, Nogueira 2006). As estimativas de riqueza de lagartos, estudados nesta e em outras nove localidades de Cerrado em Nogueira (2006), revela que o PNGSV apresenta a mais alta riqueza estimada de lagartos, podendo exceder 28 espécies simpátricas, o que enfatiza a riqueza da herpetofauna nesta região do Cerrado (ver Nogueira 2006). Já os demais grupos aparentemente ainda estão bastante sub-amostrados, evidenciando a necessidade de novos inventários na região, especialmente estudos de médio prazo, englobando regiões do parque ainda pouco estudadas, como a porção sul do Chapadão Ocidental da Bahia, na porção norte do parque (ver Figura 1).
É quase certo que com um maior esforço de coleta outras espécies de Squamata ainda sejam amostradas nesta localidade, uma vez que um grande número de espécies raras são registradas apenas em estudos mais longos em localidades no Cerrado (Nogueira et al. 2005, Valdujo 2003). Localidades bem estudadas no Cerrado apresentam riqueza de serpentes de cerca de 40 a 70 espécies, com valores de riqueza de Squamata variáveis, mas que podem exceder as 90 espécies (Strüssmann 2000, Pavan & Dixo 2002, Vitt et al. 2005, França & Araújo 2007). De acordo com a curva de acumulação de espécies, obtida após a amostragem de 206 espécimes de Squamata, a riqueza local ainda encontra-se bastante subestimada, já que não há tendência à estabilização da curva, com estimadores de riqueza retornando valores entre 35 (Bootstrap) e 53 espécies (Jacknife 2), ainda muito abaixo do valor esperado para localidades no Cerrado (Strüssmann 2000, Pavan & Dixo 2002, Vitt et al. 2005, França & Araújo 2007). Costa et al. (2007), em abordagem conservadora, utilizando técnicas de distribuição potencial de espécies, detectaram que a riqueza de Squamata pode exceder 70 espécies em boa parte da região do Cerrado. Deste modo, a riqueza estimada e observada no presente estudo deve ser tomada como uma subestimativa, decorrente do esforço amostral ainda insuficiente.
Dentre as espécies registradas apenas a partir de dados prévios em coleções, muitas provavelmente ocorrem também dentro da área sul do parque. Como exemplo, Kentropyx paulensis e Polychrus acutirostris foram encontradas apenas na região da Fazenda Trijunção, atualmente pertencente à região noroeste do parque, no estado da Bahia (R. Brandão, com. pess.).
A taxocenose de lagartos do PNGSV, apesar de rica, é caracterizada pela grande abundância relativa de apenas seis espécies, e pela raridade de outras espécies, especialmente de Iguania e Gekkonidae, indicando a dominância ecológica da linhagem dos Autarchoglossa (Vitt et al. 2003), havendo seis espécies de Gymnophthalmidae, três espécies de Teiidae e quatro espécies de Scincidae simpátricos na localidade.
As anfisbenas e serpentes amostradas também se mostraram pouco abundantes. Com a predominância de hábitos de vida fossoriais em algumas das espécies, a ocorrência de espécies de grande porte, a amostragem destes grupos torna-se difícil através da metodologia de armadilhas de queda, em período curto de amostragem, fazendo com que a riqueza obtida esteja muito aquém da riqueza real. Portanto, pouco se pode dizer sobre o padrão de distribuição e uso de hábitat destes grupos de Squamata na região, antes que estudos detalhados de médio e longo prazo sejam realizados.
Neste estudo, não foi verificada uma estruturação significativa na taxocenose de Squamata, sendo os padrões de co-ocorrência das espécies similares ao esperado em distribuições aleatórias nos diferentes tipos de ambientes. Em um estudo com serpentes no Cerrado do Brasil Central, não foi encontrada organização nas taxocenoses de serpentes, indicando uma baixa importância de condicionantes locais para a diversidade deste grupo (França & Araújo 2007). Assim, pode ser prematuro afirmar que haja alguma relação estrita entre as espécies e as fitofisionomias na região. Ainda não é bem compreendido em que grau os efeitos locais (interações ecológicas, perturbações, disponibilidade de recursos) e históricos (características intrínsecas das linhagens), atuam na estruturação das taxocenoses de lagartos do Cerrado (Mesquita et al. 2006a,b), e em qual escala a heterogeneidade paisagística influencia a biodiversidade local do Cerrado (Ricklefs 2004, ver Silva et al. 2006). Adicionalmente, o uso dos recursos por uma espécie pode ser diferenciado sazonalmente (Pavan 2001), e alguns tipos de hábitats podem não constituir barreiras para a fauna adaptada aos ambientes abertos do Cerrado (Rodrigues 2005b). Por outro lado, além dos fatores estruturais relacionados às diferenças entre os hábitats, outros fatores podem estar relacionados à distribuição local dos lagartos, como fatores edáficos e abundância de microhábitats (Valdujo 2003).
No entanto, as espécies apresentaram diferença no uso de hábitats disponíveis, aparentemente utilizando de modo desigual as fisionomias campestres, savânicas e florestais. Este padrão se reflete na grande similaridade faunística entre estas categorias de hábitats aqui utilizadas, evidenciada pela análise de agrupamento, onde ambientes estruturalmente similares estão agrupados em termos de diversidade de Squamata. Em estudo mais amplo com a fauna de lagartos do Cerrado, os ambientes abertos e florestais representaram barreiras mútuas à distribuição local de lagartos (Nogueira 2006), concordando com o padrão detectado no presente estudo. Deste modo, é possível que a ausência de estruturação na taxocenose pela análise de co-ocorrência seja um artefato da amostragem limitada, o que poderá ser testado com novos estudos e uma ampliação do esforço de amostragem na região.
Predominam na taxocenose espécies com preferência por hábitats abertos e semi-abertos. O uso de hábitat pelas espécies de lagartos no PNGSV concorda com o observado em populações da mesma espécie ou espécies relacionadas em outras localidades. As espécies que tipicamente se utilizam de formações florestais no Cerrado, como Colobosaura modesta, Mabuya frenata e Mabuya nigropunctata (Vitt 1991, Vrcibradic & Rocha 1998, Brandão & Araújo 2001, Valdujo 2003, Nogueira et al. 2005, Mesquita et al. 2006b, Nogueira 2006), utilizaram frequentemente hábitats savânicos ou semi-abertos, como o cerrado sensu stricto e o carrasco. Algumas espécies de áreas abertas que habitam marginalmente as formações florestais como Ameiva ameiva e Cercosaura ocellata (Vitt & Colli 1994, Avila-Pires 1995, Brandão & Araújo 2001, Pavan 2001, Nogueira et al. 2005), foram freqüentes também em formações savânicas e florestais.
As espécies típicas de formações abertas habitaram preferencialmente fisionomias savânicas e campestres, estando relacionadas a certas características de cada ambiente, em concordância com a ecologia conhecida das espécies. Anolis meridionalis, Mabuya dorsivittata e Ophiodes striatus possuem preferência por áreas campestres com grande densidade de gramíneas (Vitt & Caldwell 1993, Valdujo 2003, Nogueira et al. 2005, Nogueira 2006), Vanzosaura rubricauda, Mabuya heathi e Cnemidophorus cf. ocellifer por áreas de solo arenoso com baixa densidade de gramíneas (Vanzolini et al. 1980, Vitt 1995, Mesquita & Colli 2003, Valdujo 2003, Mesquita et al. 2006b, Nogueira 2006) e Tupinambis duseni por hábitats campestres (Valdujo 2003, Nogueira 2006); Tropidurus itambere geralmente está associado a afloramentos rochosos (Van-Sluys 1992, Faria & Araújo 2004), porém também campo sujo (Thomé 2006) e cerrado típico (Nogueira et al. 2005), e Micrablepharus atticolus, associada a hábitats abertos campestres e savânicos (Vitt 1991, Vitt & Caldwell 1993, Rodrigues 1996, Vieira et al. 2000, Valdujo 2003, Nogueira et al. 2005, Thomé 2006), usando ocasionalmente ninhos de saúvas e cupinzeiros (Vitt 1991, Vitt & Caldwell 1993, Rodrigues 1996). Embora inicialmente considerada rara e, como boa parte das espécies congenéricas, associada a ambientes florestais (ver discussões em Colli et al. 1998), Bachia bresslaui, espécie endêmica do Cerrado (Colli et al. 2002, Nogueira 2006), foi encontrada em hábitats abertos, com estrutura semelhante aos ambientes nos quais foi registrada em outras localidades do Cerrado (Colli et al. 1998, Nogueira et al 2005).
Stenocercus quinarius, espécie recentemente descrita (Nogueira & Rodrigues 2006), foi coletada no PNGSV nas fisionomias de carrasco e cerrado sensu stricto. As espécies deste gênero no Brasil apresentam distribuição aparentemente disjunta, habitando formações semi-abertas e florestas secas, em localidades restritas e descontínuas. Este padrão indica uma provável distribuição relictual associada a manchas de ambientes favoráveis nas regiões entre o Cerrado e a Caatinga (ver discussões em Nogueira & Rodrigues 2006).
Nas formações de carrasco também foi encontrada uma provável espécie não-descrita do gênero Psilophthalmus. Portanto, as formações de carrasco destacam-se por abrigarem duas espécies com distribuição restrita a esta região do Cerrado, além de possuir alta diversidade de Squamata. Estas formações do PNGSV mantêm uma estrutura semi-aberta, e apresentam vários elementos florísticos de Cerrado e Caatinga, mostrando-se deste modo bastante distintas das formações semi-abertas de floresta seca de baixada, na região da depressão do Rio Paranã, no leste de Goiás e Tocantins, que têm sido foco de estudos detalhados com a avifauna (Silva & Bates 2002) e a herpetofauna (Werneck & Colli 2006). Novos estudos nestas matas secas e carrascos isolados no planalto do oeste da Bahia e contato Cerrado e Caatinga deverão trazer novas descobertas zoológicas, com potencial para endemismos restritos (Nogueira e Rodrigues, 2006).
Psilophthalmus paeminosus Rodrigues 1991, a única espécie conhecida do gênero, é endêmica da Caatinga e vive na serapilheira em hábitats arenosos com certa densidade de arbustos (Rodrigues 1991, Delfim et al. 2006), semelhante ao hábitat utilizado pela espécie do PNGSV. Deste modo, os gêneros Psilophthalmus e Vanzosaura são encontrados no Cerrado apenas em regiões arenosas, um possível caso de inércia filogenética (Pellegrino et al. 2001, Nogueira 2006) nesta radiação de microteídeos psamófilos (Rodrigues 1995). Além desta provável espécie não descrita de lagarto, foi registrada também para a região uma provável nova espécie de anfisbena, Leposternon sp. (Síria Ribeiro, com. pess.), capturada na fisionomia de cerrado sensu stricto.
A alta riqueza e diversidade de lagartos encontrada no cerrado sensu stricto e nas áreas campestres concorda com outros estudos realizados na área nuclear do Cerrado (Valdujo 2003, Nogueira 2006), onde as fisionomias abertas também possuem maior riqueza de espécies. Estes resultados têm implicações na conservação do Cerrado, já que as regiões de topo de chapada, onde predomina vegetação aberta, são intensamente afetadas pela expansão agropecuária (Ratter et al. 1997, Cavalcanti & Joly 2002), e as poucas regiões ainda com cobertura vegetal original sofrem grande pressão de ocupação (Rodrigues 2005b). Uma vez que apenas uma área muito pequena do Cerrado encontra-se protegida em áreas de conservação (Cavalcanti & Joly 2002, Klink & Machado 2005, Silva et al. 2006), é necessário buscar proteger novas regiões que englobem áreas de planaltos para que sejam mantidas populações de espécies endêmicas e de distribuição restrita, especialmente na região ao norte dos limites do PNGSV, no planalto ocidental da Bahia, sob intensa pressão de desmatamento.
Agradecimentos
À FAPESP (projeto 02/0015-3) pelo apoio concedido através de Bolsa de Doutoramento ao autor sênior. Este trabalho é parte do "Projeto Répteis Squamata do Cerrado", que teve apoio financeiro da Conservação Internacional do Brasil. Guarino Rinaldi Colli, Hussam E. D. Zaher e Francisco L. Franco permitiram acesso aos exemplares tombados nas coleções herpetológicas da UnB, MZUSP e Instituto Butantan, respectivamente. Frederico França e Ana Paula Carmignotto auxiliaram os trabalhos de campo. O IBAMA e os funcionários do PN Grande Sertão Veredas permitiram a coleta de exemplares no campo. Assessores anônimos contribuíram com importantes comentários.
Recebido em 28/06/07
Versão Reformulada recebida em 13/08/07
Publicado em 06/09/07
ISSN 1676-0603.
Número de tombo e museus dos espécimes coletados:
IGUANIA:Anolis meridionalis MZUSP 94396. Stenocercus quinarius MZUSP 94068 69. Tropidurus itambere MZUSP 94632 36. Tropidurus oreadicus MZUSP 94601. SCLEROGLOSSA: Ameiva ameiva MZUSP 94645 55. Bachia bresslaui MZUSP 94473 74. Cercosaura ocellata MZUSP 94240 41, MZUSP 94678. Cnemidophorus gr. ocellifer MZUSP 93408, MZUSP 94077 97. Colobosaura modesta MZUSP 94420 25. Mabuya dorsivittata MZUSP 94547. Mabuya frenata MZUSP 94561 64. Mabuya heathi MZUSP 94527 40. Mabuya nigropunctata MZUSP 94522 24. Micrablepharus atticolus MZUSP 94179. Ophiodes striatus MZUSP 94410. Psilophthalmus sp. MZUSP 94703. Tupinambis duseni MZUSP 94714. Vanzosaura rubricauda CHUNB23821; MZUSP 94144 78, MZUSP 94705 11. Amphisbaenia: Amphisbaena vermicularis MZUSP 93157. Leposternon sp. MZUSP 93158. Serpentes: Boa constrictor amarali CN00561. Bothrops moojeni IB 67476. Liotyphlops ternetzi MZUSP12886. Leptotyphlops koppesi MZUSP12881, MZUSP 12883 MZUSP 12885, MZUSP 12887. Liophis paucidens MZUSP12874. Oxybelis aeneus MZUSP12873. Philodryas nattereri CN00441. Thamnodynastes hypoconia MZUSP 12888. Waglerophis merremii MZUSP 12879 80.
Exemplares testemunho de coleções:
IGUANIA:Polychrus acutirostris Chapada Gaúcha (MG): CHUNB33968; Cocos (BA): CHUNB00009. Tropidurus etheridgei Arinos (MG): MZUSP 09323 33. Tropidurus torquatus Arinos (MG): MZUSP 09344; 9352; 9357-58. SCLEROGLOSSA: Briba brasiliana Rio Pandeiros (MG): MZUSP 04038 47. Phyllopezus pollicaris Rio Pandeiros (MG): MZUSP 04075. Kentropyx paulensis Cocos (BA): MZUSP 94881. Tupinambis quadrilineatus Chapada Gaúcha (MG): CHUNB33980. Amphisbaenia: Leposternon microcephalum Rio Pandeiros (MG): MZUSP6674. Serpentes: Apostolepis ammodites Cocos (BA): IB61525, CHUNB23715. Bothrops lutzi Cocos (BA): IB44518 24. Chironius flavolineatus Arinos (MG): MZUSP03849. Chironius quadricarinatus Rio Pandeiros (MG): IB9168. Epicrates cenchria Rio Pandeiros (MG): IB9165 66. Liophis dilepis Rio Pandeiros (MG): IB9156 57. Liophis paucidens Arinos (MG): CHUNB37262. Liophis poecilogyrus Rio Pandeiros (MG): IB9159 60. Liophis typhlus Rio Pandeiros (MG): IB9169. Philodryas nattereri Arinos (MG): CHUNB37263. Phimophis guerini Cocos (BA): CHUNB23789-90. Phimophis iglesiasi Cocos (BA): CHUNB15612. Pseudoboa neuwiedii Rio Pandeiros (MG): IB9155. Pseudoboa nigra Arinos (MG): CHUNB37261. Psomophis joberti Rio Pandeiros (MG): IB9158.
- AB'SÁBER, A. 1977. Os domínios morfoclimáticos da América do Sul: primeira aproximação. Geomorfologia 52:1-22.
- AVILA-PIRES, T.C.S. 1995. Lizards of Brazilian Amazonia (Reptilia: Squamata). Zool. Verh., Leidein. 299:1-706.
- BRANDÃO, R.A. & ARAÚJO, A.F.B. 2001. A herpetofauna associada às matas de galeria do Distrito Federal. In Cerrado: Caracterização e -Recuperação de Matas de Galeria (Ribeiro, J.F., Fonseca, C.E.L. & Sousa-Silva, J.C., eds.). Embrapa Cerrados, Planaltina, p. 561-604.
- CAVALCANTI, R & JOLY, C.A. 2002. Biodiversity and conservation priorities in the Cerrado region. In The Cerrados of Brazil: Ecology and Natural History of a Neotropical Savanna. (Oliveira, P.S. & Marquis, R.J., eds.). Columbia University Press, New York. p. 351-367.
- COLLI, G.R., ZATZ, M.G. & da CUNHA, H.J. 1998. Notes on the ecology and geographical distribution of the rare gymnophthalmid lizard Bachia bresslaui Herpetologica 54:169-174.
- COLLI G.R., BASTOS, R.P. & ARAÚJO, A.F.B. 2002. The character and dynamics of the Cerrado Herpetofauna. In The Cerrados of Brazil: Ecology and Natural History of a Neotropical Savanna. (Oliveira, P.S. & Marquis, R.J., eds.). Columbia University Press, New York. p. 223241.
- COLLI, G.R., COSTA, G.C., GARDA, A.A., KOPP, K.A., MESQUITA, D.O., PÉRES, A.K., Jr., VALDUJO, P.H., VIEIRA, G.H.C. & WIEDERCKER, H.C. 2003a. A critically endangered new species of Cnemidophorus (Squamata, Teiidae) from a Cerrado enclave in southwestern Amazonia, Brazil. Herpetologica 59:76-88.
- COLLI, G.R., CALDWELL, J.P., COSTA, G.C., GAINSBURY, A.M., GARDA, A.A., MESQUITA, D.O., FILHO, C.M.M., SOARES, A.H.B., SILVA, V.N., VALDUJO, P.H., VIEIRA, G.H.C., VITT, L.J., WERNECK, F.P., WIEDERHECKER, H.C. & ZATZ, M.G. 2003b. A new species of Cnemidophorus (Squamata, Teiidae) from the Cerrado biome in central Brazil. Occ. Pap. San Noble Mus. Nat Hist. 14:1-14.
- COLWELL, R.K. 2005. EstimateS: Statistical estimation of species richness and shared species from samples. Version 7.5.0. User's Guide and application published at: http://purl.oclc.org/estimates
- COSTA, G.C., NOGUEIRA, C., MACHADO, R.B. & COLLI, G.R. 2007. Squamate richness in the Brazilian Cerrado and its environmental-climatic associations. Diversity and Distributions (OnlineEarly Articles). doi:10.1111/j.1472-4642.2007.00369.x http://www.blackwell-synergy.com/ddi Artigo publicado online em:14-Maio-2007.
- DELFIM, F.R., GONÇALVES, E. de M. & da SILVA, S.T. 2006. Squamata, Gymnophthalmidae, Psilophthalmus paeminosus: distribution extension, new state record. Checklist 2:89-92.
- FARIA, R.G. & ARAÚJO, A.F.B. 2004. Sintopy of two Tropidurus lizard species (Squamata: Tropiduridae) in a rocky Cerrado habitat in central Brazil. Braz. J.Biol. 64:775-786.
- FELFILI, J.M. & SILVA JÚNIOR, M.C. 2001. Biogeografia do bioma Cerrado: Estudo fitofisionômico da Chapada do Espigão Mestre do São Francisco. Faculdade de Tecnologia, Universidade de Brasília, Brasília.
- FERRAREZZI, H., BARBO, F. E. & ALBUQUERQUE, C. E. 2005. Phylogenetic relationships of a new species of Apostolepis from Brazilian Cerrado with notes on the assimilis group (Serpentes: Colubridae: Xenodontinae: Elapomorphini). Pap. Avulsos Zool. 45:215-229.
- FRANÇA, F.G.R. & ARAÚJO, A.F.B. 2007. Are there co-occurrence patterns that structure snake communities in Central Brazil? Braz. J. Biol. 67:33-40.
- FROST, D.R., ETHERIDGE, R., JANIES, D. & TITUS, T.A. 2001. Total Evidence, Sequence Alignment, Evolution of Polychrotid Lizards and a Reclassification of the Iguania (Squamata: Iguania). Am. Mus. Novitat. 3343:1-38.
- GAINSBURY, A. M. & COLLI, G. R. 2003. Lizard assemblages from natural Cerrado enclaves in southwestern Amazonia: the role of stochastic extinctions and isolation. Biotropica 35:503-519.
- GOTELLI, N.J. & COLWELL, R.K. 2001. Quantifying biodiversity: procedures & pitfalls in the measurement & comparison of species richness. Ecol. Lett. 4:379391.
- GOTELLI, N.J. & ENTSMINGER, G.L. 2005. EcoSim: Null Models Software for Ecology. Version 7.72. Available at http://together.net/~gentsmin/ecosim.htm
- KLINK, C.A. & MACHADO, R.B. 2005. A conservação do Cerrado brasileiro. Megadiversidade 1:147-155.
- KOVACH, W.L. 2000. MVSP A multi-variate statistical package for Windows, version 3.1. Penthraeth: Kovach Computing Services.
- LOMBARDI, J.A., SALINO, A. & TEMONI, L.G. 2005. Diversidade florística de plantas vasculares no município de Januária, Minas Gerais, Brasil. Lundiana 6:3-20.
- MAGURRAN, A.E. 2004. Measuring Biological Diversity. Blackwell Publishing.
- MESQUITA D.O. & COLLI G.R. 2003. The ecology of Cnemidophorus ocellifer (Squamata, Teiidae) in a Neotropical Savanna. J. Herpetol. 37: 498-509.
- MESQUITA D.O., COSTA G.C. & COLLI G.R. 2006a. Ecology of an Amazonian Savanna lizard assemblage in Monte Alegre, Pará State, Brazil. South American Journal of Herpetology 1:61-71.
- MESQUITA D.O., COLLI G.R., FRANÇA F.G.R & VITT, L. 2006b. Ecology of a Cerrado Lizard Assemblage in the Jalapão Region of Brasil. Copeia 2006:460-471.
- MYERS, N., MITTERMEIER, R.A., MITTERMEIER, C.G., da FONSECA, G.A.B. & KENT, J. 2000. Biodiversity hotspots for conservation priorities. Nature 403:853-858.
- NOGUEIRA, C. 2001. New records of squamate reptiles in Central Brazilian Cerrado II: Brasília region. Herp. Rev. 32:285-287.
- NOGUEIRA, C. 2006. Diversidade e padrões de distribuição da fauna de lagartos do Cerrado. Tese de Doutorado, Universidade de São Paulo, São Paulo.
- NOGUEIRA, C., VALDUJO, P.H. & FRANÇA, F.G.R. 2005. Habitat variation and lizard diversity in a Cerrado area of Central Brazil. Stud. Neotrop. Fauna Environ. 40:105-112.
- NOGUEIRA, C. & RODRIGUES, M.T. 2006. The genus Stenocercus (Squamata: Tropiduridae) in Extra-Amazonian Brazil, with the description of two new species. South American Journal of Herpetology, 1:149-165.
- OLIVEIRA-FILHO, A.T. & RATTER, J.A. 2002. Vegetation physiognomies and woody flora of the Cerrado biome. In The Cerrados of Brazil: Ecology and Natural History of a Neotropical Savanna. (Oliveira, P.S. & Marquis, R.J., eds.). Columbia University Press, New York. p. 91-120.
- PAVAN, D. 2001. Considerações ecológicas sobre a fauna de sapos e lagartos de uma área do Cerrado brasileiro sob o impacto do enchimento do reservatório de Serra da Mesa. Tese de Mestrado, Universidade de São Paulo, São Paulo.
- PAVAN, D. & DIXO, M. 2002. A Herpetofauna da área de influência do reservatório da Usina Hidrelétrica Luis Eduardo Magalhães, Palmas, TO. Humanitas 4:13-30.
- PELLEGRINO, K.C.M., RODRIGUES M.T., YONENAGA-YASSUDA, Y. & SITES JR, J.W. 2001. A molecular perspective of the evolution of microteiid lizards (Squamata, Gymnophthalmidae), and a new classification to the family. Biol. J.Linn. Soc. 74:315-338.
- RADAM. 1982. Projeto Radam Brasil – Levantamento de recursos naturais Volume 29. Folha SD.23 Brasília. Ministério das Minas e Energia, Secretaria-Geral, Rio de Janeiro.
- RATTER, J.A., RIBEIRO, J.F. & BRIDGEWATER, S. 1997. The Brazilian Cerrado and threats to its biodiversity. Ann. Bot. London 80:223-230.
- RICKLEFS, R.E. 2004. A comprehensive framework for global patterns in biodiversity. Ecol. Lett. 7:1-15.
- RODRIGUES, M.T. 1991. Herpetofauna das dunas interiores do Rio São Francisco, Bahia, Brasil.II. Psilophthalmus: um novo gênero de microteiidae sem pálpebra (Sauria, Teiidae). Pap. Avulsos Zool. 37:321-327.
- RODRIGUES, M.T. 1995. Filogenia e historia geográfica de uma radiação de lagartos microteídeos (Sauria, Teiioidea, Gymnophthalmidae). Tese de Livre Docência, Universidade de São Paulo, São Paulo.
- RODRIGUES, M.T. 1996. A new species of lizard, genus Micrablepharus (Squamata: Gymnophthalmidae), from Brazil. Herpetologica 52:535-541.
- RODRIGUES, M.T. 2005a. Conservação dos répteis brasileiros: os desafios para um país megadiverso. Megadiversidade 1:87-94.
- RODRIGUES, M.T. 2005b. A biodiversidade dos Cerrados: conhecimento atual e perspectivas, com uma hipótese sobre o papel das matas galerias na troca faunística durante ciclos climáticos. In Cerrado: Ecologia, biodiversidade e conservação. (Scariot, A., Silva, J.C.S. & Felfili, J.M. org.). Brasília, DF: Ministério do Meio Ambiente. p. 235-246.
- SICK, H. 1965. A Fauna do Cerrado. Arquivos de Zoologia 12:71-93.
- da SILVA, J.M.C. & BATES, J.M. 2002. Biogeographic patterns and conservation in the South American Cerrado: A Tropical Savanna Hotspot. BioScience 52:225-233.
- SILVA, J.F., FARIÑAS, M.R., FELFILI, J.M. & KLINK, C.A. 2006. Spatial heterogeneity, land use and conservation in the cerrado region of Brazil. J. Biogeogr. 33:536-548.
- STRÜSSMANN, C. 2000. Herpetofauna. InFauna silvestre da região do Rio Manso, MT. (Alho, C.J.R. et al., Org.). Brasília, DF: MMA/Edições IBAMA/ELETRONORTE, 2000. p.153-189.
- THOMÉ, M.T.C. 2006. Diversidade de anuros e lagartos em fisionomias de Cerrado na região de Itirapina, Sudeste do Brasil. Tese de Mestrado, Universidade de São Paulo, São Paulo.
- VALDUJO, P.H. 2003. Distribuição da comunidade de lagartos no mosaico fisionômico do cerrado e suas implicações para a conservação. Tese de Mestrado, Universidade de Brasília, Brasília.
- VAN-SLUYS, M. 1992. Aspectos da ecologia do lagarto Tropidurus itambere (Tropiduridae), em uma área do sudeste do Brasil. Rev. Bras. Biol. 52:181-185.
- VANZOLINI, P.E. 1963. Problemas faunísticos do cerrado. In: Simpósio sobre o Cerrado. EDUSP, São Paulo. p. 305-321.
- VANZOLINI, P.E. 1976. On the lizards of a Cerrado-Caatinga contact: evolutionary and zoogeographical implications (Sauria). Pap. Avulsos Zool. 29:111-119.
- VANZOLINI, P.E. 1988. Distributional patterns of South American lizards. In Proceedings of a workshop on Neotropical distributional patterns. (Vanzolini, P.E. & Heyer, W.R eds.). Academia Brasileira de Ciências. Rio de Janeiro. p. 317-342.
- VANZOLINI, P.E., RAMOS-COSTA, A.M.M. & VITT, L.J. 1980. Répteis das Caatingas. Academia Brasileira de Ciências, Rio de Janeiro.
- VIEIRA, G.H.C., MESQUITA, D.O., PÉRES Jr, A.K., KITAYAMA, K. & COLLI, G.R. 2000. Micrablepharus atticolus Natural History. Herp. Rev. 31:241-242.
- VITT, L.J. 1991. An introduction to the ecology of the Cerrado lizards. J. Herpetol. 25:79-90.
- VITT,.LJ. & CALDWELL, J.P. 1993. Ecological observations on Cerrado lizards in Rondônia, Brazil. J. Herpetol. 27:46-52.
- VITT, L.J. & COLLI, G.R. 1994. Geographical ecology of a neotropical lizard Ameiva ameiva (Teiidae) in Brazil. Can. J. Zool. 72:1986-2008.
- VITT, L.J., ZANI, P.A. & ESPÓSITO, M.C. 1999. Historical ecology of Amazonian lizards: implications for community ecology. Oikos 87: 286-294.
- VITT, L.J., PIANKA, E.R., COOPER, W.E. & SCHWENK, K. 2003. History and the global ecology of squamate reptiles. The American Naturalist 162:44-61.
- VITT, L.J., CALDWELL, J.P., COLLI, G.R., GARDA, A.A., MESQUITA, D.O. FRANÇA, F.G.R., SHEPARD, D.B., COSTA, G.C., VASCONCELLOS, M.M. & de NOVAES e SILVA. V. 2005. Uma atualização do guia fotográfico dos répteis e anfíbios da região do Jalapão no Cerrado brasileiro. Special Publications in Herpetology, Sam Noble Oklahoma Museum of Natural History 2:1-24.
- VRCIBRADIC, D. & ROCHA, C.F.D. 1998. The ecology of the skink Mabuya frenata in an area of rock outcrops in southeastern Brazil. J. Herpetol. 32:229-237.
- WERNECK, F.R & COLLI, G.R. 2006. The lizard assemblage from Seasonally Dry Tropical Forest enclaves in the Cerrado biome and its association with the Pleistocenic Arc. J. Biogeogr. 33:1983-1992.
Apêndice 1
Datas de Publicação
-
Publicação nesta coleção
14 Mar 2008 -
Data do Fascículo
2007
Histórico
-
Recebido
28 Jun 2007 -
Aceito
06 Set 2007