Resumos
A família Amaranthaceae é formada por cerca de 2.360 espécies, 145 delas encontradas no Brasil. Cerca de 94 espécies da família subsistem em diversas fitofisionomias do Bioma Cerrado e 27 espécies aparecem em listas regionais de espécies ameaçadas de extinção. O objetivo deste trabalho foi inventariar e estudar a anatomia foliar e a morfologia de espécies da família Amaranthaceae de uma Unidade de Conservação de Alto Paraíso, GO, relacionando-as ao metabolismo fotossintético. Foram localizadas uma espécie de hábito subarbustivo (Pfaffia townsendii) e cinco espécies herbáceas (Froelichiella grisea, Gomphrena hermogenesii, G. lanigera, G. prostrata e P. gnaphalioides), a maioria demonstrando comportamento pirofítico e anemocoria, bem como sistemas subterrâneos bem desenvolvidos associados com anfiestomia foliar. A anatomia Kranz foi caracterizada em três espécies (todas do gênero Gomphrena), indicando o metabolismo fotossintético C4. Duas espécies são endêmicas da área e duas espécies são consideradas ameaçadas de extinção. Aspectos de anatomia e morfologia são discutidos em relação ao hábito das espécies, comportamento ecológico, duração das porções aéreas e significado funcional. Os dados demonstram a importância da família como indicadora da biodiversidade das áreas abertas dos cerrados e da importância da ampliação das pesquisas na Chapada dos Veadeiros, que tem potencial para o registro de novas espécies, inclusive endêmicas, dado o comportamento sazonal de algumas dicotiledôneas herbáceas e as dificuldades para localizá-las, identificá-las e coletá-las.
Cerrado; anatomia kranz; morfologia; Froelichiella; Gomphrena; Pfaffia
The Amaranthaceae family is composed of 2,360 species of which 145 are found in Brazilian vegetation. About 94 species of this family subsist in different phytofisionomies of the Cerrado Biome (a savanna-like vegetation) and 27 species are cited in Brazilian regional lists of endangered species. This work aimed to inventory and to study the leaf anatomy and morphology of the Amaranthaceae species found in one Conservation Area in Alto Paraíso, GO, relating them to the species' photosynthetic metabolism. It was found one subshrub species (Pfaffia townsendii) and five herbaceous species (Froelichiella grisea, Gomphrena hermogenesii, G. lanigera, G. prostrata and P. gnaphalioides), most of them showing pirophytic and anemocoric behavior and well developed subterraneous systems associated with leaf amphistomy. The Kranz anatomy was verified in three species (all Gomphrena genus), which indicates the C4 pathway of photosynthesis. Two species are endemic of the area (Chapada dos Veadeiros) and two are considered endangered species. The anatomy and morphology aspects are discussed in relation to the species habit, ecological behavior, life span of the aerial organs and functional data. The results indicate the Amaranthaceae importance as biodiversity indicator of open vegetation areas of Cerrado and the necessity of further research in Chapada dos Veadeiros, which has the potential to register new plant species, including endemic ones, since this work displays the seasonal behavior of some dicotyledonean herbaceous species and the difficulties to locate, identify and collect them.
Cerrado; kranz anatomy; morphology; Froelichiella; Gomphrena; Pfaffia
ARTIGOS
Anatomia foliar, morfologia e aspectos ecológicos das espécies da família Amaranthaceae da Reserva Particular do Patrimônio Natural Cara Preta, em Alto Paraíso, GO, Brasil
Leaf anatomy, morphology and ecological aspects of Amaranthaceae species from Reserva Particular do Patrimônio Natural Cara Preta, in Alto Paraíso, GO, Brazil
Suzane Margaret Fank-de-CarvalhoI, III, * * Autora para correspondência: Suzane Margaret Fank-de-Carvalho, e-mail: suzifankcarvalho@gmail.com ; Maria Salete MarchiorettoII; Sônia Nair BáoIII
IPós-graduação em Biologia Celular e Estrutural, Universidade Estadual de Campinas - UNICAMP, Prédio da PG-IB, Bloco O, CP 6109, Av. Bertrand Russel, s/n., CEP 13083-865, Campinas, SP, Brasil
IIHerbarium Anchieta - PACA Instituto Anchietano de Pesquisas, Universidade do Vale do Rio dos Sinos - UNISINOS, Rua Brasil, n. 725, CP 275, CEP 93001-970, São Leopoldo, RS, Brasil
IIIDepartamento de Biologia Celular, Laboratório de Microscopia Eletrônica, Instituto de Ciências Biológicas, Universidade de Brasília - UnB, Campus Universitário Darcy Ribeiro, CEP 70919-970, Brasília, DF, Brasil
RESUMO
A família Amaranthaceae é formada por cerca de 2.360 espécies, 145 delas encontradas no Brasil. Cerca de 94 espécies da família subsistem em diversas fitofisionomias do Bioma Cerrado e 27 espécies aparecem em listas regionais de espécies ameaçadas de extinção. O objetivo deste trabalho foi inventariar e estudar a anatomia foliar e a morfologia de espécies da família Amaranthaceae de uma Unidade de Conservação de Alto Paraíso, GO, relacionando-as ao metabolismo fotossintético. Foram localizadas uma espécie de hábito subarbustivo (Pfaffia townsendii) e cinco espécies herbáceas (Froelichiella grisea, Gomphrena hermogenesii, G. lanigera, G. prostrata e P. gnaphalioides), a maioria demonstrando comportamento pirofítico e anemocoria, bem como sistemas subterrâneos bem desenvolvidos associados com anfiestomia foliar. A anatomia Kranz foi caracterizada em três espécies (todas do gênero Gomphrena), indicando o metabolismo fotossintético C4. Duas espécies são endêmicas da área e duas espécies são consideradas ameaçadas de extinção. Aspectos de anatomia e morfologia são discutidos em relação ao hábito das espécies, comportamento ecológico, duração das porções aéreas e significado funcional. Os dados demonstram a importância da família como indicadora da biodiversidade das áreas abertas dos cerrados e da importância da ampliação das pesquisas na Chapada dos Veadeiros, que tem potencial para o registro de novas espécies, inclusive endêmicas, dado o comportamento sazonal de algumas dicotiledôneas herbáceas e as dificuldades para localizá-las, identificá-las e coletá-las.
Palavras-chave: Cerrado, anatomia kranz, morfologia, Froelichiella, Gomphrena, Pfaffia.
ABSTRACT
The Amaranthaceae family is composed of 2,360 species of which 145 are found in Brazilian vegetation. About 94 species of this family subsist in different phytofisionomies of the Cerrado Biome (a savanna-like vegetation) and 27 species are cited in Brazilian regional lists of endangered species. This work aimed to inventory and to study the leaf anatomy and morphology of the Amaranthaceae species found in one Conservation Area in Alto Paraíso, GO, relating them to the species' photosynthetic metabolism. It was found one subshrub species (Pfaffia townsendii) and five herbaceous species (Froelichiella grisea, Gomphrena hermogenesii, G. lanigera, G. prostrata and P. gnaphalioides), most of them showing pirophytic and anemocoric behavior and well developed subterraneous systems associated with leaf amphistomy. The Kranz anatomy was verified in three species (all Gomphrena genus), which indicates the C4 pathway of photosynthesis. Two species are endemic of the area (Chapada dos Veadeiros) and two are considered endangered species. The anatomy and morphology aspects are discussed in relation to the species habit, ecological behavior, life span of the aerial organs and functional data. The results indicate the Amaranthaceae importance as biodiversity indicator of open vegetation areas of Cerrado and the necessity of further research in Chapada dos Veadeiros, which has the potential to register new plant species, including endemic ones, since this work displays the seasonal behavior of some dicotyledonean herbaceous species and the difficulties to locate, identify and collect them.
Keywords: Cerrado, kranz anatomy, morphology, Froelichiella, Gomphrena, Pfaffia.
Introdução
A família Amaranthaceae no sensu lato tem 169 gêneros e cerca de 2.360 espécies e inclui a família Chenopodiaceae, sendo os maiores gêneros Atriplex L. (300 spp.), Gomphrena L. (120 spp.), Salsola L. (120 spp.), Alternanthera Forssk. (100 spp.), Chenopodium L. 100 spp.), Ptilotus R. Br. (100 spp.), Suaeda Forssk. ex J.F.Gmelin (100 spp.), Iresine R. Browne (80 spp.), Amaranthus L. (60 spp.), Corispermum L. (60 spp.) e Celosia L. (50 spp.) (Judd et al. 2002; The International... 2009). No Brasil são encontradas 145 espécies, distribuídas em 19 gêneros, sendo 71 espécies endêmicas de diferentes regiões e biomas brasileiros (Marchioretto et al. 2010).
Amaranthaceae apresenta predominância de ervas e subarbustos tropicais. No Bioma Cerrado são encontrados 16 gêneros: Achyranthes L., Alternanthera Forssk., Amaranthus L., Blutaparon Raf., Celosia L., Chamissoa Kunth, Chenopodium L., Cyathula Blume, Froelichia Moench, Froelichiella R.E.FR., Gomphrena L., Hebanthe Mart., Iresine P.Browne, Pfaffia Mart., Quaternella Pedersen e Xerosiphon Turcz., entre eles algumas espécies cujo hábitat não foi identificado (Mendonça et al. 1998, Marchioretto et al. 2010). Entre as 94 espécies encontradas no Bioma Cerrado, 31 pertencem ao gênero Gomphrena e 19 são do gênero Pfaffia (Marchioretto et al. 2010). Exemplos de representantes da família são duas plantas conhecidas como ginseng brasileiro (Hebanthe eriantha (Poir.) Pedersen e Pfaffia glomerata (Spreng.) Pedersen). Cerca de 20 espécies têm uso alimentício e/ou medicinal, principalmente espécies dos gêneros Alternanthera, Amaranthus e Gomphrena (Siqueira 1987).
Os estudos realizados nas espécies brasileiras dessa família se concentram nas revisões taxonômicas e estudos fitogeográficos dos gêneros Gomphrena, Froelichia e Froelichiella, Hebanthe Mart. e Pfaffia (Siqueira 1992, Marchioretto et al. 2002, 2004, 2008, 2009, Marchioretto 2008). A família é citada em listas de espécies vasculares (Mendonça et al. 1998, Cavalcanti & Ramos 2001, Siqueira 2002, Batalha & Martins 2004), conta com um estudo de sua morfologia polínica (Laboriau 1961), outros sobre morfologia e anatomia foliar e de outros órgãos (Handro 1964, 1967, Monteiro-Scanavacca 1971, Gavilanes 1999, Fank-de-Carvalho & Graciano Ribeiro 2005) e alguns estudos de farmacognosia e fitoquímica de espécies medicinais.
Embora 27 espécies de Amaranthaceae apareçam em listas regionais de espécies ameaçadas de extinção (23 na lista do Rio Grande do Sul e quatro na lista de São Paulo) (Biodiversitas 2009), ainda são necessários estudos básicos (morfologia, anatomia, ultraestrutura, ecologia) em seus diferentes gêneros e espécies. Os poucos estudos anatômicos das folhas de espécies da família Amaranthaceae do Cerrado indicaram a presença de uma bainha vascular bem desenvolvida nas espécies dos gêneros Gomphrena e Froelichia, mas não nas dos gêneros Alternanthera e Pfaffia (Handro 1964, 1967, Fank-de-Carvalho & Graciano Ribeiro 2005).
Estima-se que as plantas com metabolismo fotossintético C4 sejam responsáveis por 20-30% da produtividade global terrestre, embora elas representem apenas 3% das angiospermas, sendo principalmente espécies herbáceas e subarbustivas (Edwards et al. 2004). Junto com Chenopodiaceae, a família Amaranthaceae é a que apresenta maior número de espécies C4 já identificadas entre as dicotiledôneas, o que a torna interessante para estudos no sentido de compreender a evolução dos diferentes metabolismos fotossintéticos; entre os fatores considerados importantes nessa evolução estão as condições associadas ao clima e distúrbios ecológicos (fogo, hábitats abertos e com alta luminosidade) (Edwards et al. 2004). Os fatores climáticos e ecológicos citados são características encontradas no Bioma Cerrado.
Entretanto, a conversão do Cerrado em agroecossistemas, principalmente a expansão das pastagens de gramíneas de origem africana e as monoculturas para exportação (soja) ou para as agro-indústrias do sul e sudeste do país (milho) tem gerado fragmentação dos hábitats naturais, extinção local da biodiversidade, introdução de espécies exóticas, erosão do solo, poluição de aquíferos, uso inadequado de pesticidas e herbicidas, alteração dos estoques de carbono no solo e na vegetação e modificação das funções biogeoquímicas e hidrológicas do Cerrado (Conservation International et al. 1999, Miranda & Miranda 2000, Klink & Machado 2005). Essa situação torna urgente a ampliação dos estudos das espécies vegetais nativas do Bioma, buscando compreender a ecologia das mesmas e fornecer subsídios para valorizar a conservação de áreas representativas do Cerrado.
Assim, visando ampliar o conhecimento sobre a anatomia foliar e do metabolismo das espécies de Amaranthaceae do Bioma Cerrado, realizamos pesquisas preliminares em herbários brasileiros, que apontaram a ocorrência do gênero Froelichiella R.E.Fr., monoespecífico, na antiga fazenda Cara Preta, em Alto Paraíso, GO Froelichiella grisea R.E.Fr. é pouco conhecida, não estudada sob o ponto de vista anatômico e ocorre restritamente em campos rupestres da Chapada dos Veadeiros e apresenta problemas de conservação (Marchioretto et al. 2005). Atualmente, a área está protegida e é denominada Reserva Particular do Patrimônio Natural (RPPN) Cara Preta. Criada em 1999, a RPPN possui 975 ha e se localiza próxima ao Parque Nacional (PARNA) Chapada dos Veadeiros, protegendo as nascentes do Rio Cara Preta e áreas de Cerrado de altitude. Siqueira (2007) ressalta a persistência de apenas cerca de 15% da cobertura vegetal de remanescentes de cerrado em Goiás (dados de 2002), uma vegetação que cobria cerca de 50% do território do estado. De acordo com essa pesquisa, estima-se que, a continuar a velocidade de desmatamento ora observada, em 100 anos restarão apenas unidades de conservação com esta cobertura vegetal.
Desta forma, esse trabalho visou localizar o gênero Froelichiella e demais representantes da família Amaranthaceae na RPPN Cara Preta, inventariando essas ocorrências, realizar o estudo da anatomia foliar, além de descrever a morfologia e os aspectos ecológicos das espécies. Essas informações serão discutidas em relação aos dados disponíveis no Plano de Manejo da área, disponibilizado pela ONG Oca Brasil (oca@ocabrasil.org), visando gerar subsídios para ampliar o conhecimento sobre a biodiversidade vegetal da área e do Bioma Cerrado.
Material e Métodos
O acesso à RPPN Cara Preta foi obtido através de autorização da ONG Oca Brasil. Foram realizadas caminhadas não sistematizadas para localizar, observar, fotografar, coletar e herborizar espécies (Filgueiras et al. 1994 apud Farias et al. 2002), desde setembro de 2006 até março de 2009. As espécies suspeitas ou diagnosticadas como membros da família Amaranthaceae foram fotografadas e suas localizações marcadas com GPS (Global Positioning System). Indivíduos não férteis foram marcados e revisitados até o florescimento, a fim confirmar a identificação como membro da família Amaranthaceae, cujas flores pequenas são tipicamente dispostas em inflorescências capituliformes e possuem sépalas escariosas e secas. Ramos vegetativos e reprodutivos, bem como exemplares completos das espécies de Amaranthaceae em estádio reprodutivo, foram coletados para a confecção de exsicatas, sendo prensados imediatamente e submetidos à dessecação em estufa. Em laboratório, as espécies foram pré-identificadas com base em literatura e encaminhadas ao herbário PACA para determinação final das espécies encontradas na área, bem como para a descrição morfológica. Todas as exsicatas foram tombadas em herbários indexados, relacionados a seguir pelas siglas, de acordo com Thiers (2010): IBGE, PACA, UB, UEC e CEN. O voucher dos exemplares depositados no herbário PACA encontra-se identificado na Tabela 1.
Para análise anatômica, folhas do 3º ao 5º nó, a partir do ápice, de 2-6 indivíduos de cada espécie, foram coletadas e fracionadas, com a escolha do terço médio para fixação em FAA-70 (Kraus & Arduin 1997), uma mistura de etanol, ácido acético e formaldeído, por 24 horas e em uma mistura de glutaraldeído a 2%, paraformaldeído a 2% e sacarose a 3%, diluídas em tampão cacodilato de sódio a 0,05 M, por 12-24 horas (Karnovsky 1965, Souza 1998).
O material fixado em FAA foi mantido em etanol 70%, até o processamento, sendo seccionado à mão livre e utilizado para a descrição anatômica e realização de testes para identificação de amido (lugol) e composição de cristais (dissolução ácida), de acordo com protocolos de Kraus & Arduin (1997).
O material fixado em mistura com glutaraldeído foi pós-fixado em ferrocianeto de potássio 1,6% e tetróxido de ósmio 2% 1:1 (v/v), contrastado com acetato de uranila aquoso 0,5%, desidratado em série crescente de acetona (30-100%), infiltrado lentamente em resina epóxi do tipo "Spurr" e incluído na resina pura, sendo levado à polimerização em estufa a 60 °C. Os blocos obtidos foram submetidos a cortes semi-finos com facas de vidro, utilizando ultramicrótomo, e corados com solução aquosa de azul de toluidina 1% com borato de sódio 1%. Os cortes histológicos foram analisados e fotografados sob um microscópio óptico Axiophot, utilizando o programa AxioVision® e câmera digital acoplada.
As medidas de espessura de limbo foliar, cutícula e paredes foram realizadas em pelo menos 3 cortes semi-finos de diferentes folhas de cada espécie, todos originários de material emblocado em resina Spurr, utilizando-se o programa AxioVision® (Zeiss). As medidas da espessura das paredes correspondem às duas paredes adjacentes de 10 células: para o parênquima, considera-se a medida entre duas células de parênquima (paliçádico ou lacunoso); para a bainha, considera-se a medida entre uma célula da bainha e uma célula do parênquima adjacente (paliçádico ou lacunoso). Esta estratégia reflete a dificuldade em definir os limites entre as paredes adjacentes na técnica adotada. Para a cutícula, foram medidas a espessura da parede periclinal externa de 10 células não-vizinhas, excluindo-se a medida na região de aderência à célula vizinha, próxima à parede anticlinal (naturalmente mais espessa).
Resultados
A vegetação da RPPN Cara Preta é tipicamente de cerrado, com altitude média de 1.500 m, onde ocorrem seis espécies de Amaranthaceae (três gêneros): Froelichiella grisea, Gomphrena hermogenesii, G. lanigera, G. prostrata, Pfaffia gnaphalioides e P. townsendii. As espécies são listadas, com aspectos de sua morfologia, georreferência e voucher de material testemunha depositado no Herbário PACA (Tabela 1). O gênero Pfaffia ocorre em um morro rochoso (até 1.525 m de altitude) (Figura 1). As demais espécies ocorrem nas áreas de campo limpo e rupestres, predominantemente em solo de quartzo arenoso, em relevo plano (Figura 2). A altitude média de coletas foi acima de 1500 m.
A localização das espécies no campo foi difícil e altamente dependente de observações frequentes e de um evento fortuito: o incêndio da vegetação da área, ocorrido no final de agosto/2008. Apenas uma das espécies (Pfaffia townsendii Pedersen), de hábito subarbustivo, tem suas partes aéreas persistentes e apresenta-se em floração o ano inteiro (Figura 3). Outra espécie, Gomphrena hermogenesii J.C. Siqueira, uma herbácea endêmica da Chapada dos Veadeiros, também apresenta partes aéreas persistentes (cerca de 10-20 cm de altura), sendo geralmente encontrada em estádio vegetativo, sob as folhas das gramíneas e ciperáceas que predominam em antigas áreas de pastagens (Figura 2). A floração dessa espécie, Gomphrena hermogenesii J.C. Siqueira, foi estimulada por ocorrência de fogo na área (Figura 4). As demais espécies - Froelichiella grisea R.E.Fr. (Figura 5), também endêmica da área, Gomphrena lanigera Pohl. ex Moq. (Figura 6), Gomphrena prostrata Mart. (Figura 7), Pfaffia gnaphalioides (L.f.) Mart. (Figura 8) - só foram registradas na área entre 20-25 dias após a ocorrência de fogo, evidenciando o comportamento pirofítico da maioria das espécies encontradas (Tabela 1).
Considerando-se que morfologia é uma ferramenta importante para o reconhecimento e identificação das espécies no campo, apresentamos uma breve descrição das seis espécies de Amaranthaceae coletadas na área e algumas anotações de coleta:
Froelichiella grisea (Lopr.) R.E. Fr. (Figura 5)
Ervas eretas vilosas ou tomentosas branco-acinzentadas. Sistema subterrâneo fusiforme e axial. Folhas cartáceas opostas a raro adensadas na base, lanceoladas, linear-lanceoladas ou obovaladas, ápice acuminado, base atenuada, face adaxial glabra, pilosa ou raro vilosa e face abaxial densamente tomentosa, branco-acinzentada. Inflorescências espiciformes, terminais, pedúnculos longos, vilosos a tomentosos, acinzentados; bráctea mediana triangular, glabra; brácteas laterais ovado-cônicas ou orbiculares, margens levemente onduladas. Flores amarelado-claras, sépalas lanceoladas soldadas na base; estames com anteras elípticas na margem do tubo, sésseis e estaminódios interpostos às anteras, truncados; ovário oblongo, estilete quase nulo, estigma penicilado. Raros exemplares foram encontrados em estádio vegetativo em junho/2008 e a espécie foi encontrada em abundância após a ocorrência da queimada na área da RPPN, em setembro/2008, em floração.
Gomphrena hermogenesii J. C. Siqueira (Figura 4)
Ervas a subarbustos eretos, pilosos ou vilosos, alvos. Sistema subterrâneo tuberiforme e axial, bem desenvolvido. Folhas subcoriáceas opostas cruzadas na base e opostas no ápice, lanceoladas ou obovalado-lanceoladas, ápice mucronado e base atenuada, face adaxial escabrosa e face abaxial vilosa, alvo-amarelada. Inflorescências capituliformes, terminais, pedúnculos longos e pilosos (tricomas adpressos), amarelados; bráctea mediana ovalo-lanceolada, glabra; brácteas laterais lanceoladas, dorso cristado-serrilhado, glabras. Flores amareladas, sépalas linear-lanceoladas de nervura central proeminente, pilosas; tubo estaminal igual ao comprimento das sépalas, anteras oblongas; ovário turbinado, estilete cilíndrico alongado ou semi-alongado, estigma bífido, piloso. A espécie foi encontrada o ano todo, em estádio vegetativo, entre gramíneas e ciperáceas, e sua floração foi estimulada pela ocorrência de queimada na área da RPPN.
Gomphrena lanigera Pohl ex Moq. (Figura 6)
Ervas a subarbustos eretos pilosos, lanuginosos, ferrugíneos. Sistema subterrâneo tuberoso, fusiforme, pouco desenvolvido. Folhas basais rosuladas, oblongas ou obovaladas, pilosas ou híspidas ferrugíneas; folhas superiores alternas, lineares, lanadas, ferrugíneas, ápice acuminado e base atenuada, face adaxial pilosa, ferrugínea, face abaxial lanosa, ferrugínea. Inflorescências espiciformes, terminais, pedúnculos semi-alongados, lanosos; brácteas mediana e laterais lanceoladas, pilosas. Flores amarelo-rufescentes ou alaranjadas, sépalas linear-lanceoladas, pilosas; tubo estaminal maior que o comprimento das sépalas, anteras oblongas; ovário oblongo-ovalado, estilete curto, estigma linear, papiloso. Espécie que apresentou o ciclo de vida aéreo mais rápido (rebrotação, crescimento vegetativo, floração e frutificação), já que a maioria dos indivíduos da espécie se encontrava em fase de frutificação 20-25 dias após a ocorrência de fogo na RPPN, antes mesmo da recuperação das gramíneas e ciperáceas que predominam no local.
Gomphrena prostrata Mart. (Figura 7)
Ervas a subarbustos prostrados ou semi-prostrados, semi-eretos, pilosos, lanosos ou vilosos, alvecentes. Sistema subterrâneo tuberiforme ou fusiforme, lenhoso, bem desenvolvido. Folhas alternas, ovaladas, ovalado-lanceoladas ou lanceoladas, ápice mucronado, subsésseis, face adaxial pilosa ou híspida ferrugínea e face abaxial lanosa ou vilosa, alvecente. Inflorescências capituliformes, terminais, pedúnculos semi-alongados, pilosos; bráctea mediana ovalado-lanceolada, vilosa e brácteas laterais ovaladas, glabras. Flores alvecentes ou amarelo-claras, sépalas lanceoladas lanuginosas; tubo estaminal menor que o comprimento das sépalas, anteras oblongas; ovário globoso, oblongo, estilete curto, estigma papiloso. Espécie de comportamento pirofítico, foi encontrada em plena floração apenas após a ocorrência do fogo na RPPN.
Pfaffia gnaphalioides (L.f.) Mart. (Figura 8)
Ervas a subarbustos eretos, lanosos, alvecentes. Sistema subterrâneo tuberoso fusiforme e axial, pouco desenvolvido. Folhas cartáceas, alternas ovaladas, elípticas, lanceoladas, oblongo-lanceoladas ou linear-lanceoladas, ápice agudo a acuminado e base atenuada, face adaxial denso lanosa verde-acinzentada e face abaxial denso tomentosa, alvo-acinzentada. Inflorescências capituliformes, terminais, pedúnculos curto a longos, lanosos; bráctea mediana ovalada a oblonga, nervura central proeminente, extremidade do dorso pilosa ou híspida e brácteas laterais oblongas a ovaladas, extremidade do dorso pilosa ou híspida. Flores alvas ou amareladas, sépalas ovalado-lanceoladas a oblongo-lanceoladas, densamente pilosas ou vilosas; tubo estaminal menor que o comprimento das sépalas ou quase do mesmo tamanho, anteras linear-oblongas; ovário oblongo, estigma capitado levemente bilobado. A rebrotação e floração da espécie foram estimuladas pela ocorrência de fogo na RPPN, ao final da estação seca, com persistência de hastes aéreas pelo menos até o final da estação chuvosa (final de março/2009).
Pfaffia townsendii Pedersen (Figura 3)
Subarbustos a arbustos eretos e ramificados, tomentosos, acinzentados. Sistema subterrâneo tuberiforme. Folhas cartáceas alternas, oblongo, oblongo-ovaladas a ovaladas, ápice agudo a acuminado e base rotunda, face adaxial tomentosa verde-acinzentada e face abaxial lanosa a tomentosa, alvo-acinzentada. Inflorescências capituliformes ou em espigas, pedúnculos longos, lanosos; bráctea mediana ovalada a ovalado-lanceolada, glabra e brácteas laterais ovaladas, pilosas no dorso; tubo estaminal unido na base e mais da metade estreitado, anteras oblongas; ovário oblongo, estigma capitado emaginado. A espécie foi encontrada na área da RPPN o ano todo, sempre em floração.
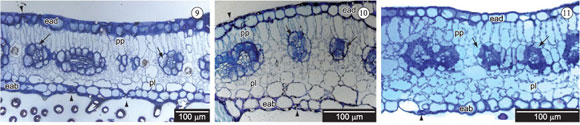
Além das características morfológicas distintivas (hábito, filotaxia, pilosidade e coloração das folhas, formato e coloração das inflorescências), as folhas das espécies estudadas evidenciam variações anatômicas entre os gêneros e uma relativa homogeneidade da anatomia foliar entre as espécies do mesmo gênero.
As espécies G. hermogenesii (Figura 9), G. lanigera (Figura 10) e G. prostrata (Figura 11) possuem folhas anfiestomáticas, com mesofilo dorsiventral e bainha parenquimática completa e bem desenvolvida, envolvendo completamente os feixes colaterais de menor porte (excluindo-se a nervura principal). O mesofilo é composto por 1-2 camadas de parênquima paliçádico adaxial, feixes vasculares de menor porte envoltos por bainha parenquimática completa e 2-5 camadas de parênquima lacunoso abaxial (Figuras 9, 10 e 11). O limbo das espécies mede de 195,94 a 504 μm de espessura, em regiões entre a nervura principal e o bordo. O limbo mais espesso é o de G. hermogenesii (268 a 504 μm) e o mais fino é o de G. prostrata (195,94 a 300,25 μm) (Tabela 2). Nas três espécies, a bainha parenquimática possui paredes mais espessas em relação às células do mesofilo, podendo apresentar de 2,11 a 5,55 μm de espessura. A bainha possui parede mais espessa em G. lanigera (3,26 a 5,55 μm) e é mais fina em G. prostrata (2,11 a 3,44 μm) (Tabela 2).
As organelas das células da bainha (ou células Kranz) posicionam-se centripetamente, próximas ao feixe vascular, e a reação para amido concentra-se nessas células, em relação às demais do mesofilo. Ao redor das células da bainha parenquimática, as células tendem a apresentar padrão radial, com espaços intercelulares maiores na região abaxial. A epiderme uni-estratificada das folhas é formada por células com superfície externa plana, com estômatos nivelados na face adaxial e tendendo a se elevarem na face abaxial. A cutícula adaxial dessas espécies é geralmente mais espessa do que na face abaxial, podendo apresentar de 4,72 a 13,04 μm de espessura. A cutícula adaxial é mais espessa em G. lanigera (8,84 a 13,04 μm) e é mais fina em G. prostrata (4,72 a 6,52 μm) (Tabela 2). Os bordos foliares de G. prostrata são recurvados em direção abaxial (nas outras duas espécies, os bordos também são planos em corte transversal). Nesse gênero, os tricomas que recobrem as folhas aparentam maior densidade à medida que o tamanho da área foliar se reduz (como as folhas de G. lanigera), em relação às folhas mais expandidas das outras duas espécies. Essas espécies de Gomphrena apresentam grande quantidade de drusas no mesofilo foliar, cuja composição é oxalato de cálcio.
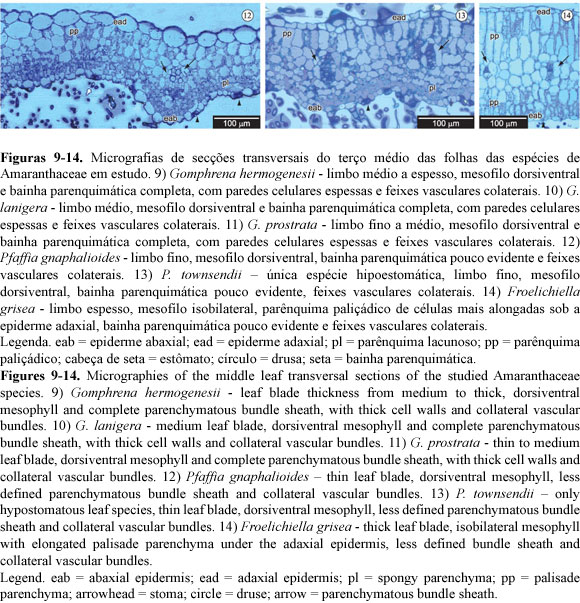
As espécies P. gnaphalioides (Figura 12) e P. townsendii (Figura 13) possuem folhas com superfície mais ondulada, marcadamente na face abaxial, com a espessura do limbo foliar variando entre 135,49 e 204,32 μm de espessura (Tabela 2). A epiderme é uni-estratificada e a cutícula adaxial é fina, variando de 1,51 a 6,66 μm de espessura, sendo que a cutícula de P. townsendii é mais fina das espécies estudadas. Nessas espécies a pilosidade é mais densa que nas Gomphrena spp., e o formato alongado e sinuoso dos tricomas unisseriados e nodosos não permite a visualização da superfície epidérmica das folhas sob lupa. O mesofilo das espécies também é dorsiventral, mas a bainha parenquimática é pouco evidente (Figuras 12 e 13), com paredes celulares de mesma espessura ou mais finas que as demais células do mesofilo (Tabela 2), envolvendo feixes colaterais. O mesofilo é composto por 1-2 camadas de parênquima paliçádico adaxial de células pouco alongadas, feixes vasculares colaterais e 2-6 camadas de células mais arredondadas formando um parênquima lacunoso abaxial de pequenos espaços intercelulares (Figuras 12 e 13). Só foram encontrados estômatos na superfície abaxial de P. townsendii, enquanto em P. gnaphalioides foram observados estômatos tanto na superfície adaxial (mais raros e nivelados às demais células) quanto na superfície abaxial da epiderme. Os estômatos de ambas as espécies, na superfície abaxial, são elevados em relação às demais células epidérmicas. O teste histoquímico indica amido amplamente distribuído nas células do mesofilo. A anatomia dessas espécies é compatível com o metabolismo fotossintético C3.
A espécie F. grisea possui folhas com superfície plana e tricomas unisseriados longos, marcadamente na face abaxial. A epiderme é uni-estratificada, formada por células pequenas e com cutícula de espessura mediana (Figura 14), variando entre de 3,61 a 8,4 μm na face adaxial. A densidade dos tricomas não permite a visualização da superfície epidérmica abaxial das folhas sob lupa. O limbo foliar apresenta de 415,19 a 549,45 μm de espessura. O mesofilo da espécie é isobilateral e a bainha parenquimática é pouco evidente (Figura 14), embora suas paredes celulares apresentem espessura ligeiramente superior às demais células do mesofilo (Tabela 2). As organelas na bainha vascular estão posicionadas centrifugamente (da mesma forma que nas demais células do mesofilo) e os feixes vasculares também são colaterais. O mesofilo é composto por 2-4 camadas de parênquima paliçádico adaxial, formado por células longas, feixes vasculares colaterais e 2-3 camadas de parênquima paliçádico abaxial, formado por células mais curtas (Figura 14). No espaço intervenal, os feixes vasculares são substituídos por 2-5 camadas de células parenquimáticas arredondadas. Foram encontrados estômatos tanto na superfície adaxial quanto na superfície abaxial da epiderme, geralmente nivelados com as demais células epidérmicas. As drusas se concentram na região próxima à nervura principal das folhas desta espécie e são compostas de oxalato de cálcio. Amido é encontrado na maioria das células do mesofilo. A anatomia dessa espécie é compatível com o metabolismo fotossintético C3.
Discussão
O monitoramento da área por longo espaço de tempo, com visitas periódicas (intervalos de cerca de dois meses) e a ocorrência de fogo foram determinantes para a localização e identificação de Froelichiella grisea, Gomphrena lanigera e G. prostrata, bem como para o registro da floração de G. hermogenesii e Pfaffia gnaphalioides. O fogo deve quebrar a dormência dessas espécies, estimulando tanto a rebrotação das porções aéreas quanto a floração/frutificação. Essas observações são compatíveis com as observações realizadas para outras espécies dessa família (Siqueira 1992, Marchioretto 2008).
O único levantamento de flora registrado para a área não cita espécies da família Amaranthaceae. De acordo com o Plano de Utilização da RPPN Cara Preta (de Souza 2004), os levantamentos de flora efetuados na área registraram a presença de 239 espécies vegetais, distribuídas em 46 famílias (137 gêneros). Acompanhando o registro de predominância de fitofisionomias campestres na RPPN (campos rupestres, campos limpos e campo sujo), o maior número de espécies vegetais pertence à família Poaceae (=Gramineae) (30 spp.), seguido de Asteraceae (=Compositae) com 21 espécies, Cyperaceae, Orchidaceae, Fabaceae (=Leguminosae) e Eriocaulaceae (16 espécies cada família) e Xyridaceae (10 espécies). De acordo com os autores do Plano de Utilização, estão protegidas na área da RPPN cerca de 38% das famílias vegetais registradas para o município de Alto Paraíso, GO. Três espécies vegetais foram apontadas como prováveis endemismos da área (Xyris paradisiaca Wand., Cambessedesia glaziovi Cogn. ex A.B. Martins e Mimosa regina Barneby).
Considerando-se que o presente trabalho de campo acrescentou mais seis espécies, três gêneros e uma família ao levantamento florístico da área, a RPPN Cara Preta passa a registrar 245 espécies vegetais distribuídas em 47 famílias e 140 gêneros, em uma área de 975 ha. Entre as espécies de Amaranthaceae encontradas na área, 33% são endêmicas da Chapada dos Veadeiros: G. hermogenesii e F. grisea. Essa última espécie é citada na "Lista Oficial das Espécies da Flora Brasileira Ameaçadas de Extinção" como uma das espécies com dados de registros considerados deficientes, não permitindo enquadrá-las com segurança na situação de ameaçada (Brasil 2008) e com problemas de conservação (Marchioretto et al. 2005). Estudos mais específicos e ampliados (Marchioretto et al. 2005, Biodiversitas 2009) consideram que F. grisea, monoespecífica para o gênero Froelichiella e de ocorrência restrita aos campos rupestres da Chapada dos Veadeiros, se enquadraria na categoria "vulnerável" da União Internacional para a Conservação da Natureza (IUCN), correndo alto risco de extinção a médio prazo. Além dessa espécie, P. townsendii, também encontrada na área, se enquadra na mesma categoria de ameaça (Biodiversitas 2009) e sua distribuição é restrita aos cerrados e campos rupestres dos Estados da Bahia, Goiás e Minas Gerais (Marchioretto 2008). Essas informações tornam a RPPN Cara Preta particularmente importante como local de preservação dessas espécies da família Amaranthaceae para estudos futuros (genética, biogeografia e outros) e para fins de educação ambiental.
A área da RPPN Cara Preta representa apenas 1,5% da área do Parque Nacional (PARNA) Chapada dos Veadeiros, mas possui 9,2% do número de espécies vegetais registradas para a Chapada dos Veadeiros. Somente em relação à família Amaranthaceae, na RPPN Cara Preta são encontradas 23 a 25% das espécies ocorrentes na Chapada dos Veadeiros. Das 27 espécies de Amaranthaceae da Chapada, três podem ser consideradas invasoras, o que eleva ainda mais o percentual de representantes nativos encontrados na RPPN. A lista de espécies vegetais da Chapada dos Veadeiros (Felfili et al. 2007) inclui pesquisas realizadas nos 65.038 ha do Parque Nacional Chapada dos Veadeiros, uma área fronteiriça com a RPPN Cara Preta, no município de Alto Paraíso e na Vila Propício, registrando um total de 2.661 espécies, distribuídas em 150 famílias e 731 gêneros.
Considerando que os dados de endemismo constantes do Plano de Utilização da RPPN sejam confirmados (três espécies), somadas às espécies endêmicas de Amaranthaceae (duas espécies) registradas para a área, chega-se à taxa de endemismo de 2%, bem representativo para o Bioma Cerrado. O Cerrado consta da lista de Hotspots de prioridades para a conservação (Myers et al. 2000) por conter, entre outras, 4.400 espécies de plantas endêmicas - ou 1,5% do total das 300 mil espécies de plantas do planeta.
O Brasil é um reduto de riqueza e endemismos de espécies de Amaranthaceae, com alguns táxons já identificados como ameaçados e outros com potencial ornamental, medicinal e/ou alimentício ainda inexplorado. As condições de coleta citadas no Plano de Utilização da RPPN Cara Preta (de Souza 2004) e as observações de campo deste trabalho indicam que a flora da área ainda se encontra sub-registrada, havendo necessidade de ampliação dos estudos florísticos na área. Este estudo sugere que a ampliação do trabalho de monitoramento e coletas de plantas nessa RPPN pode resultar em registros de espécies novas para a ciência, inclusive endêmicas, dado o comportamento sazonal das dicotiledôneas herbáceas, exemplificado pelo atual registro da família Amaranthaceae.
A anatomia foliar das espécies é compatível com o encontrado na literatura para outras espécies dos gêneros Gomphrena e Pfaffia (Handro 1964, 1967, Carolin et al. 1978, Estelita-Teixeira & Handro 1984, Gavilanes 1999, Fank-de-Carvalho & Graciano-Ribeiro 2005). Pela primeira vez, descreveu-se a anatomia do gênero Froelichiella. De acordo com Mauseth (2009), plantas de ambientes quentes e secos apresentam anatomia foliar padrão, com parênquima paliçádico adaxial e parênquima lacunoso abaxial, geralmente reduzindo os espaços intercelulares e compactando as células para evitar perdas de água. Essa configuração de tecidos poderia reduzir a fotossíntese, pois as células ficariam menos expostas ao dióxido de carbono, mas modificações enzimáticas e ultraestruturais propiciaram a resolução deste problema, através do surgimento de diferentes vias fotossintéticas (Mauseth 2009).
A anatomia das folhas das espécies de Gomphrena encontradas na RPPN indica a realização da via C4 de fotossíntese, especialmente em razão da presença de uma bainha vascular completa, com paredes celulares espessas envolvendo os feixes vasculares, além de organelas em posição centrípeta e concentração da produção de amido nestas células. Essas espécies apresentam o tipo Gomphrena de anatomia Kranz (Kadereit et al. 2003), onde a porção adaxial do mesofilo adjacente à bainha vascular se organiza radialmente e a porção abaxial é formada por células menores e nem sempre distintamente radiais. Essas são espécies com maior capacidade de captura e fixação de gás carbônico em biomassa subterrânea, garantindo o crescimento rápido das partes aéreas sob condições ambientais favoráveis. A anatomia foliar dessas espécies de Gomphrena corrobora apenas parcialmente um estudo recente sobre o metabolismo das espécies, baseado na análise de isótopos de carbono (Sage et al. 2007), que indica duas dessas espécies como C4 e reporta que G. hermogenesii seria uma espécie C3.
As demais espécies estudadas, dos gêneros Froelichiella e Pfaffia, devem realizar apenas a via C3 de fotossíntese, uma vez que a bainha vascular é menos distinta e as paredes celulares são tão finas quanto as das demais células do mesofilo, as organelas estão posicionadas centrifugamente no mesofilo e na bainha e o amido é produzido tanto no mesofilo quanto na bainha, concordando com os resultados de Sage et al. (2007) através da análise de isótopos de carbono.
Dentre as Gomphrena, o ciclo de vida aéreo mais rápido (rebrotação, crescimento vegetativo, floração e frutificação) ocorreu na espécie G. lanigera. Essa espécie é a que apresenta a cutícula adaxial mais espessa (Tabela 2), característica anatômica não relacionada com a duração da folha no tempo, já que a maioria dos indivíduos da espécie se encontrava em fase de frutificação 20-25 dias após a ocorrência de fogo, antes mesmo da recuperação das gramíneas que predominam no local. Da mesma forma, o espessamento das paredes celulares na bainha vascular também não parece um evento de longo prazo, pois G. lanigera é a espécie que apresentou maior espessamento nessas paredes (Tabela 2). Sugere-se, assim, que tanto o desenvolvimento de cutícula quanto das paredes celulares seja um evento mais correlacionado à genética da espécie e, possivelmente, ao metabolismo fotossintético (em relação às células da bainha). O comportamento pirofítico de G. lanigera também foi enfatizado por Siqueira (1992), que informa a ocorrência da espécie em áreas de cerrados e campos rupestres de Goiás, Minas Gerais e Distrito Federal, aparecendo frequentemente após queimadas.
Embora as três espécies de Gomphrena sejam subarbustivas ou herbáceas de pequeno porte (menos de 30 cm de altura), apenas duas delas possuem sistemas subterrâneos bem desenvolvidos e perenes (G. hermogenesii e G. prostrata), aparentemente com xilopódio, indicando a alocação preferencial da biomassa em estruturas persistentes. G. lanigera possui raiz tuberosa, mas com menor desenvolvimento em relação às outras duas espécies de Gomphrena. Isto pode ser explicado pelo curto espaço de tempo para a produção de carboidratos e alocação no sistema subterrâneo, somado ao limbo reduzido e baixa quantidade de folhas disponíveis em cada indivíduo (Figura 6). A rebrotação das porções aéreas e floração de G. prostrata também foram estimuladas pelo fogo, mas essa espécie possui maior quantidade de tecido fotossintetizante do que G. lanigera.
Entre as espécies de Gomphrena, apenas G. hermogenesii apresenta porções aéreas (caule e folhas) persistentes ao longo do ano (independentemente de ser período seco ou chuvoso) e o limbo foliar mais espesso foi encontrado em amostras coletadas ao longo do estádio vegetativo. Durante cerca de um ano e meio de acompanhamento da área, antes da ocorrência do fogo e após a localização da espécie no campo, não houve registro de floração. A floração desta espécie também foi estimulada pela ocorrência da queimada, um aspecto importante de seu comportamento ecológico ainda não descrito na literatura.
A rápida floração das espécies herbáceas de Amaranthaceae, que fazem a dispersão anemocórica dos frutos, favorece o estabelecimento pioneiro em áreas mais distantes, antes mesmo da recuperação integral do restante da vegetação rasteira, composta especialmente por gramíneas e ciperáceas. O estudo da ecologia das espécies dessa camada da vegetação é importante para ampliar o conhecimento sobre a vegetação que recobre as áreas abertas de Cerrado. Nas plantas, o sistema subterrâneo desenvolvido, a dispersão anemocórica e o pirofitismo são adaptações consideradas importantes para a sobrevivência das espécies (Siqueira 2007). A camada rasteira possui diversidade de cerca de quatro a sete vezes o número das espécies lenhosas (arbustos maiores e árvores), sendo mais importantes as famílias Compositae, Gramineae, Leguminosae e Rubiaceae (Ratter et al. 1997). Nos campos úmidos, a flutuação no nível de disponibilidade de água nas estações chuvosa e seca não permite o crescimento de árvores (Ratter et al. 1997).
O limbo foliar das duas espécies do gênero Pfaffia encontradas na área são os menos espessos dentre as espécies deste estudo (Tabela 2). Entretanto, a organização interna dos tecidos é marcadamente dorsiventral em P. townsendii (Figura 13), que possui porções aéreas persistentes ao longo do ano, enquanto em P. gnaphalioides (Figura 12) o parênquima lacunoso é mais compactado e o parênquima paliçádico é menos alongado. A maior especialização dos tecidos pode ser decorrente da longevidade das folhas - que são de curta duração na segunda espécie. A maior compactação das células em P. ganaphalioides pode estar relacionada à aparente menor densidade de tricomas. A cutícula mais fina foi encontrada em P. townsendii, provavelmente em função da densa pilosidade e da trama fechada que os tricomas lanuginosos formam sobre a epiderme foliar. A pilosidade densa é considerada fundamental para reduzir a temperatura e a perda de água transpiracional em ambientes quentes e secos, durante o dia, bem como para a manutenção da temperatura foliar à noite (Press 1999). A pilosidade mais densa nas folhas das duas espécies de Pfaffia pode estar ligada à ocorrência das mesmas em áreas acidentadas e rochosas do cerrado de altitude, sujeitas a ventanias.
A anfiestomia pode não estar diretamente relacionada com a ocorrência do metabolismo C4, uma vez que ela é comum a cinco das seis espécies estudadas e apenas três delas possuem anatomia compatível com a realização da via C4 de fotossíntese. Entretanto, pode estar diretamente relacionada à espessura do limbo foliar, pelo menos em parte, e tambérm à evolução do metabolismo C4, uma vez que aumenta a exposição dos tecidos internos ao dióxido de carbono. Embora a diferença entre a espessura das folhas de Pfaffia seja similar, P. townsendii é a única espécie arbustiva e suas folhas perenes têm o limbo mais fino entre as espécies deste estudo, com estômatos restritos à face abaxial. Este dado corrobora com os de Parkhusrt (1978), que afirma que para o mesmo ambiente, as folhas mais espessas tendem a ser anfiestomáticas e as folhas mais finas tendem a ser hipoestomáticas. Entretanto, uma pesquisa em larga escala, conduzida por Mott et al. (1982), indica que a espessura foliar deve ser um caráter secundário em relação à anfiestomia, necessitando-se de mais algum parâmetro independente, uma vez que folhas de muitas plantas herbáceas com 100-500 μm de espessura podem apresentar anfiestomia, enquanto muitas plantas lenhosas com folhas de mesma espessura tendem a ser hipoestomáticas. Neste sentido, o hábito arbustivo de P. townsendii, conjugado às folhas de menor espessura, reflete o caráter hipostômico típico de espécies lenhosas.
À exceção de P. townsendii, todas as demais espécies deste estudo são herbáceas de pequeno porte e anfiestomáticas. Três das seis espécies deste estudo possuem estrutura foliar compatível com o metabolismo C4, o que concorda com a afirmação de Mott et al. (1982) de que espécies de plantas com metabolismo C4 são adaptadas a ambientes de alta luminosidade e são anfiestomáticas. Também corrobora com Parkhurst (1978), que afirma que, em relação à captura de gás carbônico, folhas anfiestomáticas parecem melhor adaptadas para a maioria das condições ambientais e, especialmente, às condições de baixo estresse hídrico. Afinal, todas as espécies de provável metabolismo C4 (Gomphrena spp.) foram encontradas na região de campo limpo úmido, onde seus sistemas subterrâneos bem desenvolvidos e o lençol freático superficial atuam na manutenção do suprimento de água durante o período de persistência de suas porções aéreas, não havendo necessidade de restrição transpiracional.
Desta maneira, as variações anatômicas das folhas das espécies são parcialmente decorrentes da genética, da adaptação ao ambiente e também podem estar relacionadas ao hábito, comportamento ecológico e duração das folhas durante o ciclo de vida da planta. O entendimento do significado funcional da estrutura foliar em nível ecológico é complexo e envolve muitas variantes, sendo dependente do ambiente, não intuitivo e freqüentemente indica que há mais do que uma solução estrutural para a obtenção do mesmo resultado fisiológico (Press 1999).
Portanto, considerando-se alta a taxa de endemismo dos cerrados e sua importância como centro de biodiversidade (Ratter et al. 1997), é necessário ampliar os estudos de biologia básica (taxonomia, ecologia, anatomia, ultra-estrutura e biogeografia) em espécies dessa e de outras famílias vegetais nativas do Bioma Cerrado. Assim, além de descrever algumas espécies do Cerrado em aspectos comportamentais e anatômicos inéditos, esse trabalho indica que a família Amaranthaceae também pode ser um bom marcador da biodiversidade de dicotiledôneas de pequeno porte e da capacidade de regeneração das áreas de campos rupestres, campos úmidos e outros tipos de vegetação aberta dos cerrados. O monitoramento constante das áreas preservadas e disponíveis para a pesquisa científica pode revelar dados inesperados e ampliar a motivação para as pesquisas e conservação do mosaico de ecossistemas que formam o Bioma Cerrado.
Agradecimentos
Agradecemos à CAPES, CNPq e FINEP pelo apoio financeiro; aos Herbários IBGE, UB e PACA e à ONG Oca Brasil pela infra-estrutura e apoio; aos coletores adicionais pelo acompanhamento nas buscas e coletas das espécies.
Parte da tese de Doutorado da primeira autora.
Recebido em 26/02/2010
Versão reformulada recebida em 17/06/2010
Publicado em 04/10/2010
- BATALHA, M.A. & MARTINS, F.R. 2004. Reproductive fenology of the cerrado plant community in Emas National Park (Central Brazil). Aust. J. Bot. 52:149-161.
- BIODIVERSITAS. 2009. Lista da flora brasileira ameaçada de extinção. http://www.biodiversitas.org.br/ (último acesso em 11/09/2009).
- BRASIL. Ministério do Meio Ambiente - MMA. 2008. Lista oficial das espécies da flora brasileira ameaçadas de extinção. http://www.mma.gov.br (último acesso em 11/09/2009).
- CAROLIN, R.C., JACOBS, S.W.L. & VESK, M. 1978. Kranz cells and mesophyll in the Chenopodiales. Aust. J. Bot. 26:683-698.
- CAVALCANTI, T.B. & RAMOS, A.E. (org.). 2001. Flora do Distrito Federal, Brasil. Embrapa Recursos Genéticos e Biotecnologia, Brasília.
- CONSERVATION INTERNATIONAL, FUNATURA, FUNDAÇÃO BIODIVERSITAS & UNIVERSIDADE DE BRASÍLIA. 1999. Ações prioritárias para a conservação da biodiversidade do Cerrado e Pantanal. www.bdt.org.br/bdt/workcerrado (último acesso em 19/05/2005).
- DE SOUZA, A. 2004. Relatório plano de utilização RPPN Cara Preta. Nativa Proteção Ambiental, Alto Paraíso, 327p.
- EDWARDS, G.E., FRANCESCHI, V.R. & VOZNESENSKAYA, H.V. 2004. Single-cell C4 photosynthesis versus the dual-cell (Kranz) paradigm. Ann. Rev. Plant Biol. 55:173-196.
- ESTELITA-TEIXEIRA, M.E. & HANDRO, W. 1984. Leaf ultrastructure in species of Gomphrena and Pfaffia (Amaranthaceae). Can. J.Bot. 62:812-817.
- FANK-DE-CARVALHO, S.M., GRACIANO-RIBEIRO, D. 2005. Arquitetura, anatomia e histoquímica das folhas de Gomphrena arborescens L.f. (Amaranthaceae). Acta Bot. Bras. 19(2):379-392.
- FARIAS, R., ALVES, E.R., MARTINS, R.C., BARBOZA, M.A., ZANENGA-GODOY, R., SILVA, J.B. & RODRIGUES-DA-SILVA, R. 2002. Caminhando pelo cerrado. Planta herbáceo-arbustivas - caracteres vegetativos e organolépticos. Editora Universidade de Brasília, Brasília.
- FELFILI, J.M., REZENDE, A.V. & SILVA JÚNIOR, M.D. (org.). 2007. Biogeografia do Bioma Cerrado - vegetação e solos da Chapada dos Veadeiros. Editora Universidade de Brasília/FINATEC, Brasília.
- GAVILANES, M.L. 1999. Estudo anatômico do eixo vegetativo de plantas daninhas que ocorrem em Minas Gerais. 1. Anatomia foliar de Gomphrena celosioides Mart. (Amaranthaceae). Ciênc. e Agrotecn. 23(4):881-898.
- HANDRO, W. 1964. Contribuição ao estudo da venação e anatomia foliar das amarantáceas dos cerrados. An. Acad. Brasil. Ciênc. 36(4):479-499.
- HANDRO, W. 1967. Contribuição ao estudo da venação e anatomia foliar das amarantáceas dos cerrados. II - Gênero Pfaffia An. Acad. Brasil. Ciênc. 39(3-4):495-506.
- THE INTERNATIONAL PLANT NAMES INDEX - IPNI. 2009. http://www.ipni.org/index.html (último acesso em 11/09/2009).
» link - JUDD, W.S., CAMPBELL, C.S., KELLOG, E.A. & STEVENS, P.F. 2002. Plant Systematics - a phylogenetic approach. 2 ed. Sinauer Associates, Sunderland.
- KADEREIT, G., BORSH, T., WEISING, K. & FREITAG, H. 2003. Phylogeny of Amaranthaceae and Chenopodiaceae and the evolution of the C4 Photosynthesis. Int. J. Plant Sci. 164/6:959-986
- KARNOVSKY, M.J. 1965. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy Abstracts Fifth Annual Meeting American Society for Cell Biology. J. Cell. Biol. 27:137-138A.
- KLINK, C.A. & MACHADO, R.B. 2005. A conservação do Cerrado brasileiro. Megadiversidade 1(1):147-155.
- KRAUS, J.E. & ARDUIN, M. 1997. Manual básico de métodos em morfologia vegetal. EDUR, Rio de Janeiro.
- LABORIAU, M.L.S. 1961. Pollen grains of plants of the "Cerrado" - I. An. Acad. Brasil. Ciênc. 33(1):119-130.
- MARCHIORETTO, M.S. 2008. Os gêneros Hebanthe Mart. e Pfaffia Mart. (Amaranthaceae) no Brasil. Tese de doutorado, Universidade Federal do Rio Grande do Sul.
- MARCHIORETTO, M.S., MIOTTO, S.T.S. & SIQUEIRA, J.C. 2008. Padrões de distribuição geográfica dos táxons brasileiros de Hebanthe Mart. (Amaranthaceae). Pesq. Bot. 59:159-170.
- MARCHIORETTO, M.S., MIOTTO, S.T.S. & SIQUEIRA, J.C. 2009. Padrões de distribuição geográfica das espécies brasileiras de Pfaffia (Amaranthaceae). Rodriguésia 60(3):667-681.
- MARCHIORETTO, M.S., SENNA, L. & SIQUEIRA, J.C. 2010. Amaranthaceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. http://floradobrasil.jbrj.gov.br/2010/FB000042 (último acesso em 12/06/2010).
- MARCHIORETTO, M.S., WINDISCH, P.G. & SIQUEIRA, J.C. 2002. Os gêneros Froelichia Moench e Froelichiella R.E. Fries (Amaranthaceae) no Brasil. Pesq. Bot. 52:7-46.
- MARCHIORETTO, M.S., WINDISCH, P.G. & SIQUEIRA, J.C. 2004. Padrões de distribuição geográfica das espécies de Froelichia Moench e Froelichiella R. E. Fries (Amaranthaceae) no Brasil. Iheringia, Sér. Bot. 2:149-159.
- MARCHIORETTO, M.S., WINDISCH, P.G. & SIQUEIRA, J.C. 2005. Problemas de conservação das espécies dos gêneros Froelichia Moench e Froelichiella R. E. Fries (Amaranthaceae) no Brasil. Acta Bot. Bras. 19(2):215-219.
- MAUSETH, J.D. 2009. Botany - na introduction to plant biology. 4th ed. Jones & Bartlett Pub., Sudbury.
- MENDONÇA, R.C., FELFILI, J.M., WALTER, B.M.T., SILVA, M.C., REZENDE, A.R., FILGUEIRAS, T.S. & NOGUEIRA, P.E. 1998. Flora vascular do Cerrado. In Cerrado: ambiente e flora (S.M. Sano & S.P. Almeida, ed.). Embrapa CPAC, Planaltina, p.286-556.
- MIRANDA, H. & MIRANDA, A.C. 2000. Queimadas e estoques de carbono no Cerrado. In As mudanças climáticas e os ecossistemas brasileiros (A.G. Moreira & S. Schwartzman, ed.). Foco, Brasilia, p.75-81.
- MONTEIRO-SCANAVACCA, W.R. 1971. Vascularização floral em Amaranthaceae. Ciênc. e Cult. 23(3):339-349.
- MOTT, K.A., GIBSON, A.C. & O´LEARY, J.W. 1982. The adaptive significance of amphistomatic leaves. Plant Cell Environ. 5:455-460.
- MYERS, N., MITTERMEIER, R.A., MITTERMEIER, C.G., FONSECA, G.A.B. & KENT, J. 2000. Biodiversity hotspots for conservation priorities. Nature 403:853-858.
- PARKHURST, D.F. 1978. The adaptive significance of stomatal occurrence on one or both surfaces of leaves. J. Ecol. 66:367-383.
- PRESS, M.C. 1999. The functional significance of leaf structure: a search for generalizations. New Phytol. 143:213-219.
- RATTER, J.A., RIBEIRO, J.F. & BRIDGEWATER, S. 1997. The Brazilian Cerrado vegetation and threats to its biodiversity. Ann. Bot. 80:223-230.
- SAGE, R.F., SAGE, T.L., PEARCY, R.W. & BORSCH, T. 2007. The taxonomic distribution of C4 photosynthesis in Amaranthaceae sensu stricto Am. J. Bot. 94(12):1992-2003.
- SIQUEIRA, J.C. 1987. Importância alimentícia e medicinal das amarantáceas do Brasil. Acta Biol. Leopold. 9(1):99-110.
- SIQUEIRA, J.C. 1992. O gênero Gomphrena L. (Amaranthaceae) no Brasil. Pesq. Bot. 43:5-197.
- SIQUEIRA, J.C. 2002. Amaranthaceae. In Flora fanerogâmica do Estado de São Paulo, vol. II. (M.G.L. Wanderley, G.J. Shepherd, A.N. Giulietti, T.S.A. Melhem, V. Dittrich & C. Kameyama). HUCITEC, São Paulo, p.11-30.
- SIQUEIRA, J.C. 2007. O Bioma Cerrado e a preservação de grupos taxonômicos: um olhar sobre as Amaranthaceae. Pesq. Bot. 58:389-394.
- SOUZA, W. (ED). 1998. Técnicas básicas de microscopia eletrônica aplicadas às ciências biológicas. Sociedade Brasileira de Microscopia, Rio de Janeiro.
- THIERS, B. 2010. Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden´s Virtual Herbarium. Continuously updated. http://sweetgum.nybg.org/ih (último acesso em 06/2010).
Datas de Publicação
-
Publicação nesta coleção
29 Jul 2011 -
Data do Fascículo
Dez 2010
Histórico
-
Recebido
26 Fev 2010 -
Revisado
17 Jun 2010 -
Aceito
04 Out 2010