Resumos
Foram estudadas as comunidades de ácaros em indivíduos de Hymenaea martiana Hayne (Leguminosae) com diferentes tamanhos, localizados em fragmento de Mata Estacional Semidecidual com transição para o Cerrado. As plantas analisadas foram selecionadas com base no gradiente de altura e perímetro do tronco a 10 cm acima do solo. Foram realizadas coletas quinzenais no período de março de 2007 a março de 2008. Em cada amostragem foram retiradas três folhas dos ramos externos e três dos ramos internos, ao redor da região mediana da copa de cada planta selecionada. Para comparar os padrões ecológicos das comunidades de ácaros entre as plantas, foram aplicados índices descritores da diversidade. Em H. martiana, foram registrados 109.445 ácaros pertencentes a 28 espécies de 14 famílias. Nove espécies de ácaros, dentre as 19 classificadas como frequentes e acessórias, tiveram sua densidade populacional influenciada pelo tamanho da planta. Enquanto a densidade populacional de Chiapacheylus edentatus De Leon, 1962, Euseius cf. errabundus, Pronematus sp., Brevipalpus phoenicis (Geijskes, 1939) e Tarsonemus sp., apresentou correlação positiva com a altura da planta, a de Aberoptus aff. cerostructor, Euseius sibelius (De Leon, 1962), Typhlodromalus aripo De Leon, 1967 e Phytoseius nahuatlensis De Leon, 1959, apresentou correlação negativa. Não houve influência da altura da planta sobre a riqueza de espécies e densidade total de ácaros entre ramos internos e externos das plantas com diferentes alturas. As variações fisiológicas entre os indivíduos de diferentes estágios ontogenéticos de H. martiana, juntamente com fatores abióticos, podem ter influenciado a ocorrência e a distribuição dessas espécies de ácaros sobre essa planta.
ecologia de comunidades; gradiente de altura; jatobá; riqueza de espécies
The mite communities on plants with different sizes of Hymenaea martiana Hayne (Leguminosae) were studied in a remnant of Mata Estacional Semidecidual in transition to Cerrado forest. The plants were selected according to the height and perimeter of trunk at 10 cm from the soil. Biweekly samples from March 2007 to March 2008 were performed, with three leaves collected from the outer and three from the inner branches at level of median canopy region for each plant selected. Diversity indexes were applied in order to verify the ecological patterns of mite community among the plants. We recorded 109,445 mites belonging to 28 species and 14 families on H. martiana. The population density of nine species of mites, among 19 classified as frequent and accessory, varied according to the plant size. While the population densities of Chiapacheylus edentatus De Leon, 1962, Euseius cf. errabundus, Pronematus sp., Brevipalpus phoenicis (Geijskes, 1939) and Tarsonemus sp. had positive correlation with the plant size, the densities of Aberoptus aff. cerostructor, Euseius sibelius (De Leon, 1962), Typhlodromalus aripo De Leon, 1967 and Phytoseius nahuatlensis De Leon, 1959 had negative correlation. There was no influence of the plant height on the species richness and total density of mites between leaves from the inner and outer branches sampled in plants with different sizes. The physiological variations between individuals of H. martiana in different ontogenetic stages, in addition to abiotics traits, might have influenced the occurrence and distribution of mites on this plant.
community ecology; height gradient; jatobá; species richness
ARTIGOS
Diversidade de ácaros (Arachnida: Acari) em Hymenaea martiana (Leguminosae) em gradiente de tamanho de plantas
Diversity of mites (Arachnida: Acari) on Hymenaea martiana (Leguminosae) in gradient of plant size
Reinaldo José Fazzio FeresI, ** Autor para correspondência: Reinaldo José Fazzio Feres, e-mail: reinaldo@ibilce.unesp.br; Vimael RussoII; Rodrigo Damasco DaudII
IDepartamento de Zoologia e Botânica, Instituto de Biociências, Letras e Ciências Exatas - IBILCE, Universidade Estadual Paulista - UNESP, Pesquisador bolsista do CNPq, Rua Cristóvão Colombo, n. 2265, CEP 15054-000, São José do Rio Preto, SP, Brasil
IIPrograma de Pós-graduação em Biologia Animal
RESUMO
Foram estudadas as comunidades de ácaros em indivíduos de Hymenaea martiana Hayne (Leguminosae) com diferentes tamanhos, localizados em fragmento de Mata Estacional Semidecidual com transição para o Cerrado. As plantas analisadas foram selecionadas com base no gradiente de altura e perímetro do tronco a 10 cm acima do solo. Foram realizadas coletas quinzenais no período de março de 2007 a março de 2008. Em cada amostragem foram retiradas três folhas dos ramos externos e três dos ramos internos, ao redor da região mediana da copa de cada planta selecionada. Para comparar os padrões ecológicos das comunidades de ácaros entre as plantas, foram aplicados índices descritores da diversidade. Em H. martiana, foram registrados 109.445 ácaros pertencentes a 28 espécies de 14 famílias. Nove espécies de ácaros, dentre as 19 classificadas como frequentes e acessórias, tiveram sua densidade populacional influenciada pelo tamanho da planta. Enquanto a densidade populacional de Chiapacheylus edentatus De Leon, 1962, Euseius cf. errabundus, Pronematus sp., Brevipalpus phoenicis (Geijskes, 1939) e Tarsonemus sp., apresentou correlação positiva com a altura da planta, a de Aberoptus aff. cerostructor, Euseius sibelius (De Leon, 1962), Typhlodromalus aripo De Leon, 1967 e Phytoseius nahuatlensis De Leon, 1959, apresentou correlação negativa. Não houve influência da altura da planta sobre a riqueza de espécies e densidade total de ácaros entre ramos internos e externos das plantas com diferentes alturas. As variações fisiológicas entre os indivíduos de diferentes estágios ontogenéticos de H. martiana, juntamente com fatores abióticos, podem ter influenciado a ocorrência e a distribuição dessas espécies de ácaros sobre essa planta.
Palavras-chave: ecologia de comunidades, gradiente de altura, jatobá, riqueza de espécies.
ABSTRACT
The mite communities on plants with different sizes of Hymenaea martiana Hayne (Leguminosae) were studied in a remnant of Mata Estacional Semidecidual in transition to Cerrado forest. The plants were selected according to the height and perimeter of trunk at 10 cm from the soil. Biweekly samples from March 2007 to March 2008 were performed, with three leaves collected from the outer and three from the inner branches at level of median canopy region for each plant selected. Diversity indexes were applied in order to verify the ecological patterns of mite community among the plants. We recorded 109,445 mites belonging to 28 species and 14 families on H. martiana. The population density of nine species of mites, among 19 classified as frequent and accessory, varied according to the plant size. While the population densities of Chiapacheylus edentatus De Leon, 1962, Euseius cf. errabundus, Pronematus sp., Brevipalpus phoenicis (Geijskes, 1939) and Tarsonemus sp. had positive correlation with the plant size, the densities of Aberoptus aff. cerostructor, Euseius sibelius (De Leon, 1962), Typhlodromalus aripo De Leon, 1967 and Phytoseius nahuatlensis De Leon, 1959 had negative correlation. There was no influence of the plant height on the species richness and total density of mites between leaves from the inner and outer branches sampled in plants with different sizes. The physiological variations between individuals of H. martiana in different ontogenetic stages, in addition to abiotics traits, might have influenced the occurrence and distribution of mites on this plant.
Keywords: community ecology, height gradient, jatobá, species richness.
Introdução
A maior ameaça à diversidade biológica é a perda de hábitat ou sua fragmentação. Além da rápida destruição, os hábitats que anteriormente ocupavam grandes áreas são constantemente divididos em pequenos fragmentos pelas estradas, campos, cidades e por um grande número de outras atividades humanas (Primack & Rodrigues 2001).
O estudo da diversidade e ocorrência sazonal da comunidade de ácaros associada a plantas nativas poderá ser de grande importância para aplicação posterior em processos de recuperação de áreas degradadas e avaliação dos danos causados pelas mudanças físicas e biológicas nesses habitates. Estudos neste sentido foram realizados por Feres et al. (2007) e Daud & Feres (2005) que avaliaram a diversidade e ocorrência sazonal da comunidade de ácaros associada a plantas de fragmentos de Mata Estacional Semidecidua no estado de São Paulo.
Além da importância ecológica, plantas nativas podem também servir como reservatórios de ácaros predadores em períodos de escassez de presas. Diversos predadores podem utilizar o pólen e néctar como alimento alternativo, além de certas estruturas vegetais da planta (e.g. domácias, tricomas não glandulares) servirem como abrigos e sítios de oviposição para essas espécies (Altieri et al. 2003, Romero & Benson 2005). Diferentes espécies de ácaros fitófagos e predadores foram registradas por Flechtmann (1967), Aranda (1974) e Lofego et al. (2004, 2005) em plantas nativas de Cerrado, e por Feres & Moraes (1998), Feres et al. (2005) e Buosi et al. (2006) em fragmentos de Mata Estacional Semidecidual.
A eficiência e a qualidade do recurso podem ser alteradas durante a ontogenia de um organismo, o que permite a sucessão de novas interações ecológicas (Fonseca & Benson 2003). Podem ser citadas como exemplo, as interações de espécies de artrópodes fitófagos com suas plantas hospedeiras. Alguns insetos fitófagos estão intimamente associados com plantas de determinada idade ou tamanho (Lawton 1983), enquanto que as atividades de artrópodes polinizadores e exploradores de néctar estão diretamente relacionadas com a idade reprodutiva das plantas visitadas (Barth 1991). Segundo Karban (1987), plantas jovens de algumas espécies são mais propícias para o desenvolvimento de fitófagos, enquanto na fase adulta tornam-se mais resistentes como consequência da defesa induzida pelo ataque desses organismos ao longo de seu desenvolvimento.
Foram amostrados os ácaros presentes na copa de indivíduos de Hymenaea martiana Hayne (Leguminosae), considerando-se um gradiente de altura, com o objetivo de verificar possíveis mudanças na estrutura da comunidade desses artrópodes em função das diferentes arquiteturas e estados fisiológicos dos estágios ontogenéticos dessa planta. Plantas do gênero Hymenaea, popularmente conhecidas como jatobás, são nativas de Mata Estacional Semidecidual e de Cerrado nas regiões nordeste, centro-oeste e sudeste, sendo sua madeira muito utilizada para construção civil e naval. Além disso, podem ser empregadas na arborização urbana e em programas de recuperação de áreas naturais degradadas (Pestana 2010, Lorenzi 1992).
Material e Métodos
1. Área de estudo
O estudo foi desenvolvido em um fragmento de Mata Estacional Semidecidual com transição para o Cerrado, localizado no Sítio Bom Sucesso (20°28' S, 49°22' W, altitude de 541 m), município de Nova Granada, estado de São Paulo. Em uma área de 2,66 ha deste fragmento, possuindo cerca de 200 plantas de diferentes idades de H. martiana, foram selecionados e marcados 15 exemplares com distância entre os indivíduos variando de 25 a 380 m. Desses exemplares foram extraídas medidas da altura e do diâmetro do tronco a 10 cm acima do solo de cada uma das plantas, a fim de ordená-los por gradientes de tamanho. Do menor para maior (P1 a P15) as alturas variam de 70 cm a 1.600 cm (Figura 1). Dentre as plantas menores, P1 e P5 eram sombreadas por plantas de outras espécies e de maior porte, enquanto P2 e P6 encontravam-se em locais abertos, totalmente expostas a luz solar.
2. Amostragem e identificação
Foram realizadas coletas quinzenais no período de março de 2007 a março de 2008. Em cada amostragem foram retiradas seis folhas ao redor da região mediana da copa de cada planta marcada, sendo três folhas pertencentes aos ramos externos e três aos ramos internos. As folhas foram transportadas para o Laboratório de Acarologia da UNESP de São José do Rio Preto, acondicionadas em sacos de papel no interior de sacos plásticos, mantidos em caixas isotérmicas de poliestireno com gelo X®. As folhas coletadas foram analisadas sob microscópio estereoscópico e todos os ácaros presentes foram montados em lâminas de microscopia com o meio de Hoyer (Flechtmann 1975). Devido ao seu fácil reconhecimento, os eriofiídeos foram contados diretamente sob estereomicroscópio durante os períodos de grandes infestações, sendo uma parcela de indivíduos montada em lâminas para a confirmação da espécie.
Os ácaros foram identificados e quantificados sob microscópio óptico com contraste de fases. Alguns exemplares foram depositados como material testemunho (lâminas 7490 a 7657) na coleção de Acari (DZSJRP) - http:www.splink.cria.org.br, do Departamento de Zoologia e Botânica, Universidade Estadual Paulista (UNESP), São José do Rio Preto, SP.
3. Análises dos dados
Para determinar a densidade populacional de ácaros (número de indivíduos/área foliar) foi calculada a área foliar média de 40 folhas de H. martiana selecionadas com base no gradiente de tamanho foliar. O contorno de cada folha foi desenhado sobre papel quadriculado para posterior cálculo da área superficial e da área do retângulo que delimita o mesmo. A relação entre a área foliar e a área do retângulo foi testada através de regressão linear (Zar 1999), obtendo-se uma equação para o cálculo da área superficial das demais folhas. Foi obtida a seguinte equação para o cálculo da área superficial: área foliar = 2 × (-1,4828 + 0,7623 × Área do retângulo) (r2 = 0,99 e p < 0,001).
A diversidade e a uniformidade de espécies foram calculadas pelos índices de Shannon-Wiener (H') e de Pielou (J), respectivamente (Odum 1988), através do software PAST® versão 1.36 (Hammer et al. 2001). O método Bootstrap (Krebs 1999) foi utilizado para gerar variância nos valores de diversidade, uniformidade e riqueza de espécies com o intuito de determinar o intervalo de confiança a 95%. Os valores dos índices ecológicos de cada comunidade foram comparados por meio de análise gráfica através do método de sobreposição de barras de erro proposto por Cumming et al. (2007).
A constância (c) foi calculada de acordo com a fórmula de Bodenheimer (1955) apud Silveira-Neto et al. (1976) e as espécies classificadas como frequentes (c > 50%), acessórias (25 < c < 50%) e raras (c < 25%).
Os valores de riqueza, densidade total da comunidade e da densidade média das espécies frequentes e acessórias nas plantas com diferentes tamanhos foram comparados através da análise de co-variância (ANCOVA, Underwood 1997), sendo a altura da planta utilizada como co-variável e os microhábitats (ramos internos e externos) como variáveis categóricas independentes. Devido a sua distribuição não-paramétrica, os dados foram primeiramente transformados pela equação Öy, antes da realização da análise estatística.
Resultados
1. Composição de espécies de ácaros
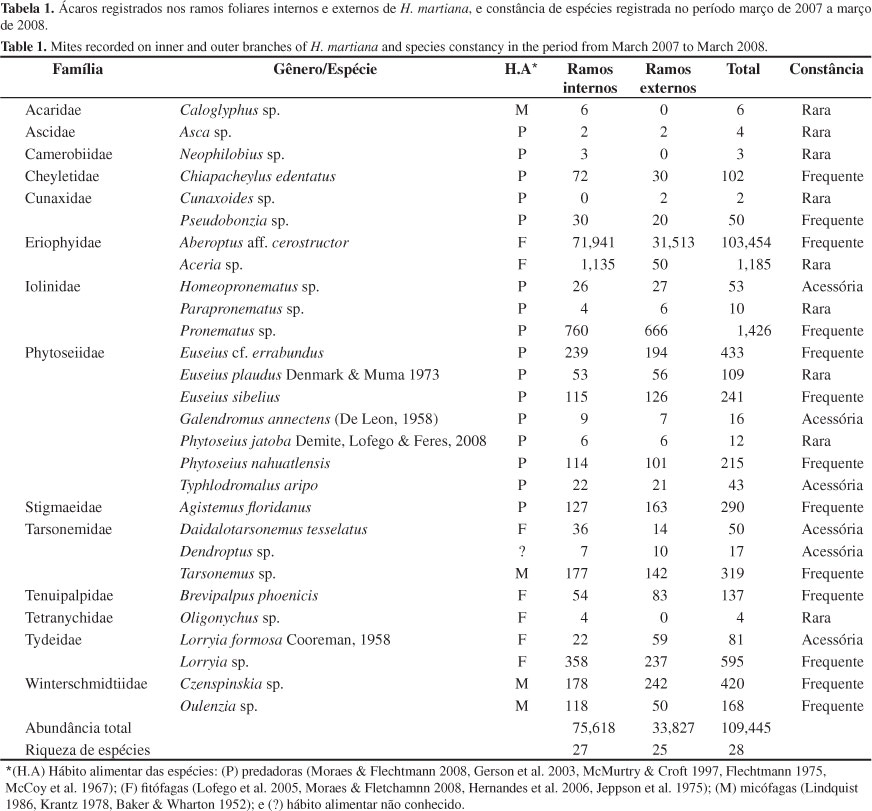
Foram registrados em H. martiana, 109.445 ácaros pertencentes a 28 espécies de 25 gêneros e 14 famílias. Metade dessas espécies (46,4%) foi classificada como frequente, enquanto que 29 e 21% foram raras e acessórias, respectivamente (Tabela 1). As espécies classificadas como frequentes foram comuns a todas as plantas avaliadas.
Dentre as espécies fitófagas frequentes, Aberoptus aff. cerostructor (Eriophyidae), Lorryia sp. (Tydeidae) e Brevipalpus phoenicis (Geijskes, 1939) (Tenuipalpidae) foram as mais numerosas, com 103.454, 595 e 137 indivíduos coletados, respectivamente. O fitófago Aceria sp. (Eriophyidae) foi também abundante, mas pouco frequente, tendo sido registrada em maio de 2007. As predadoras mais abundantes foram Pronematus sp. (Iolinidae), Euseius cf. errabundus (Phytoseiidae) e Agistemus aff. floridanus (Stigmaeidae). As espécies micófagas com maior número de indivíduos amostrados foram Czenspinskia sp. (Winterschmidtiidae), Tarsonemus sp. (Tarsonemidae) e Oulenzia sp. (Winterschmidtiidae) (Tabela 1).
2. Tamanho da planta e comunidade de ácaros
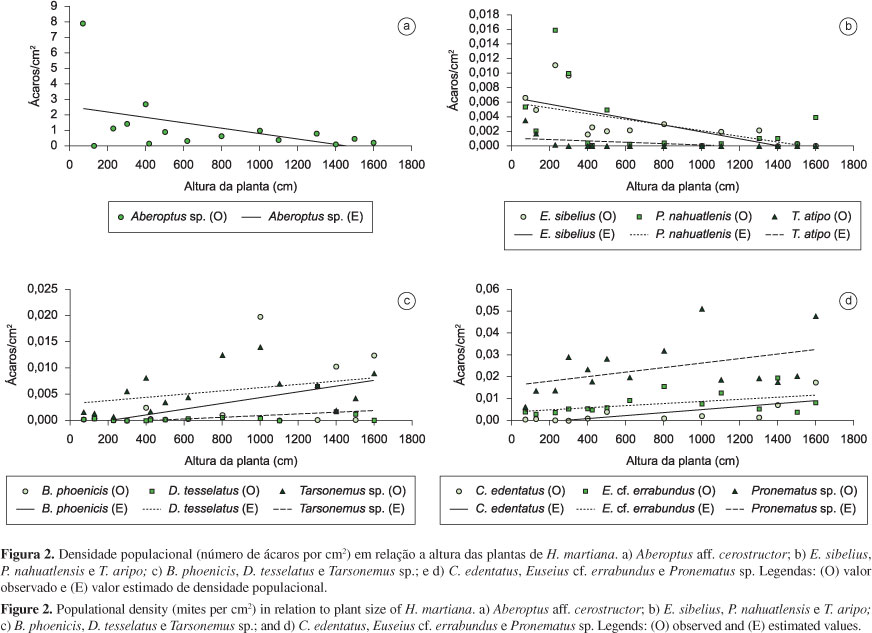
Foi observado que a altura da planta influenciou a densidade populacional média de nove espécies de ácaros. Não houve influência do tipo de microhábitat (ramos foliares internos e externos de H. martiana) sobre a comunidade, e da altura da planta sobre a riqueza de espécies e densidade total de ácaros (Tabela 2). A densidade populacional do fitófago Aberoptus aff. cerostructor teve correlação negativa com a altura das plantas, enquanto a de B. phoenicis e Daidalotarsonemus tesselatus De Leon, 1956 (Tarsonemidae), apresentou correlação positiva. Já a densidade dos predadores Chiapacheylus edentatus De Leon, 1962 (Cheyletidae), Pronematus sp. e Euseius cf. errabundus tiveram correlação positiva, enquanto que a de Euseius sibelius (DeLeon, 1962), Phytoseius nahuatlensis DeLeon, 1959 e Typhlodromalus aripo DeLeon, 1967, teve correlação negativa com a altura da planta. Dentre os ácaros micófagos, somente a população de Tarsonemus sp. aumentou de acordo com o tamanho da planta (Tabela 2, Figuras 2a, d).
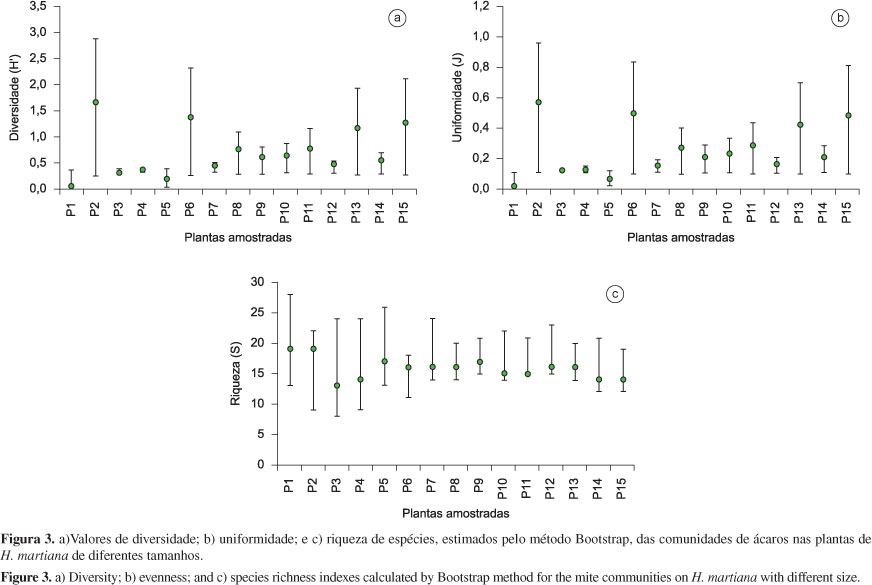
Foram observados menores valores de diversidade e uniformidade de espécies nas comunidades das plantas P1, P3, P4, P5, P7, P12 e P14. Por outro lado, em P2, P6, P13 e P15 foram registradas tendências de maior diversidade e uniformidade de espécies de ácaros. (Figuras 3a, b). Os valores da riqueza de espécies não variaram entre as plantas de diferentes tamanhos (Figura 3c).
Discussão
Nos exemplares estudados de H. martiana foram registrados valores similares de riqueza e composição de espécies de ácaros, entretanto, o padrão de colonização e a densidade de cada espécie variaram entre os indivíduos em diferentes estágios ontogenéticos desse hospedeiro vegetal. Provavelmente, os valores nutricionais e a concentração de compostos defensivos foliares de plantas em diferentes fases de desenvolvimento (Pizzamiglio-Gutierrez 2009, Coley & Aide 1991, Kearsley & Whitham 1989), juntamente com outros fatores bióticos e abióticos, influenciaram a quantidade e qualidade de recursos disponíveis, o que determinou os padrões de ocorrência e abundância de algumas espécies de ácaros. Alterações nos processos fisiológicos e morfológicos durante o crescimento das plantas, associado à modificações na estrutura da comunidade de artrópodes, já foram verificadas por outros autores (e.g. Coley & Barone 1996, Coley & Aide 1991, Karban 1987) . De acordo com Larsson & Ohmart (1988), as modificações dos padrões nutricionais e fenológicos, ocorridas durante o desenvolvimento de folhas de Eucalyptus blakelyi Maiden, influenciaram o desempenho e seleção das populações de larvas do besouro Paropsis atomaria Oliver, 1807 (Coleoptera: Chrysomelidae). Karban & Thaler (1999) verificaram que folhas de algodoeiro, Gossypium hirsutum L. (Malvaceae), em diferentes fases de desenvolvimento apresentaram distintas respostas na susceptibilidade ao ataque do ácaro fitófago Tetranychus urticae Koch, 1836 (Tetranychidae) e propuseram que isso foi consequência da variação da capacidade fotossintética durante a ontogenia foliar.
A arquitetura da planta é uma característica que também apresenta fundamental importância na modulação da diversidade e abundância de artrópodes (Lawton 1983). A copa da planta pode influenciar a ocorrência da comunidade associada, pois dependendo de seu tamanho, receberá distintos níveis de incidência solar, vento, umidade e de outros fatores abióticos, o que interfere diretamente no desenvolvimento das espécies. As plantas de H. martiana mais altas apresentavam copas mais amplas e com maior número de folhas, sendo o inverso observado para aquelas de menor estatura (plantas mais jovens), o que pode também ter contribuído para modular a estrutura da comunidade de ácaros.
A densidade total de ácaros não foi influenciada pelo tamanho da planta. Isto pode ser explicado pelo fato da densidade de Aberoptus aff. cerostructor e das espécies predadoras E. sibelius, P. nahuatlensis e T. aripo ter diminuído com o aumento do tamanho da planta, enquanto que a densidade populacional de C. edentatus, Pronematus sp., E. cf. errabundus e Tarsonemus sp. aumentou, mantendo-se portanto uma densidade total relativamente constante entre as plantas.
De acordo com Flechtmann (2001), indivíduos de Aberoptus cerostructor Flechtmann, 2001 (Eriophyidae) raspam a epiderme da face abaxial das folhas de Hymenaea courbaril L. e formam um abrigo constituído por uma camada de cera. Essa mesma característica foi também observada para Aberoptus aff. cerostructor em H. martiana.
Aberoptus aff. cerostructor foi a espécie dominante em todas as plantas estudadas de H. martiana e, com isso, pode ter exercido influência na densidade populacional de algumas espécies de ácaros predadores. Nas plantas jovens P1, P3 e P4, com grande densidade de A. aff. cerostructor, também ocorreu grande densidade populacional de Agistemus aff. floridanus. Além disso, vários indivíduos de A. aff. floridanus foram capturados dentro dos abrigos construídos por A. aff. cerostructor durante as triagens. Isso é sugestivo de que A. aff. floridanus pode alimentar-se dessa espécie de eriofiídeo. Segundo Ferla & Moraes (2003), Agistemus floridanus Gonzalez, 1965 apresentou alta taxa de oviposição quando alimentado com o eriofiídeo Calacarus heveae Feres, 1992.
Além de A. aff. floridanus, outras espécies de ácaros predadores podem ter se alimentado de A. aff. cerostructor, tais como as pertencentes as famílias Iolinidae (Homeopronematus sp, Parapronematus sp. e Pronematus sp.) e Phytoseiidae (Euseius spp.). Pronematus e Euseius são referidos como predadores de eriofiídeos por Baker & Warton (1952) e McMurtry & Croft (1997), respectivamente.
A densidade populacional de T. aripo e das espécies de Euseius também pode ter sido modulada pela presença de nectários extraflorais nas folhas das plantas adultas de H. martiana. Muitos indivíduos de Euseius foram observados alimentando-se em nectários extraflorais (NEFs) durante as triagens e, segundo McMurtry & Croft (1997), T. aripo pode se desenvolver e sobreviver quando alimentados com substâncias açucaradas, néctar e exsudados de plantas.
Dessa forma, tanto a arquitetura como as condições fisiológicas dos diferentes estágios de desenvolvimento de H. martiana foram determinantes na ocorrência e distribuição de algumas espécies de ácaros. Porém, as relações entre ácaros com a ontogenia de plantas hospedeiras ainda são pouco conhecidas em sistemas tropicais, sendo necessário mais estudos na tentativa de revelar quais os principais fatores que alteram os recursos disponíveis para a comunidade de ácaros no decorrer do desenvolvimento de diferentes plantas nesses ambientes.
Agradecimentos
Aos Drs. Peterson Rodrigo Demite e Fábio Akashi Hernandes (UNESP, São José do Rio Preto) pela identificação dos Phytoseiidae e Stigmaeidae, respectivamente. A Profa. Dra. Neusa Taroga Ranga (UNESP) pela identificação da planta estudada. Aos Profs. Drs. Gustavo Quevedo Romero (UNICAMP, Campinas) e Antônio Carlos Lofego (UNESP, São José do Rio Preto) pelas valiosas críticas e sugestões ao trabalho.
Recebido em 14/05/2010
Versão reformulada recebida em 21/10/2010
Publicado em 28/10/2010
- ALTIERI, M.A., SILVA, E.N. & NICHOLLS, C.I. 2003. O papel da biodiversidade no manejo de pragas. Holos, Ribeirão Preto.
- ARANDA, C.B.R. 1974. Tetranychoidea (Acari) de uma área de Cerrado do Estado de São Paulo. Dissertação de Mestrado, ESALQ/Universidade de São Paulo, Piracicaba.
- BAKER, E.W. & WHARTON, A.E. 1952. An introduction to acarology. McMillan, New York.
- BARTH, F.G. 1991. Insect and flowers: the biology of a partnership. Princepton Science Library, Princepton.
- BUOSI, R., FERES, R.J.F., OLIVEIRA, A.R., LOFEGO, A.C. & HERNANDES, F.A. 2006. Ácaros plantícolas (Acari) da "Estação Ecológica de Paulo de Faria", estado de São Paulo, Brasil. Biota Neotrop. 6(1): http://www.biotaneotropica.org.br/v6n1/pt/abstract?article+bn02006012006 (último acesso em 10/05/2010).
- COLEY, P.D. & AIDE, T.M. 1991. Comparisons of herbivory and plant defenses in temperate and tropical broad-leaved forest. In Plant-animal interactions: evolutionary ecology in tropical and temperate regions (P.W. Price, T.M. Lewinsohn, G.W. Fernandes & W.W. Benson, eds.). John Wiley & Sons, New York, p.25-48.
- COLEY, P.D. & J.A. BARONE. 1996. Herbivory and plant defenses in tropical forests. Annu. Rev. Ecol. 27:305-335.
- CUMMING, G., FIDLER, F. & VAUX, D.L. 2007. Error bars in experimental biology. J. Cel. Biol. 177(1):7-11.
- DAUD, R.D. & FERES, R.J.F. 2005. Diversidade e flutuação populacional de ácaros (Acari) em Mabea fistulifera Mart. (Euphorbiaceae) de dois fragmentos de Mata Estacional Semidecídua em São José do Rio Preto, SP. Neotrop. Entomol. 34(2):191-201.
- FERES, R.J.F. & MORAES, G.J. 1998. Phytoseiid mites (Acari: Phytoseiidae) from wood areas in the State of São Paulo, Brazil. Sys. Appl. Acarol. 3:125-132.
- FERES, R.J.F., LOFEGO, A.C. & OLIVEIRA, A.R. 2005. Ácaros plantícolas (Acari) da Estação Ecológica do Noroeste Paulista, Estado de São Paulo, Brasil. Biota Neotrop. 5(1):http://www.biotaneotropica.org.br/v5n1/pt/abstract?article+BN00405012005 (último acesso em 09/05/2010).
- FERES, R.J.F., BUOSI, R., DAUD, R.D. & DEMITE, P.R. 2007. Padrões ecológicos da comunidade de ácaros em euforbiáceas de um fragmento de mata Estacional Semidecídual, no Estado de São Paulo. Biota Neotrop. 7(2): http://www.biotaneotropica.org.br/v7n2/pt/abstract?article+bn04907022007 (último acesso em 10/05/2010).
- FERLA, N.J. & MORAES, G.J. 2003. Oviposição dos ácaros predadores Agistemus floridanus Gonzáles, Euseius concordis (Chant) e Neoseiulus anonymus (Chant & Baker) (Acari) em resposta a diferentes tipos de alimento. Rev. Bras. Zool. 20(1):153-155.
- FLECHTMANN, C.H.W. 1967. Ácaros de plantas do Cerrado. Anais E.S.A. Luiz de Queiroz 24:315-316.
- FLECHTMANN, C.H.W. 1975. Elementos de acarologia. Nobel, São Paulo.
- FLECHTMANN, C.H.W. 2001. Aberoptus cerosconstrutor n. sp., a deuterogynous species from Brazil (Acari: Eriophyidae). Internat. J. Acarol. 27(3):199-204.
- FONSECA, C.R. & BENSON, W.W. 2003. Ontogenetic succession in Amazonian ant tree. Oikos 102(2):407-412.
- GERSON, U., SMILEY, R.L. & OCHOA, R. 2003. Mites (Acari) for pest control. Blackwell Science, Oxford.
- HAMMER, Ø., HARPER, D.A.T. & RYAN, P. D. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontol. Electr. 4: http://palaeo-lectronica.org/2001_1/past/issue1_01.htm (último acesso em 10/05/2010).
- HERNANDES, F.A., FERES, R.J.F. & NOMURA, F. 2006. Biological cycle of Lorryia formosa (Acari, Tydeidae) on rubber tree leaves: a case of thelytoky. Exp. Appl. Acarol. 38(4):237-242.
- JEPPSON, L.R., KEIFER, H.H. & BAKER, E.W. 1975. Mites injurions to economic plants. Univ. Calif. Press, Los Angeles.
- KARBAN, R. 1987. Herbivory dependent on plant age: a hypothesis based on acquired resistance. Oikos 48(3):336-337.
- KARBAN, R. & THALER, J.S. 1999. Plant phase change and resistance to herbivory. Ecology 80(2):510-517.
- KEARSLEY, J.C. & WHITHAM, T.G. 1989. Development changes in resistance to herbivory: Implications for individuals and populations. Ecology 70(2):422-434.
- KRANTZ, G.W. 1978. A manual of acarology. Corvallis, Oregon State University Book Stores, Corvallis.
- KREBS, C.J. 1999. Ecological methodology. Adson Wesley Longman, Menlo Park.
- LARSSON, S. & OHMART, C.P. 1988. Leaf age and larval performance of the leaf beetle Parapsis atomaria Ecol. Entomol. 13(1):19-24.
- LAWTON, J.H. 1983. Plant architecture and the diversity of phytophagous insects. Ann. Rev. Entomol. 28:23-29.
- LINDQUIST, E.E. 1986. The world genera of Tarsonemidae (Acari: Heterostigmata): A morphological, phylogenetic and systematic revision, with a reclassification of familygroup taxa in the Heterostigmata. Mem. Entomol. Soc. Canada 118(136):1-516.
- LOFEGO, A.C., MORAES, G.J. & CASTRO, L.A.S. 2004. Phytoseiid mites (Acari: Phytoseiidae) on Myrtaceae in the State of São Paulo, Brasil. Zootaxa 516:1-18.
- LOFEGO, A.C., OCHOA, R. & MORAES, G.J. de. 2005. Some tarsonemidae mites (Acari: Tarsonemidade) from the Brazilian "Cerrado" vegetation, with description of three new species. Zootaxa. 823:1-27.
- LORENZI, H. 1992. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Plantarum, Nova Odessa.
- MCCOY, C.W., SELHIME, A.G. & KANAVEL, R.F. 1967. The feeding behavior and biology of Parapronematus acacie (Acarina: Tydeidae). Fla. Entomol. 52(1):13-19.
- MCMURTRY, J.A. & CROFT, B.A. 1997. Life-styles of phytoseiid mites and their roles in biological control. Annu. Rev. Entomol. 42:291-321.
- MORAES, G.J. DE & FLECHTMANN, C.H.W. 2008. Manual de acarologia: acarologia básica e ácaros de plantas cultivadas no Brasil. Holos, Ribeirão Preto.
- ODUM, E.P. 1988. Ecologia. Editora Guanabara, Rio de Janeiro.
- PESTANA, L.T.C. 2010. Estudo taxonômico de Hymenea L.: complexo H. courbaril, H. martiana e H. stigonocarpa (Fabaceae: Caesalpinioidea: Detarieae). Dissertação de mestrado, PPG Biologia Vegetal, Universidade Federal de Mato Grosso do Sul, Campo Grande: http://www.scribd.com/doc/32130951/PESTANA-2010-Estudo-taxonomico-de-Hymenaea-L-complexo-H-courbaril-H-martiana-e-H-stigonocarpa-Fabaceae-Caesalpinioideae-Detarieae
- PIZZAMIGLIO-GUTIERREZ, M.A. 2009. Interações inseto-planta. In Bioecologia e nutrição de insetos: Base para o manejo integrado de pragas (A.R. Panizzi & J.R.P. Parra, eds.). Embrapa Informação Tecnológica, Brasília, p. 211-249.
- PRIMACK, R. B. & RODRIGUES, E. 2001. Biologia da Conservação. Editora Planta, Londrina.
- ROMERO, G.Q. & BENSON, W.W. 2005. Biotic interactions of mites, plants and leaf domatia. Curr. Opin. Plant Biol. 8:436-440.
- SILVEIRA-NETO, S., NAKANO, O., BARBIN, D. & NOVA, N.A.V. 1976. Manual de ecologia dos insetos. Agronômica Ceres, Piracicaba.
- UNDERWOOD, A.J. 1997. Experiments in ecology: Their logical design and interpretation using analysis of variance. Cambridge University Press, Cambridge.
- ZAR, J.H. 1999. Biostatistical analysis. 4th ed. Prentice-Hall, New Jersey.
Datas de Publicação
-
Publicação nesta coleção
29 Jul 2011 -
Data do Fascículo
Dez 2010
Histórico
-
Aceito
28 Out 2010 -
Revisado
21 Out 2010 -
Recebido
14 Maio 2010