Resumos
O presente trabalho tem como objetivo apresentar o resultado de um levantamento herpetofaunístico realizado na floresta do baixo rio Moa, em Cruzeiro do Sul, Acre. O estudo foi realizado entre fevereiro de 2008 e setembro de 2009, sendo as espécies registradas através de armadilhas de interceptação e queda (AIQ), procura limita por tempo (PLT), busca ativa (BA), amostragem em sítios reprodutivos (ASR) e encontros ocasionais (EO). A herpetofauna foi amostrada em uma área de aproximadamente 256 hectares em áreas de propriedades particulares, incluindo área aberta antropizada, adjacente a floresta, composta principalmente por pastagens. Na área florestada a amostragem foi realizada em duas trilhas com fisionomias diferentes (Mata de Terra Firme e Mata de Várzea). Foram registradas 103 espécies, sendo 50 de anfíbios anuros e 53 de répteis (35 serpentes, 17 lagartos e um crocodiliano). A curva do coletor atingiu a assíntota para os anfíbios anuros, mas não para os lagartos, serpentes e a herpetofauna (todos os grupos). Nas áreas florestadas foi registrada a maioria das espécies de anfíbios anuros, o mesmo sendo observado para os répteis, sendo que a maioria destes foi registrada na mata de terra firme. A maioria dos anfíbios foi registrada durante a PLT e a ASR, enquanto os répteis foram através de EO e também por PLT. Espera-se um número maior de espécies de serpentes para a localidade do que a riqueza registrada (35 espécies). Salienta-se a importância da preservação de áreas florestadas particulares abrangendo tanto habitats nas margens de rios sujeitos a alagação periódica como de terra firme, uma vez que existem diferenças na composição herpetofaunística em relação a estrutura das florestas. A preservação das áreas de floresta é fundamental para manutenção da diversidade de anfíbios e répteis na Amazônia, que tem sua riqueza diminuída com a transformação de florestas em pastagens e também com a retirada de madeira e abertura de clareiras.
Amazônia; Amphibia; Reptilia; Anura; Squamata
We report the results of a herpetofauna survey carried out in the forest of Lower Moa River, Cruzeiro do Sul, state of Acre, northern Brazil. The study was carried out from February 2008 to September 2009; the species were sampled through pitfall traps with drift fences (AIQ), time-constrained search (PLT), active search (BA), sampling at breeding sites (ASR), and occasional encounters (EO). The herpetofauna was sampled in an area of approximately 256 ha located within private properties, including an open area of pastures adjacent to a forest. In the forest area, sampling was carried out in two trails with different physiognomies: terra firme (upland forest) and várzea (flooded forest). We recorded 103 species: 50 anurans and 53 reptiles (35 snakes, 17 lizards and one crocodilian). The collector's curve reached the asymptote for anurans, but not for lizards, snakes or the whole herpetofauna (all groups together). Most species of anurans and reptiles were recorded in forest areas, mainly terra firme. Most amphibians were recorded through PLT and ASR, whereas reptiles were recorded through EO and PLT. A higher number of snakes were expected for the locality than the richness actually recorded (35 species). We emphasize the importance of preserving private forests that encompass both kinds of habitat (terra firme and várzea), since they differ in herpetofauna composition due to differences in forest structure. The preservation of forests is crucial to the maintenance of amphibian and reptile biodiversity in the Amazon, which loses species due to the conversion of forests into pastures and logging.
Amazon; Amphibia; Reptilia; Anura; Squamata
INVENTÁRIOS
Herpetofauna da floresta do baixo rio Moa em Cruzeiro do Sul, Acre Brasil
Herpetofauna of the forest of Lower Moa River, Cruzeiro do Sul, Acre - Brazil
Paulo Sérgio BernardeI,** Autor para correspondência: Paulo Sérgio Bernarde, e-mail: snakebernarde@hotmail.com; Saymon de AlbuquerqueII; Daniele Bazzo de MirandaIII; Luiz Carlos Batista TurciI
ILaboratório de Herpetologia, Centro Multidisciplinar, Universidade Federal do Acre UFAC, Campus Floresta, CEP 69980-000, Cruzeiro do Sul, AC, Brasil
IIDepartamento de Zoologia, Centro de Ensino Faculdade São Lucas, Rua Alexandre Guimarães, 1927, Bairro Areal, CEP 76804-373, Porto Velho, RO, Brasil
IIIInstituto Federal de Educação, Ciência e Tecnologia do Acre IFAC, CEP 69980-000, Cruzeiro do Sul, AC, Brasil
RESUMO
O presente trabalho tem como objetivo apresentar o resultado de um levantamento herpetofaunístico realizado na floresta do baixo rio Moa, em Cruzeiro do Sul, Acre. O estudo foi realizado entre fevereiro de 2008 e setembro de 2009, sendo as espécies registradas através de armadilhas de interceptação e queda (AIQ), procura limita por tempo (PLT), busca ativa (BA), amostragem em sítios reprodutivos (ASR) e encontros ocasionais (EO). A herpetofauna foi amostrada em uma área de aproximadamente 256 hectares em áreas de propriedades particulares, incluindo área aberta antropizada, adjacente a floresta, composta principalmente por pastagens. Na área florestada a amostragem foi realizada em duas trilhas com fisionomias diferentes (Mata de Terra Firme e Mata de Várzea). Foram registradas 103 espécies, sendo 50 de anfíbios anuros e 53 de répteis (35 serpentes, 17 lagartos e um crocodiliano). A curva do coletor atingiu a assíntota para os anfíbios anuros, mas não para os lagartos, serpentes e a herpetofauna (todos os grupos). Nas áreas florestadas foi registrada a maioria das espécies de anfíbios anuros, o mesmo sendo observado para os répteis, sendo que a maioria destes foi registrada na mata de terra firme. A maioria dos anfíbios foi registrada durante a PLT e a ASR, enquanto os répteis foram através de EO e também por PLT. Espera-se um número maior de espécies de serpentes para a localidade do que a riqueza registrada (35 espécies). Salienta-se a importância da preservação de áreas florestadas particulares abrangendo tanto habitats nas margens de rios sujeitos a alagação periódica como de terra firme, uma vez que existem diferenças na composição herpetofaunística em relação a estrutura das florestas. A preservação das áreas de floresta é fundamental para manutenção da diversidade de anfíbios e répteis na Amazônia, que tem sua riqueza diminuída com a transformação de florestas em pastagens e também com a retirada de madeira e abertura de clareiras.
Palavras-chave: Amazônia, Amphibia, Reptilia, Anura, Squamata.
ABSTRACT
We report the results of a herpetofauna survey carried out in the forest of Lower Moa River, Cruzeiro do Sul, state of Acre, northern Brazil. The study was carried out from February 2008 to September 2009; the species were sampled through pitfall traps with drift fences (AIQ), time-constrained search (PLT), active search (BA), sampling at breeding sites (ASR), and occasional encounters (EO). The herpetofauna was sampled in an area of approximately 256 ha located within private properties, including an open area of pastures adjacent to a forest. In the forest area, sampling was carried out in two trails with different physiognomies: terra firme (upland forest) and várzea (flooded forest). We recorded 103 species: 50 anurans and 53 reptiles (35 snakes, 17 lizards and one crocodilian). The collector's curve reached the asymptote for anurans, but not for lizards, snakes or the whole herpetofauna (all groups together). Most species of anurans and reptiles were recorded in forest areas, mainly terra firme. Most amphibians were recorded through PLT and ASR, whereas reptiles were recorded through EO and PLT. A higher number of snakes were expected for the locality than the richness actually recorded (35 species). We emphasize the importance of preserving private forests that encompass both kinds of habitat (terra firme and várzea), since they differ in herpetofauna composition due to differences in forest structure. The preservation of forests is crucial to the maintenance of amphibian and reptile biodiversity in the Amazon, which loses species due to the conversion of forests into pastures and logging.
Keywords: Amazon, Amphibia, Reptilia, Anura, Squamata.
Introdução
O Brasil representa um dos maiores países em termos de megadiversidade, apresentando uma das mais ricas herpetofaunas, com aproximadamente 946 espécies de anfíbios (Segalla et al. 2012) e 732 de répteis (Bérnils & Costa 2011). Apesar da grande riqueza de espécies e anfíbios catalogada para o território nacional, ainda existem regiões não amostradas como na Amazônia, onde grande parte dessa diversidade é encontrada (Avila-Pires et al. 2007). A freqüência com que novas espécies são descritas (e. g., Caramaschi 2010, Peloso et al. 2011) e novos registros (e. g., Avila-Pires et al. 2010, Bernarde et al. 2011, Simões et al. 2011) são feitos, são indicativos da necessidade de mais estudos nesse bioma, especialmente de inventários.
O estado do Acre localiza-se no Oeste da Amazônia brasileira, região com a herpetofauna relativamente menos estudada quando comparada às suas regiões Central, Meridional e Oriental (Avila-Pires et al. 2007). No Acre, uma lista de serpentes com suas respectivas distribuições para os municípios e informações sobre a dieta de algumas espécies foi publicada por Silva et al. (2010). Na região do Alto Juruá, Souza (2009) realizou um levantamento de espécies de anfíbios na Serra do Divisor (Reserva Extrativista do Alto Juruá e no Parque Nacional da Serra do Divisor), registrando 126 espécies. Também no Alto Juruá, no município de Porto Walter, um levantamento de répteis Squamata foi conduzido por Avila-Pires et al. (2009), onde foram registradas 50 espécies de lagartos, serpentes e anfisbênios. Ainda no Alto Juruá, um levantamento de anfíbios e répteis foi realizado por Bernarde et al. (2011) na Reserva Extrativista Riozinho da Liberdade, registrando 83 espécies de anfíbios e 79 de répteis. Na floresta do baixo rio Moa, Turci et al. (2009) desenvolveram um estudo sobre a atividade e uso do habitat de duas espécies de serpentes Viperidae (Bothriopsis bilineata e Bothrops atrox), e Bernarde et al. (2010) registrou, pela segunda vez para o Brasil, o anfíbio anuro Hemiphractus helioi.
Em vista da importância do conhecimento da biodiversidade e de sua conservação, tornam-se relevantes estudos sobre os anfíbios e répteis na região do Alto Juruá. O presente trabalho tem como objetivo apresentar o resultado de um levantamento herpetofaunístico realizado na floresta do baixo Rio Moa, em Cruzeiro do Sul, Acre, Brasil.
Material e Métodos
Área de estudo: A floresta do Rio Moa (07° 38' 23,9" S e 72° 47' 43,1" W) localiza-se no município de Cruzeiro do Sul (Acre) (Figura 1), a uma distância de 20 km da cidade pela Rodovia AC 405. O Rio Moa é afluente do Juruá, região localizada no extremo oeste do Brasil (Acre 2006). As principais atividades econômicas da região são: farinha de mandioca, borracha, exploração da madeira, extrativismo (açaí, etc.) e a agricultura (milho, arroz, etc.). A Floresta Ombrófila Aberta predomina na paisagem regional (Silveira et al. 2002), sendo caracterizada pelo dossel normalmente aberto e pela abundância de palmeiras, cipós ou bambus (Veloso et al. 1991).
O clima da região é caracterizado como tropical, quente, úmido com temperatura média anual de 24 °C (Ribeiro 1977), compreendendo o período mais seco entre os meses de junho a setembro. Apresenta uma precipitação pluviométrica anual variando entre 1.140 e 2.700 mm. O índice de umidade relativa do ar está sempre superior a 60%. O clima no Alto Juruá é mais úmido do que na maior parte da Amazônia brasileira, ocorrendo uma estação mais chuvosa e outra menos chuvosa, assemelhando-se mais aos climas superúmidos do piemonte oriental dos Andes (Daly & Silveira 2002).
Atividades de campo: O estudo foi realizado entre fevereiro de 2008 a setembro de 2009. Nos primeiros três meses (fevereiro a abril de 2008) foram feitas visitas preliminares para abertura de trilhas e instalação de armadilhas de interceptação e queda. Durante 17 meses (maio de 2008 a setembro de 2009) aplicaram-se os métodos de amostragem para registro das espécies.
Ambientes amostrados: A herpetofauna foi amostrada em uma área de aproximadamente 256 hectares em áreas de propriedades particulares, incluindo área aberta antropizada adjacente a floresta composta principalmente por pastagens. Na área florestada a amostragem foi realizada em duas trilhas com fisionomias diferentes (Mata de Terra Firme e Mata de Várzea):
Mata de várzea (Figuras 2a, 3 e 4): Floresta Aluvial Densa com árvores emergentes (Acre 2006). Essa tipologia florestal ocorre ao longo dos principais rios e alguns dos seus afluentes (Acre 2006) e, devido sua maior proximidade ao Rio Moa, sofre influência deste, sendo sazonalmente alagada com o enchimento dos lagos. O dossel florestal apresenta árvores com uma altura média em torno de 20 m e nessa área também ocorrem algumas espécies emergentes atingindo altura máxima de 35 m. O dossel é fechado, sendo composto principalmente por indivíduos do gênero Brosimum (Moraceae), Enterolobium (Fabaceae) e Virola (Myristicaceae). Grande parte das árvores de grande porte apresenta raízes tabulares (sapopembas), comuns em espécies que ocorrem em solos instáveis e que sofrem influência das cheias durante um período do ano. O sub-bosque é caracterizado pela grande abundância de Poaceae, Astrocaryum (Arecaceae) e arvoretas e pela pouca abundância de ervas (Heliconiaceae, Marantaceae e Costaceae). A vegetação apresentou-se pouco abundante para representantes da família Arecaceae (Palmeiras), sendo observados alguns indivíduos das espécies Euterpe precatoria, Iriartella stenocarpa e Bactris sp. Em toda sua extensão essa trilha margeia três lagos que invadem a mesma durante a cheia (janeiro a março) por influência do Rio Moa.
Mata de terra firme (Figuras 2b, 5 e 6): Floresta Aberta com Palmeiras de Terra Firme (Acre 2006). Essa tipologia vegetal é geralmente encontrada em áreas próximas a planícies aluviais de rios com grande vazão na época da cheia e se caracteriza por uma floresta de dossel aberto com presença de palmeiras, podendo também ser encontradas áreas com cipós (Acre 2006). As árvores que atingem o dossel e que apresentam os maiores diâmetros são representadas principalmente pelos gêneros Couma (Apocynaceae), Parkia e Vataireopsis (Fabaceae), Virola (Myristicaceae), Pouteria e Manilkara (Sapotaceae) e Vochysiaceae, não sendo comum nessas espécies a presença de raízes tabulares. A altura média do dossel foi de aproximadamente 20 m, com uma altura máxima de 30 m, sendo aberto e comum a presença de palmeiras (Arecaceae): Astrocaryum jauari, Mauritia flexuosa, Euterpe precatoria, Iriartea deltoidea e Iriartella stenocarpa. Abaixo do dossel, na região de sub-bosque, a vegetação apresenta-se com poucos arbustos e a estratificação da floresta é pouco definida, o que é comum em florestas abertas devido à maior entrada de luz sobre a região de sub-bosque (Acre 2006). Nesse ambiente a vegetação se mostrou bastante densa, sendo comum a presença de Bactris sp. (Arecaceae), e em maior abundância ervas representadas pela espécie Calathea sp. (Marantaceae), não sendo rara a ocorrência das famílias Heliconiaceae e Cyperaceae. Quanto à presença de ambientes aquáticos, existe um riacho temporário (cerca de 3 m de largura) que seca sazonalmente e é margeado pela trilha ao longo de sua extensão.
Métodos de amostragem: Para a amostragem da herpetofauna foram utilizados os seguintes métodos: procura limitada por tempo em transectos (diurna e noturna), armadilhas de interceptação e queda, busca ativa (diurna) e a procura de anfíbios anuros em sítios reprodutivos. Além desses, foram também registrados répteis durante encontros ocasionais, especialmente serpentes atropeladas em rodovia que margeia a área de estudo.
Procura limitada por tempo em transectos (ver Campbell & Christman 1982, Martins & Oliveira 1998): Consiste no deslocamento a pé, lentamente através de trilhas dentro de floresta, à procura de anfíbios, lagartos e serpentes que estejam visualmente expostos. O esforço de procura abrangeu todos os microhábitats visualmente acessíveis. Foram percorridas trilhas de 300 a 400 metros com a presença de ambientes aquáticos (igarapés, poças temporárias, etc.) durante um período de quatro horas por noite e trilhas de 150 a 200 metros durante duas horas pela manhã.
Foram realizadas 510 horas, de procura por anfíbios, lagartos e serpentes dentro de mata, sendo 408 horas, durante a noite (18:00‑22:00 horas) e 102 horas durante o dia (manhã) durante 17 meses (30 horas por mês). O maior esforço empregado durante a noite deve-se à maior taxa de encontro de anuros, serpentes (em atividade ou em repouso) e lagartos (em repouso) durante este período (Martins 1993, Martins & Oliveira 1998, Macedo et al. 2008).
Armadilhas de interceptação e queda (ver Fitch 1987 e Heyer et al. 1994), seguindo as recomendações de Cechin & Martins 2000): Neste método foram utilizados quatro baldes plásticos (100 L), enterrados a cada dez metros e ligados por uma cerca de lona de um metro de altura.
Foram construídas dez seqüências de armadilhas com quatro tambores e uma cerca de 46 metros em cada uma delas, sendo cinco com a disposição dos baldes e a cerca em linha reta e outras cinco com um balde central e outros três dispostos radialmente, formando uma armadilha em forma de "Y". Nos tambores foram feitos pequenos furos no fundo para que os mesmos não armazenem água das chuvas, evitando que os animais se afoguem. Além disso, foi colocado dentro de cada tambor, um pedaço de isopor, para que os animais possam permanecer sobre ele, caso ainda assim armazene água. As armadilhas foram construídas dentro de floresta, todas em ambiente de terra firme, distantes no mínimo 50 metros entre si.
As armadilhas permaneceram abertas três dias por mês durante 17 meses e foram monitoradas diariamente, totalizando 51 dias ou 2040 dias-balde.
Busca ativa (Ver Heyer et al. 1994): Consiste em procurar por anfíbios e répteis durante o dia (pela manhã) revirando a serapilheira, troncos e pedras no chão. Foram realizadas duas horas de procura em cada trilha por mês entre outubro de 2008 a setembro de 2009, totalizando 48 horas de amostragem.
Amostragem em sítios reprodutivos (Ver Heyer et al. 1994): Consiste em procurar anfíbios anuros nos ambientes de reprodução através de registros auditivos e/ou visuais. Foram registradas as espécies em atividade de vocalização em cada mês e os ambientes sendo utilizados: rio, igarapé, lago, igapó, poça temporária, etc. Três dias (manhãs e noites) por mês foram utilizados para esse método de amostragem, totalizando 36 dias de amostragem durante outubro de 2008 a setembro de 2009.
Os espécimes-testemunhos coletados (Licença SISBIO-IBAMA nº 12178-1 e 12178-2) foram depositados na Coleção Herpetológica da Universidade Federal do Acre (UFACF), Campus Floresta em Cruzeiro do Sul (Relação em Anexo).
Para a identificação dos espécimes foram utilizadas as chaves taxonômicas e descrições disponíveis para cada grupo na Amazônia: anfíbios (Rodríguez & Duellman 1994, Souza 2009), lagartos (Avila-Pires 1995, Vitt et al. 2008), serpentes (Cunha & Nascimento 1993, Martins & Oliveira 1998, Campbell & Lamar 2004).
Resultados
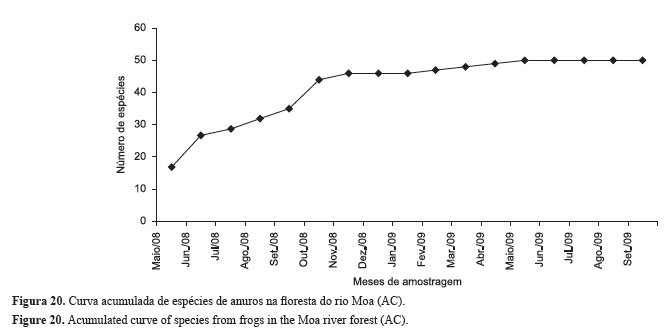
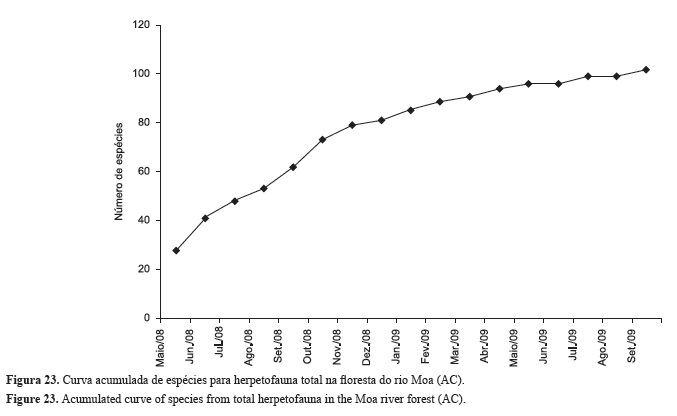
Foram registradas para a floresta do baixo rio Moa (AC) 103 espécies, sendo 50 espécies de anfíbios anuros (Tabela 1) e 53 espécies de répteis (Tabela 2), sendo estes representados por 35 serpentes, 17 lagartos e um crocodiliano (ver fotografias de algumas espécies nas Figuras 7 a 19). A curva do coletor atingiu a assíntota para os anfíbios anuros (Figura 20), mas não para os lagartos, serpentes e a herpetofauna (todos os grupos) (Figuras 21 a 23).
Nas áreas florestadas foi registrada a maioria das espécies de anfíbios anuros (Tabela 1), o mesmo sendo observado para os répteis (Tabela 2), sendo que a maioria destes foi registrada na mata de terra firme. Os métodos de amostragem que registraram mais anfíbios foram a procura limitada por tempo e a amostragem em sítios reprodutivos (Tabela 1), enquanto que para os répteis foram os encontros ocasionais e também a procura limitada por tempo (Tabela 2).
Discussão
A riqueza (50 espécies) de anfíbios anuros registrado em uma área de 256 ha na Floresta do Baixo Rio Moa está acima, considerando o tamanho de área amostrada, do registrado em algumas localidades amazônicas como a Reserva Ducke em Manaus (50 espécies em 6.400 ha de área amostrada; Lima et al. 2006) e Fazenda Jaburi em Espigão do Oeste, Rondônia (47 em 1.000 ha; Bernarde 2007). Em comparações de riqueza entre localidades deve-se levar em conta o tamanho da área. Por exemplo, Souza (2009) registrou 124 espécies de anuros no Parque Nacional da Serra do Divisor (com 843.000 hectares) amostrando em aproximadamente 3.000 ha dessa unidade de conservação e assim abrangendo um número bem maior de diferentes tipologias vegetais e ambientes, o que pode influenciar muito na riqueza. Bernarde et al. (2011) amostraram em área de tamanho próximo a esse estudo (200 ha) na Reserva Extrativista Riozinho da Liberdade (86 km distante da área de estudo) e registraram 79 espécies. A diferença na estrutura da floresta da Resex Riozinho da Liberdade pode ser responsável pela maior riqueza encontrada, sendo uma área caracterizada por árvores de maior diâmetro, a presença de árvores com raízes tabulares, maior disponibilidade de fitotelmatas, bambuzais, igarapés permanentes e conseqüentemente uma maior umidade relativa e disponibilidade para locais de abrigos e reprodução (e.g., Hödl 1990, Schiesari et al. 2003, Summers & McKeon 2004, Whitfield & Pierce 2005). Isso explicaria a ausência de dendrobatídeos na área de estudo, uma vez que seis espécies ocorrem na Resex Riozinho da Liberdade (Bernarde et al. 2011) e também na Serra do Divisor (Souza 2009) e também as poucas espécies de Strabomantidae (11 espécies ocorrem na Resex Riozinho da Liberdade e 18 na Serra do Divisor) e a ausência de Leiuperidade (duas espécies ocorrem no Alto Juruá).
A perereca Dendropsophus rossalleni, apesar de ser conhecida para o Acre e amplamente distribuída na Amazônia (Frost 2010), foi registrada pela primeira vez para a região do Alto Juruá. Foi registrado pela primeira vez para o estado do Acre, o microhilídeo Chiasmocleis hudsoni, que tem como distribuição a região de Cerro Neblina na Venezuela, Guiana, Suriname e Guiana Francesa (Frost 2010) e no Brasil no norte do Pará (Avila-Pires et al. 2010) e Manaus (Lima et al. 2006). Esse registro amplia a área de ocorrência de C. hudsoni em aproximadamente 1.500 km a oeste da Reserva Ducke em Manaus, localidade mais próxima, onde essa espécie é conhecida no Brasil (Lima et al. 2006) e, cerca de 1.200 km da Cerro de La Neblina na Venezuela (Barrio-Amorós & Schargel 2003), que corresponde ao registro mais próximo da área de estudo.
Foram registradas 17 espécies de lagartos para a Floresta do Baixo Rio Moa, uma riqueza inferior à observada em outras localidades amazônicas, que varia nas localidades bem amostradas entre 22 até 40 espécies (Dixon & Soini 1986, Macedo et al. 2008, Vitt et al. 2008, Avila-Pires et al. 2009) e essa baixa riqueza pode ser também assim como para os anfíbios anuros devido a estrutura da floresta. Com exceção de Arthrosaura reticulata que corresponde ao primeiro registro para o Acre, todas demais espécies já tinham sido registradas para a região do Alto Juruá por Avila-Pires et al. (2009) e Bernarde et al. (2011). O registro de A. reticulata amplia para o oeste, a ocorrência dessa espécie em 244 km do Igarapé Nova Empresa (afluente do Rio Juruá) no Amazonas (Avila-Pires 1995), localidade mais próxima com registro desse lagarto.
Pressupõe-se que a riqueza de serpentes (35 espécies) obtida nesse estudo esteja subestimada devido ao fato da curva do coletor não ter atingido a assíntota e os valores maiores registrados para as localidades amazônicas, que variam de 42 a 88 espécies (Dixon & Soini 1986, Martins & Oliveira 1998, Bernarde & Abe 2006, Bernarde et al. 2011). Além disso, para se amostrar bem comunidades de serpentes na Amazônia é necessário estudos com maior esforço amostral e com maior duração de tempo (Bernarde et al. 2011). O registro do viperídeo Bothriopsis bilineata, comum na área de estudo (Turci et al. 2009), evidencia a dificuldade na amostragem de serpentes, pois a mesma não foi registrada na Resex Riozinho da Liberdade (Bernarde et al. 2011), área onde maior esforço amostral de procura foi empregado (720 h de procura visual limitada por tempo). A maioria das espécies de serpentes já havia sido registrada para a região do Alto Juruá por Avila-Pires et al. (2009), Silva et al. (2010) e Bernarde et al. (2011), com exceção de Philodryas olfersii, Pseudoboa coronata e Xenodon rabdocephalus. As espécies Liophis taeniogaster e Micrurus remotus correspondem ao segundo registro para o Acre (ver Bernarde et al. 2011).
Segundo Bernarde et al. (2011), inventários da herpetofauna são importantes no Alto Juruá, pois servem de base para estudos mais aprofundados sobre bio-ecologia e taxonomia, além de contribuir para o conhecimento da diversidade desses animais e também de realizar novos registros zoogeográficos. Do ponto de vista conservacionista, pela riqueza registrada nesses ambientes próximos da área urbana (distante 20 km da cidade de Cruzeiro do Sul) salienta-se a importância da preservação de áreas florestadas particulares abrangendo tanto habitats nas margens de rios sujeitos a alagação periódica como de terra firme, uma vez que existem diferenças na composição herpetofaunística em relação à estrutura das florestas. A preservação das áreas de floresta é fundamental para manutenção da diversidade de anfíbios e répteis na Amazônia, que tem sua riqueza diminuída com a transformação de florestas em pastagens e também com a retirada de madeira e abertura de clareiras (Vitt et al. 1998, Vitt & Caldwell 2001, Bernarde & Abe 2006, Bernarde 2007, Bernarde & Macedo 2008, Macedo et al. 2008).
Agradecimentos
A Antonio Medeiros de Araújo e família por permitirem essa pesquisa no Sítio Morada Nova e no Seringal Recordação. A Flávio Amorim Obermüller pela caracterização da vegetação na área de estudo. Ao CNPq pelo auxílio financeiro para esse estudo (Processo: 479225/2007-9). Ao CNPq pela bolsa de produtividade em pesquisa (501927/2009-3) para Paulo S. Bernarde. As bolsas de mestrado concedidas à Luiz Carlos B. Turci (CNPq), Saymon de Albuquerque (Capes) e Daniele B. Miranda (Capes). Ao IBAMA (SISBIO) pela licença concedida (nº 12178-1 e 12178-2).
Recebido em 18/10/2011
Versão reformulada recebida em 04/08/2012
Publicado em 18/02/2013
Anexo
Relação do material colecionado.
AMPHIBIA: Aromobatidae: Allobates sp.1 (UFACF 1068, 1069, 1070, 1071, 1072, 1088, 1089, 1146, 1147, 1148, 1149, 1176, 1179, 1194, 1226, 1240, 1264, 2412, 2416, 2417, 2418, 2419, 2420, 2421, 2422, 2428, 2443, 2444, 2445, 2446, 2510, 2511, 2512, 2513, 2532, 2533, 2534, 2539, 2540, 2541, 2553, 2554, 2556, 2570, 2571, 2572, 2573, 2617, 2622), Allobates sp. (UFACF 1133, 1314, 1817, 2626). Bufonidae: Amazophrynella minuta (UFACF 1096, 1193, 1196, 1224, 1256, 2423, 2538, 2555, 2576), Rhaebo guttatus (UFACF 1117, 1120, 1844), Rhinella castaneotica (UFACF 1067, 1095, 2500, 2427, 2503), Rhinella margaritifera (UFACF 1046, 1079, 1113, 1115, 1118, 1124, 1125, 1181, 1195, 1221, 1231, 1241, 1242, 1262, 1266, 1270, 1272, 1290, 1291, 1293, 1299, 1300, 1318, 1320, 1321, 1322, 1843, 1845, 2409, 2410, 2413, 2414, 2425, 2437, 2504, 2505, 2506, 2508, 2519, 2520, 2521, 2522, 2523, 2524, 2525, 2526, 2527, 2528, 2529, 2530, 2557, 2558, 2560, 2561, 2562, 2563, 2564, 2565, 2566, 2567, 2568, 2569, 2574, 2575, 2581, 2601, 2602, 2603). Rhinella marina (UFACF 1121). Hemiphractidae: Hemiphractus helioi (UFACF 1191, 1257). Hylidae: Dendropsophus leucophyllatus (UFACF 1129), Dendropsophus microcephalus (UFACF 1136, 1137, 2514), Dendropsophus parviceps (UFACF 1074, 1090, 1258, 1295, 1296, 1819, 1820, 1821, 1846, 1854, 2404), Dendropsophus rossalleni (UFACF 1119, 1130, 1131, 2629), Dendropsophus sarayacuensis (UFACF 1190), Dendropsophus triangulum (UFACF 1134), Hypsiboas calcaratus (UFACF 1848), Hypsiboas cinereascens (UFACF 1138), Hypsiboas geographicus (UFACF 1184, 1185), Hypsiboas lanciformis (UFACF 1186, 1313), Hypsiboas punctatus (UFACF 1276, 1818, 1823, 2381), Osteocephalus buckleyi (UFACF 2604), Osteocephalus leprieurii (UFACF 1123, 2405, 2624), Osteocephalus taurinus (UFACF 1192, 1289, 1312, 2627, 2628), Scarthyla goinorum (UFACF 1301, 2621), Scinax cruentommus (UFACF 1093, 1259, 1302, 1306, 1311, 2436), Scinax funereus (UFACF 1091, 1277, 1278, 1286, 1303, 1307, 2619), Scinax garbei (UFACF 1073, 1092, 1127, 1128, 1135, 1182, 1328, 1849, 1855), Sphaenorhynchus dorisae (UFACF 1126, 1197), Sphaenorhynchus lacteus (UFACF 1275). Leptodactylidae: Leptodactylus andreae (UFACF 1822, 2449, 2550, 2605, 2614, 2618, 2631), Leptodactylus chaquensis (UFACF 1116, 1187), Leptodactylus hylaedactylus (UFACF 2407, 2542, 2578, 2630), Leptodactylus lineatus (UFACF 1078, 1114, 1159, 1220, 1223, 1839, 2559, 2600), Leptodactylus mystaceus (UFACF 1048, 1076, 1077, 1109, 1110, 1139, 1140, 1141, 1222, 1229, 1235, 1268, 1279, 1319, 1323, 1324, 1840, 1842, 2509, 2615, 2616), Leptodactylus petersii (UFACF 1047, 1132, 1183, 1233, 1250, 1271, 1273, 1274, 1292, 1297, 1298, 2408, 2411, 2442, 2447, 2501, 2502, 2507), Leptodactylus rhodomystax (UFACF 1111, 1112, 1263, 1841, 2439). Microhylidae: Chiasmocleis bassleri (UFACF 1051, 1052, 1053, 1082, 1142, 1143, 1144, 1145, 1244, 1246, 1249, 1255, 1261, 1265, 1267, 1269, 1305, 1317, 2424, 2426, 2438, 2448, 2531, 2580), Chiasmocleis hudsoni (UFACF 1054, 1055, 1056, 1057, 1058, 1059, 1060, 1061, 1062, 1063, 1064, 1065, 1066, 1083, 1084, 1085, 1086, 1087, 1151, 1152, 1153, 1154, 1155, 1156, 1157, 1158, 1160, 1161, 1162, 1163, 1164, 1165, 1177, 1178, 1230, 1239, 1245, 1253, 1254, 1260, 1304, 2440, 2441, 2450, 2535, 2536, 2537, 2543, 2544, 2545, 2546, 2547, 2548, 2549, 2551, 2552, 2579), Chiasmocleis ventrimaculata (UFACF 1049, 1050, 1080, 1081, 1150, 1225, 1227, 1228, 1234, 1236, 1237, 1238, 1243, 1247, 1248, 1251, 1252, 2406, 2415). Ranidae: Lithobates palmipes (UFACF 1824). Strabomantiade: Oreobates quixensis (UFACF 1180), Pristimantis conspicillatus (UFACF 1122, 1188, 1189, 1294, 1308, 1309, 1310, 1325, 1326, 1327, 1329, 1330, 1847, 1850, 1851, 1852, 1853, 1856, 1857, 1858, 1859, 1860, 2401, 2402, 2403, 2429, 2430, 2431, 2432, 2433, 2434, 2435, 2515, 2516, 2517, 2518, 2577, 2606, 2607, 2608, 2609, 2610, 2611, 2612, 2613, 2620), Pristimantis ockendeni (UFACF 1075, 1198, 1199, 2625).
REPTILIA: Iguanidae: Iguana iguana (UFACF 1210); Polychrotidae: Anolis fuscoauratus (UFACF 974, 2463, 1799, 2459, 2461, 2462, 1166, 935, 2460, 1167, 2457, 2458, 941, 1796, 1797, 1864, 1283, 1215, 1284, 1217, 1282, 1216, 1104, 2479, 2475, 2478, 1219, 944, 1103, 2476, 2585, 2592, 2588, 2590); Anolis ortonii (UFACF 2474); Anolis trachyderma (UFACF 1863, 1867, 1861, 2377, 945, 2469,1202, 2468, 1203, 1204, 1213, 1792, 2477, 2480, 2473, 2595); Anolis transversalis (UFACF 968, 967, 959, 1205, 942, 1201, 1868, 2470, 2584, 2590); Tropiduridae: Plica umbra (UFACF 1869, 973, 962, 963, 1865, 2464, 2586, 2587); Sphaerodactylidae: Gonatodes humeralis (UFACF 2456, 1285, 2467, 2465, 2466, 1866, 2591, 2596, 2597, 2598); Teiidae: Kentropyx pelviceps (UFACF 1105, 1106, 1862, 1789, 1171, 1862, 2378,1960, 1200, 1105, 1170, 2378); Gymnophtalmidae: Arthrosaura reticulata (UFACF 929); Cercosaura ocellata (UFACF 2379, 1211, 2455); Iphisa elegans (UFACF 924, 977, 1173, 953, 978, 961); Ptychoglossus brevifrontalis (UFACF 954, 922, 975, 2454, 2472, 1212, 2453, 936, 2594); Sincidae: Mabuya nigropunctata (UFACF 1174, 949, 971, 2593); Colubridae: Chironius scurrulus (UFACF 972); Dendrophidion dendrophis (UFACF 1206, 1168); Spilotes pullatus (UFACF 1218, 1332); Tantilla melanocephala (UFACF 2583); Dipsadidae: Atractus latifrons (UFACF 931, 932); Clelia clelia (UFACF 1763); Dipsas ctesbyi (UFACF 1208, 1780); Dipsas indica (UFACF 1100, 1101); Drepanoide anomalus (UFACF 969, 980); Helicops angulatus (UFACF 1794); Helicops hagmanni (UFACF 1108); Leptodeira annulata (UFACF 964); Liophis breviceps (UFACF 1806); Liophis reginae (UFACF 1795, 1169); Oxyrhopus melanogenys (UFACF 940, 950); Philodryas argentea (UFACF 976, 1102, 1208); Pseudoboa coronata (UFACF 1784); Taeniophallus brevirostris (UFACF 979); Xenodon rhabdocephalus (UFACF 2582); Elapidae: Micrurus remotus (UFACF 955); Micrurus lemnisctaus (UFACF 2599);. Viperidae: Bothrops atrox (UFACF 1097, 1099, 1098, 1175); Bothriopsis bilineata (UFACF 982, 1785).
- ACRE. Secretaria Estadual do Meio Ambiente. 2006. Programa Estadual de Zoneamento Ecológico- Econômico do Estado do Acre Fase II – Escala 1:250.000. Rio Branco, SEMA, 356p.
- AVILA-PIRES, T.C.S. 1995. Lizards of brazilian Amazonian (Reptilia: Squamata). Zool. Verh. Leiden 299:1-706.
- AVILA-PIRES, T.C.S., HOOGMOED, M.S. & ROCHA, W.A. 2010. Notes on the Vertebrates of northern Pará, Brazil: a forgotten part of the Guianan Region, I. Herpetofauna. Bol. Mus. Para. Emílio Goeldi Ciênc. Nat. 5(1):13-112.
- AVILA-PIRES, T.C.S., HOOGMOED, M.S. & VITT, L.J. 2007. Herpetofauna da Amazônia. In Herpetologia no Brasil II (L.B. Nascimento & M.E. Oliveira, eds.). Sociedade Brasileira de Herpetologia, Belo Horizonte, p.13-43.
- AVILA-PIRES, T.C.S., VITT, L.J., SARTORIUS, S.S. & ZANI, P.A. 2009. Squamata (Reptilia) from four sites in southern Amazonia, with a biogeographic analysis of Amazonian lizards. Bol. Mus. Para. Emílio Goeldi Ciênc. Nat. 4(2):99-118.
- BARRIO-AMORÓS, C.L. & SCHARGEL, W. 2003. Chiasmocleis hudsoni Geographic distribution. Herpetol. Rev. 34(4):380.
- BERNARDE, P.S. 2007. Ambientes e temporada de vocalização da anurofauna no Município de Espigão do Oeste, Rondônia, Sudoeste da Amazônia - Brasil (Amphibia: Anura). Biota Neotrop. 7(2): http://www.biotaneotropica.org.br/v7n2/pt/abstract?article+bn01507022007 (último acesso em 10/10/2011).
- BERNARDE, P.S. & ABE, A.S. 2006. A snake community at Espigão do Oeste, Rondônia, Southwestern Amazon, Brazil. South Am. J. Herpetol. 1(2):102-113. http://dx.doi.org/10.2994/1808-9798(2006)1[102:ASCAED]2.0.CO;2
- BERNARDE, P.S. & MACEDO, L.C. 2008. Impacto do desmatamento e formação de pastagens sobre a anurofauna de serapilheira em Rondônia. Iheringia 98(4):454-459. http://dx.doi.org/10.1590/S0073-47212008000400006
- BERNARDE, P. S.; MACHADO, R. A. & TURCI, L. C. B. 2011. Herpetofauna da área do Igarapé Esperança na Reserva Extrativista Riozinho da Liberdade, Acre Brasil. Biota Neotrop. 11(3): http://www.biotaneotropica.org.br/v11n3/pt/abstract?article+bn02111032011
- BERNARDE, P.S., MIRANDA, D.B., ALBUQUERQUE, S. & TURCI, L.C.B. 2010. Amphibia, Anura, Hemiphractidae, Hemiphractus helioi Sheil and Mendelson, 2001: distribution extension in the state of Acre and second record for Brazil.Check List (4):491-492.
- BÉRNILS, R.S. & COSTA, H.C. 2011. Brazilian reptiles List of species. Sociedade Brasileira de Herpetologia. http://www.sbherpetologia.org.br/ (último acesso em 10/10/2011).
- CAMPBELL, H.W. & CHRISTMAN, S.P. 1982. Field techniques for herpetofaunal community analysis, In Herpetological communities: a Symposium of the Society for the Study of Amphibians and Reptiles and the Herpetologis's League (N.J. Scott Junior, ed.). U.S. Fish Wildlife Service, Washington, p.193-200.
- CAMPBELL, J.A. & LAMAR, W.W. 2004. The venomous reptiles of Latin América. Cornell Univ. Press, Ithaca, 425p.
- CARAMASCHI, U. 2010. Notes on the taxonomic status of Elachistocleis ovalis (Schneider, 1799) and description of five new species of Elachistocleis Parker, 1927 (Amphibia, Anura, Microhylidae). Bol. Mus. Nac., Zool. 527:1-30.
- CECHIN, S.Z. & MARTINS, M. 2000. Eficiência de armadilhas de queda (pitfall traps) em amostragem de anfíbios e répteis no Brasil. Rev. Bras. Zool. 17:729-740. http://dx.doi.org/10.1590/S0101-81752000000300017
- CUNHA, O.R. & NASCIMENTO, F.P. 1993. Ofídios da Amazônia: as cobras da região Leste do Pará. Bol. Mus. Para. Emílio Goeldi., Sér. Zool. 9(1):1-191.
- DALY, D. C. & SILVEIRA, M. 2002. Aspectos florísticos da Bacia do Alto Juruá: história botânica, peculiaridades, afinidades e importância para a conservação. In Enciclopédia da Floresta: O Alto Juruá: Práticas e Conhecimentos das Populações (M.C. Cunha & M.B. Almeida, orgs.). Companhia das Letras, São Paulo, p.53-63.
- DIXON, J.R. & SOINI, P. 1986. The reptiles of the upper Amazon basin, Iquitos region, Peru. 2. ed. Milwaukee Public Museum, Milwaukee.
- FITCH, H.S. 1987. Collecting and life-history techniques. In Snakes, Ecology and evolutionary biology (R.A. Seigel, J.T. Collins & S.S. Novak, eds.). MacMillan Publishing Company, New York, p.143-164.
- FROST, D.R. 2010. Amphibian species of the world: an online reference. version 5.5. American Museum of Natural History, New York. http://research.amnh.org/vz/herpetology/amphibia/ (último acesso em 10/10/2011).
- HEYER, R.H., DONNELLY, M.A., McDIARMID, R.W., HAYEK, L.C. & FOSTER, M.S. 1994. Measuring and monitoring biological diversity: Standard methods for amphibians. Smithsonian Institution Press, Washington, p.364.
- HÖDL, W. 1990. Reproductive diversity in Amazonian lowland frogs. Fortschr. Zool. 38:41-60.
- LIMA, A.P., MAGNUSSON, W.E., MENIN, M., ERDTMANN, L.K., RODRIGUES, D.J., KELLER, C. & HÖDL, W. 2006. Guia de sapos da Reserva Adolph Ducke Amazônia Central. Editora Attema, INPA, Manaus, p.168. PMid:17225441.
- MACEDO, L.C., BERNARDE, P.S. & ABE, A.S. 2008. Lagartos (Squamata:Lacertilia) em áreas de floresta e de pastagem em Espigão do Oeste, Rondônia, sudoeste da Amazônia, Brasil. Biota Neotrop. 8(1): http://www.biotaneotropica.org.br/v8n1/pt/fullpaper?bn01108012008 (último acesso em 10/10/2011).
- MARTINS, M. 1993. Why do snakes sleep on the vegetation in Central Amazonia? Herpetol. Rev. 24:83-84.
- MARTINS, M. & OLIVEIRA, M. E. 1998. Natural history of snakes in forests of the Manaus region, Central Amazonia, Brazil. Herpetol. Nat. Hist. 6(2):78-150.
- PELOSO, P.L.V., PELLEGRINO, K.C.M., RODRIGUES, M.T. & AVILA-PIRES, T.C.S. 2011. Description and phylogenetic relationships of a new genus and species of lizard (Squamata, Gymnophthalmidae) from the Amazonian rainforest of Northern Brazil. Am. Mus. Novit. 3713:1-24. http://dx.doi.org/10.1206/3713.2
- RIBEIRO, A.G. 1977. O Clima do Estado do Acre. Bol. Geogr. 35:112-141.
- RODRÍGUEZ, L.O. & DUELLMAN, W.E. 1994. Guide to the Frogs of the Iquitos Region, Amazonian Peru. Lawrence, Kansas. Asociación de Ecologia y Conservación, Amazon Center for Environmental Education and Research, Natural History Museum, The University of Kansas, 80p.
- SEGALLA, M.V., CARAMASCHI, U., CRUZ, C.A.G., GARCIA, P.C.A., GRANT, T., HADDAD, C.F.B & LANGONE, J. 2012. Brazilian amphibians - List of species. Sociedade Brasileira de Herpetologia. http://www.sbherpetologia.org.br (último acesso em 04/08/2012).
- SCHIESARI, L., GORDO, M. & HÖDL, W. 2003. Treeholes as calling, breeding, and development sites for the Amazonian canopy frog, Phrynohyas resinifictrix (Hylidae). Copeia 2003(2):263-272. http://dx.doi.org/10.1643/0045-8511(2003)003[0263:TACBAD]2.0.CO;2
- SILVA, M.V., SOUZA, M.B. & BERNARDE, P.S. 2010. Riqueza e dieta de serpentes do Estado do Acre, Brasil. Rev. Bras. Zoocienc. 12(2):55-66.
- SILVEIRA, M., TOREZAN, J.M.D. & DALY, D.C. 2002. Vegetação e diversidade arbórea da região do Alto Juruá. In Enciclopédia da Floresta. O Alto Juruá: Práticas e Conhecimentos das Populações (M.C. Cunha & M.B. Almeida, orgs.). Companhia das Letras, São Paulo, p.65-75.
- SIMÕES, P.I., KAEFER, I.L. & LIMA, A.P. 2011. The first record of the rare microhylid Altigius alios Wild, 1995 in Brazil. Herpetol. Notes 4:141-142.
- SOUZA, M.B. 2009. Anfíbios: Reserva Extrativista do Alto Juruá e Parque Nacional da Serra do Divisor, Acre. IFCH, Campinas, p.77.
- SUMMERS, K. & McKEON, C.S. 2004. The evolutionary ecology of phytotelmata use in Neotropical poison frogs. In Ecology and evolution of phytotelm-breeding anurans (R.M. Lehtinen, ed.). Misc. Publ. Mus. Zool., Univ. Mich. 193, Michigan, 55-73.
- TURCI, L.C.B., ALBUQUERQUE, S., BERNARDE, P.S. & MIRANDA, D.B. 2009. Uso do hábitat, atividade e comportamento de Bothriopsis bilineatus e de Bothrops atrox (Serpentes: Viperidae) na floresta do Rio Moa, Acre, Brasil. Biota Neotrop. 9(3): 197-206. http://www.biotaneotropica.org.br/v9n3/pt/abstract?article+bn03909032009 (último acesso em 10/10/2011).
- VELOSO, H.P., RANGEL-FILHO, A.L.R. & LIMA, J.C.A. 1991. Classificação da vegetação brasileira, adaptada a um sistema universal. Instituto Brasileiro de Geografia e Estatística-IBGE, Rio de Janeiro.
- VITT, L. J. & CALDWELL, J. P. 2001. Effects of logging on reptiles and amphibians of tropical forests. In The Cutting Edge Conserving Wildlife in Managed Tropical Forests (R. Fimbel, A. Grajal & J. Robinson, eds.). Columbia University Press, New York, p.239-259.
- VITT, L.J., AVILA-PIRES, T.C.S., CALDWELL, J.P. & OLIVEIRA, V.R.L. 1998. The impact of individual tree harvesting on thermal environments of lizards in amazonian rain forest. Conserv. Biol. 12:654‑664. http://dx.doi.org/10.1046/j.1523-1739.1998.96407.x
- VITT, L.J., MAGNUSSON, W.E., AVILA-PIRES, T.C. & LIMA, A.P. 2008. Guia de lagartos da Reserva Adolpho Ducke: Amazônia Central. Editora Attema, INPA, Manaus, p.176.
- WHITFIELD, S.M. & PIERCE, M.S.F. 2005. Tree buttress microhabitat use by a Neotropical leaf-litter herpetofauna. J. Herpetol. 39(2):192-198. http://dx.doi.org/10.1670/219-04A
Datas de Publicação
-
Publicação nesta coleção
07 Maio 2013 -
Data do Fascículo
Mar 2013
Histórico
-
Recebido
18 Out 2011 -
Aceito
18 Fev 2013 -
Revisado
04 Ago 2012