Resumos
A amebíase é a segunda causa de morte entre as doenças parasitárias no mundo. Seu agente etiológico é o protozoário Entamoeba histolytica, que através da secreção de proteinases é capazes de destruir o tecido hospedeiro, matando as células-alvo por contato e fagocitando eritrócitos. Dessa forma, os trofozoítos invadem a mucosa intestinal, provocando a colite amebiana. Em alguns casos atravessam a mucosa e, através da circulação porta, chegam ao fígado, onde causam necrose constituída por poucos trofozoítos rodeados de hepatócitos mortos e debris celulares liquefeitos. Essa invasão está diretamente relacionada com a capacidade de síntese e a secreção de moléculas responsáveis pela virulência dos trofozoítos, como os amebaporos, as lectinas e as cisteína proteinases. O diagnóstico da infecção causada pelo patógeno é rotineiramente realizado através da microscopia óptica de amostras frescas ou espécimes fixados. Entretanto essa metodologia apresenta limitações, sendo incapaz de distinguir as espécies pertencentes ao complexo E. histolytica/E. dispar. A pesquisa de coproantígenos e a reação em cadeia da polimerase (PCR) têm sido utilizadas para diferenciação desses protozoários em amostras fecais. No entanto, estudos mais aprofundados são necessários para maior compreensão sobre a relação parasita/hospedeiro, a proteômica e a genômica do protozoário, o desenvolvimento de vacinas e a real prevalência dessa infecção no Brasil e no mundo.
Entamoeba histolytica; Amebíase; Fisiopatogenia
Amebiasis is the second cause of death among parasitary diseases in the world. Its etiologic agent is the protozoan Entamoeba histolytica, which destroys the host tissue by means of the secretion of proteinases, kills the target-cells by contact and phagocytizes erythrocytes. Accordingly, the trophozoites invade the intestinal mucosa, what causes amoebaean colitis. In some cases, they pass through the mucosa and reach the liver through the portal system, where they cause necrosis, which is composed of a few trophozoites surrounded by dead hepatocytes and liquefied cellular debris. This invasion is directly related to the synthesis capacity and secretion of molecules responsible for the virulence of trophozoites such as amoebapores, lectins and cysteine proteinases. The diagnosis of infection caused by this pathogen is routinely performed through optical microscopy of fresh samples or fixed specimens. However this methodology presents limitations insofar as it is unable to distinguish the specimens belonging to the complex E. histolytica /E. dispar. The research on coproantigens and the polymerase chain reaction (PCR) method have been used to differentiate these protozoa in fecal samples. However further studies are required for a better understanding of the host-parasite relationship, the proteomics and genomics of the protozoa, the development of vaccines and the real prevalence of this infection in Brazil and worldwide.
Entamoeba histolytica; Amebiasis; Physiopathogeny
ARTIGO DE REVISÃO REVIEW ARTICLE
Mecanismos fisiopatogênicos e diagnóstico laboratorial da infecção causada pela Entamoeba histolytica
Physiopathogenic mechanisms and laboratorial diagnosis of Entamoeba histolytica infection
Fred Luciano Neves SantosI; Neci Matos SoaresII
IMestre em Patologia Experimental; professor de Parasitologia nas Faculdades Integradas da Bahia (FIB)
IIDoutora em Biologia Celular e Molecular; professora-adjunta do Departamento de Análises Clínicas da Faculdade de Farmácia da Universidade Federal da Bahia (UFBA)
Endereço para correspondência : Endereço para correspondência Fred Luciano Neves Santos Laboratório de Imunoparasitologia Faculdade de Farmácia da UFBA Av. Barão de Geremoabo, s/nº Campus Universitário de Ondina CEP: 41170-280 Salvador-BA e-mail: flucianon@hotmail.com
RESUMO
A amebíase é a segunda causa de morte entre as doenças parasitárias no mundo. Seu agente etiológico é o protozoário Entamoeba histolytica, que através da secreção de proteinases é capazes de destruir o tecido hospedeiro, matando as células-alvo por contato e fagocitando eritrócitos. Dessa forma, os trofozoítos invadem a mucosa intestinal, provocando a colite amebiana. Em alguns casos atravessam a mucosa e, através da circulação porta, chegam ao fígado, onde causam necrose constituída por poucos trofozoítos rodeados de hepatócitos mortos e debris celulares liquefeitos. Essa invasão está diretamente relacionada com a capacidade de síntese e a secreção de moléculas responsáveis pela virulência dos trofozoítos, como os amebaporos, as lectinas e as cisteína proteinases. O diagnóstico da infecção causada pelo patógeno é rotineiramente realizado através da microscopia óptica de amostras frescas ou espécimes fixados. Entretanto essa metodologia apresenta limitações, sendo incapaz de distinguir as espécies pertencentes ao complexo E. histolytica/E. dispar. A pesquisa de coproantígenos e a reação em cadeia da polimerase (PCR) têm sido utilizadas para diferenciação desses protozoários em amostras fecais. No entanto, estudos mais aprofundados são necessários para maior compreensão sobre a relação parasita/hospedeiro, a proteômica e a genômica do protozoário, o desenvolvimento de vacinas e a real prevalência dessa infecção no Brasil e no mundo.
Unitermos: Entamoeba histolytica, Amebíase, Fisiopatogenia
ABSTRACT
Amebiasis is the second cause of death among parasitary diseases in the world. Its etiologic agent is the protozoan Entamoeba histolytica, which destroys the host tissue by means of the secretion of proteinases, kills the target-cells by contact and phagocytizes erythrocytes. Accordingly, the trophozoites invade the intestinal mucosa, what causes amoebaean colitis. In some cases, they pass through the mucosa and reach the liver through the portal system, where they cause necrosis, which is composed of a few trophozoites surrounded by dead hepatocytes and liquefied cellular debris. This invasion is directly related to the synthesis capacity and secretion of molecules responsible for the virulence of trophozoites such as amoebapores, lectins and cysteine proteinases. The diagnosis of infection caused by this pathogen is routinely performed through optical microscopy of fresh samples or fixed specimens. However this methodology presents limitations insofar as it is unable to distinguish the specimens belonging to the complex E. histolytica /E. dispar. The research on coproantigens and the polymerase chain reaction (PCR) method have been used to differentiate these protozoa in fecal samples. However further studies are required for a better understanding of the host-parasite relationship, the proteomics and genomics of the protozoa, the development of vaccines and the real prevalence of this infection in Brazil and worldwide.
Key words: Entamoeba histolytica, Amebiasis, Physiopathogeny
Introdução
A amebíase é uma a infecção causada pelo protozoário Entamoeba histolytica, da família Endamoebidae, do filo Sarcomastigophora e classe Sarcodina. Os protozoários desta classe são organismos que se movem e incorporam alimentos por meio de pseudópodes.
A E. histolytica possui distribuição cosmopolita e representa um risco à saúde nos países onde as barreiras sanitárias são inadequadas(84). Estima-se que 500 milhões de indivíduos em todo o mundo estejam infectados pela E. histolytica, havendo 40 mil a 100 mil óbitos anuais, o que torna essa infecção a segunda causa de morte entre as doenças parasitárias, perdendo somente para a malária(114). No Brasil, a amebíase também constitui um sério problema de saúde pública, apresentando maior prevalência em populações de nível socioeconômico mais baixo e condições precárias de saneamento básico, resultando em altos índices de morbidade(28, 95). Em vários estados brasileiros tem sido demonstrada elevada prevalência da E. histolytica. Em Manaus (Amazonas), a infecção atinge 6,8% da população(11); em Fortaleza (Ceará), 14,9% da população de baixa renda(17), e, em Belém (Pará), 29,5% dos indivíduos residentes na região metropolitana(100). No estado de Pernambuco, na cidade de Belo Horizonte (Minas Gerais) e em Salvador (Bahia) a ocorrência da E. histolytica é rara, tendo sido identificada somente a E. dispar, organismo não-patogênico morfologicamente semelhante à E. histolytica(70, 96) (Figura 1). Nas demais regiões brasileiras não há estudos que retratem a prevalência da E. histolytica.
Após a infecção do hospedeiro via ingestão de cistos, os trofozoítos colonizam o lúmen intestinal, onde se multiplicam e vivem como comensais, usando bactérias e restos celulares como fonte de energia. Entretanto, quando os trofozoítos penetram na mucosa intestinal, provocam uma reação inflamatória que pode levar à destruição do tecido envolvido(84). Muitos estudos procuram identificar e caracterizar as bases moleculares da reação citolítica, que é iniciada a partir do contato íntimo entre a célula-alvo e o parasito. Após contato estabelecido pelo reconhecimento de moléculas de galactose (Gal) ou N-acetil-D-galactosamina (GalNAc) presentes na superfície das células-alvo por lectinas expressas pelo parasito, dispara-se uma cascata de sinalização intracelular, ocorrendo liberação de moléculas protéicas conhecidas como amebaporos(33). Essas moléculas inserem-se na membrana da célula-alvo formando canais iônicos(89, 123). Além disso, o parasito libera cisteína-proteinases, que são responsáveis pela degradação da matriz extracelular, facilitando, assim, a invasão tecidual(46). Em poucos minutos a célula torna-se intumescida, com a formação de uma bolha citoplasmática indicando a perda da permeabilidade da membrana plasmática; e, como conseqüência, ocorre a morte celular(12, 82).
A Entamoeba dispar é capaz de causar lesões intestinais focais em animais de laboratório, como gatos, gerbilos e cobaias(61). No homem vive como um comensal estável e avirulento, produzindo um estado de portador assintomático e sendo aproximadamente 10 vezes mais prevalente do que a E. histolytica(6, 85). Outras espécies de ameba, como, por exemplo, a Entamoeba hartmanni e a Entamoeba coli, são capazes de infectar o homem e não produzir ações patogênicas.
O diagnóstico laboratorial do complexo E. histolytica/E. dispar é realizado rotineiramente pela demonstração microscópica de cistos e/ou trofozoítos no sedimento fecal. No entanto, para a identificação espécie-específica, é necessária a realização de exames que se baseiem na detecção de coproantígenos e/ou da pesquisa de DNA por reação em cadeia da polimerase (PCR), utilizando sondas espécie-específicas.
Moléculas de virulência
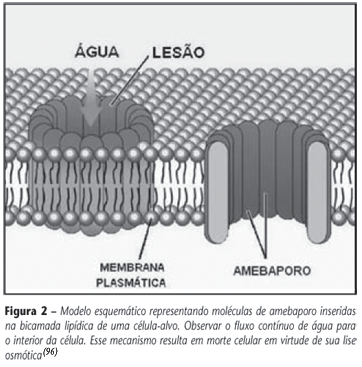
A patogenia da amebíase está diretamente relacionada com a capacidade de síntese e secreção de moléculas responsáveis pela virulência dos trofozoítos. A família dos amebaporos é composta pelas isoformas A, B e C, que foram isoladas como peptídeos biologicamente ativos a partir do citoplasma granular de cepas patogênicas, na proporção de 35:10:1, respectivamente(54). Essas moléculas são capazes de penetrar na superfície hidrofóbica da membrana plasmática das células-alvo enquanto, simultaneamente, expõem o lado polar da cadeia para a água graç as ao seu arranjo de α-hélices anfipáticas. Os monômeros tendem a oligomerizar-se como moléculas de alta massa molecular, num processo dirigido por interação peptídeo-peptídeo, formando um canal preenchido por água através do qual íons e outras moléculas pequenas passam livremente, resultando em lise osmótica (Figura 2)(53, 69).
Outro grupo de molécula é composto pelas lectinas localizadas na superfície dos trofozoítos, que reconhecem especificamente os oligossacarídeos N- e O-ligados, como a Gal e a GalNAc, presentes na superfície das células-alvo, incluindo neutrófilos e macrófagos, assim como as células colônicas que revestem o epitélio intestinal, principais alvos do efeito citolítico da E. histolytica(22, 83). Após contato entre as moléculas de lectina e glicoconjugados, há uma mudança conformacional da subunidade maior da lectina, disparando uma cascata de transdução de sinal responsável pela citólise da célula-alvo(19, 52). Além dessa função, as lectinas protegem os trofozoítos do ataque do sistema complemento, pois parecem possuir similaridade funcional com a proteína regulatória do complemento, a CD59, a qual se liga às subunidades C8 e C9 do complexo C5b-9(90).
A função da cisteína-proteinase na invasão tecidual é atribuída à sua habilidade em clivar estruturas que compõem a matriz extracelular (colágeno, laminina e fibronectina)(80). Alguns estudos de microscopia eletrônica demonstraram que, após a adesão dos trofozoítos na superfície apical de células polarizadas, ocorre diminuição na resistência do epitélio devido a uma modificação da integridade morfológica da camada lipídica e das proteínas que compõem as junções celulares. Alguns estudos demonstraram o desprendimento das células epiteliais colônicas após contato com os trofozoítos, sugerindo que a degradação da membrana basal seja um importante passo na invasão tecidual(56, 58, 79). Além disso, quando o parasita alcança a corrente circulatória, as moléculas de cisteína-proteinase são capazes de degradar tanto imunoglobulinas da classe A (IgA) humanas presentes nas mucosas como moléculas de IgG por meio de clivagem de sua cadeia pesada(47, 79). Assim, as proteinases não agem somente na degradação das barreiras naturais do hospedeiro como a fibronectina, o colágeno e a laminina, mas também exercem forte influência na imunidade específica pela clivagem de determinados isotipos de imunoglobulinas.
Mecanismos fisiopatogênicos da amebíase
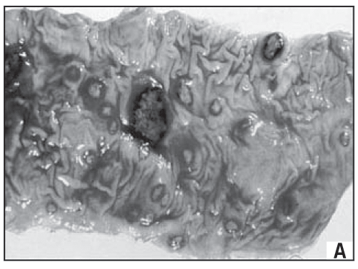
A colite amebiana caracteriza-se pela presença de úlceras discretas, separadas por regiões de mucosa colônica de aparência normal (Figura 3A). O processo de invasão tecidual é iniciado pelo reconhecimento de moléculas do epitélio intestinal pelo parasito. Em seguida, no processo de adesão celular há formação de um espaço intercelular denominado foco de adesão, no qual ocorre a secreção de proteínas necessárias ao processo de invasão tecidual. Além das proteínas mais importantes relacionadas com o processo de invasão, como as cisteína-proteinases e as lectinas específicas, a proteína quinase C exerce importante função, tanto no processo de citólise quanto na adesão trofozoítica à superfície celular, favorecendo a liberação de maior quantidade de cisteína-proteinase no foco de adesão e maior dano à célula-alvo, onde desenvolve uma rápida resposta inflamatória aguda, com presença de leucócitos polimorfonucleares e macrófagos, podendo ocasionar ulcerações profundas em forma de frasco com pescoço estreito e uma base ampla (Figura 3B). À medida que a lesão progride, a superfície mucosa sobrejacente é privada de fluxo sangüíneo, sendo, por fim, necrosada, com perfuração da parede intestinal e infecção sistêmica.
No início da invasão tecidual a imunidade inata do hospedeiro exerce importante papel na resolução da colite amebiana. Enterócitos reconhecem moléculas antigênicas de padrões moleculares associados ao patógeno (PAMPs). Nas amebas, os PAMPs são formados por lectinas específicas, moléculas de serina-proteinase e moléculas ricas em lipofosfoglicanos (LPGs) e lipofosfopeptideoglicanos (LPPGs)(15, 65, 66, 77, 101). Polimorfismos na estrutura dessas moléculas determinam a heterogeneidade no perfil patogênico da E. histolytica, definindo cepas como patogênicas ou não. Assim, a patogenicidade de uma cepa depende da habilidade de reconhecimento pelos toll-like receptors (TLRs) das células epiteliais(20)destes PAMPs. Mudanças estruturais nas moléculas de LPG e LPPG formam novos PAMPs, que podem não ser reconhecidos pelas células da resposta imune e inflamatória.
Após o reconhecimento dos PAMPs pelos TLRs ocorrem ativação intracelular e liberação de citocinas pró-inflamatórias e fatores solúveis, como as interleucinas 1 , 6 e 8 (IL-1, IL-6 e IL-8), o fator de necrose tumoral alfa (TNF-α), o fator estimulador de granulócitos e macrófago (GMCF), entre outras(62). Neutrófilos e monócitos são rapidamente recrutados, ativados em resposta a estes fatores e lisados pelos trofozoítos, ocorrendo então a liberação de mediadores químicos provenientes de seus grânulos citoplasmáticos, resultando em dano tecidual e necrose(98, 103). Por meio da microscopia ótica visualiza-se, no tecido necrosado, um exsudato composto por material protéico amorfo, células vermelhas e faixas de fibrina, formando uma zona profundamente rosada de necrose liquefativa. Também pode ser observado intenso infiltrado neutrofílico com presença de alguns linfócitos e macrófagos e raros eosinófilos. Sharma et al.(99) demonstraram baixos níveis de quimiocinas e de citocinas pró-inflamatórias em resposta à lectina de E. dispar. Segundo Talvani et al.(106), uma resposta imune específica ao parasito regulada pelas quimiocinas e citocinas pode modular a inflamação eliminando o parasito ou contribuindo para agravar a patogenia e a sobrevivência do patógeno.
O papel dos macrófagos na amebíase aguda permanece obscuro. A escassez de macrófagos na lesão ocorre em virtude da secreção do fator de inibição de locomoção monocitária (MLIF) produzido por diversas cepas de E. histolytica independentemente de sua virulência(49). Essa molécula é um pequeno peptídeo amebiano capaz de inibir a quimiotaxia de fagócitos mononucleares, mas não de polimorfonucleares(50). Além disso, o MLIF também é capaz de inibir a síntese de compostos nitrogenados e oxigenados(87, 88). Estudos in vitro demonstraram que os trofozoítos de E. histolytica exercem potente atividade citolítica em leucócitos polimorfonucleares e células mononucleares do sangue periférico(92). No curso da infecção, há uma supressão da função efetora dos macrófagos, a qual é gradualmente recuperada após terapia antiamebiana(71, 93). Macrófagos isolados de abscessos hepáticos são refratários à ativação por IFN-γ e lipopolissacarídeos (LPS) e são, também, defectivos na produção de H2O2, IL-1 e TNF-α, sugerindo uma supressão das funções dos macrófagos no sítio da infecção(24, 116, 117). Entretanto outras populações de macrófagos distantes desse sítio permanecem imunologicamente funcionantes.
Estudos in vitro demonstraram que macrófagos naïve, derivados de medula óssea de camundongos BALB/c, quando expostos às proteínas antigênicas da E. histolytica, aumentam a expressão de RNAm para TNF-α. No entanto não há formação de TNF-α ativo(97). Uma outra hipótese para a anergia dessas células no sítio de infecção está relacionada com a síntese de prostaglandina E2 (PGE2), que possui efeitos pró-inflamatórios, aumentando o edema e a infiltração leucocitária, inibindo a produção de algumas citocinas do tipo Th1 (IL-1, TNF-α e INF-δ) e não o interferindo na produção de citocinas do tipo Th2 (IL-4 e IL-5)(75) . Sendo o INF-δ uma importante citocina para ativação dos macrófagos e conseqüente destruição da E. histolytica, a produção de PGE2 favorece a sobrevivência do parasito, induzindo a um estado de imunossupressão transitória na fase aguda de doença(118). Em modelos animais foi demonstrado que macrófagos derivados de lesões amebianas produzem altos níveis de PGE2(115). Além disso, macrófagos naïve do peritônio e da medula óssea secretam PGE2 após incubação com proteínas de E. histolytica(118). Ademais, pacientes infectados com E. histolytica produzem elevados níveis de IL-10 e fator beta de crescimento (TGF-β) quando em comparação com os pacientes infectados com E. dispar. Essas citocinas exercem atividades imunomoduladoras da infecção, contribuindo para limitar a resposta inflamatória associada à E. histolytica.
Mediadores químicos como histamina, prostaglandinas, leucotrienos, quininas e citocinas pró-inflamatórias induzem alteração intestinal, dificultando a absorção alimentar(13, 14). Mesmo quando não existem danos macro ou microscópicos, há evidências de que a presença de células inflamatórias possa prejudicar o processo de absorção intestinal, levando o hospedeiro a crises diarréicas. A histamina ativa as vias secretórias agindo diretamente nos receptores H1, presentes na superfície dos enterócitos. As bradicininas atuam de modo indireto mediante o estímulo à secreção dos metabólitos do ácido araquidônico, como as prostaglandinas e os leucotrienos de linfócitos e outras células do sistema imune localizadas nas adjacências da lesão. As prostaglandinas E2 e F2 atuam em receptores presentes na membrana basolateral dos enterócitos, resultando na ativação da enzima adenilato-ciclase e, conseqüentemente, aumentando o influxo de eletrólitos para o lúmen intestinal, provocando diarréia. O bloqueio da síntese de prostaglandinas por inibidores da ciclooxigenase (indometacina) restabelece a absorção intestinal, diminuindo ou cessando as crises diarréicas(7).
Ao final da doença, pode ocorrer a formação de tecido granulomatoso, caracterizado pela formação de novos vasos (angiogênese), indicando a cura da lesão. Não se sabe se esse processo de reparo ocorre espontaneamente ou é secundário à quimioterapia antiamebiana. Tratamento adequado, nos casos de amebíase invasiva, cura a lesão sem a formação de tecido de cicatrização. Os mecanismos desse processo de reparo ainda não são complemente entendidos.
Caso os trofozoítos atinjam a circulação sangüínea, anticorpos específicos ligam-se ao parasito. No entanto as amebas possuem a habilidade de concentrar ou agregar os anticorpos em regiões específicas da membrana plasmática, denominadas uróides, estruturas caracterizadas morfologicamente por dobras na membrana plasmática. Esse fato se deve ao transporte ativo realizado pelas moléculas de actina, miosina e proteínas associadas à actina que direcionam os agregados para os uróides. Forças contráteis geradas nessa região propiciam o desprendimento dos uróides da superfície do parasito (Figura 4)(108). Dessa forma, os trofozoítos escapam do mecanismo de citotoxicidade dependente de anticorpo (ADCC).
A depender do perfil genético, imunoenzimático, da capacidade de evasão do sistema complemento e da habilidade em sintetizar enzimas proteolíticas, os trofozoítos podem penetrar em pequenas veias, presentes na submucosa intestinal, e disseminar-se pela circulação portal, atingindo preferencialmente o tecido hepático. Os mecanismos fisiopatogênicos pelos quais os trofozoítos provocam lesões hepáticas e em outros órgãos são semelhantes aos vistos na colite amebiana. A inflamação tecidual e a lise de neutrófilos mediada pelos trofozoítos liberam uma série de mediadores químicos responsáveis pela amplificação da lesão inicial, ocasionando a morte dos hepatócitos. Com a evolução do processo inflamatório, as úlceras focais podem coalescer, desenvolvendo uma lesão hepática extensa, constituída por material espesso, homogêneo, acastanhado e estéril(4, 94).
As lesões hepáticas são usualmente únicas ou solitárias, mais freqüentemente localizadas no lobo direito, continuamente à cápsula hepática. São variáveis em tamanho, ocupando, em alguns casos, mais de 80% de toda a superfície hepática. Esse fato pode ser explicado pelo elevado tamanho do lobo direito, o qual recebe um grande influxo de drenagem venosa advinda do cólon direito, segmento do intestino freqüentemente afetado pela amebíase intestinal(44). As lesões amebianas do lobo esquerdo são menos comuns e múltiplos abscessos podem ocorrer em casos avançados da doença.
Sinas e sintomas
O intervalo que decorre entre a ingestão de cistos e o aparecimento dos sintomas pode variar de alguns dias até anos, de modo que não é possível, na maioria dos casos, definir de maneira precisa o período de incubação. No entanto a maioria dos indivíduos infectados pela E. histolytica não desenvolve sintomas, permanecendo assintomática durante todo o curso da infecção(30, 35, 36, 38, 41). Esse fato é devido à existência de cepas polimórficas, diferindo no grau de patogenicidade, e a fatores associados ao hospedeiro, tornando-o ou não suscetível à infecção. De acordo com Campos-Rodríguez e Jarillo-Luna(20), a resposta imune inata é o fator mais importante no controle da infecção para evitar a invasão tecidual e, conseqüentemente, provocar um estado de portador assintomático, o que não impede a formação de anticorpos específicos contra a E. histolytica.
Um dos sintomas mais freqüentes na amebíase intestinal é a colite amebiana aguda, na qual o indivíduo apresenta intensas dores abdominais e as fezes contêm muito muco e sangue, geralmente permanecendo nesse estado por um ou dois dias. Também podem ocorrer náuseas e vômitos, assim como mal-estar e cefaléia. Em seguida, os indivíduos infectados passam a apresentar múltiplas evacuações mucóides e de pequeno volume, podendo-se observar diarréia aquosa profusa com presença de sangue, dor abdominal, perda de peso, anorexia e febre em 40% dos casos(5, 57). A invasão da mucosa colônica pelos trofozoítos pode levar a hemorragia macroscópica e ser detectada também em crianças sem histórico de diarréia(5, 42, 63). Ocasionalmente a colite amebiana evolui para perfuração da parede intestinal, podendo apresentar íleo paralítico e deslocamento da mucosa, caracterizando-se um quadro de colite fulminante(8, 9, 21, 25, 42, 105). Muitos estudos apontam que a mortalidade pela colite amebiana ultrapassa os 40% dos infectados(8, 25, 105). Pacientes imunossuprimidos e gestantes formam um grupo de risco para o desenvolvimento da doença fulminante. Além dessas situações, alguns autores também destacam o diabetes mellitus (DM) e o uso crônico de álcool como fatores de risco(2, 105).
Geralmente a disenteria amebiana aguda cessa no início da doença, seguindo-se um período de quiescência ou latência, usualmente caracterizado por constipação alternada com diarréia e fezes contendo muito muco e sangue. Esse estado pode persistir durante semanas e meses, e é geralmente denominado colite amebiana subaguda, podendo reativar a fase aguda, com sintomas semelhantes aos iniciais discutidos anteriormente. Essa seqüência de acontecimentos constitui a forma crônica amebiana, que se processa, via de regra, depois de uma fase aguda, ou pode ser crônica desde o começo da infecção. Além disso, aparecem outros sintomas, como emagrecimento, inapetência, astenia, dores abdominais e flatulência(61).
Na amebíase hepática, os principais sintomas consistem em dor ou sensação de peso no hipocôndrio direito e rigidez dos músculos abdominais na região hepática. Cerca de 25% dos pacientes apresentam diarréia, náuseas, vômitos e, por vezes, icterícia. Outros sintomas e sinais característicos são dor localizada à percussão hepática, leucocitose variável, febre baixa e inconstante e perda de peso(102). Em casos graves, o indivíduo infectado pode apresentar necrose do tecido hepático e caquexia, podendo evoluir para o óbito.
Diagnóstico laboratorial
O diagnóstico laboratorial do complexo E. histolytica/E. dispar é realizado rotineiramente pela demonstração microscópica de cistos e/ou trofozoítos no material fecal. Essas espécies apresentam características morfológicas semelhantes, sendo diferenciadas somente por meio de técnicas moleculares específicas. Um diagnóstico preciso é importante tanto para pacientes sintomáticos como para os portadores assintomáticos, pois o parasito pode ser transmitido facilmente pelo contato pessoa-pessoa, especialmente em países subdesenvolvidos, onde as condições de higiene são precárias(95).
A microscopia de preparações fecais coradas pelo lugol para pesquisa de cistos é a ferramenta mais usada no diagnóstico da amebíase. Sua execução é simples, barata e não exige equipamentos sofisticados. No entanto é incapaz de diferenciar as espécies pertencentes ao complexo E. histolytica/E. dispar, tornando o diagnóstico presuntivo e invalidando a sua utilização em estudos epidemiológicos específicos. Nos espécimes fecais a fresco, os trofozoítos são mais freqüentemente observados com sua motilidade linear característica, com projeções hialinas do ectoplasma formando pseudópodes, os quais arrastam o endoplasma e seu núcleo(78). Geralmente observam-se eritrócitos no citoplasma de trofozoítos de E. histolytica. No entanto trofozoítos de E. dispar eventualmente apresentam eritrócitos fagocitados(34). Experimentos in vitro demonstraram que a taxa de eritrofagocitose é significativamente maior nas espécies de E. histolytica do que em qualquer outra espécie de ameba(109). Nos casos de amebíase crônica é comum a ausência de eritrócitos fagocitados, sugerindo que a eritrofagocitose seja indicativa de infecção por cepas invasivas(31). O diagnóstico por meio da pesquisa de trofozoítos ocorre somente em condições disentéricas, e a demora no processamento do material fecal implica a redução da sensibilidade do teste, pois, na maioria das vezes, a viabilidade dos trofozoítos é de aproximadamente 20 minutos após sua eliminação. Ocasionalmente são vistos trofozoítos móveis em amostras fecais mantidas sob refrigeração durante um prazo de até 4 horas, apesar de se desintegrarem rapidamente em amostras não-fixadas(78, 84, 120).
Além de a diferenciação entre as espécies de E. histolytica e E. dispar não poder ser definida pela morfologia dos cistos, outros fatores podem afetar os resultados, como, por exemplo, atraso no processamento do material; analista mal treinado; dificuldade na diferenciação de trofozoítos não-móveis de células epiteliais; uso de coletores contaminados; presença de substâncias interferentes, como antibióticos, laxantes, antiácidos, antidiarréicos ou enemas; número inadequado de amostras fecais analisadas; preservação inapropriada das amostras; e liberação intermitente de cistos e/ou trofozoítos(29, 51, 113).
Os meios de cultura podem ser utilizados para o diagnóstico da amebíase, no entanto são pouco utilizados na rotina laboratorial, uma vez que são de difícil execução, alto custo, baixa sensibilidade (30%) e não diferenciam as espécies do complexo E. histolytica/E. dispar. Os cultivos axênicos desses organismos são de valor para estudos bioquímicos e imunológicos, produção de antígenos e anticorpos, estudos diferenciais entre cepas patogênicas e não-patogênicas (zimodemos), triagem de novos medicamentos in vitro, infecção de animais de laboratório como modelo experimental em estudos de patogenia e para o conhecimento da organização do parasito em nível ultra-estrutural.
A detecção de anticorpos é uma ferramenta que auxilia no diagnóstico da infecção causada pela E. histolytica. No entanto não distingue infecções recentes de anteriores devido à persistência de anticorpos circulantes(18, 30). Em locais onde a infecção é incomum, a pesquisa de anticorpos revela resultados mais fidedignos(68, 112, 119). Anticorpos séricos anti-E. histolytica podem ser detectados em 75% a 80% dos pacientes com infecção sintomática e em até 100% dos casos de abscessos hepáticos(124). Os métodos mais utilizados para esta finalidade incluem: ensaio imunossorvente ligado à enzima (ELISA)(16, 72), hemaglutinação indireta(39, 73), contra-imunoeletroforese(10, 86), testes de difusão em gel(40), fixação do complemento(48, 59), métodos de imunofluorescência indireta(104, 107) e aglutinação em partículas de látex(23, 60). Os testes de ELISA disponíveis no mercado pesquisam a presença de anticorpos IgM ou IgG antilectinas(30, 37). No entanto, apesar de raros, resultados falso-positivos podem ocorrer em virtude da colonização do lúmen intestinal pela E. dispar, que também é capaz de estimular a secreção de anticorpos antilectinas(41, 43).
Para a detecção de antígenos, o teste de ELISA possui vantagens quando em comparação com outras metodologias rotineiramente usadas no diagnóstico da amebíase. Alguns kits são capazes de diferenciar a infecção causada pela E. histolytica da colonização intestinal provocada pela E. dispar, podem ser utilizados para diagnóstico de várias amostras em uma única placa e possuem sensibilidade e especificidade elevadas(32). Entretanto essa metodologia é limitada para pesquisa de antígenos em amostras fecais que sofrem sucessivos congelamentos ou preservadas pelo formol, pois os antígenos podem ser desnaturados durante tais processos(81). Na pesquisa da E. histolytica, além do material fecal, outras amostras podem ser usadas para detecção de antígenos, como, por exemplo, saliva, soro e fluidos de abscessos hepáticos. Haque et al.(37) diagnosticaram a maioria de seus pacientes utilizando ELISA, que foi capaz de detectar lectinas específicas para E. histolytica no fluido dos abscessos hepáticos. Abd-Alla et al.(1) realizaram diagnóstico da amebíase hepática utilizando saliva de indivíduos portadores de abscessos hepáticos.
A diferenciação da infecção pode ser realizada por outros métodos de pesquisa de coproantígenos disponíveis comercialmente. No entanto estes testes possuem sensibilidade e especificidade variadas, muitas vezes havendo necessidade da realização de testes mais sensíveis, como, por exemplo, a PCR.
A PCR reproduz a habilidade natural de replicação do DNA mediante a utilização de sondas ou iniciadores (primers). Na metodologia utilizam-se uma DNA-polimerase, as bases nitrogenadas (d-NTPs), um co-fator enzimático (MgCl2) e os iniciadores da reação. Em seguida a mistura é submetida a um ciclo composto por três etapas. A primeira é denominada desnaturação por aquecimento, ocorre normalmente em temperaturas superiores a 90ºC e separa a dupla fita do DNA em duas fitas simples. Na segunda etapa, de hibridização e ligação do iniciador ao alvo, ocorrem o reconhecimento dos iniciadores à seqüência-alvo específica e posterior hibridização. Esse processo acontece normalmente entre 40ºC e 65ºC, dependendo da extensão e da seqüência de base dos iniciadores. Isso permite aos iniciadores ligarem-se à seqüência-alvo com alta especificidade. Na terceira e última etapa, a de extensão, a DNA-polimerase inicia o processo de síntese na região delimitada pelos iniciadores. Ela sintetiza novas moléculas de DNA de cadeia dupla, ambas idênticas à cadeia original, na região do DNA-alvo, facilitando a ligação e unindo os nucleotídeos complementares que estão livres na solução. Esse processo é realizado em um termociclador, instrumento que controla e alterna automaticamente as temperaturas em períodos programados de tempo por um número determinado de ciclos de PCR (geralmente entre 30 e 40 ciclos). A cada ciclo a quantidade de DNA-alvo duplica. Esse processo da PCR é também chamado amplificação, pois a seqüência-alvo é multiplicada milhões de vezes. O diagnóstico pela PCR possui boa reprodutibilidade e altas sensibilidade e especificidade, sendo capaz e detectar um único trofozoíto por miligrama de fezes. Em pacientes com eliminação de poucos cistos, é uma alternativa para o diagnóstico e, quando padronizada, possui um custo menor do que a técnica de ELISA(45). Vários estudos têm utilizado a PCR como ferramenta de escolha para o diagnóstico diferencial entre as espécies pertencentes ao complexo E. histolytica/E. dispar(26, 27, 91, 96, 110).
Discussão
A amebíase é uma infecção humana causada pela Entamoeba histolytica, sendo mais comum em determinados grupos populacionais(84). As manifestações clínicas da doença variam de acordo com a região estudada e estão na dependência de fatores intrínsecos do parasito e da suscetibilidade do hospedeiro. Atualmente entendem-se melhor os mecanismos que fazem esses protozoários únicos na habilidade de causar invasão tissular(102). As lectinas Gal/GalNAc, os amebaporos e as cisteína-proteinases, principais moléculas de virulência envolvidas na invasão tecidual, já foram caracterizadas em nível molecular. Entre essas moléculas destacam-se os amebaporos, devido à sua atividade citolítica(55). No entanto as outras moléculas também exercem papel fundamental no reconhecimento e na aderência do parasito ao tecido-alvo, podendo levar à formação de úlceras características da amebíase(33, 123). Esse protozoário é uma das maiores causas de diarréia em crianças, principalmente na Ásia, na Américas Central e do Sul e na África, sendo considerado a segunda causa de óbito entre as doenças parasitárias em todo o mundo, com grande impacto na saúde dessas populações.
Apesar do progresso na compreensão dos mecanismos fisiopatogênicos da amebíase, alguns aspectos necessitam de maior esclarecimento. Estudos in vitro relacionados com a anergia de macrófagos de camundongo demonstram que essas células são refratárias à ativação e também são defectivas na produção de H2O2, IL-1 e TNF-α(24, 116, 117). Os mecanismos pelos quais ocorre o processo anérgico ainda não estão complemente esclarecidos. Em modelos murinos, o processo inicial das respostas imune e inflamatória não é favorecido pela presença de TNF-α. A transcrição do gene do TNF-α ocorre em macrófagos ativados, no entanto não há expressão protéica da molécula. Os estudos da modulação das respostas imune e inflamatória em populações humanas são bastante escassos e por vezes contraditórios(71, 75).
Rotineiramente, a infecção tem sido diagnosticada por meio de pesquisa microscópica de cistos e/ou trofozoítos em espécimes clínicos. Um diagnóstico sensível e eficaz, utilizando metodologias capazes de diferenciar as espécies pertencentes ao complexo E. histolytica/E. dispar, é essencial para o tratamento adequado e o acompanhamento dos pacientes(84). Atualmente existe um consenso sobre a importância de diferenciar a E. histolytica da E. dispar. A aceitação dessa última como uma nova espécie modificou o entendimento da epidemiologia da amebíase e evidenciou a necessidade do desenvolvimento de técnicas diagnósticas capazes de diferenciar tais espécies(122). Por essa razão, nas últimas décadas houve grande avanço no desenvolvimento das técnicas moleculares aplicadas ao diagnóstico desse protozoário. A pesquisa de coproantígenos possui vantagens quando em comparação com outras metodologias utilizadas. Uma alternativa para diferenciação das espécies pertencentes ao complexo E. histolytica/E. dispar é a PCR, que vem sendo utilizada com bastante freqüência em estudos epidemiológicos(27, 91, 96, 110). No entanto a PCR é uma metodologia cara e trabalhosa. Ainda não existe uma uniformização quanto ao método de extração de DNA ideal, visto que diversas substâncias presentes no sedimento fecal podem atuar como inibidores da Taq DNA-polimerase, ocasionando resultados falso-negativos na PCR(67, 121). Santos(96), ao extrair o DNA dos cistos oriundos do material fecal de 262 pacientes residentes em Salvador (BA), observou a inibição de 45% das amostras. Mesmos após diversas diluições do material fecal, 13,3% das amostras permaneceram sem amplificação na PCR, provavelmente em virtude da inibição da DNA-polimerase, enzima que copia o DNA. Uma maneira de minimizar a influência desses inibidores enzimáticos é a utilização de colunas cromatográficas específicas para DNA. Verweij et al.(111) propuseram sua utilização (QIAamp Qiagen, Alemanha) e verificaram que somente 1,7% das 657 amostras analisadas não amplificaram na PCR. Segundo os autores, esse método é rápido, simples e pode ser facilmente utilizado. No entanto, para o diagnóstico diferencial, o emprego das colunas onera o custo, inviabilizando seu uso na rotina laboratorial. Diante das dificuldades encontradas na realização da PCR de amostras fecais, a ELISA, para pesquisa de antígenos, pode ser utilizada como alternativa para o diagnóstico diferencial do complexo E. histolytica/E. dispar devido a sua elevada especificidade, fácil execução e rapidez, podendo ser executada em 2 a 3 horas, sendo bastante apropriada para trabalhos de campo e diferindo da PCR, que necessita de maior tempo para a sua realização(96).
A literatura relata muitos pontos sobre as vantagens e desvantagens da utilização do método ELISA. Mirelman et al.(64) relataram que a técnica de ELISA (E. histolytica II Techlab) possui alta especificidade para a E. histolytica, sendo capaz de detectar aproximadamente cem trofozoítos. Entretanto o teste não é capaz de revelar baixa carga parasitária, especialmente em indivíduos assintomáticos residentes em áreas endêmicas. Na rotina laboratorial fica evidente que a PCR possui vantagens tanto na detecção quanto na diferenciação das espécies pertencentes ao complexo E. histolytica/E. dispar, além da capacidade de detectar infecções mistas(26). Apesar desses fatos, Haque et al.(35) demonstraram que, quando utilizados em estudos epidemiológicos, os testes não possuem diferenças significativas. De forma semelhante, Ackers(3) mostrou que nenhuma das técnicas apresenta sensibilidade elevada quando utilizadas em amostras congeladas e/ou conservadas e que não seriam métodos adequados para utilização na rotina laboratorial. Segundo dados obtidos no nosso laboratório, a PCR pode ser utilizada com segurança para diferenciação das amebas do complexo, não obstante sua sensibilidade ter sido reduzida devido à presença de substâncias inibidoras enzimáticas nas fezes.
A prevalência da amebíase no Brasil é variável. Pinheiro et al.(76) avaliaram 1.437 amostras de indivíduos residentes em Macaparana (PE) e observaram uma prevalência de 4,1% na população geral para a E. dispar, não encontrando E. histolytica na população examinada. Oliveira-Costa et al.(70), após análise de 20 mil amostras de fezes oriundas da população geral da Grande Belo Horizonte (MG), atendida pela rede privada de saúde, relataram uma prevalência de 0,38% para a E. dispar diagnosticada por PCR, não encontrando E. histolytica na amostragem estudada. De modo semelhante, Santos(96), ao examinar amostras de 55.272 pacientes provenientes de Salvador (BA) e região metropolitana, observou prevalência de 3,2% para o complexo E. histolytica/E. dispar; no entanto, entre as positivas para o complexo, nenhuma foi positiva para a E. histolytica após amplificação pela PCR. Por outro lado, em alguns estados brasileiros tem sido demonstrada elevada prevalência da E. histolytica. Em Manaus (AM) a infecção atinge 6,8% da população(11); em Fortaleza (CE), 14,9% da população de baixa renda(17); e em Belém (PA), 29,5% dos indivíduos residentes na região metropolitana(100) (Figura 1). Nas demais regiões brasileiras ainda não há estudos que retratem a prevalência da E. histolytica.
As indefinições sobre o diagnóstico diferencial do complexo E. histolytica/E. dispar precisam ser superadas devido à necessidade de um tratamento eficaz para a E. histolytica. A PCR possui custo elevado e a maioria dos laboratórios de rotina não possui infra-estrutura adequada para sua execução. A utilização dessa metodologia em nosso país ainda está em fase inicial e seu uso é praticamente restrito aos centros de pesquisa situados, em sua grande maioria, nos centros urbanos de maior porte. No entanto, depois de implantada e padronizada, possui baixo custo. Pesquisas sobre metodologias mais simples, rápidas e de baixo custo devem ser estimuladas e, quando devidamente avaliadas, ser implantadas em laboratórios que compõem as redes pública e privada de saúde.
Estudos mais aprofundados são necessários para melhor entendimento da relação parasito-hospedediro e da proteômica e genômica do protozoário. O projeto genoma da E. histolytica fornecerá ferramentas capazes de formular novos paradigmas a respeito da amebíase. No entanto a descrição de determinados genes pode levar alguns anos, tornando o desenvolvimento de uma vacina uma prioridade para combater essa importante doença.
A erradicação da amebíase em escala global pode ser possível, já que o protozoário não é transmitido por meio de vetores e o homem é o principal hospedeiro da E. histolytica(74). O controle da infecção pode ser conseguido mediante a implantação de sistemas adequados de saneamento básico em áreas endêmicas e orientação a boas práticas de higiene. No entanto os países em desenvolvimento não investem o suficiente em programas de saúde pública e, conseqüentemente, a população encontra-se exposta aos riscos de contrair a infecção. Portanto a vacinação contra a amebíase é uma alternativa para a erradicação da infecção.
Primeira submissão em 08/05/08
Última submissão em 02/10/08
Aceito para publicação em 22/10/08
Publicado em 20/08/08
Trabalho realizado no Laboratório de Imunoparasitologia como requisito para a obtenção do título de Especialista em Tópicos Avançados em Diagnóstico Laboratorial pela Faculdade de Farmácia da UFBA.
- 1. ABD-ALLA, M. D.; RAVDIN, J. I. Diagnosis of amoebic colitis by antigen capture ELISA in patients presenting with acute diarrhea in Cairo, Egypt. Trop Med Int Health, v. 7, n. 4, p. 365-70, 2002.
- 2. ABIOYE, A. A. Fatal amoebic colitis in pregnancy and puerperium: a new clinico-pathological entity. J Trop Med Hyg, v. 76, n. 4, p. 97-100, 1973.
- 3. ACKERS, J. P. The diagnostic implications of the separation of Entamoeba histolytica and Entamoeba dispar. J Biosci, v. 27, n. 6, suppl. 3, p. 573-8, 2002.
- 4. ADAMS, E. B.; MACLEOD, I. N. Invasive amebiasis. II. Amebic liver abscess and its complications. Medicine (Baltimore), v. 56, n. 4, p. 325-34, 1977a.
- 5. ADAMS, E. B.; MACLEOD, I. N. Invasive amebiasis. I. Amebic dysentery and its complications. Medicine (Baltimore), v. 56, n. 4, p. 315-23, 1977b.
- 6. ALLASON-JONES, E. et al Entamoeba histolytica as a commensal intestinal parasite in homosexual men. N Engl J Med, v. 315, n. 6, p. 353-6, 1986.
- 7. ARGENZIO, R. A. et al Prostanoids inhibit intestinal NaCl absorption in experimental porcine cryptosporidiosis. Gastroenterology, v. 104, n. 2, p. 440-7, 1993.
- 8. ARISTIZABAL, H. et al Fulminant amebic colitis. World J Surg, v. 15, n. 2, p. 216-21, 1991.
- 9. BANK, S. et al The clinical spectrum of amoebic colitis. S Afr Med J, v. 45, n. 9, p. 219-25, 1971.
- 10. BAPAT, M. M.; BHAVE, G. G. Counterimmunoelectrophoresis in the immunodiagnosis of amoebiasis. J Postgrad Med, v. 36, n. 3, p. 124-7, 1990.
- 11. BENETTON, M. L. et al Risk factors for infection by the Entamoeba histolytica/E. dispar complex: an epidemiological study conducted in outpatient clinics in the city of Manaus, Amazon Region, Brazil. Trans R Soc Trop Med Hyg, v. 99, n. 7, p. 532-40, 2005.
- 12. BERNINGHAUSEN, O.; LEIPPE, M. Necrosis versus apoptosis as the mechanism of target cell death induced by Entamoeba histolytica. Infect Human, v. 65, n. 9, p. 3615-21, 1997.
- 13. BEUBLER, E. et al Involvement of 5-hydroxytryptamine, prostaglandin E2 and cyclic adenosine monophosphate in cholera toxin-induced fluid secretion in the small intestine of the rat in vivo. Gastroenterology, v. 96, p. 368-76, 1989.
- 14. BEUBLER, E. et al Cholera toxin induces prostaglandin synthesis via posttranscriptional activation of cyclooxygenase-2 in the rat jejunum. J Pharmacol Exp Ther, v. 297, n. 3, p. 940-45, 2002.
- 15. BHATTACHARYA, A. et al Absence of lipophosphoglycan-like glycoconjugates in Entamoeba histolytica. Parasitology, v. 120, p. 31-5, 2000.
- 16. BRAGA, L. L. et al Seroepidemiology of Entamoeba histolytica in a slum in northeastern Brazil. Am J Trop Med Hyg, v. 55, n. 6, p. 693-7, 1996.
- 17. BRAGA, L. L. et al Entamoeba histolytica and Entamoeba dispar infections as detected by monoclonal antibody in an urban slum in Fortaleza, Northeast Brazil. Rev Soc Bras Med Trop, v. 34, n. 5, p. 467-71, 2001.
- 18. CABALLERO-SALCEDO, A. et al Seroepidemiology of amebiasis in Mexico. Am J Trop Med Hyg, v. 50, n. 4, p. 412-9, 1994.
- 19. CALALB, M. B. et al Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity: a role for Src kinases. Mol Cell Biol, v. 15, n. 2, p. 954-63, 1995.
- 20. CAMPOS-RODRÍGUEZ, R.; JARILO-LUNA, A. The pathogenicity of Entamoeba histolytica is related to the capacity of evading innate immunity. Parasite Immunol, v. 27, p. 1-8, 2005.
- 21. CARDOSO, J. M. et al Radiology of invasive amebiasis of the colon. Am J Roentgenol, v. 128, n. 6, p. 935-41, 1977.
- 22. CHADEE, K. et al Rat and human colonic mucins bind to and inhibit the adherence lectin of Entamoeba histolytica. J Clin Invest, v. 80, n. 5, p. 1245-54, 1987.
- 23. CUMMINS, A. J. Rapid latex agglutination test for extraluminal amoebiasis. J Clin Pathol, v. 47, n. 7, p. 647-8, 1994.
- 24. DENIS, M.; CHADEE, K. In vitro and in vivo studies of macrophage functions in amebiasis. Infect Immun, v. 56, p. 3126-31, 1988.
- 25. ELLYSON, J. H. et al Necrotizing amebic colitis: a frequently fatal complication. Am J Surg, v. 152, n. 1, p. 21-6, 1986.
- 26. EVANGELOPOULOS, A. et al A nested, multiplex, PCR assay for the simultaneous detection and differentiation of Entamoeba histolytica and Entamoeba dispar in faeces. Ann Trop Med Parasitol, v. 94, n. 3, p. 233-40, 2000.
- 27. EVANGELOPOULOS, A. et al Microscopy, PCR and ELISA applied to the epidemiology of amebiasis in Greece. Parasitol Int, v. 50, n. 3, p. 185-9, 2001.
- 28. FERREIRA, C. B.; MARÇAL, J. R. Enteroparasitoses em escolares do distrito de Martinésia, Uberlândia-MG: um estudo-piloto. Rev Soc Bra Med Trop, v. 30, n. 5, p. 373-7, 1997.
- 29. GARCIA, L. S.; BRUCKNER, D. A. Diagnostic medical parasitology. 3. ed. Washington, D.C.: ASM Press, 1997.
- 30. GATHIRAM, V.; JACKSON, T. F. A longitudinal study of asymptomatic carriers of pathogenic zymodemes of Entamoeba histolytica. S Afr Med J, v. 72, n. 10, p. 669-72, 1987.
- 31. GONZÁLEZ-RUIZ, A. et al Value of microscopy in the diagnosis of dysentery associated with invasive Entamoeba histolytica. J Clin Pathol, v. 47, n. 3, p. 236-9, 1994a.
- 32. GONZÁLEZ-RUIZ, A. et al Diagnosis of amebic dysentery by detection of Entamoeba histolytica fecal antigen by an invasive strain-specific, monoclonal antibody-based enzyme-linked immunosorbent assay. J Clin Microbiol, v. 32, n. 4, p. 964-70, 1994b.
- 33. GUERRANT, R. L. et al Interaction between Entamoeba histolytica and human polymorphonuclear neutrophils. J Infec Dis, v. 143, n. 1, p. 83-93, 1981.
- 34. HAQUE, R. et al Rapid diagnosis of Entamoeba infection using Entamoeba and Entamoeba histolytica stool antigen detection kits. J Clin Microbiol, v. 33, n. 10, p. 2558-61, 1995.
- 35. HAQUE, R. et al Comparison of PCR, isoenzyme analysis and antigen detection for diagnosis of Entamoeba histolytica infection. J Clin Microbiol, v. 36, n. 2, p. 449-52, 1998.
- 36. HAQUE, R. et al Prevalence and immune response to Entamoeba histolytica infection in preschool children in Bangladesh. Am J Trop Hyg, v. 60, p. 1031-4, 1999.
- 37. HAQUE, R. et al Diagnosis of amebic liver abscess and intestinal infection with the TechLab Entamoeba histolytica II antigen detection and antibody tests. J Clin Microbiol, v. 38, n. 9, p. 3235-9, 2000.
- 38. HAQUE, R. et al Innate and acquired resistance to amoebiasis in Bangladeshi children. J Infect Dis, v. 186, n. 4, p. 547-52, 2002.
- 39. HUNG, C. C. et al Invasive amoebiasis: an emerging parasitic disease in patients infected with HIV in an area endemic for amoebic infection. AIDS, v. 13, n. 17, p. 2421-8, 1999.
- 40. JACKSON, T. F. et al Serological differentiation between past and present infection in hepatic amoebiasis. Tran R Soc Trop Med Hyg, v. 78, n. 3, p. 342-5, 1984.
- 41. JACKSON, T. F. et al Seroepidemiological study of antibody responses to the zymodemes of Entamoeba histolytica. Lancet, v. 1, n. 8431, p. 716-9, 1985.
- 42. JAMMAL, M. A. et al Amebiasis presenting as rectal bleeding without diarrhea in childhood. J Pediatr Gastroenterol Nutr, v. 4, n. 2, p. 294-6, 1985.
- 43. JETTER, A. et al An epidemiological study of Entamoeba histolytica and E. dispar infection in eastern Turkey using a colorimetric polymerase chain reaction. Arch Med Res, v. 28, p. 319-21, 1997.
- 44. KAPOOR, O. P. Amebic liver abscess. Bombay Hospital Journal, v. 332, p. 5-8, 1990.
- 45. KATZWINKEL-WLADARSCH, S. et al Direct amplification and differentiation of pathogenic and nonpathogenic Entamoeba histolytica DNA from stool specimens. Am J Trop Med Hyg, v. 51, p. 115-8, 1994.
- 46. KEENE, W. E. et al The major neutral proteinase of Entamoeba histolytlca. J Exp Med, v. 163, n. 3, p. 536-49, 1986.
- 47. KELSALL, B. L.; RAVDIN, J. L. Degradation of human IgA by Entamoeba histolytica. J Infect Dis, v. 168, n. 5, p. 1319-22, 1993.
- 48. KNOBLOCH, J.; MANNWEILER, E. Development and persistence of antibodies to Entamoeba histolytica in patients with amebic liver abscess: Analysis of 216 cases. Am J Trop Med Hyg, v. 32, n. 4, p. 727-32, 1983.
- 49. KRETSCHMER, R. et al Inhibition of monocyte locomotion by products of axenically grown Entamoeba histolytica. Parasite Immunol, v. 7, n. 5, p. 527-43, 1985.
- 50. KRETSCHMER, R. R. et al A novel anti-inflammatory oligopeptide produced by Entamoeba histolytica. Mol Bioch Parasitol, v. 112, n. 2, p. 201-9, 2001.
- 51. KROGSTAD, D. J. et al Amebiasis: epidemiologic studies in the United States, 1971-1974. Ann Inter Med, v. 88, n. 1, p. 89-97, 1978.
- 52. LAFLAMME, S. E.; AUER, K. L. Integrin signaling. Seminars in Cancer Biology, v. 7, n. 3, p. 111-8, 1996.
- 53. LEIPPE, M. et al Primary and secondary structure of the pore-forming peptide of pathogenic Entamoeba histolytica. EMBO J, v. 11, n. 10, p. 3501-6, 1992.
- 54. LEIPPE, M. et al Amoebapores, a family of membranolytic peptides from cytoplasmic granules of Entamoeba histolytica: isolation, primary structure, and pore formation in bacterial cytoplasmic membranes. Mol Microbiol, v. 14, n. 5, p. 895-904, 1994.
- 55. LEIPPE, M. Ancient weapons: the three-dimensional structure of amoebapore A. Trends in Parasitol, v. 21, n. 1, p. 5-7, 2005.
- 56. LEROY, A. et al Entamoeba histolytica disturbs the tight junction complex in human enteric T84 cell layers. FASEB J, v. 14, n. 9, p. 1139-46, 2000.
- 57. LEWIS, E. A.; ANTIA, A. U. Amoebic colitis: review of 295 cases. Trans R Soc Trop Med Hyg, v. 63, p. 633-8, 1969.
- 58. LI, E. et al Entamoeba histolytica interactions with polarized human intestinal Caco-2 epithelial cells. Infect Immun, v. 62, n. 11, p. 5112-9, 1994.
- 59. LOTTER, H. et al Crude or recombinant proteins applied to latex agglutination, complement-fixation and enzymelinked immunosorbent assays for the serodiagnosis of invasive amebiasis. Trop Med Parasitol, v. 44, n. 4, p. 277-80, 1993.
- 60. LOTTER, H. et al Evaluation of three serological tests for the detection of antiamebic antibodies applied to sera of patients from an area endemic for amebiasis. Trop Med Parasitol, v. 46, n.3, p. 180-2, 1995.
- 61. MARKELL, E. K. et al Protozoários que habitam a luz. In: MARKELL. Parasitologia médica 8. ed. Rio de Janeiro: Guanabara-Koogan, 2003.
- 62. McGEE, D. W. Inflammation and mucosal cytokine production. In: OGRA, P. L. et al. (ed.). Mucosal immunology. San Diego: Academic Press Inc, 1999. p. 559-73.
- 63. MERRITT, R. J. et al Spectrum of amebiasis in children. Am J Dis Child, v. 136, n. 9, p. 785-9, 1982.
- 64. MIRELMAN, D. et al Comparison of use enzyme-linked immunosorbent assay-based kits and PCR amplification of rRNA genes for simultaneous of Entamoeba histolytica and E. dispar. J Clin Microbiol, v. 35. n. 9, p. 2405-7, 1997.
- 65. MOODY, S. et al An improved colorimetric PCR-based method for detection and differentiation of Entamoeba histolytica and Entamoeba dispar in feces. J Clin Microbiol, v. 35, n. 5, p. 1108-11, 1997.
- 66. MOODY-HAUPT, S. et al The major surface antigens of Entamoeba histolytica trophozoites are GPI-anchored proteophosphoglycans. J Mol Biol, v. 297, n. 2, p. 409-20, 2000.
- 67. MONTEIRO, L. et al Complex polysaccharides as PCR inhibitors in feces: Helicobacter pylori model. J Clin Microbiol, v. 35, n. 4, p. 995-8, 1997.
- 68. OHNISHI, K.; MURATA, M. Present characteristics of symptomatic amebiasis due to Entamoeba histolytica in the east-southeast area of Tokyo. Epidemiol Infect, v. 119, n. 3, p. 363-7, 1997.
- 69. OJCIUS, D. M.; YOUNG, J. D. Cytolytic pore-forming proteins and peptides: is there a common structural motif? Trends Biochem Sci, v.16, p. 225-9, 1991.
- 70. OLIVEIRA-COSTA, J. et al Prevalência de Entamoeba histolytica e Entamoeba dispar em amostras fecais de um laboratório privado na Grande Belo Horizonte. Semana de Iniciação Científica da Universidade Federal de Minas Gerais, Belo Horizonte-MG, 2006.
- 71. ORTIZ-ORTIZ, L. et al Cell-mediated immunity in patients with amebic abscess of the liver. Clin Immunol Immunopathol, v. 4, p. 127-34, 1975.
- 72. PAL, S. et al. Comparative evaluation of somatic and excretory-secretory antigens of Entamoeba histolytica in serodiagnosis of human amoebiasis by ELISA. Indian J Med Res, v. 104, p. 152-6, 1996.
- 73. PARIJA, S. C.; KARKI, B. M. Detection of circulating antigen in amoebic liver abscess by counter-current immunoelectrophoresis. J Med Microbiol, v. 48, n. 1, p. 99-101, 1999.
- 74. PETRI, W. A. et al Estimating the impact of amebiasis on health. Parasitol Today, v. 16, n. 8, p. 320-1, 2000.
- 75. PHIPPS, R. P. et al A new view of prostaglandin E regulation of the immune response. Immunol Today, v. 12, p. 349-52, 1991.
- 76. PINHEIRO, S. M. et al Determination of the prevalence of Entamoeba histolytica and E. dispar in the Pernambuco State of Northeastern Brazil by a polymerase chain reaction. Am J Trop Med Hyg, v. 70, n. 2, p. 221-4, 2004.
- 77. PRASAD, R. et al Recognition of Entamoeba histolytica lipophosphoglycan by a strain-specific monoclonal antibody and human immune sera. Mol Biochem Parasitol, v. 56, p. 279-87, 1992.
- 78. PROCTOR, E. M. Laboratory diagnosis of amebiasis. Clin Lab Med, v. 11, n. 4, p. 829-59, 1991.
- 79. QUE, X.; REED, S. L. The role of extracelular cysteine proteinases in pathogenesis of Entamoeba histolytica invasion. Parasitol Today, v. 13, n. 5, p. 190-4, 1997.
- 80. QUE, X.; REED, S. L. Cysteine proteinases and the pathogenesis of amebiasis. Clin Microbiol Rev, v. 13, n. 2, p. 196-206, 2000.
- 81. RAMOS, F. et al The effect of formalin fixation on the polymerase chain reaction characterization of Entamoeba histolytica. Trans Med Roy Soc Hyg, v. 93, p. 335-3, 1999.
- 82. RAVDIN, J. L. Cytopathogenic mechanism of Entamoeba histolytica. J Exp Med, v. 152, n. 2, p. 377-90, 1980.
- 83. RAVDIN, J. I. et al Adherence of Entamoeba histolytica trophozoites to rat and human colonic mucosa. Infect Immun, v. 48, n. 2, p. 292-7, 1985.
- 84. RAVDIN, J. L. Amebiasis. Clin Infect Dis, v. 20, n. 6, p. 1453-66, 1995.
- 85. REED, S. L. et al Entamoeba histolytica infection and AIDS. Am J Med, v. 90, n. 2, p. 269-71, 1991.
- 86. RESTREPO, M. I. et al Diagnostic tests for amoebic liver abscess: comparison of enzyme-linked immunosorbent assay (ELISA) and counterimmunoelectrophoresis (CIE). Rev Soc Bras Med Trop, v. 29, n. 1, p. 27-32, 1996.
- 87. RICO, G. et al Effect of the monocyte locomotion inhibitory factor (MLIF) produced by Entamoeba histolytica upon the respiratory burst of human leukocytes. Arch Med Res, v. 23, n. 2, p. 157-9, 1992.
- 88. RICO, G. et al The effect of the monocyte locomotion inhibitory factor (MLIF) produced by Entamoeba histolytica upon nitric oxide production by human leukocytes. Arch Med Res, v. 31, p. S90-1, 2000.
- 89. ROSENBERG, I. et al Isolation, characterization and partial purification of a transferable membrane channel (amoebapore) produced by Entamoeba histolytica. Mol Biochem Parasitol, v. 33, n. 3, p. 237-47, 1989.
- 90. ROLLINS, S. A. et al Inhibition of homologous complement by CD59 is mediated by a species-specific recognition conferred through binding to C8 within C5b-8 or C9 within C5b-9. J Immunol, v. 146, n. 7. p. 2345-51, 1991.
- 91. ROY, S. et al Real-time-PCR assay for diagnosis of Entamoeba histolytica infection. J Clin Micorbiol, v. 43, n. 5, p. 2168-72, 2005.
- 92. SALATA, R. A. et al Interaction of human leukocytes and Entamoeba histolytica: killing of virulent amebae by the activated macrophage. J Clin Invest, v. 76, n. 2, p. 491-9, 1985.
- 93. SALATA, R. A. et al Suppression of T-lymphocyte responses to Entamoeba histolytica antigen by immune sera. Infect Immun, v. 58, p. 3941-6, 1990.
- 94. SALLES, J. M. et al Hepatic amebiasis. Brazilian Journal of Infectious Diseases, v. 7, p. 96-110, 2003.
- 95. SANTOS, F. L. et al Comparison of the thick smear and Kato-Katz techiniques for diagnosis of intestinal helminth infections. Rev Soc Bras Med Trop, v. 38, n. 2, p. 196-8, 2005.
- 96. SANTOS, F. L. Implantação e avaliação do diagnóstico diferencial entre Entamoeba histolytica e Entamoeba dispar em amostras fecais. 2007. Dissertação (mestrado) Faculdade de Medicina, Universidade Federal da Bahia, Salvador.
- 97. SÉGUIN, R. et al Entamoeba histolytica stimulates the unstable transcription of c-fos and tumor necrosis factor-a messenger RNA by protein kinase C signal transduction in macrophages. Immunology, v. 86, p. 49-57, 1995.
- 98. SEYDEL, K. B. et al Human intestinal epithelial cells produce proinflammatory cytokines in response to infection in a SCID mouse-human intestinal xenograft model of amebiasis. Infect Immun, v. 65, n. 5, p. 1631-9, 1997.
- 99. SHARMA, M. et al Enhanced pro-inflammatory chemokine/cytokine response triggered by pathogenic Entamoeba histolytica: basis invasive disease. Parasitology, v. 131, n. 6, p. 783-96, 2005.
- 100. SILVA, M. C. et al Determination of Entamoeba histolytica infection in patients from Greater Metropolitan Belém, Pará, Brazil, by enzyme-linked immunosorbent assay (ELISA) for antigen detection. Cad Saúde Pública, v. 21, n. 3, p. 969-73, 2005.
- 101. SRIVASTAVA, G. et al Lipophosphoglycan is present in distinctly different form in different Entamoeba histolytica strains and absent in Entamoeba moshkovskii and Entamoeba invadens. J Eukaryot Microbiol, v. 42, n. 5, p. 617-22, 1995.
- 102. STANLEY, S. L. Amoebiasis. Lancet, v. 361, n. 9362, p. 1025-34, 2003.
- 103. STENSON, W. F. et al Amebic infection in the human colon induces cyclooxygenase-2. Infect Immun, v. 69, n. 5, p. 3382-8, 2001.
- 104. TACHIBANA, H. et al Asymptomatic cyst passers of Entamoeba histolytica but not Entamoeba dispar in institutions for the mentally retarded in Japan. Parasitol Int, v. 49, n. 1, p. 31-5, 2000.
- 105. TAKAHASHI, T. et al Fulminant amebic colitis: analysis of 55 cases. Dis Colon Rectum, v. 40, n. 11, p. 1362-7, 1997.
- 106. TALVANI, A. et al Chemokine receptor expression on the surface of peripheral blood mononuclear cells in Chagas disease. J Infect Dis, 189: 214-220, 2004.
- 107. TANYUKSEL, M. et al Comparison of the serologic tests (IFA, ELISA) with microscopy using for the diagnosis of amoebosis. Acta Parasitol Turc, v. 19, p. 476-2, 1995.
- 108. TAVAERS, P. et al Cell polarization and adhesion in a motile pathogenic protozoan: role and fate of the Entamoeba histolytica Gal/GalNac lectin. Microbes and Infection, v. 2, n. 6, p. 643-9, 2000.
- 109. TRISSL, D. et al Surface properties of Entamoeba: increased rates of human erythrocyte phagocytosis in pathogenic strain. J Exp Med, v. 148, n. 5, p. 1137-43, 1978.
- 110. VALLE, P. R. et al Arbitrarily primed PCR fingerprinting of RNA and DNA in Entamoeba histolytica. Rev Inst Med Trop São Paulo, v. 42, n. 5, p. 249-53, 2000.
- 111. VERWEIJ, J. J. et al Differentiation of Entamoeba histolytica and Entamoeba dispar cysts using polymerase chain reaction on DNA isolated from faeces with spin columns. Eur J Clin Microbiol Infect Dis, v. 19, p. 358-61, 2000.
- 112. WALDERICH, B. et al Differentiation of Entamoeba histolytica and Entamoeba dispar from German travelers and residents of endemic regions. Am J Trop Med Hyg, v. 57, n. 1, p. 70-4, 1997.
- 113. WALSH, J. A. Problems in recognition and diagnosis of amebiasis: estimation of the global magnitude of morbidity and mortality. Rev Infect Dis, v. 8, n. 2, p.228-38, 1986.
- 114. WALSH, J. A. Prevalence of Entamoeba histolytica infection. In: RAVDIN, J. I. (ed.). Amebiasis: human infection by Entamoeba histolytica New York: John Wiley and Sons, p. 93-105, 1988.
- 115. WANG, W.; CHADEE, K. Entamoeba histolytica alters arachidonic acid metabolism in macrophages in vitro and in vivo. Immunology, v. 76, p. 242-50, 1992.
- 116. WANG, W. Modulation of tumor necrosis factor production by macrophages in Entamoeba histolytica infection. Infect Immun, v. 60, p. 3169-74, 1992.
- 117. WANG, W. et al Entamoeba histolytica modulates the nitric oxide synthase gene and nitric oxide production by macrophages for cytotoxicity against amoebae and tumour cells. Immunology, v. 83, p. 601-10, 1994.
- 118. WANG, W.; CHADEE, K. Entamoeba histolytica suppresses gamma interferon-induced macrophage class II major histocompatibility complex Ia molecule and I-Ab mRNA expression by a prostaglandin E2-dependent mechanism. Infect Immun, v. 63, p. 1089-94, 1995.
- 119. WEINKE, T. et al Prevalence and clinical importance of Entamoeba histolytica in two high-risk groups: travelers returning from tropics and male homosexuals. J Infec Dis, v. 161, n. 5, p. 1029-31, 1990.
- 120. WELCH, J. S. et al Immunodiagnosis of Entamoeba histolytica and Ascaris lumbricoides infections in Caucasian and aboriginal Australians. Trans R Soc Trop Med Hyg, v. 80, n. 2, p. 240-7, 1986.
- 121. WILSON, I. G. Inhibition and facilitation of nucleic acid amplification. Appl Envirol Microbio, v. 63, n. 10, p. 3741-51, 1997.
- 122. WORLD HEALTH ORGANIZATION. Amoebiasis. Report on the WHO/Pan American Health Organization/UNESCO Expert Consultation, Mexico City. Geneva-WHO. W Epidemiol Rec, v. 72, p. 97-100, 1997.
- 123. YOUNG, J. D. et al Characterization of a membrane pore-forming protein from Entamoeba histolytica. J Exp Med, v. 156, n. 6, p. 1677-90, 1982.
- 124. ZENGZHU, G. et al Analysis by enzyme-linked immunosorbent assay and PCR of human liver abscess aspirates from patients in China for Entamoeba histolytica. J Clin Microbiol, v. 37, n. 9, p. 3034-6, 1999.
Datas de Publicação
-
Publicação nesta coleção
30 Jan 2009 -
Data do Fascículo
Ago 2008
Histórico
-
Revisado
02 Out 2008 -
Recebido
08 Maio 2008 -
Aceito
22 Out 2008