Resumos
INTRODUÇÃO: A determinação de cortisol nos diferentes fluídos orgânicos tem sido aplicada como auxílio diagnóstico em distintas condições nosológicas em humanos, bem como empregada em estudos envolvendo pesquisa clínica. No intervalo de aplicação clínica, rotineiramente é determinado pela técnica de radioimunoensaio (RIE). Na determinação do cortisol urinário livre essa técnica vem sendo substituída pelo emprego da cromatografia líquida de alta eficiência (HPLC), principalmente no diagnóstico da síndrome de Cushing. Já para a determinação do cortisol sérico não se têm evidências do emprego da cromatografia líquida em substituição a outras técnicas analíticas. OBJETIVOS: O desenvolvimento de metodologia analítica empregando HPLC no modo fase reversa (RP-HPLC) para a determinação de cortisol sérico em substituição ao RIE visando à redução da geração de resíduos radioativos. MATERIAL E MÉTODOS: O cortisol foi quantificado diretamente empregando-se RP-HPLC em amostras de soro previamente extraídas com éter utilizando-se acetonido de triancinolona como padrão interno (PI). Utilizou-se coluna analítica BDS-Hypesil-C18® (125 x 4 mm, 5 µm), fase móvel composta de água e acetonitrila (72:28; v/v) a 1 ml/min e detecção a 243 nm. RESULTADOS: O cortisol e o PI apresentaram tempo de retenção de 3,4 e 7,1 min, respectivamente. O coeficiente de variação (CV%) obtido no estudo da precisão foi menor que 10%, e a exatidão apresentou um desvio inferior a 4%. DISCUSSÃO: O método mostrou-se eficaz e eficiente, com sensibilidade e linearidade na faixa estudada de 2,5 a 60 µµg/dl. CONCLUSÃO: O método proposto substitui o RIE no intervalo de sua aplicação clínica.
HPLC; Radioimunoensaio; Cortisol; Acetonido de triancinolona; Esteróides
BACKGROUND: The quantification of cortisol in different organic fluids has not only been applied to different human nosological conditions as a diagnostic aid but it has also been used in clinical research. In clinical application, cortisol is routinely measured by radioimmunoassay (RIA). In the determination of free urinary cortisol this technique has been replaced by the high-performance liquid chromatography mainly in the diagnosis of Cushing syndrome. As to serum cortisol determination, there is no evidence of the application of liquid chromatography as a substitute for other analytical techniques. OBJECTIVE: The development of an analytical methodology using reversed-phase high-performance liquid chromatography (RP-HPLC) to determine serum cortisol levels as a substitute for RIA in order to reduce radioactive waste. MATERIAL AND METHODS: Cortisol was directly quantified by RP-HPLC in previously ether-extracted serum samples. Triamcinolone acetonide was used as internal standard (IS). The chromatographic separation was developed in a BDS-Hypersil-C18® column (125 x 4 mm, 5 µm) using water-acetonitrile (72:28; v/v) as mobile phase at 1 ml/min and steroid peaks were measured at 243 nm. RESULTS: Cortisol and IS presented retention time of 3.4 and 7.1 min, respectively. The precision was less than 10% and accuracy was less than 4%. DISCUSSION: The method was effective and efficient, with good sensitivity and linearity in the concentration range of 2.5 to 60.0 µµg/dl. CONCLUSION: The present methodology substitutes RIA at clinical application.
HPLC; Radioimmunoassay; Cortisol; Triamcinolone acetonide; Steroids
ARTIGO ORIGINAL ORIGINAL ARTICLE
Emprego da cromatografia líquida de alta eficiência na determinação de cortisol sérico em substituição à técnica de radioimunoensaio
High-performance liquid chromatography application for serum cortisol quantification as a substitute for radioimmunoassay
Eduardo Kinio SugawaraI; Luciane Maria Ribeiro NetoII; Kelly Cristina de OliveiraIII; Ieda Therezinha do Nascimento VerreschiIV
IFarmacêutico-bioquímico; mestrando em Ciências Médicas pelo Programa de Pós-Graduação em Endocrinologia do Departamento de Medicina da Escola Paulista e Medicina da Universidade Federal de São Paulo (EPM/UNIFESP)
IIFarmacêutica-bioquímica; pesquisadora convidada do Programa de Pós-Graduação do Laboratório de Esteróides do Departamento de Medicina da EPM/UNIFESP
IIIGraduanda em Farmácia; técnica de laboratório do Laboratório de Esteróides da disciplina de Endocrinologia do Departamento de Medicina da EPM/UNIFESP
IVProfessora associada; chefe do Laboratório de Esteróides da disciplina de Endocrinologia do Departamento de Medicina da EPM/UNIFESP
Endereço para correspondência Endereço para correspondência Ieda Therezinha do Nascimento Verreschi Laboratório de Esteróides do Departamento de Medicina da EPM/UNIFESP Rua Pedro de Toledo, 781 - 13º andar CEP 04039-032 - São Paulo-SP e-mail: ieda.verreschi@unifesp.br
RESUMO
INTRODUÇÃO: A determinação de cortisol nos diferentes fluídos orgânicos tem sido aplicada como auxílio diagnóstico em distintas condições nosológicas em humanos, bem como empregada em estudos envolvendo pesquisa clínica. No intervalo de aplicação clínica, rotineiramente é determinado pela técnica de radioimunoensaio (RIE). Na determinação do cortisol urinário livre essa técnica vem sendo substituída pelo emprego da cromatografia líquida de alta eficiência (HPLC), principalmente no diagnóstico da síndrome de Cushing. Já para a determinação do cortisol sérico não se têm evidências do emprego da cromatografia líquida em substituição a outras técnicas analíticas.
OBJETIVOS: O desenvolvimento de metodologia analítica empregando HPLC no modo fase reversa (RP-HPLC) para a determinação de cortisol sérico em substituição ao RIE visando à redução da geração de resíduos radioativos.
MATERIAL E MÉTODOS: O cortisol foi quantificado diretamente empregando-se RP-HPLC em amostras de soro previamente extraídas com éter utilizando-se acetonido de triancinolona como padrão interno (PI). Utilizou-se coluna analítica BDS-Hypesil-C18® (125 x 4 mm, 5 µm), fase móvel composta de água e acetonitrila (72:28; v/v) a 1 ml/min e detecção a 243 nm.
RESULTADOS: O cortisol e o PI apresentaram tempo de retenção de 3,4 e 7,1 min, respectivamente. O coeficiente de variação (CV%) obtido no estudo da precisão foi menor que 10%, e a exatidão apresentou um desvio inferior a 4%.
DISCUSSÃO: O método mostrou-se eficaz e eficiente, com sensibilidade e linearidade na faixa estudada de 2,5 a 60 µµg/dl.
CONCLUSÃO: O método proposto substitui o RIE no intervalo de sua aplicação clínica.
Unitermos: HPLC, Radioimunoensaio, Cortisol, Acetonido de triancinolona, Esteróides
ABSTRACT
BACKGROUND: The quantification of cortisol in different organic fluids has not only been applied to different human nosological conditions as a diagnostic aid but it has also been used in clinical research. In clinical application, cortisol is routinely measured by radioimmunoassay (RIA). In the determination of free urinary cortisol this technique has been replaced by the high-performance liquid chromatography mainly in the diagnosis of Cushing syndrome. As to serum cortisol determination, there is no evidence of the application of liquid chromatography as a substitute for other analytical techniques.
OBJECTIVE: The development of an analytical methodology using reversed-phase high-performance liquid chromatography (RP-HPLC) to determine serum cortisol levels as a substitute for RIA in order to reduce radioactive waste.
MATERIAL AND METHODS: Cortisol was directly quantified by RP-HPLC in previously ether-extracted serum samples. Triamcinolone acetonide was used as internal standard (IS). The chromatographic separation was developed in a BDS-Hypersil-C18® column (125 x 4 mm, 5 µm) using water-acetonitrile (72:28; v/v) as mobile phase at 1 ml/min and steroid peaks were measured at 243 nm.
RESULTS: Cortisol and IS presented retention time of 3.4 and 7.1 min, respectively. The precision was less than 10% and accuracy was less than 4%.
DISCUSSION: The method was effective and efficient, with good sensitivity and linearity in the concentration range of 2.5 to 60.0 µµg/dl.
CONCLUSION: The present methodology substitutes RIA at clinical application.
Key words: HPLC, Radioimmunoassay, Cortisol, Triamcinolone acetonide, Steroids
Introdução
A determinação de cortisol nos diferentes fluidos orgânicos tem sido aplicada como auxílio diagnóstico de diversas condições nosológicas em humanos, bem como empregada em estudos envolvendo pesquisa clínica. A dosagem do cortisol em saliva é empregada para o estudo do ritmo circadiano do cortisol e para a avaliação de insuficiência adrenal nos primeiros dias de vida de recém-nascidos a termo e pré-termo(4). Adicionalmente, sua determinação em soro tem sido utilizada para avaliar o eixo hipotálamo-hipófise-adrenal em alterações da função cognitiva, em situações de estresse, ansiedade, depressão, síndrome do pânico, na avaliação da privação de sono em pacientes trabalhadores noturnos e naqueles com fadiga crônica(8, 24). O cortisol urinário tem sido empregado no diagnóstico da síndrome de Cushing, bem como sua dosagem sérica em 24 horas(17).
O cortisol no intervalo de aplicação clínica (2 a 25 µg/dl)(11, 15) rotineiramente é determinado pela técnica de radioimunoensaio (RIE), a qual apresenta problemas devido à semelhança estrutural dos hormônios esteróides e à dificuldade de obtenção de anticorpos específicos, associados à ampla faixa de concentração em que podem ser encontrados(23). A utilização do RIE na determinação do cortisol urinário livre vem sendo substituída pela cromatografia líquida de alta eficiência (HPLC), principalmente visando o diagnóstico da síndrome de Cushing(7, 13, 19-21). A HPLC também é uma ferramenta da fase preparativa, tecnologia fundamental na purificação de amostras, principalmente em laboratório de hormônios esteróides. Quanto à determinação do cortisol sérico empregando-se HPLC, não se têm evidências de sua ampla utilização em substituição a outras técnicas analíticas. Recentemente foi alertado que os valores de cortisol sérico obtidos por kits comerciais de RIE apresentavam ampla variação (-62% a 770%), comprometendo sua confiabilidade. Esses valores foram constantemente superiores aos encontrados na determinação por HPLC(9).
Objetivos
Propõe-se o desenvolvimento de uma metodologia analítica confiável e sensível empregando a HPLC no modo fase reversa (RP-HPLC) para dosagem de cortisol sérico, objetivando aplicá-la em substituição ao RIE, o que permitirá principalmente a redução dos resíduos radioativos gerados a partir desta rotina laboratorial.
Material e métodos
Padrão
O padrão de cortisol foi adquirido da Sigma-Aldrich e o padrão de acetonido de triancinolona, utilizado como padrão interno (PI), foi adquirido da United States Pharmacopeia (USP). Soluções metanólicas de ambos os padrões foram preparadas nas concentrações de 1, 10 e 100 mg/dl. O metanol empregado foi de grau cromatográfico (Merck). Essas soluções foram armazenadas a -20ºC.
RP-HPLC
Empregou-se cromatógrafo líquido de alta eficiência HP 1100 (Hewlett-Packard) constituído por amostrador automático, bomba quaternária e detector UV com comprimento de onda variável selecionado em 243 nm. Para separação cromatográfica utilizou-se coluna analítica BDS-Hypersil-C18® (125 x 4 mm, 5 µm), com coluna-guarda equivalente, obtida da Agilent e mantida durante a análise a 40ºC. A fase móvel empregada foi água-acetonitrila (72:28; v/v) com vazão de 1 ml/min. A água foi obtida empregando-se o sistema Milli-Q de purificação (Millipore) e a acetonitrila foi grau cromatográfico (Merck).
Preparação das amostras
A alíquota de 1 ml de soro adicionada de 200 µl da solução de PI na concentração de 1 µg/dl foi extraída com 3 ml de éter p.a. (Merck) sob agitação mecânica em agitador tipo Vórtex por 1 min. A fase etérea foi separada sob centrifugação a 21.130 g por 20 min a 4ºC. Os extratos foram submetidos à evaporação sob fluxo de N2 em banho seco a 30ºC. Os resíduos foram ressuspendidos com 200 µl de fase móvel e filtrados com membrana Durapore® (13 mm, 0,45 µm; Millipore). Desses, 50 µl foram submetidos à análise cromatográfica.
Validação analítica
Para o estudo da linearidade foram utilizadas amostras adicionadas de cortisol na faixa de concentração de 2,5 a 60 µg/dl e avaliadas em quintuplicatas. Essas concentrações contemplam a faixa de trabalho para aplicação diagnóstica. A partir desses resultados determinou-se o limite de quantificação (LQ), que foi definido como a menor concentração, cujo coeficiente de variação (CV%) não ultrapasse 10%. A precisão intra-ensaio foi demonstrada pelo CV% médio das quintuplicatas das amostras de sete diferentes concentrações (2,5; 5; 10; 15; 25; 40; e 60 µg/dl) analisadas no mesmo dia. Para determinação do CV% médio interensaio analisaram-se três diferentes concentrações (5; 10; e 40 µg/dl) por dois dias. A exatidão do método foi verificada por análise de amostras em concentrações conhecidas (5; 10; e 40 µg/dl) e expressa em porcentagem. O procedimento de validação foi baseado em propostas da literatura para validação de métodos cromatográficos(3, 5, 6, 16, 18).
As amostras empregadas para determinação desses parâmetros foram elaboradas a partir de albumina bovina a 3% (Sigma-Aldrich) e submetidas previamente ao método proposto por RP-HPLC e à dosagem por RIE, comprovando a ausência de cortisol.
Curva de calibração
A curva de calibração para quantificação das amostras séricas foi determinada a partir das amostras adicionadas em sete concentrações diferentes (2,5; 5; 10; 15; 25; 40; e 60 µµg/dl), elaboradas a partir de albumina bovina a 3%. Essas amostras foram submetidas ao método proposto.
Amostragem
Foram utilizadas 21 amostras de soro humano obtidas por punção venosa periférica, remanescentes da rotina laboratorial de RIE no Laboratório de Esteróides da disciplina de Endocrinologia do Departamento de Medicina da Universidade Federal de São Paulo (UNIFESP). Após a centrifugação o soro foi armazenado a -20ºC até sua utilização.
Estudo comparativo com RIE
Para este estudo comparativo as amostras autênticas de soro e adicionados de concentração conhecida de cortisol, preparados em albumina bovina a 3%, foram analisadas em ambas as técnicas.
A dosagem de cortisol por RIE foi realizada utilizando-se rotina laboratorial adaptada(22). A concentração em µg/dl foi calculada com ajuda do software RIACALC (WallacOy) e os resultados foram corrigidos em função do volume inicial e da diluição das amostras.
Resultados
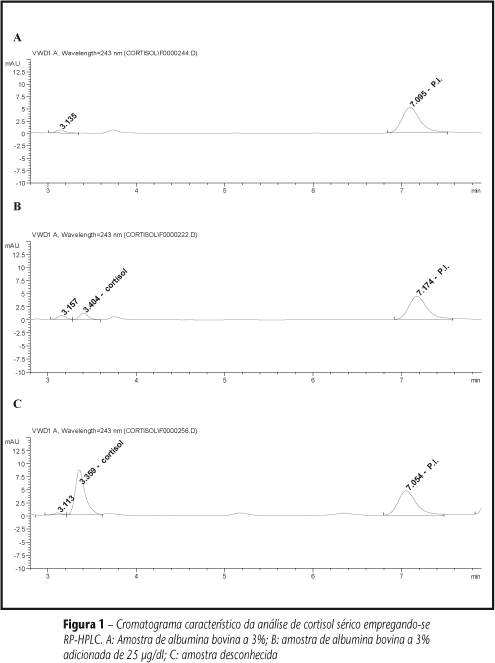
O cortisol e o PI apresentaram tempo de retenção de 3,4 e 7,1 min, respectivamente. O tempo total de análise cromatográfica foi de 15 min. A Figura 1 ilustra essa separação cromatográfica.
Observou-se linearidade na faixa de concentração estudada de 2,5 a 60 µg/dl com coeficiente de determinação (r2) de 0,9991 (Figura 2).
A Tabela 1 reúne os resultados da validação analítica obtidos no estudo de precisão e exatidão. O CV% médio intra-ensaio obtido na faixa de concentração de 2,5 a 60 µg/dl foi de 6,1%. Para a faixa de concentração compreendida entre 5 e 40,0 µg/dl o CV% médio interensaio foi de 5,6%. A exatidão do método está compreendida entre 99,8 e 103,7%.
A Tabela 2 apresenta os resultados obtidos no estudo comparativo da metodologia proposta por RP-HPLC com RIE da rotina laboratorial.
Os resultados obtidos para os adicionados de concentrações conhecidas submetidos a ambos os métodos estão agrupados na Tabela 3. A comparação dos resultados obtidos entre as duas técnicas mostra que os valores encontrados para a RP-HPLC apresentaram exatidão entre 96% e 116%, enquanto os encontrados para RIE estavam na faixa de 66% a 77%.
O RIE tem sido utilizado na rotina laboratorial para quantificação de cortisol sérico. Embora essa metodologia tenha se mostrado adequada a essa aplicação, o emprego de padrão radioativo nessa técnica implica a geração de resíduos de serviço da saúde classificados como grupo C(2).
O método proposto por RP-HPLC mostrou-se rápido e eficiente na determinação do cortisol sérico. Citação na literatura do emprego da HPLC na determinação de cortisol em plasma apresenta tempo de análise de 25 min e tempo de retenção de 21 min(12). O emprego do éter na extração garante simplicidade e baixo custo nas análises realizadas na RP-HPLC. Seu emprego na extração de esteróides é bastante citado na literatura(10, 18, 22, 25).
A exatidão obtida mostrou-se compatível com os citados na literatura, que estão compreendidos na faixa de 92% a 107%(1, 12).
Os resultados encontrados na determinação por RIE no estudo comparativo com a metodologia proposta mostraram-se superiores aos observados na determinação por RP-HPLC, com incrementos de até 68%. Essa discrepância é mais significativa quanto menor é a concentração de cortisol sérico. A porcentagem de variação média na faixa de concentração inferior a 2,5 a 29 µg/dl foi de 38%. Esses achados são compatíveis com os encontrados num estudo comparativo entre a técnica de RIE e a aplicação de HPLC na determinação do cortisol livre urinário(20), em que os autores avaliaram um número superior de amostras (n = 88). Esses autores obtiveram, na determinação por HPLC, resultados equivalentes à metade dos encontrados por RIE.
O estudo realizado com os adicionados de concentrações conhecidas revelou discrepância com os achados para a avaliação das amostras desconhecidas. Com base na possibilidade da interferência da matriz, uma vez que as amostras empregadas neste estudo foram preparadas em albumina bovina a 3%, essas amostras foram encaminhadas para o Laboratório de Pesquisa da disciplina de Nutrologia do Departamento de Pediatria para comparação dos resultados mediante o emprego do fluoroimuoensaio tempo-resolvido. Foram utilizados kits DELFIA® Immunoassay Kit com leitura pelo leitor de placas Victor 3 (Perkin Elmer). Esta técnica apresentou exatidão de 83% a 100% na faixa de concentração estudada, corroborando os achados para RP-HPLC.
Embora a HPLC ainda não esteja amplamente difundido em laboratórios de análises clínicas, atualmente é uma tecnologia fundamental na fase preparativa, principalmente em laboratório de hormônios esteróides, bem como vem se tornando método de referência para algumas análises da rotina laboratorial. Laboratórios conceituados já disponibilizam dosagens de cortisol sérico/plasmático empregando HPLC, cujo valor de referência é de 2 a 25 µg/dl(11, 14), faixa contemplada nesse estudo que dispensa o alto investimento do detector de espectrometria de massas. Contudo observa-se crescente avanço no emprego de cromatografia líquida com migração tecnológica em função da alta especificidade, presteza, sensibilidade e baixa geração de resíduos químicos, sugerindo a indicação principalmente acoplada à espectrometria de massas (LC-MS ou LC-MS-MS) como técnica de referência (padrão-ouro) para análise de outros esteróides, cujos níveis de interesse clínico em fluidos biológicos são inferiores aos do cortisol.
Conclusão
Pelo método proposto foi possível reduzir significativamente o tempo de análise em relação àquele empregado na dosagem por RIE. A RP-HLPC ainda proporciona a eliminação da geração de resíduos radioativos (grupo C), conforme objetiva a Resolução da Diretoria Colegiada (RDC) nº 306(2).
Agradecimentos
Ao apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (nº 478243/2004-9); à professora-doutora Olga Maria Silvério Amâncio, do Laboratório de Pesquisa da disciplina de Nutrologia do Departamento de Pediatria, pela realização do fluoroimunoensaio.
Primeira submissão em 04/01/08
Última submissão em 16/10/08
Aceito para publicação em 20/10/08
Publicado em 20/10/08
Apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (nº 478243/2004-9).
- 1. ABURUZ, S. et al. Simple liquid chromatography method for the rapid simultaneous determination of prednisolone and cortisol in plasma and urine using hydrophilic lipophilic balaneed solid phase extraction cartriges. J Chromatogr B, v. 798, p. 193-201, 2003.
-
2ANVISA - Agência Nacional de Vigilância Sanitária. Resolução 306, de 7 de dezembro de 2004. Diário Oficial da União Disponível em: <http:// www.anvisa.gov.br>. Acesso em: 15 jan. 2005.
-
3ANVISA - Agência Nacional de Vigilância Sanitária. Resolução 899, de 29 de maio de 2003. Diário Oficial da União Disponível em: <http:// www.anvisa.gov.br>. Acesso em: 16 jan. 2004.
- 4. CASTRO, M.; MOREIRA, A. C. Análise crítica do cortisol salivar na avaliação do eixo hipotálamo-hipófise-adrenal. Arq Bras Endocrinol Metab, v. 47, n. 4, p. 358-67, 2003.
- 5. CHASIN, A. A. M. et al. Validação de métodos em análises toxicológicas: uma abordagem geral. Rev Bras Toxicol, v. 11, n. 1, p. 1-6, 1998.
- 6. CHASIN, A. M.; CHASIN, M.; SALVBADORI, M. C. Validação de métodos cromatográficos em análises toxicológicas. Rev Farm Bioquim Univ São Paulo, v. 30, n. 2, p. 49-53, 1994.
- 7. CHING, S. Y. et al Urine free cortisol analysis by autoamated immunoassay and high-performance liquid chromatography for the investigation of Cushing's syndrome. Ann Clin Biochem, v. 43, p. 402-7, 2006.
- 8. CHRIST-CRAIN, M. et al. Measurement of serum free cortisol shows discordant responsivity to stress and dynamic evaluation. J Clin Endocrinol Metab, 2007 (epub ahead of print).
- 9. COHEN, J. et al. Variability of cortisol assays can confound the diagnosis of adrenal insufficiency in the critically ill population. Intensive Care Med, v. 32, n. 11, p. 1901-5, 2006.
- 10. FERNANDES, V. T. et al. Reversed-phase high-performance liquid chromatography separation of adrenal steroids prior to radiimmunoassay: aplication in cogenital adrenal hyperplasia. J Choromatogr Sci, v. 41, p. 251-3, 2003.
-
11FLEURY. Manual de coleta Disponível em: <http://www.fleury.com.br/Sist/manual_exames /Pages/Coleta.aspx?usuario=medico>. Acesso em: 07 dez. 2007.
- 12. HU, Z. et al. Simultaneous determination of 6β -hydroxycortisol and cortisol in human urine and plasma by liquid chromatography with ultraviolet absorbance detection for phenotyping the CYP3A activity. J Chromatogr B, v. 826, p. 238-43, 2005.
- 13. LIN, C. et al. Urinary free cortisol and cortisone determined by high performance liquid chromatography in the diagnosis of Cushing's syndrome. J Clin Endocrinol Metab, v. 82, n. 1, p. 151-5, 1997.
- 14. MAYO CLINIC. Catalog Disponível em: <http://www.testcatalog.org/nrr/Catalogs/ mcts/Catalog/TestDetail.aspx?id=25516>. Acesso em: 7 dez. 2007.
- 15. MAYO CLINIC. Catalog Disponível em: http://www.testcatalog.org/nrr/Catalogs/ mcts/Catalog/TestDetail.aspx?id=25514 Acesso em: 7 dez. 2007.
- 16. PINTO, T. J. A.; FERRARINI, M; GATTI, R. M. Proposta de roteiro prático para a validação de métodos analíticos. Farm Quim, v. 36, n. 1, p. 26-36, 2003.
- 17. ROLLIN, G. A. F. S.; CCEPIELEWSKI, M. A. Síndrome de Cushing: é possível simplificar e padronizar sua abordagem diagnóstica? Arq Bras Endocrinol Metab, v. 47, n. 4, p. 368-80, 2003.
- 18. SUGAWARA, E. K. et al. Aplicação da cromatografia líquida de alta eficiência para quantificação direta da 17α -hidroxiprogesterona sérica. Rev Bras Cien Farm, v. 40, n. 3, p. 327-33, 2004.
- 19. TAYLOR, R. L.; MACHACEK, D.; SINGH, R. J. Validation of a high-throughput liquid chromatography-tandem mass spectrometry method for urinary cortisol and cortisone. Clin Chem, v. 48, n. 9, p. 1511-9, 2002.
- 20. TURPEINEN, U. et al. Determination of urinary free cortisol by HPLC. Clin Chem, v. 43, n. 8, p. 1386-91, 1997.
- 21. TURPEINEN, U.; STENMAN, U. H. Determination of urinary free cortisol by liquid chromatography-tandem mass spectrometry. Scand J Clin Lab Invest, v. 63, n. 2, p. 143-50, 2003.
- 22. VIEIRA, J. G. H. et al. Método radioimunológico para dosagem do cortisol sérico. Rev Bras Patol Clin, v. 15, n. 3, p. 125-30, 1979.
- 23. VIEIRA, J. G. H. et al. Valores falsamente elevados em ensaios diretos para a medida de hormônios esteróides no soro. J Bras Patol, v. 35, p. 71-4, 1999.
- 24. VOGESER, M.; MOHNIE, P.; BRIEGEL, J. Free serum cortisol: quantification applying equilibrium dialysis or ultrafiltration and an automated immunoassay system. Clin Chem Lab Med, v. 45, n. 4, p. 521-5, 2007.
- 25. WEI, J. Q. et al. Isocratic reversed phase high performance liquid chromatography determination of twelve natural corticosteroids in serum with on line ultraviololet and fluorescence detection. Biomed Chromatogr, v. 4, n. 4, p. 161-4, 1990.
Endereço para correspondência
Datas de Publicação
-
Publicação nesta coleção
27 Mar 2009 -
Data do Fascículo
Out 2008
Histórico
-
Aceito
20 Out 2008 -
Recebido
04 Jan 2008