Resumo
Contexto
O clampeamento aórtico e a oclusão da aorta com balão poderiam levar a lesões na parede aórtica.
Objetivo
O objetivo deste estudo foi verificar as alterações da parede aórtica relacionadas ao método de interrupção de fluxo (cample ou balão) em diferentes técnicas disponíveis para cirurgia de aorta.
Métodos
Os experimentos foram realizados em 40 porcos fêmeas pesando de 25-30 kg, alocados para quatro grupos: S (n = 10), nenhuma intervenção (sham); C (n = 10), laparotomia mediana transperitoneal para acesso à aorta abdominal infrarrenal com tempo de clampeamento de 60 minutos; L (n = 10), cirurgia laparoscópica da aorta abdominal infrarrenal com tempo de clampeamento de 60 minutos; EV (n = 10), controle aórtico proximal com inserção de cateter-balão para oclusão aórtica por acesso femoral, inflado a fim de promover oclusão aórtica contínua por 60 minutos. Após a eutanásia, as aortas foram removidas e seccionadas para obtenção de espécimes histológicos destinados a análises morfométricas e por microscopia de luz. Os fragmentos longitudinais restantes foram estirados até a ruptura, e determinaram-se padrões mecânicos.
Resultados
Observou-se redução do limite de proporcionalidade da aorta abdominal, diminuição da rigidez e da carga de ruptura nos grupos submetidos a campleamento aórtico (C e L) em comparação ao grupo EV.
Conclusões
O campleamento aórtico durante cirurgia aberta ou laparoscópica pode afetar as propriedades mecânicas da aorta, ocasionando redução de resistência da parede aórtica sem desencadear alterações na estrutura histológica da parede aórtica.
Palavras-chave:
aorta abdominal; resistência à tração; estresse mecânico; dispositivos de oclusão vascular
Abstract
Background
Aortic cross-clamping and balloon occlusion of the aorta could lead to damage to the aorta wall.
Objective
The aim of this study was to investigate changes to the aorta wall related to the method used to interrupt flow (clamping or balloon) in the different techniques available for aortic surgery.
Methods
Experiments were performed on 40 female pigs, weighing 25-30kg, which were randomly allocated to 4 study groups: S (n=10), no intervention (sham group); C (n=10), midline transperitoneal laparotomy for infrarenal abdominal aortic access with 60 min of cross-clamping; L (n=10), laparoscopic infrarenal abdominal aortic surgery with 60 min of cross-clamping; EV (n=10), remote proximal aortic control with transfemoral arterial insertion of aortic occlusion balloon catheter, inflated to provide continued aortic occlusion for 60min. After euthanasia, the aortas were removed and cross-sectioned to obtain histological specimens for light microscopic and morphometric analyses. The remaining longitudinal segments were stretched to rupture and mechanical parameters were determined.
Results
We observed a reduction in the yield point of the abdominal aorta, decrease in stiffness and in failure load in the aortic cross-clamping groups (C and L) compared with the EV group.
Conclusions
Aortic cross-clamping during open or laparoscopic surgery can affect the mechanical properties of the aorta leading to decrease in resistance of the aorta wall, without structural changes in aorta wall histology.
Keywords:
abdominal aorta; tensile strength; mechanical stress; vascular closure devices
INTRODUÇÃO
A escolha da via cirúrgica mais adequada para a correção do aneurisma de aorta abdominal (AAA) infrarrenal envolve análise do risco cirúrgico, comorbidades, morfologia do AAA, expectativa de vida do paciente, experiência da equipe cirúrgica com a técnica, e evidências científicas de cada técnica. As estratégias atuais disponíveis para o tratamento dessa doença incluem cirurgia aberta convencional, cirurgia videolaparoscópica e tratamento endovascular11 Coscas R, Maumias T, Capdevila C, Javerliat I, Goëau-Brissonnière O, Coggia M. Mini-invasive treatment of abdominal aneurysms: current roles of endovascular, laparoscopic and open techniques. Ann Vasc Surg. 2014;28(1):123-31. http://dx.doi.org/10.1016/j.avsg.2013.05.007. PMid:24200131.
http://dx.doi.org/10.1016/j.avsg.2013.05...
2 Pascarella L, Aboul Hosn M. Minimally invasive management of severe aortoiliac occlusive disease. J Laparoendosc Adv Surg Tech A. 2018;28(5):562-8. http://dx.doi.org/10.1089/lap.2017.0675. PMid:29346011.
http://dx.doi.org/10.1089/lap.2017.0675...
3 Ahmed N, Gollop ND, Ellis J, Khan OA. How does elective laparoscopic aortic aneurysm repair compare to endovascular aneurysm repair? Interact Cardiovasc Thorac Surg. 2014;18(6):814-20. http://dx.doi.org/10.1093/icvts/ivu031. PMid:24578481.
http://dx.doi.org/10.1093/icvts/ivu031...
-44 Robertson L, Nandhra S. Laparoscopic surgey for elective abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2017;5:CD012302.. Apesar do entusiasmo inicial com a cirurgia aórtica laparoscópica, essa técnica não obteve ampla aceitação em cirurgia vascular, em decorrência dos desafios inerentes ao procedimento e da extensa curva de aprendizado, ficando seu uso restrito a poucos centros especializados22 Pascarella L, Aboul Hosn M. Minimally invasive management of severe aortoiliac occlusive disease. J Laparoendosc Adv Surg Tech A. 2018;28(5):562-8. http://dx.doi.org/10.1089/lap.2017.0675. PMid:29346011.
http://dx.doi.org/10.1089/lap.2017.0675...
,33 Ahmed N, Gollop ND, Ellis J, Khan OA. How does elective laparoscopic aortic aneurysm repair compare to endovascular aneurysm repair? Interact Cardiovasc Thorac Surg. 2014;18(6):814-20. http://dx.doi.org/10.1093/icvts/ivu031. PMid:24578481.
http://dx.doi.org/10.1093/icvts/ivu031...
. Existem evidências que sugerem que a cirurgia laparoscópica eletiva para a correção do AAA apresente invasividade comparável à da cirurgia endovascular (EVAR), com as vantagens de menor taxa de conversão, e similar morbimortalidade, além de ser opção minimamente invasiva para o tratamento dos pacientes com anatomia desfavorável para EVAR11 Coscas R, Maumias T, Capdevila C, Javerliat I, Goëau-Brissonnière O, Coggia M. Mini-invasive treatment of abdominal aneurysms: current roles of endovascular, laparoscopic and open techniques. Ann Vasc Surg. 2014;28(1):123-31. http://dx.doi.org/10.1016/j.avsg.2013.05.007. PMid:24200131.
http://dx.doi.org/10.1016/j.avsg.2013.05...
,33 Ahmed N, Gollop ND, Ellis J, Khan OA. How does elective laparoscopic aortic aneurysm repair compare to endovascular aneurysm repair? Interact Cardiovasc Thorac Surg. 2014;18(6):814-20. http://dx.doi.org/10.1093/icvts/ivu031. PMid:24578481.
http://dx.doi.org/10.1093/icvts/ivu031...
,44 Robertson L, Nandhra S. Laparoscopic surgey for elective abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2017;5:CD012302..
Nas cirurgias aberta convencional e laparoscópica, é necessário o posicionamento de pinças hemostáticas (clampes atraumáticos) para interrupção de fluxo e refluxo. Porém, apesar de ditos “atraumáticos”, esses clampes são responsáveis por lesões agudas na parede arterial. O grau de lesão parece ser dependente da pressão aplicada pelo clampe e do tempo de clampeamento, e varia desde distorção da íntima até completo desarranjo da camada média do vaso, com enfraquecimento da parede arterial, hiperplasia intimal e reestenose55 Slayback JB, Bowen WW, Hinshaw DB. Intimal injury from arterial clamps. Am J Surg. 1976;132(2):183-7. http://dx.doi.org/10.1016/0002-9610(76)90045-3. PMid:952348.
http://dx.doi.org/10.1016/0002-9610(76)9...
. Margovsky et al.66 Margovsky AI, Lord RSA, Meek AC, Bobryshev YV. Artery wall damage and platelet uptake from so-called atraumatic arterial clamps: an experimental study. Cardiovasc Surg. 1997;5(1):42-7. http://dx.doi.org/10.1016/S0967-2109(96)00064-6. PMid:9158122.
http://dx.doi.org/10.1016/S0967-2109(96)...
observaram formação de cavidades na camada média, sendo essa alteração conhecida como necrose cística da média e encontrada em processos degenerativos da aorta como dissecções aórticas, aneurismas degenerativos e envelhecimento77 Borges LF, Gutierrez PS, Marana HR, Taboga SR. Picrosirius polarization staining method as an efficient histopathological tool for collagenolysis detection in vesical prolapse lesions. Micron. 2007;38(6):580-3. http://dx.doi.org/10.1016/j.micron.2006.10.005. PMid:17126553.
http://dx.doi.org/10.1016/j.micron.2006....
,88 Jaldin RG, Castardelli É, Perobelli JE, et al. Morphologic and biomechanical changes of thoracic and abdominal aorta in a rat model of cigarette smoke exposure. Ann Vasc Surg. 2013;27(6):791-800. http://dx.doi.org/10.1016/j.avsg.2013.03.002. PMid:23880458.
http://dx.doi.org/10.1016/j.avsg.2013.03...
. Loh et al.99 Loh CS, Al-Jafari MS, Croton R. Acute rupture of the abdominal aorta from cross-clamp injury. Eur J Vasc Surg. 1990;4(6):647-8. http://dx.doi.org/10.1016/S0950-821X(05)80824-2. PMid:2279578.
http://dx.doi.org/10.1016/S0950-821X(05)...
descreveram rotura aguda da aorta abdominal provocada pelo clampeamento, documentando lesão parietal isquêmica localizada que provocou enfraquecimento da integridade estrutural da aorta. Por outro lado, observou-se que, apesar de o clampeamento provocar alterações morfológicas1010 Chen HY, Navia JA, Shafique S, Kassab GS. Fluid-structure interaction in aortic cross-clampig:implications for vessel injury. J Biomech. 2010;43(2):221-7. http://dx.doi.org/10.1016/j.jbiomech.2009.08.042. PMid:19883917.
http://dx.doi.org/10.1016/j.jbiomech.200...
, não houve alteração significativa das propriedades mecânicas da parede arterial em longo prazo1111 Dobrin PB, McGurrin JF, McNulty JA. Chronic histologic changes after vascular clamping are not associated with altered vascular mechanics. Ann Vasc Surg. 1992;6(2):153-9. http://dx.doi.org/10.1007/BF02042737. PMid:1599834.
http://dx.doi.org/10.1007/BF02042737...
. Entretanto, faltam estudos que correlacionem as alterações agudas provocadas pelo clampeamento aórtico com as alterações mecânicas da sua parede.
Apesar de não haver clampeamento aórtico durante o tratamento endovascular de rotina, há oclusão temporária do fluxo aórtico pelos dispositivos de liberação das endopróteses e pela insuflação do balão de acomodação após liberação do dispositivo1212 Thompson MM, Nasim A, Sayers RD, et al. Oxygen free radical and cytokine generation during endovascular and conventional aneurysm repair. Eur J Vasc Endovasc Surg. 1996;12(1):70-5. http://dx.doi.org/10.1016/S1078-5884(96)80278-4. PMid:8696901.
http://dx.doi.org/10.1016/S1078-5884(96)...
,1313 Malina M, Veith F, Ivancev K, Sonesson B. Balloon occlusion of the aorta during endovascular repair of ruptured abdominal aortic aneurysm. J Endovasc Ther. 2005;12(5):556-9. http://dx.doi.org/10.1583/05-1587.1. PMid:16212455.
http://dx.doi.org/10.1583/05-1587.1...
. O efeito negativo do sobredimensionamento da endoprótese sobre as propriedades mecânicas da parede aórtica já foi estudado1414 Sincos IR, Aun R, Silva ES, et al. Impact of stent-graft oversizing on the thoracic aorta: experimental study in a porcine model. J Endovasc Ther. 2011;18(4):576-84. http://dx.doi.org/10.1583/11-3470.1. PMid:21861750.
http://dx.doi.org/10.1583/11-3470.1...
. Existem cenários clínicos que necessitam insuflação prolongada do balão sem os efeitos do contato da endoprótese sobre a parede arterial – por exemplo na oclusão ressuscitativa por balão Endovascular da aorta (resuscitative endovascular balloon occlusion of the aorta, REBOA), utilizada no tratamento das roturas aórticas ou de complicações durante o procedimento1313 Malina M, Veith F, Ivancev K, Sonesson B. Balloon occlusion of the aorta during endovascular repair of ruptured abdominal aortic aneurysm. J Endovasc Ther. 2005;12(5):556-9. http://dx.doi.org/10.1583/05-1587.1. PMid:16212455.
http://dx.doi.org/10.1583/05-1587.1...
,1515 Matsuda H, Tanaka Y, Hino Y, et al. Transbrachial arterial insertion of aortic occlusion balloon catheter in patients with shock from ruptured abdominal aortic aneurysm. J Vasc Surg. 2003;38(6):1293-6. http://dx.doi.org/10.1016/S0741-5214(03)00774-2. PMid:14681630.
http://dx.doi.org/10.1016/S0741-5214(03)...
. As lesões provocadas pela insuflação de balão intraluminal incluem desde danos ao endotélio (abrasão e dissecção) até necrose da camada média, interferindo mormente na função dos componentes da matriz extracelular1616 Batchelor WB, Robinson R, Strauss BH. The extracellular matrix in balloon arterial injury: a novel target for restenosis prevention. Prog Cardiovasc Dis. 1998;41(1):35-49. http://dx.doi.org/10.1016/S0033-0620(98)80021-2. PMid:9717858.
http://dx.doi.org/10.1016/S0033-0620(98)...
. Keris et al.1717 Keris V, Ozolanta I, Enina G, Kasyanovs V, Aide H, Bricis R. Biomechanical and structure assessment of transluminal angioplasty. Med Eng Phys. 1998;20(5):339-46. http://dx.doi.org/10.1016/S1350-4533(98)00032-0. PMid:9773687.
http://dx.doi.org/10.1016/S1350-4533(98)...
observaram, em segmentos arteriais submetidos a angioplastia com balão, a redução do módulo elástico tangencial da parede arterial na direção circunferencial, o que poderia predispor ao aumento do diâmetro do vaso quando submetido a condições normais de pressão arterial.
Embora haja aparente benefício nos métodos menos invasivos sobre as repercussões sistêmicas do trauma cirúrgico convencional, são necessários estudos que elucidem as respostas fisiopatológicas do organismo após abordagem cirúrgica aberta, endovascular ou videolaparoscópica da aorta33 Ahmed N, Gollop ND, Ellis J, Khan OA. How does elective laparoscopic aortic aneurysm repair compare to endovascular aneurysm repair? Interact Cardiovasc Thorac Surg. 2014;18(6):814-20. http://dx.doi.org/10.1093/icvts/ivu031. PMid:24578481.
http://dx.doi.org/10.1093/icvts/ivu031...
. O objetivo deste estudo foi avaliar comparativamente as alterações estruturais e biomecânicas da parede aórtica provocadas pelos métodos de interrupção temporária de fluxo aórtico, dependendo do acesso cirúrgico utilizado para a abordagem da aorta.
MATERIAIS E MÉTODOS
Foi feito estudo experimental prospectivo e randomizado. Este estudo seguiu os preceitos do Guide for care and use of laboratory animals e foi aprovado pelo Comitê de Ética em Experimentação Animal da Instituição (protocolo 899-2011). Foram usados porcos fêmeas, cruzamento das raças Large White e Landrace, com peso entre 25 e 30 kg. Após um período de adaptação de 5 a 10 dias, os animais foram aleatoriamente divididos por sorteio simples em três grupos experimentais, com 10 animais cada: Grupo C (cirurgia aberta), Grupo L (videolaparoscopia) e Grupo EV (endovascular). Além desses grupos, foi constituído um grupo suplementar, denominado de Grupo S (Sham), composto por 10 animais que tiveram a mesma procedência e a faixa de peso preestabelecida, mas os espécimes de aorta foram retirados pela equipe de estudo logo após o abate no frigorífico de destino do produtor. Esse grupo serviu de padrão de normalidade dos parâmetros biomecânicos e histológicos.
Procedimentos de anestesia
Os animais foram submetidos a um período de 8 horas de jejum pré-operatório. A medicação pré-anestésica adotada consistiu em uma combinação de 0,1 mg/kg de acepromazina 1%, 8 mg/kg de cetamina, 0,5 mg/kg de xilazina e 0,5 mg/kg de morfina por via intramuscular. Após 15 minutos da medicação pré-anestésica, a veia central da orelha foi canulada para que se fizesse a indução anestésica por administração de 2 mg/kg de cetamina e 2 mg/kg de diazepan. O animal era então colocado em posição pronada na mesa cirúrgica para intubação orotraqueal. A manutenção anestésica foi realizada com isofluorano na taxa de 5-10 mL/kg/min. A ventilação mecânica foi efetuada com volume corrente de 12-15 mL/kg de oxigênio, à razão de 10 a 12 movimentos respiratórios/min, para manter a pressão expiratória de gás carbônico entre 35 e 45 mmHg. A hidratação basal foi realizada com solução de Ringer lactato infundida a 5 mL/kg/h em bomba de infusão intravenosa e completada com a infusão de soro fisiológico 0,9% de acordo com a necessidade hemodinâmica identificada pelo anestesiologista veterinário ao longo do procedimento. A monitorização intraoperatória consistiu em oximetria de pulso por sensor localizado na língua do animal, termômetro transretal para aferição da temperatura corporal, e monitorização invasiva da pressão arterial por meio de acesso carotídeo, onde foi realizado cateterismo arterial com introdutor 6F de 11 cm.
Procedimentos cirúrgicos
Grupo C: Os animais foram posicionados na mesa cirúrgica em decúbito dorsal horizontal. Após antissepsia e delimitação do campo cirúrgico, procedeu-se à laparotomia mediana xifopúbica e à exposição da aorta por via transperitoneal. A exposição da aorta infrarrenal fez-se a partir do cruzamento com a veia renal esquerda e da identificação da origem das artérias renais e da bifurcação aórtica. A seguir, foi posicionada pinça hemostática atraumática de De Bakey na aorta infrarrenal para interrupção do fluxo aórtico pelo período de 60 minutos.
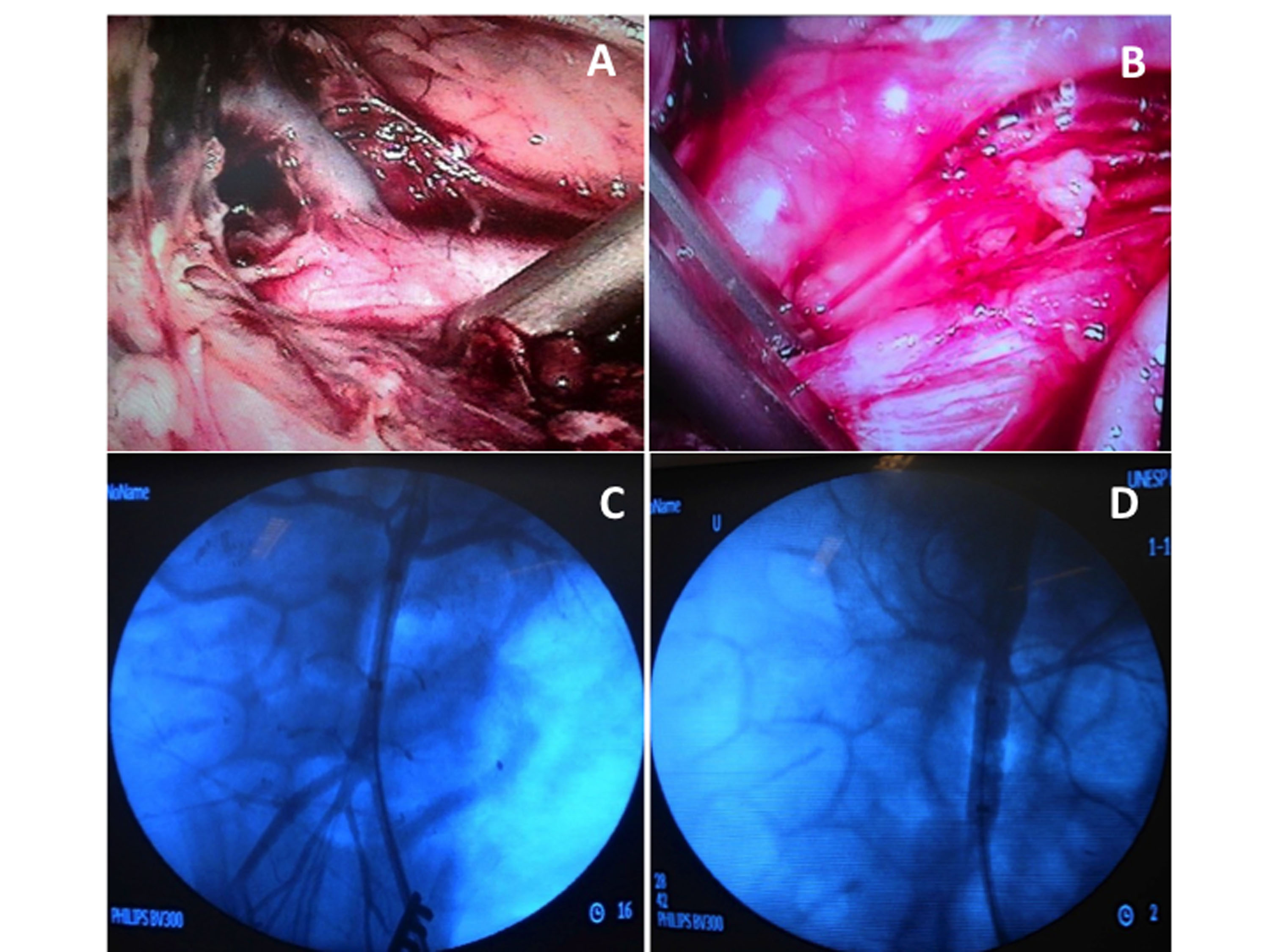
Grupo L: Os animais foram posicionados na mesa cirúrgica em decúbito lateral direito. Realizou-se a aplicação da solução antisséptica e delimitação do campo cirúrgico. O pneumoperitônio foi iniciado por meio de punção percutânea com agulha de Veress. Após a realização de pneumoperitônio com CO2 com pressão de 16 mmHg, um trocarte de 11 mm foi posicionado lateralmente à cicatriz umbilical para a introdução da lente óptica de 30°. Após o reestabelecimento da pressão de 12 mmHg, dois outros trocartes de 11 mm foram posicionados lateralmente à linha média, acima e abaixo da linha do umbigo. Outros três trocartes de 11 mm foram posicionados ao longo do lado esquerdo da parede abdominal, tendo por referência o rebordo costal, a linha axilar média, o músculo grande dorsal e a crista ilíaca. A exposição da aorta iniciou-se por meio da mobilização medial do cólon esquerdo, do rim esquerdo e da flexura esplênica, utilizando-se de pinças laparoscópicas do tipo graspers, tesouras e bisturi harmônico (Ultracision®, Johnson & Johnson®). Após completada a dissecção da aorta abdominal, uma pinça aórtica hemostática laparoscópica (Storz®) foi posicionada imediatamente abaixo da artéria renal esquerda para interrupção do fluxo aórtico pelo periodo de 60 minutos (Figura 1).
Local de interrupção de fluxo aórtico nas técnicas minimamente invasivas. (A) Dissecção laparoscópica e identificação da artéria renal esquerda; (B) Posicionamento de pinça hemostattica laparoscópica; (C) Aortografia para identificação da emergência das artérias renais; (D) Aortografia com balão insuflado.
Grupo EV: Os animais foram posicionados na mesa cirúrgica em decúbito dorsal horizontal. Após a antissepsia da região inguinal, foi delimitado o campo cirúrgico. Por meio de inguinotomia oblíqua, a artéria femoral comum esquerda foi acessada. Sob visão direta, realizou-se a punção da artéria femoral comum com agulha de corpo único de 21G e passado guia metálico rígido ponta “J”, permitindo cateterismo arterial com introdutor 6F de 11 cm pela técnica de Seldinger. Após a progressão de fio guia hidrofílico 0,035” Roadrunner (Cook Medical®) de 260 cm até a aorta infrarrenal, guiada por radioscopia (Arco Cirúrgico Phillips®, modelo BV 300, EUA), foi introduzido cateter angiográfico de Pig Tail 5F (Cook Medical®) para realização de aortografia, mediante injeção de 20 mL de contraste não iônico Optiray®, com delimitação das artérias renais por road mapping. Foram realizadas aortografias pré e pós-insuflação do balão, totalizando 40 mL de contraste. O cateter angiográfico, após retirada do introdutor e hemostasia por compressão manual, foi substituído por cateter-balão complacente de 32 mm de diâmetro para oclusão aórtica (Coda Balloon Catheter®, Cook Medical®, USA). O cateter angiográfico foi então introduzido pelo acesso carotídeo. Após o balão ser posicionado logo abaixo da origem das artérias renais, foi insuflado até interrupção total do fluxo – utilizando-se 15 mL de solução de contraste ao meio –, com controle angiográfico, e mantido pelo período de 60 minutos (Figura 1).
Protocolo experimental
Todos os procedimentos cirúrgicos foram executados pela mesma equipe e seguindo a mesma sequência experimental. Precedendo-se ao clampeamento aórtico, foi realizada administração endovenosa de heparina sódica na dose de 100 UI/kg em todos os grupos. Em todos os grupos, o período de interrupção de fluxo aórtico adotado foi de 60 minutos. Após esse período, os animais foram eutanaziados por overdose de anestésicos e realizou-se laparotomia mediana para acesso à aorta e coleta de material de estudo. Foram coletados segmentos de aorta abdominal de aproximadamente 5 mm de extensão no sítio de clampeamento/balonamento de cinco animais por grupo, incluindo-se o local onde o clampe/balão foi posicionado, sendo em seguida fixados em formalina tamponada a 10%, para posterior estudo histológico. Os outros cinco animais de cada grupo forneceram amostras de aortas suínas de aproximadamente 3 cm (sendo 1 cm suprarrenal e 2 cm infrarrenal para incluir a área de interrupção de fluxo), as quais foram destinadas ao ensaio de tração.
Histologia
Os segmentos de aorta coletados e conservados em formol foram processados em Autotécnico Leica TP102 e montados em blocos de parafina em equipamento Leica EG 1160. Posteriormente, foram realizados cortes seriados de aproximadamente 5 µm em micrótomo Leica RM 2155, os quais foram colocados em lâminas de vidro e corados pelas técnicas de hematoxilina e eosina (H&E) e Picrosirius Red, para colágeno, e de Verhoeff, para avaliação das fibras elásticas da parede aórtica. Foram verificadas as alterações gerais da parede vascular como perda da arquitetura lamelar, redução das células musculares lisas, infiltrado celular mononuclear, desorganização das fibras colágenas, intensidade de coloração pelo Picrosirius, e redução ou fragmentação das fibras elásticas.
Ensaio biomecânico
Os segmentos da aorta abdominal, incluindo as porções imediatamente acima e imediatamente abaixo do local de interrupção de fluxo, foram submetidos a ensaio destrutivo de tração uniaxial de acordo com o método utilizado previamente88 Jaldin RG, Castardelli É, Perobelli JE, et al. Morphologic and biomechanical changes of thoracic and abdominal aorta in a rat model of cigarette smoke exposure. Ann Vasc Surg. 2013;27(6):791-800. http://dx.doi.org/10.1016/j.avsg.2013.03.002. PMid:23880458.
http://dx.doi.org/10.1016/j.avsg.2013.03...
,1818 Bertanha M, Moroz A, Jaldin RG, et al. Morphofunctional characterization of decellularized vena cava as tissue engineering scaffolds. Exp Cell Res. 2014;326(1):103-11. http://dx.doi.org/10.1016/j.yexcr.2014.05.023. PMid:24929113.
http://dx.doi.org/10.1016/j.yexcr.2014.0...
19 Cerqueira NF, Yoshida WB, Müller SS, Sequeira JL, Rodrigues AC, Padovani CR. Morphological and biomechanical study of abdominal aorta of rats submitted to experimental chronic alcoholism. Acta Cir Bras. 2005;20(3):213-8. http://dx.doi.org/10.1590/S0102-86502005000300004. PMid:16033179.
http://dx.doi.org/10.1590/S0102-86502005...
-2020 Yoshida WB, Müller SS, Carvalho I, Fabris VE, Naresse LE, Maffei FHA. Tensile strengthand histological changes of abdominal aorta of malnourished rats. Cardiovasc Surg. 1995;3(4):437-9. http://dx.doi.org/10.1016/0967-2109(95)94165-S. PMid:7583001.
http://dx.doi.org/10.1016/0967-2109(95)9...
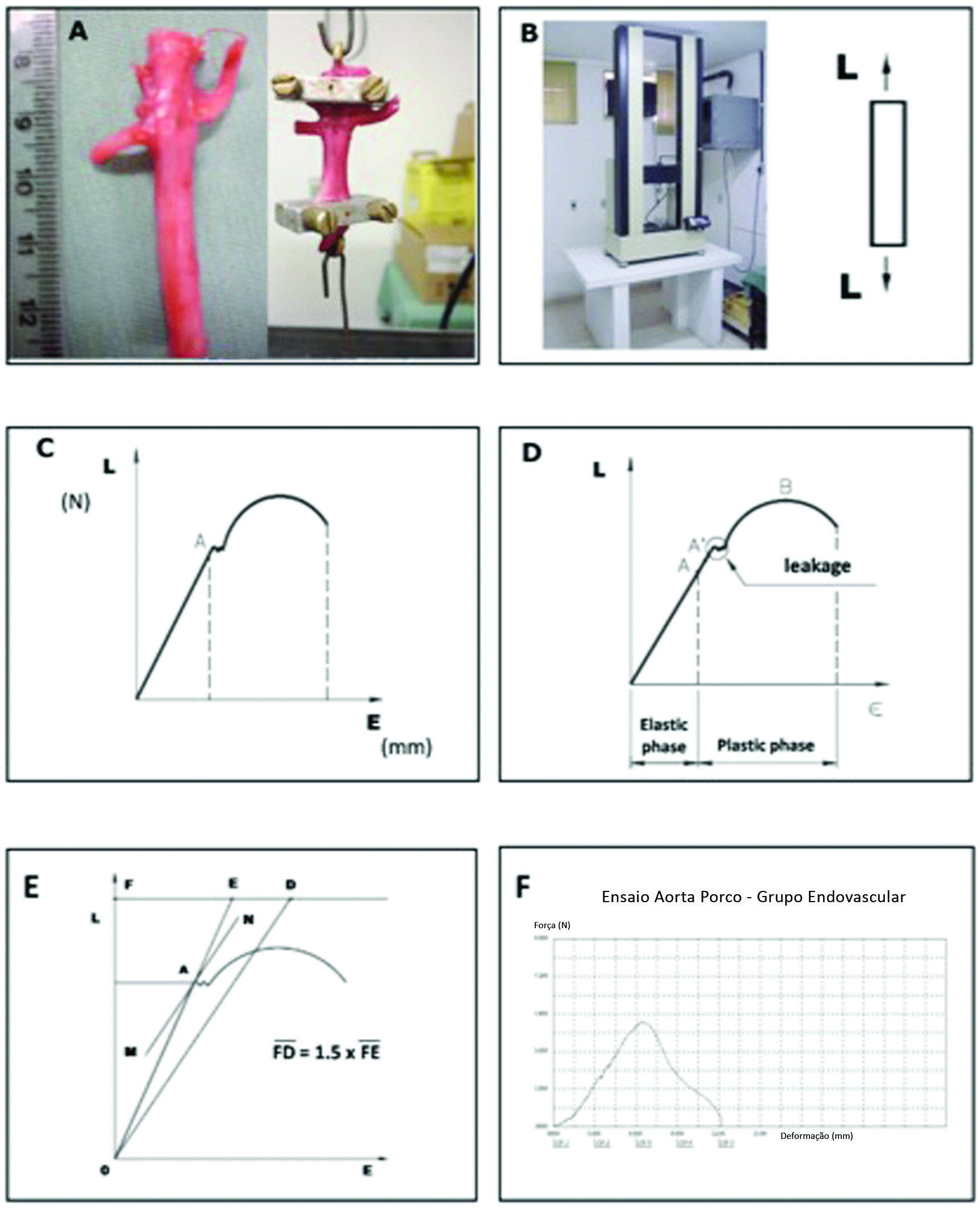
para avaliação de propriedades mecânicas. As extremidades de cada segmento estudado foram fixadas às presilhas da máquina, placas de metal liso não cortante, permitindo o estiramento longitudinal do segmento aórtico. A velocidade adotada para a aplicação da tração foi de 30 mm/min. O equipamento utilizado foi a Máquina Universal de Ensaios Mecânicos EMIC®, modelo DL 10.000 (Equipments and Testing Systems, Ltd., Curitiba, PR, Brasil), que tem sistema com precisão em torno de 0,018+F/3700 KN, apurada pelas especificações da Associação Brasileira de Normas Técnicas (ABNT) NBR6156 e NBR6674. A máquina opera em conjunto com um microcomputador sob o sistema operacional Windows 98®, utilizando o programa Mtest 1.00. O programa fornece ao final do ensaio valores das propriedades mecânicas escolhidas pelo usuário, além do diagrama de carga versus deformação. Esses diagramas possibilitaram a obtenção dos seguintes parâmetros (Figura 2): Limite de proporcionalidade (N): valor máximo de carga em que o material guarda a capacidade de retornar ao seu comprimento original quando interrompido o carregamento; graficamente, corresponde ao valor máximo de tensão de uma função linear na curva carga-deformação, ainda obedecendo à Lei de Hooke, calculado pelo método de Johnson; Coeficiente de rigidez (N/mm): divisão da força (N) pela deformação (mm) correspondentes ao limite elástico; por se tratar de uma relação numérica linear e constante, representa a capacidade de deformação do material conforme a carga aplicada; e Carga máxima – força de rotura (N): maior carga suportada pelo material até a ruptura, ou seja, o limite de resistência.
Modelo matemático utilizado para o ensaio de tração da aorta. (A) Segmento de aorta abrangendo a área de clampeamento, fixada nas presilhas do aparelho; (B) Máquina Universal de Ensaios Mecânicos do Laboratório de Ensaios Biomecânicos do Laboratório de Técnica Cirúrgica e Cirurgia Experimental e o vetor de força uniaxial aplicado na amostra; (C) Diagrama de carga versus deformação; (D) Apresentação das fases elástica e plástica no diagrama; (E) Limite de elasticidade calculado pelo método de Johnson; (F) Exemplo de gráfico obtido no ensaio.
Avaliação estatística
O tamanho amostral de 10 animais por grupo experimental foi calculado com suporte do Escritório de Apoio à Pesquisa da instituição, bem como com base nos estudos experimentais de cirurgia aórtica em modelos suínos2121 Suk P, Cundrle I Jr, Hruda J, et al. Porcine model of ruptured abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg. 2012;43(6):698-704. http://dx.doi.org/10.1016/j.ejvs.2012.02.020. PMid:22421373.
http://dx.doi.org/10.1016/j.ejvs.2012.02...
22 Martín-Cancho MF, Sánchez-Margallo FM, Soria F, et al. Physiological responses to different ischemic periods during laparoscopic infrarenal aortic cross-clamping: evaluation in an experimental animal model. Ann Vasc Surg. 2009;23(4):506-18. http://dx.doi.org/10.1016/j.avsg.2008.12.002. PMid:19375889.
http://dx.doi.org/10.1016/j.avsg.2008.12...
23 Martin-Cancho MF, Crisostomo V, Soria F, et al. Physiologic responses to infrarenal aortic cross-clamping during laparoscopic or conventional vascular surgery in experimental animal model: comparative study. Anesthesiol Res Pract. 2008;581948:1-8. http://dx.doi.org/10.1155/2008/581948. PMid:21197458.
http://dx.doi.org/10.1155/2008/581948...
-2424 Alric P, Ryckwaert F, Branchereau P, Marty-Ane C, Mary H, Colson P. A porcine model of systemic and renal haemodynamic responses to infrarenal aortic cross-clamping. Eur J Vasc Endovasc Surg. 2003;25(1):72-8. http://dx.doi.org/10.1053/ejvs.2002.1789. PMid:12525815.
http://dx.doi.org/10.1053/ejvs.2002.1789...
, e foi adotado como referência para a composição dos grupos. Primeiramente, foi realizado um teste de normalidade nos dados, e constatou-se que estes apresentavam simetria. Desse modo, realizou uma análise de variância (ANOVA), seguida do teste de Tukey para as comparações múltiplas, a fim de verificar se havia diferença entre os grupos C, L, EV e S.
RESULTADOS
Ensaio biomecânico
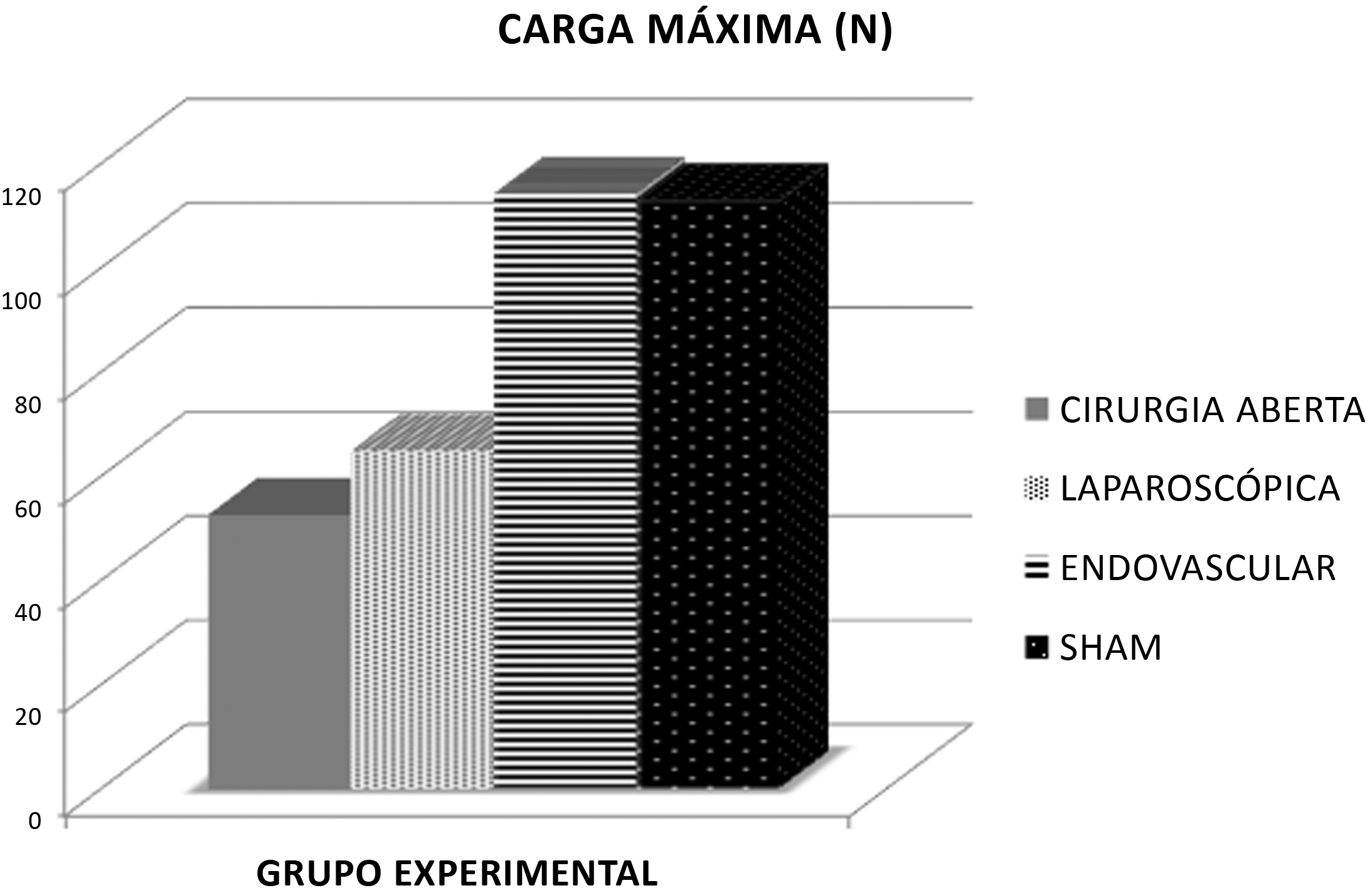
O grupo EV mostrou-se mais resistente à carga, com maiores coeficiente de rigidez (p < 0,05), carga máxima (p < 0,05) e limite de proporcionalidade (p < 0,05), quando comparado aos grupos C e L. As amostras de aorta do grupo EV tiveram comportamento mecânico similar ao do grupo S no teste de tração (Figuras 3, 4 e 5).
Comparação absoluta entre os grupos quanto ao parâmetro carga máxima, em que a diferença de carga máxima foi estatisticamente significativa (p < 0,05) entre os grupos EV e L e entre EV e C.
Comparação absoluta entre os grupos quanto ao parâmetro elasticidade, em que a diferença de limite de elasticidade foi estatisticamente significativa (p < 0,05) entre os grupos EV e L e entre EV e C.
Comparação absoluta entre os grupos quanto ao parâmetro coeficiente de rigidez, em que a diferença de coeficiente de rigidez foi estatisticamente significativa (p< 0,05) entre os grupos EV e L e EV e C.
Avaliação histológica da aorta
A histologia da aorta apresentou-se preservada em todos os casos avaliados. Dessa maneira, não foi observada alteração celular, de fibras colágenas ou de fibras elásticas nas amostras avaliadas, independentemente do grupo de estudo (Figura 6).
Secções histológicas de aorta abdominal. (A, B, C) Observa-se arranjo lamelar preservado, caracterizado por padrão paralelo das fibras da túnica média. Número e núcleo de células musculares lisas preservados. Ausência de infiltrado inflamatório mononuclear (Hematoxicilina e eosina, 200x); (D, E, F) Fibras colágenas organizadas e coradas normalmente (Picrosirius, 200x); (G, H, I) Fibras elásticas sinuosas presentes em todo o segmento vascular, sem fragmentação e em número preservado (Verhoeff, 200x).
DISCUSSÃO
Os principais achados desde estudo consistem em alterações provocadas pela pinça hemostática cirúrgica no sítio de interrupção de fluxo, que tem seu uso inevitável durante a cirurgia aórtica. Sempre que um vaso é manipulado, existe possibilidade de rotura de placas, lesão intimal e formação de trombos durante e após o posicionamento de pinças hemostáticas. Mesmo na cirurgia endovascular, 1 hora após balonamento arterial nas angioplastias já ocorrem alterações na parede arterial, tais como: denudação endotelial, deposição de plaquetas, trombos murais e rachaduras endoteliais envolvendo a lâmina elástica interna2525 Gutierrez PS, Reis MM, Higuchi ML, Aiello VD, Stolf NAG, Lopes EA. Distribution of hyaluronan and dermatan/chondroitin sulfate proteoglycans in human aortic dissection. Connect Tissue Res. 1998;37(3-4):151-61. http://dx.doi.org/10.3109/03008209809002435. PMid:9862217.
http://dx.doi.org/10.3109/03008209809002...
. O balão utilizado durante EVAR é complacente; porém, permaneceu insuflado acima da pressão arterial do animal por tempo prolongado, e desse modo poderia ser fonte de lesão na parede da artéria. Quando esta é submetida a angioplastia com balão, está sujeita a tensões radiais além do seu intervalo fisiológico; desse modo, poderiam ocorrer danos, em especial nas fibras de colágeno2626 Taghizadeh N, Vonk JM, Boezen HM. Lifetime smoking history and cause-specific mortality in a cohort study with 43 years of follow-up. PLoS One. 2016;11(4):e0153310. http://dx.doi.org/10.1371/journal.pone.0153310. PMid:27055053.
http://dx.doi.org/10.1371/journal.pone.0...
. A complacência do balão fez com que a área de contato do balão com a parede aórtica fosse maior que sua superfície nominal, em razão de sua acomodação ao diâmetro reduzido da aorta dos suínos. Experimentos demonstraram que essa lesão induziria o espessamento da parede do vaso e seria determinada pelo estresse na superfície da parede que tangencia o balão no vaso2727 Steele PM, Chesebro JH, Stanson AW, et al. Balloon angioplasty. Natural history of the pathophysiological response to injury in a pig model. Circ Res. 1985;57(1):105-12. http://dx.doi.org/10.1161/01.RES.57.1.105. PMid:3159504.
http://dx.doi.org/10.1161/01.RES.57.1.10...
. Consigny et al.2828 Consigny PM, Tulenko TN, Nicosia RF. Immediate and long-term effects of angioplasty-balloon dilation on normal rabbit iliac artery. Arteriosclerosis. 1986;6(3):265-76. http://dx.doi.org/10.1161/01.ATV.6.3.265. PMid:2939818.
http://dx.doi.org/10.1161/01.ATV.6.3.265...
observaram de imediato aumento do diâmetro arterial, denudação endotelial, lesões em células musculares lisas, diminuição da espessura arterial, e aumento do módulo elástico logo após balonamento arterial. No presente estudo, o segmento aórtico em contato com o balão poderia ser sede de alterações isquêmicas locais, pela compressão dos vasa vasorum, por falta de contato da aorta com o sangue circulante e pela reperfusão.
A hipótese de alterações agudas na parede da aorta após balonamento prolongado teria fundamento, mesmo com balão complacente, pois este seria insuflado com pressões altas e por tempo prolongado. Porém, o comportamento mecânico das aortas que tiveram o fluxo interrompido pela insuflação de balão foi similar ao daquelas do controle de normalidade. Esses resultados podem sugerir que a insuflação de balão complacente na aorta, mesmo por tempo prolongado, não provoca alterações parietais estruturais, o que é fundamental para a durabilidade das técnicas endovasculares. O aumento de diâmetro aórtico por eventual lesão e enfraquecimento de parede no sítio de balonamento (fixação proximal das endopróteses) poderia levar à degeneração do colo e a consequentes endoleaks tipo I e migração da endoprótese2929 Savlovskis J, Krievins D, de Vries J-PPM, et al. Artic neck enlargement after endovascular aneurysm repair using balloon-expandable versus self-expanding endografts. J Vasc Surg. 2015;62(3):541-9. http://dx.doi.org/10.1016/j.jvs.2015.04.393. PMid:26213274.
http://dx.doi.org/10.1016/j.jvs.2015.04....
. Ademais, atualmente é cada vez mais difundida a hemostasia endovascular durante emergências aórticas por meio de balão intraluminal pela técnica REBOA3030 Ribeiro MAF Jr, Feng CYD, Nguyen ATM, et al. The complications associated with Ressuscitative Endovascular Balloon Occlusion of the Aorta (REBOA). World J Emerg Surg. 2018;13(1):20-5. http://dx.doi.org/10.1186/s13017-018-0181-6. PMid:29774048.
http://dx.doi.org/10.1186/s13017-018-018...
, sendo importante obter dados que evidenciem que essa técnica não provocaria alterações mecânicas persistentes da parede aórtica.
As análises mostraram que os parâmetros mecânicos dos grupos C e L foram menores do que os do grupo EV, sendo que as variáveis biomecânicas do grupo S se assemelharam às encontradas no grupo EV, denotando redução da resistência da parede da aorta com o uso de pinças hemostáticas. A distensibilidade da aorta depende dos componentes da túnica média – colágeno, elastina e proteoglicanos – e todos podem afetar a resistência da aorta à tração88 Jaldin RG, Castardelli É, Perobelli JE, et al. Morphologic and biomechanical changes of thoracic and abdominal aorta in a rat model of cigarette smoke exposure. Ann Vasc Surg. 2013;27(6):791-800. http://dx.doi.org/10.1016/j.avsg.2013.03.002. PMid:23880458.
http://dx.doi.org/10.1016/j.avsg.2013.03...
, de modo que a capacidade elástica dos tecidos cardiovasculares é relacionada diretamente com seu comportamento biomecânico1818 Bertanha M, Moroz A, Jaldin RG, et al. Morphofunctional characterization of decellularized vena cava as tissue engineering scaffolds. Exp Cell Res. 2014;326(1):103-11. http://dx.doi.org/10.1016/j.yexcr.2014.05.023. PMid:24929113.
http://dx.doi.org/10.1016/j.yexcr.2014.0...
. Testes de resistência à tração refletem, em última análise, a rigidez e a elasticidade da aorta, ou seja, analisam a capacidade do colágeno e da elastina em permitir que a aorta sofra distensibilidade, parte fundamental de sua função88 Jaldin RG, Castardelli É, Perobelli JE, et al. Morphologic and biomechanical changes of thoracic and abdominal aorta in a rat model of cigarette smoke exposure. Ann Vasc Surg. 2013;27(6):791-800. http://dx.doi.org/10.1016/j.avsg.2013.03.002. PMid:23880458.
http://dx.doi.org/10.1016/j.avsg.2013.03...
. Carga máxima, limite de proporcionalidade e coeficiente de rigidez são os parâmetros mais vinculados a essas propriedades biomecânicas. É possível que esses fatores tenham contribuído para as alterações verificadas nos grupos C e L durante os testes biomecânicos, uma vez que a tensão mecânica da parede arterial depende da carga aplicada e da geometria vascular deformada3131 Polindara C, Waffenschmidt T, Menzel A. Simulation of balloon angioplasty in residually stressed blood vessels-Application of a gradient-enhanced fibre damage model. J Biomech. 2016;49(12):2341-8. http://dx.doi.org/10.1016/j.jbiomech.2016.01.037. PMid:26924658.
http://dx.doi.org/10.1016/j.jbiomech.201...
32 Zubilewicz T, Wronski J, Bourriez A, et al. Injury in vascular surgery--the intimal hyperplastic response. Med Sci Monit. 2001;7(2):316-24. PMid:11257743.-3333 Barone GW, Cornely JM, Flagagan TL, Kron IL. Assessing clamp related vascular injuries by measurement of associated vascular dysfunction. Surgery. 1989;105(4):465-71. PMid:2648627..
Como os parâmetros biomecânicos da parede arterial são devidos em grande escala ao colágeno e a fibras elásticas, foram incluídas colorações especificas para esses componentes da parede, mas mesmo assim não se observaram alterações marcantes e significativas nesses cortes à microscopia de luz. Borges et al.77 Borges LF, Gutierrez PS, Marana HR, Taboga SR. Picrosirius polarization staining method as an efficient histopathological tool for collagenolysis detection in vesical prolapse lesions. Micron. 2007;38(6):580-3. http://dx.doi.org/10.1016/j.micron.2006.10.005. PMid:17126553.
http://dx.doi.org/10.1016/j.micron.2006....
demonstraram que a coloração de Picrosirius Red analisada na luz polarizada, somada à microscopia de luz convencional, seria o melhor método para avaliar a estrutura de colágeno, uma vez que permite o estudo do arranjo e da agregação das fibras colágenas, devido à sua birrefringência normal. Essa coloração torna possível a visualização da morfologia de feixes de colágeno íntegro e também de feixes fragmentados, sendo possível também a detecção de colagenólise. Talvez a utilização de luz polarizada pudesse demonstrar algum rearranjo na estrutura tridimensional das fibras colágenas não identificadas nas técnicas convencionais utilizadas.
As análises histológicas não tiveram sensibilidade suficiente para detectar alterações estruturais agudas nos componentes da parede aórtica, mas alterações funcionais ou ultraestruturais poderiam ter ocorrido. Estudos com ultramicroscopia, com histoquímica para outros componentes da média2525 Gutierrez PS, Reis MM, Higuchi ML, Aiello VD, Stolf NAG, Lopes EA. Distribution of hyaluronan and dermatan/chondroitin sulfate proteoglycans in human aortic dissection. Connect Tissue Res. 1998;37(3-4):151-61. http://dx.doi.org/10.3109/03008209809002435. PMid:9862217.
http://dx.doi.org/10.3109/03008209809002...
e com imuno-histoquímica para elastases talvez pudessem mostrar alguma alteração que corroborasse as alterações biomecânicas observadas. Há estudos sugerindo dano ultraestrutural na parede arterial provocado pelo clampe após o ato cirúrgico, mesmo sem lesão histológica identificável à microscopia de luz3434 Sassani SG, Kakisis J, Tsangaris S, Sokolis DP. Layer-dependent wall properties of abdominal aortic aneurysms: Experimental study and material characterization. J Mech Behav Biomed Mater. 2015;49:141-61. http://dx.doi.org/10.1016/j.jmbbm.2015.04.027. PMid:26011656.
http://dx.doi.org/10.1016/j.jmbbm.2015.0...
,3535 Taghizadeh H, Tafazzoli-Shadpour M. Characterization of mechanical properties of lamellar structure of the aortic wall: effect of aging. J Mech Behav Biomed Mater. 2017;65:20-8. http://dx.doi.org/10.1016/j.jmbbm.2016.08.011. PMid:27544616.
http://dx.doi.org/10.1016/j.jmbbm.2016.0...
. As pinças hemostáticas possuem ranhuras, as quais exercem uma pressão pontual significativa sobre a parede arterial, que invariavelmente resulta em trauma nos vasos2424 Alric P, Ryckwaert F, Branchereau P, Marty-Ane C, Mary H, Colson P. A porcine model of systemic and renal haemodynamic responses to infrarenal aortic cross-clamping. Eur J Vasc Endovasc Surg. 2003;25(1):72-8. http://dx.doi.org/10.1053/ejvs.2002.1789. PMid:12525815.
http://dx.doi.org/10.1053/ejvs.2002.1789...
. A pressão exercida pelo clampe na parede aórtica, além da isquemia transitória local, seguida pela reperfusão, poderia ter provocado alterações na estrutura vascular e nos parâmetros biomecânicos. Embora as alterações agudas da parede aórtica decorrentes do clampeamento sejam documentadas em diversos estudos, aparentemente não resultam em enfraquecimento permanente do vaso3636 Babin-Ebell J, Gimpel-Henning K, Sievers H-H, Scharfschwerdt M. Influence of clamp duration and pressure on endothelial damage in aortic cross-clamping. Interact Cardiovasc Thorac Surg. 2010;10(2):168-71. http://dx.doi.org/10.1510/icvts.2009.220996. PMid:19934161.
http://dx.doi.org/10.1510/icvts.2009.220...
. Dobrin et al.3737 Dobrin PB, McGurrin JF, McNulty JA. Chronic histologic changes after vascular clamping are not associated with altered vascular mechanics. Ann Vasc Surg. 1992;6(2):153-9. http://dx.doi.org/10.1007/BF02042737. PMid:1599834.
http://dx.doi.org/10.1007/BF02042737...
descreveram lesões persistentes da área pinçada por até 6 meses após o ato, mas estas não estavam associadas a alterações mecânicas crônicas da aorta. Esses achados podem explicar a segurança das técnicas que vêm sendo utilizadas há décadas.
CONCLUSÃO
A utilização de pinça hemostática durante cirurgia aberta ou laparoscópica produziu alterações mecânicas agudas na aorta que sugerem redução de resistência, mesmo sem aparente alteração morfológica. A insuflação prolongada de balão intraluminal não alterou as propriedades mecânicas da parede, denotando manutenção da integridade estrutural.
-
Como citar: Prata MP, Jaldin RG, Lourenção PLTA, et al. Lesão aguda da parede arterial provocada pelo método de interrupção temporária de fluxo em diferentes vias de cirurgia aórtica: estudo morfológico e biomecânico da aorta de porcos. J Vasc Bras. 2020;19:e20190025. https://doi.org/10.1590/1677-5449.190025
-
Fonte de financiamento: Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) (Processos 2012/50159-3 e 2014/13616-2).
-
O estudo foi realizado no Departamento de Cirurgia e Ortopedia, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (UNESP), São Paulo, SP, Brasil.
REFERÊNCIAS
-
1Coscas R, Maumias T, Capdevila C, Javerliat I, Goëau-Brissonnière O, Coggia M. Mini-invasive treatment of abdominal aneurysms: current roles of endovascular, laparoscopic and open techniques. Ann Vasc Surg. 2014;28(1):123-31. http://dx.doi.org/10.1016/j.avsg.2013.05.007 PMid:24200131.
» http://dx.doi.org/10.1016/j.avsg.2013.05.007 -
2Pascarella L, Aboul Hosn M. Minimally invasive management of severe aortoiliac occlusive disease. J Laparoendosc Adv Surg Tech A. 2018;28(5):562-8. http://dx.doi.org/10.1089/lap.2017.0675 PMid:29346011.
» http://dx.doi.org/10.1089/lap.2017.0675 -
3Ahmed N, Gollop ND, Ellis J, Khan OA. How does elective laparoscopic aortic aneurysm repair compare to endovascular aneurysm repair? Interact Cardiovasc Thorac Surg. 2014;18(6):814-20. http://dx.doi.org/10.1093/icvts/ivu031 PMid:24578481.
» http://dx.doi.org/10.1093/icvts/ivu031 -
4Robertson L, Nandhra S. Laparoscopic surgey for elective abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2017;5:CD012302.
-
5Slayback JB, Bowen WW, Hinshaw DB. Intimal injury from arterial clamps. Am J Surg. 1976;132(2):183-7. http://dx.doi.org/10.1016/0002-9610(76)90045-3 PMid:952348.
» http://dx.doi.org/10.1016/0002-9610(76)90045-3 -
6Margovsky AI, Lord RSA, Meek AC, Bobryshev YV. Artery wall damage and platelet uptake from so-called atraumatic arterial clamps: an experimental study. Cardiovasc Surg. 1997;5(1):42-7. http://dx.doi.org/10.1016/S0967-2109(96)00064-6 PMid:9158122.
» http://dx.doi.org/10.1016/S0967-2109(96)00064-6 -
7Borges LF, Gutierrez PS, Marana HR, Taboga SR. Picrosirius polarization staining method as an efficient histopathological tool for collagenolysis detection in vesical prolapse lesions. Micron. 2007;38(6):580-3. http://dx.doi.org/10.1016/j.micron.2006.10.005 PMid:17126553.
» http://dx.doi.org/10.1016/j.micron.2006.10.005 -
8Jaldin RG, Castardelli É, Perobelli JE, et al. Morphologic and biomechanical changes of thoracic and abdominal aorta in a rat model of cigarette smoke exposure. Ann Vasc Surg. 2013;27(6):791-800. http://dx.doi.org/10.1016/j.avsg.2013.03.002 PMid:23880458.
» http://dx.doi.org/10.1016/j.avsg.2013.03.002 -
9Loh CS, Al-Jafari MS, Croton R. Acute rupture of the abdominal aorta from cross-clamp injury. Eur J Vasc Surg. 1990;4(6):647-8. http://dx.doi.org/10.1016/S0950-821X(05)80824-2 PMid:2279578.
» http://dx.doi.org/10.1016/S0950-821X(05)80824-2 -
10Chen HY, Navia JA, Shafique S, Kassab GS. Fluid-structure interaction in aortic cross-clampig:implications for vessel injury. J Biomech. 2010;43(2):221-7. http://dx.doi.org/10.1016/j.jbiomech.2009.08.042 PMid:19883917.
» http://dx.doi.org/10.1016/j.jbiomech.2009.08.042 -
11Dobrin PB, McGurrin JF, McNulty JA. Chronic histologic changes after vascular clamping are not associated with altered vascular mechanics. Ann Vasc Surg. 1992;6(2):153-9. http://dx.doi.org/10.1007/BF02042737 PMid:1599834.
» http://dx.doi.org/10.1007/BF02042737 -
12Thompson MM, Nasim A, Sayers RD, et al. Oxygen free radical and cytokine generation during endovascular and conventional aneurysm repair. Eur J Vasc Endovasc Surg. 1996;12(1):70-5. http://dx.doi.org/10.1016/S1078-5884(96)80278-4 PMid:8696901.
» http://dx.doi.org/10.1016/S1078-5884(96)80278-4 -
13Malina M, Veith F, Ivancev K, Sonesson B. Balloon occlusion of the aorta during endovascular repair of ruptured abdominal aortic aneurysm. J Endovasc Ther. 2005;12(5):556-9. http://dx.doi.org/10.1583/05-1587.1 PMid:16212455.
» http://dx.doi.org/10.1583/05-1587.1 -
14Sincos IR, Aun R, Silva ES, et al. Impact of stent-graft oversizing on the thoracic aorta: experimental study in a porcine model. J Endovasc Ther. 2011;18(4):576-84. http://dx.doi.org/10.1583/11-3470.1 PMid:21861750.
» http://dx.doi.org/10.1583/11-3470.1 -
15Matsuda H, Tanaka Y, Hino Y, et al. Transbrachial arterial insertion of aortic occlusion balloon catheter in patients with shock from ruptured abdominal aortic aneurysm. J Vasc Surg. 2003;38(6):1293-6. http://dx.doi.org/10.1016/S0741-5214(03)00774-2 PMid:14681630.
» http://dx.doi.org/10.1016/S0741-5214(03)00774-2 -
16Batchelor WB, Robinson R, Strauss BH. The extracellular matrix in balloon arterial injury: a novel target for restenosis prevention. Prog Cardiovasc Dis. 1998;41(1):35-49. http://dx.doi.org/10.1016/S0033-0620(98)80021-2 PMid:9717858.
» http://dx.doi.org/10.1016/S0033-0620(98)80021-2 -
17Keris V, Ozolanta I, Enina G, Kasyanovs V, Aide H, Bricis R. Biomechanical and structure assessment of transluminal angioplasty. Med Eng Phys. 1998;20(5):339-46. http://dx.doi.org/10.1016/S1350-4533(98)00032-0 PMid:9773687.
» http://dx.doi.org/10.1016/S1350-4533(98)00032-0 -
18Bertanha M, Moroz A, Jaldin RG, et al. Morphofunctional characterization of decellularized vena cava as tissue engineering scaffolds. Exp Cell Res. 2014;326(1):103-11. http://dx.doi.org/10.1016/j.yexcr.2014.05.023 PMid:24929113.
» http://dx.doi.org/10.1016/j.yexcr.2014.05.023 -
19Cerqueira NF, Yoshida WB, Müller SS, Sequeira JL, Rodrigues AC, Padovani CR. Morphological and biomechanical study of abdominal aorta of rats submitted to experimental chronic alcoholism. Acta Cir Bras. 2005;20(3):213-8. http://dx.doi.org/10.1590/S0102-86502005000300004 PMid:16033179.
» http://dx.doi.org/10.1590/S0102-86502005000300004 -
20Yoshida WB, Müller SS, Carvalho I, Fabris VE, Naresse LE, Maffei FHA. Tensile strengthand histological changes of abdominal aorta of malnourished rats. Cardiovasc Surg. 1995;3(4):437-9. http://dx.doi.org/10.1016/0967-2109(95)94165-S PMid:7583001.
» http://dx.doi.org/10.1016/0967-2109(95)94165-S -
21Suk P, Cundrle I Jr, Hruda J, et al. Porcine model of ruptured abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg. 2012;43(6):698-704. http://dx.doi.org/10.1016/j.ejvs.2012.02.020 PMid:22421373.
» http://dx.doi.org/10.1016/j.ejvs.2012.02.020 -
22Martín-Cancho MF, Sánchez-Margallo FM, Soria F, et al. Physiological responses to different ischemic periods during laparoscopic infrarenal aortic cross-clamping: evaluation in an experimental animal model. Ann Vasc Surg. 2009;23(4):506-18. http://dx.doi.org/10.1016/j.avsg.2008.12.002 PMid:19375889.
» http://dx.doi.org/10.1016/j.avsg.2008.12.002 -
23Martin-Cancho MF, Crisostomo V, Soria F, et al. Physiologic responses to infrarenal aortic cross-clamping during laparoscopic or conventional vascular surgery in experimental animal model: comparative study. Anesthesiol Res Pract. 2008;581948:1-8. http://dx.doi.org/10.1155/2008/581948 PMid:21197458.
» http://dx.doi.org/10.1155/2008/581948 -
24Alric P, Ryckwaert F, Branchereau P, Marty-Ane C, Mary H, Colson P. A porcine model of systemic and renal haemodynamic responses to infrarenal aortic cross-clamping. Eur J Vasc Endovasc Surg. 2003;25(1):72-8. http://dx.doi.org/10.1053/ejvs.2002.1789 PMid:12525815.
» http://dx.doi.org/10.1053/ejvs.2002.1789 -
25Gutierrez PS, Reis MM, Higuchi ML, Aiello VD, Stolf NAG, Lopes EA. Distribution of hyaluronan and dermatan/chondroitin sulfate proteoglycans in human aortic dissection. Connect Tissue Res. 1998;37(3-4):151-61. http://dx.doi.org/10.3109/03008209809002435 PMid:9862217.
» http://dx.doi.org/10.3109/03008209809002435 -
26Taghizadeh N, Vonk JM, Boezen HM. Lifetime smoking history and cause-specific mortality in a cohort study with 43 years of follow-up. PLoS One. 2016;11(4):e0153310. http://dx.doi.org/10.1371/journal.pone.0153310 PMid:27055053.
» http://dx.doi.org/10.1371/journal.pone.0153310 -
27Steele PM, Chesebro JH, Stanson AW, et al. Balloon angioplasty. Natural history of the pathophysiological response to injury in a pig model. Circ Res. 1985;57(1):105-12. http://dx.doi.org/10.1161/01.RES.57.1.105 PMid:3159504.
» http://dx.doi.org/10.1161/01.RES.57.1.105 -
28Consigny PM, Tulenko TN, Nicosia RF. Immediate and long-term effects of angioplasty-balloon dilation on normal rabbit iliac artery. Arteriosclerosis. 1986;6(3):265-76. http://dx.doi.org/10.1161/01.ATV.6.3.265 PMid:2939818.
» http://dx.doi.org/10.1161/01.ATV.6.3.265 -
29Savlovskis J, Krievins D, de Vries J-PPM, et al. Artic neck enlargement after endovascular aneurysm repair using balloon-expandable versus self-expanding endografts. J Vasc Surg. 2015;62(3):541-9. http://dx.doi.org/10.1016/j.jvs.2015.04.393 PMid:26213274.
» http://dx.doi.org/10.1016/j.jvs.2015.04.393 -
30Ribeiro MAF Jr, Feng CYD, Nguyen ATM, et al. The complications associated with Ressuscitative Endovascular Balloon Occlusion of the Aorta (REBOA). World J Emerg Surg. 2018;13(1):20-5. http://dx.doi.org/10.1186/s13017-018-0181-6 PMid:29774048.
» http://dx.doi.org/10.1186/s13017-018-0181-6 -
31Polindara C, Waffenschmidt T, Menzel A. Simulation of balloon angioplasty in residually stressed blood vessels-Application of a gradient-enhanced fibre damage model. J Biomech. 2016;49(12):2341-8. http://dx.doi.org/10.1016/j.jbiomech.2016.01.037 PMid:26924658.
» http://dx.doi.org/10.1016/j.jbiomech.2016.01.037 -
32Zubilewicz T, Wronski J, Bourriez A, et al. Injury in vascular surgery--the intimal hyperplastic response. Med Sci Monit. 2001;7(2):316-24. PMid:11257743.
-
33Barone GW, Cornely JM, Flagagan TL, Kron IL. Assessing clamp related vascular injuries by measurement of associated vascular dysfunction. Surgery. 1989;105(4):465-71. PMid:2648627.
-
34Sassani SG, Kakisis J, Tsangaris S, Sokolis DP. Layer-dependent wall properties of abdominal aortic aneurysms: Experimental study and material characterization. J Mech Behav Biomed Mater. 2015;49:141-61. http://dx.doi.org/10.1016/j.jmbbm.2015.04.027 PMid:26011656.
» http://dx.doi.org/10.1016/j.jmbbm.2015.04.027 -
35Taghizadeh H, Tafazzoli-Shadpour M. Characterization of mechanical properties of lamellar structure of the aortic wall: effect of aging. J Mech Behav Biomed Mater. 2017;65:20-8. http://dx.doi.org/10.1016/j.jmbbm.2016.08.011 PMid:27544616.
» http://dx.doi.org/10.1016/j.jmbbm.2016.08.011 -
36Babin-Ebell J, Gimpel-Henning K, Sievers H-H, Scharfschwerdt M. Influence of clamp duration and pressure on endothelial damage in aortic cross-clamping. Interact Cardiovasc Thorac Surg. 2010;10(2):168-71. http://dx.doi.org/10.1510/icvts.2009.220996 PMid:19934161.
» http://dx.doi.org/10.1510/icvts.2009.220996 -
37Dobrin PB, McGurrin JF, McNulty JA. Chronic histologic changes after vascular clamping are not associated with altered vascular mechanics. Ann Vasc Surg. 1992;6(2):153-9. http://dx.doi.org/10.1007/BF02042737 PMid:1599834.
» http://dx.doi.org/10.1007/BF02042737
Datas de Publicação
-
Publicação nesta coleção
03 Abr 2020 -
Data do Fascículo
2020
Histórico
-
Recebido
18 Mar 2019 -
Aceito
01 Maio 2019