Resumos
OBJETIVO: Analisar a imunoexpressão das proteínas COX-2, p53 e caspase-3 em adenomas colorretais e na mucosa não neoplásica. MÉTODOS: Foram submetidos à colonoscopia 72 indivíduos que forneceram 50 amostras de adenomas e 45 de mucosa colorretal não neoplásica. Os tecidos foram obtidos pela técnica de arranjo em matriz (tissue microarray) e submetidos a estudo imunoistoquímico com anticorpos primários p53, COX-2 e caspase-3. A positividade e intensidade da imunorreação foram classificadas. Foram estudadas as seguintes variáveis: localização do adenoma no colo, grau de displasia, tamanho, e escores de positividade e intensidade da imunoexpressão das proteínas p-53, caspase-3 e COX-2. RESULTADOS: Nos adenomas, a imunoexpressão da proteína p53 mutada foi positiva em 30 (60%) e negativa em 20 (40%) amostras. Na mucosa colorretal não neoplásica, a imunoexpressão da proteína p53 mutada foi negativa em 39 (86,6%) amostras e positiva em 6 (13,3%) (p<0,0001). Houve diferença significativa entre o maior tamanho (p=0,006) e o maior grau de displasia dos adenomas (p<0,0001) e a intensidade de imunoexpressão da proteína p53 mutada. A positividade e intensidade da imunoexpressão das proteínas COX-2 (p=0,14) e caspase-3 (p=0,23), nos adenomas e na mucosa colorretal não neoplásica, não apresentaram diferença significante. CONCLUSÃO: A proteína p53 mutada é hiperexpressada nos adenomas em comparação com a mucosa não neoplásica. Nos adenomas, o maior tamanho e o maior grau de displasia foram associados à maior expressão da proteína p53 mutada. A imunoexpressão das proteínas COX-2 e caspase nos adenomas não apresentou correlação com os aspectos anatomopatológicos e não foi diferente em termos de níveis de expressão correspondentes na mucosa não neoplásica.
Adenoma; Imunoistoquímica; Genes p53; Caspase 3; Ciclo-oxigenase 2; Intestino grosso
OBJECTIVE: To analyze the immunoexpression of the COX-2, p53, and caspase-3 proteins in colorectal adenomas and non-neoplastic mucosa. METHODS: 72 individuals were subjected to colonoscopy, which provided 50 samples of adenomas and 45 samples of non-neoplastic colorectal mucosa. The tissue samples were obtained via the tissue microarray technique and subjected to immunohistochemical analysis using primary anti-p53, anti-COX-2, and anti-caspase-3 antibodies. The positivity and intensity of the immunoreaction were classified. The analyzed variables were as follows: site of the adenomas in the colon, degree of dysplasia, size, and score of positivity and intensity of immunoexpression of the p-53, caspase-3, and COX-2 proteins. RESULTS: The immunoexpression of mutated protein p53 was positive in 30 (60%) adenoma samples and negative in 20 (40%) adenoma samples. The immunoexpression of mutated protein p53 was negative in 39 (86.6%) samples and positive in 6 (13.3%) samples of the non-neoplastic colorectal mucosa (p<0.0001). Significant differences were seen between both the largest size (p=0.006) and the highest degree of dysplasia (p<0.0001) of the adenomas and the intensity of immunoexpression of mutated protein p53. The positivity and intensity of immunoexpression of COX-2 (p=0.14) and caspase-3 (p=0.23) showed no significant differences between the adenomas and the non-neoplastic colorectal mucosa. CONCLUSION: Mutated protein p53 was hyperexpressed in the adenomas compared with the non-neoplastic mucosa. Greater size and greater degree of dysplasia in the adenomas were associated with higher expression of mutated protein p53. The immunoexpression of COX-2 and caspase-3 in the adenomas did not exhibit a correlation with the anatomical-pathological features of the tumors and did not differ from the corresponding expression levels in the non-neoplastic mucosa.
Adenoma; Immunohistochemistry; Gene, p53; Caspase 3; Cyclooxygenase 2; Intestine, large
ARTIGO ORIGINAL
Imunoexpressão das proteínas COX-2, p53 e caspase-3 em adenoma colorretal e mucosa não neoplásica
Renan Brito NogueiraI; Andréa Rodrigues Cordovil PiresII; Thélia Maria Santos SoaresIII; Simone Rabello de Souza RodriguesIV; Mariane Antonieta Menino CamposV; Giovanna Canato ToloiV; Jaques WaisbergV
IPrograma de Pós-Graduação em Gastrenterologia Cirúrgica, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil
IIUniversidade Federal Fluminense, Niterói, RJ, Brasil
IIIHospital Irmandade São João Batista, Macaé, RJ, Brasil
IVFonte Medicina Diagnóstica, Niterói, Rio de Janeiro, RJ, Brasil
VFaculdade de Medicina do ABC, Santo André, SP, Brasil
Endereço para correspondência Endereço para correspondência: Jaques Waisberg Faculdade de Medicina do ABC, Fundação do ABC Avenida Príncipe de Gales, 821 CEP: 09080-650 - Santo André, SP, Brasil Tel: (11) 4993-5426 E-mail: jaqueswaisberg@uol.com.br
RESUMO
OBJETIVO: Analisar a imunoexpressão das proteínas COX-2, p53 e caspase-3 em adenomas colorretais e na mucosa não neoplásica.
MÉTODOS: Foram submetidos à colonoscopia 72 indivíduos que forneceram 50 amostras de adenomas e 45 de mucosa colorretal não neoplásica. Os tecidos foram obtidos pela técnica de arranjo em matriz (tissue microarray) e submetidos a estudo imunoistoquímico com anticorpos primários p53, COX-2 e caspase-3. A positividade e intensidade da imunorreação foram classificadas. Foram estudadas as seguintes variáveis: localização do adenoma no colo, grau de displasia, tamanho, e escores de positividade e intensidade da imunoexpressão das proteínas p-53, caspase-3 e COX-2.
RESULTADOS: Nos adenomas, a imunoexpressão da proteína p53 mutada foi positiva em 30 (60%) e negativa em 20 (40%) amostras. Na mucosa colorretal não neoplásica, a imunoexpressão da proteína p53 mutada foi negativa em 39 (86,6%) amostras e positiva em 6 (13,3%) (p<0,0001). Houve diferença significativa entre o maior tamanho (p=0,006) e o maior grau de displasia dos adenomas (p<0,0001) e a intensidade de imunoexpressão da proteína p53 mutada. A positividade e intensidade da imunoexpressão das proteínas COX-2 (p=0,14) e caspase-3 (p=0,23), nos adenomas e na mucosa colorretal não neoplásica, não apresentaram diferença significante.
CONCLUSÃO: A proteína p53 mutada é hiperexpressada nos adenomas em comparação com a mucosa não neoplásica. Nos adenomas, o maior tamanho e o maior grau de displasia foram associados à maior expressão da proteína p53 mutada. A imunoexpressão das proteínas COX-2 e caspase nos adenomas não apresentou correlação com os aspectos anatomopatológicos e não foi diferente em termos de níveis de expressão correspondentes na mucosa não neoplásica.
Descritores: Adenoma; Imunoistoquímica; Genes p53; Caspase 3; Ciclo-oxigenase 2; Intestino grosso
INTRODUÇÃO
Os genes com regulação positiva em adenomas em relação ao tecido normal, que manteriam a expressão aumentada no carcinoma e adenoma colorretais, codificariam proteínas adequadas como supostos alvos para a imunoprevenção(1,2). A identificação de marcadores tumorais em fase inicial e facilmente detectável, a qual pode contribuir para o tratamento de carcinogênese colorretal, como os mecanismos biológicos necessários para que o adenoma pré-invasivo progrida até o carcinoma, é assunto altamente relevante(3,4). A despeito da constante melhoria de métodos de estadiamento para o carcinoma colorretal, também observamos um alto grau de resultados imprevisíveis, o que demonstra uma necessidade de mais conhecimento dos determinantes da evolução de neoplasias(5-8).
O gene p53, considerado um replicador da inibição de DNA, participa da regulação da apoptose e do bloqueio da angiogênese(2,9), sendo considerado como de supressão tumoral. Mutações desse gene ocorrem frequentemente no câncer humano, com importantes implicações para a apoptose celular(10). As neoplasias de pulmão, mama e colo são frequentemente associadas a mutações em p53 e à hiperexpressão da proteína codificada(9,10).
A caspase-3 desempenha um papel importante nas vias de ativação intrínseca (ou mitocondrial) e extrínseca (ou citoplasmática) da apoptose. A expressão da proteína na mucosa não neoplásica e em adenomas colorretais é um assunto controverso na literatura(6,11,12).
A ciclo-oxigenase-2 (COX-2) participa da resposta a estímulos inflamatórios, fatores de crescimento, angiogênese, hormônios, mitogênese e carcinogênese(9-16). Os inibidores de COX-2 podem reduzir a angiogênese tumoral e promover apoptose(17,18). Estudos com modelos animais e humanos demonstraram que o uso de inibidores de COX-2 pode prevenir ou dificultar a progressão de adenomas para carcinomas(17,19). A expressão de COX-2 está aumentada de forma significante em tecidos tumorais(9,13). Entretanto, o mecanismo de base do efeito protetor dos inibidores de COX-2 contra a sequência mucosa normal - adenoma - carcinoma ainda não foi plenamente elucidado(17,19).
OBJETIVO
Analisar a expressão imunoistoquímica das proteínas p53, COX-2 e caspase-3 no colo e na mucosa colorretal não neoplásica, e determinar a possível associação dessa expressão com os aspectos anatomopatológicos da neoplasia.
MÉTODOS
Desenho do estudo
O estudo foi aprovado pelo Comitê de Ética em Pesquisa (número 0279/10) da Escola Paulista de Medicina da Universidade Federal de São Paulo (UNIFESP).
A presente investigação foi um estudo retrospectivo (de janeiro de 2005 a dezembro de 2006), que incluiu amostras de biópsias de adenomas colorretais e mucosa não neoplásica ressecadas durante colonoscopias e removidas de blocos de parafina.
Características das amostras
Foram incluídos pacientes adultos dos dois gêneros com adenomas colorretais diagnosticados por exame anatomopatológico. Os critérios de exclusão foram pacientes com carcinoma colorretal associado, doenças inflamatórias do intestino, síndrome de polipose colorretal e idade <18 anos.
Foram armazenadas em blocos de parafina 95 amostras, de 72 pacientes submetidos à colonoscopia, obtidas do Laboratório de Patologia THELAB em Macaé (RJ, Brasil), as quais foram analisadas. As amostras foram alocadas a dois grupos: Grupo Adenoma (GA), composto por 40 pacientes com adenoma colorretal, e Grupo Controle (GC), composto por 32 pacientes sem adenoma colorretal. Foram coletadas 50 amostras de adenoma no GA e 45 amostras de mucosa não neoplásica do GC.
O GA incluiu 21 (52,5%) homens e 19 (47,8%) mulheres, com uma idade média de 57,8±13,1 anos (28 a 83 anos). O GC incluiu 17 (53,1%) homens e 15 (46,9%) mulheres, com uma idade média de 46,1±14,9 anos (18 a 74 anos).
Amostras de tecido e imunoistoquímica
Lâminas de blocos de parafina foram preparadas e coradas com hematoxilina-eosina (HE). Os blocos selecionados foram submetidos à técnica de arranjo em matriz (tissue microarray - TMA).
Os testes de TMA foram preparados segundo a técnica descrita por Pires et al.(20,21). Os blocos de TMA e análises imunoistoquímicas foram feitos no Laboratório de Patologia Fonte em Niterói (RJ, Brasil).
Para garantir a representatividade de cada área selecionada nos blocos de parafina para análise imunoistoquímica, duas amostras foram coletadas de diferentes seções do mesmo bloco.
Para preparar as lâminas histológicas, os blocos de parafina de TMA foram separados em cortes de 3µm de espessura e corados com HE, e a técnica de imunoistoquímica foi aplicada segundo protocolos previamente estabelecidos pelo laboratório. Os seguintes anticorpos primários foram usados nas lâminas de TMA: antiproteína p53 (clone SP5, código 453R-14, Cell Marque Corp., Rocklin, Califórnia, EUA), caspase-3 (policlonal, código CP229A, Biocare Medical, Concord, Califórnia, EUA) e COX-2 (clone SP21, código 240R-14, Cell Marque Corp., Rocklin, Califórnia, EUA). Os casos externos (placenta, rins e fígado) foram adicionados a cada lâmina para identificar a posição de cada caso no TMA.
Para as reações imunoistoquímicas, os cortes histológicos de 3µm de espessura foram obtidos e colocados em lâminas previamente tratadas com solução salina (Sigma Chemical Co., St. Louis, Missouri, EUA), segundo protocolos previamente estabelecidos pelo laboratório.
A intensidade da expressão de p53, COX-2e caspase-3 nas lâminas foi semiquantificada da seguinte maneira: negativa ou zero, leve ou 1 (<10% de células coradas), moderada ou 2 (10 a 50% de células coradas), e forte ou 3 (>50% de células coradas)(22). A análise microscópica das lâminas foi feita sob um microscópio óptico (Eclipse E200, Nikon, Japão), com um aumento final de 400X. As lâminas coradas por HE e as lâminas de TMA foram examinadas por dois patologistas. Os controles positivos usados para análises imunoistoquímicas foram tecidos de amígdalas humanas. Como controle negativo, o anticorpo primário foi removido da reação imunoistoquímica.
Coleta de dados
Os resultados foram analisados com base nas seguintes variáveis: tamanho, local, tipo histológico e grau de displasia dos adenomas, além da intensidade e da distribuição da imunoexpressão de p53, caspase-3 e COX-2 nos adenomas colorretais e mucosa não neoplásica.
Análise estatística
Os dados estatísticos descritivos foram resumidos como média ± desvio padrão (DP) ou frequências (porcentagens), conforme apropriado. O teste χ2 foi usado para variáveis qualitativas, ou seja, frequências e proporções. O software estatístico usado foi Statistical Package for the Social Sciences (SPSS) para Windows 10.1 (SPSS Inc., EUA). O nível de significância foi estabelecido em 5%.
RESULTADOS
O tamanho médio dos adenomas (GA) foi 0,62±0,2mm (2 a 20mm). Dos 50 adenomas, 29 (58%) eram tubulares, 17 (34%) túbulo-vilosos e 4 (8%) vilosos. A displasia foi leve em 25 (50%) tumores, moderada em 18 (36%) e severa em 7 (14%). O local mais frequente de adenomas foi o cólon sigmoide, respondendo por 17 (34%) tumores, seguido do cólon transverso com 11 (22%), cólon descendente com 7 (14%), ceco com 7 (14%), cólon ascendente com 4 (8%) e reto com 4 (8%).
A comparação da imunoexpressão das proteínas p53, COX-2e caspase-3 entre os adenomas colorretais e a mucosa não neoplásica mostrou uma diferença significante (p<0,0001) na imunoexpressão de p53 entre os Grupos A e C, enquanto a expressão de COX-2 (p=0,14) e caspase-3 (p=0,24) não apresentou uma diferença significante (Tabela 1).
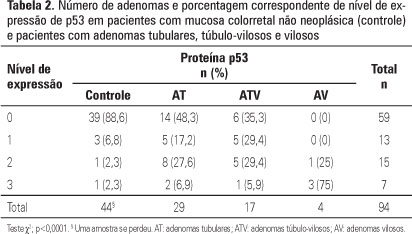
Diferenças significantes foram encontradas (p<0,0001) entre a imunoexpressão de p53 nos vários tipos histológicos de adenoma colorretal e a imunoexpressão correspondente na mucosa normal (Tabela 2).
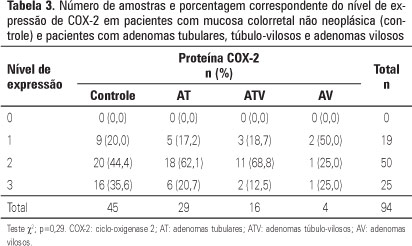
Nenhuma associação significante foi encontrada entre a imunoexpressão de COX-2 (p=0,08) e a caspase-3 (p=0,12) nos vários tipos histológicos de adenomas colorretais e mucosa normal (Tabelas 3 e 4).
A associação entre a intensidade de imunoexpressão de p53 e o grau de displasia dos adenomas colorretais foi significante (p=0,03). A relação entre a intensidade de imunoexpressão de COX-2 e caspase-3 e o grau de displasia dos adenomas colorretais não foi significante (p=0,76 e p=0,3, respectivamente).
A associação entre a distribuição do tamanho médio dos adenomas colorretais e a imunoexpressão de p53, COX-2 e caspase-3 mostrou uma diferença significante (p=0,006).
DISCUSSÃO
Pacientes com adenomas exibem um risco três vezes maior de desenvolver câncer colorretal, um risco até maior entre pacientes com mais de 60 anos e/ou que apresentam múltiplos adenomas colorretais(1). Entretanto, a relação entre a histogênese do câncer colorretal e alterações genéticas, além do acúmulo de biomarcadores, não foi até agora totalmente compreendida(2,3).
A maior parte da pesquisa sobre esse assunto abordou os genes que controlam a apoptose(4,5), que é o alvo de tratamento de câncer em vários estágios de progressão de tumores. Distúrbios na regulação do ciclo celular e nas vias de apoptose ocorrem frequentemente na sequência mucosa colorretal-adenoma-carcinoma(5-8).
O presente estudo avaliou a expressão das proteínas p53, COX-2 e caspase-3 em adenomas colorretais tubulares, túbulo-vilosos e vilosos, além da mucosa não neoplásica do colo, por meio de análise imunoistoquímica com a técnica de TMA.
A expressão imunoistoquímica de p53 ocorre quando a proteína está inativa e se acumula dentro do núcleo da célula, o que pode ser causado por mutações no gene p53 ou por inativação da proteína mediada por outras moléculas que, por dificultarem a transformação de p53 de sua forma monomérica para a tetramérica, evitam a ligação de p53 ao DNA e impedem a funcionalidade dessa proteína(23).
A presença de um gene p53 com mutação é frequente nas áreas com maior displasia dos adenomas(23). Kaklamanis et al.(23) avaliaram a expressão de p53 em 72 adenomas quanto a tamanho, tipo histológico e grau de displasia, e demonstraram que apenas o último exibe uma significante associação com a expressão de p53. A imunoexpressão de p53 está ausente na mucosa colorretal não neoplásica. Neste estudo, a proteína p53 não foi expressa em 39 (88,63%) das amostras de mucosa não neoplásica. Quanto ao tamanho dos adenomas, foi encontrada maior expressão de p53 nos maiores tumores, confirmando os resultados de Kaklamanis et al.(23).
Sheikh et al.(1) analisaram a expressão de p53 em 42 adenomas com graus maiores de displasia, 15 dos quais também exibiram carcinomas, e encontraram a expressão de p53 em 27 (64,2%) casos. Dentre os adenomas com carcinoma in situ, 93% foram p53-positivos, enquanto 48% dos adenomas colorretais, sem carcinoma in situ, foram p53-positivos. Ieda et al.(24) estudaram a expressão de p53 em 139 adenomas colorretais, 57 adenomas colorretais com carcinoma precoce, e 12 amostras de carcinoma colorretal. Os resultados revelaram um nível de expressão significantemente maior de p53 nos adenomas com um grau maior de displasia. Visca et al.(25) analisaram a imunoexpressão de proteínas reguladoras de apoptose (incluindo p53) em cem amostras de adenoma, cem amostras de carcinoma, e cem amostras de mucosa adjacente não neoplásica. A proteína p53 não foi expressa em nenhuma amostra de mucosa não neoplásica. Os adenomas com maior grau de displasia exibiram maiores níveis de expressão de p53. Sheikh et al.(1) e Ieda et al.(24) mostraram que a expressão da proteína p53 aumenta com o maior grau de displasia do adenoma. No entanto, esses autores não compararam os resultados em tumores com tecido não neoplásico. Visca et al.(25) compararam a expressão da proteína p53 em adenomas, carcinomas e mucosa não neoplásica adjacente a carcinoma colorretal. Esses autores estudaram material de arquivo, fixado em formalina e embebido em parafina, de cem adenomas não consecutivos e cem adenocarcinomas, incluindo mucosa não neoplásica aderente ao tumor, e controles negativos obtidos de ressecções de colo de doença não neoplásica. Sugerem que os dados da evolução clinico-patológica e de marcadores imunohistoquímicos tanto em tecido de colo normal quanto anormal constitui em modelo atrativo de progressão do tumor. No estudo, observou-se que a expressão da proteína p53 foi maior em adenomas do que na mucosa colorretal de pacientes sem adenomas ou carcinomas, e que o tamanho do adenoma se correlacionou com aumento da expressão da proteína p53.
Leonardos et al.(26) observaram diferenças na atividade de caspase-3 em carcinomas colorretais em comparação com a mucosa não neoplásica. A atividade de caspase-3 foi significativamente maior no tecido tumoral relativo à mucosa não neoplásica. Guan et al.(12) encontraram maior expressão de caspase-3 em adenomas em comparação com a mucosa colônica não neoplásica. Entretanto, Sena et al.(11) estudaram a expressão de caspase-3 em microadenomas e mucosa colônica não neoplásica, e identificaram níveis baixos de proteína ativa nos microadenomas. A função inadequada ou reduzida do processo apoptótico poderá representar uma importante característica da progressão tumoral. Na presente série de casos, a expressão de caspase-3 não diferiu significantemente entre os adenomas e a mucosa não neoplásica ou como uma função dos aspectos anatomopatológicos dos adenomas.
Sato et al.(14) fizeram um estudo retrospectivo em que avaliaram a expressão de COX-2 em 95 adenomas e mucosa colorretal adjacente, encontrando maior expressão de COX-2 nos adenomas que exibiam maiores graus de displasia (com proliferação celular aumentada). McLean et al.(13) avaliaram a expressão de COX-2 em adenomas e na mucosa colorretal, e não encontraram expressão de COX-2 na última, ao passo que a expressão estava significantemente maior nos adenomas, quando comparada com a mucosa normal. Naquele estudo, o nível de expressão de COX-2 foi maior em adenomas >10mm e em adenomas com maiores graus de displasia. Sheehan et al.(9) avaliaram a expressão de COX-2 em 123 adenomas e sua relação com transformação maligna, e encontraram níveis aumentados de expressão de COX-2 que eram proporcionais com relação a tamanho, tipo histológico e grau de displasia dos adenomas. Wasilewicz et al.(19) avaliaram a expressão de COX-2 em pólipos colônicos e encontraram maiores níveis de expressão nos adenomas do que nos pólipos não adenomatosos. Maior expressão de COX-2 foi encontrada nos adenomas displásicos e em pólipos >6mm. Todavia, Einspahr et al.(27) não observaram nenhuma relação significante entre a expressão de COX-2 e o grau de displasia, tamanho ou tipo histológico na análise de 108 adenomas colorretais. Mesmo assim, quando o tipo histológico e o tamanho (>7mm) dos adenomas foram analisados em conjunto, os níveis de expressão de COX-2 exibiram um aumento significante.
Sakuma et al.(28) analisaram a expressão de COX-2 em 21 pacientes com câncer colorretal. COX-2 foi expressa em oito (38,1%) amostras, e não houve nenhuma relação entre a distribuição e a intensidade de expressão desse marcador. Nakajima et al.(29) encontraram níveis aumentados de expressão de COX-2 em amostras de tecido de carcinoma e na mucosa colônica não neoplásica. No presente estudo, a expressão de COX-2 foi encontrada na mucosa não neoplásica e nos adenomas colorretais, embora sem diferença significante.
Han et al.(30) correlacionaram a expressão de COX-2 com o tamanho do tumor em 50 adenomas colorretais e com 40 carcinomas, e não identificaram uma relação significante. No presente estudo, a associação entre a expressão de COX-2 e o grau de displasia, tamanho e tipo histológico dos adenomas não foi significante. Essa falta de associação é observada, possivelmente, pelo tamanho da maioria dos adenomas (<10mm) e por haver apenas poucos adenomas vilosos na amostra.
A estratégia para tratar carcinoma colorretal pela ativação da apoptose em células tumorais que expressam especificamente os receptores para proteínas relacionadas à indução de morte celular é atraente. Esperam-se resultados promissores em estudos clínicos de fases I/II, em andamento, que provem a eficácia dessa terapia com anticorpos agonistas e/ou proteínas recombinantes, quer de modo isolado ou em combinação com drogas quimioterápicas(31). Entretanto, questões fundamentais necessitam de estudos extensos antes da aplicação clínica dessa modalidade terapêutica ser considerada segura. Sua ação deve ser seletiva e efetiva para reduzir a toxicidade sistêmica excessiva em comparação com células normais. Além disso, é necessário entender melhor os mecanismos de sinalização desencadeados por genes que levam à sobrevida de células resistentes à apoptose(31).
CONCLUSÃO
A proteína p53 mutada foi hiperexpressa nos adenomas em comparação com a mucosa não neoplásica. O tamanho aumentado de adenoma e o grau de displasia mostraram associação com uma maior expressão de p53 mutada. A imunoexpressão de ciclo-oxigenase-2 e de caspase-3 nos adenomas não mostrou associação com os aspectos anatomopatológicos do tumor, e não diferiu da expressão dessas proteínas na mucosa colorretal não neoplásica.
Data de submissão: 1/2/2013
Data de aceite: 10/10/2013
Conflito de interesse: não há.
Trabalho realizado na Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.
- 1. Sheikh RA, Min BH, Yasmeen S, Teplitz R, Tesluk H, Ruebner BH, et al. Correlation of Ki-67, p53, and Adsab-9 immunohistochemical staining and ploidy with clinical and histopathologic features of severely dysplastic colorectal adenomas. Dig Dis Sci. 2003;48(1):223-9.
- 2. Goel A, Boland CR. Recent insights into the pathogenesis of colorectal cancer. Curr OpinGastroenterol. 2010;26(1):47-52.
- 3. Rosenberg DW, Giardina C, Tanaka T. Mouse models for the study of colon carcinogenesis. Carcinogenesis. 2009;30(2):183-96.
- 4. Neri E, Faggioni L, Cini L, Bartolozzi C. Colonic polyps: inheritance, susceptibility, risk evaluation, and diagnostic management. Cancer Manag Res. 2011;3:17-24.
- 5. Fulda S, Debatin KM. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy. Oncogene. 2006;25(34):4798-811.
- 6. Gown AM, Willingham MC. Improved detection of apoptotic cells in archival paraffin sections: immunohistochemistry using antibodies to cleaved Caspase 3. J Histochem Cytochem. 2002;50(4):449-54.
- 7. Grivicich I, Regner A, Rocha AB. Morte celular por apoptose. See Bras Cancerol. 2007;53(3):335-43.
- 8. Su Y, Shrubsole MJ, Ness RM, Cai Q, Kataoka N, Washington K, et al. Immunohistochemical expressions of Ki-67, cyclinD1, b-Catenin, cyclooxygenase-2, and epidermal growth factor receptor in human colorectal adenoma: a validation study of tissue microarrays. Cancer Epidemiol Biomarkers Prev. 2006;15(9):1719-25.
- 9. Sheehan KM, O'Connell F, O'Grady A, Conroy RM, Leader MB, Byrne MF, et al. The relationship between cyclooxygenase-2 expression and characteristics of malignant transformation in human colorectal adenomas. Eur J Gastroenterol Hepatol. 2004;16(6):619-25.
- 10. He X, He L, Hannon GJ. The guardian's little helper: microRNAs in the p53 tumor suppressor network. Cancer Res. 2007;67(23):11099-101.
- 11. Sena P, Roncucci L, Marzona L, Mariani F, Maffei S, Manenti A, et al. Altered expression of apoptosis biomarkers in human colorectal microadenomas. Cancer Epidemiol Biomarkers Prev. 2010;19(2):351-7.
- 12. GuanJT, Wang L, Wang Y, Li Y, Wang R, Zhang WY, et al. Expression of AIF and caspase-3 in colorectal carcinoma, adenoma, and normal mucosa and its correlation. Chin J GastrointSurg (Zhonghua Wei Chang WaiKeZaZhi). 2009;12(4):391-4.
- 13. McLean MH, Murray GI, Fyfe N, Hold GL, Mowat NA, El-Omar EM. COX-2 expression in sporadic colorectal adenomatous polyps is linked to adenoma characteristics. Histopathology. 2008;52(7):806-15.
- 14. Sato T, Yoshinaga K, Okabe S, Okawa T, Higuchi T, Enomoto M, et al. Cyclooxygenase-2 expression and its relationship with proliferation of colorectal adenomas. Jpn J ClinOncol. 2003;33(12):631-5.
- 15. Chapple KS, Scott N, Guillou PJ, Coletta PL, Hull MA. Interstitial cell cyclooxygenase-2 expression is associated with increased angiogenesis in human sporadic colorectal adenomas. J Pathol. 2002;198(4):435-41.
- 16. Fujita M, Fukui H, Kusaka T, Ueda Y, Fujimori T. Immunohistochemical expression of cyclooxygenase (COX-2) in colorectal adenomas. J Gastroenterol. 2000;35(6):488-90.
- 17. Arber N. Cyclooxygenase-2 inhibitors in colorectal cancer prevention: point. Cancer Epidemiol Biomarkers Prev. 2008;17(8):1852-7.
- 18. Galamb O, Spisák S, Sipos F, Tóth K, Solymosi N, Wichmann B, et al. Reversal of gene expression changes in the colorectal normal-adenoma pathway by NS398 selective COX2 inhibitor. Br J Cancer. 2010;102(4):765-73.
- 19. Wasilewicz MP, Kolodziej B, Bojulko T, Kaczmarczyk M, Sulzyc-Bielicka V, Bielicki D. Expression of cyclooxygenase-2 in colonic polyps. Pol Arch Med Wewn. 2010;120(9):313-20.
- 20. Pires AR, Andreiuolo FM, de Souza SR. TMA for all: a new method for the construction of tissue microarrays without recipient paraffin block using custom-built needles. Diagn Pathol. 2006;1:14-8.
- 21. Cunha KS, Caruso AC, Gonçalves AS, Bernardo VG, Pires AR, da Fonseca EC, et al. Validation of tissue microarray technology in malignant peripheral nerve sheath tumours. J Clin Pathol. 2009;62(7):629-33.
- 22. Walker RA. Quantification of immunohistochemistry-issues concerning methods, utility and semiquantitative assessment I. Histopathology. 2006; 49(4):406-10.
- 23. Kaklamanis L, Gatter KC, Mortensen N, Baigrie RJ, Heryet A, Lane DP, et al. p53 expression in colorectal adenomas. Am J Pathol. 1993;142(1):87-93.
- 24. Ieda S, Watatani M, Yoshida T, Kuroda K, Inui H, Yasutomi M. Immunohistochemical analysis of p53 and rasp21 expression in colorectal adenomas and early carcinomas. Surg Today. 1996;26(4):230-5.
- 25. Visca P, Alò PL, Del Nonno F, Botti C, Trombetta G, Marandino F, et al. Immunohistochemical expression of fatty acid synthase, apoptotic-regulating genes, proliferating factors, and ras protein product in colorectal adenomas, carcinomas, and adjacent non-neoplastic mucosa. Clin Cancer Res. 1999; 5(12):4111-8.
- 26. Leonardos L, Butler LM, Hewett PJ, Zalewski PD, Cowled PA. The activity of caspase-3-like proteases is elevated during the development of colorectal carcinoma. Cancer Lett. 1999;143(1):29-35.
- 27. Einspahr JG, Krouse RS, Yochim JM, Danenberg PV, Danenberg KD, Bhattacharyya AK, et al. Association between cyclooxygenase expression and colorectal adenoma characteristics. Cancer Res. 2003;63(14):3891-3.
- 28. Sakuma K, Fujimori T, Hirabayashi K, Terano A. Cyclooxygenase (COX)-2 immunoreactivity and relationship to p53 and Ki-67 expression in colorectal cancer. J Gastroenterol. 1999;34(2):189-94.
- 29. Nakajima T, Hamanaka K, Fukuda T, Oyama T, Kashiwabara K, Sano T. Why is cyclooxygenase-2 expressed in neuroendocrine cells of the human alimentary tract? Pathol Int. 1997;47(12):889-91.
- 30. Han YD, Hong YK, Kang JG, Choi YJ, Park CH. Relation of the expression of cyclooxygenase-2 in colorectal adenomas and adenocarcinomas to angiogenesis and prognosis. J Korean Soc Coloproctol. 2010;26(5):339-46.
- 31. Russo M, Mupo A, Spagnuolo C, Russo GL. Exploring death receptor pathways as selective targets in cancer therapy. Biochem Pharmacol. 2010;80(5):674-82.
Datas de Publicação
-
Publicação nesta coleção
31 Jan 2014 -
Data do Fascículo
Dez 2013
Histórico
-
Recebido
01 Fev 2013 -
Aceito
10 Out 2013