Resumos
Tromboembolia pulmonar aguda e exacerbação aguda de doença pulmonar obstrutiva crônica são doenças comuns. A doença pulmonar obstrutiva crônica é um fator clínico de risco para tromboembolia pulmonar aguda. As apresentações clínicas da tromboembolia pulmonar aguda e da exacerbação aguda da doença pulmonar obstrutiva crônica freqüentemente mimetizam-se tanto que pode ser difícil distingui-las. Anormalidades estruturais nos pulmões com doença pulmonar obstrutiva crônica tornam também difícil a interpretação de testes não invasivos de diagnóstico, como o mapeamento de ventilação e perfusão pulmonares. Assim, diagnosticar tromboembolia pulmonar aguda em pacientes com doença pulmonar obstrutiva crônica é uma tarefa desafiadora. Com o objetivo de atualizar o assunto e oferecer sugestões de conduta, nós avaliamos artigos abordando este tema, incluindo relatos e séries de casos, abordagens diagnósticas de tromboembolia pulmonar aguda e fizemos algumas reflexões. A probabilidade clínica de tromboembolia pulmonar aguda em cenários de doença pulmonar obstrutiva crônica é usualmente intermediária, o mapeamento de ventilação e perfusão pulmonares é predominantemente de probabilidade intermediária e os algoritmos de conduta os deveriam assim considerar.
Doença pulmonar obstrutiva crônica; Embolia pulmonar; Embolia pulmonar; Relação ventilação-perfusão
Pulmonary thromboembolism and exacerbation of chronic obstructive pulmonary disease are common conditions. Chronic obstructive pulmonary disease is a clinical risk factor for pulmonary thromboembolism. The presentation of acute pulmonary thromboembolism and acute exacerbation of chronic obstructive pulmonary disease often mimic each other so closely that they cannot be distinguished clinically. The structural abnormalities of the lungs in chronic obstructive pulmonary disease make also difficult to interpret the results of noninvasive tests like ventilation-perfusion lung scans. Therefore, diagnosing acute pulmonary thromboembolism in patients with underlying chronic obstructive pulmonary disease is a challenging task. In order to update knowledge of the subject and offer suggestions regarding conduct, we evaluated various studies addressing this theme, including case reports and case series. In addition, we reviewed diagnostic approaches to acute pulmonary thromboembolism, and we reflect upon that topic. The clinical probability of pulmonary thromboembolism concomitant to chronic obstructive pulmonary disease is typically intermediate, as is positivity on the ventilation-perfusion lung scan. Diagnostic algorithms should take that into consideration.
Pulmonary disease; chronic obstructive; Pulmonary embolism; Pulmonary embolism; Ventilation-perfusion ratio
ARTIGO DE REVISÃO
O desafio de diagnosticar tromboembolia pulmonar aguda em pacientes com doença pulmonar obstrutiva crônica* * Trabalho realizado no Serviço de Pneumologia do Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul -UFRGS - Porto Alegre (RS) Brasil.
Sérgio Saldanha Menna-Barreto
Professor Titular do Departamento de Medicina Interna da Universidade Federal do Rio Grande do Sul - UFRGS - Porto Alegre (RS) Brasil
Endereço para correspondência Endereço para correspondência: Sérgio Menna Barreto Rua Dr. Barbosa Gonçalves 262 CEP: 91330-320, Chácara das Pedras Porto Alegre - RS, Brasil E-mail: smenna@terra.com.br
RESUMO
Tromboembolia pulmonar aguda e exacerbação aguda de doença pulmonar obstrutiva crônica são doenças comuns. A doença pulmonar obstrutiva crônica é um fator clínico de risco para tromboembolia pulmonar aguda. As apresentações clínicas da tromboembolia pulmonar aguda e da exacerbação aguda da doença pulmonar obstrutiva crônica freqüentemente mimetizam-se tanto que pode ser difícil distingui-las. Anormalidades estruturais nos pulmões com doença pulmonar obstrutiva crônica tornam também difícil a interpretação de testes não invasivos de diagnóstico, como o mapeamento de ventilação e perfusão pulmonares. Assim, diagnosticar tromboembolia pulmonar aguda em pacientes com doença pulmonar obstrutiva crônica é uma tarefa desafiadora. Com o objetivo de atualizar o assunto e oferecer sugestões de conduta, nós avaliamos artigos abordando este tema, incluindo relatos e séries de casos, abordagens diagnósticas de tromboembolia pulmonar aguda e fizemos algumas reflexões. A probabilidade clínica de tromboembolia pulmonar aguda em cenários de doença pulmonar obstrutiva crônica é usualmente intermediária, o mapeamento de ventilação e perfusão pulmonares é predominantemente de probabilidade intermediária e os algoritmos de conduta os deveriam assim considerar.
Descritores: Doença pulmonar obstrutiva crônica/complicações; Embolia pulmonar/diagnóstico; Embolia pulmonar/epidemiologia; Relação ventilação-perfusão
A TROMBOEMBOLIA PULMONAR
As taxas de incidência de manifestação inicial de tromboembolia venosa (TEV), em suas formas de trombose venosa profunda (TVP) e de tromboembolia pulmonar aguda (TEP), encontram inúmeras dificuldades para serem estabelecidas, dentre elas o subdiagnóstico, a falta de confiança nos registros de casos, a irregularidade dos serviços de necropsias e a inexatidão dos atestados de óbito.
Em alguns estudos epidemiológicos, a incidência da TEV tem sido estimada em aproximadamente 100 casos por 100.000 pessoas, com menos de 5 casos por 100.000 em pessoas com menos de quinze anos de idade e cerca de 500 casos por 100.000 pessoas na idade de 80 anos.
A incidência de TEV aumenta com a idade, aproximadamente dobrando em cada década após os 40 anos. A TEP é considerada como a complicação pulmonar aguda mais freqüente em pacientes hospitalizados. Manifestações de TEV estão presentes em até 1% dos pacientes internados em hospitais gerais. Cerca de 10% dos óbitos hospitalares são atribuídos à TEP. (1-5)
A TEP é comum e potencialmente fatal nas primeiras horas da ocorrência do evento agudo, e é associada à alta mortalidade se não diagnosticada e tratada. Cerca de 10% dos eventos agudos de TEP são rapidamente fatais, com a morte ocorrendo predominantemente nas primeiras duas horas e meia após a instalação dos sintomas. Cerca de 5% dos pacientes morrem a seguir em conseqüência da TEP, mesmo diagnosticada e com tratamento instituído. A mortalidade geral tem se estabilizado ao redor de 30%, englobando a TEP como causa determinante, causa contributiva ou causa associada do óbito. Metade dos óbitos decorrentes de TEP aguda ocorre em pacientes que não evoluíram para óbito imediato pela sua doença de base. Em pacientes que sobreviveram ao evento agudo e foram tratados por, pelo menos, três meses, a recorrência de TEP fatal é rara durante e após a anticoagulação. Clinicamente a TEV aguda se expressa como TEP em um terço dos pacientes e, como TVP, em dois terços deles.(5-8)
A DOENÇA PULMONAR OBSTRUTIVA CRÔNICA
A doença pulmonar obstrutiva crônica (DPOC) é uma condição de crescente prevalência e importante causa de morbidade e mortalidade em todo o mundo. A prevalência da DPOC por 100.000 habitantes em países desenvolvidos, em 1990, foi de 698 para homens e de 379 para mulheres e, em termos mundiais, de 934 para homens e 733 para mulheres.(9-12)
Nos EUA, a DPOC tornou-se a quarta maior causa de morte, afetando cerca de 20% da população adulta, e é considerada a única, entre as dez principais causas de morte, que continua em ascensão. No Reino Unido, 15% a 20% de homens e 10% das mulheres, aproximadamente, acima de 45 anos de idade, apresentam tosse crônica e expectoração, sendo que a DPOC é diagnosticada em cerca de 4% dos homens e 2% das mulheres. Os índices aumentam após os 45 anos de idade.(12) Na Europa Ocidental, sofrem de DPOC 3 milhões de pessoas na Espanha, 2,7 milhões no Reino Unido, 2,6 milhões na Alemanha, 2,6 milhões na Itália e 2,6 milhões na França.(9-12) Em termos mundiais, aproximadamente 44 milhões de pessoas sofrem de DPOC, sendo ela considerada a sexta maior causa de morte.(10)
A mortalidade por DPOC obtida pelo Código Internacional de Doenças (CID-10) foi de cerca de 50 por 100.000 pessoas, para homens brancos nos EUA, com homens negros, mulheres brancas e mulheres negras apresentando cifras menores.(11) No Reino Unido, a DPOC é diagnosticada em aproximadamente 6% das mortes em homens e em 4% das mortes em mulheres acima de 45 anos de idade. A mortalidade geral por DPOC é de 200 a 300 por 100.000 pessoas entre 45 e 64 anos de idade.(10,12)
EXACERBAÇÕES AGUDAS DA DPOC
Primeiramente, deve-se considerar que há uma tendência de se resumir na palavra "exacerbação" as informações de piora dos sintomas (exacerbação) com o intervalo de tempo (aguda).
A DPOC é geralmente uma doença progressiva, que cursa com lenta piora dos sintomas e das manifestações fisiopatológicas. As exacerbações agudas reduzem a qualidade de vida, sendo inconclusivos os estudos sobre seu impacto na deterioração geral.(13-14)
A DPOC é causa muito comum de hospitalização. A mortalidade intra-hospitalar para pacientes que são admitidos com exacerbação aguda de DPOC e hipercapnia é de 11%, enquanto que a mortalidade em um ano após a alta é de 43%.(15)
A principal anormalidade fisiopatológica nas exacerbações agudas é a piora das trocas gasosas, decorrente, principalmente, do aumento da desigualdade da relação entre ventilação e perfusão alveolares (V/Q). Como conseqüência há aumento da hipoxemia, necessidade de aumento do volume minuto para compensar a extensão do espaço morto alveolar, aumento do trabalho respiratório, risco de estafa muscular respiratória e instalação de hipercapnia. Dependendo do débito cardíaco, poderá haver aumento da diferença arteriovenosa de oxigênio e redução da saturação do sangue venoso misto, o que contribui para a hipoxemia.(16) As causas mais comuns de exacerbação aguda de DPOC são, primariamente, infecção traqueobrônquica e poluição do ar, e secundariamente, pneumonia, embolia pulmonar, pneumotórax, fraturas de costela, uso inapropriado de sedativos, narcóticos e agentes betabloqueadores, falência ventricular direita/esquerda e arritmias.(17)
O DIAGNÓSTICO DE TEP
O diagnóstico da TEP exige a identificação da presença do êmbolo com testes objetivos. Não existe diagnóstico clínico de TEP, já que não se pode confirmar ou excluir sua ocorrência por meio de sinais ou sintomas. Mas a suspeita clínica criteriosa, estabelecendo níveis de probabilidade, incluindo escores clínicos, com ou sem testes de apoio, é essencial para o desenvolvimento do processo diagnóstico.(18-20) Em casos de suspeita com probabilidade clínica alta ou moderada (intermediária), impõe-se o início do tratamento com heparina, protegendo o paciente até a definição diagnóstica nas horas seguintes.(21-22) Em termos gerais, pode-se dizer que a presença de TEP deve ser suspeitada quando há sinais e sintomas compatíveis, presença de fatores de risco e ausência de outro diagnóstico mais provável.(18-20, 23-25)
A apresentação clínica da tromboembolia pulmonar tem amplo espectro de variação: do evento silencioso, virtualmente assintomático, ao quadro de morte súbita. As principais manifestações clínicas são taquipnéia, dispnéia, dor torácica pleurítica, taquicardia, ansiedade, tosse e hemoptise.(23-25) Manifestações clínicas de TVP podem também estar presentes, assim como possibilidade de identificação de fatores de risco. Mais que sintomas isolados, as associações deles têm sido mais expressivas para o desenvolvimento da suspeita clínica.(24)
Os fatores clínicos de risco para TEV são aqueles que proporcionam as condições básicas de trombogênese venosa. Há várias condições médicas que predispõem o paciente a desenvolver trombose venosa. São fatores independentes de risco de TEV: cirurgia, trauma, câncer e quimioterapia, idade acima dos 40 anos, insuficiência cardíaca congestiva, doenças crônicas limitantes de movimentos, estados trombofílicos heterozigóticos e/ou combinados, e síndrome antifosfolípide. O uso de contraceptivos orais e de reposição hormonal e o estado gravídico-puerperal constituem-se em fatores de risco adquiridos na mulher.(1-2,4) Os testes de confirmação diagnóstica têm sofrido evolução, com os novos recursos de imagens e a valorização dos dímeros-D.
São critérios de confirmação de TEP: mapeamentos cintilográficos V/Q com resultado de probabilidade alta; cintilografia pulmonar perfusional compatível e radiograma de tórax normal nas áreas afetadas pelos defeitos perfusionais; mapeamento com anormalidades não diagnósticas, associado à identificação objetiva de TVP; angiotomografia helicoidal de tórax (TCH) positiva; e arteriografia pulmonar positiva.(20-21,26) São critérios de exclusão de TEP: mapeamento perfusional normal ou quase normal; arteriografia pulmonar normal (apesar de haver 3% de falso-negativos e discrepância interobservadores para êmbolos subsegmentares); mapeamento V/Q não diagnóstico associado a estudos negativos de TVP; TCH com multidetectores negativa (a ser confirmado); e níveis normais de dímeros-D associados a probabilidade clínica baixa.(20-21, 26-28)
A suspeita pré-teste criteriosa, fruto de acurada avaliação clínica, é uma etapa essencial para o direcionamento do processo diagnóstico, para a definição pós-teste e para a melhor relação entre custo e efetividade. Não obstante, como prova das dificuldades em se fazer uma boa suspeita, vários estudos prospectivos muito bem delineados têm mostrado que a confirmação objetiva de TEP está abaixo de 40% nos casos suspeitados,(27-29) e que cerca de 70% de casos de TEP diagnosticados em necropsias não tiveram suspeita prévia por parte dos médicos assistentes.(30)
OCORRÊNCIA DE TEP EM PACIENTES COM DPOC: EVIDÊNCIAS
A prevalência de DPOC como fator clínico de risco para TEP tem variado em alguns estudos epidemiológicos. No estudo Worcester, em 450 pacientes com episódio inicial de TEV, a DPOC esteve presente em 18% dos pacientes com TEP e em 34% daqueles com TVP.(1) No estudo ICOPER, a DPOC esteve presente em 12,4% de pacientes com TEP.(25) No estudo em Olmsted (Minnesota, EUA), a análise logística univariada, de fatores potenciais de risco para TEV, objetivamente diagnosticada em bases populacionais - para uma primeira manifestação de TEV - comparada com controles da comunidade, encontrou uma razão de chance de 1,2 (intervalo de confiança para 95%: 0,89 - 1,70) para pacientes com DPOC.(2,4) Na análise multivariada a DPOC não figurou como fator independente de risco para TEV.(2,4)
Entre os autores referenciados em nosso estudo, é consenso que a importância da DPOC como fator clínico de risco para TEP deriva dos fatores associados, como idade, sedentarismo, imobilidade, insuficiência cardíaca congestiva, malignidade oculta e, possivelmente, a poliglobulia hipoxêmica. A trombose venosa pode ser causa ou conseqüência das agudizações, desde que nestas estão aumentados os fatores de risco de TEV, principalmente a acentuação da dispnéia ao exercício.
Sabe-se que cerca de 90% das tromboses venosas ocorrem no sistema venoso profundo dos membros inferiores. A origem predominante são as veias da panturrilha, onde o trombo formado pode sofrer lise, permanecer no local ou estender-se para as veias proximais (cerca de 20%). Ao atingir o sistema venoso profundo proximal o trombo aumenta seu potencial de embolizar para o pulmão (cerca de 45 %).(31)
Alguns autores investigaram a presença de TVP em 45 pacientes hospitalizados com descompensação aguda de DPOC, utilizando mapeamento com fibrinogênio marcado com iodo-125, flebografia por contraste, ultra-sonografia e pletismografia de impedância.(32) Encontraram 4 (8,9%) pacientes com TVP (2 com trombose limitada à panturrilha e 2 com tromboses distais e proximais). Em 2 pacientes a TVP estava presente na admissão. De 33 pacientes avaliados com fibrinogênio marcado com iodo-125, a TVP esteve presente em apenas 2 deles durante a internação (6%), e foi considerada complicação de exacerbação de DPOC.
Em outro estudo, foram avaliados 196 pacientes com exacerbação aguda de DPOC de intensidade moderada a grave, internados em unidade de cuidados respiratórios intensivos, através da ultra-sonografia de compressão em membros inferiores.(33) Foi encontrada TVP em 21 pacientes (10,7%), 18 dos quais assintomáticos. Todos os casos foram unilaterais.
Outros autores estudaram 223 pacientes sob ventilação mecânica por descompensação aguda de DPOC.(34) Um grupo recebeu a heparina de baixo peso molecular nadroparina e outro placebo. A presença de TVP foi avaliada por ultra-sonografia de compressão com doppler a cores. Ela foi encontrada em 15% dos pacientes do grupo da nadroparina (13/84) e em 28,2 % do grupo placebo (24/85) (p = 0,045). Quanto à sua localização, no grupo da nadroparina 3 casos foram proximais e 10 distais, enquanto que no grupo controle 7 casos apresentaram TVP proximais e 17 distais. O uso de nadroparina subcutânea resultou em redução de 45% na incidência de TVP.
Outro estudo avaliou a presença de TVP em 56 pacientes hospitalizados com exacerbação aguda de DPOC de intensidade moderada a grave.(35) Foi utilizada ultra-sonografia de compressão com doppler a cores em todos os casos e flebografia por contraste em dois pacientes com resultado indeterminado. A TVP esteve presente em 6 pacientes (10,7%). Mapeamento V/Q foi realizado em 8 pacientes com suspeita de TEP por presença de sintomas, hipocapnia ou radiograma de tórax sugestivo. Cinco pacientes apresentaram V/Q com alta probabilidade de TEP. No total, 16% dos pacientes estudados apresentaram diagnóstico de TEV. Não houve, neste estudo, indicação sobre a localização da TVP.
Outros autores apresentaram três casos de pacientes com DPOC grave, com TEP documentada angiograficamente, enfatizando que estudos clínicos e cintilográficos foram de pouca valia no estabelecimento do diagnóstico.(36) As manifestações clínicas foram súbitas piora da dispnéia e redução da capacidade de exercício. Os três pacientes tiveram aumento agudo da ventilação alveolar com redução dos valores prévios dos níveis de pressão parcial arterial de dióxido de carbono (PaCO2), bem como hipoxemia. Estas mudanças nos gases arteriais em pacientes com DPOC grave deveriam sugerir TEP, em lugar de exacerbação da obstrução brônquica. O mapeamento V/Q mostrou múltiplos defeitos segmentares bilaterais discordantes em um caso, defeitos concordantes em outro e, no terceiro caso, não foi realizado mapeamento. Os autores consideraram que a inatividade e a insuficiência cardíaca direita podem ter sido os fatores predisponentes da TEV e recomendaram que: a TEP deve ser suspeitada em qualquer paciente com DPOC e cor pulmonale, cuja dispnéia tenha piora precipitada e seja irresponsiva ao tratamento broncodilatador convencional; o diagnóstico de TEP seja apoiado pela redução da PaCO2 em pacientes previamente hipercápnicos; sinais clínicos e cintilográficos não devem ser considerados úteis na diferenciação entre TEP e exacerbação aguda de DPOC; a angiografia deve ser realizada para se confirmar o diagnóstico de TEP em pacientes com DPOC grave.
Em outro trabalho, foram estudados dois pacientes com TEP aguda maciça (obliteração da circulação pulmonar > 50% à angiografia).(37) Ambos os pacientes tinham acentuado gradiente alvéolo-arterial de oxigênio (um paciente com pressão parcial de oxigênio arterial de 62 mmHg, com fração inspirada de oxigênio de 100%; e o outro com pressão parcial de oxigênio arterial de 45 mmHg, com fração inspirada de oxigênio de 40% sob máscara). Foi empregada a técnica da eliminação múltipla de gases inertes para se determinar a distribuição da relação V/Q. O aumento da desuniformidade da relação V/Q foi encontrado nos dois pacientes, sendo este aumento causado inteiramente pela maior ventilação de unidades com alta relação V/Q (> 1,0). Não foi encontrado fluxo sangüíneo perfundindo áreas de relação V/Q abaixo de 1,0. Ambos os pacientes tiveram grande quantidade de fluxo sangüíneo (20% a 39% do débito cardíaco) perfundindo unidades pulmonares não ventiladas (shunt), e a percentagem do volume minuto desviado para unidades pulmonares subperfundidas, bem como a relação espaço morto/volume corrente, determinadas pela equação de Bohr, estavam aumentadas. Com 82% do volume minuto dirigido para área de espaço morto e regiões com alta relação V/Q, pode-se explicar porque um dos pacientes tinha PaCO2 de 42 mmHg, não obstante um volume minuto de 17 litros (relação entre espaço morto e volume corrente de 78%). No outro paciente, a PaCO2 foi de 24 mmHg (volume minuto de 13 litros e relação entre espaço morto e volume corrente de 54%). Os autores concluíram que, nestes dois pacientes com TEP maciça, a desuniformidade V/Q não representou papel predominante na hipoxemia e que a elevação do gradiente alvéolo-arterial de oxigênio foi explicada pelo grande curto-circuito (shunt) encontrado.
As causas mais prováveis de grandes shunts no cenário de TEP aguda são edema pulmonar e atelectasia (com ou sem infarto pulmonar). O mecanismo de formação de edema pulmonar pode ser a liberação de mediadores que produzem aumento de permeabilidade e aumento de pressão hidrostática em vasos não obstruídos, ambos acompanhados de aumento da filtração no parênquima pulmonar.
Os mecanismos propostos para hipoxemia na TEP aguda incluem shunt direita-esquerda, prejuízo da difusão, desuniformidade V/Q e dessaturação do sangue venoso misto por aumento do gradiente arteriovenoso de oxigênio.
Alguns autores apresentaram o caso de um paciente sem doença cardíaca ou pulmonar de base, com hipercapnia refratária secundária à TEP maciça.(38) Revisaram sumariamente vários relatos de casos de pacientes com TEP maciça e hipercapnia, apesar do aumento do volume minuto em ventilação espontânea ou em ventilação mecânica.
Outros autores apresentaram o caso de um paciente com 81 anos de idade, com DPOC grave, quadro de aparente exacerbação aguda de DPOC, história de duas semanas de dispnéia e tosse produtiva de escarro purulento.(39) A gasometria arterial, em ar ambiente, mostrou pressão parcial arterial de oxigênio de 43 mmHg, PaCO2 de 38 mmHg e pH 7,43. O paciente foi tratado com antibióticos, prednisolona e broncodilatadores, tendo melhorado da tosse e do escarro após uma semana de tratamento, mas continuou com dispnéia. A angiotomografia helicoidal de tórax mostrou TEP envolvendo a artéria pulmonar direita.
Em outro estudo, foram investigados 83 pacientes com DPOC e suspeita de TEP, através de mapeamentos V/Q.(40) Os mapeamentos foram categorizados como de probabilidade alta, não diagnósticos ou de probabilidade baixa. TEP esteve presente em 19 de 22 casos com mapeamentos de probabilidade alta (86%), em nenhum de 2 não diagnósticos (0%) e em 4 de 59 casos com probabilidade baixa (7%). A sensibilidade geral dos cintilogramas V/Q foi de 83% e a especificidade de 92%. Resultados falso-negativos ocorreram em 3 de 16 pacientes com anormalidades no estudo ventilatório em mais de 50% dos campos pulmonares (19%). Em 67 pacientes em que as anormalidades ventilatórias estiveram presentes em menos de 50% dos campos pulmonares, o mapeamento V/Q teve sensibilidade de 95% e especificidade de 94% para o diagnóstico de TEP. Os autores concluíram que, a despeito do diagnóstico de DPOC, o mapeamento V/Q constitui método confiável para se detectar TEP, se as anormalidades do componente ventilatório forem limitadas.
Alguns autores avaliaram o impacto da cardiopatia ou pneumopatia prévias na utilidade do mapeamento V/Q no diagnóstico de TEP, em pacientes do estudo PIOPED.(27) Foram comparadas cintilografias de 365 pacientes sem doenças prévias (117 com TEP), com as de 526 pacientes com cardiopatias ou pneumopatias de base (140 com TEP).(41) Os resultados mostraram que o valor preditivo positivo para V/Q de probabilidade alta foi de 83% para casos com doenças de base, e de 93% para pacientes sem doenças de base, diferença que se mostrou não significativa. A sensibilidade dos estudos V/Q de probabilidade alta foi de 39% para pacientes com doença de base e de 43% para aqueles sem doença de base, diferença também não significativa. Estudos V/Q de probabilidade intermediária em pacientes com TEP confirmada estiveram presentes em 39% dos pacientes sem doença de base, e em 26% dos pacientes com doenças de base (p < 0,02). A especificidade de um mapeamento V/Q de probabilidade alta com doença de base foi de 97%, e sem doença de base foi de 98%, diferença também não significativa. Os autores concluíram que a utilidade diagnóstica do mapeamento V/Q para TEP aguda não foi prejudicada pela presença de doença cardíaca ou pulmonar preexistentes, embora resultados de probabilidade intermediária (não diagnósticos) fossem mais freqüentemente encontrados em pacientes com doenças de base.
Foram avaliados, em outro estudo,(42) as características clínicas e os testes não invasivos, incluindo o mapeamento V/Q, em 108 pacientes com DPOC e suspeita de TEP, que faziam parte da casuística geral do PIOPED.(27) TEP foi diagnosticada em 21 pacientes (19%), 20 por angiografia e 1 por necropsia, não sendo confirmada em 87 pacientes. Não houve diferenças significativas nas manifestações clínicas, radiografia de tórax e na gasometria arterial entre os grupos de pacientes com e sem TEP confirmada. Mas em pacientes com TEP, a dor torácica pleurítica foi mais freqüente, porém de forma não significativa. O gradiente alvéolo-arterial de oxigênio no grupo com TEP foi de 64 ± 59 mmHg e no grupo sem TEP de 89 ± 116 mmHg (a fração inspirada de oxigênio foi variada). A PaCO2 foi de 34 ± 6 mmHg e de 38 ± 11 mmHg, respectivamente. A maioria dos mapeamentos V/Q (65/108 = 60%) foi interpretada como de probabilidade intermediária para TEP. Probabilidade intermediária esteve presente em 33% de 356 pacientes do PIOPED sem doença cardíaca ou pulmonar prévias (p = 0,001) e em 43% de 227 pacientes com doenças cardíacas ou pulmonares (incluindo DPOC) prévias (p = 0,01). Apenas 5% foram interpretados como de probabilidade alta, outros 5% foram interpretados como normais ou quase normais, e 30% foram interpretados como de probabilidade baixa (não diagnósticos). Os 5% de pacientes com mapeamento V/Q de probabilidade alta tiveram a TEP confirmada, e os 5% de pacientes com mapeamento V/Q normal ou quase normal tiveram a TEP excluída. Entre os pacientes com mapeamento V/Q de probabilidade intermediária, 22% tiveram confirmada a TEP e, naqueles com baixa probabilidade, 6% a tiveram confirmada. Em resumo, em pacientes com DPOC, o mapeamento V/Q é predominantemente de probabilidade intermediária, mas em 19% de pacientes com DPOC, o mapeamento V/Q foi diagnóstico, isto é, de probabilidade alta ou normal, ou houve concordância entre probabilidades baixas, quadro clínico e cintilografia.
Alguns autores,(24) revisando a casuística do PIOPED,(27) constataram que pacientes com DPOC (n = 21) que tiveram TEP diferiam de pacientes com TEP sem doença cardíaca ou pulmonar prévias (n = 117): no grupo com DPOC, dor pleurítica foi menos freqüente (p < 0,005), enquanto que tosse (p < 0,05) e sibilância (p < 0,001) foram menos freqüentes no grupo sem doença cardíaca ou pulmonar prévias (Tabela 1).
Outros autores(43) estudaram a mortalidade por TEP em pacientes com DPOC com dados do PIOPED.(27) Foram avaliadas as taxas de mortalidade em 1.487 pacientes que se submeteram a mapeamentos V/Q, para diagnóstico de TEP, tendo eles sido acompanhados por até um ano após a entrada no estudo. Morreram 23,8% dos pacientes com TEP e 18,9% daqueles sem TEP (risco relativo de 1,34, intervalo de confiança para 95%: 1, p = 0,03). Dentre os pacientes com DPOC e TEP morreram 53,3%. Após ajuste para as características dos pacientes, o risco estimado de morrer dentro de um ano após o evento tromboembólico foi de 1,94 vezes (intervalo de confiança para 95%: 1,17 - 3,24) para pacientes com DPOC e TEP, comparados com aqueles sem TEP, e 1,14 (intervalo de confiança para 95%: 0,85 - 1,54) para pacientes com TEP sem DPOC (p = 0,08). A hipertensão arterial pulmonar talvez possa explicar a associação entre DPOC, TEP e mortalidade. A hipertensão arterial pulmonar foi associada com mortalidade (p = 0,001), mas não com DPOC (p = 0,25) ou TEP (p = 0,79). Não houve interação apreciável entre TEP, DPOC e hipertensão arterial pulmonar (p = 0,79). O risco relativo estimado de mortalidade entre pacientes com hipertensão arterial pulmonar foi de 1,87 (intervalo de confiança para 95%: 1,42 - 2,45). Em pacientes com DPOC o risco relativo estimado de mortalidade ajustada para hipertensão arterial pulmonar em pacientes com TEP foi de 1,52 (intervalo de confiança para 95%: 0,90 - 2,55), em comparação com pacientes sem TEP.
Um estudo investigou 627 pacientes consecutivos com suspeita de TEP em seis hospitais de ensino nos EUA, com o objetivo de avaliar o desempenho dos dímeros-D, mapeamento V/Q, TCH e angiografia convencional no diagnóstico de TEP em pacientes com DPOC.(44) Os pacientes foram independentemente categorizados como tendo ou não DPOC (diagnóstico clínico, radiológico e funcional pulmonar). Noventa e um pacientes foram identificados como tendo DPOC (15%). TEP esteve presente em 29% dos pacientes com DPOC e em 31% dos pacientes sem DPOC. O mapeamento V/Q foi não diagnóstico em 46% dos pacientes com DPOC e em 21% daqueles sem DPOC (p = 0,001). O desempenho diagnóstico de um mapeamento V/Q, de probabilidade alta, não diferiu significativamente entre pacientes com e sem DPOC: sensibilidade 79% versus 88%, especificidade 92% versus 96%, valor preditivo positivo 79% versus 90%, valor preditivo negativo 92% versus 94%. Contrariamente ao esperado, a sensibilidade, a especificidade e os valores preditivos positivo e negativo foram maiores com mapeamento V/Q do que com TCH nos dois grupos de pacientes. A distribuição da probabilidade clínica, valor diagnóstico dos dímeros-D, valor diagnóstico da TCH e a reprodutibilidade da angiografia pulmonar foram comparáveis entre pacientes com e sem DPOC. A presença de DPOC não afetou o desempenho diagnóstico da probabilidade clínica, dos dímeros-D, da TCH e da angiografia pulmonar. Embora mais cintilografias não diagnósticas possam ser esperadas na presença de DPOC, o estudo V/Q mostrou-se ser um estudo valioso em pacientes com DPOC e suspeita de TEP.
COMENTÁRIOS
A suspeita clínica de TEP aguda provável (probabilidade clínica alta ou pré-teste diagnóstico) baseia-se na presença de um ou mais fatores de risco e sintomas clínicos compatíveis, não explicados por outro diagnóstico. A presença de outra possível causa para o quadro diminui a probabilidade de ocorrência de TEP.(46)
A DPOC não é um fator independente de risco para TEP, mas muitas condições potencialmente associadas à DPOC, como imobilidade, idade avançada, insuficiência cardíaca congestiva e câncer subjacente, têm sido relacionadas, independentemente, como fatores clínicos de risco para TEV. Assim, em face de sintomas compatíveis, a DPOC configura-se como um fator clínico de risco a ser considerado, mesmo que a limitação ao fluxo aéreo não seja por si só fator trombogênico. Paralelamente, pode-se teorizar que, como os sintomas compatíveis com a TEP podem ser explicados pela doença de base, com exceção de dor pleurítica aguda, quando presente, a suspeita clínica de TEP aguda em cenário de DPOC configuraria uma probabilidade intermediária de TEP.
É difícil identificar características de TEP aguda em pacientes que podem estar vivenciando uma exacerbação aguda de DPOC grave. Sintomas, sinais físicos, anormalidades radiográficas e anormalidades no gradiente alvéolo-arterial de oxigênio ou na PaCO2, da mesma forma que não permitem o diagnóstico de TEP em indivíduos sem doença cardíaca ou pulmonar de base, não ajudam no reforço da suspeita em casos de TEP e DPOC.
Usualmente, os pacientes com DPOC grave já apresentam hipoxemia, devido à dispersão da relação da V/Q. A hipoxemia costuma se acentuar em exacerbações agudas ou por episódios de TEP. Tem sido sugerido que a redução da PaCO2 em um paciente previamente hipercápnico levanta a suspeita de TEP. Entretanto, a PaCO2 pode não ser reduzida e até aumentar em alguns pacientes com DPOC, devido à inabilidade de o volume minuto compensar o incremento do espaço morto causado pela TEP, ou pela distribuição do volume minuto para área de espaço morto alveolar. A TEP deve ser suspeitada em qualquer paciente com DPOC grave com piora da dispnéia e da redução da capacidade de exercício, e que não responda ao tratamento broncodilatador convencional.
Antibióticos podem melhorar a tosse e a expectoração purulenta eventualmente presentes, mas a falta de melhora correspondente da dispnéia, ou mesmo sua piora, deve levar à suspeição de episódio tromboembólico causal ou associado à exacerbação aguda de DPOC.
Levantada a suspeita, outro desafio é a confirmação diagnóstica, dentro do princípio da relação custo-benefício. O mapeamento V/Q tem sido o principal instrumento diagnóstico de TEP nas últimas décadas. Na casuística do PIOPED,(27) no grupo de pacientes com DPOC, foram encontrados 60% de diagnósticos V/Q de probabilidade intermediária, contra 33% em pacientes sem doença pulmonar prévia,(42) mas em 19% dos pacientes com DPOC o mapeamento V/Q foi diagnóstico, isto é, de probabilidade alta, normal ou com concordância entre as manifestações clínicas e probabilidade baixa. Mapeamentos V/Q de probabilidades alta ou normal não foram afetados pela doença de base. Um estudo anterior(35) já havia constatado que, a despeito do diagnóstico de DPOC, o mapeamento V/Q constitui método confiável para se detectar TEP se as anormalidades do estudo ventilatório forem pouco extensas, embora estudos V/Q de probabilidade intermediária tenham ocorrido mais freqüentemente em pacientes com doenças pulmonares de base.
Os dímeros-D estão ocupando um lugar cada vez mais importante nos algoritmos diagnósticos da TEV pelo seu alto valor preditivo negativo, decorrente da alta sensibilidade. Associados aos níveis de probabilidade clínica, podem excluir presença de TEV aguda, quando negativos e associados à baixa probabilidade ou a exames de imagens indeterminados. Os níveis de dímeros-D estão aumentados em qualquer condição em que ocorre fibrinólise reacional, na qual fibrina é formada e degradada por plasmina. Os dímeros-D estão aumentados em presença de infecção, câncer, cirurgia, insuficiência cardíaca, insuficiência renal, síndromes coronarianas agudas, acidente vascular cerebral não lacunar, gravidez e crises falciformes. Valores aumentados ocorrem em cerca de 80% a 90% dos pacientes com infecção ou malignidade. A inflamação crônica da DPOC parece não interferir na elevação basal dos dímeros-D.(20-21,44-45)
Um abrangente estudo encontrou que a presença de DPOC não afetou o desempenho diagnóstico das probabilidades clínicas dos dímeros-D, da TCH e da angiografia pulmonar por cateter.(44) Quanto ao estudo V/Q, embora maior número de mapeamentos não diagnósticos possa ser esperado na presença de DPOC, ele se mostrou um teste útil em pacientes com DPOC e suspeita de TEP.
Vale considerar que os estudos ventilatórios referidos na literatura foram executados com gases radiativos, primeiramente o xenônio-133(27-28,40) e, mais recentemente, o criptônio-81m.(44) Os gases radiativos têm melhor penetração em processos obstrutivos do que o radioaerossol de dietilenotriamino penta-acetato marcado com tecnécio-99m.(47)
Nos pacientes com obstrução acentuada das vias aéreas, a deposição do aerossol faz-se em brônquios e carinas centrais, não atingindo adequadamente a área alveolar para uma comparação V/Q adequada. O estudo PISA-PED(28) demonstrou que o mapeamento perfusional pode ser suficiente para o diagnóstico de probabilidade de TEP, com altos valores preditivos positivo e negativo, quando associado com probabilidades clínicas.
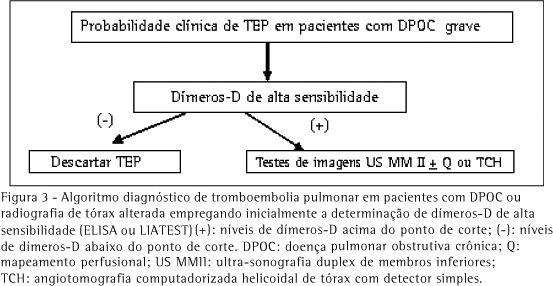
A probabilidade clínica de TEP aguda em pacientes com DPOC grave pode, mais freqüentemente, ser considerada moderada. O estudo do mapeamento perfusional resulta também, mais provavelmente, intermediário (não diagnóstico). Nestas condições tem sido proposto como teste diagnóstico inicial a ultra-sonografia dos membros inferiores e, na negatividade deste, a TCH (Figura 1).(20-21,29,48-49) Sempre que disponível, o mapeamento perfusional pode ser útil para o diagnóstico quando normal/quase normal, ou de alta probabilidade, mesmo em pacientes com DPOC (Figura 2). Em casos de probabilidade clínica baixa, o teste de dímeros-D negativo (de alta sensibilidade) pode afastar o diagnóstico (Figura 3).
Um método que pode aumentar o poder diagnóstico da angiotomografia computadorizada do tórax é o da incorporação da venografia dos membros inferiores. Esta técnica estende o exame das artérias pulmonares às veias profundas da coxa e da fossa poplítea.(50) Considerando-se que a TEV é uma entidade única, a venografia indireta pode auxiliar no seu diagnóstico pela identificação de TVP no mesmo exame. Esta abordagem combinada economiza meio de contraste, mas aumenta a exposição à radiação, e deve, portanto, seguir recomendações específicas.(51) Este método só é valido para exclusão de TVP com procedimentos de excelência técnica,(52) e ainda está à espera de uma validação mais ampla, dentro dos critérios que têm norteado a validação de outros métodos de imagens para diagnóstico de TVP.
Finalmente, deve-se considerar que a tomografia computadorizada helicoidal com multidetectores permite a visualização de vasos subsegmentares. Em exames de alta qualidade pode excluir a TEP. O seu valor preditivo negativo tem sido estimado entre 98% e 99%.(53-54) Como a DPOC não interferiu no desempenho diagnóstico de TCH de detector simples,(44) o impacto específico para o grupo de pacientes com DPOC grave tem expectativa justificadamente favorável.
Os resultados de um estudo multicêntrico para a avaliação da tomografia computadorizada do tórax e imagens de fase venosa para o diagnóstico de doença tromboembólica aguda (NHLBI Collaborative Prospective Investigation of Pulmonary Embolism Diagnosis II - PIOPED II) estão para ser publicados (resultados apresentados no congresso da American Thoracic Society de 2005 em San Diego - EUA). Seguramente, abrir-se-á um novo capítulo no diagnóstico da TEV.
Recebido para publicação em 12/2/05. Aprovado, após revisão, em 6/4/05.
- 1. Anderson FA Jr, Wheeler HB, Goldberg RJ, Hosmer DW, Patwardham NA, Jovanovic B, et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT study. Arch Intern Med. 1991;151(5):933-8.
- 2. Heit JA, Mohr DN, Silverstein MD, Petterson TM, O´Fallon WM, Melton LJ 3rd. Risk factors for deep vein thrombosis and pulmonary embolism. Arch Intern Med. 2000;160(6):809-15.
- 3. Kniffin WD, Baron JA, Barrett J, Birkmeyer JD, Anderson FA Jr. The epidemiology of diagnosed pulmonary embolism and deep venous thrombosis in the elderly. Arch Intern Med. 1994;154(8):861-6.
- 4. Silverstein MD, Heit JA, Mohr DN, Petterson TM, O'Fallon WM, Melton LJ 3rd. Trends in the incidence of deep vein thrombosis and pulmonary embolism: A 25-yers population-based study. Arch Intern Med. 1998;158(6):585-93.
- 5. White RH. The epidemiology of venous thromboembolism. Circulation. 2003(23 Suppl 1):I-4.
- 6. Dalen JE, Alpert JS. Natural history of pulmonary embolism. Prog Cardiovasc Dis. 1975;17(4):259-70.
- 7. Carson JL, Kelley MA, Duff A, Weg JG, Fulkerson WJ, Palevsky HI, et al. The clinical course of pulmonary embolism. N Engl J Med. 1992;326(19):1240-5.
- 8. Douketis JD, Kearon C, Bates S, Duku EK, Ginsberg JS. Risk of fatal pulmonary embolism in patients with treated venous thromboembolism. JAMA. 1998; 279(6):458-62.
- 9. Sorlie PD, Kannel WB, O´Connor G. Mortality associated with respiratory function and symptoms on advanced age. The Framingham Study. Am Rev Respir Dis. 1989;140(2):379-84.
- 10. Murray CJL, Lopez AD, editors. The global burden of disease: a comprehensive assessment of mortality and disability from disease, injuries and risk factors in 1990 and projected to 2002. Cambridge, MA: Harvard University Press; 1996.
- 11. National Heart, Lung, and Blood Institute. Morbidity & mortality: chartbook on cardiovascular, lung, and blood diseases. Bethesda, MD: US Department of Health and Human Services, Public Health Service, National Institute of Health; 1998.
- 12. Guest JF. The annual cost of chronic obstructive pulmonary disease to the UK's National Health Service Dis Manage Health Outcomes .1999;5(2):93-100.[
- 13. Seemungal TA, Donaldson GC, Paul EA, Bestall JC, Jeffries DJ, Wedzicha JA. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Crit Care Med. 1998; 157(5 Pt 1):1418-22.
- 14. Fletcher C, Peto R. The natural history of chronic airflow obstruction. Br Med J. 1977;1(6077):1645-8.
- 15. Connors AF Jr, Dawson NV, Thomas C, Harrel FE Jr, Desbiens N, Fulkenson WJ, et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study of Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med .1996;154(4 Pt 1):959-67. ( Erratum in: Am J Respir Crit Care Med. 1997;155(1):386.
- 16. Barbera JA, Roca J, Ferrer A, Felez MA, Diaz O, Roger N, et al. Mechanisms of worsening gas exchange during acute exacerbations of chronic obstructive pulmonary disease. Eur Respir J. 1997;10(6):1285-91.
- 17. Celli BR, MacNee W; ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J. 2004;23(6):932-46.
- 18. Wells PS, Ginsberg JS, Anderson DR, Kearon C, Gent M, Turpies AG, et al. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med.1998;129(12):997-1005.
- 19. Wicki J, Perneger TV, Junod A, Bounameaux H, Perrier A. Assessing clinical probability of pulmonary embolism in emergency ward: a simple score. Arch Intern Med. 2001;161(1):92-7.
- 20. Fedullo PF, Tapson VF. Clinical practice. The evaluation of suspected pulmonary embolism. N Engl J Med. 2003;349(13):1247-56.
- 21. British Thoracic Society Standards of Care Committee Pulmonary Embolism. Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003;58(6):470-84.
- 22. Büller HR, Agnelli G, Hull RD, Hyers TM, Prins MH, Raskob GE. Antithrombotic therapy for venous thromboembolic disease. the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126(3 Suppl):401S-28S.
- 23. Bell WR, Simon TL, DeMets DL. The clinical features of submassive and massive pulmonary emboli. Am J Med. 1977;62(3):355-60.
- 24. Stein PD Terrin ML, Hales CA, Palevsky HI, Saltzman HA, Thompson T, et al. Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no pre-existing cardiac or pulmonary disease. Chest. 1991; 100(3):598-603.
- 25. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcome in the International Cooperative Pulmonary Embolism (ICOPER). Lancet. 1999;353(9162):1386-9.
- 26. Pistolesi M, Lavorini F, Allscia G, Miniatti M. Diagnostic strategies for suspected pulmonary embolism. Eur Respir J. 2004;30:89-10.
- 27. The PIOPED Investigators. Values of the ventilation/perfusion scan in acute pulmonary embolism - results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). JAMA. 1990; 263(20):2753-9.
- 28. Miniati M, Pistolesi M, Marini C, Ricco GD, Formichi B, Prediletto R, et al. Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the Prospective Investigative Study of Acute Pulmonary Embolism Diagnosis (PISA-PED). Am J Respir Crit Care Med. 1996;154(5):1387-93.
- 29. Musset D, Parent F, Meyer G, Maître S, Girard P, Leroyer C, et al. Diagnostic strategy for patients with suspected pulmonary embolism: a prospective multicentre outcome study. Lancet. 2002;360(9349):1914-20.
- 30. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force Report of the European Society of Cardiology Eur Heart J. 2000; 21(16):1301-36.
- 31. Kakkar WW Howe CT, Flanc C, Clarke MB. Natural history of postoperative deep-vein thrombosis. Lancet. 1969;2(7614):230-2.
- 32. Prescott SM, Richards KL, Tikoff RG, Armstrong JD Jr, Shigeoka JW. Venous thrombosis in decompensated chronic obstructive pulmonary disease. A prospective study. Am Rev Respir Dis. 1981;123(1):32-6.
- 33. Schönhofer B, Köhler D. Prevalence of deep-vein thrombosis of the leg in patients with acute exacerbation of chronic obstructive pulmonary disease. Respiration. 1998;65(3):173-7.
- 34. Fraisse F, Holzapfel L, Couland JM, Simonneau G, Bedock B, Feissel M , et al. Nadroparin in the prevention of deep vein thrombosis in acute decompensated COPD. The Association of Non-University Affiliated Intensive Care Specialist Physicians of France. Am J Respir Crit Care Med. 2000;161(4 Pt 1):1109-14.
- 35. Erelel M, Cuhadaroglu C, Ece T, Arseven O. The frequency of deep venous trombosis and pulmonary embolus in acute exacerbation of chronic obstructive pulmonary disease. Respir Med. 2002;96(7):515-8.
- 36. Lippmann M, Fein A. Pulmonary embolism in the patient with chronic obstructive pulmonary disease. A dianostic dilemma. Chest. 1981;79(1):39-42.
- 37. D'Alonzo GE, Bower JS, DeHart P, Dantzerk DR. The mechanisms of abnormal gas exchange in acute massive pulmonary embolism. Am Rev Respir Dis. 1983;128(1): 170-2.
- 38. Bouchama A, Curley W, Al-Dossary S, Elguindi A. Refractory hypercapnia complicating massive pulmonary embolism. Am Rev Respir Dis. 1988;138(2):466-8.
- 39. Stebbing AEL, Lim TK. A patient with acute exacerbation of COPD who did not respond to conventional treatment. Chest. 1998;114(6):1759-61.
- 40. Alderson PO, Biello DR, Sachariah G, Siegel BA. Scintigraphic detection of pulmonary embolism in patients with obstructive pulmonary disease. Radiology. 1981;138(3):661-6.
- 41. Stein PD, Coleman RE, Gottschalk A, Saltzman HA, Terrin ML, Weg JG. Diagnostic utility of ventilation/perfusion lung scans in acute pulmonary embolism is not diminished by pre-existing cardiac or pulmonary diease. Chest. 1991;100(3):604-06.
- 42. Lesser BA, Leeper KV Jr, Stein PD , Saltzman HA, Chen J, Thompson BT, et al. The diagnosis of acute pulmonary embolism in patients with chronic obstructive pulmonary disease. Chest. 1992;102(1):17-22.
- 43. Carson JL, Terrin ML, Duff A Kelley MA. Pulmonary embolism and mortality in patients with COPD. Chest. 1996;110(5):1212-9.
- 44. Hartmann IJ, Hagen PJ, Melissant CF, Postmus PE, Prins MH. Diagnosing acute pulmonary embolism: effect of chronic obstructive pulmonary disease on the performance od D-dimer testing, ventilation/perfusion scintigraphy, spiral computed tomographic angiography, and conventional angiography. ANTELOPE Study Group. Advances in New Technologies Evaluation the Localizaton of Pulmonary Embolism. Am J Respir Crit Care Med. 2000;162(6):2232-7.
- 45. Stein PD, Hull RD, Patel KC, Olson RE, Ghali WA, Brant R, et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. Ann Intern Med. 2004;140(8):589-602.
- 46. Hyers TM. Venous thromboembolism. Am J Respir Crit Care Med. 1999;159(1):1-14 .
- 47. Hayes M, Taplin GV. Lung imaging with radioaerosols for the assessment of airway disease. Semin Nucl Med. 1980;10(3):243-51.
- 48. Lipchik RJ, Goodman LR. Spiral computed tomography in the evaluation of pulmonary embolism. Clin Chest Med. 1999;20(4):731-8.
- 49. Perrier A, Nendaz MR, Sarasin FP, Haworth N, Bounameaux H. Cost-effectiveness analysis of diagnostic strategies for suspected pulmonary embolism including helical computed tomography. Am J Respir Crit Care Med. 2003;167(1):39-44.
- 50. Loud PA, Grossman ZD, Klippenstein DL, Ray CE. Combined CT venography and pulmonary angiography: a new technique for suspected thromboembolism disease. AJR Am J Roentegenol. 1998;170(4):951-4.
- 51. Rademaker J, Griesshaber V, Hidajat N, Oestmann JW, Felix R. Combined CT pulmonary angiography and venography for diagnosis of pulmonary embolism and deep venous thrombosis: radiation dose. J Thorac Imaging. 2001;16(4):297-9.
- 52. Yankelevitz DF, Gamsu G, Shah A, Rademaker J, Shaham D, Buckshee N, et al. Optimization of combined CT pulmonary angiography with lower extremity CT venography. AJR Am J Roentgenol. 2000;174(1):67-9.
- 53. Kavanagh EC, O'Hare A, Hargaden G, Murray JG. Risk of pulmonary embolism after negative MDCT pulmonary angiography findings. AJR Am J Roentgenol. 2004;182(2): 499-504.
- 54. Eyer BA, Goodman LR, Washington L. Clinician's response to radiologists' reports of isolated subsegmental pulmonary embolism or inconclusive interpretation of pulmonary embolism using MDCT. AJR Am J Roentgenol. 2005;184(2):623-8.
Datas de Publicação
-
Publicação nesta coleção
03 Mar 2006 -
Data do Fascículo
Dez 2005
Histórico
-
Aceito
06 Abr 2005 -
Recebido
12 Fev 2005