Resumos
Paciente masculino, 27 anos, com sintomas respiratórios, linfonodomegalia cervical anterior bilateral e hepatomegalia. Os estudos de imagem evidenciaram linfonodomegalia hilar bilateral e infiltrado pulmonar. O paciente foi submetido a biópsias pulmonar e hepática, que evidenciaram presença de granulomas não caseosos. Também foi submetido à biópsia de linfonodo hilar, que revelou a presença de material amilóide. Os achados clínicos, radiológicos e histopatológicos foram compatíveis com sarcoidose e amiloidose ganglionar. A associação entre sarcoidose e amiloidose é raramente descrita.
Amiloidose; Sarcoidose; Linfonodos
A 27-year-old male patient presented with respiratory symptoms, bilateral enlargement of the cervical lymph nodes and enlarged liver. In the imaging studies, bilateral enlargement of the hilar nodes was observed, together with pulmonary infiltrate. The patient was submitted to lung and liver biopsies, which revealed noncaseating granulomas. The clinical, radiological and histopathological findings were consistent with sarcoidosis and lymph node amyloidosis. The combination of sarcoidosis and amyloidosis has rarely been reported.
Amyloidosis; Sarcoidosis; Lymph nodes
RELATO DE CASO
Amiloidose ganglionar mediastinal em paciente com sarcoidose* * Trabalho realizado no Serviço de Pneumologia do Hospital de Clínicas da Universidade Federal do Paraná UFPR - Curitiba (PR) Brasil.
Lilian SchadeI; Eliane Ribeiro CarmesII; João Adriano de BarrosIII
IGraduanda em Medicina pela Universidade Federal do Paraná UFPR Curitiba (PR) Brasil
IIMestre em Medicina Interna pela Universidade Federal do Paraná UFPR Curitiba (PR) Brasil
IIIChefe do Laboratório de Função Pulmonar do Hospital de Clínicas da Universidade Federal do Paraná HC/UFPR Curitiba (PR) Brasil
Endereço para correspondência Endereço para correspondência: Lilian Schade Rua Mariano Torres, 401, apto 403, Centro CEP 80060-120, Curitiba, PR, Brasil E-mail: lilianschade@terra.com.br
RESUMO
Paciente masculino, 27 anos, com sintomas respiratórios, linfonodomegalia cervical anterior bilateral e hepatomegalia. Os estudos de imagem evidenciaram linfonodomegalia hilar bilateral e infiltrado pulmonar. O paciente foi submetido a biópsias pulmonar e hepática, que evidenciaram presença de granulomas não caseosos. Também foi submetido à biópsia de linfonodo hilar, que revelou a presença de material amilóide. Os achados clínicos, radiológicos e histopatológicos foram compatíveis com sarcoidose e amiloidose ganglionar. A associação entre sarcoidose e amiloidose é raramente descrita.
Descritores: Amiloidose; Sarcoidose; Linfonodos.
Introdução
A sarcoidose é uma doença sistêmica, de etiologia desconhecida, que acomete indivíduos de qualquer localização geográfica, independentemente de raça, sexo e idade,(1) porém é mais freqüente em indivíduos entre 25 e 40 anos e é rara em crianças.(2,3) A sarcoidose tem sido amplamente estudada,(4-8) bem como a amiloidose, que é caracterizada pela deposição de proteínas fibrilares e insolúveis no espaço extracelular, interferindo na estrutura de tecidos e órgãos.(9)
A associação entre sarcoidose e amiloidose é raramente descrita. Relatamos um caso de sarcoidose associada à amiloidose ganglionar.
Relato do caso
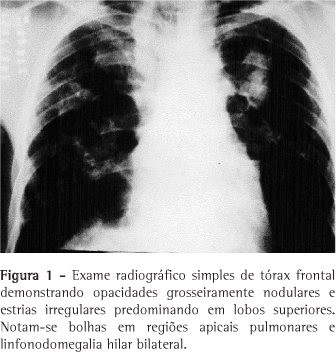
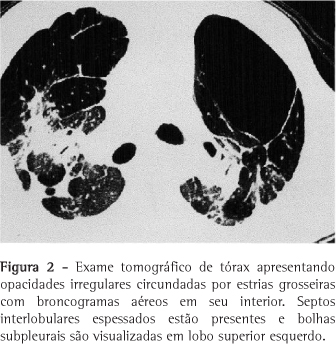
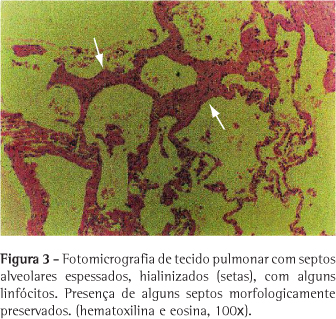
Paciente do sexo masculino, 27 anos, fumante esporádico há cinco anos, há seis anos vem apresentando dispnéia progressiva a esforço moderado, tosse seca e emagrecimento de 20 kg. Há quatro anos vem sendo tratado com corticosteróide sistêmico. Apresentou quadros repetidos de infecção respiratória e três episódios de pneumotórax espontâneo nos dois últimos anos. À admissão apresentava linfonodomegalia em cadeia cervical anterior bilateral de aspecto reacional e hepatomegalia. A ausculta evidenciou hiperfonese de P2, murmúrio vesicular diminuído difusamente e raros sibilos. O hemograma demonstrou poliglobulia (hemoglobina = 18,2 g/dL e volume globular = 54%). As provas de atividade inflamatória e função hepática foram normais. As pesquisas de fungos e de bacilos álcool-acido resistentes (BAAR) no escarro e lavado broncoalveolar foram negativas. O teste de Kveim-Silzbach foi negativo e a dosagem de enzima conversora de angiotensina foi de 51,7 U/L (35-90 U/L). A tomografia computadorizada de tórax demonstrou opacidades irregulares circundadas por estrias grosseiras, septos interlobulares espessados, bolhas subpleurais em lobo superior esquerdo e linfonodomegalia hilar bilateral, já evidenciados à radiografia (Figuras 1 e 2). A espirometria revelou distúrbio ventilatório obstrutivo grave (capacidade vital forçada = 51%, volume expiratório forçado no primeiro segundo = 26% e volume expiratório forçado no primeiro segundo/capacidade vital forçada = 52%) associado a aprisionamento de ar (volume residual = 186% e volume residual/capacidade pulmonar total = 217%) e distúrbio difusional leve (DCO = 69%). A gasometria arterial evidenciou hipoxemia grave (pressão parcial arterial de oxigênio = 45,5 mmHg). Foi realizada ecografia abdominal, que demonstrou fígado homogêneo, mas com sinais de aumento da ecogenicidade periportal. Foi realizada biópsia hepática, que evidenciou agregados multifocais de células epitelióides, ausência de necrose e não foram visualizados BAAR, compatíveis com hepatite granulomatosa multifocal. A biópsia de linfonodo de ângulo traqueobrônquico, através de mediastinoscopia, revelou presença de material hialino, positivo para material amilóide pela coloração de cristal-violeta. Para complementar a investigação, o paciente foi submetido à biópsia pulmonar a céu aberto, cuja histologia demonstrou alargamento de septos alveolares por fibrose, infiltrado inflamatório linfohistiocitário e esparsas estruturas granulomatosas com linfócitos, histiócitos epitelióides e ausência de necrose caseosa, compatíveis com sarcoidose (Figura 3).
Discussão
A sarcoidose pulmonar é uma das causas mais comuns de doença intersticial pulmonar.(4) O trato respiratório está envolvido em praticamente todos os casos de sarcoidose.(1) O sistema linfático é acometido em cerca de 90% dos casos. Acometimentos cardíaco, renal e hepático são pouco freqüentes, normalmente não associados a repercussão funcional relevante. Hepatomegalia, colestase e mínimas alterações de aminotransferases são as manifestações hepáticas mais comuns.(1) O diagnóstico é baseado nas suspeitas clínica e radiológica (linfonodomegalia hilar bilateral com infiltrado pulmonar tipicamente de distribuição perivascular),(5) evidência histológica de granuloma não caseoso e exclusão de outras doenças capazes de produzir quadro clínico e histológico similar.(6) O teste imunológico de Kveim-Silzbach é positivo nas formas ativas da doença em cerca de 80% dos casos.(7) A enzima conversora de angiotensina, presente no tecido pulmonar, embora inespecífica para o diagnóstico, é útil para a avaliação da eficácia do tratamento, pois se encontra aumentada nos casos de sarcoidose ativa.(7) A evolução varia de resolução espontânea em 12 a 36 meses à cronicidade, marcada por fibrose pulmonar progressiva e/ou acometimento de outros órgãos.(2) O prognóstico depende do estadiamento da doença: adenopatia hilar, sem infiltração de parênquima pulmonar (estadio I), adenopatia hilar e infiltrado pulmonar (estadio II) e infiltrado sem adenopatia (estadio III). A remissão varia de 80 a 30% nos estádios I e III, respectivamente.(1) Corticóides são indicados para o tratamento da sarcoidose, porém, não há consenso quanto ao início da sua administração, à dose a ser usada e à duração do tratamento.(8) Um estudo sistemático concluiu que o corticosteróide oral melhora a imagem radiológica pulmonar e a sintomatologia, mas há pouca evidência de que melhore a função pulmonar.(8)
As amiloidoses são um grupo heterogêneo de doenças caracterizadas por deposição extracelular de proteínas fibrilares e insolúveis que interferem na estrutura e na função de diversos tecidos e órgãos. Glicosaminoglicanos e proteína pentraxina amilóide sérica P são componentes não fibrilares do amilóide que contribuem para a fibrilogênese e a estabilidade do depósito amilóide.(9) A amiloidose pode ser hereditária ou adquirida, local ou sistêmica, e é definida de acordo com a proteína precursora.(9,10) Entre as amiloidoses adquiridas estão amiloidose primária (tipo AL, sistêmica), amiloidose nodular local, amiloidose secundária (tipo AA, sistêmica e reativa) e amiloidose sistêmica senil. A amiloidose AL associada a mieloma, discrasias e gamopatias monoclonais é resultado da formação de fibrilas a partir de cadeias leves de anticorpos monoclonais. A amiloidose nodular local acomete principalmente a pele, o trato respiratório e o trato urogenital, e também é originada de cadeias leves de anticorpos monoclonais. A amiloidose AA está associada a doenças crônicas ativas, tais como doenças inflamatórias crônicas, infecções crônicas e algumas neoplasias malignas. Seu precursor é a proteína amilóide A sérica. E ainda, 25% dos indivíduos idosos apresentam depósitos sistêmicos clinicamente silenciosos, ocasionalmente mais extensos no miocárdio, causando disfunção cardíaca que pode ser fatal - amiloidose sistêmica senil. Também são descritas diversas formas hereditárias de amiloidose, com modo de herança autossômico dominante(10). Radiologicamente, as imagens são inespecíficas e variadas.(11) O diagnóstico de amiloidose requer confirmação histológica pela presença de depósito amilóide no tecido.(10) A imunohistoquímica do tecido determina o tipo de amiloidose.(10) Na evolução, a cintilografia com componente amilóide P sérico é capaz de detectar órgãos envolvidos e permitir a avaliação da resposta terapêutica.(9) Nenhuma terapia causa a resolução dos depósitos de amilóide, mas a terapia que reduz o suprimento de precursores de amilóide pode melhorar a sobrevida e preservar a função do órgão acometido.(12)
A associação entre sarcoidose e amiloidose tem sido raramente descrita.(13-19) Os relatos que descrevem a associação da sarcoidose com a amiloidose AA sugerem a implicação do processo inflamatório da sarcoidose na patogênese da amiloidose.(15,16,18) Porém, há discordância quanto a se tratar de sarcoidose associada à amiloidose AL ou apenas uma coincidência.(13,14,19) Relatamos um caso de sarcoidose sistêmica associada à amiloidose ganglionar. O diagnóstico de sarcoidose pulmonar baseou-se no quadro clínico, exames de imagem e função pulmonar, associados aos achados histopatológicos e à exclusão de outras possíveis doenças granulomatosas através da pesquisa de fungos e BAAR no exame de escarro e lavado broncoalveolar.(5,6) A hepatomegalia levou a uma investigação hepática por meio de ecografia abdominal e posterior biópsia. Devido ao achado histológico de hepatite granulomatosa, história de emagrecimento e quadro crônico houve dúvida diagnóstica em relação à tuberculose sistêmica. Decidiu-se, então, realizar biópsia ganglionar mediastinal, o que revelou a presença de material amilóide. Como o padrão pulmonar não era compatível com amiloidose, procedeu-se à investigação por meio de biópsia pulmonar, que confirmou o diagnóstico de sarcoidose, evidenciando a associação entre sarcoidose e amiloidose ganglionar. O teste de Kveim-Silzbach negativo não exclui o diagnóstico de sarcoidose, embora seja positivo em 80% dos casos.(7) A dosagem de enzima conversora de angiotensina dentro dos valores normais sugeriu resposta favorável ao uso de corticosteróide.(7) A imunohistoquímica para determinação do tipo de amiloidose e a cintilografia com amilóide P sérico não estão disponíveis em nosso serviço, o que impossibilitou a classificação do tipo de amiloidose. Considerando que os casos relatados de amiloidose renal e cardíaca associados à sarcoidose evoluíram para óbito ou perda da função renal,(13-15,18,19) questionamos se a presença de material amilóide em linfonodo hilar esteve de alguma forma relacionada à gravidade da evolução da sarcoidose, o que é incomum. A associação descrita suscita interesse quanto ao prognóstico, morbi-mortalidade e resposta ao tratamento, porém, a raridade dos relatos e as descrições de amiloidose em órgãos variados, com repercussões específicas, são fatores limitantes da resposta a esses quesitos.
Recebido para publicação em 28/11/2005. Aprovado, após revisão, em 11/5/2006.
- 1. Newman LS, Rose CS, Maier LA. Sarcoidosis. N Engl J Med. 1997;336(17):1224-34.
- 2. Nunes H, Soler P, Valeyre D. Pulmonary sarcoidosis. Allergy 2005;60(5):565-82.
- 3. Singal A, Thami GP, Goraya JS. Scar sarcoidosis in childhood: case report and review of the literature. Clin Exp Dermatol. 2005;30(3):24-6.
- 4. Baughman RP. Pulmonary sarcoidosis. Clin Chest Med. 2004;25(3): 521-30, vi.
- 5. Koyama T, Ueda H, Togashi K, Umeoka S, Kataoka M, Nagai S. Radiologic manifestations of sarcoidosis in various organs. Radiographics. 2004;24(1):87-104.
- 6. Sharma OP. Pulmonary sarcoidosis: management. J Postgrad Med 2002;48(2):135-41.
- 7. Bethem N, Figueiredo S, Bethem EP, Rezende SRN. Sarcoidose gânglio-pulmonar: conduta diagnóstica e terapêutica. J Pneumol. 1984;10(1):44-50.
- 8. Paramothayan NS, Lasserson TJ, Jones PW. Corticosteroids for pulmonary sarcoidosis. Cochrane Database Syst Rev. 2000;(4):CD001114.
- 9. Hirschfield GM. Amyloidosis: a clinico-pathophysiological synopsis. Semin Cell Dev Biol. 2004;15(1):39-44.
- 10. Gillmore JD, Hawkins PN, Pepys MB. Amyloidosis: a review of recent diagnostic and therapeutic developments. Br J Haematol. 1997;99(2):245-56.
- 11. Georgiades CS, Neyman EG, Barish MA, Fishman EK. Amyloidosis: review and CT manifestations. Radiographics. 2004;24(2):405-16.
- 12. Tan SY, Pepys MB, Hawkins PN. Treatment of amyloidosis. Am J Kidney Dis. 1995;26(2):267-85.
- 13. Rakhit RD, Clesham GJ, Cleland JG. Sarcoid, amyloid and heart failure. Int J Cardiol. 1993;41(2):180-2.
- 14. Stather D, Ford S, Kisilevsky R. Sarcoid, amyloid, and acute myocardial failure. Mod Pathol. 1998;11(9):901-4.
- 15. Tchénio X, Bertocchi M, McGrégor B, Daoud S, Mornex JF, Cordier JF. Type AA renal amyloidosis in sarcoidosis. Rev Mal Respir. 1996;13(6):601-2.
- 16. Levasseur R, Le Goff C, Richer C, Hurault de Ligny B, Marcelli C, Ryckelynck JP. AA amyloidosis complicating sarcoidosis. Rev Med Interne. 1999;20(2):168-70.
- 17. Carreiro M, Margarit-Coll N, Sailler L, Roussel C, Dahan S, Uro-Coste E, et al Localized amyloidosis of the bladder and sarcoidosis: analysis of a fortuitous association. Rev Med Interne 2002;23(7):668-9.
- 18. Komatsuda A, Wakui H, Ohtani H, Maki N, Nimura T, Takatsu H, et al Amyloid A-type renal amyloidosis in a patient with sarcoidosis: report of a case and review of the literature. Clin Nephrol. 2003;60(4):284-8.
- 19. Treaba DO, Benson MD, Assad LW, Dainauskas JR. Sarcoidosis and immunoglobulin lambda II light-chain amyloidosis diagnosed after orthotopic heart transplantation: a case report and review of the literature. Mod Pathol. 2005;18(3):451-5.
Datas de Publicação
-
Publicação nesta coleção
20 Ago 2007 -
Data do Fascículo
Abr 2007
Histórico
-
Aceito
11 Maio 2006 -
Recebido
28 Nov 2005