Diretrizes brasileiras em pneumonia adquirida na comunidade em pediatria - 2007
Pneumonias comunitárias
A pneumonia adquirida na comunidade é uma das infecções do trato respiratório inferior. A historia relatada pela mãe ou cuidador é semelhante ao da bronquite aguda, bronquiolite e outras afecções respiratórias. Há um processo inflamatório que é a resposta do hospedeiro ao agente agressor. O quadro clínico é semelhante, independente do agente etiológico tosse, febre e dificuldade respiratória.
Devido às dificuldades darealização da radiografia de tórax e da interpretação do exame radiológico como atendimento primário, principalmente em crianças menores, é aceitável que os critérios clínicos sugeridos pela Organização Mundial de Saúde e pela Organização Pan-americana de Saúde sejam seguidos nesta diretriz.(15)
Na suspeita clinica de pneumonia, chamamos a atenção da necessidade da maior utilização da radiografia de tórax, que pode confirmar o diagnóstico e melhorar a decisão de tratamento.(610)
Grau de evidência B
Referências
1. OPS. Tratamiento del niño con infección respiratoria aguda. Serie PALTEX para técnicos medios y auxiliares. N.15, P.3. 1987.
1. OMS/OPS. Manejo de casos de infecciones respiratorias agudas en ninos em paises em desarrollo. HPM/ARI/WHO1989;10:2-3.
2. Benguigui, Y. Editor. Infecciones respiratorias agudas: fundamentos técnicos de las estrategias de control. Serie HCT/AIEPI-8. Organización Panamericana de la Salud/Organización Mundial de la Salud, 1997.
3. World Health Organization. Acute respiratory infections in children: case management in small hospitals in developing countries. WHO/ARI/90, 5th ed. Geneva: WHO, 1990.
4. Sant'Anna CC, Cunha AJ, Dalcolmo M. Infecções respiratórias agudas na criança. Rio de Janeiro: Cultura Médica; 1989
5. Gupta A and Doull I. Management and complications of bacterial pneumonia. Curr Opin Pediatr 2003;13:382-7.
6. Mandell LA, Marrie TJ, Grossman RF, Chow AW, Hyland RH. Canadian guidelines for the initial management of community-acquired pneumonia: An evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group. Clin Infect Dis. 2000;31(2):383-421.
7. British Thoracic Society Standards of Care Committee. Guidelines for the management of community acquired pneumonia in childhood. Thorax. 2002;57 Suppl 1:i1-24.
8. McIntosh K. Community-acquired pneumonia in children. N Engl J Med. 2002;346(6):429-37.
9. Donnelly LF. Maximizing the usefulness of imaging in children with community-acquired pneumonia. AJR Am J Roentgenol. 1999;172(2):505-12.
Epidemiologia
A maioria das crianças tem de 4 a 6 infecções respiratórias agudas (IRA) por ano.(1) Dessas, apenas 2-3% evoluem para pneumonia.(2) Entretanto, 80% das mortes por IRA é devido à pneumonia.(3)
São vários os fatores de risco para as IRA de uma maneira geral e para a pneumonia em particular. Os mais importantes são a desnutrição, a baixa idade e as co-morbidades que, juntamente com a gravidade da doença, podem concorrer para o desfecho letal. Outros fatores como baixo peso ao nascer, permanência em creche, episódios prévios de sibilos e pneumonia, ausência de aleitamento materno, vacinação incompleta, variáveis sócio-econômicas e variáveis ambientais também contribuem para a morbidade e a mortalidade.(5)
Atualmente, a estimativa mundial da incidência de pneumonia adquirida na comunidade (PAC) entre crianças menores de 5 anos é de cerca de 0,29 episódios/ano, que equivale a uma incidência anual de 150,7 milhões de casos novos, dos quais 11 a 20 milhões (de 7 a 13%) necessitam internação hospitalar devido à gravidade.(6)
Alguns estudos sobre o tema foram realizados no Brasil. A incidência de PAC com diagnóstico clínico e confirmado por radiografia de tórax foi de 5,66 na cidade de Goiânia Goiás.(5) Na cidade de São Paulo, 0,35 casos para cada 1000 crianças necessitaram internação por PAC na mesma faixa etária.(6)
Ocorreu uma redução do número de hospitalizações entre 1998 e 2005. As internações recuaram no Sistema Único de Saúde de 571.301 para 403.219 (Figura 1). Oitenta por cento das crianças internadas tinham menos de cinco anos. Como acima exposto, esta é a faixa etária de maior vulnerabilidade para esta afecção.(810)
Grau de Evidência A
As IRA representam uma das cinco principais causas de óbito em crianças menores de cinco anos de idade nos países em desenvolvimento, sendo responsáveis por cerca de 3 milhões de mortes/ano.(2,3)
Ainda nos dias atuais o impacto que a pneumonia exerce sobre a mortalidade infantil é preocupante, especialmente nos países em desenvolvimento.(2)
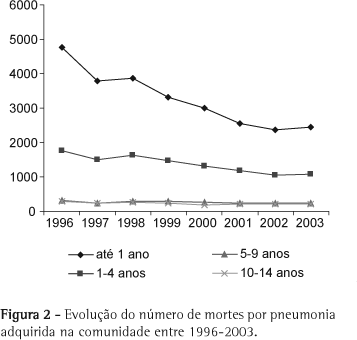
No Brasil, as IRA constituem a segunda causa de óbito em crianças menores de cinco anos em expressiva parcela das unidades federativas. A mortalidade por PAC nas crianças abaixo de 5 anos apresentou uma redução no período de 1996 a 2003 (Figura 2), quando se observa um declínio na taxa de mortalidade proporcional por IRA em menores de 5 anos de 6.41 para 5.39, respectivamente.(8)
Referências
1. Bulla A, Hitze KL. Acute respiratory infections: a review. Bull World Health Organ. 1978;56(3):481-98
2. Ahmad OB, Lopez AD, Inoue, M. The decline in child mortality: a reappraisal. Bull World Health Organ. 2000;78(10):1175-91
3. Williams BG, Gouws E, Boschi-Pinto C, Bryce J, Dye C. Estimates of world-wide distribution of child deaths from acute respiratory infections. Lancet Infect Dis. 2002;2(1):25-32
4. Goya A; Ferrari GF: Fatores de risco para morbimortalidade por pneumonia em crianças. Rev Paul Pediatr. 2005;23(2):99-105.
5. Monteiro, CA, D'Aquino-Benicio, MH. Estudo das condições de saúde das crianças do Município de São Paulo, SP (Brasil), 1984/1985: VI. Doença respiratória. Rev. Saúde Pública. 1987;21(5):380-6.
6. Farha T, Thomson AH. The Burden of Pneumonia in Children in the Developed World. Paediatr Respir Rev. 2005;6(2):76-82.
7. de Andrade, ALSS, Silva, SA, Martelli, CMT, de Oliveira, RM, de Morais Neto, OL, Siqueira Júnior, JB et al. Vigilância populacional de pneumonia em crianças: uso de análise espacial numa área urbana do Brasil Central. Cad. Saúde Pública. 2004;20(2):411-21.
8. DATASUS [homepage on the Internet]. Brazil: Ministerio da Saude SINASC Sistema de informações sobre nascidos vivos. Acesso em fev.2006. http://www.datasus.gov.br/catalogo/sinasc.htm
9. Datasus.gov.br. Tab Net Win32 2_4C7. Sistema de informações sobre nascidos vivos-SINASC, Sistema de informações sobre mortalidade-SIM, IBGE-estimativas demográficas. Acesso em fev.2006.
10. Datasus.gov.br. Tab Net Win32 2_4C7. Sistema de informações sobre nascidos vivos-SINASC, Sistema de informações sobre mortalidade-SIM, IBGE-estimativas demográficas. Acesso em fev.2006.
Etiologia
Um grande número de agentes etiológicos é identificado como causa de pneumonia adquirida na comunidade (PAC). A dificuldade de se obter amostras fidedignas e de respostas em tempo hábil tornam a realização da coleta de exames específicos uma prática não habitual.
O patógeno não é identificado em até 60% dos casos de pneumonia, mas o conhecimento do perfil etiológico das pneumonias é indispensável para orientar a terapêutica.(1,2)
A maioria dos estudos publicados na literatura especializada é originária de países desenvolvidos(1,2,3) e, a despeito da elevada freqüência das pneumonias em nosso meio, as investigações nacionais sobre esse tema ainda são escassas.
Os agentes mais encontrados em vários estudos(1,2,3) estão relacionados na Tabela 1.
Os agentes encontrados são diferentes para cada faixa etária. O conhecimento dos agentes esperados irá orientar o tratamento específico. Os resultados obtidos em países industrializados não podem ser automaticamente transpostos para a realidade brasileira, onde poucos estudos sobre a etiologia das pneumonias são disponíveis até o momento (Tabela 2). O mais expressivo deles foi realizado em São Paulo e avaliou 102 crianças de um mês a 11,5 anos de idade com pneumonia aguda, utilizando o aspirado pulmonar como espécime para a identificação bacteriológica. A positividade final foi de 61,8%, sendo, dentre o total de casos, 23,5% para Streptococcus pneumoniae e 15,6% para Haemophilus influenzae. Bacilos gram-negativos foram mais prevalentes (9,8%) que Staphylococcus aureus (1% do total). A mesma distribuição das bactérias ocorreu em todas as faixas etárias.(4) Outros estudos nacionais obtiveram os mesmos resultados. A participação do S. Aureus também foi pequena.(5,6,9) Os dados obtidos nos estudos nacionais reproduzem os dados mundiais.
Os vírus predominam nos primeiros anos e vão deixando lugar para as bactérias Chlamydia pneumoniae e Mycoplasma pneumoniae a partir do final do período pré-escolar.(2,3,7,8)
Até três dias após o nascimento provavelmente se trata de pneumonia adquirida intra-útero, sendo os agentes etiológicos mais prováveis Streptococcus do Grupo B, organismos Gram negativos e Listeria monocytogenes.
A partir do terceiro dia, devemos considerar S. Aureus e Staphylococcus epidermidis, além dos gram-negativos.
Entre um e três meses de vida, além dos agentes bacterianos, os agentes da "pneumonia afebril do lactente" devem ser lembrados: Chlamydia trachomatis, Ureaplasma urealyticum e o vírus respiratório sincicial.(9)
Acima dos três meses de idade, por ordem de freqüência, os agentes seriam os vírus (respiratório sincicial, sobretudo), S. pneumoniae, H. influenzae (tipo b e cepas não tipáveis); S. Aureus, Chlamydia spp e Mycoplasma pneumoniae têm relevância ainda desconhecida, mas sempre devem ser considerados no diagnóstico diferencial.(9)
Em pré-escolares, a participação do S. Aureus reduz-se e, inversamente, o envolvimento do M. pneumoniae se eleva paulatinamente a partir dos 4-5 anos. Os agentes bacterianos principais continuam sendo S. pneumoniae e H. influenzae, mas com progressivo destaque para o primeiro.(9)
Nos escolares e adolescentes, S. pneumoniae continua sendo o agente bacteriano mais freqüente. M. pneumoniae e Chlamydia pneumoniae são microorganismos de prevalência crescente. H. influenzae e vírus têm participação reduzida.
A associação do S. pneumoniae com H. influenzae ou com bastonetes Gram-negativos foi observada, respectivamente, em taxas de 3,9% e 2,0%.(4) Salienta-se ainda a possibilidade de ocorrência de etiologia mista em até 25% dos casos de PAC.(3)
A escolha terapêutica realizada empiricamente deve ser baseada em agentes esperados para cada faixa etária (PAC). Essa diretriz recomenda que sejam seguidos os dados apresentados no Quadro 1.
Grau de evidência C
Referências
1. Michelow IC, Olsen K, Lozano J, Rollins NK, Duffy LB, Ziegler T et al. Epidemiology and clinical characteristics of community-acquired pneumonia in hospitalized children. Pediatrics. 2004;113(4):701-7.
2. Korppi M, Heiskanen-Kosma T, Jalonen E, et al. Aetiology of community-acquired pneumonia in children treated in hospital. Eur J Pediatr. 1993;152(1):24-30.
3. Heiskanen-Kosma T, Korppi M, Jokinen C, Kurki S, Heiskanen L, Juvonen H et al. Etiology of childhood pneumonia: serologic results of a prospective, population-based study. Pediatr Infect Dis J. 1998;17(11):986-91.
4. Ejzenberg B, Fernandes VO, Rodrigues Neto AJ, Baldacci ER, Belizzio Neto L. Pesquisa da etiologia bacteriana em 102 crianças internadas por pneumonia aguda. Pediat. (São Paulo) 1986;8(2):99-106.
5. Camargos PA, Guimarães MD, Ferreira CS. Benzathine penicillin for unilateral lobar or segmental infiltrates presumptively caused by Streptococcus pneumoniae in children 2-12 years old. J Trop Ped. 1997;43(6):353-60.
6. Grisi SJ. Pneumonias bacterianas agudas. In: Rosov T, editor. Doenças pulmonares em pediatria: diagnóstico e tratamento. São Paulo: Atheneu; 1999. p. 204-14.
7. Ruuskanen O, Nohynek H, Ziegler T, Capeding R, Rikalainen H, Huovinen P et al. Pneumonia in childhood: etiology and response to antimicrobial therapy. Eur J Clin Infect Dis. 1992;11(3):217-23.
8. Juven T, Mertsola J, Waris M, Leinonen M, Meurman O, Roivainen M et al. Etiology of community-acquired pneumonia in 254 hospitalized children. Pediatr Infect Dis J. 2000;19(4):293-8.
9. McCracken GH Jr. Etiology and treatment of pneumonia. Pediatric Infect Dis J. 2000;19(4):373-7.
10. Ejzenberg B Fernandes VO, Rodrigues Neto AJ, Baldacci ER, Grisi SJ, Bellizia L et al. Infecções por vírus, bactérias e mycoplasma pneumoniae em 42 crianças internadas com pneumonia aguda. Pediatria. (S. Paulo) 1986;8:141-7.
11. Jadavji T, Law B, Lebel MH, Kennedy WA, Gold R, Wang EE. A practical guide for the diagnosis and treatment of pediatric pneumonia. CMAJ. 1997;156(5):703.
Aspectos clínicos
As síndromes respiratórias agudas apresentam sintomas muito parecidos. A história clínica deve ajudar a separar as infecções do trato respiratório superior das infecções do trato respiratório inferior.(1) As pneumonias não se apresentam de maneira uniforme, nem quanto aos dados da história, sintomas e exame físico.(1)
A pneumonia adquirida na comunidade (PAC) costuma ser precedida por um quadro de infecção viral alta. A mudança de sinais e sintomas do quadro viral para o bacteriano pode não ser evidente para os familiares.
Na PAC, o quadro clínico pode ser mais grave, a febre mais elevada, a prostração mais evidente e a tosse mais produtiva.(1,2,3)
A pneumonia afebril não é freqüente e é mais encontrada em crianças até os 3 meses de idade. A intensidade da febre e o comportamento do quadro febril podem nos ajudar na distinção clínica. Os quadros virais podem apresentar febre superior a 39 °C, mas após a diminuição da temperatura com anti-térmicos ou banhos térmicos, apresenta uma grande melhora do estado geral, ao passo que nas infecções bacterianas a prostração se mantêm.(1,5) Toxemia, palidez e cianose acompanham a prostração e mostram relação com a gravidade do caso.(1)
A taquipnéia com ou sem dispnéia é mais encontrada nos casos de PAC, sendo este o sintoma mais importante no seu diagnóstico. Quanto menor for a criança, mais perceptível será a dificuldade ventilatória.(1) A taquipnéia, na presença de febre, deve ser reavaliada após a diminuição da temperatura.
A tosse é um dos sintomas mais encontrados nas doenças respiratórias, não sendo específica da PAC.
A história de outros episódios de desconforto respiratório chama a atenção para doença com hiperreatividade brônquica.(6)
Outras manifestações clínicas, tais como irritabilidade, cefaléia, redução do apetite e vômitos podem ser relatados. O meningismo pode ser encontrado nas PAC de acometimento dos segmentos posteriores. A dor pleurítica, com respiração entrecortada e posição antálgica, pode ocorrer no derrame pleural. A dor abdominal (15%) caracteriza derrame pleural mais diafragmático, não sendo infreqüente o diagnóstico de pneumonias com base em uma radiografia de abdômen.(1,2,6)
O exame físico e a avaliação geral da criança devem ser realizados. A modificação do humor, a irritabilidade, a falta de atenção ao ambiente, a habilidade para mamar ou tomar líquidos, a movimentação, o sorriso e a vocalização devem ser observados.
No exame físico do aparelho respiratório devemos identificar a taquidispnéia. A medida da freqüência respiratória (FR) mostra uma relação estreita com a gravidade da PAC e com a hipoxemia.(5,10,11) A FR modifica-se no primeiro ano de vida, indo de 50 incursões por minuto (ipm) na primeira semana para 40 ipm aos seis meses de idade.(4) A FR deve ser medida com a criança no colo do cuidador ou sentada. A medida realizada com o estetoscópio pode irritar a criança e aumentar a contagem. Os valores considerados normais variam de acordo com a idade: até os 2 meses, FR = 60 ipm; de 2 meses a 12 meses FR = 50 ipm; acima de 12 meses, FR = 40 ipm.(4)
A presença de retração intercostal é um sinal de gravidade da doença e seu achado é indicativo de internamento. É mais observado em crianças pequenas de até dois anos de idade. O batimento de asas nasais pode ser observado, assim como a presença de um estridor expiratório contínuo, decorrente do fechamento das cordas vocais com intuito de elevar a pressão expiratória final, o que é um sinal de gravidade.(4,10,11)
A ausculta pulmonar varia de acordo com o padrão anatômico e a extensão da pneumonia. Deve ser realizada após a inspeção torácica. O choro pode prejudicar a ausculta. Em crianças, é freqüente o comprometimento brônquico com estertores finos médios e grossos. À ausculta, o murmúrio vesicular poderá estar diminuído na condensação por pneumonia, como também nas grandes atelectasias e nos derrames pleurais.
O frêmito tóraco-vocal estará aumentado nos casos de consolidação e diminuído nos derrames pleurais.(1) À palpação e à percussão, pouco realizada, podem-se identificar condensações, derrames extensos (sinal de Signorelli com macicez na coluna vertebral nos indica derrame pleural), enquanto que a coluna normal à percussão nos indica atelectasia com expansão do pulmão oposto.
À semelhança da sintomatologia, podemos ter exame físico negativo até a identificação da clássica síndrome da condensação (frêmito tóraco-vocal aumentado, macicez e estertores crepitantes com sopro tubário).(2)
A radiografia de tórax é utilizada no diagnóstico de pacientes com suspeita de pneumonia. A utilidade clínica do diagnóstico da radiografia deve ser acoplada ao diagnóstico clínico com exame físico, que sempre deve anteceder qualquer exame laboratorial ou radiológico.(7-11)
A suspeita clínica de PAC ocorre na presença de tosse, taquipnéia sem sibilância e febre.
A radiografia de tórax pode ser utilizada no diagnóstico de pacientes com suspeita de pneumonia. A utilidade clínica do diagnóstico da radiografia deve ser acoplada ao diagnóstico clínico com exame físico, que sempre deve anteceder qualquer exame laboratorial ou radiológico
Grau de Evidência B
Referências
1. Grisi SJ. Pneumonias bacterianas agudas. In: Rosov T, editor. Doenças pulmonares em pediatria: diagnóstico e tratamento. São Paulo: Atheneu; 1999. p. 204-14.
2. Bethlem N. Pneumologia. 2nd ed. Rio de Janeiro: Atheneu; 1975. p. 159-84: Pneumonias.
3. Ruvinski R, Balanzal MC. Pneumonias bacterianas e virais. In: Benguigui Y, López Antuñano FJ, Schmunis G, Yunes J. Infecções respiratórias em crianças. Washington: Organização Pan-Americana da Saúde; 1998. p. 217-51.
4. Braman SS. Postinfectious cough: ACCP evidence-based clinical practice guidelines. Chest. 2006;129(1 Suppl):138S-146S.
5. Margolis P, Gadomski A. Does this infant have pneumonia? JAMA. 1998;279(4):308-13
6. Braman SS. Chronic cough due to acute bronchitis: ACCP evidence-based clinical practice guidelines. Chest. 2006;129(1 Suppl):95S-103S.
7. Donnelly FL. Maximizing the usefulness of imaging in children with community-acquired pneumonia. AJR Am J Roentgenol. 1999;172(2):505-12.
8. Wilkins TR, Wilkins RL. Clinical and radiographic evidence of pneumonia. Radiol Technol. 2005;77(2):106-10.
9. Coote N, McKenzie S. Diagnosis and investigation of bacterial pneumonias. Paediatr Respir Rev. 2000;1(1):8-13.
10. Palafox M, Guiscafré H, Reyes H, Munoz O, Martinez H. Diagnostic value of tachypnoea in pneumonia defined radiologically. Arch Dis Child. 2000;82(1):415.
11. Magree HC, Russell FM, Sa'aga R, Greenwood P, Tikoduadua L, Pryor J, Wagatakirewa L et al. Chest X-Ray confirmed pneumonia in children in Fiji. Bull World Health Organ. 2005;83(6):427-33
Avaliação da gravidade
Classificação da gravidade em pneumonias
O diagnóstico de pneumonia pode se basear em dados clínico-radiológicos.(1,2,3,4) Os dados clínicos são essenciais na prática médica, principalmente nos países em desenvolvimento. A Organização Mundial da Saúde (OMS) vem preconizando há mais de duas décadas a valorização da queixa de "tosse e freqüência respiratória elevada" como indicativo de pneumonia em crianças menores de 5 anos. O Ministério da Saúde do Brasil adotou e adaptou tais normas, transformando-as em política pública de saúde no país há cerca de 20 anos, através da ação de saúde denominada Controle das Infecções Respiratórias Agudas (IRA).(2,3)
A valorização de dados clínicos, acrescidos de parâmetros objetivos, como a medida da saturação periférica de oxigênio (SpO2), devem ser empregados na prática para avaliação da gravidade da pneumonia.
Um estudo de coorte com 510 crianças de 2 meses a 4 anos mostrou, para os pacientes com mais de um ano, freqüência respiratória (FR) > 50 respirações por minuto (rpm) e SpO2 < 96%. Para os menores de um ano, o batimento nasal permitiu identificar, daquelas crianças com IRA, as que tinham evidência radiológica de pneumonia.(5)
Os sinais clínicos que são preconizados pela OMS(6) para a classificação da gravidade de pneumonias em crianças com menos de 5 anos estão descritos no Quadro 2.
Nesse quadro, basta somente UM sinal ou sintoma para se definir a classificação, predominando aquela de maior gravidade.(1)
Notar que a retração que está mais associada à gravidade da pneumonia é a subcostal, embora outros tipos de retração possam estar presentes. É importante ressaltar que a tiragem subcostal deve ser evidente, ou seja, não deve haver dúvida de que esteja presente e mantida (não intermitente), para que seja associada à gravidade.(7)
O Consenso Britânico para o gerenciamento das pneumonias comunitárias na infância(8) acrescentou aos parâmetros da OMS a hipertermia (>38,5 °C) e separou os sinais presentes em lactentes e em crianças maiores. A taquipnéia e a tiragem são achados do exame físico sempre presentes nos pacientes com pneumonia grave.(9)
Além dos sinais de pneumonia muito grave e grave descritos no Quadro 2, também indicam gravidade os sinais de hipoxemia que geralmente precedem a cianose, como sudorese, palidez e a alternância entre sonolência e agitação.(6) Os oxímetros de pulso permitem uma mensuração adequada e guardam estreita relação com a pressão parcial de oxigênio no sangue arterial.(10)
A taquipneia e a tiragem subcostal são achados do exame físico sempre presentes nos pacientes com pneumonia grave. A procura de hipoxemia por uso de oxímetro de pulso deve ser estimulada, garantindo um melhor diagnóstico de hipoxemia, racionalizando o uso de oxigênio.
Grau de evidência A
Classificação da gravidade de acordo com a faixa etária
Lactentes com menos de dois meses
Os lactentes com menos de dois meses com pneumonia representam um grupo especial de pacientes, para os quais está indicada a internação,(2) devido ao risco de agentes Gram negativos, estreptococos b hemolíticos e Staphylococcus aureus como causadores de pneumonia. Nesta faixa etária, portanto, qualquer pneumonia é considerada grave.
Na atenção primária dos lactentes menores de 2 meses, pela dificuldade de se diferenciar quadros de pneumonia de outras doenças como septicemia ou meningite, a OMS recomenda que se classifique como possível infecção bacteriana grave a presença de freqüência respiratória elevada ou de tiragem subcostal mantida e grave. Nesses casos, há uma conduta própria a ser seguida.(6)
O Consenso Britânico(8) valoriza também os sinais e sintomas preconizados pela OMS, mas estabelece que a principal indicação para a hospitalização seja a hipoxemia:
-
SpO
2 < 92%, cianose
-
FR
> 70 rpm
-
Dificuldade respiratória
-
Apnéia intermitente, gemido
-
Impossibilidade de se alimentar
-
Incapacidade da família em tratar o paciente no domicílio
O diagnóstico de pneumonia adquirida na comunidade em menores de dois meses de idade indica internação.
Grau de evidência A
Crianças de 2 meses a 5 anos
Além dos sinais de gravidade (Quadro 2), outros critérios para internação do lactente de 2 meses a 5 anos com pneumonia são(4,6):
-
Falha da terapêutica ambulatorial
-
Doença grave concomitante
-
Sinais radiológicos de gravidade (derrame pleural, pneumatoceles, abscesso)
A radiografia de tórax é sempre indicada nos casos que necessitam internação.(1,3) Os portadores de pneumonia complicada com derrame pleural, pneumotórax e pneumatoceles devem ser internados.
A presença de condensação radiológica extensa tem potencial de evoluir para derrame pleural e, portanto, serve como um preditor de gravidade.(1,3)
A hipoxemia deve ser utilizada como indicativo de internação também nessa faixa etária. Assim, seriam critérios para internação: SpO2 < 92%, além de cianose, FR > 50 rpm, dificuldade para respirar, gemido, sinais de desidratação, incapacidade da família em cuidar do paciente.(8)
As crianças maiores de 2 anos podem ser tratadas em ambulatório. Havendo falha terapêutica, ou na presença de sinais de gravidade, a internação deve ser imediata.
Grau de evidência A
Indicações de transferência para unidade de terapia intensiva
Recomenda-se a transferência para uma unidade de terapia intensiva o paciente que apresente:
-
SpO
2 < 92% com fração inspirada de oxigênio > 60%
-
Hipotensão arterial
-
Evidência clínica de grave falência respiratória e exaustão
-
Apnéia recorrente ou respiração irregular
Subentende-se que, se o paciente chega ao serviço de saúde com pelo menos um desses sinais ou sintomas, ele deva ser encaminhado para uma unidade de terapia intensiva.
A transferência para a unidade de terapia intensiva deve ocorrer na presença de hipoxemia não responsiva, na presença de instabilidade hemodinâmica e na falência respiratória.
Grau de evidência C
Todos os pacientes internados em unidade de terapia intensiva devem ser submetidos a pesquisa do agente etiológico.
Grau de evidência C
Referências
1. Benguigui Y. Infecções respiratórias agudas: fundamentos técnicos das estratégias de controle. Washington: Organização Pan-Americana da Saúde; 1997.
2. Brasil. Ministério da Saúde. Assistência e controle das infecções respiratórias agudas. Brasília, DF, 1994. 36p.
3. Brasil. Ministério da Saúde. Tratamento de pneumonias em hospitais de pequeno e médio portes. Brasília, DF, 1996. 47p.
4. McIntosh K. Community-acquired pneumonia in children. New Engl J Med. 2002;346(6):429-37.
5. Mahabee-Gittens EM, Grupp-Phelan J, Brody AS, Donnelly LF, Bracey SE, Duma EM et al. Identifying children with pneumonia in the emergency department. Clin Pediatr (Phila). 2005;44(5):427-35.
6. World Health Organization. Pocket book of hospital care for children. Guidelines for the management of common illnesses with limited resources. [Acesso em 12 de fevereiro de 2006-11-29 ] Disponível em: http://www.who.int/child-adolescent-health/publications/CHILD_HEALTH/PB.htm.
7. Mulholland EK, Simoes EA, Costales MO, McGrath EJ, Manalac EM, Gove S. Standardized diagnosis of pneumonia in developing countries. Pediatric Infec Dis J. 1992;11(2):77-81.
8. British Thoracic Society Guidelines for the Management of community acquired pneumonia in childhood. Thorax. 2002;57(Suppl 1):i1-24.
9. Bhavneet B, Sahul B, Vandna V. Severe pneumonia in a remote hilly area: Integrated management of childhood illness. Indian J Pediatr 2006;73(1):33-7.
10. Rees PJ, Dudley F. ABC of oxygen: Oxygen therapy in chronic lung disease BMJ. 1998;317(7162):871-74.
Investigação radiológica e laboratorial
Radiologia
É imperativa a análise conjunta das anormalidades radiográficas e clínicas. A radiografia de tórax confirma o diagnóstico de pneumonia, avalia a extensão do processo e identifica complicações. Sua indicação deve justificar-se clinicamente e a sua interpretação procedida de forma sistematizada e minuciosa, a começar pela análise da qualidade da técnica radiológica, pois exames de má qualidade levam a diagnósticos equivocados.
De um modo geral, nas pneumonias exclusivamente virais, predominam espessamentos brônquicos e peribrônquicos, infiltrados intersticiais, adenopatia hilar e parahilar, hiperinsuflação e atelectasia; procurar sempre distinguí-las da consolidação bacteriana.(1) Por vezes, se verifica a dissociação entre os quadros clínico e radiológico, ou seja, um paciente oligossintomático com alterações radiológicas relativamente floridas e vice-versa.
Por sua vez, as pneumonias bacterianas apresentam-se com padrão alveolar segmentar ou lobar, broncograma aéreo, abscessos, pneumatoceles, espessamento ou derrame pleurais(1) e imagens arredondadas.(1,2)
O Mycoplasma pneumoniae determina alterações radiológicas mistas, ora assumindo "padrão" viral, ora bacteriano, ou ambos. As consolidações são mais freqüentemente vistas em escolares e adolescentes, ao passo que infiltrados intersticiais e espessamento hilar ocorrem em pré-escolares. Infiltrados reticulares ou retículo-nodulares restritos a um único lobo constituem a alteração radiológica usual.(1)
Radiografia de tórax pneumonia por vírus ou por bactérias
Desde a última década surgiram na literatura artigos que contestam a utilidade da radiologia no diagnóstico diferencial entre processos virais e bacterianos. Uma única revisão sistemática disponível concluiu que a radiografia de tórax apresenta baixa acurácia para realizar essa diferenciação.(3,4)
Baseado em estudos conduzidos em países desenvolvidos, pelo menos dois consensos internacionais concluíram que a radiologia apresenta baixa sensibilidade para o diagnóstico etiológico, classificando-a como um indicador deficiente para orientar a decisão terapêutica.(5,6)
A radiografia de tórax não deve ser solicitada para o controle de cura de pneumonia adquirida na comunidade (PAC).(1,6)
A comprovação de PAC é feita pela radiografia de tórax.
Grau de evidência A
O uso de critérios clínicos e radiográficos para a distinção de pneumonia viral e bacteriana pode ajudar a reduzir o uso desnecessário de antibióticos.
Grau de evidência C
A radiografia de tórax não deve ser solicitada para o controle de cura da PAC.
Deve ser solicitada na pesquisa de complicações da PAC e na sua resolução.
Grau de evidência C
Diagnóstico laboratorial
Exames inespecíficos
Leucograma global e diferencial
Como ocorre para a radiologia, a contagem de leucócitos, neutrófilos e bastonetes tem pouco valor na distinção entre processos virais e bacterianos, e a sua realização rotineira não é recomendada. Para pacientes hospitalizados, a leucometria deve ser solicitada.
A presença de eosinofilia nos casos de pneumonia afebril pode sugerir infecção por Chlamydia trachomatis.
O leucograma não deve ser realizado como rotina para pacientes tratados ambulatorialmente.
Grau de evidência A
Para pacientes internados, o leucograma deve ser realizado.
Grau de evidência C
Proteína C-reativa
A dosagem de proteína C-reativa ainda esbarra na definição do ponto de corte para sua concentração sérica. Korppi e colaboradores demonstraram que a sua concentração situou-se entre 21,5 mg/L e 60,3 mg/L em pneumonias virais e entre 53,9 mg/L e 126,0 mg/L na pneumonia pneumocócica, havendo, portanto, uma superposição de valores que ainda impede a distinção baseada na sua determinação isoladamente.(7)
Não é recomendada a utilização rotineira da dosagem da proteína C reativa
Grau de evidência C
Exames específicos
Hemocultura
Para o diagnóstico etiológico dos quadros bacterianos, o exame disponível no nosso meio é a hemocultura. Seu baixo rendimento (taxa de isolamento média de 10%) talvez induza o clínico a evitar a sua solicitação. Entretanto, mesmo que sua contribuição seja limitada para um paciente em particular, a reunião de dados de diversos pacientes fornece informações epidemiológicas vitais para a prática clínica, não apenas pela identificação bacteriana, como também para a elaboração dos perfis de sensibilidade aos antimicrobianos dos germes nela isolados. Por esses motivos, ela deve ser solicitada rotineiramente para os casos hospitalizados.(5)
É recomendada a realização da hemocultura para todos os casos hospitalizados.
Grau de evidência C
Pesquisa de vírus respiratórios
O diagnóstico de infecção viral em pacientes hospitalizados é benéfico para orientar as precauções de controle de infecção hospitalar e limitar o uso inapropriado de antibióticos. Os vírus podem ser identificados por vários métodos diagnósticos: enzimaimunoensaio, detecção de anticorpos por fluorescência indireta, reação de cadeia de polimerase e cultura do vírus. Em geral, preferem-se métodos que forneçam o resultado com maior rapidez e que tenham uma sensibilidade e especificidade aceitáveis (90% e > 95%, respectivamente). Por isso, utiliza-se mais a detecção de antígeno viral e o isolamento do vírus, enquanto testes sorológicos são utilizados quando os métodos de identificação rápida não forem disponíveis.
É importante salientar que, para a detecção do vírus, a coleta do material deve ser realizada o mais precocemente possível após o início da infecção.
A pesquisa de vírus na secreção nasal deve ser realizada, desde que esteja disponível na unidade de tratamento.
Grau de evidência C
Técnicas invasivas
Pelo seu caráter invasivo, as técnicas com elevados índices de recuperação bacteriana, tais como a punção aspirativa e o lavado broncoalveolar, têm aplicação apenas em protocolos de pesquisa e em pacientes selecionados como, por exemplo, aqueles que requeiram internação em centros de tratamento intensivo.
As técnicas invasivas devem ser realizadas em pacientes que não estejam respondendo ao tratamento.
Grau de evidência C
Teste de aglutinação de partículas de látex
Esse método é realizado em amostras de urina e de líquido pleural e baseia-se numa reação de aglutinação simples, visível a olho nu, entre os anticorpos que compõem o kit e os antígenos capsulares bacterianos.
Os produtos comerciais disponíveis contêm antisoros anti-pneumococo (tipo omniserum) e anti-hemófilo tipo b. Além de não necessitar de pessoal especializado, proporciona resultados em até 24 horas e tem a grande vantagem de não sofrer influência do uso de antibióticos se estes tiverem sido utilizados em até cerca de cinco dias antes da realização do exame. Entretanto, ainda são escassos os estudos avaliando este método.
Em um estudo utilizando amostras de urina concentrada de 44 crianças com pneumonia e de 62 controles sadios, o teste revelou sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo iguais a 77,3, 90,3, 85,0 e 84,8%, respectivamente.(8) Em outro estudo conduzido por autores nacionais, a sensibilidade média foi de 73,0% em 115 crianças com pneumonia.(9)
A reação de aglutinação na urina ou em líquido pleural pode ajudar no diagnóstico etiológico
Grau de evidência C
Exame citobacteriológico do escarro
A pesquisa do Gram em escarro e a cultura de escarro não são realizadas rotineiramente por ser de difícil obtenção na criança, mas se a amostra for de boa qualidade (ou seja, deve conter mais que 25 polimorfonucleares/campo e menos que 10 células epiteliais/campo) pode auxiliar no diagnóstico etiológico. Sua interpretação é difícil devido à contaminação por germes da orofaringe. A presença de um único tipo de bactéria pode sugerir o diagnóstico.
A pesquisa de Gram e a cultura do escarro não são recomendadas rotineiramente.
Grau de evidência D
Diagnóstico laboratorial das pneumonias por M. pneumoniae e Chlamydia pneumoniae
Mycoplasma pneumoniae
Há vários testes sorológicos para M. pneumoniae que utilizam diferentes métodos e antígenos. Neles são detectados os anticorpos imunoglobulina G (IgG) e IgM. A IgM aparece sete a dez dias após o início da infecção e a IgG não está presente na fase aguda mas é detectável três semanas após o início da infecção. Os dois testes sorológicos mais freqüentemente utilizados são os de fixação de complemento e o enzyme-linked immunosorbent assay.
Reação de fixação de complemento
O nível do anticorpo específico IgG aumenta lentamente no curso da doença e usualmente não aparece durante a primeira semana, tendo o pico cinco semanas depois do surgimento dos sintomas clínicos. Pode persistir por vários anos após uma infecção aguda.(9)
A confirmação diagnóstica através deste método requer uma segunda coleta no intervalo de duas a três semanas. A elevação dos níveis de anticorpos em quatro vezes, entre a primeira e a segunda amostra, firma o diagnóstico de infecção por M. pneumoniae. Caso o paciente seja avaliado na fase de resolução, a queda dos títulos dessas imunoglobulinas na mesma proporção também permite confirmar o envolvimento do patógeno referido. Quando os títulos estão elevados e superiores a 1:80, e principalmente 1:160, o diagnóstico pode ser feito baseado numa simples coleta.
A reação de fixação de complemento tem sensibilidade de 71% e especificidade de 80%, o que revela uma proporção não desprezível de reações falso-positivas e falso-negativas.(10)
Enzyme-linked immunosorbent assay
O método surgiu no início dos anos 80 e atualmente é o principal recurso utilizado. A técnica identifica a IgM anti-M. pneumoniae e dispensa a realização da segunda coleta. Tem sensibilidade de 92% e especificidade de 98%.(10)
A pesquisa de anticorpos para M. pneumoniae ajuda na pesquisa do agente etiológico, não ajuda na decisão de tratamento
Grau de evidência D
Chlamydia spp
Anticorpos específicos das classes A, G e M são pesquisados através de diferentes técnicas, entre elas a reação de fixação de complemento, imunofluorescência indireta, enzyme-linked immunosorbent assay e microimunofluorescência . Os anticorpos específicos da classe A podem estar elevados ou não nos pacientes com pneumonia por C. trachomatis e por isso são pouco utilizados. A IgG sérica é útil apenas quando realizada nas fases aguda e convalescente. Desta forma, o diagnóstico baseia-se na análise da IgM. Uma outra opção é o uso da polimerização em cadeia (polimerase chain reaction).(9,11)
A pesquisa de anticorpos para C. pneumoniae ajuda na pesquisa do agente etiológico, não ajuda na decisão de tratamento
Grau de evidência D
Referências
1. Donnelly L. Maximizing the usefulness of imaging in children with community-acquired pneumonia. AJR Am J Roentgenol. 1999;172(2):505-12.
2. Camargos PA, Ferreira CS. On round pneumonia in children. Pediatr Pulmonol. 1995;20(3): 194-5.
3. Swingler GH. Radiologic differentiation between bacterial and viral lower respiratory tract infection in children: a systematic literature review. Clin Pediatr (Phila). 2000;39(11):627-33.
4. Virkki R, Juven T, Rikalainen H, Svedstrom E, Mertsola J, Ruuskanen O. Differentiation of bacterial and viral pneumonia. Thorax. 2002;57(5):438-41.
5. British Thoracic Society Standards of Care Committee. Guidelines for the management of community acquired pneumonia in childhood. Thorax. 2002;57 Suppl 1:i1-24.
6. Community acquired pneumonia guideline team, Cincinnati Children's Hospital Medical Center [homepage on the Internet]. The Center; Cincinnati: c1999-2006 [cited 2005 Dec 22]. Evidence-based care guideline for children with community acquired pneumonia. Guideline 14: Community acquired pneumonia in children 60 days through 17 years of age; [16 pages] Disponível em: http://www.cincinnatichildrens.org/NR/rdonlyres/BD9258A5-CC7B-4378-BFBB -B09C36B85813/0/pneumoniaguideline.pdf.
7. Waites KB. New concepts of Mycoplasma pneumoniae infections in children. Pediatr Pulmonol. 2003;36(4):267-78.
8. Daxboeck F, Krause R, Wenisch C. Laboratory diagnosis of Mycoplasma pneumoniae infection. Clin Microbiol Infect. 2003;9(4):263-73.
9. Hammerschlag MR. Mycoplasma pneumoniae infections. Curr Opin Infect Dis. 2001;14(2):181-6.
10. Ferwerda A, Moll HA, de Groot R. Respiratory tract infections by Mycoplasma pneumoniae in children: a review of diagnostic and therapeutic measures. Eur J Pediatr. 2001;160(8):483-91.
11. Michelow IC, Olsen K, Lozano J, Rollins NK, Duffy LB, Ziegler T et al. Epidemiology and clinical characteristics of community-acquired pneumonia in hospitalized children. Pediatrics. 2004;113(4):701-7.
Conduta geral
Conduta no hospital
Oxigenoterapia Deve ser estimulado o uso de oxímetros nas unidades de saúde. O emprego do oxigênio está indicado para todas as crianças classificadas como tendo pneumonia grave, apresentando(1,2,3):
-
Tiragem subcostal grave
-
Taquipnéia de acordo com a faixa etária.
-
Gemência respiratória.
-
Cianose central
-
Incapacidade de deglutição pela dificuldade respiratória
-
saturação periférica de oxigênio (SpO
2) menor que 92%
A agitação pode ser o primeiro sinal de hipoxemia em crianças, antes mesmo da cianose.(2,3)
Quando se monitora o paciente com oxímetro, está indicado o uso de oxigênio quando a SpO2 for inferior a 92%. O paciente pode ser avaliado pelos sinais clínicos já referidos, mas é recomendada a oximetria não invasiva.(1)
O oxigênio deve ser dispensado de modo contínuo, na forma mais confortável para a criança. Deve ser fornecido um fluxo de oxigênio ideal para manter a SpO2 entre 92% e 94%.(1,2,3) O oxigênio pode ser suspenso quando a criança estiver estável com SpO2 > 92% em ar ambiente.(1)
O paciente deve ser sempre avaliado, visando o controle da SpO2 e para identificar problemas, tais como(1,3):
-
Cateter nasal ou cânula fora de posição
-
Diminuição da oferta de oxigênio
-
Fluxo de oxigênio incorreto
-
Obstrução das vias aéreas por muco
-
Distensão gástrica
Havendo obstrução nasal por muco, deve-se proceder a limpeza do nariz com pano úmido ou aspirar as secreções suavemente.
Administração de líquidos
A administração de líquidos por via intravenosa (IV) deve ser vigiada atentamente pelo risco de sobrecarga hídrica. Isso inclui a antibioticoterapia, que pode ser via intramuscular ou preferencialmente oral, sempre que possível.(1) A utilização da via intravenosa (IV), para a reposição de líquidos é recomendada apenas em casos de desidratação grave, choque séptico e situações em que a via oral não possa ser utilizada. Nestas circunstâncias, uma vez que a hipovolemia tenha sido corrigida, os líquidos devem ser administrados em cerca de 80% das necessidades básicas para a criança.(3)
A administração de líquidos deve ser realizada com cuidado; a via oral é a preferida; se necessário, a hidratação por via intravenosa deve ser utilizada com cautela.
Grau de evidência A
Nutrição
Recém-nascidos prematuros ou com peso inferior a 2 kg podem ter comprometimento de sua condição respiratória em virtude de intubação nasogástrica. Do mesmo modo, crianças maiores, se necessitarem intubação nasogástrica, deverão receber tubos de pequeno calibre introduzidos pela narina mais estreita para evitar comprometimento ventilatório.(3)
A administração de alimentos deve ser, sempre que possível, por via oral; se for necessário o uso de sondas de alimentação, cuidados quanto ao calibre da sonda e à velocidade de administração devem ser observados.
Grau de evidência C
Tratamento fisioterápico
O conhecimento atual disponível sobre as técnicas de fisioterapia respiratória como drenagem postural, percussão torácica e manobras de inspiração profunda não evidenciam benefício em crianças com pneumonia comunitária, do ponto de vista de: redução do tempo de internação, febre, melhora radiológica ou gravidade da doença.(3,4) A posição supina seria suficiente para melhorar a ventilação do paciente e manter os pulmões expandidos.(3)
Não se recomenda fisioterapia respiratória para pneumonia adquirida na comunidade.
Grau de evidência C
Conduta no domicílio
Cuidados gerais
Os familiares de crianças com pneumonia que têm condições clínicas de serem tratadas em casa devem sempre ser orientados quanto ao modo de administrar os antibióticos, tratar a febre, ter cuidados com a alimentação e hidratação e a observar sinais de piora do paciente que demandariam a busca de serviço de saúde a qualquer momento.(1,3)
Toda criança com pneumonia com condições clínicas de ser tratada em casa deve ter uma consulta de revisão agendada após as primeiras 48 h.(1,3)
Grau de evidência D
Administração de líquidos
A administração de líquidos deve ser sempre por via oral. Os cuidadores devem ser orientados quanto à administração de um limite mínimo de líquidos.
Grau de evidência C
Tratamento da febre e da dor
O uso de antitérmicos e analgésicos que tragam conforto ao paciente deve ser prescrito; o controle de temperatura deve ser realizado.
Grau de evidência C
Referências
1. World Health Organization. Pocket book of hospital care for children. Guidelines for the management of common illnesses with limited resources. [Acesso em 22 de fevereiro de 2006] Disponível em: http://www.who.int/child-adolescent-health/publications/CHILD_HEALTH/PB.htm.
2. Qazi S. Oxygen therapy for acute respiratory infections in young children. Indian Pediatr. 2002;39(10):909-13.
3. British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Childhood. Thorax. 2002;57(Suppl 1):i1-24.
4. Wallis C, Prasad A. Who needs chest physiotherapy? Moving from anecdote to evidence. Arch Dis Child. 1999;80(4):393-7
Tratamento
No tratamento das pneumonias bacterianas, a antibioticoterapia de escolha varia com a faixa etária e com as características da infecção.
Tratamento ambulatorial
Antibióticos de primeira escolha são a amoxicilina ou a penicilina procaína (Tabela 3). Apesar do aumento da resistência do pneumococo nos últimos anos, recomendamos as doses habituais dos betalactâmicos no tratamento da pneumonia adquirida na comunidade. O uso abusivo de antibióticos em quadros virais pode aumentar a resistência à penicilina.(1)
Em crianças acima de 6 anos, devido à incidência de Mycoplasma pneumoniae e Chlamydia pneumoniae, pode-se optar pela introdução de macrolídeos.(2)
O período de uso do antibiótico não precisa ser longo, o antibiótico pode ser suspenso entre 3 e 5 dias após o desaparecimento dos sintomas clínicos.(4)
Pacientes internados
Em crianças com idade inferior a 2 meses, deve-se introduzir penicilina cristalina ou ampicilina associada a amicacina ou a gentamicina (Tabela 4). Em pacientes com idade inferior a 5 anos e presença de pneumonia extensa, de evolução rápida e com comprometimento importante do estado geral, deve-se optar pela introdução de oxacilina associada a cloranfenicol ou a cefalosporina de terceira geração, devido a possibilidade de infecção por Staphylococcus aureus ou Haemophilus influenzae (Tabela 5).
TA mudança de via parenteral para via oral deve ser realizada após o segundo dia de estabilização clinica. No paciente sem complicação, o período de uso do antibiótico não precisa ser longo, podendo ser suspenso o seu uso entre 3 e 5 dias após o desaparecimento dos sintomas clínicos.
Em quadros acompanhados por sibilos e insuficiência respiratória, opta-se pela introdução de broncodilatadores e corticosteróides.
Referências
1. McIntosh, K. Community-acquired pneumonia in children. N Engl J Med. 2002;346(6):429-37.
2. Paiva MA, Reis FJ, Fischer GB, Rozov T. I Consenso brasileiro sobre pneumonias. J Pneumol. 1998;24(2):101-8.
3. Gavranich JB, Chang AB. Antibiotics for community acquired lower respiratory tract infections (LRTI) secondary to Mycoplasma pneumoniae in children. Cochrane Database Syst Rev. 2005;20(3):CD004875.
4. El Moussaoui R, de Borgie CA, van den Broek P, Hustinx WN, Bresser P, van den Berk GE et al. Effectiveness of discontinuing antibiotic treatment after three days versus eight days in mild to moderate-severe community acquired pneumonia: randomised, double blind study. BMJ. 2006;332(7554);1355.
Complicações e falha terapêutica
Quando pensar em complicação
Se a criança permanece com febre ou clinicamente instável após 48-72 h da admissão por pneumonia, deve-se pesquisar complicações, sendo a mais freqüente o derrame pleural.(1,2) Do ponto de vista terapêutico, o derrame é considerado como não complicado (não necessita drenagem) ou complicado (necessita procedimento cirúrgico complementar - toracostomia).(3) Os derrames parapneumônicos não complicados apresentam evolução clínica favorável com a antibioticoterapia apropriada e serão reabsorvidos à medida que a pneumonia regride.(1)
Outras questões que devem ser respondidas: se o diagnóstico de pneumonia está correto, se o curso clínico é mais prolongado que o habitual, se o tratamento instituído está adequado ou se a etiologia é por um patógeno atípico ou resistente ao tratamento.(4)
A resposta clínica deve ocorrer com 48-72 h; a redução da febre e da dispnéia deve ocorrer e no caso da não resposta clínica devem ser procurados os motivos de falha, tais como aescolha inadequada do antibiótico, a dose errada ou complicações da pneumonia adquirida na comunidade.
Grau de evidência D
Derrame pleural
Em crianças, o derrame pleural é a complicação mais freqüente da pneumonia bacteriana. No Brasil, ocorre em torno de 40% das crianças hospitalizadas por pneumonias.(2) Os principais agentes etiológicos são os mesmos encontrados em pneumonias não complicadas: Streptococcus pneumoniae (64%), Haemophilus influenzae (7%) e Staphylococcus aureus (15%).(5,6) O S. pneumoniae é o agente mais encontrado em crianças, em todas as faixas etárias, inclusive lactentes.(6) Apesar do aumento da freqüência de pneumococos resistentes à penicilina, não tem sido identificado um aumento de complicações associadas a infecções causadas por cepas resistentes.(7)
A apresentação clínica dos pacientes com derrame pleural associado à pneumonia é semelhante àquela encontrada na pneumonia não complicada, exceto pela presença de febre por um período maior antes da admissão (5,7 e 3,1 dias, respectivamente).(1,6,7) Ao exame físico podem-se observar murmúrio vesicular diminuído, macicez à percussão e postura antálgica (pseudoescoliose). Por não se ter um achado clínico patognomônico de derrame pleural, a presença de derrame deve ser considerada em todo paciente com pneumonia e, principalmente, se houver falha de resposta após 48-72h de tratamento adequado.(1)
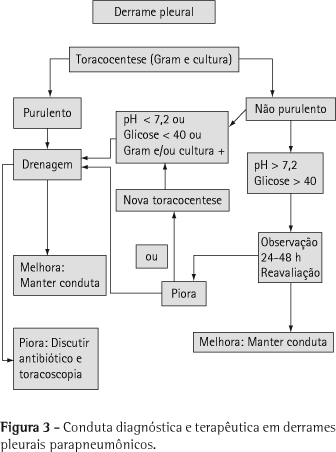
A presença de derrame pleural indica a necessidade do exame do líquido quando houver a possibilidade de toracocentese. O líquido deve ser enviado para exame bacterioscópico e cultura, incluindo a pesquisa de bacilo álcool-ácido-resistente. Se o líquido não for purulento, a análise bioquímica (pH, glicose) pode identificar características de empiema e direcionar à necessidade de drenagem.(6,8) Líquidos fétidos indicam a presença de anaeróbios. A detecção de pus estabelece o diagnóstico de empiema que requer drenagem. Nesse caso, o exame bioquímico pode ser dispensado, mas o líquido deverá ser encaminhado para exame bacterioscópico e cultura, independente do uso prévio de antibióticos.
A ultra-sonografia, apenas em caso de dúvida, pode auxiliar na confirmação da presença de derrame e na identificação do melhor local para toracocentese ou drenagem. A tomografia excepcionalmente tem indicação no derrame pleural complicado. A tomografia de tórax com utilização de contraste intravenoso fornece um benefício adicional ao planejamento cirúrgico, pois diferencia o espessamento pleural de pulmão consolidado e também avalia o comprometimento intra-parênquimatoso, identificando outras complicações como, por exemplo, o abscesso pulmonar.(9)
A presença de derrame pleural indica a necessidade do exame do líquido quando houver a possibilidade de toracocentese. O líquido deve ser examinado com testes bioquímicos, exame direto para bactérias e bacilos álcool-ácidos resistentes, citologia diferencial de células e cultura para bactérias e micobactérias.
Grau de evidência C
Tratamento
Toda criança com derrame pleural a ser puncionado deve ser hospitalizada (Figura 3).(1)
Todos os casos devem ser tratados com antibiótico intravenoso com cobertura para S. pneumoniae, que é o agente mais freqüente.(1) Em estudos realizados no Brasil, o S. pneumoniae tem sido o agente etiológico mais freqüente.
Quando possível, a escolha do antibiótico deve ser guiada por um estudo microbiológico.(1)
Deve-se considerar a possibilidade de S. aureus como agente freqüente em crianças menores de um ano de idade com quadro toxêmico e fatores de risco associados como, por exemplo, lesões cutâneas infectadas. Não existem estudos sobre o tempo de tratamento com antibióticos. Antibióticos orais devem ser administrados por período de 1 a 4 semanas.(1)
Na faixa etária pediátrica, em torno de 15% a 35% dos derrames pleurais parapneumônicos necessitarão de drenagem torácica para resolução do processo infeccioso.(10,11,12) Os pacientes que apresentam infecção persistente com coleção pleural associada devem ser considerados para tratamento cirúrgico.(1) Embora não existam ensaios clínicos randomizados para determinar a necessidade de drenagem pleural na presença de derrame pleural, alguns estudos sugerem que o perfil bioquímico do líquido pode auxiliar nesta decisão.
Semelhante ao utilizado em adultos, a presença de pus, pH < 7,2, glicose < 40 mg/dL ou a identificação de bactérias no líquido pleural têm sido utilizados como indicativos de drenagem torácica.(1) Quando utilizado o pH, a análise deve ser em aparelho de gasometria.(1)
Todos os casos devem ser inicialmente tratados com antibióticos intravenosos com cobertura para S. pneumoniae, que é o agente mais freqüente.
Nos derrames pleurais complicados ou no empiema pleural deve ser realizada a drenagem de tórax.
Grau de evidência B
A escolha do tipo da drenagem tem sido determinada pelo estágio de organização do fluido pleural, pela resposta ao tratamento inicial e pelo grau de encarceramento pulmonar.
Drenagem tubular simples
A drenagem fechada e o uso concomitante de antibiótico parenteral é o tratamento padrão para o empiema em crianças e deve ser realizado nos estágios iniciais.
Nos pacientes com empiema, a febre tende a ser mais prolongada.(5,6)
Os pacientes submetidos à drenagem tubular simples que não melhoram do quadro infeccioso (presença de febre) devem ser avaliados quanto à eficácia da drenagem antes da troca desnecessária de antibióticos. Deve-se avaliar a ocorrência de obstrução ou posição inadequada do dreno e a presença de empiema loculado. Constitui erro freqüente, nos derrames parapneumônicos e no empiema, a troca ou a adição de drenos na tentativa de tratar o espaço pleural.
A drenagem fechada e o uso concomitante de antibiótico parenteral é o tratamento padrão para o empiema em crianças e deve ser realizado nos estágios iniciais.
Grau de evidência B
Toracoscopia
Nos derrames exsudativos, que se caracterizam por multisseptações, a drenagem tubular precedida de pleuroscopia sob visão direta permite a ruptura das loculações promovendo a drenagem efetiva do espaço pleural e reduzindo o tempo de hospitalização.(12,13) Esse deve ser o primeiro procedimento em crianças com empiema de longa evolução e com sinais de encarceramento pulmonar.
Grau de evidência C
Fibrinolíticos
Não existem ensaios clínicos randomizados com número suficiente de pacientes para recomendar o uso de fibrinolíticos de rotina em crianças.(14) Um estudo com limitação metodológica demonstrou que no empiema volumoso e loculado, em relação ao tempo de drenagem e hospitalização, a videotoracoscopia foi melhor do que a drenagem tubular aliada à estreptoquinase.(15)
Grau de evidência D
Decorticação
Nos pacientes com empiema na fase fibrionopurulenta ou organizada, que persistem com febre, pode-se realizar drenagem aberta (pleurostomia) ou descorticação pulmonar para promover a expansão pulmonar, devendo cada caso ser avaliado individualmente.(15)
Grau de evidência D
Fisioterapia
Não existem evidências de que a aplicação de técnicas fisioterápicas altere a evolução do derrame pleural.(16)
Grau de evidência D
Referências
1. Balfour-Lynn IM, Abrahamson E, Cohen G, Hartley J, King S, Parikh D et al. BTS guidelines for the management of pleural infection in children. Thorax. 2005;60 Suppl 1:i1-21.
2. Riccetto AG, Zambom MP, Pereira IC, Morcillo AM. Complicações em crianças internadas com pneumonia: fatores socioeconômicos e nutricionais Rev Assoc Med Bras. 2003;49(2):191-5.
3. Light RW, Girard WM, Jenkinson SG, George RB. Parapneumonic effusions. Am J Med. 1980; 69(4):507-12
4. Fein AM, Feinsilver SH, Niederman MS, Fiel S, Pai PB. "When the pneumonia doesn't get better". Clin Chest Med. 1987;8(3):529-41
5. Cirino LM, Gomes FM, Batista BN. The etiology of extensive pleural effusions with troublesome clinical course among children. Sao Paulo Med J. 2004;122(6):269-72.
6. Mocelin HT, Fischer GB. Fatores preditivos para drenagem de derrames pleurais parapneumônicos em crianças. J. Pneumologia. 2001;27(4):177-84.
7. Tan TQ. Clinical characteristics of children with complicated pneumonia caused by Streptococcus pneumoniae. Pediatrics. 2002;110(1 pt 1):1-6.
8. Colice GL, Curtis A, Deslauriers J, Heffner J, Light R, Littenberg B et al. Medical and surgical treatment of parapneumonic effusions: an evidence-based guideline. Chest. 2000;118(4):1158-71.
9. Stark DD, Federle MP, Goodman PC, Podrasky AE, Webb WR. Differentiating lung abscess and empyema: radiography and computed tomography. AJR Am J Roentgenol. 1983;141(1):163-7.
10. Fischer GB, Luchese S, Roos MO. Pneumonias com derrame pleural: análise de 116 casos. Anais do XXVII Congresso Brasileiro de Pediatria;1991.
11. Carvalho MFC, Barros ML, Cunha AJLA. Derrame pleural parapneumônico em crianças hospitalizadas. ABP Supl Arq Bras Med 1992; 66(6):502-506
12. Kercher KW, Attorri RJ, Hoover JD et al. Thoracoscopic decortication as a first-line therapy for pediatric parapneumonic empyema a case series. Chest 2000; 118(1): 24-27.
13. Avansino JR, Goldman B, Sawin RS, Flum DR. Primary Operative Versus Nonoperative Therapy for Pediatric Empyema: A Meta-analysis. Pediatrics 2005; 115 (6):1652-1659.
14. Cameron R, Davies HR. Intra-pleural fibrinolytic therapy versus conservative management in the treatment of parapneumonic effusions and empyema (Cochrane Review). In: The Cochrane Library, Issue 2, 2005.
15. Coote N. Surgical versus non-surgical management of pleural empyema (Cochrane Review). In: The Cochrane Library, Issue 2, 2005. Oxford: Update Software.
16. Britto MCA, Duarte MCMB, Silvestre SMMC. Fisioterapia respiratória no empiema pleural. Revisão sistemática da literatura J. bras. pneumol. 2005;31(6): 551-54.
Pneumatocele
É uma cavidade pulmonar cística de paredes finas.(1,2,3) A pneumatocele pode ocorrer em pneumonias bacterianas de qualquer etiologia. Embora seja mais caracteristicamente causada por estafilococos, nota-se sua maior freqüência nas pneumonias por Streptococcus pneumoniae.(2,3,4)
A radiografia de tórax é suficiente para o diagnóstico. A tomografia de tórax poderá ser utilizada para melhor avaliação da imagem, incluindo as complicações; diagnóstico diferencial com pneumotórax e cistos pulmonares; e para precisar sítio de drenagem percutânea, quando necessária.(2)
Na maioria das vezes, as pneumatoceles têm involução espontânea, num período de tempo que pode variar de semanas até mais de um ano.(3,5)
O tratamento das pneumatoceles deve ser conservador na maioria dos pacientes.
Grau de evidência B
Referências
1. Quigley MJ, Fraser RS. Pulmonary pneumatocele: Pathology and Pathogenesis. AJR Am J Roentgenol.1988;150(6):1275-7.
2. Imamoglu M, Cay A, Kosucu P, Ozdemir O, Cobanoglu U, Orhan F et al. Pneumatoceles in postpneumonic empyema: an algorithmic approach. J Pediatr Surg. 2005;40(7):1111-7.
3. Amitai I, Mogle P, Godfrey S, Aviad I. Pneumatocele in infants and children. Report of 12 cases. Clin Pediatr (Phila). 1983;22(6):420-2.
4. Kunyoshi V, Cataneo DC, Cataneo AJ. Complicated pneumonias with empyema and/or pneumatocele in children. Pediatr Surg Int. 2006;22(2):186-90. Epub 2005 Dec 16.
5. Victoria MS, Steiner P, Rao M. Persistent postpneumonic pneumatoceles in children. Chest. 1981;79(3):359-61.
Abscesso pulmonar
Corresponde a uma área de cavitação do parênquima pulmonar resultante de necrose e supuração.(1,2)
Geralmente, radiografias de tórax em postero-anterior (paciente sentado ou em pé) e perfil são suficientes para o diagnóstico. Apresenta-se, freqüentemente, como cavidade maior de 2 cm, com paredes espessas e nível hidroaéreo.(3) Os antibióticos isoladamente resolvem de 80% a 90% dos abscessos pulmonares em crianças.(4) A duração do tratamento depende da evolução clínico-radiológica.(5)
O tratamento clínico resolve a maioria dos casos de abscesso pulmonar.
Outras complicações da pneumonia adquirida na comunidade são: atelectasias, pneumonia necrosante, pneumotórax, fístula broncopleural, hemoptise, septicemia e bronquiectasia.
Grau de evidência B
Referências
1. Asher MI, Leversha AM. Lung Abscess. In: Chernick V, Boat TF, editors. Kendig's Disorders of the Respiratory Tract in Children. 6th ed., Philadelphia: WB Saunders; 1998. p. 552-60.
2. Asher MI, Spier S, Beland M, Coates AL, Beaudry PH. Primary lung abscess in childhood: the long-term outcome of conservative management. Am J Dis Child. 1982;136(6):491-4.
3. Brook I, Finegold SM. Bacteriology and therapy of lung abscess in children. J Pediatr. 1979; 94(1):10-2.
4. Tan TQ, Seilheimer DK, Kaplan SL. Pediatric lung abscess: clinical management and outcome. Pediatr Infect Dis J. 1995;14(1):51-5.
5. Hoffer FA, Bloom DA, Colin AA, Fishman SJ. Lung abscess versus necrotizing pneumonia: implications for interventional therapy. Pediatr Radiol. 1999; 29(2):87-91.
Resistência do Streptococcus pneumoniae à penicilina no Brasil
A definição de resistência é baseada na concentração inibitória mínima (CIM) do pneumococo à penicilina. Considera-se que cepas com CIM até 1 µg/mL são sensíveis, cepas com CIM entre 1 e 2 µg/mL têm resistência intermediária, e cepas com CIM > 4 µg/mL são de alta resistência.
Os sorotipos mais freqüentemente associados à resistência no Brasil são 14, 6B e 23F.(1)
Dados colhidos em estudos de âmbito nacional podem não refletir a distribuição da resistência à penicilina para uma dada região ou estado da federação. Essa distribuição deve ser cotejada com a formulação das vacinas disponíveis, como a 7-valente e futuras, como a 9 e 11-valente - de forma a se avaliar a efetividade dessas vacinas neste contexto epidemiológico.
A relevância clínica da resistência do Streptococcus pneumoniae à penicilina é questionável para infecções localizadas fora do sistema nervoso central.(2,3) Também não se tem observado diferença na freqüência de complicações associadas à pneumonia por pneumococo resistente à penicilina.(4) Cepas com susceptibilidade intermediária comportam-se como organismos sensíveis quando causam pneumonias e podem ser tratados com penicilina em doses habituais.(5) Deve-se salientar que, após a obtenção dos testes de sensibilidade, a troca de antibiótico deve ser baseada na resposta clínica e não apenas na sensibilidade in vitro.(4)
Não existe diferença nos desfechos clínicos de infecções pneumocócicas causadas por cepas com sensibilidade reduzida e tratadas com doses habituais de penicilina.
Grau de evidência B
Referências
1. Brandileone MC, Casagrande ST, Guerra ML, Zanella RC, de Andrade AL, Di Fabio JL. Increase in penicillin resistance of invasive Streptococcus pneumoniae in Brazil after 1999. J Antimicrob Chemother. 2005;56(2):437-9.
2. Yu VL, Chiou CC, Feldman C, Ortqvist A, Rello J, Morris AJ et al. An international prospective study of pneumococcal bacteremia: correlation with in vitro resistance, antibiotics administered, and clinical outcome. Clin Infect Dis 2003;37(2):230-7.
3. Hardie WD, Roberts NE, Reising SF, Christie CD. Complicated parapneumonic effusions in children caused by penicillin-nonsusceptible streptococcus pneumoniae. Pediatrics. 1998;101(3 pt 1):388-92.
4. Tan TQ. Clinical characteristics of children with complicated pneumonia caused by Streptococcus pneumoniae. Pediatrics. 2002;110(1 pt 1):1-6.
5. Heath PT, Breathnach AS. Treatment of infections due to resistant organisms. Br Med Bull. 2002;61(1):231-45
Prevenção
A prevenção da desnutrição, do baixo peso ao nascer e do desmame precoce ocupam papel de destaque entre as medidas preventivas da pneumonia.(1,2,3),
As evidências apontam que o tabagismo passivo acarreta um maior agravamento da doença do trato respiratório inferior, particularmente nos primeiros anos de vida.(4)
O uso de oligoelementos e a suplementação da vitamina A não evidenciaram a redução da mortalidade nem no tempo de hospitalização das crianças.(5)
As vacinas têm papel inquestionável como medida de prevenção em saúde. A imunização básica deve ser realizada para todas as crianças e adolescentes seguindo as recomendações do Programa Nacional de Imunizações (PNI).(6)
Além das vacinas oferecidas pelo PNI, outras vacinas também estão disponíveis gratuitamente nos Centros de Referência de Imunobiológicos Especiais para casos selecionados (Tabela 6)
Para crianças saudáveis, a Sociedade Brasileira de Pediatria recomenda a vacinação contra o vírus influenza e a vacina conjugada heptavalente contra o pneumococo.
Referências
1. Brasil. Ministério da Saúde. Coordenação Materno-Infantil. Tratamento das Pneumonias em Hospitais de pequeno e médio portes. Brasília, 1996. 44p.
2. Paiva MAS, Reis FJC, Fischer GB, Rozov T. Pneumonias na criança. J Pneumol 1998;24(8): 101-8.
3. Victora CG. Fatores de Risco nas IRA Baixas. In: Benguigui IY, Antunano FJL, Schmunis G, Yunes J. Controle das infecções respiratórias agudas em crianças. Washington, Organização Pan-americana de Saúde, 1998. p.43-61.
4. Samet JM. Synthesis: The health effects of tobacco smoke exposure on children. Disponível em: http://www.who.int/tobacco/resources/publications/en/ Acesso em 04 de janeiro de 2006.
5. Bhutta ZA, Black RE, Brown KH, Gardner JM, Gore S, Hidayat A et al. Prevention of diarrhea and pneumonia by zinc supplementation in children in developing countries: pooled analysis of randomized controlled trials. Journal of Pediatrics 1999;135(6):689-697.
6. Sociedade Brasileira de Pediatria [homepage on the Internet]. Rio de Janeiro: The Society; c2006 [cited 2005 Dec 5]. Departamento de Infectologia. Calendário vacinal 2003. [1 screen]. Disponível em: http:/www.sbp.com.br/img/documentos/doc_calendario2003.pdf.
7. Lucero MG, Dulalia VE, Parreno RN, Lim-Quianzon DM, Nohynek H, Makela H et al. Pneumococcal conjugate vaccines for preventing vaccine-type invasive pneumococcal disease and pneumonia with consolidation on x-ray in children under two years of age. (Cochrane Review). In: the Cochrane Library, Issue 1, 2007. Oxford: Update Sotware
8. American Academy of Pediatrics. Commitee on Infectious Diseases. Policy statement: recommendations for the prevention of pneumococcal infections, including the use of pneumococcal conjugate vaccine (Prevnar), pneumococcal polysaccharide vaccine, and antibiotic prophylaxis. Pediatrics 2000;106(2):362-6.
9. Overturf GD. American Academy of Pediatrics. Committee on Infectious Diseases. Technical report: prevention of pneumococcal infections, including the use of pneumococcal conjugate and polysaccharide vaccines and antibiotic prophylaxis. Pediatrics 2000;106(2):367-76.
10. Bridges CB, Fukuda K, Uyeki TM, Cox NJ, Singleton JÁ; Centers for Disease Control and Prevention, Advisory Committee on Immunization Practices. Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep.2002;51(RR-3):1-31
11. American Academy of Pediatrics, Committee on Infectious Diseases. Recommendations for influenza immunization of children. Pediatrics 2004;113(5):1441-7
12. CDC 1997 & 2001; "Preventing pneumococcal disease," 2000; Shapiro & Clemens, 1984; Williams et al., 1988; Nichol, Grimm, & Peterson, 1996).
13. Davies EG, Riddington C, Lottenberg R, Dower N. Pneumococcal vaccines for sickle cell disease (Cochrane Review). In: The Cochrane Library, Issue 2, 2005. Oxford: Update Software.
14. Lin JC, Nichol KL. Excess mortality due to pneumonia or influenza during influenza seasons among persons with acquired immunodeficiency syndrome. Arch Intern Med. 2001;161(3):441-6.
Datas de Publicação
-
Publicação nesta coleção
11 Jun 2007 -
Data do Fascículo
Abr 2007