Resumos
A ventilação mecânica é uma terapia importante, mas pode resultar em complicações. Uma das mais relevantes é a lesão pulmonar induzida por ventilador. Devido à hiperdistensão alveolar, o pulmão inicia um processo inflamatório, com infiltrado neutrofílico, formação de membrana hialina, fibrogênese e prejuízo de troca gasosa. Nesse processo, a mecanotransdução da hiperdistensão celular é mediada através do citoesqueleto da célula e de suas interações com a matriz extracelular e com as células vizinhas, de modo que o estímulo mecânico da ventilação se traduz em sinalização bioquímica intracelular, desencadeando ativação endotelial, permeabilidade vascular pulmonar, quimiotaxia leucocitária, produção de citocinas e, possivelmente, lesão de órgãos à distância. Estudos clínicos demonstram essa relação entre distensão pulmonar e mortalidade em pacientes com lesão pulmonar induzida por ventilador. Entretanto, apesar de o citoesqueleto ter um papel fundamental na patogênese da lesão pulmonar induzida por ventilador, a literatura carece de estudos utilizando modelos in vivo sobre as alterações do citoesqueleto e de suas proteínas associadas durante esse processo patológico.
Respiração artificial; Citoesqueleto; Moléculas de adesão celular; Aderências focais; Mecanotransdução celular
Although mechanical ventilation is an important therapy, it can result in complications. One major complication is ventilator-induced lung injury, which is caused by alveolar hyperdistension, leading to an inflammatory process, with neutrophilic infiltration, hyaline membrane formation, fibrogenesis and impaired gas exchange. In this process, cellular mechanotransduction of the overstretching stimulus is mediated by means of the cytoskeleton and its cell-cell and cell-extracellular matrix interactions, in such a way that the mechanical stimulus of ventilation is translated into an intracellular biochemical signal, inducing endothelial activation, pulmonary vascular permeability, leukocyte chemotaxis, cytokine production and, possibly, distal organ failure. Clinical studies have shown the relationship between pulmonary distension and mortality in patients with ventilator-induced lung injury. However, although the cytoskeleton plays a fundamental role in the pathogenesis of ventilator-induced lung injury, there have been few in vivo studies of alterations in the cytoskeleton and in cytoskeleton-associated proteins during this pathological process.
Respiration, artificial; Cytoskeleton; Cell adhesion molecules; Focal adhesions; Mechanotransduction, cellular
ARTIGO DE REVISÃO
Citoesqueleto e mecanotransdução na fisiopatologia da lesão pulmonar induzida por ventilador* * Trabalho realizado no Hospital das Clínicas, Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil.
Leandro Utino TaniguchiI; Elia Garcia CaldiniII; Irineu Tadeu VelascoIII; Elnara Márcia NegriIV
IMédico Assistente. UTI do Pronto-Socorro de Clínica Médica, Hospital das Clínicas da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil
IIProfessora. Departamento de Patologia, Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil
IIIProfessor Titular. Disciplina de Emergências Clínicas, Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil
IVProfessor Livre-Docente. Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil
Endereço para correspondência Endereço para correspondência: Leandro Utino Taniguchi Disciplina de Emergências Clínicas, Hospital das Clínicas da Faculdade de Medicina da USP Avenida Enéas de Carvalho Aguiar, 155, 8º andar, Bloco 03, Clínica Médica Pós-Graduação Ciências Médicas CEP 05403-900, São Paulo, SP, Brasil Tel 55 11 3069-6336 E-mail: leandrout@hotmail.com
RESUMO
A ventilação mecânica é uma terapia importante, mas pode resultar em complicações. Uma das mais relevantes é a lesão pulmonar induzida por ventilador. Devido à hiperdistensão alveolar, o pulmão inicia um processo inflamatório, com infiltrado neutrofílico, formação de membrana hialina, fibrogênese e prejuízo de troca gasosa. Nesse processo, a mecanotransdução da hiperdistensão celular é mediada através do citoesqueleto da célula e de suas interações com a matriz extracelular e com as células vizinhas, de modo que o estímulo mecânico da ventilação se traduz em sinalização bioquímica intracelular, desencadeando ativação endotelial, permeabilidade vascular pulmonar, quimiotaxia leucocitária, produção de citocinas e, possivelmente, lesão de órgãos à distância. Estudos clínicos demonstram essa relação entre distensão pulmonar e mortalidade em pacientes com lesão pulmonar induzida por ventilador. Entretanto, apesar de o citoesqueleto ter um papel fundamental na patogênese da lesão pulmonar induzida por ventilador, a literatura carece de estudos utilizando modelos in vivo sobre as alterações do citoesqueleto e de suas proteínas associadas durante esse processo patológico.
Descritores: Respiração artificial; Citoesqueleto; Moléculas de adesão celular; Aderências focais; Mecanotransdução celular.
Introdução
A ventilação mecânica é uma terapia amplamente utilizada na medicina intensiva. Sua finalidade é fornecer suporte quando a ventilação espontânea não é capaz de sustentar a vida ou quando o controle da ventilação é imperativo para se prevenir o iminente colapso de determinadas funções orgânicas.(1) Apesar de ser uma terapia muitas vezes imprescindível e salvadora, seu emprego está relacionado a diversas complicações possíveis, como o aumento do risco de pneumonia, alterações hemodinâmicas, distúrbios neuromusculares e barotrauma.(2-5)
A ventilação mecânica é capaz de causar danos diretos ao pulmão, promovendo a lesão pulmonar induzida por ventilador que, em inglês, é denominada ventilator-induced lung injury (VILI).(5,6) Vista inicialmente apenas como sinônimo de barotrauma, atualmente se sabe que VILI apresenta alterações inespecíficas do ponto de vista fisiológico e morfológico no parênquima pulmonar. Alteração do balanço de fluidos no pulmão, dano alveolar difuso e aumento da permeabilidade endotelial e epitelial foram descritos após ventilação mecânica em animais, levando a um padrão muitas vezes semelhante ao encontrado em pacientes com síndrome do desconforto respiratório agudo (SDRA).(7) Assim, VILI pode não ser distinguida da maioria das patologias pulmonares que levam ao próprio uso da ventilação mecânica, além de poder contribuir para a piora do quadro inicial.
VILI: da descoberta aos determinantes mecânicos
Webb e Tierney foram os primeiros autores a descrever as alterações pulmonares induzidas por ventilação mecânica com altos volumes correntes.(8) Eles estudaram ratos ventilados com zero de positive end-expiratory pressure (PEEP, pressão expiratória final positiva), e pressões de pico inspiratório de 14, 30 ou 45 cmH2O. Animais controle não ventilados e aqueles submetidos a 14 cmH2O de pressão inspiratória não apresentaram alterações patológicas no pulmão. Aqueles do grupo submetido a 30 cmH2O mostraram edema perivascular sem edema alveolar, ao passo que, no grupo submetido a 45 cmH2O, houve edema perivascular e alveolar, hipoxemia severa e redução da complacência dinâmica, com óbito em uma hora de experimento.(8)
Os estudos subsequentes se concentraram nos fatores mecânicos desencadeantes dessa lesão, como pressão de pico respiratório e volume corrente (VC).(9-12) Dreyfuss et al. confirmaram os achados de Webb e Tierney e demonstraram que VC era o determinante mais importante no estresse lesivo ao alvéolo e à membrana alveolocapilar (o que originou o termo ''volutrauma'').(13,14) Em um estudo importante, eles compararam ratos ventilados com altos VC e pressão negativa (através de um ventilador de pressão negativa do tipo iron lung) com animais ventilados com altas pressões e baixos VC (com restrição toracoabdominal por enfaixamento). Somente houve edema extravascular pulmonar e aumento da permeabilidade microvascular nos animais com altos VC, concluindo-se que o aumento do VC foi o responsável pelo edema induzido por ventilação.(13) Cabe ressaltar que o modelo usado não permitia diferenciar os efeitos deletérios do VC dos relacionados ao aumento da pressão transpulmonar.
Com base nesses dados, estudos clínicos com estratégias de ventilação protetora foram desenvolvidos com a finalidade de minimizar a lesão pulmonar por VILI através da redução do VC. Seu impacto clínico é evidente: redução da morbidade e redução de 22% da mortalidade em pacientes com SDRA.(15,16)
Do volutrauma ao biotrauma
Conforme a estratégia ventilatória, o estresse mecânico pode alterar os processos celulares no pulmão.(17) Tremblay et al. foram um dos primeiros pesquisadores a demonstrar, em um modelo de pulmão isolado de rato, que estratégias lesivas com alto VC induzem a produção de citocinas (TNF-α) e a expressão de c-fos RNAm.(18) Outros estudos em culturas de células submetidas a estiramento cíclico também demonstraram a produção de citocinas em células epiteliais(19) e endoteliais(20) quando essas foram submetidas à distensão equivalente a mais de 80% da CPT. Tal síntese de citocinas, além de ser evolutiva temporalmente,(21) é potencializada pela concomitância de outros fatores, como endotoxinas sistêmicas ou hiperóxia.(22,23)
A partir da indução de uma resposta pró-inflamatória no epitélio pulmonar associada a uma alteração na permeabilidade no endotélio local,(14,24) alguns autores sugerem que poderia haver uma descompartimentalização da inflamação, passando agora para nível sistêmico. Isso desencadearia uma resposta inflamatória à distância, favorecendo a disfunção de múltiplos órgãos, fenômeno esse denominado ''biotrauma''.(25-27)
Em um importante estudo experimental, demonstrou-se que a ventilação mecânica lesiva desencadeia apoptose de células epiteliais em rim e intestino delgado, mecanismo esse parcialmente relacionado à produção de Fas ligante.(28) Também se sugeriu que parte da disfunção orgânica que os pacientes apresentam durante o período crítico pode ser desencadeada pela indução de apoptose à distância pela ventilação.
A avaliação dos dados de IL-6 (uma citocina pró-inflamatória) em um estudo corrobora essa idéia.(16) No grupo com SDRA ventilado com VC alto houve menores valores de IL-6 do que no grupo com VC habitual, o que sugere uma menor resposta inflamatória decorrente da estratégia ventilatória utilizada.(16)
Entretanto, a teoria do biotrauma apresenta controvérsias quanto à consistência da produção e a importância relativa das citocinas pulmonares.(29) Tal discussão, algumas vezes um tanto quanto acirrada, ainda permanece na literatura.(30,31)
Diferentes tensões atuam no parênquima pulmonar
Há vários anos sabe-se que a distribuição das forças de estresse e de distensão sobre o parênquima pulmonar não é uniforme.(32) Através de modelos de micromecânica do parênquima, percebe-se que as fibras elásticas e de colágeno, na sua disposição helicoidal no interstício, são as principais estruturas de suporte e resistência ao estresse.(33-35) O septo alveolar, por sua vez, está submetido a diferentes tipos de forças e tensões: as células endoteliais são submetidas à pressão transcapilar e às forças laminares do fluxo sanguíneo, enquanto as células epiteliais das vias aéreas e dos alvéolos sofrem estiramento e compressão cíclicos pelo movimento respiratório e pela tensão superficial da interface ar-líquido. Tais forças se tornam ainda mais importantes na vigência de heterogeneidade do parênquima.(36)
As células pulmonares precisam se adaptar constantemente às mudanças frequentes da tensão do tecido onde se situam. Tanto o epitélio como o endotélio estão sujeitos a diversas forças durante a respiração, resultado dos efeitos interdependentes do volume pulmonar, pressão transpulmonar, tensão superficial e tensão transcapilar na membrana alveolocapilar.(37,38) Tais forças, em nível celular, são transmitidas e suportadas pelo citoesqueleto da célula.
O citoesqueleto e sua dinâmica na deformação da célula
O citoesqueleto é constituído de uma rede intracelular de biopolímeros que se associam para formar três tipos de filamentos: os microtúbulos, os filamentos intermediários e os microfilamentos de actina. Os microtúbulos são polímeros de tubulina, que se organizam a partir da região perinuclear em direção à periferia, condicionando a forma celular e direcionando o transporte intracelular. Os filamentos intermediários se conectam ao envoltório nuclear, às junções intercelulares (como os desmossomos e hemidesmossomos) e a outros elementos do citoesqueleto, conferindo resistência à estrutura; são formados por diversas proteínas segundo o tipo celular: nas células musculares são formados por desmina; nas células epiteliais, por citoqueratina; e nas células mesenquimais, por vimentina. Já os microfilamentos de actina participam da geração de forças contráteis e conectam-se às proteínas intracelulares das zônulas de adesão (no caso do contato célula-célula) ou das placas de contato focal (no caso do contato célula-matriz extracelular), estabilizando a célula em relação às forças atuantes na membrana e determinando a forma da membrana plasmática.(39)
Como um sistema dinâmico e adaptável, o citoesqueleto é descrito como ''filas de formigas'': uma mesma fila pode persistir por horas se necessário, mas cada elemento individual da fila está em constante atividade. Em caso de uma nova situação, a fila pode se rearranjar rapidamente devido à sua característica dinâmica.(39) Seguindo essa metáfora, o citoesqueleto está em constante rearranjo para adaptar a célula às diferentes tensões do meio.
Uma vez que o citoesqueleto é um sistema integrado e em rede, cada elemento isolado não pode ser considerado para a resistência à deformação. Segundo um modelo biomecânico denominado tensegrity (tensegridade), as células são estruturas pré-estressadas, constituídas de um sistema em rede (o citoesqueleto) composto por filamentos sujeitos à tensão acoplados aos microtúbulos resistentes à compressão. Esse modelo é estável, resistente e permite que a célula responda prontamente a estímulos físicos externos.(40) Sendo estruturas dinâmicas, as células devem se remodelar ativamente para se adaptar às diferentes tensões presentes no pulmão durante a respiração. Para tanto, seu citoesqueleto, como estrutura celular responsável por suportar tais deformações e as tensões resultantes, deve ser capaz de se degradar e se reorganizar, conferindo plasticidade ao sistema. Descrito como tendo um comportamento amorfo dinâmico semelhante ao vidro,(41) o citoesqueleto está longe da estrutura rígida e estática descrita no passado. Ele é capaz de se reestruturar rapidamente, adaptando-se a diferentes tensões e situações, modificando inclusive a viscosidade da célula para melhor adaptá-la ao meio.(42,43)
As células constituintes do epitélio pulmonar estão conectadas umas às outras através de junções especializadas da membrana plasmática responsáveis por suportar grande parte do estresse de distensão. Para tanto, os filamentos do citoesqueleto se inserem nessas regiões ricas em caderinas (proteínas de membrana responsáveis diretamente pela adesão célula a célula). Essas junções celulares especializadas são as zônulas de adesão e os desmossomos, encarregados de acoplar mecanicamente o citoesqueleto de células vizinhas.(44)
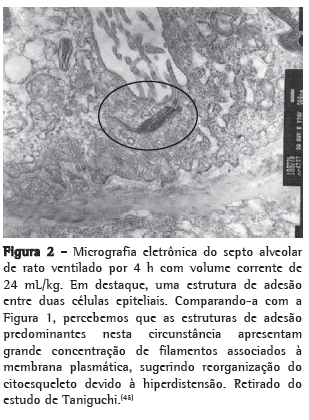
Um exemplo de reorganização do citoesqueleto é demonstrado nas Figuras 1 e 2, nas quais as estruturas de adesão entre as células epiteliais alveolares de ratos ventilados com VC baixo (Figura 1) e alto (Figura 2) são evidenciadas por microscopia eletrônica.(45)
Interação célula-matriz e mecanotransdução
Além de conectarem umas às outras, as células do epitélio alveolar estão conectadas à matriz extracelular especializada, denominada lâmina basal, sobre a qual se apoiam.
As integrinas são as proteínas da membrana celular responsáveis pela interação da matriz extracelular ao citoesqueleto. As forças presentes no interstício pulmonar são transmitidas às células através da tensão sobre as integrinas, que as repassam para o citoesqueleto. A análise ultraestrutural mostrou a existência de ''placas de adesão focal'', que são regiões especializadas da membrana celular ricas em integrinas e em elementos do citoesqueleto, onde se dá a interação bidirecional entre a célula e a matriz.(44) Nessas placas de adesão, os feixes de microfilamentos de actina do citoesqueleto se ancoram à face citoplasmática das integrinas através de um complexo multimolecular de proteínas juncionais. Alguns dos constituintes participam da ligação estrutural das integrinas ao citoesqueleto de actina, enquanto outras são moléculas de sinalização.(46,47) Sendo assim, essas estruturas dinâmicas seriam responsáveis pela monitorização da tensão do meio externo sobre a célula, desempenhando um papel importante no comportamento celular.(46,47) Entretanto, os mecanismos pelos quais os sinais mecânicos, transmitidos às integrinas e ao citoesqueleto, são submetidos à transdução para um sinal bioquímico ainda não são bem compreendidos. Já se observou que as integrinas geram segundos mensageiros intracelulares nas junções de ancoragem pela sua associação com outras proteínas, como paxilina, talina e vinculina, e com algumas quinases, como focal adhesion kinase (FAK), PKA, PKC, mitogen-activated protein kinase (MAPK) e c-Src, além de outros -Micrografia eletrônica do septo alveolar de rato ventilado por 4 h com volume corrente de 24 mL/kg. Em destaque, uma estrutura de adesão entre duas células epiteliais. Comparando-a com a Figura 1, percebemos que as estruturas de adesão predominantes nesta circunstância apresentam grande concentração de filamentos associados à membrana plasmática, sugerindo reorganização do citoesqueleto devido à hiperdistensão. Retirado do estudo de Taniguchi.(45) complexos enzimáticos como Rho-GTPase e fosfolipase C.(48-50)
A FAK está entre as mais importantes moléculas de sinalização.(51) Sendo uma tirosina quinase de 125 kDa, foi inicialmente identificada nas placas de adesão focal. Posteriormente demonstrou-se que, a partir da interação da integrina à matriz extracelular, a FAK passa por uma sequência coordenada de eventos: é autofosforilada em resíduos de tirosina (especialmente Y397), associa-se a outras tirosina quinases da família Src (como pp60src), realiza a fosforilação de outras proteínas associadas às placas de adesão focal, como p130Cas e paxilina,(52) e se liga a outras proteínas SH2, como Grb2 (de forma a ativar outras vias sinalizadoras, como Ras e MAPK).(47) Sendo assim, a localização dessa quinase na placa de adesão focal e sua fosforilação são eventos importantes e iniciais do mecanismo de mecanotransdução e na formação de novas junções focais.
Alguns estudos procuraram avaliar as alterações de FAK nos processos relacionados à hiperdistensão pulmonar. Um grupo de autores estudou células endoteliais retiradas de um modelo de pulmão isolado. Nesse estudo, a aplicação de VC elevado induziu um aumento de fosforilação de FAK, além de resposta pró-inflamatória no endotélio, facilitadora da adesão leucocitária pelo aumento de P-selectina.(20) Entretanto, outros autores(53) demonstraram achados diferentes quando estudaram pneumócitos II isolados de pulmões submetidos a alto VC e hiperóxia. Houve redução na fosforilação de FAK nessas células, em comparação com as isoladas de ratos controle ou aquelas somente submetidas a VC elevado sem hiperóxia. Como consequência dessa menor fosforilação de FAK, as células apresentavam menor capacidade de adesão ao substrato, demonstrando a importância dessa quinase nos fenômenos de interação célulamatriz extracelular.(53) Dessa forma, os diferentes tipos celulares do pulmão podem apresentar respostas distintas ao mesmo estímulo.
Outra proteína importante e muito estudada, presente nas placas de adesão focal, é a paxilina. Essa proteína de 68 kDa não apresenta sítios catalíticos em sua estrutura, mas é rica em regiões de ligação (sítios LD e LIM). Isso sugere uma função estrutural e de ancoragem para a ligação a outras proteínas. De fato, a paxilina se localiza em estruturas de adesão já estabelecidas, ligando-se a outras proteínas estruturais, como vinculina e actopaxina, e/ou servindo de estrutura de ancoragem para enzimas, como FAK.(54) A partir de sua fosforilação, ela está relacionada à estabilização e reciclagem das placas de adesão focal durante a migração e adesão das células à matriz.(55,56) De fato, acredita-se que sua maior ou menor ativação (via fosforilação) relaciona-se com o maior ou menor potencial migratório da célula, inclusive nos processos de reparação tecidual.(54)
Quanto aos estudos do comportamento da paxilina no fenômeno de VILI, os achados são semelhantes aos encontrados para FAK (o que não é surpreendente, uma vez que a ativação de FAK promove a fosforilação da paxilina). Os estudos de dois grupos de autores com endotélio(20) e com pneumócitos II(53) também demonstraram achados diferentes para a fosforilação da paxilina com hiperdistensão celular de forma parecida com os achados para FAK. Sendo assim, a alteração na fosforilação dessa proteína é variável dependendo da linhagem celular em questão.(54)
Além do processo de mecanotransdução, novos estudos sugerem que o citoesqueleto pode transmitir as tensões diretamente a organelas internas, como as mitocôndrias, gerando sinais intracelulares. Dessa forma, a hiperdistensão sobre a matriz extracelular associada ao endotélio pulmonar seria repassada aos filamentos de actina do citoesqueleto conectados em série com as integrinas e, por consequência, às mitocôndrias ligadas à actina. Isso desencadearia um estímulo para a produção de radicais livres que, entre outros efeitos intracelulares, promove a exocitose de P-selectina e aumento da produção de vascular cell adhesion molecule via nuclear factor kappa B (NF-κB, fator nuclear kappa B), além de eventos pró-inflamatórios, que facilitariam a adesão leucocitária.(57,58)
Em resumo, a hiperdistensão do parênquima pulmonar em VILI parece ser transmitida do meio extracelular para o interior das células através da conexão matriz extracelularcitoesqueleto, na qual a integrina faz o papel de mediação. Nesse mecanismo, algumas proteínas intracelulares associadas às estruturas de adesão são importantes, especialmente FAK e paxilina. A Figura 3 resume esquematicamente algumas das interações moleculares já descritas para a transdução de sinal nas estruturas de adesão celular.
Mecanismos de mecanotransdução independente das integrinas
Um mecanismo proposto pelo qual a hiperdistensão alveolar poderia gerar sinais intracelulares independentes do citoesqueleto seria através da formação de fraturas transitórias na membrana plasmática das células submetidas a estresse mecânico. Um grupo de autores demonstrou, em um modelo experimental, que os pulmões submetidos a altos VC apresentam alterações reversíveis na membrana plasmática.(59) Entretanto, essas fraturas transitórias na membrana podem desencadear uma sinalização intracelular via c-fos e NF-κB e mediar parte da mecanotransdução de forma independente do citoesqueleto(60) (Figura 4).
Perspectivas futuras: dos modelos in vitro para in vivo em VILI
Como descrito anteriormente, o citoesqueleto e as suas estruturas associadas assumem papel crucial na fisiopatologia de VILI. Os estudos nessa área estão progredindo para uma melhor compreensão de como se dá a mecanotransdução e como o citoesqueleto responde à distensão pulmonar excessiva. Entretanto, esses estudos têm sido basicamente em modelos de culturas de células.(50) Apesar de esse modelo reducionista permitir isolar cada um dos componentes nessa resposta complexa, perdem-se as múltiplas interações entre os diversos tipos celulares que compõem o pulmão. Além disso, os modelos de cultura submetidos à distensão cíclica são essencialmente bidimensionais, sendo que o alvéolo se insufla nas três dimensões. Finalmente, o impacto da resposta pró-inflamatória observada em modelos in vitro não pode ser inferido para o organismo como um todo, especialmente quanto à interação com respostas anti-inflamatórias sistêmicas, como IL-10, receptor solúvel de TNF-α ou receptor solúvel de IL-1.
Não existem muitos estudos descrevendo em modelos in vivo as alterações do citoesqueleto em VILI, nem de suas proteínas associadas (como, por exemplo, FAK e paxilina). Percebe-se então a necessidade de estudos nessa área com modelos mais integrados, que possam mimetizar mais de perto as modificações que ocorrem nas células pulmonares dos pacientes sob ventilação mecânica, uma vez que essas estão constantemente submetidas a estímulos pró-inflamatórios e pró-apoptóticos, além do estresse mecânico, que influenciam sua estrutura e função.
Recebido para publicação em 5/11/2009.
Aprovado, após revisão, em 26/1/2010.
Apoio financeiro: Este estudo recebeu apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e dos Laboratórios de Investigação Médica do Hospital das Clínicas da Universidade de São Paulo.
- 1. Hubmayr RD, Irwin RS. Mechanical Ventilation: Initiation. In: Irwin RS, Cerra FB, Rippe JM, editors. Irwin and Rippe's Intensive Care Medicine. Philadelphia: Lippincott-Raven;, 1999. p. 727-41.
- 2. Kollef MH. Prevention of hospital-associated pneumonia and ventilator-associated pneumonia. Crit Care Med. 2004;32(6):1396-405.
- 3. Pinsky MR. Recent advances in the clinical application of heart-lung interactions. Curr Opin Crit Care. 2002;8(1):26-31.
- 4. Shanely RA, Zergeroglu MA, Lennon SL, Sugiura T, Yimlamai T, Enns D, et al. Mechanical ventilation induced diaphragmatic atrophy is associated with oxidative injury and increased proteolytic activity. Am J Respir Crit Care Med. 2002;166(10):1369-74.
- 5. Pinhu L, Whitehead T, Evans T, Griffiths M. Ventilator associated lung injury. Lancet. 2003;361(9354):332-40.
- 6. Ricard JD, Dreyfuss D, Saumon G. Ventilator-induced lung injury. Eur Respir J Suppl. 2003;42:2s-9s.
- 7. Dreyfuss D, Saumon G. Ventilator-induced lung injury: lessons from experimental studies. Am J Respir Crit Care Med. 1998;157(1):294-323.
- 8. Webb HH, Tierney DF. Experimental pulmonary edema due to intermittent positive pressure ventilation with high inflation pressures. Protection by positive end-expiratory pressure. Am Rev Respir Dis. 1974;110(5):556-65.
- 9. Parker JC, Townsley MI, Rippe B, Taylor AE, Thigpen J. Increased microvascular permeability in dog lungs due to high peak airway pressures. J Appl Physiol. 1984;57(6):1809-16.
- 10. Hernandez LA, Peevy KJ, Moise AA, Parker JC. Chest wall restriction limits high airway pressure-induced lung injury in young rabbits. J Appl Physiol. 1989;66(5):2364-8.
- 11. Slutsky AS. Lung injury caused by mechanical ventilation. Chest. 1999;116(1 Suppl):9S-15S.
- 12. Parker JC, Hernandez LA, Peevy KJ. Mechanisms of ventilator-induced lung injury. Crit Care Med. 1993;21(1):131-43.
- 13. Dreyfuss D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure. Am Rev Respir Dis. 1988;137(5):1159-64.
- 14. Dreyfuss D, Basset G, Soler P, Saumon G. Intermittent positive-pressure hyperventilation with high inflation pressures produces pulmonary microvascular injury in rats. Am Rev Respir Dis. 1985;132(4):880-4.
- 15. Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338(6):347-54.
- 16. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342(18):1301-8.
- 17. Dos Santos CC, Slutsky AS. Invited review: mechanisms of ventilator-induced lung injury: a perspective. J Appl Physiol. 2000;89(4):1645-55.
- 18. Tremblay L, Valenza F, Ribeiro SP, Li J, Slutsky AS. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest. 1997;99(5):944-52.
- 19. Vlahakis NE, Schroeder MA, Limper AH, Hubmayr RD. Stretch induces cytokine release by alveolar epithelial cells in vitro. Am J Physiol. 1999;277(1 Pt 1):L167-73.
- 20. Bhattacharya S, Sen N, Yiming MT, Patel R, Parthasarathi K, Quadri S, et al. High tidal volume ventilation induces proinflammatory signaling in rat lung endothelium. Am J Respir Cell Mol Biol. 2003;28(2):218-24.
- 21. Wilson MR, Choudhury S, Goddard ME, O'Dea KP, Nicholson AG, Takata M. High tidal volume upregulates intrapulmonary cytokines in an in vivo mouse model of ventilator-induced lung injury. J Appl Physiol. 2003;95(4):1385-93.
- 22. Altemeier WA, Matute-Bello G, Frevert CW, Kawata Y, Kajikawa O, Martin TR, et al. Mechanical ventilation with moderate tidal volumes synergistically increases lung cytokine response to systemic endotoxin. Am J Physiol Lung Cell Mol Physiol. 2004;287(3):L533-42.
- 23. Quinn DA, Moufarrej RK, Volokhov A, Hales CA. Interactions of lung stretch, hyperoxia, and MIP-2 production in ventilator-induced lung injury. J Appl Physiol. 2002;93(2):517-25.
- 24. Birukov KG, Jacobson JR, Flores AA, Ye SQ, Birukova AA, Verin AD, et al. Magnitude-dependent regulation of pulmonary endothelial cell barrier function by cyclic stretch. Am J Physiol Lung Cell Mol Physiol. 2003;285(4):L785-97.
- 25. Haitsma JJ, Uhlig S, Göggel R, Verbrugge SJ, Lachmann U, Lachmann B. Ventilator-induced lung injury leads to loss of alveolar and systemic compartmentalization of tumor necrosis factor-alpha. Intensive Care Med. 2000;26(10):1515-22.
- 26. Tremblay LN, Slutsky AS. Ventilator-induced injury: from barotrauma to biotrauma. Proc Assoc Am Physicians. 1998;110(6):482-8.
- 27. dos Santos CC, Slutsky AS. Mechanotransduction, ventilator-induced lung injury and multiple organ dysfunction syndrome. Intensive Care Med. 2000;26(5):638-42.
- 28. Imai Y, Parodo J, Kajikawa O, de Perrot M, Fischer S, Edwards V, et al. Injurious mechanical ventilation and end-organ epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome. JAMA. 2003;289(16):2104-12.
- 29. Ricard JD, Dreyfuss D, Saumon G. Production of inflammatory cytokines in ventilator-induced lung injury: a reappraisal. Am J Respir Crit Care Med. 2001;163(5):1176-80.
- 30. Dreyfuss D, Ricard JD, Saumon G. On the physiologic and clinical relevance of lung-borne cytokines during ventilator-induced lung injury. Am J Respir Crit Care Med. 2003;167(11):1467-71.
- 31. Uhlig S, Ranieri M, Slutsky AS. Biotrauma hypothesis of ventilator-induced lung injury. Am J Respir Crit Care Med. 2004;169(2):314-5; author reply 315.
- 32. Agostoni E. Mechanics of the pleural space. In: Fishman AP, Macklem PT, Mead J, Geiger SR. Handbook of Physiology: Section 3: The Respiratory System Volume III, Parts 1 & 2: Mechanics of Breathing. Baltimore: Williams and Wilkins Co.; 1986. pp. 531-59.
- 33. Mercer RR, Crapo JD. Spatial distribution of collagen and elastin fibers in the lungs. J Appl Physiol. 1990;69(2):756-65.
- 34. Oldmixon EH, Hoppin FG Jr. Distribution of elastin and collagen in canine lung alveolar parenchyma. J Appl Physiol. 1989;67(5):1941-9.
- 35. Mercer RR, Laco JM, Crapo JD. Three-dimensional reconstruction of alveoli in the rat lung for pressure-volume relationships. J Appl Physiol. 1987;62(4):1480-7.
- 36. Mead J, Takishima T, Leith D. Stress distribution in lungs: a model of pulmonary elasticity. J Appl Physiol. 1970;28(5):596-608.
- 37. West JB, Tsukimoto K, Mathieu-Costello O, Prediletto R. Stress failure in pulmonary capillaries. J Appl Physiol. 1991;70(4):1731-42.
- 38. Vlahakis NE, Hubmayr RD. Cellular stress failure in ventilator-injured lungs. Am J Respir Crit Care Med. 2005;171(12):1328-42.
- 39. Theriot J, Amos L, Cooper J, Fuchs E, Gertler F, Goldstein L, et al. The Cytoskeleton. In: Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P, editors. Molecular Biology of the Cell. Nova York: Garland Science;, 2002. p. 907-82.
- 40. Ingber DE. Tensegrity: the architectural basis of cellular mechanotransduction. Annu Rev Physiol. 1997;59:575-99.
- 41. Trepat X, Deng L, An SS, Navajas D, Tschumperlin DJ, Gerthoffer WT, et al. Universal physical responses to stretch in the living cell. Nature. 2007;447(7144):592-5.
- 42. Wang N, Butler JP, Ingber DE. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 1993;260(5111):1124-7.
- 43. Gunst SJ, Tang DD, Opazo Saez A. Cytoskeletal remodeling of the airway smooth muscle cell: a mechanism for adaptation to mechanical forces in the lung. Respir Physiol Neurobiol. 2003;137(2-3):151-68.
- 44. Kypta R, Bernfield M, Burridge K, Geiger B, Goodenough D, Gumbiner B, et al. Cell junctions, cell adhesion, and the extracellular matrix. In: Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P, editors. Molecular Biology of the Cell. Nova York: Garland Science;, 2002. p. 1065-125.
- 45. Taniguchi LU. Avaliação imunohistoquímica das alterações do citoesqueleto na parede alveolar em modelo experimental de lesão pulmonar induzida pela ventilação mecânica em ratos [thesis]. São Paulo: Universidade de São Paulo; 2009.
- 46. Petit V, Thiery JP. Focal adhesions: structure and dynamics. Biol Cell. 2000;92(7):477-94.
- 47. Wozniak MA, Modzelewska K, Kwong L, Keely PJ. Focal adhesion regulation of cell behavior. Biochim Biophys Acta. 2004;1692(2-3):103-19.
- 48. Pugin J. Molecular mechanisms of lung cell activation induced by cyclic stretch. Crit Care Med. 2003;31(4 Suppl):S200-6.
- 49. Han B, Lodyga M, Liu M. Ventilator-induced lung injury: role of protein-protein interaction in mechanosensation. Proc Am Thorac Soc. 2005;2(3):181-7.
- 50. Liu M, Tanswell AK, Post M. Mechanical forceinduced signal transduction in lung cells. Am J Physiol. 1999;277(4 Pt 1):L667-83.
- 51. Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003;116(Pt 8):1409-16.
- 52. Schaller MD, Hildebrand JD, Shannon JD, Fox JW, Vines RR, Parsons JT. Autophosphorylation of the focal adhesion kinase, pp125FAK, directs SH2-dependent binding of pp60src. Mol Cell Biol. 1994;14(3):1680-8.
- 53. Desai LP, Sinclair SE, Chapman KE, Hassid A, Waters CM. High tidal volume mechanical ventilation with hyperoxia alters alveolar type II cell adhesion. Am J Physiol Lung Cell Mol Physiol. 2007;293(3):L769-78.
- 54. Brown MC, Turner CE. Paxillin: adapting to change. Physiol Rev. 2004;84(4):1315-39.
- 55. Zaidel-Bar R, Milo R, Kam Z, Geiger B. A paxillin tyrosine phosphorylation switch regulates the assembly and form of cell-matrix adhesions. J Cell Sci. 2007;120(Pt 1):137-48.
- 56. Schaller MD. Paxillin: a focal adhesion-associated adaptor protein. Oncogene. 2001;20(44):6459-72.
- 57. Ichimura H, Parthasarathi K, Quadri S, Issekutz AC, Bhattacharya J. Mechano-oxidative coupling by mitochondria induces proinflammatory responses in lung venular capillaries. J Clin Invest. 2003;111(5):691-9.
- 58. Ali MH, Pearlstein DP, Mathieu CE, Schumacker PT. Mitochondrial requirement for endothelial responses to cyclic strain: implications for mechanotransduction. Am J Physiol Lung Cell Mol Physiol. 2004;287(3):L486-96.
- 59. Gajic O, Lee J, Doerr CH, Berrios JC, Myers JL, Hubmayr RD. Ventilator-induced cell wounding and repair in the intact lung. Am J Respir Crit Care Med. 2003;167(8):1057-63.
- 60. Grembowicz KP, Sprague D, McNeil PL. Temporary disruption of the plasma membrane is required for c-fos expression in response to mechanical stress. Mol Biol Cell. 1999;10(4):1247-57.
Datas de Publicação
-
Publicação nesta coleção
30 Jun 2010 -
Data do Fascículo
Jun 2010
Histórico
-
Aceito
26 Jan 2010 -
Recebido
05 Nov 2009