RESUMO
A fibrose cística (FC) é uma doença genética autossômica recessiva caracterizada pela disfunção do gene CFTR. Trata-se de uma doença multissistêmica que ocorre mais frequentemente em populações descendentes de caucasianos. Nas últimas décadas, diversos avanços no diagnóstico e tratamento da FC mudaram drasticamente o cenário dessa doença, com aumento expressivo da sobrevida e qualidade de vida. Atualmente, o Brasil dispõe de um programa de ampla cobertura para a triagem neonatal de FC e centros de referência distribuídos na maior parte desses estados para seguimento dos indivíduos. Antigamente confinada à faixa etária pediátrica, tem-se observado um aumento de pacientes adultos com FC tanto pelo maior número de diagnósticos de formas atípicas, de expressão fenotípica mais leve, assim como pelo aumento da expectativa de vida com os novos tratamentos. Entretanto, ainda se observa uma grande heterogeneidade no acesso aos métodos diagnósticos e terapêuticos para FC entre as diferentes regiões brasileiras. O objetivo dessas diretrizes foi reunir as principais evidências científicas que norteiam o manejo desses pacientes. Um grupo de 18 especialistas em FC elaborou 82 perguntas clínicas relevantes que foram divididas em cinco categorias: características de um centro de referência; diagnóstico; tratamento da doença respiratória; tratamento gastrointestinal e nutricional; e outros aspectos. Diversos profissionais brasileiros atuantes na área da FC foram convidados a responder as perguntas formuladas pelos coordenadores. A literatura disponível foi pesquisada na base de dados PubMed com palavras-chave, buscando-se as melhores respostas às perguntas dos autores.
Descritores:
Fibrose cística/diagnóstico; Fibrose cística/terapia; Fibrose cística/complicações; Guia de prática clínica
ABSTRACT
Cystic fibrosis (CF) is an autosomal recessive genetic disorder characterized by dysfunction of the CFTR gene. It is a multisystem disease that most often affects White individuals. In recent decades, various advances in the diagnosis and treatment of CF have drastically changed the scenario, resulting in a significant increase in survival and quality of life. In Brazil, the current neonatal screening program for CF has broad coverage, and most of the Brazilian states have referral centers for the follow-up of individuals with the disease. Previously, CF was limited to the pediatric age group. However, an increase in the number of adult CF patients has been observed, because of the greater number of individuals being diagnosed with atypical forms (with milder phenotypic expression) and because of the increase in life expectancy provided by the new treatments. However, there is still great heterogeneity among the different regions of Brazil in terms of the access of CF patients to diagnostic and therapeutic methods. The objective of these guidelines was to aggregate the main scientific evidence to guide the management of these patients. A group of 18 CF specialists devised 82 relevant clinical questions, divided into five categories: characteristics of a referral center; diagnosis; treatment of respiratory disease; gastrointestinal and nutritional treatment; and other aspects. Various professionals working in the area of CF in Brazil were invited to answer the questions devised by the coordinators. We used the PubMed database to search the available literature based on keywords, in order to find the best answers to these questions.
Keywords:
Cystic fibrosis/diagnosis; Cystic fibrosis/therapy; Cystic fibrosis/complications; Practice guideline
INTRODUÇÃO
A fibrose cística é uma doença genética autossômica recessiva caracterizada pela disfunção do gene cystic fibrosis transmembrane conductance regulator (CFTR), que codifica uma proteína reguladora de condutância transmembrana de cloro. Trata-se de uma doença multissistêmica mais frequente em populações descendentes de caucasianos. No Brasil, estima-se que a incidência de fibrose cística seja de 1:7.576 nascidos vivos; porém, apresenta diferenças regionais, com valores mais elevados nos estados da região Sul.11 Raskin S, Pereira-Ferrari L, Reis FC, Abreu F, Marostica P, Rozov T, et al. Incidence of cystic fibrosis in five different states of Brazil as determined by screening of p.F508del, mutation at the CFTR gene in newborns and patients. J Cyst Fibros. 2008;7(1):15-22. https://doi.org/10.1016/j.jcf.2007.03.006
https://doi.org/10.1016/j.jcf.2007.03.00...
Nas últimas décadas, diversos avanços no diagnóstico e tratamento da fibrose cística mudaram drasticamente o cenário dessa doença, com aumento expressivo da sobrevida e ganho em qualidade de vida. Atualmente, o Brasil dispõe de um programa de ampla cobertura para a triagem neonatal dessa doença e centros de referência distribuídos na maior parte dos estados para o seguimento desses indivíduos. Antigamente confinada à faixa etária pediátrica, tem-se observado um aumento de pacientes adultos com fibrose cística tanto pelo maior número de diagnósticos de formas atípicas de expressão fenotípica mais leve, assim como pelo aumento da expectativa de vida com os novos tratamentos.22 Ong T, Ramsey BW. Update in Cystic Fibrosis 2014. Am J Respir Crit Care Med. 2015;192(6):669-75. https://doi.org/10.1164/rccm.201504-0656UP
https://doi.org/10.1164/rccm.201504-0656...
3 Stoltz DA, Meyerholz DK, Welsh MJ. Origins of cystic fibrosis lung disease. N Engl J Med. 2015;372(4):351-62. https://doi.org/10.1056/NEJMra1300109
https://doi.org/10.1056/NEJMra1300109...
-44 Boyle MP. Nonclassic cystic fibrosis and CFTR-related diseases. Curr Opin Pulm Med. 2003;9(6):498-503. https://doi.org/10.1097/00063198-200311000-00009
https://doi.org/10.1097/00063198-2003110...
) Entretanto, ainda se observa uma grande heterogeneidade no acesso aos métodos diagnósticos e terapêuticos para pacientes com fibrose cística entre as diferentes regiões brasileiras. O objetivo da presente publicação foi reunir as principais evidências científicas que norteiam o manejo de pacientes com fibrose cística, compiladas pelos principais profissionais de saúde envolvidos na atenção a essa doença no Brasil.
MÉTODOS
Um grupo de 18 especialistas em fibrose cística (coordenadores) elaborou 82 perguntas clínicas relevantes, que foram divididas em cinco categorias: características de um centro de referência; diagnóstico; tratamento da doença respiratória; tratamento gastrointestinal e nutricional; e outros aspectos. Diversos profissionais brasileiros atuantes na área da fibrose cística foram convidados a responder às perguntas formuladas pelos coordenadores das diretrizes. A literatura disponível foi pesquisada na base de dados PubMed através de palavras-chave, buscando-se as melhores respostas às perguntas dos autores. Também se buscou referências manualmente, em livros ou artigos.
Foram utilizadas as orientações do Oxford Centre for Evidence-Based Medicine para classificar o melhor nível de evidência para as perguntas referentes aos capítulos de tratamento. As orientações compreendem uma classificação dos estudos em níveis de evidência, que podem variar de “1” a “5”, sendo que “1” equivale ao maior nível de evidência e “5”, ao menor. A classificação foi simplificada em 2011 para facilitar sua aplicação clínica. O Quadro 1A (apêndice on-line no JBP - http://jornaldepneumologia.com.br/detalhe_anexo.asp?id=51) fornece maiores detalhes sobre a classificação atual de Oxford.
No total, 2.352 publicações foram rastreadas através da estratégia de busca por palavras-chave, pesquisas manuais e sugestões de referências dos autores. Um total de 243 artigos foi selecionado para o presente documento.
A primeira versão do texto foi redigida entre março e agosto de 2016. Os coordenadores de cada área ficaram responsáveis pela validação da classificação das evidências. Nos casos controversos, as perguntas foram levadas para uma reunião presencial de consenso dos coordenadores, no dia 24 de setembro de 2016. A versão final foi revisada pelos coordenadores nacionais (os dois primeiros autores) e encaminhada ao editor do JBP em fevereiro de 2017.
CARACTERÍSTICAS DE UM CENTRO DE REFERÊNCIA
Qual é a importância do centro de referência no cuidado de pacientes com fibrose cística?
A complexidade da fibrose cística e as peculiaridades do seu tratamento resultam na necessidade de centros de tratamento especializados.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
Existem evidências de que o tratamento em centros de referência especializados, que dispõem de uma equipe multidisciplinar, resulta em melhores resultados clínicos, com impacto no prognóstico.66 Mahadeva R, Webb K, Westerbeek RC, Carroll NR, Dodd ME, Bilton D, et al. Clinical outcome in relation to care in centres specialising in cystic fibrosis: cross sectional study. BMJ. 1998;316(7147):1771-5. https://doi.org/10.1136/bmj.316.7147.1771
https://doi.org/10.1136/bmj.316.7147.177...
,77 Johnson C, Butler SM, Konstan MW, Morgan W, Wohl MEB. Factors influencing outcomes in cystic fibrosis: a center-based analysis. Chest. 2003;123(1):20-7. https://doi.org/10.1378/chest.123.1.20
https://doi.org/10.1378/chest.123.1.20...
O que são serviço de referência e centro de referência?
Considera-se centro de referência aquele que atende a pelo menos 50 pacientes regularmente. Deve ter estrutura para atender às necessidades referentes a diagnóstico, seguimento e tratamento.
Serviço de referência é aquele que assiste menos de 50 pacientes, podendo ter estrutura de menor complexidade. Os serviços devem estar vinculados a um centro de referência para educação continuada e eventuais complementações de suas necessidades.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
Qual é a importância de uma equipe multidisciplinar? Como seria sua composição?
A fibrose cística, por suas peculiaridades de acometimento multissistêmico e crônico, exige um modelo de atendimento multidisciplinar.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
O atendimento realizado por uma equipe multidisciplinar possibilita tratamentos mais abrangentes e eficazes, resultando em aumento da expectativa de vida dos pacientes.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
,88 Bell SC, Robinson PJ, Fitzgerald DS. Cystic fibrosis standards of care Australia. Sidney: Cystic Fibrosis Australia; 2008.,99 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2016 Nov 1; cited 2017 Feb 1]. Standards for the Clinical Care of Children and Adults with cystic fibrosis in the UK. Second edition. December 2011. [Adobe Acrobat document, 32p.]. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/clinical-care/consensus-documents
https://www.cysticfibrosis.org.uk/the-wo...
Uma equipe multidisciplinar mínima para o atendimento a pacientes com fibrose cística deve conter os seguintes profissionais: pediatras (quando houver atendimento a crianças e adolescentes), pneumologistas, gastroenterologistas, fisioterapeutas, nutricionistas, enfermeiros, psicólogos, farmacêuticos e assistentes sociais.
Há diferenças entre centros para crianças e para adultos? Há vantagens no planejamento para essa transição?
Serviços pediátricos e de adultos de fibrose cística são bastante diferentes. Adultos têm o comando e as decisões dos seus cuidados. Centros pediátricos necessitam atender a demandas próprias da infância, tanto na estrutura como nos profissionais de saúde. Centros de adultos necessitam recursos para atender casos de maior complexidade (comorbidades e complicações distintas e mais frequentes, além de gravidez).1010 Elborn JS, Bell SC, Madge SL, Burgel PR, Castellani C, Conway S, et al. Report of the European Respiratory Society/European Cystic Fibrosis Society task force on the care of adults with cystic fibrosis. Eur Respir J. 2016;47(2):420-8. https://doi.org/10.1183/13993003.00592-2015
https://doi.org/10.1183/13993003.00592-2...
A passagem do adolescente para um centro de adultos é desafiante, e há evidências de que programas de transição otimizam o processo da transferência para o centro de adultos.1111 Okumura MJ, Kleinhenz ME. Cystic Fibrosis Transitions of Care: Lessons Learned and Future Directions for Cystic Fibrosis. Clin Chest Med. 2016;37(1):119-26. https://doi.org/10.1016/j.ccm.2015.11.007
https://doi.org/10.1016/j.ccm.2015.11.00...
12 Okumura MJ, Ong T, Dawson D, Nielson D, Lewis N, Richards M, et al. Improving transition from paediatric to adult cystic fibrosis care: programme implementation and evaluation. BMJ Qual Saf. 2014;23 Suppl 1:i64-i72. https://doi.org/10.1136/bmjqs-2013-002364
https://doi.org/10.1136/bmjqs-2013-00236...
13 Duguépéroux I, Tamalet A, Sermet-Gaudelus I, Le Bourgeois M, Gérardin M, Desmazes-Dufeu N, et al. Clinical changes of patients with cystic fibrosis during transition from pediatric to adult care. ?J Adolesc Health. 2008;43(5):459-65. https://doi.org/10.1016/j.jadohealth.2008.03.005
https://doi.org/10.1016/j.jadohealth.200...
14 Reid GJ, Irvine MJ, McCrindle BW, Sananes R, Ritvo PG, Siu SC, et al. Prevalence and correlates of successful transfer from pediatric to adult health care among a cohort of young adults with complex congenital heart defects. Pediatrics. 2004;113(3 Pt 1):e197-205. https://doi.org/10.1542/peds.113.3.e197
https://doi.org/10.1542/peds.113.3.e197...
-1515 Chaudhry SR, Keaton M, Nasr SZ. Evaluation of a cystic fibrosis transition program from pediatric to adult care. Pediatr Pulmonol. 2013;48(7):658-65. https://doi.org/10.1002/ppul.22647
https://doi.org/10.1002/ppul.22647...
Como deve ser a infraestrutura dos centros de referência? Quais são os exames complementares básicos?
Os centros de referência devem ter equipes multidisciplinares e recursos para oferecer diagnósticos precisos e cuidado integral ao paciente com fibrose cística. Devem ser capazes de tratar ou dar encaminhamento para tratar todas as complicações da fibrose cística e atuar em articulação a outras unidades mais próximas da residência dos pacientes.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
,1616 Machado CD, Matos MA, editors. Rede de Atenção à Saúde para Pessoas com Fibrose Cística--Padronização dos Cuidados na Fibrose Cística. Condições de oferta dos centros de referência, cuidados compartilhados, cuidados de transição e internação. [monograph on the Internet]. Belo Horizonte: Secretaria de Estado de Saúde de Minas Gerais; 2012 [cited 2017 Feb 1]. Available from: http://www.saude.mg.gov.br/images/documentos/Livro%20REDE%20DE%20ATENCaO%20A%20SAUDE%20PARA%20PESSOAS%20COM%20FIBROSE%20CISTICA.pdf
http://www.saude.mg.gov.br/images/docume...
Os pacientes devem ter acesso ao centro ou a serviços de emergência vinculados ao mesmo 24 h/dia.1616 Machado CD, Matos MA, editors. Rede de Atenção à Saúde para Pessoas com Fibrose Cística--Padronização dos Cuidados na Fibrose Cística. Condições de oferta dos centros de referência, cuidados compartilhados, cuidados de transição e internação. [monograph on the Internet]. Belo Horizonte: Secretaria de Estado de Saúde de Minas Gerais; 2012 [cited 2017 Feb 1]. Available from: http://www.saude.mg.gov.br/images/documentos/Livro%20REDE%20DE%20ATENCaO%20A%20SAUDE%20PARA%20PESSOAS%20COM%20FIBROSE%20CISTICA.pdf
http://www.saude.mg.gov.br/images/docume...
Cada centro de referência deve dispor de ou garantir acesso a:
-
Laboratório para a realização de exames confirmatórios do diagnóstico de fibrose cística: teste de suor e/ou análise de mutações do gene CFTR
-
Laboratório de avaliação funcional pulmonar
-
Laboratório de microbiologia, com experiência e recursos para a identificação de patógenos típicos na fibrose cística
-
Serviço de radiologia com recurso de TC
-
Laboratório de patologia clínica, com capacidade de realização dos exames de rotina, incluindo exames hematológicos, exames de função hepática e renal, sorologias e dosagens de proteínas, vitaminas e imunoglobulinas.
Qual é a importância da segregação microbiológica? Como ela deve ser feita?
Existem diversas evidências de que a transmissão de patógenos pode ocorrer entre indivíduos com fibrose cística, especialmente por meio de gotículas e contato. Pode envolver cepas virulentas, piorando a evolução da doença. Medidas de prevenção e controle de infecção têm sido efetivas para diminuir a transmissão de patógenos. A segregação dos pacientes deve ser realizada dentro e fora do ambiente hospitalar, a fim de prevenir a infecção cruzada. Os centros de fibrose cística devem oferecer estrutura adequada e ter uma política clara de prevenção e controle de infecções, como a separação de dias de atendimento para os pacientes ou uso de diferentes espaços de atendimento de acordo com a colonização desses.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
,1717 Saiman L, Siegel JD, LiPuma JJ, Brown RF, Bryson EA, Chambers MJ, et al. Infection prevention and control guideline for cystic fibrosis: 2013 update. Infect Control Hosp Epidemiol. 2014;35 Suppl 1:S1-S67. https://doi.org/10.1086/676882
https://doi.org/10.1086/676882...
18 Jain M, Saiman LM, Sabadosa K, LiPuma JJ. Point: does the risk of cross infection warrant exclusion of adults with cystic fibrosis from cystic fibrosis foundation events? Yes. Chest. 2014;145(4):678-80. https://doi.org/10.1378/chest.13-2404
https://doi.org/10.1378/chest.13-2404...
-1919 Conway S. Segregation is good for patients with cystic fibrosis. J R Soc Med. 2008;101 Suppl 1:S31-5. https://doi.org/10.1258/jrsm.2008.s18007
https://doi.org/10.1258/jrsm.2008.s18007...
Qual é a importância do compromisso com a assistência, pesquisa e ensino?
O centro de fibrose cística deve estar comprometido com a participação ativa em pesquisa clínica e translacional, propiciando a participação dos pacientes em ensaios clínicos. Educação, pesquisa e contribuição para o registro de fibrose cística devem ser realizadas preferencialmente por todos os centros. Os diversos membros da equipe multidisciplinar devem ter um papel ativo nas atividades de pesquisa e educação. Essa atuação contribui para aumentar e disseminar o conhecimento especializado, que tem papel relevante para a qualificação da assistência.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
Quais são as vantagens da cooperação com associações de pais e pacientes com fibrose cística e com o Grupo Brasileiro de Estudos em Fibrose Cística?
As associações de pais e pacientes com fibrose cística têm por objetivo a defesa dos interesses desse grupo de indivíduos, o que inclui a divulgação da doença e melhorias no diagnóstico e tratamento, visando maior sobrevida, melhor qualidade de vida e inserção dos pacientes na sociedade.55 Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
https://doi.org/10.1016/j.jcf.2014.03.00...
Na América do Norte e na Europa, algumas delas têm ainda um importante papel no fomento e financiamento de pesquisas científicas e no registro de pacientes.
No Brasil, uma aproximação entre as associações de pais e pacientes e os profissionais de saúde atuantes na fibrose cística (hoje representados pelo Grupo Brasileiro em Estudos de Fibrose Cística) traria grandes vantagens para o panorama atual, como o auxílio à inclusão de todos os pacientes brasileiros no registro nacional (Registro Brasileiro de Fibrose Cística) e monitoramento da disponibilidade de medicamentos nos diversos Estados, além da soma de forças na submissão de uma nova portaria (mais abrangente) de atenção ao indivíduo com fibrose cística junto ao Governo Federal.
DIAGNÓSTICO
Como confirmar o diagnóstico de fibrose cística após triagem neonatal positiva?
O algoritmo de triagem neonatal para fibrose cística usado no Brasil baseia-se na quantificação dos níveis de tripsinogênio imunorreativo em duas dosagens, sendo a segunda feita em até 30 dias de vida. Frente a duas dosagens positivas, faz-se o teste do suor para a confirmação ou a exclusão da fibrose cística. A dosagem de cloreto por métodos quantitativos no suor ≥ 60 mmol/l, em duas amostras, confirma o diagnóstico. Alternativas para o diagnóstico são a identificação de duas mutações relacionadas à fibrose cística e os testes de função da proteína CFTR. A Figura 1 apresenta o fluxograma que resume como deve ser a condução dos casos com triagem neonatal positiva.2020 Bhattacharya K, Wotton T, Wiley V. The evolution of blood-spot newborn screening. Transl Pediatr. 2014;3(2):63-70.,2121 Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, Cutting GR, et al. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008;153(2):S4-S14. https://doi.org/10.1016/j.jpeds.2008.05.005
https://doi.org/10.1016/j.jpeds.2008.05....
Condução dos casos com triagem neonatal positiva para fibrose cística. FC: fibrose cística; e TIR: tripsinogênio imunorreativo. Adaptado de Farrel et al.2121 Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, Cutting GR, et al. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008;153(2):S4-S14. https://doi.org/10.1016/j.jpeds.2008.05.005
https://doi.org/10.1016/j.jpeds.2008.05....
A triagem neonatal positiva ou negativa confirma ou exclui o diagnóstico de fibrose cística?
Não. A triagem neonatal para fibrose cística identifica os recém-nascidos com risco de ter a doença, mas não confirma o diagnóstico. O índice de testes falso-positivos pelo algoritmo baseado na quantificação de tripsinogênio imunorreativo é bastante alto. Por outro lado, a triagem neonatal negativa não exclui o diagnóstico.2222 Santos GP, Domingos MT, Wittig EO, Riedi CA, Rosario NA. Neonatal cystic fibrosis screening program in the state of Paraná: evaluation 30 months after implementation [Article in Portuguese]. J Pediatr (Rio J). 2005;81(3):240-4. https://doi.org/10.2223/JPED.1345
https://doi.org/10.2223/JPED.1345...
,2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
Após a confirmação do diagnóstico de fibrose cística em pacientes com triagem neonatal positiva, quando o paciente deve ser encaminhado ao centro de referência de fibrose cística?
Imediatamente após o diagnóstico, pois a fibrose cística exige manejo multidisciplinar precoce, visando manter o estado nutricional normal e tratar as infecções respiratórias em tempo oportuno.2020 Bhattacharya K, Wotton T, Wiley V. The evolution of blood-spot newborn screening. Transl Pediatr. 2014;3(2):63-70.,2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
Quais são as etapas envolvidas no teste do suor? Como assegurar a qualidade do teste do suor?
O Quadro 2A (apêndice on-line no JBP) sintetiza as etapas que devem ser seguidas na realização do teste do suor. A Tabela 1 indica os valores de referência.
Recomenda-se que laboratórios qualificados para a realização do teste do suor tenham controle de qualidade interno e externo e que realizem no mínimo 100 testes/ano (mínimo de 10 testes/ano por técnico). A quantidade de amostras com suor insuficiente não deve ultrapassar 5% do total coletado.2424 Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1.
25 Heap S, Griffiths P, Elborn S, Harris B, Wayte A, Wallis CE, et al. Guidelines for the Performance of the Sweat Test for the Investigation of Cystic Fibrosis in the UK, 2nd version [monograph on the Internet] London: Royal College of Paedriatics and Child Health ; 2014 [cited 2017 Feb 1]. Available from: http://www.rcpch.ac.uk/system/files/protected/page/Sweat%20Guideline%20v3%20reformat_2.pdf
http://www.rcpch.ac.uk/system/files/prot...
-2626 LeGrys VA, Yankaskas JR, Quittell LM, Marshall BC, Mogayzel PJ Jr; Cystic Fibrosis Foundation. Diagnostic sweat testing: the Cystic Fibrosis Foundation guidelines. J Pediatr. 2007;151(1):85-9. https://doi.org/10.1016/j.jpeds.2007.03.002
https://doi.org/10.1016/j.jpeds.2007.03....
Quais são os principais métodos quantitativos aprovados para a dosagem de cloreto no suor?
O Quadro 1 descreve os principais métodos para a dosagem de cloreto, que precisam ser validados no próprio laboratório antes do uso.2424 Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1.,2525 Heap S, Griffiths P, Elborn S, Harris B, Wayte A, Wallis CE, et al. Guidelines for the Performance of the Sweat Test for the Investigation of Cystic Fibrosis in the UK, 2nd version [monograph on the Internet] London: Royal College of Paedriatics and Child Health ; 2014 [cited 2017 Feb 1]. Available from: http://www.rcpch.ac.uk/system/files/protected/page/Sweat%20Guideline%20v3%20reformat_2.pdf
http://www.rcpch.ac.uk/system/files/prot...
Qual o papel do teste da condutividade do suor?
Apesar de o teste da condutividade do suor ter alta concordância com a concentração do cloreto no suor, ele ainda é considerado como um teste de triagem.2626 LeGrys VA, Yankaskas JR, Quittell LM, Marshall BC, Mogayzel PJ Jr; Cystic Fibrosis Foundation. Diagnostic sweat testing: the Cystic Fibrosis Foundation guidelines. J Pediatr. 2007;151(1):85-9. https://doi.org/10.1016/j.jpeds.2007.03.002
https://doi.org/10.1016/j.jpeds.2007.03....
Recomenda-se que pacientes com resultado de condutividade igual ou acima de 50 mmol/l realizem um teste quantitativo. Esse teste tem como vantagens sua fácil execução e resultado imediato.2424 Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1.,2727 Lezana JL, Vargas MH, Karam-Bechara J, Aldana RS, Furuya ME. Sweat conductivity and chloride titration for cystic fibrosis diagnosis in 3834 subjects. J Cyst Fibros. 2003;2(1):1-7. https://doi.org/10.1016/S1569-1993(02)00146-7
https://doi.org/10.1016/S1569-1993(02)00...
,2828 Mattar AC, Leone C, Rodrigues JC, Adde FV. Sweat conductivity: an accurate diagnostic test for cystic fibrosis? J Cyst Fibros. 2014;13(5):528-33. https://doi.org/10.1016/j.jcf.2014.01.002
https://doi.org/10.1016/j.jcf.2014.01.00...
Quais são os critérios mínimos para um laboratório realizar o estudo de mutações do gene CFTR?
-
Certificação pela Agência Nacional de Vigilância Sanitária
-
Capacidade para realizar a extração do DNA por diferentes métodos e de diferentes amostras
-
Aptidão para identificar a mutação F508del e outras com maior prevalência
-
Disponibilidade de realizar a análise de painéis de mutações e/ou sequenciamento completo do gene CFTR, seja em sua unidade, seja com encaminhamento para outros laboratórios
-
Capacidade de interpretar e reportar variantes patogênicas
Todos os pacientes com fibrose cística devem ser submetidos ao exame genético? Qual a importância de realizá-lo?
Sim, a identificação das mutações no gene CFTR tem implicações prognósticas e de planejamento familiar, permitindo o diagnóstico da fibrose cística (Quadro 2). Além disso, existem drogas que atuam em mutações específicas (corretores e potencializadores da proteína CFTR), sendo algumas aprovadas em diversos países e outras em desenvolvimento.2121 Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, Cutting GR, et al. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008;153(2):S4-S14. https://doi.org/10.1016/j.jpeds.2008.05.005
https://doi.org/10.1016/j.jpeds.2008.05....
,2929 Brodlie M, Haq IJ, Roberts K, Elborn JS. Targeted therapies to improve CFTR function in cystic fibrosis. Genome Med. 2015;7:101. https://doi.org/10.1186/s13073-015-0223-6
https://doi.org/10.1186/s13073-015-0223-...
30 Pettit RS, Fellner C. CFTR Modulators for the Treatment of Cystic Fibrosis. P T. 2014;39(7):500-11.
31 Dequeker E, Stuhrmann M, Morris MA, Casals T, Castellani C, Claustres M, et al. Best practice guidelines for molecular genetic diagnosis of cystic fibrosis and CFTR-related disorders--updated European recommendations. Eur J Hum Genet. 2009;17(1):51-65. https://doi.org/10.1038/ejhg.2008.136
https://doi.org/10.1038/ejhg.2008.136...
-3232 Castellani C, Cuppens H, Macek M Jr, Cassiman JJ, Kerem E, Durie P, et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibros. 2008;7(3):179-96. https://doi.org/10.1016/j.jcf.2008.03.009
https://doi.org/10.1016/j.jcf.2008.03.00...
Qual painel de mutações deve ser investigado?
A investigação das mutações no gene CFTR está descrita no Quadro 3.3131 Dequeker E, Stuhrmann M, Morris MA, Casals T, Castellani C, Claustres M, et al. Best practice guidelines for molecular genetic diagnosis of cystic fibrosis and CFTR-related disorders--updated European recommendations. Eur J Hum Genet. 2009;17(1):51-65. https://doi.org/10.1038/ejhg.2008.136
https://doi.org/10.1038/ejhg.2008.136...
32 Castellani C, Cuppens H, Macek M Jr, Cassiman JJ, Kerem E, Durie P, et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibros. 2008;7(3):179-96. https://doi.org/10.1016/j.jcf.2008.03.009
https://doi.org/10.1016/j.jcf.2008.03.00...
33 De Boeck K, Wilschanski M, Castellani C, Taylor C, Cuppens H, Dodge J, et al. Cystic fibrosis: terminology and diagnostic algorithms. Thorax. 2006;61(7):627-35. https://doi.org/10.1136/thx.2005.043539
https://doi.org/10.1136/thx.2005.043539...
34 Ferec C, Cutting GR. Assessing the Disease-Liability of Mutations in CFTR. Cold Spring Harb Perspect Med. 2012;2(12):a009480. https://doi.org/10.1101/cshperspect.a009480
https://doi.org/10.1101/cshperspect.a009...
-3535 Moskowitz SM, Chmiel JF, Sternen DL, Cheng E, Gibson RL, Marshall SG, et al. Clinical practice and genetic counseling for cystic fibrosis and CFTR-related disorders. Genet Med. 2008;10(12):851-68. https://doi.org/10.1097/GIM.0b013e31818e55a2
https://doi.org/10.1097/GIM.0b013e31818e...
Quando indicar outros testes para a avaliação da função da CFTR?
Testes da função da CFTR são indicados quando o teste do suor e a análise genética são inconclusivos. Em essência, esses testes avaliam a função da proteína CFTR através da medida do transporte do cloreto. Atualmente, os testes da diferença de potencial nasal e da medida da corrente intestinal são internacionalmente padronizados. Outros testes promissores, como a avaliação da CFTR por evaporimetria e pela diferença de potencial das glândulas sudoríparas, estão sendo estudados.3636 Beekman JM, Sermet-Gaudelus I, de Boeck K, Gonska T, Derichs N, Mall MA, et al. CFTR functional measurements in human models for diagnosis, prognosis and personalized therapy: Report on the pre-conference meeting to the 11th ECFS Basic Science Conference, Malta, 26-29 March 2014. J Cyst Fibros. 2014;13(4):363-72. https://doi.org/10.1016/j.jcf.2014.05.007
https://doi.org/10.1016/j.jcf.2014.05.00...
,3737 De Boeck K, Kent L, Davies J, Derichs N, Amaral M, Rowe SM, et al. CFTR biomarkers: time for promotion to surrogate end-point. Eur Respir J. 2013;41(1):203-16. https://doi.org/10.1183/09031936.00057512
https://doi.org/10.1183/09031936.0005751...
TRATAMENTO DA DOENÇA RESPIRATÓRIA
Quais amostras de secreções respiratórias são mais adequadas, como obtê-las, e qual é sua importância?
As amostras de secreções respiratórias são essenciais para o acompanhamento da infecção bacteriana crônica das vias aéreas nos pacientes com fibrose cística, assim como para a identificação de infecções oportunistas e como método de acompanhamento de intervenções terapêuticas. O escarro expectorado é o espécime de escolha. Para crianças não expectorantes, colher secreção faríngea após tosse induzida com swab (região tonsilar ou palato mole), aspirado de nasofaringe, secreção após inalação de solução salina hipertônica 5% ou lavado broncoalveolar. Essas amostras devem ser entregues ao laboratório imediatamente ou mantidas sob refrigeração por até 3 h.3838 Cuthbertson L, Rogers GB, Walker AW, Oliver A, Hafiz T, Hoffman LR, et al. Time between collection and storage significantly influences bacterial sequence composition in sputum samples from cystic fibrosis respiratory infections. J Clin Microbiol. 2014;52(8):3011-6. https://doi.org/10.1128/JCM.00764-14
https://doi.org/10.1128/JCM.00764-14...
,3939 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [cited 2017 Feb 1]. Laboratory Standards for Processing Microbiological Samples from People with Cystic Fibrosis. 1st edition. September 2010 [Adobe Acrobat document, 40p.]. Available from: https://www.cysticfibrosis.org.uk/~/media/documents/the-work-we-do/care/consensus-docs-with-new-address/laboratory-standards.ashx?la=en
https://www.cysticfibrosis.org.uk/~/medi...
(Nível de evidência: 4)
Quando colher as amostras?
Nas consultas (com intervalo máximo de 3 meses), nas exacerbações e após o tratamento para a erradicação da infecção. Recomenda-se uma triagem anual para micobactérias e fungos para pacientes que expectoram ou para aqueles com evolução clínica desfavorável.4040 Lahiri T, Hempstead SE, Brady C, Cannon CL, Clark K, Condren ME, et al. Clinical Practice Guidelines From the Cystic Fibrosis Foundation for Preschoolers With Cystic Fibrosis. Pediatrics. 2016; 137(4). pii: e20151784. https://doi.org/10.1542/peds.2015-1784
https://doi.org/10.1542/peds.2015-1784...
(Nível de evidência: 5)
Quais são os métodos e meios de cultivo de rotina?
A cultura quantitativa deve ser realizada obrigatoriamente no lavado broncoalveolar. Os meios de cultura recomendados na rotina microbiológica da fibrose cística são os seguintes:
-
Ágar sangue: universal para as rotinas microbiológicas
-
Ágar manitol: seletivo para Staphylococcus aureus
-
Ágar MacConkey: para bacilos gram-negativos (incluindo Pseudomonas aeruginosa, Achromobacter spp. e Stenotrophomonas spp.)
-
Ágar seletivo para complexo Burkholderia cepacia
-
Ágar chocolate para Streptococcus pneumoniae e Haemophilus influenzae
-
Ágar Sabouraud suplementado com cloranfenicol ou gentamicina para fungos, incluindo Aspergillus spp.
-
Meios de cultura líquidos, conforme automação disponível, e um meio sólido, como ágar Lowenstein-Jensen. Para micobactérias não-tuberculose, também se podem utilizar ágar sangue e Burkholderia cepacia selective agar, desde que esses meios sejam incubados por 14 dias.3939 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [cited 2017 Feb 1]. Laboratory Standards for Processing Microbiological Samples from People with Cystic Fibrosis. 1st edition. September 2010 [Adobe Acrobat document, 40p.]. Available from: https://www.cysticfibrosis.org.uk/~/media/documents/the-work-we-do/care/consensus-docs-with-new-address/laboratory-standards.ashx?la=en
https://www.cysticfibrosis.org.uk/~/medi... ,4141 Kiska DL, Riddell SW. Practical Laboratory Aspects of Cystic Fibrosis Microbiology: an Update, Part II. Clin Microbiol Newsl. 2012;34(5):35-41. https://doi.org/10.1016/j.clinmicnews.2012.02.001
https://doi.org/10.1016/j.clinmicnews.20...
42 Gilligan PH. Infections in patients with cystic fibrosis: diagnostic microbiology update. Clin Lab Med. 2014;34(2):197-217. https://doi.org/10.1016/j.cll.2014.02.001
https://doi.org/10.1016/j.cll.2014.02.00...
43 Gilligan PH, Kiska Dl, Appleman MD. Cystic fibrosis microbiology. Cumitech 43. Washington, DC: ASM Press; 2006.
44 Burns JL, Rolain JM. Culture-based diagnostic microbiology in cystic fibrosis: can we simplify the complexity? J Cyst Fibros. 2014;13(1):1-9. https://doi.org/10.1016/j.jcf.2013.09.004
https://doi.org/10.1016/j.jcf.2013.09.00... -4545 Caballero Jde D, del Campo R, Tato M, Gómez G de la Pedrosa E, Cobo M, López-Causapé C, et al. Microbiological diagnostic procedures for respiratory cystic fibrosis samples in Spain: towards standard of care practices. BMC Microbiol. 2014;14:335. https://doi.org/10.1186/s12866-014-0335-y
https://doi.org/10.1186/s12866-014-0335-...
(Nível de evidência: 5)
Quais são os métodos de identificação bacteriana?
-
Métodos fenotípicos: colônias típicas de S. aureus, P. aeruginosa e Stenotrophomonas maltophilia são facilmente reconhecidas e poucos testes são necessários
-
Kits comerciais fenotípicos não automatizados: quando associados às características típicas, podem ser usados para S. aureus e alguns bacilos gram-negativos não fermentadores de glicose, como P. aeruginosa, S. maltophilia e Achromobacter spp., mas não são adequados para complexo B. cepacia, Burkholderia gladioli, Pandoraea spp. e Ralstonia spp.
-
Métodos automatizados: não recomendados para a maioria dos bacilos gram-negativos não fermentadores de glicose
-
Testes moleculares são recomendados para a caracterização de Achromobacter spp., complexo B. cepacia e os gêneros Ralstonia, Cupriavidus e Pandoraea
-
Identificação por espectrometria de massa (matrix-assisted laser desorption/ionization, time-of-flight mass spectrometry, MALDI-TOF MS) representa uma alternativa rápida, mas apresenta limitações, especialmente para bacilos gram-negativos não fermentadores de glicose4242 Gilligan PH. Infections in patients with cystic fibrosis: diagnostic microbiology update. Clin Lab Med. 2014;34(2):197-217. https://doi.org/10.1016/j.cll.2014.02.001
https://doi.org/10.1016/j.cll.2014.02.00... ,4343 Gilligan PH, Kiska Dl, Appleman MD. Cystic fibrosis microbiology. Cumitech 43. Washington, DC: ASM Press; 2006.,4646 Marko DC, Saffert RT, Cunningham SA, Hyman J, Walsh J, Arbefeville S, et al. Evaluation of the Bruker Biotyper and Vitek MS matrix-assisted laser desorption ionization-time of flight mass spectrometry systems for identification of nonfermenting gram-negative bacilli isolated from cultures from cystic fibrosis patients. J Clin Microbiol. 2012;50(6):2034-9. https://doi.org/10.1128/JCM.00330-12
https://doi.org/10.1128/JCM.00330-12...
(Nível de evidência: 5 para todos os métodos, exceto MALDI-TOF MS para bacilos gram-negativos não fermentadores de glicose-nível de evidência: 2)
Qual é o papel dos testes de função pulmonar no manejo dos pacientes com fibrose cística?
A espirometria deve ser realizada a partir dos 5 anos de idade em toda visita clínica ou no mínimo duas vezes ao ano. Testes com e sem uso de broncodilatadores são recomendados. As técnicas de washout, com determinação do lung clearance index, têm uso crescente e promissor na identificação de doença pulmonar precoce.
Estudos têm mostrado que o VEF1 é fundamental para avaliar a evolução e o prognóstico na fibrose cística, assim como para a detecção precoce de exacerbações pulmonares agudas, correlacionando-se com a qualidade de vida. O FEF25-75% também deve ser valorizado, já que pode estar alterado mais precocemente. A pletismografia corporal total e a oscilometria podem complementar a avaliação funcional.99 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2016 Nov 1; cited 2017 Feb 1]. Standards for the Clinical Care of Children and Adults with cystic fibrosis in the UK. Second edition. December 2011. [Adobe Acrobat document, 32p.]. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/clinical-care/consensus-documents
https://www.cysticfibrosis.org.uk/the-wo...
,4747 Habib AR, Manji J, Wilcox PG, Javer AR, Buxton JA, Quon BS. A systematic review of factors associated with health-related quality of life in adolescents and adults with cystic fibrosis. Ann Am Thorac Soc. 2015;12(3):420-8. https://doi.org/10.1513/AnnalsATS.201408-393OC
https://doi.org/10.1513/AnnalsATS.201408...
48 Rosenfeld M, Allen J, Arets BH, Aurora P, Beydon N, Calogero C, et al. An official American Thoracic Society workshop report: optimal lung function tests for monitoring cystic fibrosis, bronchopulmonary dysplasia, and recurrent wheezing in children less than 6 years of age. Ann Am Thorac Soc. 2013;10(2):S1-S11. https://doi.org/10.1513/AnnalsATS.201301-017ST
https://doi.org/10.1513/AnnalsATS.201301...
49 Subbarao P, Milla C, Aurora P, Davies JC, Davis SD, Hall GL, et al. Multiple-Breath Washout as a Lung Function Test in Cystic Fibrosis. A Cystic Fibrosis Foundation Workshop Report. Ann Am Thorac Soc. 2015;12(6):932-9. https://doi.org/10.1513/AnnalsATS.201501-021FR
https://doi.org/10.1513/AnnalsATS.201501...
-5050 Tridello G, Volpi S, Assael BM, Meneghelli I, Passiu M, Circelli M. Lung function comparison between two decades in cystic fibrosis children: A single centre study. Pediatr Pulmonol. 2015;50(12):1237-43. https://doi.org/10.1002/ppul.23314
https://doi.org/10.1002/ppul.23314...
(Nível de evidência: 5)
Quais exames de imagem devem ser feitos no paciente com fibrose cística? Com que frequência?
A radiografia de tórax é o método mais difundido para pacientes com fibrose cística e correlaciona-se com os testes de função pulmonar na detecção da progressão da doença.5151 Cleveland RH, Zurakowski D, Slattery DM, Colin AA. Chest radiographs for outcome assessment in cystic fibrosis. Proc Am Thorac Soc. 2007;4(4):302-5. https://doi.org/10.1513/pats.200611-179HT
https://doi.org/10.1513/pats.200611-179H...
,5252 de Jong PA, Lindblad A, Rubin L, Hop WC, de Jongste JC, Brink M, et al. Progression of lung disease on computed tomography and pulmonary function tests in children and adults with cystic fibrosis. Thorax. 2006;61(1):80-5. https://doi.org/10.1136/thx.2005.045146
https://doi.org/10.1136/thx.2005.045146...
A TCAR de tórax apresenta melhor acurácia no diagnóstico e no seguimento de lesões pulmonares em todas as idades, incluindo crianças com função pulmonar normal.5353 Ernst CW, Basten IA, Ilsen B, Buls N, Van Gompel G, De Wachter E, et al. Pulmonary disease in cystic fibrosis: assessment with chest CT at chest radiography dose levels. Radiology. 2014;273(2):597-605. https://doi.org/10.1148/radiol.14132201
https://doi.org/10.1148/radiol.14132201...
54 Sanders DB, Li Z, Brody AS, Farrell PM. Chest computed tomography scores of severity are associated with future lung disease progression in children with cystic fibrosis. Am J Respir Crit Care Med. 2011;184(7):816-21. https://doi.org/10.1164/rccm.201105-0816OC
https://doi.org/10.1164/rccm.201105-0816...
-5555 Kang EY, Miller RR, Müller NL. Bronchiectasis: comparison of preoperative thin-section CT and pathologic findings in resected specimens. Radiology. 1995;195(3):649-54. https://doi.org/10.1148/radiology.195.3.7753989
https://doi.org/10.1148/radiology.195.3....
Tal benefício é questionável em lactentes, e há obstáculos técnicos inerentes à faixa etária.5656 Thia LP, Calder A, Stocks J, Bush A, Owens CM, Wallis C, et al. Is chest CT useful in newborn screened infants with cystic fibrosis at 1 year of age? Thorax. 2014;69(4):320-7. https://doi.org/10.1136/thoraxjnl-2013-204176
https://doi.org/10.1136/thoraxjnl-2013-2...
A ressonância magnética de tórax avançou nos últimos anos e pode se tornar uma opção futura por ser um método isento de radiação.5757 Sileo C, Corvol H, Boelle PY, Blondiaux E, Clement A, Ducou Le Pointe H. HRCT and MRI of the lung in children with cystic fibrosis: comparison of different scoring systems. J Cyst Fibros. 2014;13(2):198-204. https://doi.org/10.1016/j.jcf.2013.09.003
https://doi.org/10.1016/j.jcf.2013.09.00...
Apesar de não existir consenso sobre a frequência da realização dos exames de imagem, recomenda-se uma radiografia de tórax anual. Sugere-se ainda realizar TCAR de tórax na presença de deterioração clínica, funcional ou radiológica. O seguimento periódico com TCAR de tórax pode ser indicado, com intervalos de 2 a 4 anos, de forma individualizada. Nos quadros de exacerbação pulmonar na fibrose cística, a radiografia e a TCAR de tórax podem ser utilizadas, sempre tendo em mente o uso da menor dose de radiação possível.5858 Sanders DB, Li Z, Brody AS. Chest computed tomography predicts the frequency of pulmonary exacerbations in children with cystic fibrosis. Ann Am Thorac Soc. 2015;12(1):64-9. https://doi.org/10.1513/AnnalsATS.201407-338OC
https://doi.org/10.1513/AnnalsATS.201407...
,5959 Robinson TE, Leung AN, Chen X, Moss RB, Emond MJ. Cystic fibrosis HRCT scores correlate strongly with Pseudomonas infection. Pediatr Pulmonol. 2009;44(11):1107-17. https://doi.org/10.1002/ppul.21107
https://doi.org/10.1002/ppul.21107...
(Nível de evidência: 2 para TCAR de tórax em todas as idades, exceto lactentes) (Nível de evidência: 5 para radiografia de tórax e ressonância magnética)
Qual é a importância dos nebulizadores no tratamento da doença pulmonar na fibrose cística?
O tratamento diário da doença pulmonar na fibrose cística inclui nebulizações de diversos medicamentos fundamentais na manutenção da saúde pulmonar, sendo essencial um sistema de inalação para todo paciente com fibrose cística.6060 Agent P, Parrott H. Inhaled therapy in cystic fibrosis: agents, devices and regimens. Breathe (Sheff). 2015;11(2):110-8. https://doi.org/10.1183/20734735.021014
https://doi.org/10.1183/20734735.021014...
61 Collins N. Nebulizer therapy in cystic fibrosis: an overview. J R Soc Med. 2009;102 Suppl 1:11-7. https://doi.org/10.1258/jrsm.2009.s19003
https://doi.org/10.1258/jrsm.2009.s19003...
-6262 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Nebuliser therapy in cystic fibrosis. Factsheet. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
https://www.cysticfibrosis.org.uk/the-wo...
(Nível de evidência: 5)
Qual sistema de inalação deve ser usado para cada tipo de tratamento inalatório na fibrose cística?
A combinação da substância a ser inalada com o sistema de inalação é fundamental para garantir a eficácia do tratamento. Devido à grande variabilidade de dispositivos, é recomendada a utilização dos inaladores testados nos estudos clínicos das medicações.6363 Geller DE. The science of aerosol delivery in cystic fibrosis. Pediatr Pulmonol. 2008;43(S9):S5-S17. https://doi.org/10.1002/ppul.20860
https://doi.org/10.1002/ppul.20860...
,6464 Daniels T, Mills N, Whitaker P. Nebuliser systems for drug delivery in cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD007639.
Os seguintes tipos são frequentemente utilizados para cada tratamento6464 Daniels T, Mills N, Whitaker P. Nebuliser systems for drug delivery in cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD007639.,6565 Laube BL, Janssens HM, de Jongh FH, Devadason SG, Dhand R, Diot P, et al. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J. 2011;37(6):1308-31. https://doi.org/10.1183/09031936.00166410
https://doi.org/10.1183/09031936.0016641...
:
-
Ultrassônicos: salina hipertônica
-
A jato de ar: tobramicina, colistimetato, dornase alfa e salina hipertônica
-
Membrana vibratória ativa: tobramicina, colistimetato, dornase alfa e aztreonam
-
Membrana vibratória passiva com adaptação do padrão respiratório: tobramicina e colistimetato
(Nível de evidência: 2)
Quais são os cuidados com os dispositivos inalatórios e de fisioterapia?
Os dispositivos para o tratamento da doença pulmonar na fibrose cística incluem os nebulizadores e os equipamentos utilizados na fisioterapia respiratória para a remoção das secreções. A contaminação bacteriana dos nebulizadores dos pacientes com fibrose cística já foi descrita, e programas de educação para a limpeza e desinfecção desses dispositivos têm impacto nesse cenário. Recomenda-se a limpeza após cada uso e a desinfecção diária por fervura, uso de álcool 70-90%, álcool isopropílico ou peróxido de hidrogênio 3%.1717 Saiman L, Siegel JD, LiPuma JJ, Brown RF, Bryson EA, Chambers MJ, et al. Infection prevention and control guideline for cystic fibrosis: 2013 update. Infect Control Hosp Epidemiol. 2014;35 Suppl 1:S1-S67. https://doi.org/10.1086/676882
https://doi.org/10.1086/676882...
,6666 Della Zuana A, Garcia Dde O, Juliani RC, Silva Filho LV. Effect that an educational program for cystic fibrosis patients and caregivers has on the contamination of home nebulizers. J Bras Pneumol. 2014;40(2):119-27. https://doi.org/10.1590/S1806-37132014000200004
https://doi.org/10.1590/S1806-3713201400...
67 Towle D, Callan DA, Farrel PA, Egan ME, Murray TS. Baby bottle steam sterilizers disinfect home nebulizers inoculated with bacterial respiratory pathogens. J Cyst Fibros. 2013;12(5):512-6. https://doi.org/10.1016/j.jcf.2012.11.013
https://doi.org/10.1016/j.jcf.2012.11.01...
68 Reychler G, Leonard A, Van Ossel C, Godding V, Gigi J, Simon A, et al. Impact of hypochlorite-based disinfection on bacterial contamination of cystic fibrosis patients' home-nebulisers. J Hosp Infect. 2009;72(4):351-7. https://doi.org/10.1016/j.jhin.2009.05.011
https://doi.org/10.1016/j.jhin.2009.05.0...
-6969 Merritt K, Hitchins VM, Brown SA. Safety and cleaning of medical materials and devices. ?J Biomed Mater Res. 2000;53(2):131-6. https://doi.org/10.1002/(SICI)1097-4636(2000)53:2<131::AID-JBM1>3.0.CO;2-I
https://doi.org/10.1002/(SICI)1097-4636(...
(Nível de evidência: 3)
Quais são as técnicas de fisioterapia respiratória indicadas no tratamento da doença pulmonar?
Técnicas de fisioterapia respiratória devem ser realizadas em todos os pacientes com fibrose cística a partir do diagnóstico, com frequência diária.7070 Warnock L, Gates A. Chest physiotherapy compared to no chest physiotherapy for cystic fibrosis. Cochrane Database Syst Rev. 2015;(12):CD001401. https://doi.org/10.1002/14651858.cd001401.pub3
https://doi.org/10.1002/14651858.cd00140...
) A fisioterapia respiratória apresenta benefícios clínicos comprovados quando comparada à ausência dessa intervenção; porém, sem evidência de superioridade de uma técnica sobre a outra. A preferência do paciente é um fator imprescindível para a adesão ao tratamento, mas o uso de dispositivos, como máscara de pressão expiratória positiva e máscara de pressão oscilatória positiva do tipo flutter ®, shaker ® e acapella ®, é de grande utilidade e confere independência ao paciente.7171 McIlwaine M, Button B, Dwan K. Positive expiratory pressure physiotherapy for airway clearance in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD003147. https://doi.org/10.1002/14651858.cd003147.pub4
https://doi.org/10.1002/14651858.cd00314...
O uso do dispositivo de oscilação de alta frequência de parede torácica, apesar de também conferir independência ao paciente, foi inferior ao uso da máscara de pressão expiratória positiva em um estudo recente.7272 McIlwaine MP, Alarie N, Davidson GF, Lands LC, Ratjen F, Milner R, et al. Long-term multicentre randomised controlled study of high frequency chest wall oscillation versus positive expiratory pressure mask in cystic fibrosis. Thorax. 2013;68(8):746-51. https://doi.org/10.1136/thoraxjnl-2012-202915
https://doi.org/10.1136/thoraxjnl-2012-2...
A ventilação não invasiva pode ser utilizada como coadjuvante da terapia de desobstrução brônquica e em pacientes com doença avançada e insuficiência respiratória hipercápnica.7373 Moran F, Bradley JM, Piper AJ. Non-invasive ventilation for cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD002769. https://doi.org/10.1002/14651858.cd002769.pub4
https://doi.org/10.1002/14651858.cd00276...
74 Young AC, Wilson JW, Kotsimbos TC, Naughton MT. Randomised placebo controlled trial of non-invasive ventilation for hypercapnia in cystic fibrosis. Thorax. 2008;63(1):72-7. https://doi.org/10.1136/thx.2007.082602
https://doi.org/10.1136/thx.2007.082602...
75 Holland AE, Denehy L, Ntoumenopoulos G, Naughton MT, Wilson JW. Non-invasive ventilation assists chest physiotherapy in adults with acute exacerbations of cystic fibrosis. Thorax. 2003;58(10):880-4. https://doi.org/10.1136/thorax.58.10.880
https://doi.org/10.1136/thorax.58.10.880...
-7676 Lester MK, Flume PA. Airway-clearance therapy guidelines and implementation. Respir Care. 2009;54(6):733-50; discussion 751-3. https://doi.org/10.4187/002013209790983205
https://doi.org/10.4187/0020132097909832...
(Nível de evidência: 2 para fisioterapia respiratória)
(Nível de evidência: 2 para a superioridade da máscara de pressão expiratória positiva vs. dispositivo de oscilação de parede torácica de alta frequência)
(Nível de evidência: 2 para ventilação não invasiva vs. sem ventilação não invasiva como adjuvante na doença avançada com hipercapnia)
Qual é o papel do exercício na fibrose cística?
O exercício (aeróbico e anaeróbico) pode auxiliar em desfechos funcionais e posturais, assim como na autoestima para esses pacientes. Recomenda-se frequência de 3-5 vezes por semana e duração de 20-30 min, com benefícios observados a partir de 6 semanas. Sua prática deve fazer parte das recomendações para os pacientes com fibrose cística, inclusive durante as internações. A atividade física não substitui a fisioterapia respiratória.7777 Radtke T, Nolan SJ, Hebestreit H, Kriemler S. Physical exercise training for cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD002768. https://doi.org/10.1002/14651858.cd002768.pub3
https://doi.org/10.1002/14651858.cd00276...
78 Orenstein DM, Hovell MF, Mulvihill M, Keating KK, Hofstetter CR, Kelsey S, et al. Strength vs aerobic training in children with cystic fibrosis: a randomized controlled trial. Chest. 2004;126(4):1204-14. https://doi.org/10.1378/chest.126.4.1204
https://doi.org/10.1378/chest.126.4.1204...
79 Selvadurai HC, Blimkie CJ, Meyers N, Mellis CM, Cooper PJ, Van Asperen PP. Randomized controlled study of in-hospital exercise training programs in children with cystic fibrosis. Pediatr Pulmonol. 2002;33(3):194-200. https://doi.org/10.1002/ppul.10015
https://doi.org/10.1002/ppul.10015...
80 Dwyer TJ, Elkins MR, Bye PT. The role of exercise in maintaining health in cystic fibrosis. Curr Opin Pulm Med. 2011;17(6):455-60. https://doi.org/10.1097/mcp.0b013e32834b6af4
https://doi.org/10.1097/mcp.0b013e32834b...
81 Schindel CS, Hommerding PX, Melo DA, Baptista RR, Marostica PJ, Donadio MV. Physical exercise recommendations improve postural changes found in children and adolescents with cystic fibrosis: a randomized controlled trial. J Pediatr. 2015;166(3):710-6.e2. https://doi.org/10.1016/j.jpeds.2014.12.001
https://doi.org/10.1016/j.jpeds.2014.12....
-8282 Rovedder PM, Flores J, Ziegler B, Casarotto F, Jaques P, Barreto SS, et al. Exercise programme in patients with cystic fibrosis: a randomized controlled trial. Respir Med. 2014;108(8):1134-40. https://doi.org/10.1016/j.rmed.2014.04.022
https://doi.org/10.1016/j.rmed.2014.04.0...
(Nível de evidência: 2)
Quais são as indicações do uso de dornase alfa e qual é a sua posologia?
A dornase alfa inalatória tem eficácia comprovada na fibrose cística através de melhora da função pulmonar e da qualidade de vida, assim como da redução de exacerbações respiratórias.8383 Flume PA, O'Sullivan BP, Robinson KA, Goss CH, Mogayzel PJ Jr, Willey-Courand DB, et al. Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2007;176(10):957-69. https://doi.org/10.1164/rccm.200705-664OC
https://doi.org/10.1164/rccm.200705-664O...
84 Fuchs HJ, Borowitz DS, Christiansen DH, Morris EM, Nash ML, Ramsey BW, et al. Effect of aerosolized recombinant human DNase on exacerbations of respiratory symptoms and on pulmonary function in patients with cystic fibrosis. The Pulmozyme Study Group. N Engl J Med. 1994;331(10):637-42. https://doi.org/10.1056/NEJM199409083311003
https://doi.org/10.1056/NEJM199409083311...
85 Jones AP, Wallis C. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev. 2010;(3):CD001127. https://doi.org/10.1002/14651858.cd001127.pub2
https://doi.org/10.1002/14651858.cd00112...
86 Konstan MW, Wagener JS, Pasta DJ, Millar SJ, Jacobs JR, Yegin A, et al. Clinical use of dornase alpha is associated with a slower rate of FEV1 decline in cystic fibrosis. Pediatr Pulmonol. 2011;46(6):545-53. https://doi.org/10.1002/ppul.21388
https://doi.org/10.1002/ppul.21388...
87 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
88 Quan JM, Tiddens HA, Sy JP, McKenzie SG, Montgomery MD, Robinson PJ, et al. A two-year randomized, placebo-controlled trial of dornase alfa in young patients with cystic fibrosis with mild lung function abnormalities. J Pediatr. 2001;139(6):813-20. https://doi.org/10.1067/mpd.2001.118570
https://doi.org/10.1067/mpd.2001.118570...
-8989 Rozov T, de Oliveira VZ, Santana MA, Adde FV, Mendes RH, Paschoal IA, et al. Dornase alfa improves the health-related quality of life among Brazilian patients with cystic fibrosis--a one-year prospective study. Pediatr Pulmonol. 2010;45(9):874-82. https://doi.org/10.1002/ppul.21267
https://doi.org/10.1002/ppul.21267...
É recomendada a partir de 6 anos de idade em pacientes com doença pulmonar desde seus estágios iniciais.8383 Flume PA, O'Sullivan BP, Robinson KA, Goss CH, Mogayzel PJ Jr, Willey-Courand DB, et al. Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2007;176(10):957-69. https://doi.org/10.1164/rccm.200705-664OC
https://doi.org/10.1164/rccm.200705-664O...
,8787 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
,9090 McCoy K, Hamilton S, Johnson C. Effects of 12-week administration of dornase alfa in patients with advanced cystic fibrosis lung disease. Pulmozyme Study Group. Chest. 1996;110(4):889-95. https://doi.org/10.1378/chest.110.4.889
https://doi.org/10.1378/chest.110.4.889...
A dose recomendada é de 2,5 mg, uma vez ao dia, com nebulizador apropriado. A administração em dias alternados pode ser considerada nos pacientes estáveis9191 Suri R, Grieve R, Normand C, Metcalfe C, Thompson S, Wallis C, et al. Effects of hypertonic saline, alternate day and daily rhDNase on healthcare use, costs and outcomes in children with cystic fibrosis. Thorax. 2002;57(10):841-6. https://doi.org/10.1136/thorax.57.10.841
https://doi.org/10.1136/thorax.57.10.841...
,9292 Suri R, Metcalfe C, Lees B, Grieve R, Flather M, Normand C, et al. Comparison of hypertonic saline and alternate-day or daily recombinant human deoxyribonuclease in children with cystic fibrosis: a randomised trial. Lancet. 2001;358(9290):1316-21. https://doi.org/10.1016/S0140-6736(01)06412-1
https://doi.org/10.1016/S0140-6736(01)06...
e duas vezes ao dia em pacientes graves.102102 Bilton D, Robinson P, Cooper P, Gallagher CG, Kolbe J, Fox H, et al. Inhaled dry powder mannitol in cystic fibrosis: an efficacy and safety study. Eur Respir J. 2011;38(5):1071-80. https://doi.org/10.1183/09031936.00187510
https://doi.org/10.1183/09031936.0018751...
Pode ser utilizada em qualquer horário, pelo menos 30 min antes da fisioterapia respiratória.9393 Fitzgerald DA, Hilton J, Jepson B, Smith L. A crossover, randomized, controlled trial of dornase alfa before versus after physiotherapy in cystic fibrosis. Pediatrics. 2005;116(4):e549-54. https://doi.org/10.1542/peds.2005-0308
https://doi.org/10.1542/peds.2005-0308...
,9494 Yang C, Chilvers M, Montgomery M, Nolan SJ. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev. 2016;4:CD001127. https://doi.org/10.1002/14651858.cd001127.pub3
https://doi.org/10.1002/14651858.cd00112...
(Nível de evidência: 1)
Quando usar dornase alfa em menores de 6 anos?
O uso de dornase alfa deve ser considerado nos pacientes mais jovens com sintomas respiratórios persistentes ou com evidências de doença pulmonar precoce (bronquiectasias, por exemplo).4040 Lahiri T, Hempstead SE, Brady C, Cannon CL, Clark K, Condren ME, et al. Clinical Practice Guidelines From the Cystic Fibrosis Foundation for Preschoolers With Cystic Fibrosis. Pediatrics. 2016; 137(4). pii: e20151784. https://doi.org/10.1542/peds.2015-1784
https://doi.org/10.1542/peds.2015-1784...
,9595 Berge MT, Wiel E, Tiddens HA, Merkus PJ, Hop WC, de Jongste JC. DNase in stable cystic fibrosis infants: a pilot study. J Cyst Fibros. 2003;2(4):183-8. https://doi.org/10.1016/S1569-1993(03)00090-0
https://doi.org/10.1016/S1569-1993(03)00...
96 Nasr SZ, Kuhns LR, Brown RW, Hurwitz ME, Sanders GM, Strouse PJ. Use of computerized tomography and chest x-rays in evaluating efficacy of aerosolized recombinant human DNase in cystic fibrosis patients younger than age 5 years: a preliminary study. Pediatr Pulmonol. 2001;31(5):377-82. https://doi.org/10.1002/ppul.1061
https://doi.org/10.1002/ppul.1061...
-9797 McKenzie SG, Chowdhury S, Strandvik B, Hodson ME; Investigators of the Epidemiologic Registry of Cystic Fibrosis. Dornase alfa is well tolerated: data from the epidemiologic registry of cystic fibrosis. Pediatr Pulmonol. 2007;42(10):928-37. https://doi.org/10.1002/ppul.20685
https://doi.org/10.1002/ppul.20685...
(Nível de evidência: 2)
Qual é o papel da salina hipertônica e do manitol? Quais são suas concentrações recomendadas?
A solução salina hipertônica e o manitol são substâncias mucocinéticas. Atuam como hidratantes da superfície das vias aéreas, como agentes osmóticos, alterando as propriedades reológicas do muco.
A solução salina hipertônica administrada duas vezes ao dia e na concentração de 7% reduz exacerbações respiratórias e promove melhoras na função pulmonar e na qualidade de vida. Estudos de longo prazo são necessários para a constatação de melhora sustentada.8787 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
,9898 Elkins MR, Robinson M, Rose BR, Harbour C, Moriarty CP, Marks GB, et al. A controlled trial of long-term inhaled hypertonic saline in patients with cystic fibrosis. N Engl J Med. 2006;354(3):229-40. https://doi.org/10.1056/NEJMoa043900
https://doi.org/10.1056/NEJMoa043900...
99 Wark PA, McDonald V. Nebulised hypertonic saline for cystic fibrosis. Cochrane Database Syst Rev. 2000;(2):CD001506.-100100 Dentice RL, Elkins MR, Middleton PG, Bishop JR, Wark PA, Dorahy DJ, et al. A randomised trial of hypertonic saline during hospitalisation for exacerbation of cystic fibrosis. Thorax. 2016;71(2):141-7. https://doi.org/10.1136/thoraxjnl-2014-206716
https://doi.org/10.1136/thoraxjnl-2014-2...
O manitol tem apresentação em pó seco para inalação, na dose de 400 mg, duas vezes ao dia. Seu uso está associado à redução do tempo de tratamento com nebulizações, melhora clínica e melhora da função pulmonar.101101 Aitken ML, Bellon G, De Boeck K, Flume PA, Fox HG, Geller DE, et al. Long-term inhaled dry powder mannitol in cystic fibrosis: an international randomized study. Am J Respir Crit Care Med. 2012;185(6):645-52. https://doi.org/10.1164/rccm.201109-1666OC
https://doi.org/10.1164/rccm.201109-1666...
102 Bilton D, Robinson P, Cooper P, Gallagher CG, Kolbe J, Fox H, et al. Inhaled dry powder mannitol in cystic fibrosis: an efficacy and safety study. Eur Respir J. 2011;38(5):1071-80. https://doi.org/10.1183/09031936.00187510
https://doi.org/10.1183/09031936.0018751...
-103103 Bilton D, Bellon G, Charlton B, Cooper P, De Boeck K, Flume PA, et al. Pooled analysis of two large randomised phase III inhaled mannitol studies in cystic fibrosis. J Cyst Fibros. 2013;12(4):367-76. https://doi.org/10.1016/j.jcf.2012.11.002
https://doi.org/10.1016/j.jcf.2012.11.00...
) Sua utilização é segura e bem tolerada, mas deve ser precedida pela inalação de broncodilatadores, já que podem atuar como substâncias irritantes. Ambas são abordagens complementares ao tratamento com dornase alfa.
(Nível de evidência: 1 para salina hipertônica e para manitol)
Como deve ser o tratamento de erradicação da P. aeruginosa?
O tratamento de erradicação na infecção respiratória inicial (primeira ou precoce) por P. aeruginosa visa erradicar a bactéria e postergar a infecção crônica. Existem diversas estratégias terapêuticas, não havendo superioridade de uma em relação à outra. A estratégia mais recomendada é o uso da tobramicina inalatória, 300 mg, duas vezes ao dia, por 28 dias.104104 Langton Hewer SC, Smyth AR. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD004197. https://doi.org/10.1002/14651858.cd004197.pub4
https://doi.org/10.1002/14651858.cd00419...
105 Proesmans M, Vermeulen F, Boulanger L, Verhaegen J, De Boeck K. Comparison of two treatment regimens for eradication of Pseudomonas aeruginosa infection in children with cystic fibrosis. J Cyst Fibros. 2013;12(1):29-34. https://doi.org/10.1016/j.jcf.2012.06.001
https://doi.org/10.1016/j.jcf.2012.06.00...
106 Ratjen F, Munck A, Kho P, Angyalosi G; ELITE Study Group. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax. 2010;65(4):286-91. https://doi.org/10.1136/thx.2009.121657
https://doi.org/10.1136/thx.2009.121657...
-107107 Treggiari MM, Retsch-Bogart G, Mayer-Hamblett N, Khan U, Kulich M, Kronmal R, et al. Comparative efficacy and safety of 4 randomized regimens to treat early Pseudomonas aeruginosa infection in children with cystic fibrosis. Arch Pediatr Adolesc Med. 2011;165(9):847-56. https://doi.org/10.1001/archpediatrics.2011.136
https://doi.org/10.1001/archpediatrics.2...
O colistimetato de sódio (1.000.000 a 2.000.000 UI, duas vezes ao dia) é uma alternativa com resultados consistentes, devendo ser associado a ciprofloxacina oral por 2-3 semanas.
O tratamento inalatório pode ser estendido por 2-3 meses. A antibioticoterapia endovenosa por 2 semanas pode ser a opção em casos selecionados, sempre seguida da antibioticoterapia inalatória. Sucesso na erradicação é definido como a ausência da bactéria por 1 ano nas culturas subsequentes ao término do tratamento. O tratamento de erradicação, além dos benefícios clínicos significativos, pode ser custo-efetivo.103103 Bilton D, Bellon G, Charlton B, Cooper P, De Boeck K, Flume PA, et al. Pooled analysis of two large randomised phase III inhaled mannitol studies in cystic fibrosis. J Cyst Fibros. 2013;12(4):367-76. https://doi.org/10.1016/j.jcf.2012.11.002
https://doi.org/10.1016/j.jcf.2012.11.00...
104 Langton Hewer SC, Smyth AR. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD004197. https://doi.org/10.1002/14651858.cd004197.pub4
https://doi.org/10.1002/14651858.cd00419...
105 Proesmans M, Vermeulen F, Boulanger L, Verhaegen J, De Boeck K. Comparison of two treatment regimens for eradication of Pseudomonas aeruginosa infection in children with cystic fibrosis. J Cyst Fibros. 2013;12(1):29-34. https://doi.org/10.1016/j.jcf.2012.06.001
https://doi.org/10.1016/j.jcf.2012.06.00...
106 Ratjen F, Munck A, Kho P, Angyalosi G; ELITE Study Group. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax. 2010;65(4):286-91. https://doi.org/10.1136/thx.2009.121657
https://doi.org/10.1136/thx.2009.121657...
-107107 Treggiari MM, Retsch-Bogart G, Mayer-Hamblett N, Khan U, Kulich M, Kronmal R, et al. Comparative efficacy and safety of 4 randomized regimens to treat early Pseudomonas aeruginosa infection in children with cystic fibrosis. Arch Pediatr Adolesc Med. 2011;165(9):847-56. https://doi.org/10.1001/archpediatrics.2011.136
https://doi.org/10.1001/archpediatrics.2...
(Nível de evidência: 1)
Como deve ser o tratamento de erradicação para cepas do complexo B. cepacia?
O complexo B. cepacia corresponde a um grupo de mais de 80 espécies estreitamente relacionadas,108108 Vandamme P, Dawyndt P. Classification and identification of the Burkholderia cepacia complex: Past, present and future. Syst Appl Microbiol. 2011;34(2):87-95. https://doi.org/10.1016/j.syapm.2010.10.002
https://doi.org/10.1016/j.syapm.2010.10....
,109109 Depoorter E, Bull MJ, Peeters C, Coenye T, Vandamme P, Mahenthiralingam E. Burkholderia: an update on taxonomy and biotechnological potential as antibiotic producers. Appl Microbiol Biotechnol. 2016;100(12):5215-29. https://doi.org/10.1007/s00253-016-7520-x
https://doi.org/10.1007/s00253-016-7520-...
sendo B. multivorans e B. cenocepacia as mais frequentes na fibrose cística.110110 Zlosnik JE, Zhou G, Brant R, Henry DA, Hird TJ, Mahenthiralingam E, et al. Burkholderia species infections in patients with cystic fibrosis in British Columbia, Canada. 30 years' experience. Ann Am Thorac Soc. 2015;12(1):70-8. https://doi.org/10.1513/AnnalsATS.201408-395OC
https://doi.org/10.1513/AnnalsATS.201408...
As manifestações clínicas na fibrose cística variam desde a ausência de sintomas a quadros graves com deterioração clínica rápida e evolução fulminante para pneumonia necrosante, insuficiência respiratória e sepse (síndrome cepacia).110110 Zlosnik JE, Zhou G, Brant R, Henry DA, Hird TJ, Mahenthiralingam E, et al. Burkholderia species infections in patients with cystic fibrosis in British Columbia, Canada. 30 years' experience. Ann Am Thorac Soc. 2015;12(1):70-8. https://doi.org/10.1513/AnnalsATS.201408-395OC
https://doi.org/10.1513/AnnalsATS.201408...
O tratamento do complexo B. cepacia é difícil devido à resistência intrínseca para a maioria dos antimicrobianos disponíveis, recomendando-se, sempre que possível, usar uma combinação de drogas guiada por antibiograma. Não há evidências disponíveis que avaliem a eficácia de sua erradicação, nem recomendações para tratamento inalatório para infecção crônica.110110 Zlosnik JE, Zhou G, Brant R, Henry DA, Hird TJ, Mahenthiralingam E, et al. Burkholderia species infections in patients with cystic fibrosis in British Columbia, Canada. 30 years' experience. Ann Am Thorac Soc. 2015;12(1):70-8. https://doi.org/10.1513/AnnalsATS.201408-395OC
https://doi.org/10.1513/AnnalsATS.201408...
,111111 Horsley A, Webb K, Bright-Thomas R, Govan J, Jones A. Can early Burkholderia cepacia complex infection in cystic fibrosis be eradicated with antibiotic therapy? Front Cell Infect Microbiol. 2011;1:18. https://doi.org/10.3389/fcimb.2011.00018
https://doi.org/10.3389/fcimb.2011.00018...
(Nível de evidência: 4)
Como deve ser o tratamento de erradicação de S. aureus resistente à meticilina?
A infecção crônica por S. aureus resistente à meticilina está associada a piores desfechos clínicos em pacientes com fibrose cística.112112 Dasenbrook EC, Checkley W, Merlo CA, Konstan MW, Lechtzin N, Boyle MP. Association between respiratory tract methicillin-resistant Staphylococcus aureus and survival in cystic fibrosis. JAMA. 2010;303(23):2386-92. https://doi.org/10.1001/jama.2010.791
https://doi.org/10.1001/jama.2010.791...
Há relatos de tratamentos para erradicação do patógeno, utilizando combinações de drogas orais, tópicas e inalatórias, como sulfametoxazol/trimetoprima, rifampicina, ácido fusídico e clorexidina, além de vancomicina. A linezolida pode ser considerada, porém com menor evidência.113113 Vanderhelst E, De Wachter E, Willekens J, Pierard D, Vincken W, Malfroot A. Eradication of chronic methicillin-resistant Staphylococcus aureus infection in cystic fibrosis patients. An observational prospective cohort study of 11 patients. J Cyst Fibros. 2013;12(6):662-6. https://doi.org/10.1016/j.jcf.2013.04.009
https://doi.org/10.1016/j.jcf.2013.04.00...
Protocolos de tratamento mais curtos (< 3 semanas) parecem ser tão eficazes quanto os mais longos, com menor chance de intolerância e efeitos adversos. A terapia combinada parece ter mais chance de sucesso do que a monoterapia.114114 Hall H, Gadhok R, Alshafi K, Bilton D, Simmonds NJ. Eradication of respiratory tract MRSA at a large adult cystic fibrosis centre. Respir Med. 2015;109(3):357-63. https://doi.org/10.1016/j.rmed.2015.01.013
https://doi.org/10.1016/j.rmed.2015.01.0...
,115115 Vallières E, Rendall JC, Moore JE, McCaughan J, Hoeritzauer AI, Tunney MM, et al. MRSA eradication of newly acquired lower respiratory tract infection in cystic fibrosis. ERJ Open Res. 2016;2(1). pii: 00064-2015. https://doi.org/10.1183/23120541.00064-2015
https://doi.org/10.1183/23120541.00064-2...
Ainda não existem evidências claras dos benefícios da erradicação de S. aureus resistente à meticilina em pacientes com fibrose cística.113113 Vanderhelst E, De Wachter E, Willekens J, Pierard D, Vincken W, Malfroot A. Eradication of chronic methicillin-resistant Staphylococcus aureus infection in cystic fibrosis patients. An observational prospective cohort study of 11 patients. J Cyst Fibros. 2013;12(6):662-6. https://doi.org/10.1016/j.jcf.2013.04.009
https://doi.org/10.1016/j.jcf.2013.04.00...
,114114 Hall H, Gadhok R, Alshafi K, Bilton D, Simmonds NJ. Eradication of respiratory tract MRSA at a large adult cystic fibrosis centre. Respir Med. 2015;109(3):357-63. https://doi.org/10.1016/j.rmed.2015.01.013
https://doi.org/10.1016/j.rmed.2015.01.0...
,116116 Macfarlane M, Leavy A, McCaughan J, Fair R, Reid AJ. Successful decolonization of methicillin-resistant Staphylococcus aureus in paediatric patients with cystic fibrosis (CF) using a three-step protocol. J Hosp Infect. 2007;65(3):231-6. https://doi.org/10.1016/j.jhin.2006.10.011
https://doi.org/10.1016/j.jhin.2006.10.0...
Também não há evidências para recomendar antibioticoterapia inalatória para a infecção crônica por esse patógeno.
(Nível de evidência: 4)
Quais são as recomendações para o uso crônico de antibióticos inalatórios na fibrose cística?
A Tabela 2 mostra os antibióticos inalatórios que são utilizados para supressão da infecção crônica por P. aeruginosa.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,117117 Ryan G, Singh M, Dwan K. Inhaled antibiotics for long-term therapy in cystic fibrosis. Cochrane Database Syst Rev. 2011;(3):CD001021. https://doi.org/10.1002/14651858.cd001021.pub2
https://doi.org/10.1002/14651858.cd00102...
,118118 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Antibiotic Treatment for Cystic Fibrosis. Third Edition. May 2009. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
https://www.cysticfibrosis.org.uk/the-wo...
O uso regular dos antibióticos inalatórios retarda a deterioração da função pulmonar em pacientes cronicamente infectados por P. aeruginosa.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,8787 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
,117117 Ryan G, Singh M, Dwan K. Inhaled antibiotics for long-term therapy in cystic fibrosis. Cochrane Database Syst Rev. 2011;(3):CD001021. https://doi.org/10.1002/14651858.cd001021.pub2
https://doi.org/10.1002/14651858.cd00102...
118 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Antibiotic Treatment for Cystic Fibrosis. Third Edition. May 2009. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
https://www.cysticfibrosis.org.uk/the-wo...
-119119 Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, et al. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013;39(4):495-512. https://doi.org/10.1590/S1806-37132013000400015
https://doi.org/10.1590/S1806-3713201300...
O Quadro 4 apresenta os critérios de Leeds, que classifica a infecção respiratória pela bactéria em pacientes com fibrose cística de acordo com os resultados de culturas de secreção respiratória obtidas nos últimos 12 meses.120120 Lee TW, Brownlee KG, Conway SP, Denton M, Littlewood JM. Evaluation of a new definition for chronic Pseudomonas aeruginosa infection in cystic fibrosis patients. J Cyst Fibros. 2003;2(1):29-34. https://doi.org/10.1016/S1569-1993(02)00141-8
https://doi.org/10.1016/S1569-1993(02)00...
Tratamento por antibiótico inalatório recomendado por consenso Europeu.118118 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Antibiotic Treatment for Cystic Fibrosis. Third Edition. May 2009. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
https://www.cysticfibrosis.org.uk/the-wo...
Critérios de Leeds para a classificação da infecção respiratória por Pseudomonas aeruginosa em pacientes com fibrose cística.
A tobramicina inalatória é o antibiótico mais estudado,119119 Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, et al. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013;39(4):495-512. https://doi.org/10.1590/S1806-37132013000400015
https://doi.org/10.1590/S1806-3713201300...
,121121 Ramsey BW, Dorkin HL, Eisenberg JD, Gibson RL, Harwood IR, Kravitz RM, et al. Efficacy of aerosolized tobramycin in patients with cystic fibrosis. N Engl J Med. 1993;328(24):1740-6. https://doi.org/10.1056/NEJM199306173282403
https://doi.org/10.1056/NEJM199306173282...
,122122 Ramsey BW, Pepe MS, Quan JM, Otto KL, Montgomery AB, Williams-Warren J, et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. Cystic Fibrosis Inhaled Tobramycin Study Group. N Engl J Med. 1999;340(1):23-30. https://doi.org/10.1056/NEJM199901073400104
https://doi.org/10.1056/NEJM199901073400...
e recomenda-se seu uso acima dos 6 anos de idade em pacientes com infecção crônica por P. aeruginosa, independentemente da gravidade da doença, em ciclos alternados de 28 dias. O colistimetato de sódio e o aztreonam são outras opções.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,8787 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
,123123 Oermann CM, Retsch-Bogart GZ, Quittner AL, Gibson RL, McCoy KS, Montgomery AB, et al. An 18-month study of the safety and efficacy of repeated courses of inhaled aztreonam lysine in cystic fibrosis. Pediatr Pulmonol. 2010;45(11):1121-34. https://doi.org/10.1002/ppul.21301
https://doi.org/10.1002/ppul.21301...
,124124 Balfour-Lynn IM, editor. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital. 6th edition. London: Royal Brompton Hospital; 2014. A tobramicina em pó seco para inalação tem sido utilizada e mostrou eficácia equivalente à solução, com redução do tempo gasto com o tratamento e dispensando o uso de um nebulizador.125125 Konstan MW, Flume PA, Kappler M, Chiron R, Higgins M, Brockhaus F, et al. Safety, efficacy and convenience of tobramycin inhalation powder in cystic fibrosis patients: The EAGER trial. J Cyst Fibros. 2011;10(1):54-61. https://doi.org/10.1016/j.jcf.2010.10.003
https://doi.org/10.1016/j.jcf.2010.10.00...
A recomendação de uso da terapia de supressão em meses alternados tem por objetivo evitar o desenvolvimento de resistência bacteriana. Em casos mais graves, entretanto, pode-se recomendar o uso contínuo ou alternar antimicrobianos.124124 Balfour-Lynn IM, editor. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital. 6th edition. London: Royal Brompton Hospital; 2014.
É recomendável que as primeiras inalações sejam realizadas sob supervisão para avaliar a ocorrência de broncoconstrição induzida por drogas (sibilância, dispneia e opressão torácica). Recomenda-se o uso de broncodilatador, seguido de higiene brônquica através da fisioterapia e, por fim, o uso dos antibióticos a fim de garantir uma maior deposição da medicação.8787 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
https://doi.org/10.1164/rccm.201207-1160...
,119119 Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, et al. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013;39(4):495-512. https://doi.org/10.1590/S1806-37132013000400015
https://doi.org/10.1590/S1806-3713201300...
,126126 Littlewood KJ, Higashi K, Jansen JP, Capkun-Niggli G, Balp MM, Doering G, et al. A network meta-analysis of the efficacy of inhaled antibiotics for chronic Pseudomonas infections in cystic fibrosis. J Cyst Fibros. 2012;11(5):419-26. https://doi.org/10.1016/j.jcf.2012.03.010
https://doi.org/10.1016/j.jcf.2012.03.01...
,127127 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Brady C, Guill M, Lahiri T, et al. Cystic Fibrosis Foundation pulmonary guideline. pharmacologic approaches to prevention and eradication of initial Pseudomonas aeruginosa infection. Ann Am Thorac Soc. 2014;11(10):1640-50. https://doi.org/10.1513/AnnalsATS.201404-166OC
https://doi.org/10.1513/AnnalsATS.201404...
(Nível de evidência:1)
Quais são as indicações para o uso de azitromicina em pacientes com fibrose cística e como utilizá-la?
O uso de azitromicina oral três vezes por semana em indivíduos com fibrose cística, idade > 5 anos e cronicamente colonizados por P. aeruginosa resulta em melhora da função pulmonar e redução de exacerbações.119119 Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, et al. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013;39(4):495-512. https://doi.org/10.1590/S1806-37132013000400015
https://doi.org/10.1590/S1806-3713201300...
,127127 Mogayzel PJ Jr, Naureckas ET, Robinson KA, Brady C, Guill M, Lahiri T, et al. Cystic Fibrosis Foundation pulmonary guideline. pharmacologic approaches to prevention and eradication of initial Pseudomonas aeruginosa infection. Ann Am Thorac Soc. 2014;11(10):1640-50. https://doi.org/10.1513/AnnalsATS.201404-166OC
https://doi.org/10.1513/AnnalsATS.201404...
128 Clement A, Tamalet A, Leroux E, Ravilly S, Fauroux B, Jais JP. Long term effects of azithromycin in patients with cystic fibrosis: A double blind, placebo controlled trial. Thorax. 2006;61(10):895-902. https://doi.org/10.1136/thx.2005.057950
https://doi.org/10.1136/thx.2005.057950...
129 Equi A, Balfour-Lynn IM, Bush A, Rosenthal M. Long term azithromycin in children with cystic fibrosis: a randomised, placebo-controlled crossover trial. Lancet. 2002;360(9338):978-84. https://doi.org/10.1016/S0140-6736(02)11081-6
https://doi.org/10.1016/S0140-6736(02)11...
130 Florescu DF, Murphy PJ, Kalil AC. Effects of prolonged use of azithromycin in patients with cystic fibrosis: A meta-analysis. Pulm Pharmacol Ther. 2009;22(6):467-72. https://doi.org/10.1016/j.pupt.2009.03.002
https://doi.org/10.1016/j.pupt.2009.03.0...
131 Kabra SK, Pawaiya R, Lodha R, Kapil A, Kabra M, Vani AS, et al. Long-term daily high and low doses of azithromycin in children with cystic fibrosis: a randomized controlled trial. J Cyst Fibros. 2010;9(1):17-23. https://doi.org/10.1016/j.jcf.2009.09.001
https://doi.org/10.1016/j.jcf.2009.09.00...
132 Saiman L, Marshall BC, Mayer-Hamblett N, Burns JL, Quittner AL, Cibene DA, et al. Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2003;290(13):1749-56. https://doi.org/10.1001/jama.290.13.1749
https://doi.org/10.1001/jama.290.13.1749...
-133133 Southern KW, Barker PM, Solis-Moya A, Patel L. Macrolide antibiotics for cystic fibrosis. Cochrane Database Syst Rev. 2012;11:CD002203. https://doi.org/10.1002/14651858.cd002203.pub4
https://doi.org/10.1002/14651858.cd00220...
(Nível de evidência: 1)
Em pacientes não colonizados por P. aeruginosa e VEF1 > 50% do previsto, demonstrou-se uma redução de 50% nas exacerbações, porém, sem benefício na função pulmonar.134134 Saiman L, Anstead M, Mayer-Hamblett N, Lands LC, Kloster M, Hocevar-Trnka J, et al. Effect of azithromycin on pulmonary function in patients with cystic fibrosis uninfected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2010;303(17):1707-15. https://doi.org/10.1001/jama.2010.563
https://doi.org/10.1001/jama.2010.563...
(Nível de evidência: 1)
O uso contínuo do medicamento é recomendado, apesar da escassez de estudos de avaliação em longo prazo. Sugere-se uso inicial por pelo menos 6 meses para a avaliação da resposta.135135 Tramper-Stranders GA, Wolfs TF, Fleer A, Kimpen JL, van der Ent CK. Maintenance azithromycin treatment in pediatric patients with cystic fibrosis: long-term outcomes related to macrolide resistance and pulmonary function. Pediatr Infect Dis J. 2007;26(1):8-12. https://doi.org/10.1097/01.inf.0000247109.44249.ac
https://doi.org/10.1097/01.inf.000024710...
,136136 Willekens J, Eyns H, Malfroot A. How long should we maintain long-term azithromycin treatment in cystic fibrosis patients? Pediatr Pulmonol. 2015;50(1):103-4. https://doi.org/10.1002/ppul.22981
https://doi.org/10.1002/ppul.22981...
Efeitos colaterais, como epigastralgia, alterações eletrocardiográficas, ototoxicidade e infecção por micobactérias não tuberculosas, devem ser monitorizados.
(Nível de evidência: 1)
Recomenda-se o uso da azitromicina (250 mg para peso < 40 kg e 500 mg para peso > 40 kg; três vezes por semana) para pacientes colonizados cronicamente por P. aeruginosa e idade > 5 anos, assim como para aqueles não colonizados que apresentem exacerbações pulmonares frequentes. Recomenda-se a coleta de amostra de escarro para investigar a presença de micobactérias não tuberculosas antes de iniciar o tratamento com a azitromicina.132132 Saiman L, Marshall BC, Mayer-Hamblett N, Burns JL, Quittner AL, Cibene DA, et al. Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2003;290(13):1749-56. https://doi.org/10.1001/jama.290.13.1749
https://doi.org/10.1001/jama.290.13.1749...
,134134 Saiman L, Anstead M, Mayer-Hamblett N, Lands LC, Kloster M, Hocevar-Trnka J, et al. Effect of azithromycin on pulmonary function in patients with cystic fibrosis uninfected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2010;303(17):1707-15. https://doi.org/10.1001/jama.2010.563
https://doi.org/10.1001/jama.2010.563...
(Nível de evidência: 2)
Devido à possibilidade de interação medicamentosa entre azitromicina e aminoglicosídeos, o uso combinado com tobramicina inalatória deve ser reavaliado principalmente nos pacientes com exacerbações frequentes a despeito do tratamento otimizado.137137 Nick JA, Moskowitz SM, Chmiel JF, Forssén AV, Kim SH, Saavedra MT, et al. Azithromycin may antagonize inhaled tobramycin when targeting Pseudomonas aeruginosa in cystic fibrosis. Ann Am Thorac Soc. 2014;11(3):342-50. https://doi.org/10.1513/AnnalsATS.201310-352OC
https://doi.org/10.1513/AnnalsATS.201310...
(Nível de evidência: 3)
Como reconhecer uma exacerbação pulmonar aguda?
Caracteriza-se pelos achados clínicos de aumento da tosse, alteração no aspecto das secreções, febre, alterações na ausculta pulmonar, queda do VEF1, queda da saturação, alterações radiológicas e perda ponderal.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
(Nível de evidência: 5)
Qual é o tratamento indicado para as exacerbações pulmonares agudas?
Para exacerbações leves (sem hipoxemia ou desconforto respiratório significativo), utilizar antimicrobianos por via oral, de acordo com o resultado da última cultura de secreção respiratória. Para exacerbações graves ou com intolerância por medicamentos por via oral, o tratamento intravenoso é recomendado (habitualmente intra-hospitalar),139139 de Groot R, Smith AL. Antibiotic pharmacokinetics in cystic fibrosis. Differences and clinical significance. Clin Pharmacokinet. 1987;13(4):228-53. https://doi.org/10.2165/00003088-198713040-00002
https://doi.org/10.2165/00003088-1987130...
mas a escolha das drogas depende das culturas prévias de secreção respiratória e do histórico do paciente.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
A farmacocinética dos antibióticos é alterada nos indivíduos com fibrose cística e as dosagens devem ser ajustadas139139 de Groot R, Smith AL. Antibiotic pharmacokinetics in cystic fibrosis. Differences and clinical significance. Clin Pharmacokinet. 1987;13(4):228-53. https://doi.org/10.2165/00003088-198713040-00002
https://doi.org/10.2165/00003088-1987130...
) (Tabela 3). Para P. aeruginosa, recomenda-se a combinação de dois ou mais antibióticos (geralmente um beta-lactâmico e um aminoglicosídeo).
O tempo de tratamento de uma exacerbação pulmonar aguda depende da resposta clínica, sendo recomendados de 8 a 14 dias. Pacientes mais graves podem se beneficiar de terapia antimicrobiana por um período mais prolongado.138138 Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, Rosenblatt RL, Kuhn RJ, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-8. https://doi.org/10.1164/rccm.200812-1845PP
https://doi.org/10.1164/rccm.200812-1845...
,140140 Plummer A, Wildman M. Duration of intravenous antibiotic therapy in people with cystic fibrosis. Cochrane Database Syst Rev. 2011;(1):CD006682. https://doi.org/10.1002/14651858.cd006682.pub3
https://doi.org/10.1002/14651858.cd00668...
141 Collaco JM, Green DM, Cutting GR, Naughton KM, Mogayzel PJ Jr. Location and duration of treatment of cystic fibrosis respiratory exacerbations do not affect outcomes. Am J Respir Crit Care Med. 2010;182(9):1137-43. https://doi.org/10.1164/rccm.201001-0057OC
https://doi.org/10.1164/rccm.201001-0057...
-142142 VanDevanter DR, O'Riordan MA, Blumer JL, Konstan MW. Assessing time to pulmonary function benefit following antibiotic treatment of acute cystic fibrosis exacerbations. Respir Res. 2010;11:137. https://doi.org/10.1186/1465-9921-11-137
https://doi.org/10.1186/1465-9921-11-137...
Além da antibioticoterapia, o tratamento das exacerbações requer a participação da equipe multidisciplinar, pois frequentemente é necessária a suplementação de oxigênio, o uso de dispositivos intravenosos de longa duração, a intensificação da fisioterapia e uma abordagem nutricional distinta.138138 Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, Rosenblatt RL, Kuhn RJ, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-8. https://doi.org/10.1164/rccm.200812-1845PP
https://doi.org/10.1164/rccm.200812-1845...
,143143 Hurley MN, Prayle AP, Flume P. Intravenous antibiotics for pulmonary exacerbations in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(7):CD009730. https://doi.org/10.1002/14651858.cd009730.pub2
https://doi.org/10.1002/14651858.cd00973...
,144144 Döring G, Conway SP, Heijerman HG, Hodson ME, Høiby N, Smyth A, et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J. 2000;16(4):749-67. https://doi.org/10.1034/j.1399-3003.2000.16d30.x
https://doi.org/10.1034/j.1399-3003.2000...
(Nível de evidência: 5)
Como avaliar a resposta ao tratamento?
Devem-se observar parâmetros clínicos, como sintomas respiratórios, febre e ganho de peso, assim como a melhora da função pulmonar, visando seu retorno aos valores basais. Apesar do tratamento intensivo, aproximadamente 25% dos pacientes que apresentam uma exacerbação pulmonar aguda com necessidade de tratamento intravenoso não recuperam totalmente os valores de função pulmonar,2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,138138 Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, Rosenblatt RL, Kuhn RJ, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-8. https://doi.org/10.1164/rccm.200812-1845PP
https://doi.org/10.1164/rccm.200812-1845...
139 de Groot R, Smith AL. Antibiotic pharmacokinetics in cystic fibrosis. Differences and clinical significance. Clin Pharmacokinet. 1987;13(4):228-53. https://doi.org/10.2165/00003088-198713040-00002
https://doi.org/10.2165/00003088-1987130...
140 Plummer A, Wildman M. Duration of intravenous antibiotic therapy in people with cystic fibrosis. Cochrane Database Syst Rev. 2011;(1):CD006682. https://doi.org/10.1002/14651858.cd006682.pub3
https://doi.org/10.1002/14651858.cd00668...
141 Collaco JM, Green DM, Cutting GR, Naughton KM, Mogayzel PJ Jr. Location and duration of treatment of cystic fibrosis respiratory exacerbations do not affect outcomes. Am J Respir Crit Care Med. 2010;182(9):1137-43. https://doi.org/10.1164/rccm.201001-0057OC
https://doi.org/10.1164/rccm.201001-0057...
-142142 VanDevanter DR, O'Riordan MA, Blumer JL, Konstan MW. Assessing time to pulmonary function benefit following antibiotic treatment of acute cystic fibrosis exacerbations. Respir Res. 2010;11:137. https://doi.org/10.1186/1465-9921-11-137
https://doi.org/10.1186/1465-9921-11-137...
enfatizando a necessidade de terapias de manutenção para prevenir as exacerbações pulmonares agudas.
(Nível de evidência: 5)
Quando e como empregar a oxigenoterapia em pacientes com fibrose cística?
Em pacientes hipoxêmicos, a suplementação contínua de oxigênio relaciona-se a aumento da tolerância ao exercício e melhora discreta no sono e na frequência a escola/trabalho, porém, sem aumento da sobrevida.
A indicação da oxigenoterapia deve ser avaliada individualmente quando a SpO2 estiver abaixo de 90% para aliviar a dispneia, retardar o cor pulmonale e melhorar os desfechos referidos. Pacientes com PaO2 < 55 mmHg ou SpO2 < 88% já apresentam indicação de oxigenoterapia, independentemente da sintomatologia. A via preferencial é a cânula nasal com o menor fluxo possível para manter a SpO2 acima de 90%. O uso intermitente pode ser necessário durante as exacerbações pulmonares agudas.145145 Balfour-Lynn IM, Field DJ, Gringras P, Hicks B, Jardine E, Jones RC, et al. BTS guidelines for home oxygen in children. Thorax. 2009;64 Suppl 2:ii1-26. https://doi.org/10.1136/thx.2009.116020
https://doi.org/10.1136/thx.2009.116020...
,146146 Elphick HE, Mallory G. Oxygen therapy for cystic fibrosis. Cochrane Database Syst Rev. 2013;(7):CD003884. https://doi.org/10.1002/14651858.cd003884.pub4
https://doi.org/10.1002/14651858.cd00388...
(Nível de evidência: 5)
Como diagnosticar e tratar o pneumotórax em pacientes com fibrose cística?
O pneumotórax manifesta-se com dispneia e/ou dor torácica de início súbito. O pneumotórax extenso exige internação e drenagem do tórax, com indicação de pleurodese apenas se recorrente. O uso de ventilação não invasiva e a fisioterapia respiratória devem ser realizados somente em pacientes drenados. O pneumotórax pequeno deve ser drenado apenas se há instabilidade clínica.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,147147 Flume PA, Mogayzel PJ Jr, Robinson KA, Rosenblatt RL, Quittell L, Marshall BC. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med. 2010;182(3):298-306. https://doi.org/10.1164/rccm.201002-0157OC
https://doi.org/10.1164/rccm.201002-0157...
(Nível de evidência: 5 para a não recomendação de antibióticos)
(Nível de evidência: 5 para a não interrupção de medicamentos inalatórios)
Como classificar e tratar a hemoptise em pacientes com fibrose cística?
O manejo da hemoptise depende do seu volume. Sangramentos ≥ 5 ml exigem considerar tratamento com antibióticos para exacerbação pulmonar.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,147147 Flume PA, Mogayzel PJ Jr, Robinson KA, Rosenblatt RL, Quittell L, Marshall BC. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med. 2010;182(3):298-306. https://doi.org/10.1164/rccm.201002-0157OC
https://doi.org/10.1164/rccm.201002-0157...
) Sangramentos ≥ 240 ml/dia ou > 100 ml/dia por vários dias requerem atendimento especializado e, quando evidenciada instabilidade clínica, indica-se tratamento broncoscópico ou através de embolização de artérias brônquicas.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,147147 Flume PA, Mogayzel PJ Jr, Robinson KA, Rosenblatt RL, Quittell L, Marshall BC. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med. 2010;182(3):298-306. https://doi.org/10.1164/rccm.201002-0157OC
https://doi.org/10.1164/rccm.201002-0157...
A intervenção cirúrgica pode ser feita na fase aguda somente em casos refratários.
(Nível de evidência: 2)
(Nível de evidência: 5 para intervenção cirúrgica)
Quando indicar ventilação invasiva e não invasiva na fibrose cística?
A indicação de ventilação invasiva no paciente grave é controversa e está associada à baixa sobrevida, especialmente quando indicada por infecção respiratória. Deve ser considerada na insuficiência respiratória ocasionada por um fator precipitante agudo e corrigível (hemoptise massiva, pneumotórax e no pós-operatório).
A ventilação não invasiva pode ser usada como adjuvante no tratamento de exacerbações e pode ser indicada em pacientes com hipercapnia diurna e distúrbios do sono. Há relatos de que seu uso está associado a maior tolerância ao exercício, melhora na qualidade de vida e de sobrevida e menor declínio da função pulmonar. Seu uso como recurso na fisioterapia traz benefícios na dispneia, fadiga muscular e oxigenação.7373 Moran F, Bradley JM, Piper AJ. Non-invasive ventilation for cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD002769. https://doi.org/10.1002/14651858.cd002769.pub4
https://doi.org/10.1002/14651858.cd00276...
74 Young AC, Wilson JW, Kotsimbos TC, Naughton MT. Randomised placebo controlled trial of non-invasive ventilation for hypercapnia in cystic fibrosis. Thorax. 2008;63(1):72-7. https://doi.org/10.1136/thx.2007.082602
https://doi.org/10.1136/thx.2007.082602...
-7575 Holland AE, Denehy L, Ntoumenopoulos G, Naughton MT, Wilson JW. Non-invasive ventilation assists chest physiotherapy in adults with acute exacerbations of cystic fibrosis. Thorax. 2003;58(10):880-4. https://doi.org/10.1136/thorax.58.10.880
https://doi.org/10.1136/thorax.58.10.880...
(Nível de evidência: 2 para ventilação não invasiva)
(Nível de evidência: 5 para ventilação invasiva)
Como diagnosticar e tratar a aspergilose broncopulmonar alérgica?
A aspergilose broncopulmonar alérgica é uma complicação frequente na fibrose cística. Recomenda-se a quantificação anual da IgE total como rastreamento. Os critérios para o diagnóstico de aspergilose broncopulmonar alérgica estão apresentados no Quadro 5.124124 Balfour-Lynn IM, editor. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital. 6th edition. London: Royal Brompton Hospital; 2014.,148148 Stevens DA, Moss RB, Kurup VP, Knutsen AP, Greenberger P, Judson MA, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis--state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003;37 Suppl 3:S225-64. https://doi.org/10.1086/376525
https://doi.org/10.1086/376525...
) O tratamento é realizado com prednisona oral com ou sem antifúngico (Quadro 6).118118 Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Antibiotic Treatment for Cystic Fibrosis. Third Edition. May 2009. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
https://www.cysticfibrosis.org.uk/the-wo...
,149149 Elphick HE, Southern KW. Antifungal therapies for allergic bronchopulmonary aspergillosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD002204. https://doi.org/10.1002/14651858.cd002204.pub3
https://doi.org/10.1002/14651858.cd00220...
150 Dhooria S, Agarwal R. Diagnosis of allergic bronchopulmonary aspergillosis: a case-based approach. Future Microbiol. 2014;9(10):1195-208. https://doi.org/10.2217/fmb.14.74
https://doi.org/10.2217/fmb.14.74...
151 Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013;43(8):850-73. https://doi.org/10.1111/cea.12141
https://doi.org/10.1111/cea.12141...
152 Mahdavinia M, Grammer LC. Management of allergic bronchopulmonary aspergillosis: a review and update. Ther Adv Respir Dis. 2012;6(3):173-87. https://doi.org/10.1177/1753465812443094
https://doi.org/10.1177/1753465812443094...
153 Cohen-Cymberknoh M, Blau H, Shoseyov D, Mei-Zahav M, Efrati O, Armoni S, et al. Intravenous monthly pulse methylprednisolone treatment for ABPA in patients with cystic fibrosis. J Cyst Fibros. 2009;8(4):253-7. https://doi.org/10.1016/j.jcf.2009.04.008
https://doi.org/10.1016/j.jcf.2009.04.00...
154 Wong R, Wong M, Robinson PD, Fitzgerald DA. Omalizumab in the management of steroid dependent allergic bronchopulmonary aspergillosis (ABPA) complicating cystic fibrosis. Paediatr Respir Rev. 2013;14(1):22-4. https://doi.org/10.1016/j.prrv.2012.11.004
https://doi.org/10.1016/j.prrv.2012.11.0...
-155155 Casciaro R, Naselli A, Cresta F, Ros M, Castagnola E, Minicucci L. Role of nebulized amphotericin B in the management of allergic bronchopulmonary aspergillosis in cystic fibrosis: Case report and review of literature. J Chemother. 2015;27(5):307-11.
(Nível de evidência: 5 para diagnóstico e tratamento)
Qual é a conduta frente ao paciente com identificação de Aspergillus spp. no escarro?
A presença de Aspergillus spp. no escarro geralmente não significa doença.156156 Aaron SD, Vandemheen KL, Freitag A, Pedder L, Cameron W, Lavoie A, et al. Treatment of Aspergillus fumigatus in patients with cystic fibrosis: a randomized, placebo-controlled pilot study. PLoS One. 2012;7(4):e36077. https://doi.org/10.1371/journal.pone.0036077
https://doi.org/10.1371/journal.pone.003...
Caso haja piora clínica ou falta de resposta ao tratamento com antimicrobianos, deve-se investigar aspergilose broncopulmonar alérgica e considerar bronquite fúngica.157157 Shoseyov D, Brownlee KG, Conway SP, Kerem E. Aspergillus bronchitis in cystic fibrosis. Chest. 2006;130(1):222-6. https://doi.org/10.1378/chest.130.1.222
https://doi.org/10.1378/chest.130.1.222...
(Nível de evidência: 5)
Quais são os tratamentos moduladores da CFTR que existem, para quais tipos de mutação têm sido empregados e quais os efeitos observados?
Os potencializadores aumentam a função da proteína CFTR que é expressa na membrana plasmática (classes III, IV e V), e os corretores corrigem defeitos da proteína que não é expressa na membrana da célula (classes I e II).158158 Boyle MP, De Boeck K. A new era in the treatment of cystic fibrosis: correction of the underlying CFTR defect. Lancet Respir Med. 2013;1(2):158-63. https://doi.org/10.1016/S2213-2600(12)70057-7
https://doi.org/10.1016/S2213-2600(12)70...
159 De Boeck K, Munck A, Walker S, Faro A, Hiatt P, Gilmartin G, et al. Efficacy and safety of ivacaftor in patients with cystic fibrosis and a non-G551D gating mutation. J Cyst Fibros. 2014;13(6):674-80. https://doi.org/10.1016/j.jcf.2014.09.005
https://doi.org/10.1016/j.jcf.2014.09.00...
160 Rowe SM, Heltshe SL, Gonska T, Donaldson SH, Borowitz D, Gelfond D, et al. Clinical mechanism of the cystic fibrosis transmembrane conductance regulator potentiator ivacaftor in G551D-mediated cystic fibrosis. Am J Respir Crit Care Med. 2014;190(2):175-84. https://doi.org/10.1164/rccm.201404-0703OC
https://doi.org/10.1164/rccm.201404-0703...
-161161 Taylor-Cousar J, Niknian M, Gilmartin G, Pilewski JM; VX11-770-901 investigators. Effect of ivacaftor in patients with advanced cystic fibrosis and a G551D-CFTR mutation: Safety and efficacy in an expanded access program in the United States. J Cyst Fibros. 2016;15(1):116-22. https://doi.org/10.1016/j.jcf.2015.01.008
https://doi.org/10.1016/j.jcf.2015.01.00...
O ivacaftor é um potencializador que foi estudado inicialmente em pacientes portadores da mutação G551D (classe III). Seu uso teve efeitos relevantes na redução dos níveis de cloreto no suor, melhora do VEF1 e ganho ponderal, assim como na redução do número de exacerbações e na melhora da qualidade de vida. Seu uso foi posteriormente aprovado para outras mutações classe III e R117H.162162 Davies JC, Wainwright CE, Canny GJ, Chilvers MA, Howenstine MS, Munck A. Efficacy and safety of ivacaftor in patients aged 6 to 11 years with cystic fibrosis with a G551D mutation. Am J Resp Crit Care Med. 2013;187(11)1219-25. https://doi.org/10.1164/rccm.201301-0153OC
https://doi.org/10.1164/rccm.201301-0153...
163 Ramsey BW, Davies J, McElvaney NG, Tullis E, Bell SC, Drevínek P, et al. A CFTR potentiator in patients with cystic fibrosis and the G551D mutation. N Engl J Med. 2011;365(18):1663-72. https://doi.org/10.1056/NEJMoa1105185
https://doi.org/10.1056/NEJMoa1105185...
-164164 Accurso FJ, Rowe SM, Clancy JP, Boyle MP, Dunitz JM, Durie PR, et al. Effect of VX-770 in persons with cystic fibrosis and the G551D-CFTR mutation. N Engl J Med. 2010;363(21):1991-2003. https://doi.org/10.1056/NEJMoa0909825
https://doi.org/10.1056/NEJMoa0909825...
Entre as drogas corretoras, uma droga para classe I (ataluren) demonstrou efeitos discretos na função pulmonar e no número de exacerbações em um estudo de fase III, apenas para pacientes que não utilizavam tobramicina inalatória.165165 Kerem E, Konstan MW, De Boeck K, Accurso FJ, Sermet-Gaudelus I, Wilschanski M, et al. Ataluren for the treatment of nonsense-mutation cystic fibrosis: a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Respir Med. 2014;2(7):539-47. https://doi.org/10.1016/S2213-2600(14)70100-6
https://doi.org/10.1016/S2213-2600(14)70...
Para a mutação de classe II de maior prevalência em todo o mundo, a F508del, o uso da associação ivacaftor/lumacaftor (potencializador/corretor) mostrou uma redução no número de exacerbações e uma melhora discreta no VEF1 e na qualidade de vida para pacientes homozigotos, sem efeitos significativos para heterozigotos.166166 Boyle MP, Bell SC, Konstan MW, McColley SA, Rowe SM, Rietschel E. A CFTR corrector (lumacaftor) and a CFTR potentiator (ivacaftor) for treatment of patients with cystic fibrosis who have a phe508del CFTR mutation: a phase 2 randomised controlled trial. Lancet Respir Med. 2014;2(7):527-38. https://doi.org/10.1016/S2213-2600(14)70132-8
https://doi.org/10.1016/S2213-2600(14)70...
(Nível de evidência: 1 para ivacaftor em portadores de mutação classe III [G551D])
(Nível de evidência: 3 para ataluren em pacientes não expostos a tobramicina)
(Nível de evidência: 2 para ivacaftor/lumacaftor em portadores de mutação classe II [F508del])
Existe indicação de uso do ibuprofeno em pacientes com fibrose cística?
O uso de ibuprofeno parece retardar o declínio da função pulmonar e acarretar melhora nutricional, especialmente em crianças. Os estudos recomendam doses entre 20 e 30 mg/kg, duas vezes ao dia (máximo, 1.600 mg), além de monitoramento dos eventos adversos (suspender ibuprofeno quando usar aminoglicosídeos) e de seus níveis séricos (50-100 mg/ml). Baixas doses estão associadas com aumento paradoxal na inflamação. Diante da elevada taxa de eventos adversos relacionados a seu uso e da dificuldade no monitoramento do nível sérico da droga, não se recomenda seu uso rotineiro. É desconhecido seu benefício na doença avançada.167167 Chmiel JF, Konstan MW. Inflammation and anti-inflammatory therapies for cystic fibrosis. Clin Chest Med. 2007;28(2):331-46. https://doi.org/10.1016/j.ccm.2007.02.002
https://doi.org/10.1016/j.ccm.2007.02.00...
168 Fennell PB, Quante J, Wilson K, Boyle M, Strunk R, Ferkol T. Use of high-dose ibuprofen in a pediatric cystic fibrosis center. J Cyst Fibros. 2007;6(2):153-8. https://doi.org/10.1016/j.jcf.2006.06.003
https://doi.org/10.1016/j.jcf.2006.06.00...
169 Flume PA, Van Devanter DR. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 2012;10:88. https://doi.org/10.1186/1741-7015-10-88
https://doi.org/10.1186/1741-7015-10-88...
170 Konstan MW, Byard PJ, Hoppel CL, Davis PB. Effect of high-dose ibuprofen in patients with cystic fibrosis. N Engl J Med. 1995;332(13):848-54. https://doi.org/10.1056/NEJM199503303321303
https://doi.org/10.1056/NEJM199503303321...
171 Konstan MW, Schluchter MD, Xue W, Davis PB. Clinical use of Ibuprofen is associated with slower FEV1 decline in children with cystic fibrosis. Am J Respir Crit Care Med. 2007;176(11):1084-9. https://doi.org/10.1164/rccm.200702-181OC
https://doi.org/10.1164/rccm.200702-181O...
172 Lands LC, Stanojevic S. Oral non-steroidal anti-inflammatory drug therapy for lung disease in cystic fibrosis. Cochrane Database Syst Rev. 2013;(6):CD001505. https://doi.org/10.1002/14651858.cd001505.pub3
https://doi.org/10.1002/14651858.cd00150...
173 Chmiel JF, Konstan MW, Accurso FJ, Lymp J, Mayer-Hamblett N, VanDevanter DR, et al. Use of ibuprofen to assess inflammatory biomarkers in induced sputum: Implications for clinical trials in cystic fibrosis. J Cyst Fibros. 2015;14(6):720-6. https://doi.org/10.1016/j.jcf.2015.03.007
https://doi.org/10.1016/j.jcf.2015.03.00...
-174174 Lands LC, Milner R, Cantin AM, Manson D, Corey M. High-dose ibuprofen in cystic fibrosis: Canadian safety and effectiveness trial. J Pediatr. 2007;151(3):249-54. https://doi.org/10.1016/j.jpeds.2007.04.009
https://doi.org/10.1016/j.jpeds.2007.04....
(Nível de evidência: 2)
Qual é o papel dos corticosteroides inalatórios e sistêmicos na fibrose cística?
Não existem evidências científicas que suportem o uso de corticosteroides inalatórios de forma rotineira na fibrose cística, podendo-se utilizá-los em pacientes com asma associada. Recomenda-se, sempre que possível, realizar espirometria para comprovar o benefício de seu uso.175175 Balfour-Lynn IM, Welch K. Inhaled corticosteroids for cystic fibrosis. Cochrane Database Syst Rev. 2014;(10):CD001915. https://doi.org/10.1002/14651858.cd001915.pub4
https://doi.org/10.1002/14651858.cd00191...
) O uso crônico de corticosteroides orais também não é recomendado pelo risco de efeitos adversos significativos, como aumento do risco de diabetes e retardo do crescimento. Os efeitos do uso por curtos períodos e durante as exacerbações pulmonares ainda não foram esclarecidos.176176 Cheng K, Ashby D, Smyth RL. Oral steroids for long-term use in cystic fibrosis. Cochrane Database Syst Rev. 2013;(6):CD000407. https://doi.org/10.1002/14651858.cd000407.pub3
https://doi.org/10.1002/14651858.cd00040...
(Nível de evidência: 5 para não usar corticosteroide oral cronicamente)
(Nível de evidência: 5 para uso corticosteroide inalatório)
Qual é a indicação do uso de broncodilatadores na fibrose cística?
Os broncodilatadores demonstraram benefícios apenas em pacientes com hiper-responsividade brônquica comprovada ou evidência de asma; nesse último caso, devem ser utilizados em associação com um corticosteroide inalatório. Nesse grupo de pacientes, observou-se um aumento da função pulmonar em curto e longo prazo. Os beta-agonistas de longa duração melhoraram a função pulmonar em curto prazo, com resultados duradouros inconsistentes, sendo indicados, portanto, apenas para indivíduos com asma comprovada.177177 Halfhide C, Evans HJ, Couriel J. WITHDRAWN: Inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst Rev. 2016;2:CD003428. Em relação aos anticoliwnérgicos de longa duração, recentemente o uso de tiotrópio mostrou ser bem tolerado, apesar de o ganho de função pulmonar não ter apresentado uma diferença estatisticamente significativa quando comparado a placebo.178178 Ratjen F, Koker P, Geller DE, Langellier-Cocteaux B, Le Maulf F, Kattenbeck S, et al. Tiotropium Respimat in cystic fibrosis: Phase 3 and Pooled phase 2/3 randomized trials. J Cyst Fibros. 2015;14(5):608-14. https://doi.org/10.1016/j.jcf.2015.03.004
https://doi.org/10.1016/j.jcf.2015.03.00...
(Nível de evidência: 5 para beta-agonistas na fibrose cística com asma)
(Nível de evidência: 5 para tiotrópio)
Como diagnosticar e tratar as infecções por micobactérias não tuberculosas?
O aumento na incidência de infecção por micobactérias não tuberculosas vem ocorrendo em pacientes com fibrose cística, com incidência crescente com o avançar da idade. Está associada à deterioração clínica progressiva, sendo fundamental a diferenciação entre colonização e infecção, que se baseia em critérios clínicos, microbiológicos e radiológicos.179179 Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367-416. https://doi.org/10.1164/rccm.200604-571ST
https://doi.org/10.1164/rccm.200604-571S...
Pacientes com expectoração espontânea devem coletar, pelo menos, uma cultura anual para micobactérias. As espécies mais comumente identificadas são complexo M. avium-intracellulare, M. chelonae e M. abscessus.180180 Floto RA, Olivier KN, Saiman L, Daley CL, Herrmann JL, Nick JA, et al. US Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus recommendations for the management of non-tuberculous mycobacteria in individuals with cystic fibrosis. Thorax. 2016;71 Suppl 1:i1-22. https://doi.org/10.1136/thoraxjnl-2015-207360
https://doi.org/10.1136/thoraxjnl-2015-2...
O tratamento da infecção com pelo menos três antibióticos é recomendado, geralmente incluindo um macrolídeo. O esquema antimicrobiano deve ser individualizado de acordo com a espécie das micobactérias não tuberculosas, seguindo a recomendação de diretrizes.179179 Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367-416. https://doi.org/10.1164/rccm.200604-571ST
https://doi.org/10.1164/rccm.200604-571S...
,180180 Floto RA, Olivier KN, Saiman L, Daley CL, Herrmann JL, Nick JA, et al. US Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus recommendations for the management of non-tuberculous mycobacteria in individuals with cystic fibrosis. Thorax. 2016;71 Suppl 1:i1-22. https://doi.org/10.1136/thoraxjnl-2015-207360
https://doi.org/10.1136/thoraxjnl-2015-2...
(Nível de evidência: 5)
TRATAMENTO GASTROINTESTINAL E NUTRICIONAL
Como suspeitar, diagnosticar e manejar o íleo meconial?
O íleo meconial é a primeira manifestação clinica dos pacientes com fibrose cística, em 15-20% dos casos. A obstrução ileal por mecônio e muco espesso pode surgir na vida intrauterina com polidrâmnio, peritonite meconial e distensão ileal, evidenciados na ultrassonografia pré-natal. Manifesta-se pela ausência de eliminação de fezes nas primeiras 48 h de vida, acompanhada de distensão abdominal e vômitos (abdome agudo obstrutivo).
O tratamento clínico inclui enemas hiperosmolares, uso de sonda nasogástrica aberta, hidratação e controle eletrolítico. Casos complexos (atresias, microcólon, necrose e/ou perfuração) devem ser tratados cirurgicamente, usando técnicas minimamente invasivas com ileostomia e reanastomose em momento oportuno.181181 Carlyle BE, Borowitz DS, Glick PL. A review of pathophysiology and management of fetuses and neonates with meconium ileus for the pediatric surgeon. J Pediatr Surg. 2012;47(4):772-81. Erratum in: J Pediatr Surg. 2012 Aug;47(8):1633. https://doi.org/10.1016/j.jpedsurg.2012.02.019
https://doi.org/10.1016/j.jpedsurg.2012....
(Nível de evidência: 5)
Como prevenir os distúrbios eletrolíticos?
A perda de sal pelo suor e a grande superfície corporal trazem risco para desidratação e distúrbios eletrolíticos nos lactentes com fibrose cística, mesmo sem perdas aparentes. Sinais como apatia ou irritabilidade, taquipneia e prostração podem indicar desidratação, hiponatremia, hipocalemia e hipocloremia, com potencial risco de vida. Neonatos e lactentes em uso de leite materno ou de fórmulas infantis devem receber suplementação de cloreto de sódio, na dose de 2,5-3,0 mEq/kg/dia.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,182182 Guimarães EV, Schettino GC, Camargos PA, Penna FJ. Prevalence of hyponatremia at diagnosis and factors associated with the longitudinal variation in serum sodium levels in infants with cystic fibrosis. J Pediatr. 2012;161(2):285-9. https://doi.org/10.1016/j.jpeds.2012.01.052
https://doi.org/10.1016/j.jpeds.2012.01....
,183183 Coates AJ, Crofton PM, Marshall T. Evaluation of salt supplementation in CF infants. J Cyst Fibros. 2009;8(6):382-5. https://doi.org/10.1016/j.jcf.2009.08.006
https://doi.org/10.1016/j.jcf.2009.08.00...
(Nível de evidência: 5)
Quando suspeitamos clinicamente da insuficiência pancreática exócrina?
Devemos suspeitá-la na presença de esteatorreia, diarreia crônica, baixo ganho de peso e sinais de hipovitaminose. O lactente pode ainda apresentar edema, hipoalbuminemia e anemia. Sinais indiretos são observados através das características das fezes, como oleosidade, odor fétido e diarreia.184184 Cystic Fibrosis Foundation, Borowitz D, Robinson KA, Rosenfeld M, Davis SD, Sabadosa KA, et al. Cystic Fibrosis Foundation evidence-based guidelines for management of infants with cystic fibrosis. J Pediatr. 2009;155(6 Suppl):S73-93. https://doi.org/10.1016/j.jpeds.2009.09.001
https://doi.org/10.1016/j.jpeds.2009.09....
(Nível de evidência: 5)
Como confirmamos o diagnóstico da insuficiência pancreática exócrina?
Na prática clínica, o melhor método para confirmação é a dosagem da elastase fecal, sendo valores menores de 200 µg/g de fezes confirmatórios de insuficiência pancreática exócrina, com uma sensibilidade de 86-100%.185185 O'Sullivan BP, Baker D, Leung KG, Reed G, Baker SS, Borowitz D. Evolution of pancreatic function during the first year in infants with cystic fibrosis. J Pediatr. 2013;162(4):808-12.e1. https://doi.org/10.1016/j.jpeds.2012.10.008
https://doi.org/10.1016/j.jpeds.2012.10....
A determinação quantitativa da gordura fecal pelo método de Van de Kamer é considerado o padrão ouro para o diagnóstico da esteatorreia, mas seu uso é limitado por dificuldades técnicas.185185 O'Sullivan BP, Baker D, Leung KG, Reed G, Baker SS, Borowitz D. Evolution of pancreatic function during the first year in infants with cystic fibrosis. J Pediatr. 2013;162(4):808-12.e1. https://doi.org/10.1016/j.jpeds.2012.10.008
https://doi.org/10.1016/j.jpeds.2012.10....
(Nível de evidência: 4)
Como acompanhar a suficiência pancreática?
O exame de elastase fecal é simples e confiável a partir de duas semanas de idade, na ausência de fezes líquidas. Pacientes com suficiência pancreática devem ser monitorados anualmente durante a infância e durante os períodos de déficit de crescimento, perda de peso ou diarreia crônica. A avaliação semiquantitativa de gordura nas fezes (esteatócrito) tem valor relativo no seguimento, e a avaliação qualitativa de gorduras nas fezes (Sudam III) tem apenas valor de triagem para perda fecal de gorduras.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
(Nível de evidência: 5)
Como realizar a terapia de reposição enzimática?
O requerimento de reposição de enzimas pancreáticas varia muito e deve ser avaliado individualmente, relacionando sintomas clínicos e a dieta de cada paciente. As doses iniciais (Tabela 4) e seu eventual aumento subsequente devem ser guiados pela melhora/resolução dos sintomas de má absorção.
As cápsulas de enzimas devem ser engolidas inteiras e tomadas no início ou durante as refeições. Lactentes podem ingerir os grânulos misturados com leite ou papa de frutas. Doses superiores a 10.000 UI lipase/kg/dia devem ser evitadas, mas podem ser necessárias na infância, especialmente durante as fases de crescimento acelerado.186186 Stern RC, Eisenberg JD, Wagener JS, Ahrens R, Rock M, doPico G, et al. A comparison of the efficacy and tolerance of pancrelipase and placebo in the treatment of steatorrhea in cystic fibrosis patients with clinical exocrine pancreatic insufficiency. Am J Gastroenterol. 2000;95(8):1932-8. https://doi.org/10.1111/j.1572-0241.2000.02244.x
https://doi.org/10.1111/j.1572-0241.2000...
(Nível de evidência: 1)
Como avaliar a resposta à terapia de reposição enzimática?
A adequação da terapia é determinada clinicamente observando-se o estado nutricional, sinais e sintomas de má absorção e o gráfico do ganho de peso do paciente. Doses inapropriadas de enzimas pancreáticas podem resultar em dor abdominal, constipação ou diarreia. O padrão de evacuações e as características das fezes (oleosas, odor fétido, flutuantes, diarreicas, acinzentadas ou amareladas) podem indicar inadequação da terapia de reposição enzimática.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,2424 Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1.
(Nível de evidência: 5)
Quando suspeitar e tratar a síndrome da obstrução intestinal distal?
Na obstrução incompleta, observa-se dor abdominal intermitente, náuseas e massa palpável no quadrante inferior direito. Nos quadros completos, surgem vômitos biliosos e distensão abdominal (abdome agudo obstrutivo). Hidratação oral e laxativos (como polietilenoglicol) são indicados na obstrução incompleta. Nos quadros mais graves, indica-se hidratação venosa, sonda e enemas com polietilenoglicol ou solução de diatrizoato de meglumina + diatrizoato de sódio (Gastrografin®; Bracco Diagnostics, Canadá). O tratamento cirúrgico deve ser considerado na obstrução grave ou na presença de perfuração.187187 Colombo C, Ellemunter H, Houwen R, Munck A, Taylor C, Wilschanski M; et al. Guidelines for the diagnosis and management of distal intestinal obstruction syndrome in cystic fibrosis patients. J Cyst Fibros. 2011;10 Suppl 2:S24-8. https://doi.org/10.1016/S1569-1993(11)60005-2
https://doi.org/10.1016/S1569-1993(11)60...
,188188 Subhi R, Ooi R, Finlayson F, Kotsimbos T, Wilson J, Lee WR, et al. Distal intestinal obstruction syndrome in cystic fibrosis: presentation, outcome and management in a tertiary hospital (2007-2012). ANZ J Surg. 2014;84(10):740-4. https://doi.org/10.1111/ans.12397
https://doi.org/10.1111/ans.12397...
(Nível de evidência: 4)
Existem outras condições clínicas gastrintestinais frequentes em fibrose cística?
Aproximadamente 30% dos pacientes apresentam doença do refluxo gastroesofágico, e 40% apresentam constipação intestinal. A pancreatite aguda recorrente é mais frequente em pacientes com suficiência pancreática (10%), e o prolapso retal ocorre em cerca de 20% dos pacientes, principalmente com idade de 1-2 anos. Pacientes com prolapso retal e pancreatites agudas recorrentes devem ser investigados quanto à fibrose cística. A abordagem e o tratamento de todas essas patologias não diferem dos em pacientes sem fibrose cística.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
(Nível de evidência: 4)
Como monitorar e manejar o acometimento hepático e das vias biliares?
A frequência de manifestações hepáticas e de vias biliares está apresentada na Tabela 5. A cirrose multilobar com insuficiência hepática é rara,189189 Debray D, Kelly D, Houwen R, Strandvik B, Colombo C. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10 Suppl 2:S29-36. https://doi.org/10.1016/S1569-1993(11)60006-4
https://doi.org/10.1016/S1569-1993(11)60...
mas “barro biliar” e litíase nas vias biliares são frequentes e geralmente assintomáticos.190190 Sokol RJ, Durie PR. Recommendations for management of liver and biliary tract disease in cystic fibrosis. Cystic Fibrosis Foundation Hepatobiliary Disease Consensus Group. J Pediatr Gastroenterol Nutr. 1999;28 Suppl 1:S1-13. https://doi.org/10.1097/00005176-199900001-00001
https://doi.org/10.1097/00005176-1999000...
,191191 Williams SG, Westaby D, Tanner MS, Mowat AP. Liver and biliary problems in cystic fibrosis. Br Med Bull. 1992;48(4):877-92. https://doi.org/10.1093/oxfordjournals.bmb.a072583
https://doi.org/10.1093/oxfordjournals.b...
O monitoramento dos pacientes inclui avaliação clínica em todas as consultas, exames bioquímicos (enzimas hepáticas e tempo de protrombina) e ultrassonografia abdominal anualmente. A endoscopia digestiva pode ser solicitada para investigar casos de hemorragia digestiva e/ou suspeita de varizes esofágicas e gástricas. A biópsia hepática é raramente indicada. Pacientes com acometimento hepático devem realizar a quantificação de alfa-fetoproteina anualmente, devido ao risco de carcinoma hepatocelular.189189 Debray D, Kelly D, Houwen R, Strandvik B, Colombo C. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10 Suppl 2:S29-36. https://doi.org/10.1016/S1569-1993(11)60006-4
https://doi.org/10.1016/S1569-1993(11)60...
O tratamento da hepatopatia na fibrose cística objetiva melhorar o fluxo biliar, a viscosidade e a composição da bile. O ácido ursodesoxicólico na dose de 15-20 mg/kg/dia (2-3 tomadas) é recomendado, mas seu uso é controverso na literatura médica. Não há indicação de tratamento no caso de esteatose hepática.190190 Sokol RJ, Durie PR. Recommendations for management of liver and biliary tract disease in cystic fibrosis. Cystic Fibrosis Foundation Hepatobiliary Disease Consensus Group. J Pediatr Gastroenterol Nutr. 1999;28 Suppl 1:S1-13. https://doi.org/10.1097/00005176-199900001-00001
https://doi.org/10.1097/00005176-1999000...
,192192 Colombo C. Liver disease in cystic fibrosis. Curr Opin Pulm Med. 2007;13(6):529-36. https://doi.org/10.1097/MCP.0b013e3282f10a16
https://doi.org/10.1097/MCP.0b013e3282f1...
Em casos de doença hepática avançada, o transplante hepático poderá ser indicado.189189 Debray D, Kelly D, Houwen R, Strandvik B, Colombo C. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10 Suppl 2:S29-36. https://doi.org/10.1016/S1569-1993(11)60006-4
https://doi.org/10.1016/S1569-1993(11)60...
(Nível de evidência: 5)
Como monitorar o estado nutricional do paciente com fibrose cística?
Existe uma forte associação entre função pulmonar e estado nutricional. É necessário um acompanhamento periódico com atenção não só na antropometria, mas também na função pulmonar, função gastrointestinal, qualidade e quantidade da alimentação, composição corporal e avaliação bioquímica.
Os períodos de rápido crescimento são mais vulneráveis à desnutrição, merecendo especial atenção os primeiros 12 meses após o diagnóstico, o primeiro ano de vida e o período peripuberal.193193 Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59. https://doi.org/10.1097/00005176-200209000-00004
https://doi.org/10.1097/00005176-2002090...
Os parâmetros e a periodicidade para a monitorização estão apresentados no Quadro 7.194194 Stallings VA, Stark LJ, Robinson KA, Feranchak AP, Quinton H; Clinical Practice Guidelines on Growth and Nutrition Subcommittee, et al. Evidence-based practice recommendations for nutrition-related management of children and adults with cystic fibrosis and pancreatic insufficiency: results of a systematic review. J Am Diet Assoc. 2008;108(5):832-9. https://doi.org/10.1016/j.jada.2008.02.020
https://doi.org/10.1016/j.jada.2008.02.0...
Parâmetros nutricionais e frequência sugerida para monitorização em pacientes com fibrose cística.
(Nível de evidência: 5)
Quais dados referenciais devem-se utilizar?
As curvas de crescimento utilizadas no Brasil são as da Organização Mundial da Saúde (2006-2007),195195 de Onis M, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ. 2007;85(9):660-7. https://doi.org/10.2471/BLT.07.043497
https://doi.org/10.2471/BLT.07.043497...
,196196 WHO child growth standards and the identification of severe acute malnutrition in infants and children: a joint statement by the World Health Organization and the United Nations Children's Fund. Geneva: WHO; 2009. e os dados antropométricos devem ser obtidos e registrados em todas as consultas (Quadro 8).
Índices antropométricos recomendados pela Organização Mundial da Saúde e adotados pelo Ministério da Saúde na avaliação do estado nutricional de crianças e adolescentes.
(Nível de evidência: 5)
Como definir as deficiências nutricionais?
Nas crianças e adolescentes, os escores Z de estatura/idade, peso/idade, peso/estatura e índice de massa corpórea (IMC)/idade com resultados < −2 revelam deficiências antropométricas. É sugerido associar a avaliação antropométrica à velocidade de crescimento e à estatura alvo. Para adultos, a recomendação é de IMC ≥ 22 kg/m2 para mulheres e ≥ 23 kg/m2 para homens. Avaliações adicionais da composição corporal através das pregas cutâneas, circunferência do braço e bioimpedância auxiliam na determinação da ótima condição nutricional.197197 Alicandro G, Battezzati A, Bianchi ML, Loi S, Speziali C, Bisogno A, et al. Estimating body composition from skinfold thicknesses and bioelectrical impedance analysis in cystic fibrosis patients. J Cyst Fibros. 2015;14(6):784-91. https://doi.org/10.1016/j.jcf.2015.07.011
https://doi.org/10.1016/j.jcf.2015.07.01...
(Nível de evidência: 5)
Quais são as principais estratégias para a prevenção e o tratamento dos distúrbios nutricionais na fibrose cística?
A prevenção dos distúrbios nutricionais pressupõe a ingestão de uma dieta hipercalórica e hiperproteica, suplementação vitamínica, terapia de reposição enzimática e controle das infecções/exacerbações/outras comorbidades da fibrose cística. O tratamento envolve terapia comportamental, uso de suplementos nutricionais, uso de dieta enteral via sonda nasoenteral numa fase aguda e via gastrostomia para uso prolongado.198198 Francis DK, Smith J, Saljuqi T, Watling RM. Oral protein calorie supplementation for children with chronic disease. Cochrane Database Syst Rev. 2015;(5):CD001914. https://doi.org/10.1002/14651858.cd001914.pub2
https://doi.org/10.1002/14651858.cd00191...
199 Smyth RL, Rayner O. Oral calorie supplements for cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD000406. https://doi.org/10.1002/14651858.cd000406.pub4
https://doi.org/10.1002/14651858.cd00040...
200 Engelen MP, Com G, Deutz NE. Protein is an important but undervalued macronutrient in the nutritional care of patients with cystic fibrosis. Curr Opin Clin Nutr Metab Care. 2014;17(6):515-20. Erratum in: Curr Opin Clin Nutr Metab Care. 2015;18(1):109. https://doi.org/10.1097/MCO.0000000000000100
https://doi.org/10.1097/MCO.000000000000...
-201201 Trabulsi J, Schall JI, Ittenbach RF, Olsen IE, Yudkoff M, Daikhin Y, et al. Energy balance and the accuracy of reported energy intake in preadolescent children with cystic fibrosis. Am J Clin Nutr. 2006;84(3):523-30.
(Nível de evidência: 5)
Quais fatores devem ser avaliados na falha de crescimento?
Recomenda-se avaliar a ingestão de macro e micronutrientes, assim como o controle da má-absorção e das infecções/exacerbações. Além disso, devem-se avaliar comorbidades, como distúrbios eletrolíticos, doença do refluxo gastroesofágico, sobrecrescimento bacteriano, diabetes ou distúrbios comportamentais do apetite. Causas menos frequentes incluem intolerância à lactose, doença celíaca, alergia alimentar e doença inflamatória intestinal.193193 Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59. https://doi.org/10.1097/00005176-200209000-00004
https://doi.org/10.1097/00005176-2002090...
,202202 Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi.org/10.1016/S1569-1993(02)00032-2
https://doi.org/10.1016/S1569-1993(02)00...
(Nível de evidência: 5)
Quais são as opções para a terapia nutricional?
Todos os pacientes devem receber aconselhamento dietético. A terapia comportamental pode ser útil para crianças de 3-12 anos de idade. Recomenda-se a ingestão energética de 110-200% do recomendado para a idade e sexo, com 35-40% da energia fornecida por lipídios, além de suplementação de vitaminas de acordo com a necessidade. O uso de suplementos alimentares e/ou o aumento da densidade calórica da dieta são indicados para pacientes com perda ponderal ou falha de ganho ponderal durante 2-6 meses de acordo com a faixa etária. O suporte nutricional enteral por meio de sondas é reservado para casos mais graves e por curtos períodos de tempo. A gastrostomia é indicada para a terapia nutricional de longo prazo. A nutrição parenteral é medida de exceção, indicada para pacientes cuja via digestiva não pode ser utilizada (no pós-operatório ou na enfermidade crítica) ou em casos de síndrome do intestino curto.193193 Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59. https://doi.org/10.1097/00005176-200209000-00004
https://doi.org/10.1097/00005176-2002090...
,202202 Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi.org/10.1016/S1569-1993(02)00032-2
https://doi.org/10.1016/S1569-1993(02)00...
A Figura 2 apresenta o algoritmo para o manejo dos pacientes com baixo peso ou com ganho de peso inadequado.
(Nível de evidência: 5)
Algoritmo para pacientes com baixo peso ou ganho de peso insuficiente. FC: Fibrose cística; IBP: inibidor de bomba de próton; GI: gastrointestinal; TNE: terapia nutricional enteral; DRFC: diabetes relacionado à fibrose cística; e DRGE: doença de refluxo gastroesofágico. Adaptado de Sinaasappel et al.202202 Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi.org/10.1016/S1569-1993(02)00032-2
https://doi.org/10.1016/S1569-1993(02)00...
Quais são os requerimentos para a suplementação de vitaminas na fibrose cística?
Pacientes com fibrose cística têm alto risco de desenvolver deficiência de vitaminas lipossolúveis por conta da insuficiência pancreática exócrina. As doses recomendadas têm uma ampla variação, conforme as Tabelas 6 e 1A (apêndice on-line).193193 Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59. https://doi.org/10.1097/00005176-200209000-00004
https://doi.org/10.1097/00005176-2002090...
,202202 Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi.org/10.1016/S1569-1993(02)00032-2
https://doi.org/10.1016/S1569-1993(02)00...
) As vitaminas lipossolúveis são mais bem absorvidas quando administradas em conjunto com uma refeição e enzimas pancreáticas.203203 Maqbool A, Stallings VA. Update on fat-soluble vitamins in cystic fibrosis. Curr Opin Pulm Med. 2008;14(6):574-81. https://doi.org/10.1097/MCP.0b013e3283136787
https://doi.org/10.1097/MCP.0b013e328313...
204 Okebukola PO, Kansra S, Barrett J. Vitamin E supplementation in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(12):CD009422. https://doi.org/10.1002/14651858.cd009422.pub2
https://doi.org/10.1002/14651858.cd00942...
205 Bonifant CM, Shevill E, Chang AB. Vitamin A supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2014;(5):CD006751. https://doi.org/10.1002/14651858.cd006751.pub4
https://doi.org/10.1002/14651858.cd00675...
206 Stephenson A, Brotherwood M, Robert R, Atenafu E, Corey M, Tullis E. Cholecalciferol significantly increases 25-hydroxyvitamin D concentrations in adults with cystic fibrosis. Am J Clin Nutr . 2007;85(5):1307-11.-207207 Jagannath VA, Fedorowicz Z, Thaker V, Chang AB. Vitamin K supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2015;1:CD008482. https://doi.org/10.1002/14651858.cd008482.pub4
https://doi.org/10.1002/14651858.cd00848...
(Nível de evidência: 2 para vitamina E)
(Nível de evidência: 5 para vitamina A)
(Nível de evidência: 3 para vitamina D)
(Nível de evidência: 2 para vitamina K)
OUTROS ASPECTOS
Quando e como deve ser feita a investigação para diabetes em pacientes com fibrose cística?
Aproximadamente 20% dos adolescentes e 40% dos adultos desenvolvem diabetes relacionado à fibrose cística, com piora da nutrição e da função pulmonar e aumento das taxas de morbidade e mortalidade, mesmo em sua fase assintomática.208208 Lewis C, Blackman SM, Nelson A, Oberdorfer E, Wells D, Dunitz J, et al. Diabetes-related mortality in adults with cystic fibrosis. Role of genotype and sex. Am J Respir Crit Care Med. 2015;191(2):194-200. https://doi.org/10.1164/rccm.201403-0576OC
https://doi.org/10.1164/rccm.201403-0576...
Todo paciente com fibrose cística acima de 10 anos de idade deve realizar anualmente o teste de tolerância oral à glicose, com coleta da glicemia em jejum de 8 h e em 2 h após a ingestão de 1,75 g/kg de peso de dextrosol (máximo, 75 g).209209 Moran A, Brunzell C, Cohen RC, Katz M, Marshall BC, Onady G, et al. Clinical care guidelines for cystic fibrosis-related diabetes: a position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. Diabetes Care. 2010;33(12):2697-708. https://doi.org/10.2337/dc10-1768
https://doi.org/10.2337/dc10-1768...
210 Moran A, Pillay K, Becker DJ, Acerini CL; International Society for Pediatric and Adolescent Diabetes. ISPAD Clinical Practice Consensus Guidelines 2014. Management of cystic fibrosis-related diabetes in children and adolescents. Pediatr Diabetes. 2014;15 Suppl 20:65-76. https://doi.org/10.1111/pedi.12178
https://doi.org/10.1111/pedi.12178...
211 Middleton PG, Wagenaar M, Matson AG, Craig ME, Holmes-Walker DJ, Katz T, et al. Australian standards of care for cystic fibrosis-related diabetes. Respirology. 2014;19(2):185-92. https://doi.org/10.1111/resp.12227
https://doi.org/10.1111/resp.12227...
212 Lanng S, Hansen A, Thorsteinsson B, Nerup J, Koch C. Glucose tolerance in patients with cystic fibrosis: five year prospective study. BMJ. 1995;311(7006):655-9. https://doi.org/10.1136/bmj.311.7006.655
https://doi.org/10.1136/bmj.311.7006.655...
-213213 Sermet-Gaudelus I, Castanet M, Retsch-Bogart G, Aris RM. Update on cystic fibrosis-related bone disease: a special focus on children. Paediatr Respir Rev. 2009;10(3):134-42. https://doi.org/10.1016/j.prrv.2009.05.001
https://doi.org/10.1016/j.prrv.2009.05.0...
O teste de tolerância oral à glicose deve ser realizado preferencialmente em momento de estabilidade clínica.
Recomenda-se também sua realização em pacientes com piora clínica inexplicável, antes de transplante, em uso de corticosteroides sistêmicos, antes e durante a gestação e em pacientes em uso de alimentação enteral como suporte nutricional.
Os valores para o diagnóstico de diabetes relacionado à fibrose cística são semelhantes aos de diabetes não relacionados à fibrose cística (Tabela 7).
(Nível de evidência: 2)
Qual é o tratamento atual recomendado para diabetes relacionado à fibrose cística?
O tratamento do diabetes relacionado à fibrose cística é o uso de insulina.208208 Lewis C, Blackman SM, Nelson A, Oberdorfer E, Wells D, Dunitz J, et al. Diabetes-related mortality in adults with cystic fibrosis. Role of genotype and sex. Am J Respir Crit Care Med. 2015;191(2):194-200. https://doi.org/10.1164/rccm.201403-0576OC
https://doi.org/10.1164/rccm.201403-0576...
209 Moran A, Brunzell C, Cohen RC, Katz M, Marshall BC, Onady G, et al. Clinical care guidelines for cystic fibrosis-related diabetes: a position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. Diabetes Care. 2010;33(12):2697-708. https://doi.org/10.2337/dc10-1768
https://doi.org/10.2337/dc10-1768...
-210210 Moran A, Pillay K, Becker DJ, Acerini CL; International Society for Pediatric and Adolescent Diabetes. ISPAD Clinical Practice Consensus Guidelines 2014. Management of cystic fibrosis-related diabetes in children and adolescents. Pediatr Diabetes. 2014;15 Suppl 20:65-76. https://doi.org/10.1111/pedi.12178
https://doi.org/10.1111/pedi.12178...
As doses médias de insulina variam entre 0,38 e 0,58 UI/kg/dia,214214 Sunni M, Bellin MD, Moran A. Exogenous insulin requirements do not differ between youth and adults with cystic fibrosis related diabetes. Pediatr Diabetes. 2013;14(4):295-8. https://doi.org/10.1111/pedi.12014
https://doi.org/10.1111/pedi.12014...
) distribuídas entre insulina basal lenta e insulina rápida ou ultrarrápida nas refeições. Calorias e carboidratos não devem ser restringidos, mas deve-se optar por carboidratos complexos e de baixo índice glicêmico e distribuí-los em porções e intervalos menores (2-3 h). Pacientes com alterações glicêmicas durante as exacerbações podem se beneficiar de insulinização intermitente. Não há consenso definido quanto ao tratamento da intolerância à glicose.
(Nível de evidência: 2 para tratamento com insulina)
(Nível de evidência: 3 para a recomendação quanto a calorias e carboidratos)
Quando e como deve ser feita a investigação de osteopenia/osteoporose na fibrose cística?
A baixa densidade mineral óssea é comum na fibrose cística, podendo ocorrer desde a infância. A densitometria óssea é o exame padrão ouro para sua investigação, devendo ser realizada a partir de 8-10 anos de idade. Em menores de 20 anos, os locais para a avaliação são corpo total e coluna lombar e, para os maiores de 20 anos, quadril e coluna lombar. Os resultados devem ser ajustados para sexo, idade e etnia e expressos em escore Z para pacientes < 50 anos e em escore T para pacientes > 50 anos e mulheres em menopausa. A densitometria óssea deve ser repetida a cada 1-5 anos, dependendo da classificação clínica dos achados.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,215215 Aris RM, Merkel PA, Bachrach LK, Borowitz DS, Boyle MP, Elkin SL, et al. Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab. 2005;90(3):1888-96. https://doi.org/10.1210/jc.2004-1629
https://doi.org/10.1210/jc.2004-1629...
(Nível de evidência: 4 para locais de avaliação da densitometria óssea)
(Nível de evidência: 5 para confirmar a indicação da densitometria óssea)
Qual é o tratamento recomendado para osteoporose/osteopenia na fibrose cística?
Para a prevenção da perda de massa óssea, recomenda-se manter o estado nutricional adequado, praticar exercícios físicos de baixo impacto e evitar uso de corticosteroide inalatório ou oral.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,215215 Aris RM, Merkel PA, Bachrach LK, Borowitz DS, Boyle MP, Elkin SL, et al. Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab. 2005;90(3):1888-96. https://doi.org/10.1210/jc.2004-1629
https://doi.org/10.1210/jc.2004-1629...
(Nível de evidência: 5)
Se a presença de osteopenia for confirmada (escore Z entre −1,0 e −2,5), realizar suplementação de vitamina D, vitamina K e cálcio.216216 Haworth CS, Jones AM, Adams JE, Selby PL, Webb AK. Randomised double blind placebo controlled trial investigating the effect of calcium and vitamin D supplementation on bone mineral density and bone metabolism in adult patients with cystic fibrosis. J Cyst Fibros. 2004;3(4):233-6. https://doi.org/10.1016/j.jcf.2004.08.002
https://doi.org/10.1016/j.jcf.2004.08.00...
(Nível de evidência: 2)
Se a presença de osteoporose for confirmada (escore Z < −2,5), acrescentar bifosfonatos: alendronato v.o. (70 mg/semana ou 10 mg/dia); risedronato v.o. (35 mg/semana ou 5 mg/dia); pamidronato i.v. (0,5-1,0 mg/kg/dia por 3 dias a cada 3 meses); ou ácido zoledrônico i.v. (0,025-0,05 mg/kg/dia em dose única a cada 6 meses).213213 Sermet-Gaudelus I, Castanet M, Retsch-Bogart G, Aris RM. Update on cystic fibrosis-related bone disease: a special focus on children. Paediatr Respir Rev. 2009;10(3):134-42. https://doi.org/10.1016/j.prrv.2009.05.001
https://doi.org/10.1016/j.prrv.2009.05.0...
,217217 Conwell LS, Chang AB. Bisphosphonates for osteoporosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(3):CD002010. https://doi.org/10.1002/14651858.cd002010.pub4
https://doi.org/10.1002/14651858.cd00201...
(Nível de evidência: 1 para bifosfonatos)
Quando considerar o uso e quais são as opções para o acesso venoso de longa permanência?
A avaliação da necessidade do uso de dispositivo intravenoso de longa permanência baseia-se no tempo de terapia previsto, nas características das drogas, tais como pH (< 5 ou > 9), osmolaridade (> 600 mOsmol/l) e capacidade irritante das drogas, assim como na durabilidade do dispositivo intravenoso, nas condições clínicas do paciente e na possibilidade de complicações associadas (Figura 3).218218 Santolim TQ, Santos LA, Giovani AM, Dias VC. The strategic role of the nurse in the selection of IV devices. Br J Nurs. 2012;21(21):S28, S30-2.
Seleção do dispositivo endovenoso de longa permanência. PICC: peripherally inserted central catheter (cateter central de inserção periférica). Adaptado de Santolim et al.218218 Santolim TQ, Santos LA, Giovani AM, Dias VC. The strategic role of the nurse in the selection of IV devices. Br J Nurs. 2012;21(21):S28, S30-2.
Entre as opções de dispositivos para acesso de longa permanência incluem-se o cateter central de inserção periférica, o cateter venoso central (Intracath®; Becton Dickinson, Sandy, UT, EUA), os tunelizáveis (por exemplo, do tipo Hickman) e os totalmente implantáveis (PORT-A-CATH®; Smiths Medical, Minneapolis, MN, EUA). Na rede venosa preservada, a primeira opção é o cateter central de inserção periférica valvulado, o qual permite utilização intermitente.218218 Santolim TQ, Santos LA, Giovani AM, Dias VC. The strategic role of the nurse in the selection of IV devices. Br J Nurs. 2012;21(21):S28, S30-2.
(Nível de evidência: 4 para acesso venoso)
Quando e como deve ser realizada a abordagem da sinusopatia na fibrose cística?
Manifestações nasossinusais da fibrose cística são comuns, principalmente a obstrução nasal por polipose nasal e rinossinusite crônica. A extensão da doença nasossinusal pode não se correlacionar com os sintomas.
O paciente deve ter avaliação otorrinolaringológica de rotina, já que a sinusopatia pode estar relacionada às exacerbações do quadro pulmonar. Exames de imagem estão indicados somente para planejamento cirúrgico ou investigação de quadros complicados.219219 Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allergy. 2013;27(5):387-95. https://doi.org/10.2500/ajra.2013.27.3919
https://doi.org/10.2500/ajra.2013.27.391...
O tratamento da doença nasossinusal na fibrose cística consiste em drogas anti-inflamatórias, antibióticos, medicações tópicas e cirurgia.219219 Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allergy. 2013;27(5):387-95. https://doi.org/10.2500/ajra.2013.27.3919
https://doi.org/10.2500/ajra.2013.27.391...
,220220 Robertson JM, Friedman EM, Rubin BK. Nasal and sinus disease in cystic fibrosis. Paediatr Respir Rev. 2008;9(3):213-9. https://doi.org/10.1016/j.prrv.2008.04.003
https://doi.org/10.1016/j.prrv.2008.04.0...
Um estudo com alfa dornase nasal em pacientes em pós-cirurgia endoscópica nasal mostrou benefícios. Entretanto, a efetividade depende do alargamento cirúrgico dos óstios paranasais para permitir a chegada do medicamento à mucosa sinusal.219219 Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allergy. 2013;27(5):387-95. https://doi.org/10.2500/ajra.2013.27.3919
https://doi.org/10.2500/ajra.2013.27.391...
,221221 Cimmino M, Nardone M, Cavaliere M, Plantulli A, Sepe A, Esposito V, et al. Dornase alfa as postoperative therapy in cystic fibrosis sinonasal disease. Arch Otolaryngol Head Neck Surg. 2005;131(12):1097-101. https://doi.org/10.1001/archotol.131.12.1097
https://doi.org/10.1001/archotol.131.12....
222 Mainz JG, Schien C, Schiller I, Schädlich K, Koitschev A, Koitschev C, et al. Sinonasal inhalation of dornase alfa administered by vibrating aerosol to cystic fibrosis patients: a double-blind placebo-controlled cross-over trial. J Cyst Fibros. 2014;13(4):461-70. https://doi.org/10.1016/j.jcf.2014.02.005
https://doi.org/10.1016/j.jcf.2014.02.00...
-223223 Mainz JG, Schiller I, Ritschel C, Mentzel HJ, Riethmüller J, Koitschev A, et al. Sinonasal inhalation of dornase alfa in CF: A double-blind placebo-controlled cross-over pilot trial. Auris Nasus Larynx. 2011;38(2):220-7. https://doi.org/10.1016/j.anl.2010.09.001
https://doi.org/10.1016/j.anl.2010.09.00...
Em relação aos corticosteroides tópicos nasais, estudos têm demonstrado efeitos positivos desses tanto na melhora de sintomas nasais como na redução de pólipos.224224 Hadfield PJ, Rowe-Jones JM, Mackay IS. A prospective treatment trial of nasal polyps in adults with cystic fibrosis. Rhinology. 2000;38(2):63-5.,225225 Beer H, Southern KW, Swift AC. Topical nasal steroids for treating nasal polyposis in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD008253. https://doi.org/10.1002/14651858.cd008253.pub4
https://doi.org/10.1002/14651858.cd00825...
O tratamento cirúrgico deve ser considerado na persistência da obstrução nasal mesmo após o tratamento clínico, nos casos de obstrução anatômica, quando há relação com exacerbações pulmonares, nos casos de transplante pulmonar ou naqueles cujos sintomas afetam a qualidade de vida.219219 Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allergy. 2013;27(5):387-95. https://doi.org/10.2500/ajra.2013.27.3919
https://doi.org/10.2500/ajra.2013.27.391...
Não existem estudos quanto ao uso de mucocinéticos, e as recomendações são extrapoladas a partir de pacientes sem fibrose cística. É advogado que a solução salina a 7% seria mais adequada na fibrose cística devido ao seu efeito mucocinético, mas o uso de soluções salinas a 3% é mais difundido.
(Nível de evidência: 2 para alfa dornase)
(Nível de evidência: 3 para tratamento cirúrgico)
(Nível de evidência: 5 para demais recomendações)
Quando indicar e referenciar o paciente para o transplante pulmonar?
O transplante pulmonar deve ser considerado nos pacientes com fibrose cística e expectativa de vida prevista menor do que 50% em 2 anos e que tenham limitações funcionais classe III ou IV segundo a New York Heart Association. Embora não haja um indicador claro de sobrevida em 2 anos, a queda do VEF1 abaixo de 30% é relacionada a uma mortalidade em 2 anos em torno de 40% no sexo masculino e de 55% no sexo feminino. Como o tempo médio de espera em lista para transplante pulmonar é de aproximadamente 2 anos, pacientes adultos com fibrose cística devem ser D: VEF1 < 30%; distância percorrida no teste de caminhada de seis minutos < 400 m; piora clínica ou funcional acelerada, principalmente no sexo feminino; hipoxemia e/ou hipercapnia (PaO2 < 60 mmHg e PaCO2 > 50 mmHg); e pressão sistólica de artéria pulmonar > 35 mmHg. Pacientes com episódios de pneumotórax ou hemoptise devem ser encaminhados precocemente. Em relação à faixa pediátrica, os resultados de longo prazo são menos consistentes e, apesar de os critérios de encaminhamento serem semelhantes aos citados, a indicação deve ser individualizada, levando-se em conta a disponibilidade e a expertise da equipe de transplante responsável.2323 Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
https://doi.org/10.1016/j.jcf.2014.03.01...
,226226 Rampolla R. Lung transplantation: an overview of candidacy and outcomes. Ochsner J. 2014;14(4):641-8.
227 Hirche TO, Knoop C, Hebestreit H, Shimmin D, Solé A, Elborn JS, et al. Practical guidelines: lung transplantation in patients with cystic fibrosis. Pulm Med. 2014;2014:621342. Erratum in: Pulm Med. 2015;2015:698460.-228228 Weill D, Benden C, Corris PA, Dark JH, Davis RD, Keshavjee S, et al. A consensus document for the selection of lung transplant candidates: 2014--an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2015;34(1):1-15. https://doi.org/10.1016/j.healun.2014.06.014
https://doi.org/10.1016/j.healun.2014.06...
(Nível de evidência: 5)
Como devem ser os cuidados paliativos em pacientes com fibrose cística e doença pulmonar avançada?
O diálogo franco e aberto sobre a evolução da doença deve ser promovido desde cedo, e os cuidados paliativos devem ser oferecidos pela equipe que trata o paciente. A equipe deve ser treinada e capacitada nos princípios básicos de analgesia e sedação e ser capaz de tratar sintomas, como dor, náusea, ansiedade e dispneia.
Muitas vezes, os cuidados paliativos são instituídos com o restante do tratamento ativo. O desejo do paciente e de seus familiares, não só em termos gerais, mas também quanto ao investimento em situações de emergência e de final de vida, deve ser de conhecimento de toda equipe.229229 Sands D, Repetto T, Dupont LJ, Korzeniewska-Eksterowicz A, Catastini P, Madge S. End of life care for patients with cystic fibrosis. J Cyst Fibros. 2011;10 Suppl 2:S37-44. https://doi.org/10.1016/S1569-1993(11)60007-6
https://doi.org/10.1016/S1569-1993(11)60...
(Nível de evidência: 5)
Quais são as recomendações em relação ao uso de métodos contraceptivos para pacientes com fibrose cística?
As pacientes com fibrose cística devem ser orientadas em relação aos métodos contraceptivos disponíveis (métodos hormonais, dispositivos intrauterinos, métodos de barreira e esterilização).230230 Plant BJ, Goss CH, Tonelli MR, McDonald G, Black RA, Aitken ML. Contraceptive practices in women with cystic fibrosis. J Cyst Fibros. 2008;7(5):412-4. https://doi.org/10.1016/j.jcf.2008.03.001
https://doi.org/10.1016/j.jcf.2008.03.00...
A eficácia desses métodos é semelhante àquela para população geral, exceto pela menor atividade dos anticoncepcionais hormonais com o uso das novas drogas (ivacaftor e lumacaftor).231231 Wainwright CE, Elborn JS, Ramsey BW, Marigowda G, Huang X, Cipolli M. Lumacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del CFTR. N Engl J Med. 2015;373(3):220-31. https://doi.org/10.1056/NEJMoa1409547
https://doi.org/10.1056/NEJMoa1409547...
Pacientes do sexo masculino, apesar do fato de que quase todos são inférteis, devem ser orientados sobre os riscos de doenças sexualmente transmissíveis. Apesar de haver evidências de maior gravidade no uso de anticoncepcionais orais no sexo feminino, supostamente relacionada a questões hormonais, seu uso não parece influenciar a evolução da fibrose cística.232232 Kernan NG, Alton EW, Cullinan P, Griesenbach U, Bilton D. Oral contraceptives do not appear to affect cystic fibrosis disease severity. Eur Respir J. 2013;41(1):67-73. https://doi.org/10.1183/09031936.00018712
https://doi.org/10.1183/09031936.0001871...
O aconselhamento genético deve ser oferecido a todos os pacientes e seus familiares, facilitando a prevenção da fibrose cística nas famílias afetadas.
(Nível de evidência: 5 para indicação de anticoncepcionais)
(Nível de evidência: 5 para aconselhamento genético)
Como abordar a gravidez na fibrose cística?
A gestante com fibrose cística deve ser acompanhada assiduamente pela equipe multidisciplinar e por um obstetra com experiência em gestação de alto risco. O teste de tolerância oral à glicose e ultrassonografias devem ser realizados trimestralmente, assim como o monitoramento nutricional e da função pulmonar.
As exacerbações respiratórias devem ser tratadas agressivamente. A maioria das drogas usadas no tratamento da fibrose cística não compromete o feto. Sempre que possível, o parto deve ser via vaginal com anestesia peridural.233233 Government of South Australia. Department for Health and Ageing. SA Maternal & Neonatal Clinical Network. Clinical practice guideline on cystic fibrosis in pregnancy. 3rd ed. Adelaide: Department for Health and Ageing; 2015.
234 Edenborough FP, Borgo G, Knoop C, Lannefors L, Mackenzie WE, Madge S, et al. Guidelines for the management of pregnancy in women with cystic fibrosis. J Cyst Fibros. 2008;7 Suppl 1:S2-32. https://doi.org/10.1016/j.jcf.2007.10.001
https://doi.org/10.1016/j.jcf.2007.10.00...
235 Goddard J, Bourke SJ. Cystic fibrosis and pregnancy. TOG. 2009;11(1):19-24. https://doi.org/10.1576/toag.11.1.19.27464
https://doi.org/10.1576/toag.11.1.19.274...
-236236 McMullen AH, Pasta DJ, Frederick PD, Konstan MW, Morgan WJ, Schechter MS, et al. Impact of pregnancy on women with cystic fibrosis. Chest. 2006;129(3):706-11. https://doi.org/10.1378/chest.129.3.706
https://doi.org/10.1378/chest.129.3.706...
(Nível de evidência: 5 para parto vaginal)
Qual é a melhor maneira de abordar a infertilidade na fibrose cística?
A infertilidade ou a subfertilidade em ambos os sexos costuma acompanhar a fibrose cística. Enquanto a infertilidade feminina parece estar relacionada ao espessamento do muco cervical, nos homens, essa se relaciona à ausência congênita e bilateral dos ductos deferentes.237237 Chan HC, Ruan YC, He Q, Chen MH, Chen H, Xu WM, et al. The cystic fibrosis transmembrane conductance regulator in reproductive health and disease. J Physiol. 2009;587(Pt 10):2187-95. https://doi.org/10.1113/jphysiol.2008.164970
https://doi.org/10.1113/jphysiol.2008.16...
O espermograma deve ser oferecido a todo paciente interessado em conhecer seu nível de fertilidade.1010 Elborn JS, Bell SC, Madge SL, Burgel PR, Castellani C, Conway S, et al. Report of the European Respiratory Society/European Cystic Fibrosis Society task force on the care of adults with cystic fibrosis. Eur Respir J. 2016;47(2):420-8. https://doi.org/10.1183/13993003.00592-2015
https://doi.org/10.1183/13993003.00592-2...
Os centros de referência devem proporcionar acesso a vários especialistas, incluindo ginecologistas, urologistas, geneticistas e especialistas em reprodução humana, para orientar casais e pacientes sobre as estratégias de investigação e de tratamento da infertilidade.238238 Kerem E, Conway S, Elborn S, Heijerman H; Consensus Committee. Standards of care for patients with cystic fibrosis: a European consensus. J Cyst Fibros. 2005;4(1):7-26. https://doi.org/10.1016/j.jcf.2004.12.002
https://doi.org/10.1016/j.jcf.2004.12.00...
(Nível de evidência: 5)
Qual é a importância da adesão ao tratamento na fibrose cística?
As terapias recomendadas para o tratamento da fibrose cística, apesar de sua comprovada eficácia na sobrevida, causam uma sobrecarga ao paciente, interferem na sua qualidade de vida e tornam sua adesão problemática devido à complexidade dos regimes terapêuticos.
Estratégias para vencer barreiras e intervenções psicossociais apropriadas para melhorar a adesão devem ser implementadas pelos profissionais dos centros especializados. A comunicação e a discussão abertas poderão identificar as barreiras-chave, com resolução dos problemas inerentes a cada núcleo familiar. Essas ações são essenciais, uma vez que a adequada adesão às ações inerentes à doença está relacionada a benefícios clínicos expressivos.239239 Duff AJ, Latchford GJ. Motivational interviewing for adherence problems in cystic fibrosis. Pediatr Pulmonol. 2010;45(3):211-20. https://doi.org/10.1002/ppul.21103
https://doi.org/10.1002/ppul.21103...
240 Quittner AL, Zhang J, Marynchenko M, Chopra PA, Signorovitch J, Yushkina Y, et al. Pulmonary medication adherence and health-care use in cystic fibrosis. Chest. 2014;146(1):142-51. https://doi.org/10.1378/chest.13-1926
https://doi.org/10.1378/chest.13-1926...
241 Sawicki GS, Sellers DE, Robinson WM. High treatment burden in adults with cystic fibrosis: challenges to disease self-management. J Cyst Fibros. 2009;8(2):91-6. https://doi.org/10.1016/j.jcf.2008.09.007
https://doi.org/10.1016/j.jcf.2008.09.00...
-242242 Ziaian T, Sawyer MG, Reynolds KE, Carbone JA, Clark JJ, Baghurst PA, et al. Treatment burden and health-related quality of life of children with diabetes, cystic fibrosis and asthma. J Paediatr Child Health. 2006;42(10):596-600. https://doi.org/10.1111/j.1440-1754.2006.00943.x
https://doi.org/10.1111/j.1440-1754.2006...
(Nível de evidência: 5)
Qual é a relevância da ansiedade e depressão no manejo dos pacientes com fibrose cística?
A prevalência de ansiedade e depressão entre pacientes com fibrose cística é extremamente elevada, sobretudo em mulheres. Taxas elevadas também são encontradas nos pais. O centro de referência deve estar preparado para identificar e oferecer suporte e tratamento para pacientes e familiares. A equipe multidisciplinar deve estar atenta para a identificação dessas comorbidades, e sugere-se um rastreamento anual através de questionários específicos ou conversas estruturadas. Diante da suspeita de ansiedade ou depressão, a avaliação por um profissional capacitado pode confirmar o diagnóstico e permitir intervenções psicológicas e/ou medicamentosas.243243 Quittner AL, Abbott J, Georgiopoulos AM, Goldbeck L, Smith B, Hempstead SE, et al. International Committee on Mental Health in Cystic Fibrosis: Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus statements for screening and treating depression and anxiety. Thorax. 2016;71(1):26-34. https://doi.org/10.1136/thoraxjnl-2015-207488
https://doi.org/10.1136/thoraxjnl-2015-2...
(Nível de evidência: 5)
CONSIDERAÇÕES FINAIS
O cenário da fibrose cística no país e no mundo vem sofrendo mudanças drásticas, decorrentes da incorporação de novas tecnologias para o diagnóstico e tratamento da doença. Nesse contexto, a expectativa de vida dos pacientes vem aumentado significativamente, o que trará a necessidade de mudanças na atuação dos profissionais de saúde e de incorporação de novos recursos terapêuticos.
Os pacientes com fibrose cística apresentam necessidades complexas para o manejo da sua doença, necessitando de atendimento especializado que envolva uma equipe multidisciplinar, além de uma adequada estrutura de saúde e acesso a recursos médicos avançados.
As presentes diretrizes foram elaboradas em parceria com diversas sociedades médicas brasileiras e receberam contribuições de diversos profissionais brasileiros envolvidos na atenção aos pacientes com fibrose cística, visando a homogeneização do diagnóstico e do tratamento da doença em todo o território nacional.
AGRADECIMENTOS
Os nomes listados (em ordem alfabética) responderam as perguntas referentes às categorias destas diretrizes e compõem o Grupo de Trabalho das Diretrizes Brasileiras de Diagnóstico e Tratamento da Fibrose Cística:
Características de um centro de referência: Leonardo Araújo Pinto, Luciana Freitas Velloso Monte, Laurinda Yoko Shinzato Higa e Tania Wrobel Folescu.
Diagnóstico: Fernando Augusto de Lima Marson, Isabela Sad, Maria de Fátima Correa Pimenta Servidoni, Paulo Kussek e Salmo Raskin.
Tratamento da doença respiratória: Adriana Della Zuana, Albin Augustin, Anneliese Hoffmann, Beatriz Barbisan, Bruno Hochhegger, Carlos Emilio Levy, Claudine Sarmento da Veiga, Claudio Ricachinevsky, Concetta Esposito, Dante Escuissato, Diego Brandemburgo, Elisabeth Marques, Evanirso de Aquino, Gilberto Bueno Fischer, Joaquim Carlos Rodrigues, Leonardo Araújo Pinto, Leticia Machado, Lucia Muramato, Luciana Freitas Velloso Monte, Lusmaia Damasceno Camargo Costa, Marcio Donadio, Marcos César Santos de Castro, Maria Angela Ribeiro, Maria Angélica Santana, Mariane Canan, Marina Buarque de Almeida, Murilo Britto, Paulo Roth Tarso Dalcin, Regina Terse Trindade Ramos, Sonia Chiba e Valéria de Carvalho Martins.
Tratamento gastrointestinal e nutricional: Claudine Lacerda, Eliana Barbosa, Elizabet Vilar Guimarães, Gabriel Hessel, Jocemara Gurmini, Lenycia Neri, Marcelo Coelho Nogueira, Mônica Chang Wayhs e Miriam Isabel Santos Simon.
Outros aspectos: Arlene Gonçalves dos Santos Fernandes, Claudia de Castro de Silva, Concetta Esposito, Cristiano Túlio Maciel Albuquerque, Edna Lúcia Souza, Fernando Antonio de Abreu e Silva, Paulo de Tarso Dalcin, Renata Maria de Noronha, Ricardo Teixeira, Sandra Helena Machado, Spencer Marcantonio Camargo, Tatiana Rozov, Ticiana da Costa Rodrigues e Valéria de Carvalho Martins.
REFERENCES
-
1Raskin S, Pereira-Ferrari L, Reis FC, Abreu F, Marostica P, Rozov T, et al. Incidence of cystic fibrosis in five different states of Brazil as determined by screening of p.F508del, mutation at the CFTR gene in newborns and patients. J Cyst Fibros. 2008;7(1):15-22. https://doi.org/10.1016/j.jcf.2007.03.006
» https://doi.org/10.1016/j.jcf.2007.03.006 -
2Ong T, Ramsey BW. Update in Cystic Fibrosis 2014. Am J Respir Crit Care Med. 2015;192(6):669-75. https://doi.org/10.1164/rccm.201504-0656UP
» https://doi.org/10.1164/rccm.201504-0656UP -
3Stoltz DA, Meyerholz DK, Welsh MJ. Origins of cystic fibrosis lung disease. N Engl J Med. 2015;372(4):351-62. https://doi.org/10.1056/NEJMra1300109
» https://doi.org/10.1056/NEJMra1300109 -
4Boyle MP. Nonclassic cystic fibrosis and CFTR-related diseases. Curr Opin Pulm Med. 2003;9(6):498-503. https://doi.org/10.1097/00063198-200311000-00009
» https://doi.org/10.1097/00063198-200311000-00009 -
5Conway S, Balfour-Lynn IM, De Rijcke K, Drevinek P, Foweraker J, Havermans T, et al. European Cystic Fibrosis Society Standards of Care: Framework for the Cystic Fibrosis Centre. J Cyst Fibros. 2014;13 Suppl 1:S3-22. https://doi.org/10.1016/j.jcf.2014.03.009
» https://doi.org/10.1016/j.jcf.2014.03.009 -
6Mahadeva R, Webb K, Westerbeek RC, Carroll NR, Dodd ME, Bilton D, et al. Clinical outcome in relation to care in centres specialising in cystic fibrosis: cross sectional study. BMJ. 1998;316(7147):1771-5. https://doi.org/10.1136/bmj.316.7147.1771
» https://doi.org/10.1136/bmj.316.7147.1771 -
7Johnson C, Butler SM, Konstan MW, Morgan W, Wohl MEB. Factors influencing outcomes in cystic fibrosis: a center-based analysis. Chest. 2003;123(1):20-7. https://doi.org/10.1378/chest.123.1.20
» https://doi.org/10.1378/chest.123.1.20 -
8Bell SC, Robinson PJ, Fitzgerald DS. Cystic fibrosis standards of care Australia. Sidney: Cystic Fibrosis Australia; 2008.
-
9Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2016 Nov 1; cited 2017 Feb 1]. Standards for the Clinical Care of Children and Adults with cystic fibrosis in the UK. Second edition. December 2011. [Adobe Acrobat document, 32p.]. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/clinical-care/consensus-documents
» https://www.cysticfibrosis.org.uk/the-work-we-do/clinical-care/consensus-documents -
10Elborn JS, Bell SC, Madge SL, Burgel PR, Castellani C, Conway S, et al. Report of the European Respiratory Society/European Cystic Fibrosis Society task force on the care of adults with cystic fibrosis. Eur Respir J. 2016;47(2):420-8. https://doi.org/10.1183/13993003.00592-2015
» https://doi.org/10.1183/13993003.00592-2015 -
11Okumura MJ, Kleinhenz ME. Cystic Fibrosis Transitions of Care: Lessons Learned and Future Directions for Cystic Fibrosis. Clin Chest Med. 2016;37(1):119-26. https://doi.org/10.1016/j.ccm.2015.11.007
» https://doi.org/10.1016/j.ccm.2015.11.007 -
12Okumura MJ, Ong T, Dawson D, Nielson D, Lewis N, Richards M, et al. Improving transition from paediatric to adult cystic fibrosis care: programme implementation and evaluation. BMJ Qual Saf. 2014;23 Suppl 1:i64-i72. https://doi.org/10.1136/bmjqs-2013-002364
» https://doi.org/10.1136/bmjqs-2013-002364 -
13Duguépéroux I, Tamalet A, Sermet-Gaudelus I, Le Bourgeois M, Gérardin M, Desmazes-Dufeu N, et al. Clinical changes of patients with cystic fibrosis during transition from pediatric to adult care. ?J Adolesc Health. 2008;43(5):459-65. https://doi.org/10.1016/j.jadohealth.2008.03.005
» https://doi.org/10.1016/j.jadohealth.2008.03.005 -
14Reid GJ, Irvine MJ, McCrindle BW, Sananes R, Ritvo PG, Siu SC, et al. Prevalence and correlates of successful transfer from pediatric to adult health care among a cohort of young adults with complex congenital heart defects. Pediatrics. 2004;113(3 Pt 1):e197-205. https://doi.org/10.1542/peds.113.3.e197
» https://doi.org/10.1542/peds.113.3.e197 -
15Chaudhry SR, Keaton M, Nasr SZ. Evaluation of a cystic fibrosis transition program from pediatric to adult care. Pediatr Pulmonol. 2013;48(7):658-65. https://doi.org/10.1002/ppul.22647
» https://doi.org/10.1002/ppul.22647 -
16Machado CD, Matos MA, editors. Rede de Atenção à Saúde para Pessoas com Fibrose Cística--Padronização dos Cuidados na Fibrose Cística. Condições de oferta dos centros de referência, cuidados compartilhados, cuidados de transição e internação. [monograph on the Internet]. Belo Horizonte: Secretaria de Estado de Saúde de Minas Gerais; 2012 [cited 2017 Feb 1]. Available from: http://www.saude.mg.gov.br/images/documentos/Livro%20REDE%20DE%20ATENCaO%20A%20SAUDE%20PARA%20PESSOAS%20COM%20FIBROSE%20CISTICA.pdf
» http://www.saude.mg.gov.br/images/documentos/Livro%20REDE%20DE%20ATENCaO%20A%20SAUDE%20PARA%20PESSOAS%20COM%20FIBROSE%20CISTICA.pdf -
17Saiman L, Siegel JD, LiPuma JJ, Brown RF, Bryson EA, Chambers MJ, et al. Infection prevention and control guideline for cystic fibrosis: 2013 update. Infect Control Hosp Epidemiol. 2014;35 Suppl 1:S1-S67. https://doi.org/10.1086/676882
» https://doi.org/10.1086/676882 -
18Jain M, Saiman LM, Sabadosa K, LiPuma JJ. Point: does the risk of cross infection warrant exclusion of adults with cystic fibrosis from cystic fibrosis foundation events? Yes. Chest. 2014;145(4):678-80. https://doi.org/10.1378/chest.13-2404
» https://doi.org/10.1378/chest.13-2404 -
19Conway S. Segregation is good for patients with cystic fibrosis. J R Soc Med. 2008;101 Suppl 1:S31-5. https://doi.org/10.1258/jrsm.2008.s18007
» https://doi.org/10.1258/jrsm.2008.s18007 -
20Bhattacharya K, Wotton T, Wiley V. The evolution of blood-spot newborn screening. Transl Pediatr. 2014;3(2):63-70.
-
21Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, Cutting GR, et al. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008;153(2):S4-S14. https://doi.org/10.1016/j.jpeds.2008.05.005
» https://doi.org/10.1016/j.jpeds.2008.05.005 -
22Santos GP, Domingos MT, Wittig EO, Riedi CA, Rosario NA. Neonatal cystic fibrosis screening program in the state of Paraná: evaluation 30 months after implementation [Article in Portuguese]. J Pediatr (Rio J). 2005;81(3):240-4. https://doi.org/10.2223/JPED.1345
» https://doi.org/10.2223/JPED.1345 -
23Smyth AR, Bell SC, Bojcin S, Bryon M, Duff A, Flume P, et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibros. 2014;13 Suppl 1:S23-42. https://doi.org/10.1016/j.jcf.2014.03.010
» https://doi.org/10.1016/j.jcf.2014.03.010 -
24Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1.
-
25Heap S, Griffiths P, Elborn S, Harris B, Wayte A, Wallis CE, et al. Guidelines for the Performance of the Sweat Test for the Investigation of Cystic Fibrosis in the UK, 2nd version [monograph on the Internet] London: Royal College of Paedriatics and Child Health ; 2014 [cited 2017 Feb 1]. Available from: http://www.rcpch.ac.uk/system/files/protected/page/Sweat%20Guideline%20v3%20reformat_2.pdf
» http://www.rcpch.ac.uk/system/files/protected/page/Sweat%20Guideline%20v3%20reformat_2.pdf -
26LeGrys VA, Yankaskas JR, Quittell LM, Marshall BC, Mogayzel PJ Jr; Cystic Fibrosis Foundation. Diagnostic sweat testing: the Cystic Fibrosis Foundation guidelines. J Pediatr. 2007;151(1):85-9. https://doi.org/10.1016/j.jpeds.2007.03.002
» https://doi.org/10.1016/j.jpeds.2007.03.002 -
27Lezana JL, Vargas MH, Karam-Bechara J, Aldana RS, Furuya ME. Sweat conductivity and chloride titration for cystic fibrosis diagnosis in 3834 subjects. J Cyst Fibros. 2003;2(1):1-7. https://doi.org/10.1016/S1569-1993(02)00146-7
» https://doi.org/10.1016/S1569-1993(02)00146-7 -
28Mattar AC, Leone C, Rodrigues JC, Adde FV. Sweat conductivity: an accurate diagnostic test for cystic fibrosis? J Cyst Fibros. 2014;13(5):528-33. https://doi.org/10.1016/j.jcf.2014.01.002
» https://doi.org/10.1016/j.jcf.2014.01.002 -
29Brodlie M, Haq IJ, Roberts K, Elborn JS. Targeted therapies to improve CFTR function in cystic fibrosis. Genome Med. 2015;7:101. https://doi.org/10.1186/s13073-015-0223-6
» https://doi.org/10.1186/s13073-015-0223-6 -
30Pettit RS, Fellner C. CFTR Modulators for the Treatment of Cystic Fibrosis. P T. 2014;39(7):500-11.
-
31Dequeker E, Stuhrmann M, Morris MA, Casals T, Castellani C, Claustres M, et al. Best practice guidelines for molecular genetic diagnosis of cystic fibrosis and CFTR-related disorders--updated European recommendations. Eur J Hum Genet. 2009;17(1):51-65. https://doi.org/10.1038/ejhg.2008.136
» https://doi.org/10.1038/ejhg.2008.136 -
32Castellani C, Cuppens H, Macek M Jr, Cassiman JJ, Kerem E, Durie P, et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibros. 2008;7(3):179-96. https://doi.org/10.1016/j.jcf.2008.03.009
» https://doi.org/10.1016/j.jcf.2008.03.009 -
33De Boeck K, Wilschanski M, Castellani C, Taylor C, Cuppens H, Dodge J, et al. Cystic fibrosis: terminology and diagnostic algorithms. Thorax. 2006;61(7):627-35. https://doi.org/10.1136/thx.2005.043539
» https://doi.org/10.1136/thx.2005.043539 -
34Ferec C, Cutting GR. Assessing the Disease-Liability of Mutations in CFTR. Cold Spring Harb Perspect Med. 2012;2(12):a009480. https://doi.org/10.1101/cshperspect.a009480
» https://doi.org/10.1101/cshperspect.a009480 -
35Moskowitz SM, Chmiel JF, Sternen DL, Cheng E, Gibson RL, Marshall SG, et al. Clinical practice and genetic counseling for cystic fibrosis and CFTR-related disorders. Genet Med. 2008;10(12):851-68. https://doi.org/10.1097/GIM.0b013e31818e55a2
» https://doi.org/10.1097/GIM.0b013e31818e55a2 -
36Beekman JM, Sermet-Gaudelus I, de Boeck K, Gonska T, Derichs N, Mall MA, et al. CFTR functional measurements in human models for diagnosis, prognosis and personalized therapy: Report on the pre-conference meeting to the 11th ECFS Basic Science Conference, Malta, 26-29 March 2014. J Cyst Fibros. 2014;13(4):363-72. https://doi.org/10.1016/j.jcf.2014.05.007
» https://doi.org/10.1016/j.jcf.2014.05.007 -
37De Boeck K, Kent L, Davies J, Derichs N, Amaral M, Rowe SM, et al. CFTR biomarkers: time for promotion to surrogate end-point. Eur Respir J. 2013;41(1):203-16. https://doi.org/10.1183/09031936.00057512
» https://doi.org/10.1183/09031936.00057512 -
38Cuthbertson L, Rogers GB, Walker AW, Oliver A, Hafiz T, Hoffman LR, et al. Time between collection and storage significantly influences bacterial sequence composition in sputum samples from cystic fibrosis respiratory infections. J Clin Microbiol. 2014;52(8):3011-6. https://doi.org/10.1128/JCM.00764-14
» https://doi.org/10.1128/JCM.00764-14 -
39Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [cited 2017 Feb 1]. Laboratory Standards for Processing Microbiological Samples from People with Cystic Fibrosis. 1st edition. September 2010 [Adobe Acrobat document, 40p.]. Available from: https://www.cysticfibrosis.org.uk/~/media/documents/the-work-we-do/care/consensus-docs-with-new-address/laboratory-standards.ashx?la=en
» https://www.cysticfibrosis.org.uk/~/media/documents/the-work-we-do/care/consensus-docs-with-new-address/laboratory-standards.ashx?la=en -
40Lahiri T, Hempstead SE, Brady C, Cannon CL, Clark K, Condren ME, et al. Clinical Practice Guidelines From the Cystic Fibrosis Foundation for Preschoolers With Cystic Fibrosis. Pediatrics. 2016; 137(4). pii: e20151784. https://doi.org/10.1542/peds.2015-1784
» https://doi.org/10.1542/peds.2015-1784 -
41Kiska DL, Riddell SW. Practical Laboratory Aspects of Cystic Fibrosis Microbiology: an Update, Part II. Clin Microbiol Newsl. 2012;34(5):35-41. https://doi.org/10.1016/j.clinmicnews.2012.02.001
» https://doi.org/10.1016/j.clinmicnews.2012.02.001 -
42Gilligan PH. Infections in patients with cystic fibrosis: diagnostic microbiology update. Clin Lab Med. 2014;34(2):197-217. https://doi.org/10.1016/j.cll.2014.02.001
» https://doi.org/10.1016/j.cll.2014.02.001 -
43Gilligan PH, Kiska Dl, Appleman MD. Cystic fibrosis microbiology. Cumitech 43. Washington, DC: ASM Press; 2006.
-
44Burns JL, Rolain JM. Culture-based diagnostic microbiology in cystic fibrosis: can we simplify the complexity? J Cyst Fibros. 2014;13(1):1-9. https://doi.org/10.1016/j.jcf.2013.09.004
» https://doi.org/10.1016/j.jcf.2013.09.004 -
45Caballero Jde D, del Campo R, Tato M, Gómez G de la Pedrosa E, Cobo M, López-Causapé C, et al. Microbiological diagnostic procedures for respiratory cystic fibrosis samples in Spain: towards standard of care practices. BMC Microbiol. 2014;14:335. https://doi.org/10.1186/s12866-014-0335-y
» https://doi.org/10.1186/s12866-014-0335-y -
46Marko DC, Saffert RT, Cunningham SA, Hyman J, Walsh J, Arbefeville S, et al. Evaluation of the Bruker Biotyper and Vitek MS matrix-assisted laser desorption ionization-time of flight mass spectrometry systems for identification of nonfermenting gram-negative bacilli isolated from cultures from cystic fibrosis patients. J Clin Microbiol. 2012;50(6):2034-9. https://doi.org/10.1128/JCM.00330-12
» https://doi.org/10.1128/JCM.00330-12 -
47Habib AR, Manji J, Wilcox PG, Javer AR, Buxton JA, Quon BS. A systematic review of factors associated with health-related quality of life in adolescents and adults with cystic fibrosis. Ann Am Thorac Soc. 2015;12(3):420-8. https://doi.org/10.1513/AnnalsATS.201408-393OC
» https://doi.org/10.1513/AnnalsATS.201408-393OC -
48Rosenfeld M, Allen J, Arets BH, Aurora P, Beydon N, Calogero C, et al. An official American Thoracic Society workshop report: optimal lung function tests for monitoring cystic fibrosis, bronchopulmonary dysplasia, and recurrent wheezing in children less than 6 years of age. Ann Am Thorac Soc. 2013;10(2):S1-S11. https://doi.org/10.1513/AnnalsATS.201301-017ST
» https://doi.org/10.1513/AnnalsATS.201301-017ST -
49Subbarao P, Milla C, Aurora P, Davies JC, Davis SD, Hall GL, et al. Multiple-Breath Washout as a Lung Function Test in Cystic Fibrosis. A Cystic Fibrosis Foundation Workshop Report. Ann Am Thorac Soc. 2015;12(6):932-9. https://doi.org/10.1513/AnnalsATS.201501-021FR
» https://doi.org/10.1513/AnnalsATS.201501-021FR -
50Tridello G, Volpi S, Assael BM, Meneghelli I, Passiu M, Circelli M. Lung function comparison between two decades in cystic fibrosis children: A single centre study. Pediatr Pulmonol. 2015;50(12):1237-43. https://doi.org/10.1002/ppul.23314
» https://doi.org/10.1002/ppul.23314 -
51Cleveland RH, Zurakowski D, Slattery DM, Colin AA. Chest radiographs for outcome assessment in cystic fibrosis. Proc Am Thorac Soc. 2007;4(4):302-5. https://doi.org/10.1513/pats.200611-179HT
» https://doi.org/10.1513/pats.200611-179HT -
52de Jong PA, Lindblad A, Rubin L, Hop WC, de Jongste JC, Brink M, et al. Progression of lung disease on computed tomography and pulmonary function tests in children and adults with cystic fibrosis. Thorax. 2006;61(1):80-5. https://doi.org/10.1136/thx.2005.045146
» https://doi.org/10.1136/thx.2005.045146 -
53Ernst CW, Basten IA, Ilsen B, Buls N, Van Gompel G, De Wachter E, et al. Pulmonary disease in cystic fibrosis: assessment with chest CT at chest radiography dose levels. Radiology. 2014;273(2):597-605. https://doi.org/10.1148/radiol.14132201
» https://doi.org/10.1148/radiol.14132201 -
54Sanders DB, Li Z, Brody AS, Farrell PM. Chest computed tomography scores of severity are associated with future lung disease progression in children with cystic fibrosis. Am J Respir Crit Care Med. 2011;184(7):816-21. https://doi.org/10.1164/rccm.201105-0816OC
» https://doi.org/10.1164/rccm.201105-0816OC -
55Kang EY, Miller RR, Müller NL. Bronchiectasis: comparison of preoperative thin-section CT and pathologic findings in resected specimens. Radiology. 1995;195(3):649-54. https://doi.org/10.1148/radiology.195.3.7753989
» https://doi.org/10.1148/radiology.195.3.7753989 -
56Thia LP, Calder A, Stocks J, Bush A, Owens CM, Wallis C, et al. Is chest CT useful in newborn screened infants with cystic fibrosis at 1 year of age? Thorax. 2014;69(4):320-7. https://doi.org/10.1136/thoraxjnl-2013-204176
» https://doi.org/10.1136/thoraxjnl-2013-204176 -
57Sileo C, Corvol H, Boelle PY, Blondiaux E, Clement A, Ducou Le Pointe H. HRCT and MRI of the lung in children with cystic fibrosis: comparison of different scoring systems. J Cyst Fibros. 2014;13(2):198-204. https://doi.org/10.1016/j.jcf.2013.09.003
» https://doi.org/10.1016/j.jcf.2013.09.003 -
58Sanders DB, Li Z, Brody AS. Chest computed tomography predicts the frequency of pulmonary exacerbations in children with cystic fibrosis. Ann Am Thorac Soc. 2015;12(1):64-9. https://doi.org/10.1513/AnnalsATS.201407-338OC
» https://doi.org/10.1513/AnnalsATS.201407-338OC -
59Robinson TE, Leung AN, Chen X, Moss RB, Emond MJ. Cystic fibrosis HRCT scores correlate strongly with Pseudomonas infection. Pediatr Pulmonol. 2009;44(11):1107-17. https://doi.org/10.1002/ppul.21107
» https://doi.org/10.1002/ppul.21107 -
60Agent P, Parrott H. Inhaled therapy in cystic fibrosis: agents, devices and regimens. Breathe (Sheff). 2015;11(2):110-8. https://doi.org/10.1183/20734735.021014
» https://doi.org/10.1183/20734735.021014 -
61Collins N. Nebulizer therapy in cystic fibrosis: an overview. J R Soc Med. 2009;102 Suppl 1:11-7. https://doi.org/10.1258/jrsm.2009.s19003
» https://doi.org/10.1258/jrsm.2009.s19003 -
62Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Nebuliser therapy in cystic fibrosis. Factsheet. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
» https://www.cysticfibrosis.org.uk/the-work-we-do -
63Geller DE. The science of aerosol delivery in cystic fibrosis. Pediatr Pulmonol. 2008;43(S9):S5-S17. https://doi.org/10.1002/ppul.20860
» https://doi.org/10.1002/ppul.20860 -
64Daniels T, Mills N, Whitaker P. Nebuliser systems for drug delivery in cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD007639.
-
65Laube BL, Janssens HM, de Jongh FH, Devadason SG, Dhand R, Diot P, et al. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J. 2011;37(6):1308-31. https://doi.org/10.1183/09031936.00166410
» https://doi.org/10.1183/09031936.00166410 -
66Della Zuana A, Garcia Dde O, Juliani RC, Silva Filho LV. Effect that an educational program for cystic fibrosis patients and caregivers has on the contamination of home nebulizers. J Bras Pneumol. 2014;40(2):119-27. https://doi.org/10.1590/S1806-37132014000200004
» https://doi.org/10.1590/S1806-37132014000200004 -
67Towle D, Callan DA, Farrel PA, Egan ME, Murray TS. Baby bottle steam sterilizers disinfect home nebulizers inoculated with bacterial respiratory pathogens. J Cyst Fibros. 2013;12(5):512-6. https://doi.org/10.1016/j.jcf.2012.11.013
» https://doi.org/10.1016/j.jcf.2012.11.013 -
68Reychler G, Leonard A, Van Ossel C, Godding V, Gigi J, Simon A, et al. Impact of hypochlorite-based disinfection on bacterial contamination of cystic fibrosis patients' home-nebulisers. J Hosp Infect. 2009;72(4):351-7. https://doi.org/10.1016/j.jhin.2009.05.011
» https://doi.org/10.1016/j.jhin.2009.05.011 -
69Merritt K, Hitchins VM, Brown SA. Safety and cleaning of medical materials and devices. ?J Biomed Mater Res. 2000;53(2):131-6. https://doi.org/10.1002/(SICI)1097-4636(2000)53:2<131::AID-JBM1>3.0.CO;2-I
» https://doi.org/10.1002/(SICI)1097-4636(2000)53:2<131::AID-JBM1>3.0.CO;2-I -
70Warnock L, Gates A. Chest physiotherapy compared to no chest physiotherapy for cystic fibrosis. Cochrane Database Syst Rev. 2015;(12):CD001401. https://doi.org/10.1002/14651858.cd001401.pub3
» https://doi.org/10.1002/14651858.cd001401.pub3 -
71McIlwaine M, Button B, Dwan K. Positive expiratory pressure physiotherapy for airway clearance in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD003147. https://doi.org/10.1002/14651858.cd003147.pub4
» https://doi.org/10.1002/14651858.cd003147.pub4 -
72McIlwaine MP, Alarie N, Davidson GF, Lands LC, Ratjen F, Milner R, et al. Long-term multicentre randomised controlled study of high frequency chest wall oscillation versus positive expiratory pressure mask in cystic fibrosis. Thorax. 2013;68(8):746-51. https://doi.org/10.1136/thoraxjnl-2012-202915
» https://doi.org/10.1136/thoraxjnl-2012-202915 -
73Moran F, Bradley JM, Piper AJ. Non-invasive ventilation for cystic fibrosis. Cochrane Database Syst Rev. 2013;(4):CD002769. https://doi.org/10.1002/14651858.cd002769.pub4
» https://doi.org/10.1002/14651858.cd002769.pub4 -
74Young AC, Wilson JW, Kotsimbos TC, Naughton MT. Randomised placebo controlled trial of non-invasive ventilation for hypercapnia in cystic fibrosis. Thorax. 2008;63(1):72-7. https://doi.org/10.1136/thx.2007.082602
» https://doi.org/10.1136/thx.2007.082602 -
75Holland AE, Denehy L, Ntoumenopoulos G, Naughton MT, Wilson JW. Non-invasive ventilation assists chest physiotherapy in adults with acute exacerbations of cystic fibrosis. Thorax. 2003;58(10):880-4. https://doi.org/10.1136/thorax.58.10.880
» https://doi.org/10.1136/thorax.58.10.880 -
76Lester MK, Flume PA. Airway-clearance therapy guidelines and implementation. Respir Care. 2009;54(6):733-50; discussion 751-3. https://doi.org/10.4187/002013209790983205
» https://doi.org/10.4187/002013209790983205 -
77Radtke T, Nolan SJ, Hebestreit H, Kriemler S. Physical exercise training for cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD002768. https://doi.org/10.1002/14651858.cd002768.pub3
» https://doi.org/10.1002/14651858.cd002768.pub3 -
78Orenstein DM, Hovell MF, Mulvihill M, Keating KK, Hofstetter CR, Kelsey S, et al. Strength vs aerobic training in children with cystic fibrosis: a randomized controlled trial. Chest. 2004;126(4):1204-14. https://doi.org/10.1378/chest.126.4.1204
» https://doi.org/10.1378/chest.126.4.1204 -
79Selvadurai HC, Blimkie CJ, Meyers N, Mellis CM, Cooper PJ, Van Asperen PP. Randomized controlled study of in-hospital exercise training programs in children with cystic fibrosis. Pediatr Pulmonol. 2002;33(3):194-200. https://doi.org/10.1002/ppul.10015
» https://doi.org/10.1002/ppul.10015 -
80Dwyer TJ, Elkins MR, Bye PT. The role of exercise in maintaining health in cystic fibrosis. Curr Opin Pulm Med. 2011;17(6):455-60. https://doi.org/10.1097/mcp.0b013e32834b6af4
» https://doi.org/10.1097/mcp.0b013e32834b6af4 -
81Schindel CS, Hommerding PX, Melo DA, Baptista RR, Marostica PJ, Donadio MV. Physical exercise recommendations improve postural changes found in children and adolescents with cystic fibrosis: a randomized controlled trial. J Pediatr. 2015;166(3):710-6.e2. https://doi.org/10.1016/j.jpeds.2014.12.001
» https://doi.org/10.1016/j.jpeds.2014.12.001 -
82Rovedder PM, Flores J, Ziegler B, Casarotto F, Jaques P, Barreto SS, et al. Exercise programme in patients with cystic fibrosis: a randomized controlled trial. Respir Med. 2014;108(8):1134-40. https://doi.org/10.1016/j.rmed.2014.04.022
» https://doi.org/10.1016/j.rmed.2014.04.022 -
83Flume PA, O'Sullivan BP, Robinson KA, Goss CH, Mogayzel PJ Jr, Willey-Courand DB, et al. Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2007;176(10):957-69. https://doi.org/10.1164/rccm.200705-664OC
» https://doi.org/10.1164/rccm.200705-664OC -
84Fuchs HJ, Borowitz DS, Christiansen DH, Morris EM, Nash ML, Ramsey BW, et al. Effect of aerosolized recombinant human DNase on exacerbations of respiratory symptoms and on pulmonary function in patients with cystic fibrosis. The Pulmozyme Study Group. N Engl J Med. 1994;331(10):637-42. https://doi.org/10.1056/NEJM199409083311003
» https://doi.org/10.1056/NEJM199409083311003 -
85Jones AP, Wallis C. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev. 2010;(3):CD001127. https://doi.org/10.1002/14651858.cd001127.pub2
» https://doi.org/10.1002/14651858.cd001127.pub2 -
86Konstan MW, Wagener JS, Pasta DJ, Millar SJ, Jacobs JR, Yegin A, et al. Clinical use of dornase alpha is associated with a slower rate of FEV1 decline in cystic fibrosis. Pediatr Pulmonol. 2011;46(6):545-53. https://doi.org/10.1002/ppul.21388
» https://doi.org/10.1002/ppul.21388 -
87Mogayzel PJ Jr, Naureckas ET, Robinson KA, Mueller G, Hadjiliadis D, Hoag JB, et al. Cystic fibrosis pulmonary guidelines. Chronic medications for maintenance of lung health. Am J Respir Crit Care Med. 2013;187(7):680-9. https://doi.org/10.1164/rccm.201207-1160OE
» https://doi.org/10.1164/rccm.201207-1160OE -
88Quan JM, Tiddens HA, Sy JP, McKenzie SG, Montgomery MD, Robinson PJ, et al. A two-year randomized, placebo-controlled trial of dornase alfa in young patients with cystic fibrosis with mild lung function abnormalities. J Pediatr. 2001;139(6):813-20. https://doi.org/10.1067/mpd.2001.118570
» https://doi.org/10.1067/mpd.2001.118570 -
89Rozov T, de Oliveira VZ, Santana MA, Adde FV, Mendes RH, Paschoal IA, et al. Dornase alfa improves the health-related quality of life among Brazilian patients with cystic fibrosis--a one-year prospective study. Pediatr Pulmonol. 2010;45(9):874-82. https://doi.org/10.1002/ppul.21267
» https://doi.org/10.1002/ppul.21267 -
90McCoy K, Hamilton S, Johnson C. Effects of 12-week administration of dornase alfa in patients with advanced cystic fibrosis lung disease. Pulmozyme Study Group. Chest. 1996;110(4):889-95. https://doi.org/10.1378/chest.110.4.889
» https://doi.org/10.1378/chest.110.4.889 -
91Suri R, Grieve R, Normand C, Metcalfe C, Thompson S, Wallis C, et al. Effects of hypertonic saline, alternate day and daily rhDNase on healthcare use, costs and outcomes in children with cystic fibrosis. Thorax. 2002;57(10):841-6. https://doi.org/10.1136/thorax.57.10.841
» https://doi.org/10.1136/thorax.57.10.841 -
92Suri R, Metcalfe C, Lees B, Grieve R, Flather M, Normand C, et al. Comparison of hypertonic saline and alternate-day or daily recombinant human deoxyribonuclease in children with cystic fibrosis: a randomised trial. Lancet. 2001;358(9290):1316-21. https://doi.org/10.1016/S0140-6736(01)06412-1
» https://doi.org/10.1016/S0140-6736(01)06412-1 -
93Fitzgerald DA, Hilton J, Jepson B, Smith L. A crossover, randomized, controlled trial of dornase alfa before versus after physiotherapy in cystic fibrosis. Pediatrics. 2005;116(4):e549-54. https://doi.org/10.1542/peds.2005-0308
» https://doi.org/10.1542/peds.2005-0308 -
94Yang C, Chilvers M, Montgomery M, Nolan SJ. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev. 2016;4:CD001127. https://doi.org/10.1002/14651858.cd001127.pub3
» https://doi.org/10.1002/14651858.cd001127.pub3 -
95Berge MT, Wiel E, Tiddens HA, Merkus PJ, Hop WC, de Jongste JC. DNase in stable cystic fibrosis infants: a pilot study. J Cyst Fibros. 2003;2(4):183-8. https://doi.org/10.1016/S1569-1993(03)00090-0
» https://doi.org/10.1016/S1569-1993(03)00090-0 -
96Nasr SZ, Kuhns LR, Brown RW, Hurwitz ME, Sanders GM, Strouse PJ. Use of computerized tomography and chest x-rays in evaluating efficacy of aerosolized recombinant human DNase in cystic fibrosis patients younger than age 5 years: a preliminary study. Pediatr Pulmonol. 2001;31(5):377-82. https://doi.org/10.1002/ppul.1061
» https://doi.org/10.1002/ppul.1061 -
97McKenzie SG, Chowdhury S, Strandvik B, Hodson ME; Investigators of the Epidemiologic Registry of Cystic Fibrosis. Dornase alfa is well tolerated: data from the epidemiologic registry of cystic fibrosis. Pediatr Pulmonol. 2007;42(10):928-37. https://doi.org/10.1002/ppul.20685
» https://doi.org/10.1002/ppul.20685 -
98Elkins MR, Robinson M, Rose BR, Harbour C, Moriarty CP, Marks GB, et al. A controlled trial of long-term inhaled hypertonic saline in patients with cystic fibrosis. N Engl J Med. 2006;354(3):229-40. https://doi.org/10.1056/NEJMoa043900
» https://doi.org/10.1056/NEJMoa043900 -
99Wark PA, McDonald V. Nebulised hypertonic saline for cystic fibrosis. Cochrane Database Syst Rev. 2000;(2):CD001506.
-
100Dentice RL, Elkins MR, Middleton PG, Bishop JR, Wark PA, Dorahy DJ, et al. A randomised trial of hypertonic saline during hospitalisation for exacerbation of cystic fibrosis. Thorax. 2016;71(2):141-7. https://doi.org/10.1136/thoraxjnl-2014-206716
» https://doi.org/10.1136/thoraxjnl-2014-206716 -
101Aitken ML, Bellon G, De Boeck K, Flume PA, Fox HG, Geller DE, et al. Long-term inhaled dry powder mannitol in cystic fibrosis: an international randomized study. Am J Respir Crit Care Med. 2012;185(6):645-52. https://doi.org/10.1164/rccm.201109-1666OC
» https://doi.org/10.1164/rccm.201109-1666OC -
102Bilton D, Robinson P, Cooper P, Gallagher CG, Kolbe J, Fox H, et al. Inhaled dry powder mannitol in cystic fibrosis: an efficacy and safety study. Eur Respir J. 2011;38(5):1071-80. https://doi.org/10.1183/09031936.00187510
» https://doi.org/10.1183/09031936.00187510 -
103Bilton D, Bellon G, Charlton B, Cooper P, De Boeck K, Flume PA, et al. Pooled analysis of two large randomised phase III inhaled mannitol studies in cystic fibrosis. J Cyst Fibros. 2013;12(4):367-76. https://doi.org/10.1016/j.jcf.2012.11.002
» https://doi.org/10.1016/j.jcf.2012.11.002 -
104Langton Hewer SC, Smyth AR. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD004197. https://doi.org/10.1002/14651858.cd004197.pub4
» https://doi.org/10.1002/14651858.cd004197.pub4 -
105Proesmans M, Vermeulen F, Boulanger L, Verhaegen J, De Boeck K. Comparison of two treatment regimens for eradication of Pseudomonas aeruginosa infection in children with cystic fibrosis. J Cyst Fibros. 2013;12(1):29-34. https://doi.org/10.1016/j.jcf.2012.06.001
» https://doi.org/10.1016/j.jcf.2012.06.001 -
106Ratjen F, Munck A, Kho P, Angyalosi G; ELITE Study Group. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax. 2010;65(4):286-91. https://doi.org/10.1136/thx.2009.121657
» https://doi.org/10.1136/thx.2009.121657 -
107Treggiari MM, Retsch-Bogart G, Mayer-Hamblett N, Khan U, Kulich M, Kronmal R, et al. Comparative efficacy and safety of 4 randomized regimens to treat early Pseudomonas aeruginosa infection in children with cystic fibrosis. Arch Pediatr Adolesc Med. 2011;165(9):847-56. https://doi.org/10.1001/archpediatrics.2011.136
» https://doi.org/10.1001/archpediatrics.2011.136 -
108Vandamme P, Dawyndt P. Classification and identification of the Burkholderia cepacia complex: Past, present and future. Syst Appl Microbiol. 2011;34(2):87-95. https://doi.org/10.1016/j.syapm.2010.10.002
» https://doi.org/10.1016/j.syapm.2010.10.002 -
109Depoorter E, Bull MJ, Peeters C, Coenye T, Vandamme P, Mahenthiralingam E. Burkholderia: an update on taxonomy and biotechnological potential as antibiotic producers. Appl Microbiol Biotechnol. 2016;100(12):5215-29. https://doi.org/10.1007/s00253-016-7520-x
» https://doi.org/10.1007/s00253-016-7520-x -
110Zlosnik JE, Zhou G, Brant R, Henry DA, Hird TJ, Mahenthiralingam E, et al. Burkholderia species infections in patients with cystic fibrosis in British Columbia, Canada. 30 years' experience. Ann Am Thorac Soc. 2015;12(1):70-8. https://doi.org/10.1513/AnnalsATS.201408-395OC
» https://doi.org/10.1513/AnnalsATS.201408-395OC -
111Horsley A, Webb K, Bright-Thomas R, Govan J, Jones A. Can early Burkholderia cepacia complex infection in cystic fibrosis be eradicated with antibiotic therapy? Front Cell Infect Microbiol. 2011;1:18. https://doi.org/10.3389/fcimb.2011.00018
» https://doi.org/10.3389/fcimb.2011.00018 -
112Dasenbrook EC, Checkley W, Merlo CA, Konstan MW, Lechtzin N, Boyle MP. Association between respiratory tract methicillin-resistant Staphylococcus aureus and survival in cystic fibrosis. JAMA. 2010;303(23):2386-92. https://doi.org/10.1001/jama.2010.791
» https://doi.org/10.1001/jama.2010.791 -
113Vanderhelst E, De Wachter E, Willekens J, Pierard D, Vincken W, Malfroot A. Eradication of chronic methicillin-resistant Staphylococcus aureus infection in cystic fibrosis patients. An observational prospective cohort study of 11 patients. J Cyst Fibros. 2013;12(6):662-6. https://doi.org/10.1016/j.jcf.2013.04.009
» https://doi.org/10.1016/j.jcf.2013.04.009 -
114Hall H, Gadhok R, Alshafi K, Bilton D, Simmonds NJ. Eradication of respiratory tract MRSA at a large adult cystic fibrosis centre. Respir Med. 2015;109(3):357-63. https://doi.org/10.1016/j.rmed.2015.01.013
» https://doi.org/10.1016/j.rmed.2015.01.013 -
115Vallières E, Rendall JC, Moore JE, McCaughan J, Hoeritzauer AI, Tunney MM, et al. MRSA eradication of newly acquired lower respiratory tract infection in cystic fibrosis. ERJ Open Res. 2016;2(1). pii: 00064-2015. https://doi.org/10.1183/23120541.00064-2015
» https://doi.org/10.1183/23120541.00064-2015 -
116Macfarlane M, Leavy A, McCaughan J, Fair R, Reid AJ. Successful decolonization of methicillin-resistant Staphylococcus aureus in paediatric patients with cystic fibrosis (CF) using a three-step protocol. J Hosp Infect. 2007;65(3):231-6. https://doi.org/10.1016/j.jhin.2006.10.011
» https://doi.org/10.1016/j.jhin.2006.10.011 -
117Ryan G, Singh M, Dwan K. Inhaled antibiotics for long-term therapy in cystic fibrosis. Cochrane Database Syst Rev. 2011;(3):CD001021. https://doi.org/10.1002/14651858.cd001021.pub2
» https://doi.org/10.1002/14651858.cd001021.pub2 -
118Cystic Fibrosis Trust [homepage on the Internet]. London: Cystic Fibrosis Trust [updated 2013 Jul 23; cited 2017 Feb 1]. Antibiotic Treatment for Cystic Fibrosis. Third Edition. May 2009. Available from: https://www.cysticfibrosis.org.uk/the-work-we-do/
» https://www.cysticfibrosis.org.uk/the-work-we-do -
119Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, et al. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013;39(4):495-512. https://doi.org/10.1590/S1806-37132013000400015
» https://doi.org/10.1590/S1806-37132013000400015 -
120Lee TW, Brownlee KG, Conway SP, Denton M, Littlewood JM. Evaluation of a new definition for chronic Pseudomonas aeruginosa infection in cystic fibrosis patients. J Cyst Fibros. 2003;2(1):29-34. https://doi.org/10.1016/S1569-1993(02)00141-8
» https://doi.org/10.1016/S1569-1993(02)00141-8 -
121Ramsey BW, Dorkin HL, Eisenberg JD, Gibson RL, Harwood IR, Kravitz RM, et al. Efficacy of aerosolized tobramycin in patients with cystic fibrosis. N Engl J Med. 1993;328(24):1740-6. https://doi.org/10.1056/NEJM199306173282403
» https://doi.org/10.1056/NEJM199306173282403 -
122Ramsey BW, Pepe MS, Quan JM, Otto KL, Montgomery AB, Williams-Warren J, et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. Cystic Fibrosis Inhaled Tobramycin Study Group. N Engl J Med. 1999;340(1):23-30. https://doi.org/10.1056/NEJM199901073400104
» https://doi.org/10.1056/NEJM199901073400104 -
123Oermann CM, Retsch-Bogart GZ, Quittner AL, Gibson RL, McCoy KS, Montgomery AB, et al. An 18-month study of the safety and efficacy of repeated courses of inhaled aztreonam lysine in cystic fibrosis. Pediatr Pulmonol. 2010;45(11):1121-34. https://doi.org/10.1002/ppul.21301
» https://doi.org/10.1002/ppul.21301 -
124Balfour-Lynn IM, editor. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital. 6th edition. London: Royal Brompton Hospital; 2014.
-
125Konstan MW, Flume PA, Kappler M, Chiron R, Higgins M, Brockhaus F, et al. Safety, efficacy and convenience of tobramycin inhalation powder in cystic fibrosis patients: The EAGER trial. J Cyst Fibros. 2011;10(1):54-61. https://doi.org/10.1016/j.jcf.2010.10.003
» https://doi.org/10.1016/j.jcf.2010.10.003 -
126Littlewood KJ, Higashi K, Jansen JP, Capkun-Niggli G, Balp MM, Doering G, et al. A network meta-analysis of the efficacy of inhaled antibiotics for chronic Pseudomonas infections in cystic fibrosis. J Cyst Fibros. 2012;11(5):419-26. https://doi.org/10.1016/j.jcf.2012.03.010
» https://doi.org/10.1016/j.jcf.2012.03.010 -
127Mogayzel PJ Jr, Naureckas ET, Robinson KA, Brady C, Guill M, Lahiri T, et al. Cystic Fibrosis Foundation pulmonary guideline. pharmacologic approaches to prevention and eradication of initial Pseudomonas aeruginosa infection. Ann Am Thorac Soc. 2014;11(10):1640-50. https://doi.org/10.1513/AnnalsATS.201404-166OC
» https://doi.org/10.1513/AnnalsATS.201404-166OC -
128Clement A, Tamalet A, Leroux E, Ravilly S, Fauroux B, Jais JP. Long term effects of azithromycin in patients with cystic fibrosis: A double blind, placebo controlled trial. Thorax. 2006;61(10):895-902. https://doi.org/10.1136/thx.2005.057950
» https://doi.org/10.1136/thx.2005.057950 -
129Equi A, Balfour-Lynn IM, Bush A, Rosenthal M. Long term azithromycin in children with cystic fibrosis: a randomised, placebo-controlled crossover trial. Lancet. 2002;360(9338):978-84. https://doi.org/10.1016/S0140-6736(02)11081-6
» https://doi.org/10.1016/S0140-6736(02)11081-6 -
130Florescu DF, Murphy PJ, Kalil AC. Effects of prolonged use of azithromycin in patients with cystic fibrosis: A meta-analysis. Pulm Pharmacol Ther. 2009;22(6):467-72. https://doi.org/10.1016/j.pupt.2009.03.002
» https://doi.org/10.1016/j.pupt.2009.03.002 -
131Kabra SK, Pawaiya R, Lodha R, Kapil A, Kabra M, Vani AS, et al. Long-term daily high and low doses of azithromycin in children with cystic fibrosis: a randomized controlled trial. J Cyst Fibros. 2010;9(1):17-23. https://doi.org/10.1016/j.jcf.2009.09.001
» https://doi.org/10.1016/j.jcf.2009.09.001 -
132Saiman L, Marshall BC, Mayer-Hamblett N, Burns JL, Quittner AL, Cibene DA, et al. Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2003;290(13):1749-56. https://doi.org/10.1001/jama.290.13.1749
» https://doi.org/10.1001/jama.290.13.1749 -
133Southern KW, Barker PM, Solis-Moya A, Patel L. Macrolide antibiotics for cystic fibrosis. Cochrane Database Syst Rev. 2012;11:CD002203. https://doi.org/10.1002/14651858.cd002203.pub4
» https://doi.org/10.1002/14651858.cd002203.pub4 -
134Saiman L, Anstead M, Mayer-Hamblett N, Lands LC, Kloster M, Hocevar-Trnka J, et al. Effect of azithromycin on pulmonary function in patients with cystic fibrosis uninfected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2010;303(17):1707-15. https://doi.org/10.1001/jama.2010.563
» https://doi.org/10.1001/jama.2010.563 -
135Tramper-Stranders GA, Wolfs TF, Fleer A, Kimpen JL, van der Ent CK. Maintenance azithromycin treatment in pediatric patients with cystic fibrosis: long-term outcomes related to macrolide resistance and pulmonary function. Pediatr Infect Dis J. 2007;26(1):8-12. https://doi.org/10.1097/01.inf.0000247109.44249.ac
» https://doi.org/10.1097/01.inf.0000247109.44249.ac -
136Willekens J, Eyns H, Malfroot A. How long should we maintain long-term azithromycin treatment in cystic fibrosis patients? Pediatr Pulmonol. 2015;50(1):103-4. https://doi.org/10.1002/ppul.22981
» https://doi.org/10.1002/ppul.22981 -
137Nick JA, Moskowitz SM, Chmiel JF, Forssén AV, Kim SH, Saavedra MT, et al. Azithromycin may antagonize inhaled tobramycin when targeting Pseudomonas aeruginosa in cystic fibrosis. Ann Am Thorac Soc. 2014;11(3):342-50. https://doi.org/10.1513/AnnalsATS.201310-352OC
» https://doi.org/10.1513/AnnalsATS.201310-352OC -
138Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, Rosenblatt RL, Kuhn RJ, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-8. https://doi.org/10.1164/rccm.200812-1845PP
» https://doi.org/10.1164/rccm.200812-1845PP -
139de Groot R, Smith AL. Antibiotic pharmacokinetics in cystic fibrosis. Differences and clinical significance. Clin Pharmacokinet. 1987;13(4):228-53. https://doi.org/10.2165/00003088-198713040-00002
» https://doi.org/10.2165/00003088-198713040-00002 -
140Plummer A, Wildman M. Duration of intravenous antibiotic therapy in people with cystic fibrosis. Cochrane Database Syst Rev. 2011;(1):CD006682. https://doi.org/10.1002/14651858.cd006682.pub3
» https://doi.org/10.1002/14651858.cd006682.pub3 -
141Collaco JM, Green DM, Cutting GR, Naughton KM, Mogayzel PJ Jr. Location and duration of treatment of cystic fibrosis respiratory exacerbations do not affect outcomes. Am J Respir Crit Care Med. 2010;182(9):1137-43. https://doi.org/10.1164/rccm.201001-0057OC
» https://doi.org/10.1164/rccm.201001-0057OC -
142VanDevanter DR, O'Riordan MA, Blumer JL, Konstan MW. Assessing time to pulmonary function benefit following antibiotic treatment of acute cystic fibrosis exacerbations. Respir Res. 2010;11:137. https://doi.org/10.1186/1465-9921-11-137
» https://doi.org/10.1186/1465-9921-11-137 -
143Hurley MN, Prayle AP, Flume P. Intravenous antibiotics for pulmonary exacerbations in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(7):CD009730. https://doi.org/10.1002/14651858.cd009730.pub2
» https://doi.org/10.1002/14651858.cd009730.pub2 -
144Döring G, Conway SP, Heijerman HG, Hodson ME, Høiby N, Smyth A, et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J. 2000;16(4):749-67. https://doi.org/10.1034/j.1399-3003.2000.16d30.x
» https://doi.org/10.1034/j.1399-3003.2000.16d30.x -
145Balfour-Lynn IM, Field DJ, Gringras P, Hicks B, Jardine E, Jones RC, et al. BTS guidelines for home oxygen in children. Thorax. 2009;64 Suppl 2:ii1-26. https://doi.org/10.1136/thx.2009.116020
» https://doi.org/10.1136/thx.2009.116020 -
146Elphick HE, Mallory G. Oxygen therapy for cystic fibrosis. Cochrane Database Syst Rev. 2013;(7):CD003884. https://doi.org/10.1002/14651858.cd003884.pub4
» https://doi.org/10.1002/14651858.cd003884.pub4 -
147Flume PA, Mogayzel PJ Jr, Robinson KA, Rosenblatt RL, Quittell L, Marshall BC. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med. 2010;182(3):298-306. https://doi.org/10.1164/rccm.201002-0157OC
» https://doi.org/10.1164/rccm.201002-0157OC -
148Stevens DA, Moss RB, Kurup VP, Knutsen AP, Greenberger P, Judson MA, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis--state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003;37 Suppl 3:S225-64. https://doi.org/10.1086/376525
» https://doi.org/10.1086/376525 -
149Elphick HE, Southern KW. Antifungal therapies for allergic bronchopulmonary aspergillosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD002204. https://doi.org/10.1002/14651858.cd002204.pub3
» https://doi.org/10.1002/14651858.cd002204.pub3 -
150Dhooria S, Agarwal R. Diagnosis of allergic bronchopulmonary aspergillosis: a case-based approach. Future Microbiol. 2014;9(10):1195-208. https://doi.org/10.2217/fmb.14.74
» https://doi.org/10.2217/fmb.14.74 -
151Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013;43(8):850-73. https://doi.org/10.1111/cea.12141
» https://doi.org/10.1111/cea.12141 -
152Mahdavinia M, Grammer LC. Management of allergic bronchopulmonary aspergillosis: a review and update. Ther Adv Respir Dis. 2012;6(3):173-87. https://doi.org/10.1177/1753465812443094
» https://doi.org/10.1177/1753465812443094 -
153Cohen-Cymberknoh M, Blau H, Shoseyov D, Mei-Zahav M, Efrati O, Armoni S, et al. Intravenous monthly pulse methylprednisolone treatment for ABPA in patients with cystic fibrosis. J Cyst Fibros. 2009;8(4):253-7. https://doi.org/10.1016/j.jcf.2009.04.008
» https://doi.org/10.1016/j.jcf.2009.04.008 -
154Wong R, Wong M, Robinson PD, Fitzgerald DA. Omalizumab in the management of steroid dependent allergic bronchopulmonary aspergillosis (ABPA) complicating cystic fibrosis. Paediatr Respir Rev. 2013;14(1):22-4. https://doi.org/10.1016/j.prrv.2012.11.004
» https://doi.org/10.1016/j.prrv.2012.11.004 -
155Casciaro R, Naselli A, Cresta F, Ros M, Castagnola E, Minicucci L. Role of nebulized amphotericin B in the management of allergic bronchopulmonary aspergillosis in cystic fibrosis: Case report and review of literature. J Chemother. 2015;27(5):307-11.
-
156Aaron SD, Vandemheen KL, Freitag A, Pedder L, Cameron W, Lavoie A, et al. Treatment of Aspergillus fumigatus in patients with cystic fibrosis: a randomized, placebo-controlled pilot study. PLoS One. 2012;7(4):e36077. https://doi.org/10.1371/journal.pone.0036077
» https://doi.org/10.1371/journal.pone.0036077 -
157Shoseyov D, Brownlee KG, Conway SP, Kerem E. Aspergillus bronchitis in cystic fibrosis. Chest. 2006;130(1):222-6. https://doi.org/10.1378/chest.130.1.222
» https://doi.org/10.1378/chest.130.1.222 -
158Boyle MP, De Boeck K. A new era in the treatment of cystic fibrosis: correction of the underlying CFTR defect. Lancet Respir Med. 2013;1(2):158-63. https://doi.org/10.1016/S2213-2600(12)70057-7
» https://doi.org/10.1016/S2213-2600(12)70057-7 -
159De Boeck K, Munck A, Walker S, Faro A, Hiatt P, Gilmartin G, et al. Efficacy and safety of ivacaftor in patients with cystic fibrosis and a non-G551D gating mutation. J Cyst Fibros. 2014;13(6):674-80. https://doi.org/10.1016/j.jcf.2014.09.005
» https://doi.org/10.1016/j.jcf.2014.09.005 -
160Rowe SM, Heltshe SL, Gonska T, Donaldson SH, Borowitz D, Gelfond D, et al. Clinical mechanism of the cystic fibrosis transmembrane conductance regulator potentiator ivacaftor in G551D-mediated cystic fibrosis. Am J Respir Crit Care Med. 2014;190(2):175-84. https://doi.org/10.1164/rccm.201404-0703OC
» https://doi.org/10.1164/rccm.201404-0703OC -
161Taylor-Cousar J, Niknian M, Gilmartin G, Pilewski JM; VX11-770-901 investigators. Effect of ivacaftor in patients with advanced cystic fibrosis and a G551D-CFTR mutation: Safety and efficacy in an expanded access program in the United States. J Cyst Fibros. 2016;15(1):116-22. https://doi.org/10.1016/j.jcf.2015.01.008
» https://doi.org/10.1016/j.jcf.2015.01.008 -
162Davies JC, Wainwright CE, Canny GJ, Chilvers MA, Howenstine MS, Munck A. Efficacy and safety of ivacaftor in patients aged 6 to 11 years with cystic fibrosis with a G551D mutation. Am J Resp Crit Care Med. 2013;187(11)1219-25. https://doi.org/10.1164/rccm.201301-0153OC
» https://doi.org/10.1164/rccm.201301-0153OC -
163Ramsey BW, Davies J, McElvaney NG, Tullis E, Bell SC, Drevínek P, et al. A CFTR potentiator in patients with cystic fibrosis and the G551D mutation. N Engl J Med. 2011;365(18):1663-72. https://doi.org/10.1056/NEJMoa1105185
» https://doi.org/10.1056/NEJMoa1105185 -
164Accurso FJ, Rowe SM, Clancy JP, Boyle MP, Dunitz JM, Durie PR, et al. Effect of VX-770 in persons with cystic fibrosis and the G551D-CFTR mutation. N Engl J Med. 2010;363(21):1991-2003. https://doi.org/10.1056/NEJMoa0909825
» https://doi.org/10.1056/NEJMoa0909825 -
165Kerem E, Konstan MW, De Boeck K, Accurso FJ, Sermet-Gaudelus I, Wilschanski M, et al. Ataluren for the treatment of nonsense-mutation cystic fibrosis: a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Respir Med. 2014;2(7):539-47. https://doi.org/10.1016/S2213-2600(14)70100-6
» https://doi.org/10.1016/S2213-2600(14)70100-6 -
166Boyle MP, Bell SC, Konstan MW, McColley SA, Rowe SM, Rietschel E. A CFTR corrector (lumacaftor) and a CFTR potentiator (ivacaftor) for treatment of patients with cystic fibrosis who have a phe508del CFTR mutation: a phase 2 randomised controlled trial. Lancet Respir Med. 2014;2(7):527-38. https://doi.org/10.1016/S2213-2600(14)70132-8
» https://doi.org/10.1016/S2213-2600(14)70132-8 -
167Chmiel JF, Konstan MW. Inflammation and anti-inflammatory therapies for cystic fibrosis. Clin Chest Med. 2007;28(2):331-46. https://doi.org/10.1016/j.ccm.2007.02.002
» https://doi.org/10.1016/j.ccm.2007.02.002 -
168Fennell PB, Quante J, Wilson K, Boyle M, Strunk R, Ferkol T. Use of high-dose ibuprofen in a pediatric cystic fibrosis center. J Cyst Fibros. 2007;6(2):153-8. https://doi.org/10.1016/j.jcf.2006.06.003
» https://doi.org/10.1016/j.jcf.2006.06.003 -
169Flume PA, Van Devanter DR. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 2012;10:88. https://doi.org/10.1186/1741-7015-10-88
» https://doi.org/10.1186/1741-7015-10-88 -
170Konstan MW, Byard PJ, Hoppel CL, Davis PB. Effect of high-dose ibuprofen in patients with cystic fibrosis. N Engl J Med. 1995;332(13):848-54. https://doi.org/10.1056/NEJM199503303321303
» https://doi.org/10.1056/NEJM199503303321303 -
171Konstan MW, Schluchter MD, Xue W, Davis PB. Clinical use of Ibuprofen is associated with slower FEV1 decline in children with cystic fibrosis. Am J Respir Crit Care Med. 2007;176(11):1084-9. https://doi.org/10.1164/rccm.200702-181OC
» https://doi.org/10.1164/rccm.200702-181OC -
172Lands LC, Stanojevic S. Oral non-steroidal anti-inflammatory drug therapy for lung disease in cystic fibrosis. Cochrane Database Syst Rev. 2013;(6):CD001505. https://doi.org/10.1002/14651858.cd001505.pub3
» https://doi.org/10.1002/14651858.cd001505.pub3 -
173Chmiel JF, Konstan MW, Accurso FJ, Lymp J, Mayer-Hamblett N, VanDevanter DR, et al. Use of ibuprofen to assess inflammatory biomarkers in induced sputum: Implications for clinical trials in cystic fibrosis. J Cyst Fibros. 2015;14(6):720-6. https://doi.org/10.1016/j.jcf.2015.03.007
» https://doi.org/10.1016/j.jcf.2015.03.007 -
174Lands LC, Milner R, Cantin AM, Manson D, Corey M. High-dose ibuprofen in cystic fibrosis: Canadian safety and effectiveness trial. J Pediatr. 2007;151(3):249-54. https://doi.org/10.1016/j.jpeds.2007.04.009
» https://doi.org/10.1016/j.jpeds.2007.04.009 -
175Balfour-Lynn IM, Welch K. Inhaled corticosteroids for cystic fibrosis. Cochrane Database Syst Rev. 2014;(10):CD001915. https://doi.org/10.1002/14651858.cd001915.pub4
» https://doi.org/10.1002/14651858.cd001915.pub4 -
176Cheng K, Ashby D, Smyth RL. Oral steroids for long-term use in cystic fibrosis. Cochrane Database Syst Rev. 2013;(6):CD000407. https://doi.org/10.1002/14651858.cd000407.pub3
» https://doi.org/10.1002/14651858.cd000407.pub3 -
177Halfhide C, Evans HJ, Couriel J. WITHDRAWN: Inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst Rev. 2016;2:CD003428.
-
178Ratjen F, Koker P, Geller DE, Langellier-Cocteaux B, Le Maulf F, Kattenbeck S, et al. Tiotropium Respimat in cystic fibrosis: Phase 3 and Pooled phase 2/3 randomized trials. J Cyst Fibros. 2015;14(5):608-14. https://doi.org/10.1016/j.jcf.2015.03.004
» https://doi.org/10.1016/j.jcf.2015.03.004 -
179Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367-416. https://doi.org/10.1164/rccm.200604-571ST
» https://doi.org/10.1164/rccm.200604-571ST -
180Floto RA, Olivier KN, Saiman L, Daley CL, Herrmann JL, Nick JA, et al. US Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus recommendations for the management of non-tuberculous mycobacteria in individuals with cystic fibrosis. Thorax. 2016;71 Suppl 1:i1-22. https://doi.org/10.1136/thoraxjnl-2015-207360
» https://doi.org/10.1136/thoraxjnl-2015-207360 -
181Carlyle BE, Borowitz DS, Glick PL. A review of pathophysiology and management of fetuses and neonates with meconium ileus for the pediatric surgeon. J Pediatr Surg. 2012;47(4):772-81. Erratum in: J Pediatr Surg. 2012 Aug;47(8):1633. https://doi.org/10.1016/j.jpedsurg.2012.02.019
» https://doi.org/10.1016/j.jpedsurg.2012.02.019 -
182Guimarães EV, Schettino GC, Camargos PA, Penna FJ. Prevalence of hyponatremia at diagnosis and factors associated with the longitudinal variation in serum sodium levels in infants with cystic fibrosis. J Pediatr. 2012;161(2):285-9. https://doi.org/10.1016/j.jpeds.2012.01.052
» https://doi.org/10.1016/j.jpeds.2012.01.052 -
183Coates AJ, Crofton PM, Marshall T. Evaluation of salt supplementation in CF infants. J Cyst Fibros. 2009;8(6):382-5. https://doi.org/10.1016/j.jcf.2009.08.006
» https://doi.org/10.1016/j.jcf.2009.08.006 -
184Cystic Fibrosis Foundation, Borowitz D, Robinson KA, Rosenfeld M, Davis SD, Sabadosa KA, et al. Cystic Fibrosis Foundation evidence-based guidelines for management of infants with cystic fibrosis. J Pediatr. 2009;155(6 Suppl):S73-93. https://doi.org/10.1016/j.jpeds.2009.09.001
» https://doi.org/10.1016/j.jpeds.2009.09.001 -
185O'Sullivan BP, Baker D, Leung KG, Reed G, Baker SS, Borowitz D. Evolution of pancreatic function during the first year in infants with cystic fibrosis. J Pediatr. 2013;162(4):808-12.e1. https://doi.org/10.1016/j.jpeds.2012.10.008
» https://doi.org/10.1016/j.jpeds.2012.10.008 -
186Stern RC, Eisenberg JD, Wagener JS, Ahrens R, Rock M, doPico G, et al. A comparison of the efficacy and tolerance of pancrelipase and placebo in the treatment of steatorrhea in cystic fibrosis patients with clinical exocrine pancreatic insufficiency. Am J Gastroenterol. 2000;95(8):1932-8. https://doi.org/10.1111/j.1572-0241.2000.02244.x
» https://doi.org/10.1111/j.1572-0241.2000.02244.x -
187Colombo C, Ellemunter H, Houwen R, Munck A, Taylor C, Wilschanski M; et al. Guidelines for the diagnosis and management of distal intestinal obstruction syndrome in cystic fibrosis patients. J Cyst Fibros. 2011;10 Suppl 2:S24-8. https://doi.org/10.1016/S1569-1993(11)60005-2
» https://doi.org/10.1016/S1569-1993(11)60005-2 -
188Subhi R, Ooi R, Finlayson F, Kotsimbos T, Wilson J, Lee WR, et al. Distal intestinal obstruction syndrome in cystic fibrosis: presentation, outcome and management in a tertiary hospital (2007-2012). ANZ J Surg. 2014;84(10):740-4. https://doi.org/10.1111/ans.12397
» https://doi.org/10.1111/ans.12397 -
189Debray D, Kelly D, Houwen R, Strandvik B, Colombo C. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10 Suppl 2:S29-36. https://doi.org/10.1016/S1569-1993(11)60006-4
» https://doi.org/10.1016/S1569-1993(11)60006-4 -
190Sokol RJ, Durie PR. Recommendations for management of liver and biliary tract disease in cystic fibrosis. Cystic Fibrosis Foundation Hepatobiliary Disease Consensus Group. J Pediatr Gastroenterol Nutr. 1999;28 Suppl 1:S1-13. https://doi.org/10.1097/00005176-199900001-00001
» https://doi.org/10.1097/00005176-199900001-00001 -
191Williams SG, Westaby D, Tanner MS, Mowat AP. Liver and biliary problems in cystic fibrosis. Br Med Bull. 1992;48(4):877-92. https://doi.org/10.1093/oxfordjournals.bmb.a072583
» https://doi.org/10.1093/oxfordjournals.bmb.a072583 -
192Colombo C. Liver disease in cystic fibrosis. Curr Opin Pulm Med. 2007;13(6):529-36. https://doi.org/10.1097/MCP.0b013e3282f10a16
» https://doi.org/10.1097/MCP.0b013e3282f10a16 -
193Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59. https://doi.org/10.1097/00005176-200209000-00004
» https://doi.org/10.1097/00005176-200209000-00004 -
194Stallings VA, Stark LJ, Robinson KA, Feranchak AP, Quinton H; Clinical Practice Guidelines on Growth and Nutrition Subcommittee, et al. Evidence-based practice recommendations for nutrition-related management of children and adults with cystic fibrosis and pancreatic insufficiency: results of a systematic review. J Am Diet Assoc. 2008;108(5):832-9. https://doi.org/10.1016/j.jada.2008.02.020
» https://doi.org/10.1016/j.jada.2008.02.020 -
195de Onis M, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ. 2007;85(9):660-7. https://doi.org/10.2471/BLT.07.043497
» https://doi.org/10.2471/BLT.07.043497 -
196WHO child growth standards and the identification of severe acute malnutrition in infants and children: a joint statement by the World Health Organization and the United Nations Children's Fund. Geneva: WHO; 2009.
-
197Alicandro G, Battezzati A, Bianchi ML, Loi S, Speziali C, Bisogno A, et al. Estimating body composition from skinfold thicknesses and bioelectrical impedance analysis in cystic fibrosis patients. J Cyst Fibros. 2015;14(6):784-91. https://doi.org/10.1016/j.jcf.2015.07.011
» https://doi.org/10.1016/j.jcf.2015.07.011 -
198Francis DK, Smith J, Saljuqi T, Watling RM. Oral protein calorie supplementation for children with chronic disease. Cochrane Database Syst Rev. 2015;(5):CD001914. https://doi.org/10.1002/14651858.cd001914.pub2
» https://doi.org/10.1002/14651858.cd001914.pub2 -
199Smyth RL, Rayner O. Oral calorie supplements for cystic fibrosis. Cochrane Database Syst Rev. 2014;(11):CD000406. https://doi.org/10.1002/14651858.cd000406.pub4
» https://doi.org/10.1002/14651858.cd000406.pub4 -
200Engelen MP, Com G, Deutz NE. Protein is an important but undervalued macronutrient in the nutritional care of patients with cystic fibrosis. Curr Opin Clin Nutr Metab Care. 2014;17(6):515-20. Erratum in: Curr Opin Clin Nutr Metab Care. 2015;18(1):109. https://doi.org/10.1097/MCO.0000000000000100
» https://doi.org/10.1097/MCO.0000000000000100 -
201Trabulsi J, Schall JI, Ittenbach RF, Olsen IE, Yudkoff M, Daikhin Y, et al. Energy balance and the accuracy of reported energy intake in preadolescent children with cystic fibrosis. Am J Clin Nutr. 2006;84(3):523-30.
-
202Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi.org/10.1016/S1569-1993(02)00032-2
» https://doi.org/10.1016/S1569-1993(02)00032-2 -
203Maqbool A, Stallings VA. Update on fat-soluble vitamins in cystic fibrosis. Curr Opin Pulm Med. 2008;14(6):574-81. https://doi.org/10.1097/MCP.0b013e3283136787
» https://doi.org/10.1097/MCP.0b013e3283136787 -
204Okebukola PO, Kansra S, Barrett J. Vitamin E supplementation in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(12):CD009422. https://doi.org/10.1002/14651858.cd009422.pub2
» https://doi.org/10.1002/14651858.cd009422.pub2 -
205Bonifant CM, Shevill E, Chang AB. Vitamin A supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2014;(5):CD006751. https://doi.org/10.1002/14651858.cd006751.pub4
» https://doi.org/10.1002/14651858.cd006751.pub4 -
206Stephenson A, Brotherwood M, Robert R, Atenafu E, Corey M, Tullis E. Cholecalciferol significantly increases 25-hydroxyvitamin D concentrations in adults with cystic fibrosis. Am J Clin Nutr . 2007;85(5):1307-11.
-
207Jagannath VA, Fedorowicz Z, Thaker V, Chang AB. Vitamin K supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2015;1:CD008482. https://doi.org/10.1002/14651858.cd008482.pub4
» https://doi.org/10.1002/14651858.cd008482.pub4 -
208Lewis C, Blackman SM, Nelson A, Oberdorfer E, Wells D, Dunitz J, et al. Diabetes-related mortality in adults with cystic fibrosis. Role of genotype and sex. Am J Respir Crit Care Med. 2015;191(2):194-200. https://doi.org/10.1164/rccm.201403-0576OC
» https://doi.org/10.1164/rccm.201403-0576OC -
209Moran A, Brunzell C, Cohen RC, Katz M, Marshall BC, Onady G, et al. Clinical care guidelines for cystic fibrosis-related diabetes: a position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. Diabetes Care. 2010;33(12):2697-708. https://doi.org/10.2337/dc10-1768
» https://doi.org/10.2337/dc10-1768 -
210Moran A, Pillay K, Becker DJ, Acerini CL; International Society for Pediatric and Adolescent Diabetes. ISPAD Clinical Practice Consensus Guidelines 2014. Management of cystic fibrosis-related diabetes in children and adolescents. Pediatr Diabetes. 2014;15 Suppl 20:65-76. https://doi.org/10.1111/pedi.12178
» https://doi.org/10.1111/pedi.12178 -
211Middleton PG, Wagenaar M, Matson AG, Craig ME, Holmes-Walker DJ, Katz T, et al. Australian standards of care for cystic fibrosis-related diabetes. Respirology. 2014;19(2):185-92. https://doi.org/10.1111/resp.12227
» https://doi.org/10.1111/resp.12227 -
212Lanng S, Hansen A, Thorsteinsson B, Nerup J, Koch C. Glucose tolerance in patients with cystic fibrosis: five year prospective study. BMJ. 1995;311(7006):655-9. https://doi.org/10.1136/bmj.311.7006.655
» https://doi.org/10.1136/bmj.311.7006.655 -
213Sermet-Gaudelus I, Castanet M, Retsch-Bogart G, Aris RM. Update on cystic fibrosis-related bone disease: a special focus on children. Paediatr Respir Rev. 2009;10(3):134-42. https://doi.org/10.1016/j.prrv.2009.05.001
» https://doi.org/10.1016/j.prrv.2009.05.001 -
214Sunni M, Bellin MD, Moran A. Exogenous insulin requirements do not differ between youth and adults with cystic fibrosis related diabetes. Pediatr Diabetes. 2013;14(4):295-8. https://doi.org/10.1111/pedi.12014
» https://doi.org/10.1111/pedi.12014 -
215Aris RM, Merkel PA, Bachrach LK, Borowitz DS, Boyle MP, Elkin SL, et al. Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab. 2005;90(3):1888-96. https://doi.org/10.1210/jc.2004-1629
» https://doi.org/10.1210/jc.2004-1629 -
216Haworth CS, Jones AM, Adams JE, Selby PL, Webb AK. Randomised double blind placebo controlled trial investigating the effect of calcium and vitamin D supplementation on bone mineral density and bone metabolism in adult patients with cystic fibrosis. J Cyst Fibros. 2004;3(4):233-6. https://doi.org/10.1016/j.jcf.2004.08.002
» https://doi.org/10.1016/j.jcf.2004.08.002 -
217Conwell LS, Chang AB. Bisphosphonates for osteoporosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(3):CD002010. https://doi.org/10.1002/14651858.cd002010.pub4
» https://doi.org/10.1002/14651858.cd002010.pub4 -
218Santolim TQ, Santos LA, Giovani AM, Dias VC. The strategic role of the nurse in the selection of IV devices. Br J Nurs. 2012;21(21):S28, S30-2.
-
219Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allergy. 2013;27(5):387-95. https://doi.org/10.2500/ajra.2013.27.3919
» https://doi.org/10.2500/ajra.2013.27.3919 -
220Robertson JM, Friedman EM, Rubin BK. Nasal and sinus disease in cystic fibrosis. Paediatr Respir Rev. 2008;9(3):213-9. https://doi.org/10.1016/j.prrv.2008.04.003
» https://doi.org/10.1016/j.prrv.2008.04.003 -
221Cimmino M, Nardone M, Cavaliere M, Plantulli A, Sepe A, Esposito V, et al. Dornase alfa as postoperative therapy in cystic fibrosis sinonasal disease. Arch Otolaryngol Head Neck Surg. 2005;131(12):1097-101. https://doi.org/10.1001/archotol.131.12.1097
» https://doi.org/10.1001/archotol.131.12.1097 -
222Mainz JG, Schien C, Schiller I, Schädlich K, Koitschev A, Koitschev C, et al. Sinonasal inhalation of dornase alfa administered by vibrating aerosol to cystic fibrosis patients: a double-blind placebo-controlled cross-over trial. J Cyst Fibros. 2014;13(4):461-70. https://doi.org/10.1016/j.jcf.2014.02.005
» https://doi.org/10.1016/j.jcf.2014.02.005 -
223Mainz JG, Schiller I, Ritschel C, Mentzel HJ, Riethmüller J, Koitschev A, et al. Sinonasal inhalation of dornase alfa in CF: A double-blind placebo-controlled cross-over pilot trial. Auris Nasus Larynx. 2011;38(2):220-7. https://doi.org/10.1016/j.anl.2010.09.001
» https://doi.org/10.1016/j.anl.2010.09.001 -
224Hadfield PJ, Rowe-Jones JM, Mackay IS. A prospective treatment trial of nasal polyps in adults with cystic fibrosis. Rhinology. 2000;38(2):63-5.
-
225Beer H, Southern KW, Swift AC. Topical nasal steroids for treating nasal polyposis in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD008253. https://doi.org/10.1002/14651858.cd008253.pub4
» https://doi.org/10.1002/14651858.cd008253.pub4 -
226Rampolla R. Lung transplantation: an overview of candidacy and outcomes. Ochsner J. 2014;14(4):641-8.
-
227Hirche TO, Knoop C, Hebestreit H, Shimmin D, Solé A, Elborn JS, et al. Practical guidelines: lung transplantation in patients with cystic fibrosis. Pulm Med. 2014;2014:621342. Erratum in: Pulm Med. 2015;2015:698460.
-
228Weill D, Benden C, Corris PA, Dark JH, Davis RD, Keshavjee S, et al. A consensus document for the selection of lung transplant candidates: 2014--an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2015;34(1):1-15. https://doi.org/10.1016/j.healun.2014.06.014
» https://doi.org/10.1016/j.healun.2014.06.014 -
229Sands D, Repetto T, Dupont LJ, Korzeniewska-Eksterowicz A, Catastini P, Madge S. End of life care for patients with cystic fibrosis. J Cyst Fibros. 2011;10 Suppl 2:S37-44. https://doi.org/10.1016/S1569-1993(11)60007-6
» https://doi.org/10.1016/S1569-1993(11)60007-6 -
230Plant BJ, Goss CH, Tonelli MR, McDonald G, Black RA, Aitken ML. Contraceptive practices in women with cystic fibrosis. J Cyst Fibros. 2008;7(5):412-4. https://doi.org/10.1016/j.jcf.2008.03.001
» https://doi.org/10.1016/j.jcf.2008.03.001 -
231Wainwright CE, Elborn JS, Ramsey BW, Marigowda G, Huang X, Cipolli M. Lumacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del CFTR. N Engl J Med. 2015;373(3):220-31. https://doi.org/10.1056/NEJMoa1409547
» https://doi.org/10.1056/NEJMoa1409547 -
232Kernan NG, Alton EW, Cullinan P, Griesenbach U, Bilton D. Oral contraceptives do not appear to affect cystic fibrosis disease severity. Eur Respir J. 2013;41(1):67-73. https://doi.org/10.1183/09031936.00018712
» https://doi.org/10.1183/09031936.00018712 -
233Government of South Australia. Department for Health and Ageing. SA Maternal & Neonatal Clinical Network. Clinical practice guideline on cystic fibrosis in pregnancy. 3rd ed. Adelaide: Department for Health and Ageing; 2015.
-
234Edenborough FP, Borgo G, Knoop C, Lannefors L, Mackenzie WE, Madge S, et al. Guidelines for the management of pregnancy in women with cystic fibrosis. J Cyst Fibros. 2008;7 Suppl 1:S2-32. https://doi.org/10.1016/j.jcf.2007.10.001
» https://doi.org/10.1016/j.jcf.2007.10.001 -
235Goddard J, Bourke SJ. Cystic fibrosis and pregnancy. TOG. 2009;11(1):19-24. https://doi.org/10.1576/toag.11.1.19.27464
» https://doi.org/10.1576/toag.11.1.19.27464 -
236McMullen AH, Pasta DJ, Frederick PD, Konstan MW, Morgan WJ, Schechter MS, et al. Impact of pregnancy on women with cystic fibrosis. Chest. 2006;129(3):706-11. https://doi.org/10.1378/chest.129.3.706
» https://doi.org/10.1378/chest.129.3.706 -
237Chan HC, Ruan YC, He Q, Chen MH, Chen H, Xu WM, et al. The cystic fibrosis transmembrane conductance regulator in reproductive health and disease. J Physiol. 2009;587(Pt 10):2187-95. https://doi.org/10.1113/jphysiol.2008.164970
» https://doi.org/10.1113/jphysiol.2008.164970 -
238Kerem E, Conway S, Elborn S, Heijerman H; Consensus Committee. Standards of care for patients with cystic fibrosis: a European consensus. J Cyst Fibros. 2005;4(1):7-26. https://doi.org/10.1016/j.jcf.2004.12.002
» https://doi.org/10.1016/j.jcf.2004.12.002 -
239Duff AJ, Latchford GJ. Motivational interviewing for adherence problems in cystic fibrosis. Pediatr Pulmonol. 2010;45(3):211-20. https://doi.org/10.1002/ppul.21103
» https://doi.org/10.1002/ppul.21103 -
240Quittner AL, Zhang J, Marynchenko M, Chopra PA, Signorovitch J, Yushkina Y, et al. Pulmonary medication adherence and health-care use in cystic fibrosis. Chest. 2014;146(1):142-51. https://doi.org/10.1378/chest.13-1926
» https://doi.org/10.1378/chest.13-1926 -
241Sawicki GS, Sellers DE, Robinson WM. High treatment burden in adults with cystic fibrosis: challenges to disease self-management. J Cyst Fibros. 2009;8(2):91-6. https://doi.org/10.1016/j.jcf.2008.09.007
» https://doi.org/10.1016/j.jcf.2008.09.007 -
242Ziaian T, Sawyer MG, Reynolds KE, Carbone JA, Clark JJ, Baghurst PA, et al. Treatment burden and health-related quality of life of children with diabetes, cystic fibrosis and asthma. J Paediatr Child Health. 2006;42(10):596-600. https://doi.org/10.1111/j.1440-1754.2006.00943.x
» https://doi.org/10.1111/j.1440-1754.2006.00943.x -
243Quittner AL, Abbott J, Georgiopoulos AM, Goldbeck L, Smith B, Hempstead SE, et al. International Committee on Mental Health in Cystic Fibrosis: Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus statements for screening and treating depression and anxiety. Thorax. 2016;71(1):26-34. https://doi.org/10.1136/thoraxjnl-2015-207488
» https://doi.org/10.1136/thoraxjnl-2015-207488
-
1
Trabalho organizado pelo Grupo Brasileiro de Estudos de Fibrose Cística, com o apoio da Sociedade Brasileira de Pneumologia e Tisiologia, Brasília (DF) e da Sociedade Brasileira de Pediatria, Rio de Janeiro (RJ) Brasil.
-
Apoio financeiro:
Este estudo recebeu assistência editorial e de escrita médica da Springer Healthcare, com apoio financeiro de Roche Brasil, Teva Brasil, Zambon Laboratórios Farmacêuticos e Vertex Pharmaceuticals. Os autores assumem toda a responsabilidade pelo conteúdo desta publicação. Os patrocinadores não tiveram qualquer influência na coleta de dados, análise e decisão da publicação das informações apresentadas no artigo.
Datas de Publicação
-
Publicação nesta coleção
May-Jun 2017
Histórico
-
Recebido
04 Mar 2017 -
Aceito
22 Maio 2017


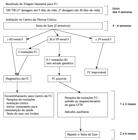





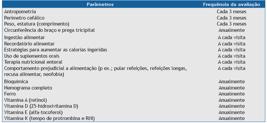


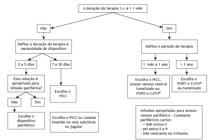



 FC: fibrose cística. aFormas atípicas de FC: sintomas compatíveis e níveis intermediários de cloreto no suor.
FC: fibrose cística. aFormas atípicas de FC: sintomas compatíveis e níveis intermediários de cloreto no suor.
 PCR: polymerase chain reaction (reação em cadeia da polimerase); RFLP: restriction fragment length polymorphism; ARMS: amplification refractory mutation system; e MLPA, multiplex ligation-dependent probe amplification.
PCR: polymerase chain reaction (reação em cadeia da polimerase); RFLP: restriction fragment length polymorphism; ARMS: amplification refractory mutation system; e MLPA, multiplex ligation-dependent probe amplification.
 Pa: Pseudomonas aeruginosa. Adaptado de Lee et al.
Pa: Pseudomonas aeruginosa. Adaptado de Lee et al.

 RNI: recommended nutrient intake. Adaptado de Stallings et al.
RNI: recommended nutrient intake. Adaptado de Stallings et al. IMC: índice de massa corpórea.
IMC: índice de massa corpórea.

