Resumos
O objetivo deste trabalho foi avaliar a incidência de fungos dos gêneros Aspergillus, Fusarium e Penicillium e as contaminações com micotoxinas em grãos de cinco híbridos comerciais de milho em função da umidade de colheita. O trabalho foi conduzido em Astorga, Estado do Paraná, durante o período da ‘safrinha’ de 2007 e da safra de ‘verão’ de 2007/2008. As amostras de grãos, colhidas em cinco épocas distintas e em cinco repetições, foram submetidas à determinação de umidade pelo método da estufa a 103 ± 1ºC por 72h. O teste de sanidade Blotter test e a quantificação micotoxinas (método da cromatografia em camada delgada) foram efetuados, utilizando-se um delineamento inteiramente casualizado. Os resultados obtidos foram submetidos à análise de variância e de regressão. O gênero Fusarium apresentou crescimento linear da incidência, em função do aumento da umidade, enquanto os gêneros Aspergillus e Penicillium tiveram suas incidências reduzidas. Observou-se que é possível a produção de aflatoxinas, associadas aos grãos de milho, ainda no campo, e que a antecipação da colheita, seguida de secagem imediata, assegura a qualidade sanitária dos grãos de milho.
Zea mays L.; pós-colheita; qualidade; aflatoxinas; zearalenona
The objective of this work was to evaluate the incidence of Aspergillus, Fusarium and Penicillium fungi, and the contaminations with mycotoxins in grains of five corn commercial hybrids due to harvest humidity. The work was conducted in Astorga, Paraná State, during the autumn/fall harvest of 2007 and the summer harvest of 2007/2008. The corn grain samples were collected in five distinguished periods and also in five replications, subjected to humidity content determination at an oven heated to 103 ± 1ºC for 72h. The blotter test and the mycotoxins presence were evaluated by thin layer chromatography, using a completely randomized design. The data were submitted to analyses of variance and regression. The genera Fusarium presented linear increasing incidence due to humidity increasing, whereas Aspergillus spp. and Penicillium spp. had their incidences decreased. It was observed that the possible production of aflatoxins, associated to corn grains, still in the field, and, that the anticipation of the crop harvesting, followed by immediate drying assures the sanitary quality of the corn grains.
Zea mays L.; post-harvest; quality; aflatoxins; zearalenone
PRODUÇÃO VEGETAL / CROP PRODUCTION
Incidência fúngica e contaminações por micotoxinas em grãos de híbridos comerciais de milho em função da umidade de colheita
Odair José MarquesI* * Autor para correspondência. E-mail: ojmarques@gmail.com ; Pedro Soares Vidigal FilhoII; Valdecir Antoninho DalpasqualeII; Carlos Alberto ScapimII; Luiz Fernando PricinottoII; Miguel Machinski JúniorIII
IPrograma de Pós-graduação em Agronomia, Universidade Estadual de Maringá, Av. Colombo, 5790, 87020-900, Maringá, Paraná, Brasil
IIDepartamento de Agronomia, Centro de Ciências Agrárias, Universidade Estadual de Maringá, Maringá, Paraná, Brasil
IIILaboratório de Toxicologia, Departamento de Análise Clínicas, Centro de Ciências Biológicas, Universidade Estadual de Maringá, Maringá, Paraná, Brasil
RESUMO
O objetivo deste trabalho foi avaliar a incidência de fungos dos gêneros Aspergillus, Fusarium e Penicillium e as contaminações com micotoxinas em grãos de cinco híbridos comerciais de milho em função da umidade de colheita. O trabalho foi conduzido em Astorga, Estado do Paraná, durante o período da safrinha de 2007 e da safra de verão de 2007/2008. As amostras de grãos, colhidas em cinco épocas distintas e em cinco repetições, foram submetidas à determinação de umidade pelo método da estufa a 103 ± 1ºC por 72h. O teste de sanidade Blotter test e a quantificação micotoxinas (método da cromatografia em camada delgada) foram efetuados, utilizando-se um delineamento inteiramente casualizado. Os resultados obtidos foram submetidos à análise de variância e de regressão. O gênero Fusarium apresentou crescimento linear da incidência, em função do aumento da umidade, enquanto os gêneros Aspergillus e Penicillium tiveram suas incidências reduzidas. Observou-se que é possível a produção de aflatoxinas, associadas aos grãos de milho, ainda no campo, e que a antecipação da colheita, seguida de secagem imediata, assegura a qualidade sanitária dos grãos de milho.
Palavras-chave:Zea mays L., pós-colheita, qualidade, aflatoxinas, zearalenona
ABSTRACT
Fungal incidence and mycotoxins in grains of commercial corn hybrids as a function of crop moisture content. The objective of this work was to evaluate the incidence of Aspergillus, Fusarium and Penicillium fungi, and the contaminations with mycotoxins in grains of five corn commercial hybrids due to harvest humidity. The work was conducted in Astorga, Paraná State, during the autumn/fall harvest of 2007 and the summer harvest of 2007/2008. The corn grain samples were collected in five distinguished periods and also in five replications, subjected to humidity content determination at an oven heated to 103 ± 1ºC for 72h. The blotter test and the mycotoxins presence were evaluated by thin layer chromatography, using a completely randomized design. The data were submitted to analyses of variance and regression. The genera Fusarium presented linear increasing incidence due to humidity increasing, whereas Aspergillus spp. and Penicillium spp. had their incidences decreased. It was observed that the possible production of aflatoxins, associated to corn grains, still in the field, and, that the anticipation of the crop harvesting, followed by immediate drying assures the sanitary quality of the corn grains.
Keywords:Zea mays L., post-harvest, quality, aflatoxins, zearalenone
Introdução
O milho constitui parte essencial da base alimentar dos seres humanos, seja pelo seu consumo direto, na forma de milho verde, milho em conserva, milho pipoca, fubá, farinha, amido e outros produtos, ou indireto, tanto como produtos de origem animal quanto como produtos industrializados (BROOKER et al., 1992; TRENTO et al., 2002; SILVA et al., 2007).
O Brasil se destaca no cenário obal, ocupando o terceiro lugar na produção mundial de milho. Entretanto, o sistema de produção brasileiro apresenta elevados índices de perdas de qualidade de grãos. Estas perdas são causadas, em sua maioria, por danos físicos ocorridos durante as operações de colheita, transporte, secagem, beneficiamento e armazenamento, por fatores climáticos, por agentes biológicos e pela própria respiração dos grãos (BROOKER et al., 1992; BRASIL, 1992; PALACIN et al., 2006).
Neste contexto, seria conveniente que a colheita ocorresse logo após a maturidade fisiológica, quando os grãos de milho apresentam máxima qualidade, máximo acúmulo de massa seca e baixa incidência de fungos toxigênicos (EGLI; TEKRONY, 1997; SAINI; WESTGATE, 1999). Entretanto, nesta fase, os grãos ainda apresentam elevado teor de umidade, o que torna inviável a colheita mecanizada, em função da dificuldade de debulha, decorrente do excesso de partes verdes e úmidas das plantas, fato que causa severas injúrias mecânicas por amassamento dos grãos (ALVES et al., 2001).
Por outro lado, o milho colhido com umidades inferiores a 18% tende a perder massa seca no campo por respiração (BROOKER et al., 1992). Além disto, os grãos podem sofrer maiores injúrias dos mecanismos de debulha, gerando trincas no endosperma e escarificações no pericarpo do grão ou mesmo a ruptura do endosperma, expondo seu conteúdo à ação de fungos e de insetos, com reflexos negativos na potencialidade de armazenamento como, por exemplo, a redução da massa específica e a formação de micotoxinas (FARIAS et al., 2000; RADÜNZ et al., 2006).
A qualidade dos grãos de milho é alterada direta ou indiretamente quando estes são infectados por fungos, pela produção de micotoxinas, que ocasionam danos à saúde tanto humana quanto animal em razão da atividade tóxica que podem exercer sobre o organismo (FARIAS et al., 2000; KUMAR et al., 2008). Em geral, a deterioração dos grãos começa ainda no campo, onde, por conveniência econômica, o produto é mantido na planta até a secagem, prática esta que é largamente utilizada pelos agricultores, uma vez que requer o mínimo de investimento. Todavia, esta prática pode resultar no início de elevadas infestações de fungos e de pragas de grãos armazenados (MILLER, 1995; RESNIK et al., 1996; REID et al., 1999; NESCI et al., 2003).
A presença de fungos dos gêneros Aspergillus e Penicillium é um indicativo da deterioração das sementes ou grãos de cereais e oleaginosas, e estes patógenos promovem danos ao embrião, descoloração, alterações nutricionais e perda da massa seca (SINHA; SINHA, 1991; MILLER, 1995).
O milho é um substrato perfeito para contaminação fúngica, uma vez que o amido é o componente principal do grão (BANKOLE; ADEBANJO, 2003). Segundo Farias et al. (2000), a contaminação por fungos com potencial toxigênicos, tais como Aspergillus spp., Fusarium spp. e Penicillium spp., pode ocorrer em grãos de milho aparentemente sadios.
Almeida et al. (2000) avaliaram a microbiota fúngica em amostras de três híbridos de milho recém-colhidos, provenientes de três regiões distintas do Estado de São Paulo. Os autores encontraram, em média, 71,1; 46,7 e 22,7% de incidência de Fusarium spp., Penicillium spp. e Aspergillus spp., respectivamente, indicando a predominância destes três gêneros sobre outras espécies fúngicas, e concluíram que fatores abióticos, tais como o teor de umidade nos grãos de milho, a atividade de água, a precipitação pluvial e a temperatura do ar influenciam diretamente no nível de contaminação fúngica, bem como na potencialidade toxigênica das cepas de Aspergillus flavus e de Fusarium moniliforme quanto à produção de micotoxinas.
Dilkin et al. (2000) encontraram contaminações de 23,6; 57,1 e 14,3% de Aspergillus sp., Fusarium sp. e Penicillium sp., respectivamente, em grãos de cinco híbridos de milho recém-colhidos, com 18% de umidade, em Santa Maria, Estado do Rio Grande do Sul. Os autores constataram, ainda, que o consumo médio de massa seca dos grãos de milho foi de 1,22 e 2,69%, nos períodos de 5 e 10 dias, respectivamente, de incubação do fungo Aspergillus parasiticus.
Kikuti et al. (2003), trabalhando com sementes de duas variedades de milho de polinização livre, encontraram infestações de 31,0 e 98,7% de Fusarium graminearum e de Penicillium sp., respectivamente, na variedade BRS106, enquanto que, na variedade AL 25, as infestações foram na ordem de 44,8; 100; 0,67 e 0,33% com os fungos F. graminearum, Penicillium sp., Aspergillus niger e A. flavus, respectivamente.
Santin et al. (2004), avaliando o efeito do retardamento da colheita de milho na incidência de grãos ardidos e de fungos patogênicos, constataram que a permanência prolongada das espigas de milho na planta, após a maturidade fisiológica, influenciou na redução da incidência de Fusarium moniliforme, seguindo a redução da umidade presente nos grãos. Por outro lado, os autores observaram que houve aumento da incidência de F. graminearum e de espécies dos gêneros Aspergillus e Penicillium, quando os grãos foram colhidos com umidades menores.
Marin et al. (1998) afirmam que o gênero Fusarium se correlaciona negativamente com os gêneros Aspergillus e Penicillium, ou seja, as espécies de Fusarium infectam e colonizam, preferencialmente, substratos com teores de umidade maiores, ao contrário do que ocorre com os gêneros Aspergillus e Penicillium que se desenvolvem melhor em umidades menores.
Diante do exposto, o presente trabalho teve por objetivo avaliar a incidência de fungos dos gêneros Aspergillus, Fusarium e Penicillium e a ocorrência de contaminações por micotoxinas em grãos de cinco híbridos comerciais de milho, em função da umidade de colheita.
Material e métodos
As amostras de grãos de milho foram coletadas na Fazenda Renascer, no município de Astorga, Estado do Paraná, durante os períodos de outono/inverno de 2007 (safrinha) e de verão de 2007/2008 (safra de verão), em uma área de lavoura comercial de milho homogênea, situada em área plana e distante de matas, no mínimo 50 m.
Por se tratar de lavoura comercial de milho, a escolha dos híbridos cultivados foi livre e exclusiva do produtor, não havendo qualquer interferência deste trabalho nos critérios da mesma, bem como, na condução da lavoura, limitando-se apenas à demarcação e colheita das plantas na área de coleta.
Na safrinha, os híbridos avaliados foram o 2B587, o 2B688 e o 2B710, pertencentes à empresa Dow AgroSciences, o primeiro apresentando grãos de textura semidentada e coloração amarela alaranjada, e os dois últimos, textura de grãos semidura e coloração alaranjada e amarela alaranjada, respectivamente.
Na safra de verão, os híbridos avaliados foram o 2B707, o 2B710 (ambos da Dow AgroSciences) e o Impacto de propriedade da Syngenta, e os três apresentam grãos com textura semidura. Os grãos dos híbridos 2B707 e Impacto possuem coloração alaranjada.
Por ocasião da colheita, tanto as lavouras de soja, quanto as de milho da Fazenda Renascer estavam aptas ao referido processo, na mesma época. Aliado a isto, o cenário econômico favorecia as duas culturas, visto que os preços praticados atingiram o ápice, naquele período. Dessa maneira, a colheita do milho foi preterida em relação à colheita da soja. Este fato gerou defasagem no início da coleta de amostras da safra de verão, em virtude da disponibilidade da colhedora, sendo evidenciado pelos teores de umidade menores nos grãos, quando comparados aos teores de umidade aferidos na safrinha.
A fim de se evitar a colheita total da lavoura, as áreas destinadas à coleta de amostras foram delimitadas, sendo uma área para cada híbrido. Por sua vez, de forma a minimizar variações no processo de colheita, utilizou-se sempre a mesma colhedora automotriz, com plataforma de seis linhas e com o mesmo operador.
As colheitas foram realizadas quando os grãos de milho apresentavam teores de umidade entre 33,2 e 14,8%, variando, aproximadamente, em quatro pontos percentuais entre uma colheita e outra, totalizando cinco momentos distintos de colheita.
As áreas de coletas de amostras foram constituídas de 50 linhas de plantas com espaçamento entre linhas de 0,70 m e com 100 m de comprimento. A amostragem foi realizada nas seis linhas internas de cada faixa, composta por dez linhas de plantas. O processo de colheita era suspenso a cada 20 m percorridos dentro da faixa, para se possibilitar coleta da amostra diretamente no graneleiro da colhedora, de forma aleatória na massa de grãos, totalizando cinco amostras de cada híbrido em cada período de colheita. As amostras foram acondicionadas em sacos plásticos e levadas ao laboratório para determinação imediata da umidade nos grãos.
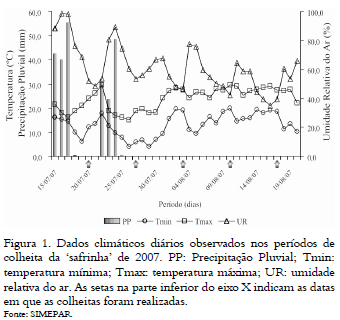
No período da safrinha de 2007, as colheitas foram realizadas nos dias 20/07, 27/07, 03/08, 10/08 e 17/8/2007, mantendo-se um intervalo constante de sete dias (Figura 1).
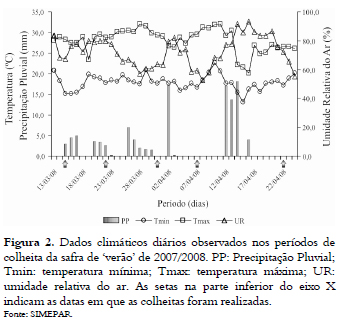
Na safra de verão, as colheitas foram realizadas nos dias 15/03, 22/03, 31/03, 07/04 e 22/04/2008. Os intervalos maiores, entre a segunda e a terceira colheita, bem como entre a penúltima e a última colheita se deram pela ocorrência de precipitações pluviais nos referidos períodos (Figura 2).
Cada amostra proveniente do campo foi dividida em três subamostras no Laboratório de Fisiologia da Produção, do Núcleo de Pesquisa Aplicada à Agricultura Nupagri / UEM. A umidade nos grãos foi determinada pelo método da estufa, com circulação forçada de ar, sob temperatura de 103 ± 1ºC durante 72h, sendo o valor da umidade obtido por diferença de massas (ASAE, 1987).
As amostras foram dispostas em um delineamento inteiramente casualizado para realização do teste de sanidade, sendo os tratamentos constituídos das umidades de colheita para cada híbrido. O método adotado foi o Blotter Test ou teste do papel de filtro, para o qual foram separados 100 grãos de cada amostra, divididos em cinco repetições de 20 grãos. Os grãos de milho foram distribuídos em gerbox plástico com quatro folhas de papel filtro, umedecidas com água destilada e autoclavada, em câmara de fluxo laminar. A seguir, os recipientes foram colocados sob iluminação, com fotoperíodo de 12h, à temperatura ambiente (20 ± 2°C) por um período de sete dias. A identificação dos fungos, em nível de gênero, presentes nos grãos de milho, foi realizada por meio de lupa estereoscópica e microscópio ótico. Na ocasião, foi efetuada a quantificação percentual da incidência de fungos (BRASIL, 1992).
O modelo matemático utilizado foi  , em que: i) Yij = valor observado no tratamento i (umidade de colheita 1, 2, 3, 4 e 5) na repetição j (1, 2, 3, 4 e 5); ii)
, em que: i) Yij = valor observado no tratamento i (umidade de colheita 1, 2, 3, 4 e 5) na repetição j (1, 2, 3, 4 e 5); ii)  = média geral do experimento, em restrição matemática; iii) ti = efeito do tratamento i; e iv) εij = efeito residual associado ao tratamento i na repetição j.
= média geral do experimento, em restrição matemática; iii) ti = efeito do tratamento i; e iv) εij = efeito residual associado ao tratamento i na repetição j.
As médias de incidência de fungos obtidas foram submetidas aos testes de Levene e de Shapiro-Wilks, para se determinar a homocedasticidade das variâncias e a normalidade dos erros, respectivamente, por meio do programa estatístico SAS. Em seguida, uma vez atendidas as pressuposições básicas da estatística (p > 0,01), as médias foram submetidas à análise de regressão (p < 0,05), utilizando-se o programa estatístico SISVAR.
Os erros para a variável incidência do gênero Fusarium nos grãos do híbrido 2B707 não atenderam as pressuposições básicas de homocedasticidade das variâncias e normalidade na distribuição dos erros, sendo, portanto, transformados em raiz quadrada, sendo submetidos, posteriormente, à análise de regressão.
As amostras para análises toxicológicas foram mantidas sob congelamento, numa temperatura de -15ºC, em freezer horizontal comum, até a realização dos procedimentos laboratoriais.
As análises toxicológicas foram realizadas no Núcleo de Produtos Naturais (Nepron) e no Laboratório de Toxicologia da UEM, utilizando-se, para a detecção e a quantificação de aflatoxinas e de zearalenona, a metodologia da cromatografia em camada delgada (CCD), proposta por Soares e Rodriguez-Amaya (1989), na qual os limites de detecção foram de 2 μg kg-1, para as aflatoxinas, e 55 μg kg-1, para a zearalenona.
As amostras foram moídas até a granulometria de 20 mesh e quarteadas para tomada de amostras analíticas de 50 g cada. A seguir, cada amostra analítica foi homogeneizada em blender com 270 mL de álcool metílico e 30 mL de cloreto de potássio (4%), durante 5 min., e a primeira mistura obtida foi filtrada em papel filtro comum. A seguir, 150 mL do primeiro filtrado foram transferidos para um béquer, no qual foram adicionados 150 mL de sulfato de amônio (30%) e 50 mL de celite, homogeneizados e deixados em repouso por 5 min. Após este período, a segunda mistura foi filtrada em papel filtro comum. Do segundo filtrado foram transferidos 150 mL para um funil de separação, sendo adicionados 150 mL de água destilada. A terceira mistura obtida foi particionada duas vezes com 10 mL de clorofórmio. A seguir, 5 mL da primeira e da segunda partição de clorofórmio foram combinados e evaporados em banho maria a 80ºC até a evaporação total do clorofórmio. O resíduo (extrato) obtido foi dissolvido em 200 μL de benzeno:acetonitrila, na proporção de 98:2 (v/v).
Na fase móvel, foram aplicados 10 μL do extrato na cromoplaca (Sil G - silicagel 60 G) a 2 cm da base, com os padrões sendo aplicados separadamente. A placa foi colocada em uma cuba não-saturada, contendo 95 mL da solução tolueno:acetato de etila:clorofórmio:ácido fórmico, na proporção de 35:25:25:10 (v/v/v/v), até se atingir a altura percorrida de 10 cm.
Na fase de quantificação, foram aplicados volumes conhecidos de amostras e de padrões nas cromoplacas. Os cálculos foram realizados de acordo com o a AOAC (1998).
A identidade das micotoxinas foi confirmada por reações de derivação e avaliação com os padrões por CCD. A revelação de zearalenona foi realizada conforme a metodologia proposta por Malaiyandi et al. (1976).
Resultados e discussão
Safrinha de 2007
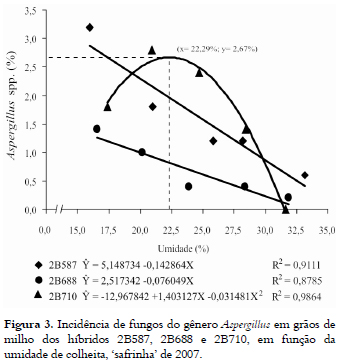
Na safrinha de 2007, a incidência dos gêneros Aspergillus e Penicillium (Figuras 3 e 5 ) foi decrescente, em função do aumento do teor de umidade na colheita, enquanto o gênero Fusarium apresentou acréscimo na sua incidência (Figura 4). Isso corrobora com a afirmação de Marin et al. (1998) de que o Fusarium spp. tem preferência por substratos com teores de umidade mais elevados.
A incidência de Aspergillus spp. foi baixa nos grãos dos três híbridos avaliados na safrinha, quando comparados com a literatura (ALMEIDA et al., 2000; KUMAR et al., 2008), sendo o maior valor observado (3,2%) no híbrido 2B587, quando colhido com 16,0% de umidade (Figura 3). A análise de regressão evidenciou que houve resposta significativa do modelo linear nos híbridos 2B587 e 2B688 e, a cada acréscimo de uma unidade no teor umidade, a incidência do patógeno foi reduzida em 0,14 e 0,08%, respectivamente. Por sua vez, as médias de incidência do patógeno no híbrido 2B710 se ajustaram de forma quadrática, apresentando o ponto de máximo (x = 22,29% de umidade) com a incidência máxima estimada em y = 2,67% (Figura 3).
Os gêneros Fusarium e Penicillium (Figuras 4 e 5 ) apresentaram alta incidência (DILKIN et al., 2000; KIKUTI et al., 2003; SANTIN et al., 2004) nos três híbridos avaliados, independente da umidade de colheita. Isto demonstra que o potencial para deterioração dos grãos de milho, após a maturidade fisiológica, é elevado (SINHA; SINHA, 1991; MILLER, 1995; RESNIK et al., 1996; REID et al., 1999; NESCI et al., 2003). Além disso, esses patógenos podem ter sido favorecidos pelas precipitações pluviais (KUMAR et al., 2008) observadas na semana que antecedeu a primeira colheita, bem como entre a primeira e a segunda colheita, ocasiões em que a umidade relativa do ar apresentava valores superiores a 75% (Figura 1).
O gênero Fusarium, como dito anteriormente, apresentou médias de incidência crescentes nos grãos dos híbridos 2B587 e 2B710, com ajuste linear e, a cada acréscimo de uma unidade no teor umidade nos grãos, a incidência do patógeno aumentou em 1,14 e 3,26%, respectivamente. As médias de incidência de Fusarium spp. no híbrido 2B688 (Figura 4) se ajustaram de forma quadrática, com a incidência estimada em 13,56% no ponto de mínimo (19,9% de umidade).
Da mesma forma que o gênero Aspergillus (Figura 3), o gênero Penicillium (Figura 5 ) apresentou decréscimo da incidência, em função da elevação do teor de umidade nos grãos (MARIN et al., 1998). Todavia, nos híbridos 2B587 e 2B688, as médias se ajustaram de forma quadrática, apresentando nos pontos de máximo (x = 22,89% e x = 23,96% de umidade) as incidências máximas estimadas de y = 81,21% e y = 72,71%, respectivamente. Já as médias de incidência de Penicillium nos grãos do híbrido 2B710 (Figura 5 ) apresentaram ajuste linear decrescente, e o coeficiente angular foi de -3,23%, a cada acréscimo de uma unidade no teor de umidade.
Nas análises toxicológicas realizadas com as amostras de grãos colhidos na safrinha de 2007, não foram detectados quaisquer traços de contaminação por micotoxinas, independente das umidades de colheita. Dessa forma, os resultados sugerem que os patógenos não foram favorecidos pelas condições climáticas desta estação de cultivo (Figura 1), no que tange à produção de micotoxinas, sobretudo pelas baixas temperaturas noturnas observadas no período (ALMEIDA et al., 2000, SANTIN et al., 2000, SILVA et al., 2008).
Safra de verão 2007/2008
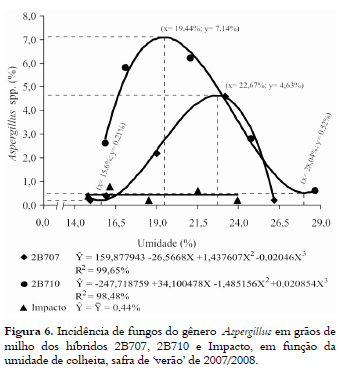
A incidência de Aspergillus spp. foi relativamente maior, em valores médios absolutos, nos grãos dos híbridos 2B707 e 2B710 avaliados na safra de verão de 2007/2008 (Figura 6), quando comparados com os híbridos avaliados na safrinha de 2007 (Figura 3). Isso, provavelmente, pode ser atribuído à ocorrência de precipitações pluviais (Figura 2), durante o período de colheita, o que resultou em acréscimos de tempo entre as colheitas, fato que não ocorreu na safrinha. Além disso, o patógeno pode ter sido favorecido pelas altas temperaturas, características do período de verão (ALMEIDA et al., 2000, SANTIN et al., 2000; SILVA et al., 2008).
A análise de regressão evidenciou que as médias de incidência do gênero Aspergillus se ajustaram de forma cúbica para os híbridos 2B707 e 2B710. No híbrido 2B707, os pontos de mínimo (x = 15,6%) e de máximo (x = 22,67% de umidade) apresentaram as incidências estimadas em y = 0,21% e y = 4,63%, respectivamente. Por sua vez, para o híbrido 2B710 as incidências estimadas foram y = 0,52% e y = 7,14%, nos pontos de mínimo (x = 28,04%) e de máximo (x = 19,44% de umidade), respectivamente. Em relação ao híbrido Impacto, não foi observada diferença significativa (p > 0,05) entre as médias de incidência de Aspergillus spp., pelo teste F (Figura 6).
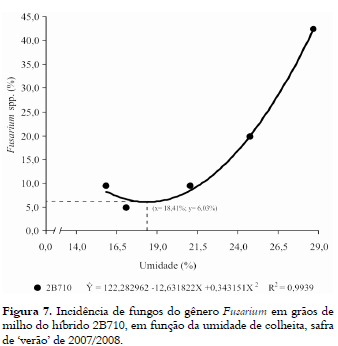
A incidência de Fusarium spp. no híbrido 2B710 se ajustou de forma quadrática (Figura 7), apresentando no ponto mínimo (x = 18,41% de umidade) a incidência mínima estimada de y = 6,03%. O comportamento do patógeno neste híbrido foi semelhante ao que ocorreu nas avaliações da safrinha, ou seja, houve aumento da incidência fúngica, em função da elevação do teor de umidade nos grãos de milho (MARIN et al., 1998).
O gênero Fusarium se comportou de maneira diferenciada nos híbridos 2B707 e Impacto (Figura 8), em relação ao ocorrido no híbrido 2B710 (Figura 7), inclusive com incidências relativamente menores. As médias de incidência do patógeno nos híbridos 2B707 e Impacto se ajustaram de forma cúbica e quadrática, respectivamente. No entanto, a análise de variância da regressão apresentou desvios significativos (p < 0,05), com coeficientes de determinação (R2) baixos para as equações ajustadas. Entretanto, como as equações e seus coeficientes (βn) foram significativos (p < 0,05), pelos testes F e t, respectivamente, optou-se por apresentá-las mesmo assim, atribuindo-se o comportamento biológico do referido patógeno às variações climáticas observadas no período (Figura 2).
No híbrido 2B707, a equação polinomial cúbica apresentou nos pontos de máximo (x = 17,19%) e de mínimo (x = 22,47% de umidade), as incidências estimadas de y = 2,89% e y = 2,27%, respectivamente. Por sua vez, a equação polinomial quadrática, ajustada para o híbrido Impacto, apresentou no ponto de mínimo (x = 19,44% de umidade) y = 3,61% de incidência estimada (Figura 8).
Em relação ao gênero Penicillium, as incidências observadas (Figura 9) nos três híbridos avaliados na safra de verão foram elevadas (DILKIN et al., 2000; SANTIN et al., 2004). Observou-se que o patógeno manteve o comportamento decrescente da incidência, em função da elevação do teor de umidade nos grãos de milho (MARIN et al., 1998). Os híbridos 2B707 e 2B710 apresentaram médias de incidências de Penicillium spp. com ajuste linear, e, a cada acréscimo de uma unidade no teor de umidade, houve redução de 3,05 e 3,79% na incidência do patógeno, no primeiro e no segundo híbrido, respectivamente.
O gênero Penicillium se comportou de maneira bastante distinta no híbrido Impacto, quando comparado aos outros dois híbridos (Figura 9). Da mesma forma que as médias do gênero Fusarium nos híbridos 2B707 e Impacto, as médias do gênero Penicillium, nesse último híbrido, também apresentaram desvio da equação de regressão significativo (p < 0,05). Porém, a exemplo do caso anterior, optou-se por apresentar a equação de regressão polinomial quadrática ajustada, cujo ponto de mínimo foi de x = 21,05% de umidade, no qual a resposta mínima foi de y = 53,65% de incidência.
A incidência dos patógenos observados nos dois períodos avaliados é condizente com os resultados encontrados por Kikuti et al. (2003), no qual predominaram os gêneros Fusarium e Penicillium. Por outro lado, os resultados deste trabalho contrariam àqueles encontrados por Santin et al. (2004) para os gêneros Fusarium e Aspergillus, porém, são condizentes em relação ao gênero Penicillium.
Nas análises toxicológicas realizadas com as amostras de grãos colhidos na safra de verão de 2007/2008, algumas amostras dos híbridos 2B710 e Impacto apresentaram contaminação por aflatoxinas (Tabela 1), com valores observados dentro do limite estabelecido pela legislação brasileira (BRASIL, 2002). Não foram detectados quaisquer traços de contaminação por zearalenona em nenhuma amostra avaliada na safra de verão.
As condições climáticas durante o período de colheita na safra de verão (Figura 2), possivelmente favoreceram a produção das aflatoxinas pelo gênero Aspergillus (Tabela 1), demonstrando que, ainda no campo, o patógeno foi capaz de produzir a toxina (KUMAR et al., 2008). O patógeno também pode ter sido beneficiado pela população de plantas, uma vez que se observou população aproximada de 71.500 plantas ha-1 (5 plantas m-1, com espaçamento de 0,7 m nas entre linhas), o que pode ter favorecido a criação de microclima específico, propício para o desenvolvimento de patógenos causadores de doenças, entre eles os do gênero Aspergillus (FONTOURA et al., 2006).
Apesar das baixas incidências de Aspergillus spp. (ALMEIDA et al., 2000; DILKIN et al., 2000; KUMAR et al., 2008), observadas em todos os híbridos avaliados, nos dois períodos agrícolas, os grãos de milho contaminados pelo patógeno constituem o inóculo inicial (MILLER, 1995; RESNIK et al., 1996; REID et al., 1999; NESCI et al., 2003). Isto indica o potencial do gênero Aspergillus para causar danos aos grãos de milho, quando armazenados, caso o patógeno encontre condições ambientais favoráveis ao seu desenvolvimento, sobretudo, em situações onde o processo de secagem for ineficiente (RADÜNZ et al., 2006; KUMAR et al., 2008).
Bankole e Adebanjo (2003) afirmam que a antecipação da colheita contribui para reduzir o nível de contaminações por micotoxinas, sobretudo as aflatoxinas. Desta forma, em relação aos fungos do gênero Aspergillus, deve-se proceder à secagem criteriosa e imediata dos grãos de milho recém-colhidos, até a umidade segura de armazenamento (BROOKER et al., 1992; BANKOLE; ADEBANJO, 2003; PALACIN et al., 2006; RADÜNZ et al., 2006), por se tratar de fungos com habilidade de colonizar substratos com baixo teor de umidade, sendo, assim, considerados fungos de pós-colheita ou de armazenamento (SANTIN et al., 2004).
Conclusão
Os fungos dos gêneros Aspergillus, Fusarium e Penicillium se comportaram de maneira diferenciada, em função dos teores de umidade nos grãos de milho.
A produção de aflatoxinas ocorreu nos grãos ainda presos às espigas, no campo, pelas condições ambientais favoráveis aos patógenos.
A antecipação da colheita do milho pode contribuir com o melhor aproveitamento do potencial produtivo dos híbridos, desde que a secagem seja realizada o mais breve possível, visando à manutenção da qualidade sanitária dos grãos de milho.
Agradecimentos
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), pela concessão da Bolsa de Estudo; ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão da Bolsa de Produtividade em Pesquisa; ao Instituto Tecnológico Simepar pela cessão dos dados climáticos e à família Brunatti pela cessão da propriedade para a realização do presente estudo.
Received on November 3, 2008.
Accepted on December 19, 2008.
License information: This is an open-access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
- ALMEIDA, A. P.; CORREA, B.; MALLOZZI, M. A. B. Mycoflora and aflatoxin/fumonisin production by fungal isolates from freshly harvested corn hybrids. Brazilian Journal of Microbiology, v. 31, n. 4, p. 321-326, 2000.
- ALVES, W. M.; FARONI, L. R. A.; CORRĘA, P. C.; QUEIROZ, D. M.; TEIXEIRA, M. M. Influęncia dos teores de umidade de colheita na qualidade do milho (Zea mays L.) durante o armazenamento. Revista Brasileira de Armazenamento, v. 26, n. 2, p. 40-45, 2001.
- AOAC-Association of Official Analytical Chemists. Official methods of analysis of International Chemistry Society: 4th version. 16th ed. Arlington, 1998. (Software Adobe and E-DOC/CJS).
- ASAE-American Society of Agricultural Engineers. Standards, engineering practices and data developed and adopted by the American Society of Agricultural Engineers 34th ed. St. Joseph, 1987.
- BANKOLE, S. A.; ADEBANJO, A. Mycotoxins in food in West Africa: current situation and possibilities of controlling it. African Journal of Biotechnology, v. 2, n. 9, p. 254-263, 2003.
- BRASIL. Ministério da Agricultura e Reforma Agrária. Regras para análise de sementes Brasília: SNDA/DNDV/CLAV, 1992.
- BRASIL. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 274, de 15 de outubro de 2002. Limites máximos de aflatoxinas admissíveis no leite, no amendoim, no milho. Diário Oficial da União, Brasília, 2002.
- BROOKER, D. B.; BAKKER-ARKEMA, F. W.; HALL, C. W. Drying and storage of grains and oilseeds New York: Van Nostrand Reinhold, 1992.
- DILKIN, P.; MALLMANN, C. A.; SANTURIO, J. M.; HICKMANN, J. L. Classificaçăo macroscópica, identificaçăo da microbiota fúngica e produçăo de aflatoxinas em híbridos de milho. Cięncia Rural, v. 30, n. 1, p. 137-141, 2000.
- EGLI, D. B.; TEKRONY, D. M. Species differences in seed water status during seed maturation and germination. Seed Science Research, v. 7, n. 1, p. 3-11, 1997.
- FARIAS, A. X.; ROBBS, C. F.; BITTENCOURT, A. M.; ANDERSEN, P. M.; CORRĘA, T. B. S. Contaminaçăo endógena por Aspergillus spp. em milho pós-colheita no Estado do Paraná. Pesquisa Agropecuária Brasileira, v. 35, n. 3, p. 617-621, 2000.
- FONTOURA, D.; STANGARLIN, J. R.; TRAUTMANN, R. R.; SCHIRMER, R.; SCHWANTES, D. O.; ANDREOTTI, M. Influęncia da populaçăo de plantas na incidęncia de doenças de colmo em híbridos de milho na safrinha Acta Scientiarum. Agronomy, v. 28, n. 4, p. 545-551, 2006.
- KIKUTI, A. L. P.; VASCONCELOS, R. C.; MARINCEK, A.; FONSECA, A. H. Desempenho de sementes de milho em relaçăo ŕ sua localizaçăo na espiga. Cięncia e Agrotecnologia, v. 27, n. 4, p. 765-770, 2003.
- KUMAR, V.; BASU, M. S.; RAJENDRAN, T. P. Mycotoxin research and mycoflora in some commercially important agricultural commodities. Crop Protection, v. 27, n. 6, p. 891-905, 2008.
- MALAIYANDI, M.; BARRETTE, J. P.; WAVROCK, P. L. Bis-diazotized benzidine as a spray reagent for detecting zearalenone on thin layer chromatoplates. Journal Association of Official Analytical Chemists, v. 59, n. 5, p. 959-962, 1976.
- MARIN, S.; SANCHIS, V.; SAENZ, R.; RAMOS, A. J.; VINAS, I.; MAGAN, N. Environmental-factors, in-vitro interactions, and niche overlap between Fusarium moniliforme, F. proliferatum, and F. graminearum, Aspergillus and Penicillium species from maize grain. Mycological Research, v. 102, n. 7, p. 831-837, 1998.
- MILLER, J. D. Fungi and mycotoxins in grain: implications for stored product research. Journal of Stored Products Research, v. 31, n. 1, p. 1-16, 1995.
- NESCI, A.; RODRIGUEZ, M.; ETCHEVERRY, M. Control of Aspergillus growth and aflatoxin production using antioxidants at different conditions of water activity and pH. Journal of Applied Microbiology, v. 95, n. 2, p. 279-287, 2003.
- PALACIN, J. J. F.; LACERDA FILHO, A. F.; CECON, P. R.; MONTES, E. J. M. Determinaçăo das isotermas de equilíbrio higroscópico de milho (Zea mays L.) nas espigas. Revista Brasileira de Armazenamento, v. 31, n. 2, p. 197-205, 2006.
- RADÜNZ, L. L.; DIONELLO, R. G.; ELIAS, M. C.; BARBOSA, F. F. Influęncia do método de armazenamento na qualidade física e biológica de grăos de milho. Revista Brasileira de Armazenamento, v. 31, n. 2, p. 136-143, 2006.
- REID, L. M.; NICOL, R. W.; OUELLET, T.; SAVARD, M.; MILLER, J. D.; YOUNG, J. C.; ATEWART, D. W.; SCHAAFSMA, A. W. Interaction of Fusarium graminearum and F. moniliforme in maize ears: disease progress, fungal biomass, and mycotoxin accumulation. Phytopathology, v. 89, n. 11, p. 1028-1037, 1999.
- RESNIK, S.; NEIRA, S.; PACIN, A.; MARTINEZ, E.; APRO, N.; LATREITE, S. A survey of the natural occurrence of aflatoxins and zearalenone in Argentina field maize 19831994. Food Additives and Contaminants, v. 13, n. 1, p. 115-120, 1996.
- SAINI, H. S.; WESTGATE, M. E. Reproductive development in grain crops during drought. Advances in Agronomy, v. 68, p. 59-96, 1999.
- SANTIN, E.; MAIORKA, A.; ZANELLA, I.; MAGON, L. Micotoxinas do Fusarium spp. na avicultura comercial. Cięncia Rural, v. 31, n. 1, p. 185-190, 2000.
- SANTIN, J. A.; REIS, E. M.; MATSUMURA, A. T. S.; MORAES, M. G. Efeito do retardamento da colheita de milho na incidęncia de grăos ardidos e de fungos patogęnicos. Revista Brasileira de Milho e Sorgo, v. 3, n. 2, p. 182-192, 2004.
- SILVA, E. C.; MURAOKA, T.; MONTEIRO, R. O. C.; BUZETTI, S. Análise econômica da adubaçăo nitrogenada no milho sob plantio direto em sucessăo a plantas de cobertura em Latossolo Vermelho. Acta Scientiarum. Agronomy, v. 29, n. 4, p. 445-452, 2007.
- SILVA, J. O.; CÂNDIDO, L. M. B.; NOVELLO, D.; MACHADO, C. Ocorręncia de aflatoxinas em arroz consumido por militares do Exército brasileiro por cromatografia em camada delgada e cromatografia líquida de alta eficięncia. Cięncia e Agrotecnologia, v. 32, n. 4, p. 1238-1244, 2008.
- SINHA, K. K.; SINHA, A. K. Impact of stored grain pests on seed deterioration and aflatoxin contamination in maize. Journal of Stored Products Research, v. 28, n. 3, p. 211-219, 1991.
- SOARES, L. M. V.; RODRIGUEZAMAYA, D. B. Survey of aflatoxins, ochratoxin A, zearalenone, and sterigmatocystin in some Brazilian foods by using multi-toxin thin-layer chromatographic method. Journal of the Association of Official Analytical Chemists, v. 72, n. 1, p. 22-29, 1989.
- TRENTO, S. M.; IRGANG, H.; REIS, E. M. Efeito de rotaçăo de culturas, de monocultura e de densidade de plantas na incidęncia de grăos ardidos em milho. Fitopatologia Brasileira, v. 27, n. 4, p. 609-613, 2002.
Datas de Publicação
-
Publicação nesta coleção
25 Ago 2011 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
19 Dez 2008 -
Recebido
03 Nov 2008