Resumos
A imobilização celular representa uma alternativa para a condução de bioprocessos. As células ficam retidas em matrizes e podem ser utilizadas por longos períodos. O objetivo deste trabalho foi testar uma nova metodologia de imobilização de fungos com custo reduzido, avaliar a viabilidade e segurança dos fungos submetidos ao novo método de encapsulamento e determinar a temperatura ideal para armazenar os fungos imobilizados. Os micélios dos fungos Aspergillus niger, Cladosporium cladosporioides e Penicillium solitum foram misturados com 15 g de arroz triturado e 3 g de alginato de sódio, que gotejava em uma solução de cloreto de cálcio a 0,25 M para a formação dos grânulos. Após a secagem em estufa a 26ºC, os grânulos foram armazenados em temperaturas ambiente, geladeira e freezer. Os plaqueamentos foram realizados a cada 15 dias em meio de cultura. As avaliações do tamanho das colônias e esporulação foram realizadas 7, 14 e 21 dias após o plaqueamento, durante 195 dias para A. niger, 225 dias para C. cladosporioides e 210 dias para P. solitum. A temperatura de armazenamento não afetou o desenvolvimento micelial de A. niger e P. solitum. Porém, a esporulação foi reduzida para os grânulos armazenados no freezer. O desenvolvimento micelial de C. cladosporioides foi influenciado pela temperatura. Os grânulos conservados em temperatura ambiente tiveram menor viabilidade. Na análise de microscopia eletrônica de varredura, observou-se que a imobilização é um método seguro no qual o micélio fúngico permanece no interior do grânulo, facilitando o transporte, o armazenamento e a aplicação de micro-organismos.
imobilização celular; encapsulamento de fungos; alginato de sódio; formulação granulada
Cellular immobilization represents an alternative for the bioprocess conduction, in which the cells are kept in a matrix and can be used over long periods. The objective of this work was to test a new fungi immobilization methodology with reduced cost to evaluate the viability of these fungi when submitted to the new encapsulation method, and to determine the ideal temperature to store the immobilized fungi. The mycelium of the fungi Aspergillus niger, Cladosporium cladosporioides and Penicillium solitum were mixed with 15 g of titrated rice and 3 g of sodium alginate, which was dripped in a 0.25 M calcium chloride solution for the formation of pellets. After drying in an oven at 26ºC, the granules were stored at three temperatures: room, refrigerator and freezer. The platings were carried out every 15 days in culture medium. The evaluations of the colony size and sporulation were carried out 7, 14 and 12 days after plating, for 195 days for A. niger, 225 days for C. cladosporioides, and 210 days for P. solitum. Storage temperature did not affect the mycelial development of A. niger and P. solitum. However, sporulation was reduced for the granules stored in the freezer. The mycelial development of C. cladosporioides was influenced by temperature. The granules conserved at room temperature had lower viability than those stored in the refrigerator and freezer. In the Scanning Electronic Microscopy analysis, it was observed that the immobilization is a safe method in which the fungus mycelium remains inside the granule, facilitating transport, storage and application of micro-organisms.
cellular immobilization; encapsulation of fungi; sodium alginate; granulated formulation
INTRODUÇÃO
A imobilização ou encapsulação de micro-organismos é um termo que descreve as muitas formas com que as células podem ser aprisionadas em matrizes ou suportes. Pesquisas na área de imobilização de células microbianas têm aumentado consideravelmente no setor de biotecnologia. Nessa perspectiva, a utilização de micro-organismos imobilizados em suportes inertes e de baixo custo é hoje um dos enfoques para a aplicação em processos agroindustriais no país (BECERRA et al., 2005BECERRA, M.; BAROLI, B.; FADDA, A.M.; BLANCO MÉNDEZ, J.; GONZÁLEZ, M.I.S. Lactose bioconvertion by calcium alginate immobilization of Kluyveromyces lactis cells. Enzime and Microbial Technology, v.29, n.12, p.506-512, 2005.).
A imobilização de células microbianas ou enzimas representa uma alternativa para a condução de bioprocessos, uma vez que os biocatalizadores ficam retidos em uma matriz e podem ser utilizados inúmeras vezes (CANILHA et al., 2006CANILHA, L.; CARVALHO, W.; SILVA, J.B.A. Biocatalizadores imobilizados: uso de células e enzimas imobilizadas em processos biotecnológicos. Biotecnologia, Ciência e Desenvolvimento, Brasília, n.36, n.6, p.48-57. 2006.). Diversos estudos mostram que o encapsulamento de fungos, bactérias, leveduras e enzimas promove a formação de um excelente inoculante sólido, de fácil aplicação, manuseio e transporte. As células microbianas imobilizadas podem ser armazenadas por longos períodos, permanecendo viáveis.
A imobilização em alginato é um método simples, barato, não tóxico para as células microbianas e que permite que as células realizem seus processos biológicos sem desestabilizar o granulo. A ruptura da esfera pode acontecer devido ao crescimento micelial do fungo ou pelo acúmulo de metabólitos secundários (VILELA el al., 2012VILELA, A.; SCHULLER, D.; MENDES-FARIA, A.; CÔRTES-REAL, M. Redução da acidez volátil de vinho por células de Saccharomyces cerevisiae imobilizadas em esferas de alginato-quitosano. Revista Enologia, São Paulo, p.38-42, 2012.).
O encapsulamento ou imobilização de células por aprisionamento em esferas tem recebido crescente atenção nos últimos anos, resultando em um grande número de aplicações biotecnológicas, agriculturais e até mesmo na medicina. Em comparação com células livres em suspensão, a imobilização tem a vantagem da utilização contínua das células, além de promover a proteção das células imobilizadas (VILELA et al. 2012VILELA, A.; SCHULLER, D.; MENDES-FARIA, A.; CÔRTES-REAL, M. Redução da acidez volátil de vinho por células de Saccharomyces cerevisiae imobilizadas em esferas de alginato-quitosano. Revista Enologia, São Paulo, p.38-42, 2012.). Em comparação com o cultivo tradicional de micro-organismos em meios de cultura, com a imobilização não há gastos com reagentes e não são necessários tempo e espaço para a manutenção das colônias (FENICE et al., 2000FENICE, M.; SELBMAN, L.; FEDERICI, F.; VASSILEV, N. Application of encapsulated Penicillium variable P16 in solubilization of rock phosphate. Bioresource Technology, Essex, v.73, n.10, p.157-162. 2000.). Existem dois tipos de leitos para imobilização microbiana, os que aprisionam fisicamente as células, e os que as células são aderidas à superfície. No primeiro caso, as células são encapsuladas em glóbulos ou fibras de polissacarídeos, proteínas ou polímeros sintéticos. No segundo caso, as células são fixadas ao suporte de imobilização diretamente por ligações químicas (iônicas ou covalentes) (MEERSMAN, 1992MEERSMAN, E. Use of monolayer carrier in brewery. Cerevisiae and Biotecnology, Elmsford, v.17, n.6, p.55-59. 1992.).
Os fungos filamentosos são utilizados na produção de enzimas de interesse comercial, nos processos de biorremediação e biocontrole, na fertilização do solo, em produção de alimentos e diversos outros processos. Considerando os fatos expostos, os objetivos deste trabalho foram: (i) testar uma nova metodologia, de baixo custo, para imobilização de fungos filamentos; (ii) avaliar a viabilidade dos fungos quando submetidos ao novo método de encapsulamento; (iii) determinar a temperatura ideal para armazenar os fungos imobilizados; e (iv) comprovar a segurança dos grânulos contendo os fungos por microscopia eletrônica de varredura.
MATERIAL E MÉTODOS
Encapsulamento dos fungos
Foram selecionados três gêneros diferentes de fungos filamentosos para serem encapsulados e analisar a viabilidade desses fungos em grãos de alginato. Foram selecionadas para o estudo as espécies Aspergillus niger, Cladosporium cladosporioides e Penicillium solitum, em razão da capacidade da utilização dessas espécies em processos agroindustriais. Os isolados utilizados foram obtidos de grãos de café provenientes de lavouras do município de Lavras (MG), e estão depositados na micoteca do Ecocentro/EPAMIG (Empresa Agropecuária de Minas Gerais).
Para produção dos micélios fúngicos, três discos de cultivos foram repicados para Erlenmeyers de 500 mL de capacidade, contendo 100 mL de meio líquido BD (batata-dextrose), seguido de incubação a 25°C sob agitação rotativa a 120 rpm, por 15 dias (MAFIA et al., 2003MAFIA, R.G.; ALFENAS, A.C.; MAFFIA, L.A.; VENTURA, G.M.; SANFUENTES, E.A. Encapsulamento de Thricoderma inhamatum para o controle biológico de Rhizoctonia solani na propagação clonal de eucalyptus. Revista Brasileira de Fitopatologia, Brasília, v.28, n.1, p.101-105. 2003.). A massa de micélio foi coletada e, após remover o excesso de meio de cultura por filtragem, o micélio foi seco em estufa de ventilação com filtro a 26°C por três dias. O micélio seco foi triturado com um moinho elétrico.
Para produzir a formulação do tipo granulada, utilizou-se a metodologia adaptada de LEWIS; PAPAVIZAS (1985)LEWIS, J.A.; PAPAVIZAS, G.C. Characteristics of alginate formulated with Trichoderma and Gliocladium and their effect on the proliferation of the fungi in soil. Plant Pathology, London, v.34, n.6, p.571-577. 1985., pela qual 15 g de arroz cru triturado e peneirado foram misturadas com 200 mL de água destilada e autoclavadas. Após o resfriamento, adicionou-se 0,50 g do micélio triturado e 3 g de alginato de sódio. A mistura foi transferida para um aparato de quatro saídas, na qual foi gotejada em uma solução de cloreto de cálcio (CaCl2) a 0,25 M, o que permitiu a formação de grânulos esféricos de diâmetro regular. Os grânulos formados foram mantidos por 10 minutos na solução de CaCl2, sendo posteriormente lavados em água destilada para remover o excesso de cloreto de cálcio. Os grânulos foram colocados em bandejas previamente esterilizadas e submetidos à secagem em estufa com filtro, sob ventilação forçada, durante dois dias, a 26°C.
Para avaliar a viabilidade do agente biológico e a inexistência de contaminação, os grânulos foram transferidos para placas de Petri contendo meio de cultura BDA para posterior observação das colônias puras.
Viabilidade dos fungos encapsulados e conservados em diferentes temperaturas
Para avaliar a viabilidade das três espécies de fungos encapsulados e a melhor condição de armazenamento, foram realizados testes com os grânulos armazenados nas temperaturas: ambiente (18 a 27°C), geladeira (4 a 7°C) e freezer (-3 a -6°C), sendo plaqueados em meio de cultura BDA (batata-dextrose-ágar), com intervalos de 15 dias, durante 195 dias para A. niger, 225 dias para C. cladosporioides e 210 dias para P. solitum. A quantificação da esporulação de A. niger, C. cladosporioides e P. solitum foi realizada por contagem de esporos, utilizando a câmara de Neubauer.
A avaliação do desenvolvimento das colônias puras mantidas em BOD a 25ºC foi realizada 7, 14 e 21 dias após o plaqueamento, sendo calculada a média do diâmetro das colônias (mm) para obtenção do Índice de Crescimento Micelial (ICM) de acordo com a fórmula:
Onde: C é o tamanho das colônias e D os dias em que as medições foram feitas.
Na instalação dos experimentos, o delineamento experimental utilizado foi o inteiramente casualizado (DIC), em parcelas subdivididas no tempo, com três repetições para o crescimento micelial e duas repetições para avaliar a esporulação. Os tratamentos das parcelas foram constituídos por três temperaturas de armazenamento (ambiente, geladeira e freezer), e as subparcelas constituíram-se do tempo de armazenamento que variou para os fungos estudados (13 avaliações para o fungo A. niger, 15 avaliações para o fungo C. cladosporioides e 14 avaliações para P. solitum). As médias de ICM e esporulação, quando significativas pelo teste F, foram avaliadas por análise de regressão (dias de armazenamento) e teste de Tukey (P ≤ 0,05) (temperatura de armazenamento).
Microscopia eletrônica de varredura
As amostras foram preparadas e fotografadas de acordo com o protocolo para preparação de amostras para microscopia eletrônica de varredura (MEV), proposto por ALVES (2004)ALVES, E. Apostila do curso introdutório de microscopia eletrônico de varredura, Lavras: Departamento de Fitopatologia da UFLA, 2004. 43p.. Os grânulos de alginato de sódio com fungos imobilizados foram fixados em solução de Karnovsky modificada (glutaraldeído 2,5%, formaldeído 2,5% em tampão cacodilato de sódio 0,05 M, pH 7,2, CaCl2 0,001 M), por um período mínimo de 24 horas. Foram transferidos no mínimo cinco fragmentos de cada tratamento para uma solução-tampão de cacodilato (0,05 M) e lavados três vezes durante dez minutos. Em seguida, foram pós-fixados em solução de tetróxido de ósmio 1% em água por uma hora, lavados em água destilada três vezes e desidratados em soluções com concentrações crescentes de acetona (30, 50, 70, 90 e 100%). Posteriormente, os espécimes foram levados à secagem ao ponto crítico com CO2 líquido em aparelho Balzers CPD 030; em seguida, foram montados em suportes de alumínio (stubs) e cobertos com ouro (evaporador Balzers SCD 050) para observação em microscópio eletrônico de varredura LEO EVO 40.
RESULTADOS
Viabilidade dos fungos imobilizados em grânulos de alginato de sódio
A técnica utilizada ofereceu condições para produzir uma formulação biológica constituída de pequenos grânulos de tamanhos uniformes (1 a 2 mm) e moderadamente resistentes. Essa formulação apresentou-se mais leve do que muitas preparações líquidas, e menos volumosas que as preparações com matéria orgânica. As três espécies de fungo utilizadas no estudo apresentaram excelente viabilidade frente ao novo método de imobilização, o que provou a eficácia do encapsulamento, utilizando a matriz de alginato de sódio para a conservação do micélio fúngico. Na avaliação do índice de crescimento micelial de A. niger, não foi observada interação significativa entre a temperatura de armazenamento e o tempo de armazenamento, demonstrando que a temperatura de armazenamento dos grânulos não influenciou o crescimento micelial. Observou-se que o fungo A. nigerapresentou ótima viabilidade durante o período de 195 dias de avaliação, mantendo todas as características morfológicas e fisiológicas (Fig. 1).
Crescimento micelial de A. niger imobilizado em alginato de sódio e armazenado em diferentes temperaturas.
Observou-se interação significativa da temperatura de armazenamento versus tempo de armazenamento na análise do índice de crescimento micelial do fungo C. cladosporioides, o que demonstra que a temperatura de armazenamento é um fator significante para manter a viabilidade do imobilizado do fungo (Fig. 2). Os grânulos armazenados em temperatura ambiente, a partir de 195 dias, apresentaram queda no crescimento micelial, resultando em perda total da viabilidade a partir de 225 dias após a imobilização. O ponto máximo de crescimento micelial para os grânulos armazenados em temperatura ambiente foi de 103 dias. Após esse período, houve declínio do crescimento micelial.
Crescimento micelial de C. cladosporioides imobilizado em alginato de sódio e armazenado em diferentes temperaturas.
Assim como observado para o fungo A. niger, a interação entre a temperatura de armazenamento e o tempo de armazenamento para o índice de crescimento micelial de P. solitum não foi significativa, indicando que a temperatura de armazenamento (geladeira, ambiente ou freezer) dos grânulos não influenciou o crescimento micelial. Os grânulos com o fungo A. nigerapresentaram crescimento micelial até 165 dias após a imobilização, independentemente da temperatura de armazenamento, com posterior queda (Fig. 3).
Crescimento micelial de P. solitum imobilizado em alginato de sódio e armazenado em diferentes temperaturas.
Esporulação dos fungos imobilizados em alginato de sódio
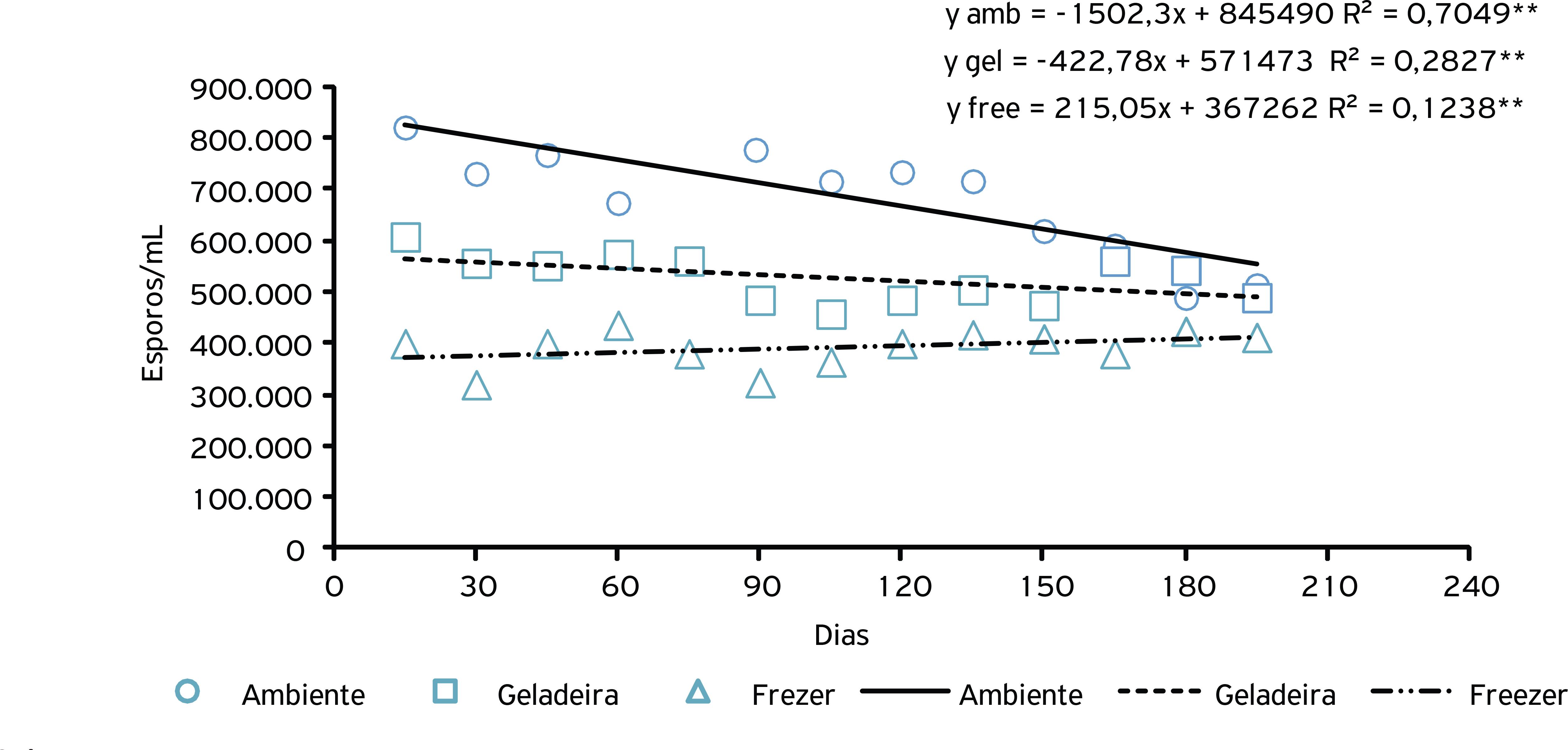
A avaliação da esporulação por A. niger crescidos a partir dos grânulos armazenados no freezer (-3 a -6ºC) apresentaram redução na quantidade de esporos quando comparados com os armazenados em temperatura ambiente (18 a 27ºC) e geladeira (4 a 7ºC) ao longo do período estudado. Os grânulos armazenados em temperatura ambiente apresentaram maior quantidade de esporos, sendo a temperatura ideal para o armazenamento (Fig. 4).
Esporulação do fungo A. niger imobilizado em alginato de sódio e submetido a diferentes temperaturas de armazenamento.
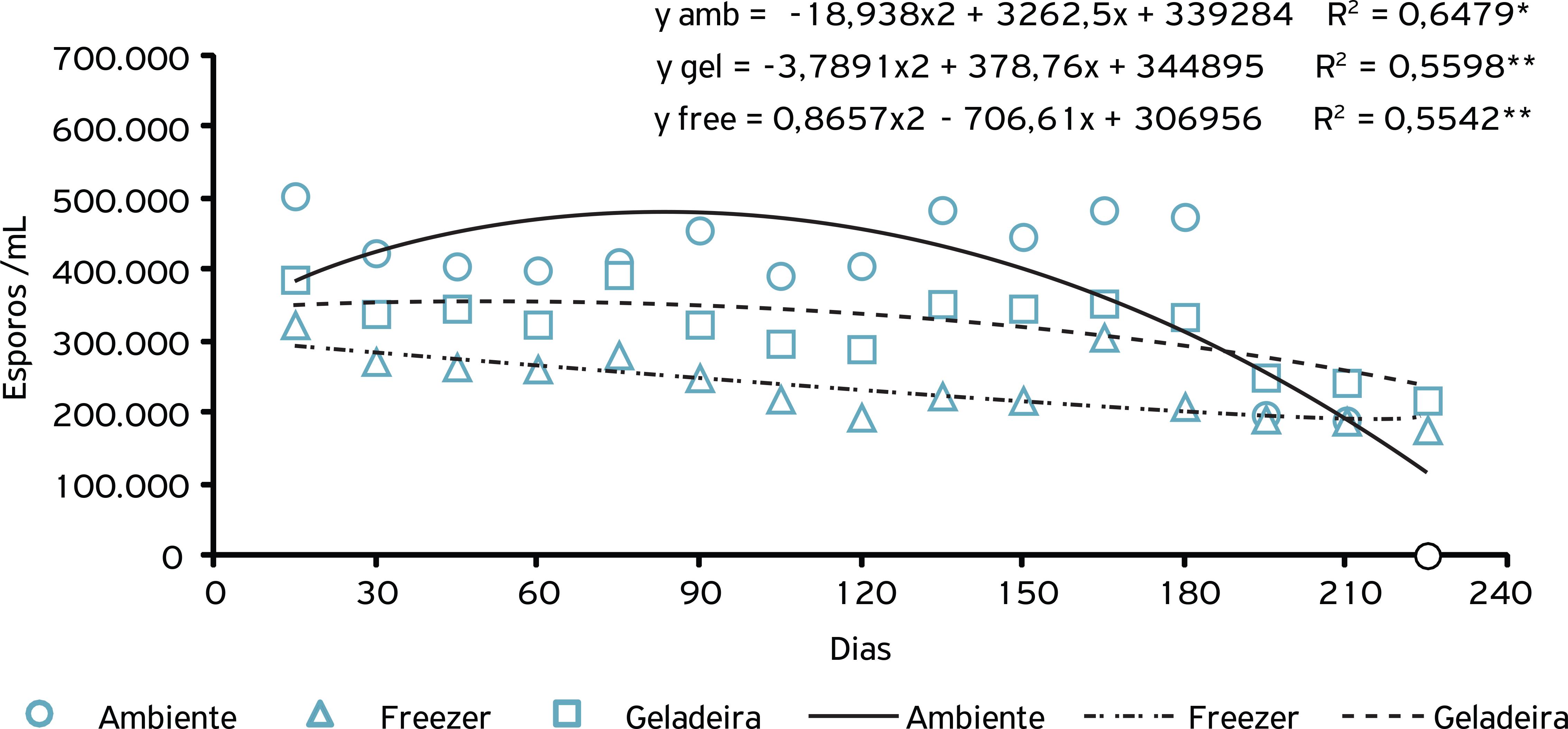
Na análise da esporulação de C. cladosporioides imobilizado e armazenado em diferentes temperaturas, observou-se interação significativa entre a temperatura de armazenamento e o tempo de armazenamento. Os grânulos armazenados nas menores temperaturas (freezer e geladeira) apresentaram menor esporulação que os grânulos armazenados em temperatura ambiente até os 210 dias. Após este período, a esporulação do fungo nos grânulos armazenados em temperatura ambiente chegou a zero, devido à inviabilidade de crescimento dos mesmos. A esporulação dos grânulos armazenados em temperatura ambiente atingiu seu ponto máximo aos 86 dias de armazenamento, com posterior declínio da esporulação (Fig. 5).
Esporulação do fungo C. cladosporioides imobilizado em alginato de sódio e armazenado em diferentes temperaturas.
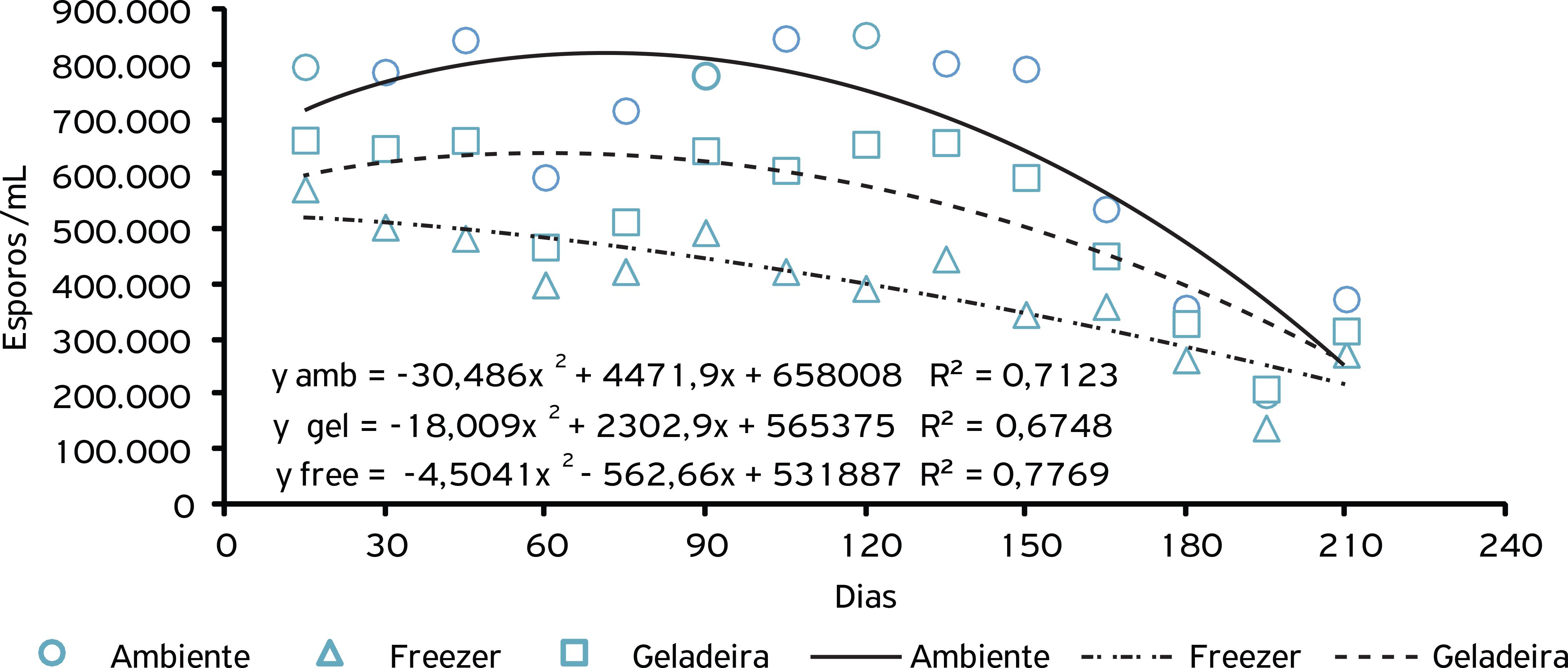
A temperatura de armazenamento influenciou a esporulação do fungo P. solitum crescido a partir do grânulo de alginato. Observaram-se que os grânulos armazenados em temperatura ambiente apresentaram maior esporulação, e que os grânulos armazenados em freezer tiveram menor esporulação (Fig. 6).
Esporulação de P. solitum imobilizado em alginato de sódio e armazenado sob diferentes temperaturas
Ao avaliar as diferentes temperaturas de armazenamento para os fungos imobilizados, apenas C. cladosporioides apresentou maior índice de crescimento micelial quando armazenado em freezer e geladeira, superior ao armazenado em temperatura ambiente (Tabela 1). Com relação à esporulação de A. niger, C. cladosporioides e P. solitum, observou-se que a melhor temperatura de armazenamento foi a temperatura ambiente. O armazenamento dos grânulos com os fungos imobilizados no freezer reduziu a esporulação deles, indicando efeito negativo de baixas temperaturas na variável analisada (Tabela 1).
Visualização dos grânulos de alginato de sódio com fungos através de microscopia eletrônica de varredura
A MEV permitiu observar a disposição das hifas e esporos após o preparo da formulação. Foi possível visualizar a superfície e o interior dos grânulos.
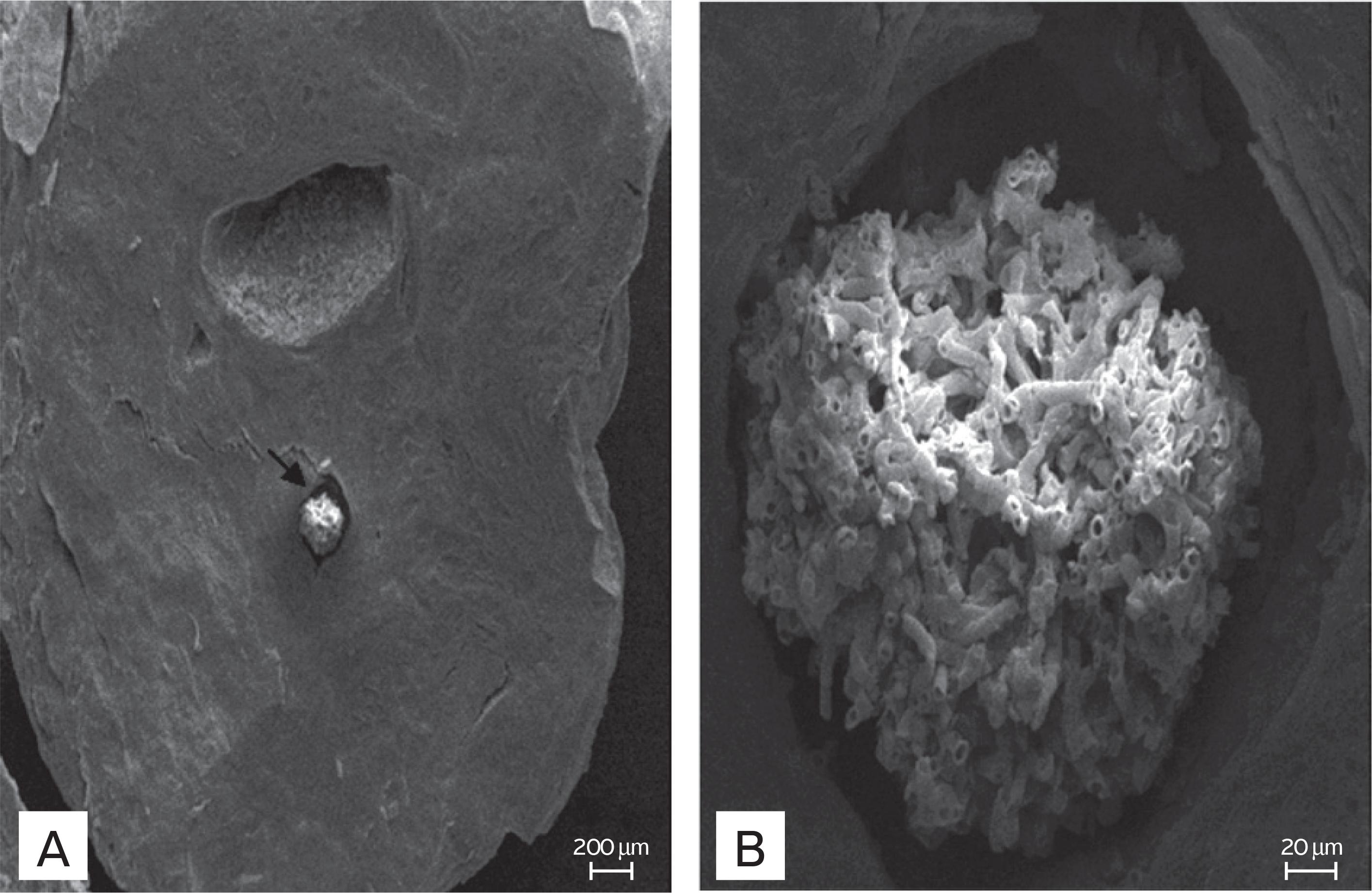
É possível notar que na superfície do granulo não foram encontradas hifas nem esporos dos fungos, o que garante a segurança para o transporte de micro-organismos, protegendo o micélio e também as pessoas que manipulam esses grânulos, livrando-as de contaminação (Fig. 7).
Eletromicrografia da superfície do grânulo de alginato de sódio com fungos imobilizados, sem a presença de micélio.
O encapsulamento produz uma formulação segura, já que as hifas e os esporos só aparecem no interior dos grânulos. Isso também confirma que a imobilização protege o micélio fúngico, por estar envolto em uma massa de alginato de sódio e farelo de arroz (Figs. 8A e 8B).
Eletromicrografia dos grânulos cortados. Na foto (A), a seta indica um emaranhado de hifas no centro do grânulo. Na foto (B), aproximação do emaranhado de hifas da foto (A).
DISCUSSÃO
Os métodos de imobilização apresentam vantagens e desvantagens. Embora a estabilidade das células não possa ser garantida, as seguintes vantagens podem ser citadas: o inóculo permanece retido no suporte e possibilita o melhor controle das propriedades reais do meio, maior pureza e o aumento do rendimento (PRADELLA, 2001PRADELLA, J.G.C. Reatores com células imobilizadas: biotecnologia industrial. São Paulo: E. Blücher. 2001. p372.). Além disso, apresenta a possibilidade de utilização contínua das células e a proteção do alginato (VILELA et al., 2012VILELA, A.; SCHULLER, D.; MENDES-FARIA, A.; CÔRTES-REAL, M. Redução da acidez volátil de vinho por células de Saccharomyces cerevisiae imobilizadas em esferas de alginato-quitosano. Revista Enologia, São Paulo, p.38-42, 2012.).
Dependendo da espécie fúngica, a imobilização em alginato permite que o inoculante seja armazenado por períodos maiores que sete meses (KUEK et al., 1992KUEK, C.; TOMMERUP, I.C.; MALAJCZUC, N. Hydrogel bead inocula for the production of ectomycorrhizal eucalypts for plantations. Mycological Research, Cambridge, v.96, n.4, p.273-277. 1992.). Micro-organismos armazenados sob condições de baixas temperaturas e longos períodos de tempo podem sofrer danos à parede celular devido à formação de cristais de gelo, que crescem e rompem a estrutura celular e molecular dos micro-organismos (MEDEIROS et al., 1992MEDEIROS, A.C.S.; MENDES, M.A.S.; FERREIRA, M.A.S.V.; ARAGÃO, F.J.L. Avaliação quali-quantitativa de fungos associados à semente de aroeira. Revista Brasileira de Sementes, Brasília, v.19, n.1, p.51-55. 1992.).
Os micro-organismos possuem um tempo de viabilidade quando preservados por meio de diferentes técnicas. Após esse período, ocorre a sua degeneração natural, que perde a capacidade de formar novos descendentes (KITAMOTO et al., 2002KITAMOTO, Y.; SUZUKI, A.; SHIMADA, S.; YAMANAKA, K. A new method for the preservation of fungus stock cultures by deep-freezing. Mycoscience, v.43, n.12, p.143-149. 2002.). Cita-se como exemplo o fungo C. cladosporioides, que tem como temperatura mínima de crescimento -4ºC, e temperatura ótima, 22ºC. De acordo com SAUTOUR et al. (2002)SAUTOUR, M.; MANSUR, C.S.; BENSOUSSAN, M.; DIVIES, C.; DANTIGNY, P. Comparison of the effects of temperature and water activity on growth rate of food spoilage moulds. Journal of Industrial Microbiology & Biotechnology, Hampshire, v.28, n.10, p.311-315. 2002., as faixas de temperatura até 22ºC são as ideais para o bom funcionamento metabólico de C. cladosporioides, atingindo assim seus níveis ótimos de desenvolvimento micelial e mantendo sua capacidade de multiplicação; temperaturas inferiores reduzem a taxa de crescimento drasticamente.
ROSA (2010)ROSA, P.R.F. Produção de probióticos com Lactobacillus imobilizados em alginato de cálcio empregando soro de queijo. 2010. 108. Dissertação (Mestrado) - Universidade Federal de Uberlândia, Uberlândia, 2010., em estudo sobre a taxa de sobrevivência de Lactobacillus acidophilus, Bifidobacterium e Streptococcus thermophillus imobilizados frente a pHs ácidos, observou que as células imobilizadas apresentaram taxa de sobrevivência de 100, 40 e 30% respectivamente, quando comparadas com células em suspensão.
A redução da quantidade de água é uma característica que reduz o metabolismo das células, quando armazenadas. A redução da quantidade de água associada a temperaturas baixas torna o metabolismo dos micro-organismos ainda mais lento. Quando esses elementos, que são fatores-chave para a redução do metabolismo celular, são retirados, ocorre a viabilidade das células microbianas por longos períodos de armazenamento (GIROTTO et al., 2008GIROTTO, M.J.; AQUINO, L.F.B.; PEREZ, R.B.; NAVES, M.F.; SACCO, S.R. O uso de fungos nematófagos no controle biológico de nematóides parasitas: revisão de literatura. Revista Científica de Medicina Veterinária, Curitiba, n.10, n.6, p.1-7. 2008.).
O tamanho dos grânulos obtidos no presente estudo estão entre 1 e 2 mm. A eficiência da imobilização de células por alginato e a qualidade do produto são influenciadas pelo tamanho das esferas. Esferas com até 3 mm são utilizadas com a finalidade de melhorar a eficiência do processo em que são aplicadas, assim como a vida útil de produto (ROSA, 2010ROSA, P.R.F. Produção de probióticos com Lactobacillus imobilizados em alginato de cálcio empregando soro de queijo. 2010. 108. Dissertação (Mestrado) - Universidade Federal de Uberlândia, Uberlândia, 2010.).
A técnica empregada para imobilização com alginato de sódio foi adequada para os fungos A. niger, C. cladosporioides e P. solitum, que apresentaram crescimento satisfatório durante o período estudado. Foi produzida uma formulação leve e fácil de ser aplicada. O longo período de viabilidade dos fungos indica que a técnica pode também ser aplicada como método de preservação de fungos.
Através das eletromicrografias, foi possível observar que a imobilização em grânulos de alginato de sódio é uma formulação segura, pela qual o micélio fúngico permanece apenas no interior dos grânulos. O fato de os fungos permanecerem viáveis no interior dos grânulos pode ser explicado pela porosidade dos grânulos de alginato, que permite a sobrevivência dos fungos, mas não seu desenvolvimento, devido à ausência de água (ROSA, 2010ROSA, P.R.F. Produção de probióticos com Lactobacillus imobilizados em alginato de cálcio empregando soro de queijo. 2010. 108. Dissertação (Mestrado) - Universidade Federal de Uberlândia, Uberlândia, 2010.).
AGRADECIMENTOS
À Fundação de Amparo à Pesquisa do estado de Minas Gerais (FAPEMIG), pela bolsa concedida. À EPAMIG Lavras e DFP/UFLA, onde os trabalhos foram realizados.
REFERÊNCIAS
- ALVES, E. Apostila do curso introdutório de microscopia eletrônico de varredura, Lavras: Departamento de Fitopatologia da UFLA, 2004. 43p.
- BECERRA, M.; BAROLI, B.; FADDA, A.M.; BLANCO MÉNDEZ, J.; GONZÁLEZ, M.I.S. Lactose bioconvertion by calcium alginate immobilization of Kluyveromyces lactis cells. Enzime and Microbial Technology, v.29, n.12, p.506-512, 2005.
- CANILHA, L.; CARVALHO, W.; SILVA, J.B.A. Biocatalizadores imobilizados: uso de células e enzimas imobilizadas em processos biotecnológicos. Biotecnologia, Ciência e Desenvolvimento, Brasília, n.36, n.6, p.48-57. 2006.
- FENICE, M.; SELBMAN, L.; FEDERICI, F.; VASSILEV, N. Application of encapsulated Penicillium variable P16 in solubilization of rock phosphate. Bioresource Technology, Essex, v.73, n.10, p.157-162. 2000.
- GIROTTO, M.J.; AQUINO, L.F.B.; PEREZ, R.B.; NAVES, M.F.; SACCO, S.R. O uso de fungos nematófagos no controle biológico de nematóides parasitas: revisão de literatura. Revista Científica de Medicina Veterinária, Curitiba, n.10, n.6, p.1-7. 2008.
- KITAMOTO, Y.; SUZUKI, A.; SHIMADA, S.; YAMANAKA, K. A new method for the preservation of fungus stock cultures by deep-freezing. Mycoscience, v.43, n.12, p.143-149. 2002.
- KUEK, C.; TOMMERUP, I.C.; MALAJCZUC, N. Hydrogel bead inocula for the production of ectomycorrhizal eucalypts for plantations. Mycological Research, Cambridge, v.96, n.4, p.273-277. 1992.
- LEWIS, J.A.; PAPAVIZAS, G.C. Characteristics of alginate formulated with Trichoderma and Gliocladium and their effect on the proliferation of the fungi in soil. Plant Pathology, London, v.34, n.6, p.571-577. 1985.
- MAFIA, R.G.; ALFENAS, A.C.; MAFFIA, L.A.; VENTURA, G.M.; SANFUENTES, E.A. Encapsulamento de Thricoderma inhamatum para o controle biológico de Rhizoctonia solani na propagação clonal de eucalyptus. Revista Brasileira de Fitopatologia, Brasília, v.28, n.1, p.101-105. 2003.
- MEDEIROS, A.C.S.; MENDES, M.A.S.; FERREIRA, M.A.S.V.; ARAGÃO, F.J.L. Avaliação quali-quantitativa de fungos associados à semente de aroeira. Revista Brasileira de Sementes, Brasília, v.19, n.1, p.51-55. 1992.
- MEERSMAN, E. Use of monolayer carrier in brewery. Cerevisiae and Biotecnology, Elmsford, v.17, n.6, p.55-59. 1992.
- PRADELLA, J.G.C. Reatores com células imobilizadas: biotecnologia industrial. São Paulo: E. Blücher. 2001. p372.
- ROSA, P.R.F. Produção de probióticos com Lactobacillus imobilizados em alginato de cálcio empregando soro de queijo. 2010. 108. Dissertação (Mestrado) - Universidade Federal de Uberlândia, Uberlândia, 2010.
- SAUTOUR, M.; MANSUR, C.S.; BENSOUSSAN, M.; DIVIES, C.; DANTIGNY, P. Comparison of the effects of temperature and water activity on growth rate of food spoilage moulds. Journal of Industrial Microbiology & Biotechnology, Hampshire, v.28, n.10, p.311-315. 2002.
- VILELA, A.; SCHULLER, D.; MENDES-FARIA, A.; CÔRTES-REAL, M. Redução da acidez volátil de vinho por células de Saccharomyces cerevisiae imobilizadas em esferas de alginato-quitosano. Revista Enologia, São Paulo, p.38-42, 2012.
Datas de Publicação
-
Publicação nesta coleção
Apr-Jun 2014
Histórico
-
Recebido
16 Out 2012 -
Aceito
20 Dez 2013