RESUMO:
Este trabalho teve por objetivo avaliar a sensibilidade de isolados dos fungos Metarhizium anisopliae (Metsch.) Sorok. e Beauveria bassiana (Bals). Vuill. ao efeito das radiações solar e ultravioleta e da temperatura. Conídios dos isolados foram expostos, por vários períodos, aos raios de um simulador solar em diversas irradiâncias e a uma lâmpada de raios ultravioleta germicida. Os conídios do isolado de M. anisopliae foram também expostos às temperaturas de 19,5; 24,2 e 31,0ºC, e os do isolado de B. bassiana a 19,4; 20,8 e 28,3ºC, e 18,7; 23,8 e 30,9ºC. Avaliou-se a germinação de conídios pelo teste de viabilidade. Os isolados dos fungos se mostraram bastantes sensíveis aos raios do simulador solar e aos raios ultravioleta. A germinação de ambos sofreu significativa redução a partir de 30 minutos de exposição à radiação do simulador solar. O efeito mais severo foi evidenciado pelo isolado de B. bassiana, com grande redução da germinação dos conídios em todas as irradiâncias testadas. A sensibilidade à radiação ultravioleta também foi grande, pois ocorreu acentuada redução da germinação dos conídios do isolado de M. anisopliae (38,2%) e de B. bassiana (65%) já aos 30 segundos de exposição. A temperatura afetou a viabilidade de ambos os fungos. Temperaturas entre 23,8 e 31ºC favoreceram a germinação dos conídios, enquanto temperaturas próximas de 20ºC dificultaram a germinação.
PALAVRAS-CHAVE:
Beauveria bassiana; Metarhizium anisopliae; controle biológico; exposição à luz
ABSTRACT:
This study aimed to access the sensibility of isolates of the fungus Metarhizium anisopliae (Metsch.) Sorok. and Beauveria bassiana (Bals.) Vuill. to the effect of solar and ultraviolet radiation and temperature. Conidia were exposed for various periods to the rays from a solar simulator at various irradiances, and to light germicidal ultraviolet rays. Conidia of the isolate of M. anisopliae were also exposed to temperatures of 19.5, 24.2 and 31.0ºC and the isolate of B. bassiana to 19.4, 20.8 and 28.3ºC, and also to 18.7, 23.8 and 30.9ºC. The germination of conidia was evaluated by the viability test. The fungal isolates showed to be very sensitive to the solar simulator and ultraviolet rays. Germination of both was significantly decreased starting from 30 minutes of exposure to the rays of the solar simulator. The most severe effect was evidenced by the isolate of B. bassiana with great reduction in conidia germination in all the tested irradiances. Sensitivity to ultraviolet radiation was also great, showing a marked reduction in the germination of M. anisopliae (38.2%) and B. bassiana (65%) conidia after 30 seconds of exposure. The temperature affected the viability of both fungi. Temperatures ranging of 23.8 to 31ºC favor the germination of conidia while temperatures around 20ºC constrained germination.
KEYWORDS:
Beauveria bassiana; Metarhizium anisopliae; biological control; light exposure
INTRODUÇÃO
Os fungos entomopatogênicos são considerados importantes agentes para o controle biológico de pragas (Inglis et al., 2008INGLIS, G.D.; DUKE, G.M.; GOETTEL, M.S.; KABALUK, J.T. Genetic diversity of Metarhizium anisopliae var. anisopliae in southwestern British Columbia. Journal of Invertebrate Pathology , San Diego, v.98, n.1, p.101-113, 2008.). Entre os mais utilizados se encontram o Metarhizium anisopliae e Beauveria bassiana (Alves, 1998ALVES, S.B. Fungos entomopatogênicos. In: ALVES, S.B. (Ed.) Controle microbiano de insetos 2 ed. Piracicaba: FEALQ, 1998. Cap.11, p.289-381.).
M. anisopliae ganhou especial atenção dos pesquisadores brasileiros quando foi observada sua ocorrência epizoótica sobre Mahanarva posticata (Stal) (Hemiptera: Cercopidae), a cigarrinha da folha da cana-de-açúcar, resultando em conhecido programa de utilização do fungo para o controle dessa praga (Alves, 1998ALVES, S.B. Fungos entomopatogênicos. In: ALVES, S.B. (Ed.) Controle microbiano de insetos 2 ed. Piracicaba: FEALQ, 1998. Cap.11, p.289-381.). Com a expansão do sistema de colheita mecanizada da cana-de-açúcar, vários trabalhos (Almeida et al., 2004ALMEIDA, J.E.M.; BATISTA FILHO, A.; SANTOS, A. Controle da cigarrinha-da-raiz da cana-de-açúcar, Mahanarva fimbriolata , com o fungo entomopatogênico Metarhizium anisopliae . STAB: Açúcar, Álcool e Subprodutos , Piracicaba, v.22, n.4, p.42-45, 2004.; Dinardo-Miranda et al., 2004DINARDO-MIRANDA, L.L.; VASCONCELOS, A.C.M.; FERREIRA, J.M.G.; GARCIA JUNIOR, C.A.; COELHO, A.L.; GIL, M.A. Eficiência de Metarhizium anisiopliae (Metsch.) no controle de Mahanarva fimbriolata (Stal) (Hemiptera: Cercopidae) em cana-de-açúcar. Neotropical Entomology , Londrina, v.33, n.6, p.743-749, 2004.) mostraram que o fungo pode ser utilizado com sucesso no controle da cigarrinha-da-raíz Mahanarva fimbriolata (Stal) (Hemiptera: Cercopidae).
Devido à sua distribuição cosmopolita e frequente presença na natureza, Beauveria bassiana é um dos mais encontrados e reconhecidos fungos patógenos de insetos (Rehner, 2005REHNER, S.A. Ecology and evolution of fungal endophytes and their role against insects. In: VEGA, F.E.; BLACKWELL, M. (Eds.) Insect-fungal associations: ecology and evolution . Oxford: Oxford University Press, 2005. p.74-96.). No Brasil usam-se aplicações do fungo para o controle de pragas de culturas importantes como a broca-do-cafeeiro Hypothenemus hampei Ferrari (Coleoptera: Scolytidae) (Neves et al., 2010NEVES, P.M.J.O.; MOINO JUNIOR, A.; ALVES, S.B. Recomendações para o uso de micoinseticidas destinados ao controle da broca-do-cafeeiro. In: ALVES, L.F.A.; NEVES, P.M.J.O.; FARIA, M.R. (Orgs.) Recomendações para utilização de fungos entomopatogênicos no controle de pragas . Piracicaba: CP2 , 2010. p.25-28.) e a broca-da-bananeira Cosmopolites sordidus Germar (Coleoptera: Curculionidae) (Batista Filho et al., 2010BATISTA FILHO, A.; MOINO JUNIOR, A.; ALVES, S.B. Recomendações para o uso de micoinseticidas destinados ao controle da broca-da-bananeira. In: ALVES, L.F.A.; NEVES P.M.J.O.; FARIA, M.R. (Orgs.). Recomendações para utilização de fungos entomopatogênicos no controle de pragas . Piracicaba: CP2, 2010. p.21-24. ).
Quando aplicados no campo, os entomopatógenos estão sujeitos à ação de fatores bióticos e abióticos, que podem influenciar sua sobrevivência, propagação e infecção no hospedeiro. Entre os abióticos, destaca-se a radiação solar, que é um dos principais fatores ambientais capazes de diminuir o tamanho das populações de fungos e/ou reduzir a disseminação de algumas espécies no ambiente (Wraight et al., 2007WRAIGHT, S.P.; INGLIS, G.D.; GOETTEL, M.S. Fungi. In: LACEY, L.A.; KAYA, H.K. (Eds.) Field manual of techniques in invertebrate pathology . 2 ed. Dordrecht: Springer, 2007. Cap.4, p.223-248.).
A radiação ultravioleta (UV) é um dos maiores problemas ambientais que afetam esses fungos, podendo provocar danos diretos e indiretos que reduzem sua eficiência contra os insetos, atuando na germinação dos conídios e sobre os estágios iniciais do tubo germinativo (Braga et al., 2001aBRAGA, G.U.L.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Variability in response to UV-B among species and strains of Metarhizium anisopliae isolates from sites at latitudes from 61ºN to 54ºS. Journal of Invertebrate Pathology , San Diego, v.78, n.2, p.98-108, 2001a., 2001bBRAGA, G.U.; FLINT, S.D.; MESSIAS, C.L.; ANDERSON, A.J.; ROBERTS, D.W. Effects of UV-B irradiance on conidia and germinants of the entomopathogenic Hyphomycete Metarhizium anisopliae: a study of reciprocity and recovery. Photochemistry and Photobiology Amsterdam, v.73, n.2, p.140-146, 2001b., 2001cBRAGA, G.U.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Both solar UVA and UVB radiation impair conidial culturability and delay germination in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.74, n.5, p.734-739, 2001c.; 2002BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Damage and recovery from UV-B exposure in conidia of the entomopathogens Verticillium lecani and Aphanocladium album . Mycologia , New York, v.94, n.6, p.912-920, 2002.). Os danos diretos incluem a inativação dos conídios, danos letais ao DNA e mutações. Entre os indiretos estão o aquecimento e a dessecação dos conídios (Nicholson et al., 2000NICHOLSON, W.L.; MUNAKATA, N.; HORNECK, G.; MELOSH, H.J.; SETLOW, P. Resistence of Bacillus endospores to extreme terrestrial end extraterrestrial environments. Microbiology and Molecular Biology Reviews , New York, v.64, n.3, p.548-572, 2000.).
Outro fator importante para a sobrevivência dos fungos entomopatogênicos no campo é a temperatura. Altas temperaturas prejudicam a sobrevivência do fungo, ao passo que baixas temperaturas aumentam sua persistência, característica essa desejável (Rath, 2002RATH, A.C. Ecology of entomopathogenic fungi in field soils. In: INTERNATIONAL COLLOQUIUM ON INVERTEBRATE PATHOLOGY AND MICROBIAL CONTROL, 8, Foz do Iguaçu, PR, 2002. Anais... Foz do Iguaçu: Society for Invertebrate Pathology, 2002. p.65-71.). Temperaturas maiores do que 30ºC dificultam o crescimento e a sobrevivência de M. anisopliae no solo, enquanto temperaturas medianas (21 a 27ºC) favorecem o crescimento e a sobrevivência do fungo (Lanza et al., 2009LANZA, L.M.; MONTEIRO, A.C.; MALHEIROS, E.B. Sensibilidade de Metarhizium anisopliae à temperatura e umidade em três tipos de solos. Ciência Rural , Santa Maria, v.39, n.1, p.6-12, 2009.).
A eficiência de fungos entomopatogênicos no controle de insetos-praga depende, entre outros aspectos, de sua sobrevivência e atividade em condições compatíveis. Temperatura e intensidade de radiação são fatores abióticos bastante variáveis e seus efeitos sobre as populações desses fungos no ambiente necessitam ser melhor conhecidos. Assim sendo, este trabalho objetivou avaliar a sensibilidade de isolados dos fungos M. anisopliae e B. bassiana ao efeito das radiações solar e ultravioleta e da temperatura.
MATERIAL E MÉTODOS
Foram utilizados os isolados JAB 68 de M. anisopliae, obtido de Deois flavopicta Stal (Hemiptera: Cercopidae), e IBCB 66 de B. bassiana (sensu lato), obtido de Hypothenemus hampei Ferrari (Coleoptera: Scolytidae). Os isolados foram mantidos em culturas estoques a 4ºC, na coleção do Laboratório de Microbiologia do Departamento de Produção Vegetal da Faculdade de Ciências Agrárias e Veterinárias (FCAV) da Universidade Estadual Paulista (UNESP). Para utilização nos ensaios foram cultivados em meio de batata, dextrose e ágar (BDA) a 27 ± 0,5ºC por 15 dias. Esporos removidos da superfície das colônias foram transferidos para tubos contendo mistura (1:1) de solução de NaCl a 0,89% (p.v-1) e solução de Tween 80(r) a 0,1% (v.v-1). Após vigorosa agitação em agitador elétrico de tubos, as suspensões foram padronizadas, com auxílio da câmara de Neubauer, na concentração de 106 conídios.mL-1.
Para irradiar os conídios do isolado de M. anisopliae foram usadas as irradiâncias de 680, 750, 780 e 800 Wm-2, na faixa espectral de 250 a 1150 nm. Essas irradiâncias são valores médios ocorridos nos meses de novembro e dezembro de 2008, e janeiro e fevereiro de 2009 no município de Jaboticabal, São Paulo (21º 14' 05" S e 48º 17' 09" W) (dados fornecidos pela Estação Agroclimatológica da FCAV/UNESP), meses esses geralmente de maior aplicação do fungo para o controle da cigarrinha-da-raiz da cana-de-açúcar, no período de uma safra. Os conídios do isolado de B. bassiana foram submetidos às irradiâncias de 590, 570, 720, 640 Wm-2, na faixa espectral já mencionada e correspondem, respectivamente, às irradiâncias médias ocorridas no município de Jaboticabal, São Paulo, nos meses que compõem as estações climáticas do outono, inverno, primavera e verão, tomando por base o período de 2008/2009 (dados fornecidos pela Estação Agroclimatológica da FCAV/UNESP), considerando a possibilidade de aplicação do fungo em qualquer época do ano.
A irradiação foi feita utilizando um simulador solar Oriel(r), modelo 68.820, Strafford, CT, USA, ajustado para emissão das irradiâncias desejadas, que foram medidas com auxílio de um radiômetro modelo 70.260, Strafford, CT, U.S.A. Em placas de Petri de 60 mm de diâmetro esterilizadas foram colocados 5 mL de suspensões de conídios que foram expostas à luz do simulador, em cada uma das irradiâncias mencionadas, por períodos de 0, 30, 60, 120 e 180 minutos. Durante a irradiação as placas de análise ficaram dispostas dentro de outra placa de Petri de 150 mm de diâmetro contendo gelo, para evitar aquecimento pela radiação infravermelha. A irradiação foi realizada em temperatura ambiente (26 a 28ºC). Para cada tratamento (irradiância e tempo de exposição) foram utilizadas três placas (repetições) e para cada placa foi feita uma suspensão de conídios.
O ensaio de exposição à radiação UV foi realizado na câmara asséptica. Suspensões de conídios (5 mL) contidas em placas de Petri de 60 mm de diâmetro esterilizadas foram submetidas, por 0, 30, 60, 120, 180 e 240 segundos a uma lâmpada de raios ultravioleta germicida Toshiba de 30W. Essas placas, em grupo de 3 por tratamento, ficaram distantes 30 cm da lâmpada e foram submetidas aos raios ultravioleta na intensidade de 12 µW/cm2, medido com auxílio de um medidor digital Instrutherm, modelo MRV 201. A irradiação foi realizada em temperatura ambiente (25 a 28ºC). Após a exposição dos conídios à luz do simulador solar ou aos raios UV, foi avaliada a germinação por meio do teste de viabilidade, usando lâminas de microscopia cobertas com fina camada de BDA, conforme metodologia descrita por Francisco et al. (2006FRANCISCO, E.A.; MOCHI, D.A.; CORREIA, A.C.B.; MONTEIRO, A.C. Influence of culture media in viability test of conidia of entomopathogenic fungi. Ciência Rural , Santa Maria, v.36, n.4, p.1309-1312, 2006.).
No ensaio para avaliar o efeito da temperatura foram utilizados:
-
para o isolado de M. anisopliae as temperaturas de 19,5; 24,2 e 31,0ºC, que foram as médias das temperaturas mínima, mediana e máxima ocorridas nos meses de novembro e dezembro de 2008, e janeiro e fevereiro de 2009, no município de Jaboticabal, São Paulo (dados fornecidos pela Estação Agroclimatológica da FCAV/UNESP);
-
para B. bassiana utilizou-se 19,4; 20,8 e 28,3ºC, e 18,7; 23,8 e 30,9ºC, que foram as médias de temperaturas mínima, mediana e máxima ocorridas em Jaboticabal, São Paulo, respectivamente, nas estações climáticas do outono e inverno, e primavera e verão, tomando por base o período de março de 2008 a março de 2009 (dados fornecidos pela Estação Agroclimatológica da FCAV/UNESP).
Para avaliar a germinação dos conídios, lâminas de microscopia cobertas com fina camada de BDA foram previamente mantidas por 6 horas em estufa ajustada com uma das temperaturas antes mencionadas, para deixar o meio na temperatura desejada. Em seguida foi adicionada a suspensão de conídios e feita a avaliação pelo teste de viabilidade, conforme descrito por Francisco et al. (2006FRANCISCO, E.A.; MOCHI, D.A.; CORREIA, A.C.B.; MONTEIRO, A.C. Influence of culture media in viability test of conidia of entomopathogenic fungi. Ciência Rural , Santa Maria, v.36, n.4, p.1309-1312, 2006.).
Em todos os experimentos empregou-se o delineamento inteiramente casualizado. A germinação de conídios expostos aos raios do simulador solar foi analisada segundo o esquema fatorial 5 x 4 (5 períodos e 4 intensidades de exposição), e a germinação de conídios expostos à radiação UV foi analisada segundo o esquema fatorial 6 x 2 (6 períodos e 2 espécies fúngicas). A análise da germinação dos conídios expostos a diferentes temperaturas foi feita segundo o esquema fatorial 3 x 1 (3 temperaturas e 1 espécie fúngica). Os dados foram submetidos à análise de variância pelo teste F e as médias comparadas pelo teste de Tukey a 5% de significância. Para execução das análises estatísticas usou-se o programa ESTAT (1997ESTAT: Sistema para análises estatísticas . Versão 2.0. Jaboticabal: Faculdade de Ciências Agrárias e Veterinárias, 1997. Disponível em: <Disponível em: http://www.fcav.unesp.br/#!/informatica/softwares/
>. Acesso em: 10 Set. 2009.
http://www.fcav.unesp.br/#!/informatica/...
).
RESULTADOS E DISCUSSÃO
Os conídios do isolado de M. anisopliae foram severamente afetados pela exposição aos raios do simulador solar. Conídios expostos por 30 minutos às irradiâncias de 680, 750 e 800 Wm-2, não tiveram a germinação afetada, mas na irradiância de 780 Wm-2 houve redução significativa da germinação a partir desse período de exposição. Após 120 minutos de exposição, a germinação foi menor do que 30% em todas as irradiâncias, mostrando que os conídios do isolado do fungo são pouco tolerantes à radiação solar e que a exposição por mais do que 30 minutos pode comprometer sua eficiência no controle (Tabela 1).
A irradiância teve menor interferência na germinação dos conídios do isolado do fungo do que o período de exposição. Nos períodos compreendidos entre 0 e 120 horas não houve redução da germinação dos conídios expostos às diferentes irradiâncias. Quando a exposição foi feita por 180 minutos, verificou-se menor efeito deletério sobre os conídios na irradiância de 780 Wm-2, resultando em maior germinação do que a verificada nas demais irradiâncias, embora os valores de germinação tenham sido bastante baixos nesse período de exposição (Tabela 1).
O isolado de B. bassiana mostrou grande sensibilidade à radiação do simulador solar, pois a redução da germinação variou entre 32 e 35% já aos 30 minutos de exposição, considerando todas as irradiâncias. A exposição pelos demais períodos reduziu gradativamente a germinação em todas as irradiâncias, com menor efeito na irradiância de 750 Wm-2, onde a germinação permaneceu constante entre 30 e 60 minutos de exposição (Tabela 2).
Analisando-se o efeito da irradiância em cada período de exposição verificou-se que a germinação dos conídios do isolado de B. bassiana foi afetada a partir de 60 minutos de exposição (Tabela 2).
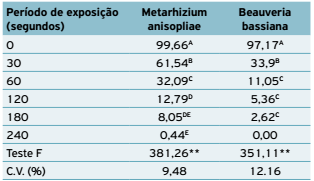
Os isolados de ambos os entomopatógenos se mostraram bastante susceptíveis à radiação UV germicida (Tabela 3). Após 30 segundos de exposição à irradiação houve significativa redução da germinação (38,2%) dos conídios do isolado de M. anisopliae , redução essa que se acentuou com o aumento do período de exposição, até 240 segundos quando praticamente não restaram conídios germinados. O isolado de B. bassiana mostrou ser mais susceptível à radiação UV germicida do que o de M. anisopliae , pois com 30 segundos de exposição houve 65% de redução da germinação, e essa redução se manteve com o aumento do período de exposição, encontrando-se apenas 2,6% conídios germinados após 180 minutos de exposição.
A radiação solar tem papel importante na redução da viabilidade e morte de muitos esporos (Carlile; Watkinson, 1994CARLILE, M.J.; WATKINSON, S.C. The fungi . San Diego: Academic Press, 1994. 428p.). Na maioria dos estudos realizados com fungos filamentosos observou-se redução acentuada da viabilidade dos conídios após curtos períodos de exposição à radiação solar ou radiação UV. Conídios de B. bassiana , M. anisopliae e Metarhizium flavoviride Gams & Rozsypal diminuiram acentuadamente a viabilidade com o aumento do período de exposição à radiação UV incidente de simulador solar (Morley-Davies et al., 1996MORLEY-DAVIES, J.; MOORE, D.; PRIOR, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research , Cambridge, v.100, n.1, p.31-38, 1996.). Conídios das linhagens ARSEF 23 e ARSEF 25 de M. anisopliae expostos diretamente à radiação solar por apenas 4 horas ficaram totalmente inativos (Braga et al., 2001cBRAGA, G.U.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Both solar UVA and UVB radiation impair conidial culturability and delay germination in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.74, n.5, p.734-739, 2001c.). A exposição de B. bassiana à radiação UV por 30 minutos ocasionou diminuição significativa no crescimento (Cagán; Svercel, 2001CAGÁN, L.; SVERCEL, M. The influence of ultraviolet light on pathogenicity of entomopathogenic fungus Beauveria bassiana (Balsamo) Vuillemin to the European corn borer, Ostrinia Nubilalis Hbn. (Lepidoptera: Crambidae). Journal of Central European Agriculture , Zagreb, v.2, n.3-4, p.228-232, 2001.) e reduziu em 99,4% a viabilidade de conídios após 60 minutos de exposição (Inglis et al., 1995INGLIS, G.D.; GOETTEL, M.S.; JOHNSON, D.L. Influence of ultraviolet light protectants on persistence of the entomopathogenic fungus, Beauveria bassiana . Biological Control , Orlando, v.5, n.4, p.581-590, 1995.). Fernandes et al. (2007FERNANDES, E.K.; RANGEL, D.E.; MORAES, A.M.; BITTENCOURT, V.R.; ROBERTS, D.W. Variability in tolerance to UV-B radiation among Beauveria spp. isolates. Journal of Invertebrate Pathology , San Diego,v.96, n.3, p.237-243, 2007.) observaram uma considerável redução na germinação de conídios do isolado Bb 19 de B. bassiana após 2 horas de exposição à radiação UV-B.
Neste estudo essa redução de viabilidade foi verificada usando intensidades de radiação solar encontradas em condições naturais. A redução da germinação dos conídios decorre da necessidade das células consumirem energia para reparar danos ocasionados ao ácido nucléico e às proteínas, diminuindo a atividade celular para reparação dos sistemas lesados (Hirao et al., 2000HIRAO, A.; Kong, Y.Y.; Matsuoka, S.; WAKEHAM, A.; RULAND, J.; Yoshida, H.; Liu, D.; Elledge, S.J.; MAK, T.W. DNA damage-induced activation of p53 by checkpoint kinase Chk2. Science , Washington, v.287, n.5459, p.1824-1827, 2000.; Zhou; Elledge, 2000ZHOU, B.B.S.; ELLEDGE, S.J. The DNA damage response: putting checkpoints in perspective. Nature , London, v.408, n.6811, p.433-439, 2000.).
A sensibilidade dos conídios à radiação solar e UV está relacionada com sua coloração (Braga et al., 2006BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; ANDERSON, A.J.; ROBERTS, D.W. Conidial pigmentation is important to tolerance against solar-simulated radiation in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.82, n.2, p.418-422, 2006.; Rangel et al., 2006RANGEL, D.E.N.; BUTLER, M.J.; TORABINEJAD, J.; ANDERSON, A.J.; BRAGA, G.U.L.; DAY, A.W.; ROBERTS, D.W. Mutants and isolates of Metarhizium anisopliae are diverse in their relationships between conidial pigmentation and stress tolerance. Journal of Invertebrate Pathology , San Diego, v.93, n.3, p.170-182, 2006.). A pigmentação pode influenciar na tolerância de leveduras e fungos filamentosos à radiação (Braga et al., 2002BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Damage and recovery from UV-B exposure in conidia of the entomopathogens Verticillium lecani and Aphanocladium album . Mycologia , New York, v.94, n.6, p.912-920, 2002.). Conídios com tonalidade escura, laranja, creme e marrom podem ser tolerantes ao UV, devido aos carotenoides que os protegem contra as lesões da radiação (Eijk et al., 1979EIJK, G.W.; MUMMERY, R.S.; ROEYMANS, H.J.; VALADON, L.R. Comparative study of carotenoids of Aschersonia aleyrodis and Aspergillus giganteus . Antonie van Leeuwenhoek , Amsterdam, v.45, n.3, p.417-422, 1979.). A coloração clara influencia a inativação do conídio pela UV (Ignoffo; Garcia, 1992IGNOFFO, C.M.; GARCIA, C. Influence of conidial color on inactivation of several entomogenous fungi (Hyphomycetes) by simulated sunlight. Environmental Entomology , Lanham, v.21, n.4, p.913-917, 1992.). Segundo esses autores, conídios de Aspergillus niger Tieghem com coloração muito escura foram mais tolerantes à radiação UV do que isolados de M. anisopliae , B. bassiana e Nomuraea rileyi (Farlow) Samson.
A importância da pigmentação de conídios de M. anisopliae na sensibilidade à radiação solar foi estudada por Braga et al. (2006BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; ANDERSON, A.J.; ROBERTS, D.W. Conidial pigmentation is important to tolerance against solar-simulated radiation in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.82, n.2, p.418-422, 2006.), que verificaram que os conídios com pigmentação verde escuro são mais tolerantes. Metarhizium robertsii cultivado em meio PDAY sob luz visível contínua produziu conídios com tolerância à radiação UV-B quase duas vezes maior do que conídios produzidos pelo cultivo do fungo no mesmo meio, mas no escuro (Rangel et al., 2011RANGEL, D.E.N.; FERNANDES, E.K.K.; BRAGA, G.U.L.; ROBERTS, D.W. Visible light during mycelial growth and conidiation of Metarhizium robertsii produces conidia with increased stress tolerance. FEMS Microbiology Letters , Oxford, v.315, n.2, p.81-86, 2011.). Linhagens de Clonostachys rosea mostraram diferentes sensibilidades à radiação UV-B (Costa et al., 2012COSTA, L.B.; RANGEL, D.E.; MORANDI, M.A.; BETTIOL, W. Impact of UV-B radiation on Clonostachys rosea germination and growth. World Journal of Microbiology and Biotechnology , Dordrecht, v.28, n.7, p.2497-2504, 2012.). Portanto, a sensibilidade de linhagens ou isolados fúngicos às radiações solar e UV pode variar (Rangel et al., 2006BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Damage and recovery from UV-B exposure in conidia of the entomopathogens Verticillium lecani and Aphanocladium album . Mycologia , New York, v.94, n.6, p.912-920, 2002.). A diferença na sensibilidade dos isolados dos fungos utilizados neste trabalho à radiação do simulador solar e UV pode ser atribuída à pigmentação dos conídios, pois os de M. anisopliae têm coloração verde, devido à presença de pigmentos na parede, enquanto os conídios de B. bassiana têm coloração branca, provavelmente com pouco pigmento na parede.
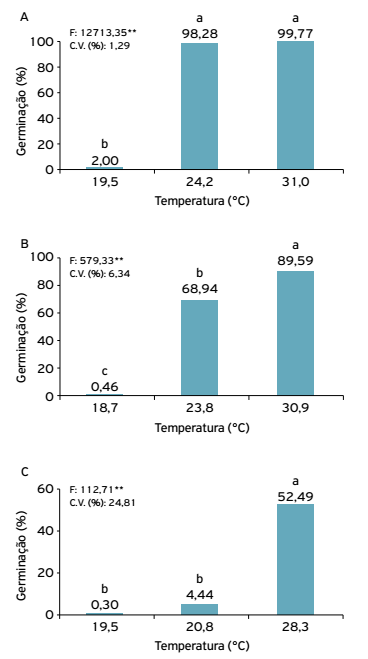
A germinação dos conídios dos isolados de ambos os fungos foi afetada pela temperatura. Nas temperaturas de 24,2 e 31ºC, a germinação dos conídios do isolado de M. anisopliae foi maior do que 98%, enquanto que a 19,5ºC houve drástica redução da germinação (Fig. 1A). Essas temperaturas correspondem às médias ambientais obtidas no período de novembro a fevereiro, meses em que normalmente mais ocorre a aplicação de M. anisopliae para o controle da cigarrinha-da-raiz da cana-de-açúcar. Os resultados sugerem que os períodos mais frios do dia podem prejudicar a germinação do conídio, devendo ser evitados para aplicar o fungo no campo.
Germinação de conídios do isolado de Metarhizium anisopliae expostos às temperaturas mínima, mediana e máxima ocorridas no município de Jaboticabal, São Paulo, no período de novembro de 2008 a fevereiro de 2009 (A), e do isolado de Beauveria bassiana exposto às mesmas temperaturas referentes às estações climáticas da primavera e verão (B), e do outono e inverno (C), ocorridas no mesmo município, no período de março de 2008 a março de 2009.
No período compreendido pelas estações climáticas da primavera e verão, onde predominaram temperaturas médias maiores do que 23,8ºC, houve maior germinação dos conídios do isolado de B. bassiana (Fig. 1B). Nas estações do outono e inverno, com temperaturas médias próximas a 20ºC, a germinação dos conídios foi drasticamente reduzida (Fig. 1C).
Temperatura e luz são fatores ambientais que regulam o desenvolvimento e processos fisiológicos da maioria dos organismos (Babitha et al., 2008BABITHA, S.; CARVAHLO, J.C.; SOCCOL, C.R.; PANDEY, A. Effect of light on growth, pigment production and culture morphology of Monascus purpureus in solid-state fermentation. World Journal of Microbiology and Biotechnology , Dordrecht, v.24, n.11, p.2671-2675, 2008.). Segundo Iskandarov et al. (2006ISKANDAROV, U.S.; GUZALOVA, A.G.; DAVRANOV, K.D. Effects of nutrient medium composition and temperature on the germination of conidia and the entomopathogenic activity of the fungi Beauveria bassiana and Metarhizium anisopliae . Applied Biochemistry and Microbiology , New York,v.42, n.1, p.72-76, 2006.), a melhor germinação dos conídios de B. bassiana e M. anisopliae ocorre na faixa de 20 a 35ºC. Isolados de M. anisopliae var. anisopliae e M. anisopliae var. acridum obtidos nas latitudes 61ºN a 54ºS apresentaram grande variabilidade na tolerância à temperatura. Em geral, isolados provenientes de latitudes mais altas demonstraram maior suscetibilidade ao calor do que isolados obtidos perto da região equatorial (Rangel et al., 2005RANGEL, D.E.N.; BRAGA, G.U.L.; ANDERSON, A.J.; ROBERTS, D.W. Variability in conidial thermotolerance of Metarhizium anisopliae isolates from different geographic origins. Journal of Invertebrate Pathology , San Diego, v.88, n.2, p.116-125, 2005.). Os resultados deste estudo mostraram que a temperatura pode interferir no desempenho desses fungos como bioagentes de controle de pragas e que o emprego de B. bassiana no outono e inverno pode ser prejudicado, visto que temperaturas baixas dificultam a germinação dos conídios.
CONCLUSÕES
Os isolados JAB 68 de M. anisopliae e IBCB 66 de B. bassiana são bastante sensíveis à exposição aos raios do simulador solar e UV, os quais promovem drástica redução da germinação de seus conídios. Os isolados são também afetados pela temperatura. Temperaturas entre 23,8 e 31ºC favorecem a germinação dos conídios, enquanto temperaturas próximas a 20ºC dificultam a germinação.
REFERÊNCIAS
- ALMEIDA, J.E.M.; BATISTA FILHO, A.; SANTOS, A. Controle da cigarrinha-da-raiz da cana-de-açúcar, Mahanarva fimbriolata , com o fungo entomopatogênico Metarhizium anisopliae . STAB: Açúcar, Álcool e Subprodutos , Piracicaba, v.22, n.4, p.42-45, 2004.
- ALVES, S.B. Fungos entomopatogênicos. In: ALVES, S.B. (Ed.) Controle microbiano de insetos 2 ed. Piracicaba: FEALQ, 1998. Cap.11, p.289-381.
- BABITHA, S.; CARVAHLO, J.C.; SOCCOL, C.R.; PANDEY, A. Effect of light on growth, pigment production and culture morphology of Monascus purpureus in solid-state fermentation. World Journal of Microbiology and Biotechnology , Dordrecht, v.24, n.11, p.2671-2675, 2008.
- BATISTA FILHO, A.; MOINO JUNIOR, A.; ALVES, S.B. Recomendações para o uso de micoinseticidas destinados ao controle da broca-da-bananeira. In: ALVES, L.F.A.; NEVES P.M.J.O.; FARIA, M.R. (Orgs.). Recomendações para utilização de fungos entomopatogênicos no controle de pragas . Piracicaba: CP2, 2010. p.21-24.
- BRAGA, G.U.L.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Variability in response to UV-B among species and strains of Metarhizium anisopliae isolates from sites at latitudes from 61ºN to 54ºS. Journal of Invertebrate Pathology , San Diego, v.78, n.2, p.98-108, 2001a.
- BRAGA, G.U.; FLINT, S.D.; MESSIAS, C.L.; ANDERSON, A.J.; ROBERTS, D.W. Effects of UV-B irradiance on conidia and germinants of the entomopathogenic Hyphomycete Metarhizium anisopliae: a study of reciprocity and recovery. Photochemistry and Photobiology Amsterdam, v.73, n.2, p.140-146, 2001b.
- BRAGA, G.U.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Both solar UVA and UVB radiation impair conidial culturability and delay germination in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.74, n.5, p.734-739, 2001c.
- BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; MILLER, C.D.; ANDERSON, A.J.; ROBERTS, D.W. Damage and recovery from UV-B exposure in conidia of the entomopathogens Verticillium lecani and Aphanocladium album . Mycologia , New York, v.94, n.6, p.912-920, 2002.
- BRAGA, G.U.; RANGEL, D.E.; FLINT, S.D.; ANDERSON, A.J.; ROBERTS, D.W. Conidial pigmentation is important to tolerance against solar-simulated radiation in the entomopathogenic fungus Metarhizium anisopliae . Photochemistry and Photobiology , Amsterdam, v.82, n.2, p.418-422, 2006.
- CAGÁN, L.; SVERCEL, M. The influence of ultraviolet light on pathogenicity of entomopathogenic fungus Beauveria bassiana (Balsamo) Vuillemin to the European corn borer, Ostrinia Nubilalis Hbn. (Lepidoptera: Crambidae). Journal of Central European Agriculture , Zagreb, v.2, n.3-4, p.228-232, 2001.
- CARLILE, M.J.; WATKINSON, S.C. The fungi . San Diego: Academic Press, 1994. 428p.
- COSTA, L.B.; RANGEL, D.E.; MORANDI, M.A.; BETTIOL, W. Impact of UV-B radiation on Clonostachys rosea germination and growth. World Journal of Microbiology and Biotechnology , Dordrecht, v.28, n.7, p.2497-2504, 2012.
- DINARDO-MIRANDA, L.L.; VASCONCELOS, A.C.M.; FERREIRA, J.M.G.; GARCIA JUNIOR, C.A.; COELHO, A.L.; GIL, M.A. Eficiência de Metarhizium anisiopliae (Metsch.) no controle de Mahanarva fimbriolata (Stal) (Hemiptera: Cercopidae) em cana-de-açúcar. Neotropical Entomology , Londrina, v.33, n.6, p.743-749, 2004.
- ESTAT: Sistema para análises estatísticas . Versão 2.0. Jaboticabal: Faculdade de Ciências Agrárias e Veterinárias, 1997. Disponível em: <Disponível em: http://www.fcav.unesp.br/#!/informatica/softwares/ >. Acesso em: 10 Set. 2009.
» http://www.fcav.unesp.br/#!/informatica/softwares/ - EIJK, G.W.; MUMMERY, R.S.; ROEYMANS, H.J.; VALADON, L.R. Comparative study of carotenoids of Aschersonia aleyrodis and Aspergillus giganteus . Antonie van Leeuwenhoek , Amsterdam, v.45, n.3, p.417-422, 1979.
- FERNANDES, E.K.; RANGEL, D.E.; MORAES, A.M.; BITTENCOURT, V.R.; ROBERTS, D.W. Variability in tolerance to UV-B radiation among Beauveria spp. isolates. Journal of Invertebrate Pathology , San Diego,v.96, n.3, p.237-243, 2007.
- FRANCISCO, E.A.; MOCHI, D.A.; CORREIA, A.C.B.; MONTEIRO, A.C. Influence of culture media in viability test of conidia of entomopathogenic fungi. Ciência Rural , Santa Maria, v.36, n.4, p.1309-1312, 2006.
- HIRAO, A.; Kong, Y.Y.; Matsuoka, S.; WAKEHAM, A.; RULAND, J.; Yoshida, H.; Liu, D.; Elledge, S.J.; MAK, T.W. DNA damage-induced activation of p53 by checkpoint kinase Chk2. Science , Washington, v.287, n.5459, p.1824-1827, 2000.
- IGNOFFO, C.M.; GARCIA, C. Influence of conidial color on inactivation of several entomogenous fungi (Hyphomycetes) by simulated sunlight. Environmental Entomology , Lanham, v.21, n.4, p.913-917, 1992.
- INGLIS, G.D.; DUKE, G.M.; GOETTEL, M.S.; KABALUK, J.T. Genetic diversity of Metarhizium anisopliae var. anisopliae in southwestern British Columbia. Journal of Invertebrate Pathology , San Diego, v.98, n.1, p.101-113, 2008.
- INGLIS, G.D.; GOETTEL, M.S.; JOHNSON, D.L. Influence of ultraviolet light protectants on persistence of the entomopathogenic fungus, Beauveria bassiana . Biological Control , Orlando, v.5, n.4, p.581-590, 1995.
- ISKANDAROV, U.S.; GUZALOVA, A.G.; DAVRANOV, K.D. Effects of nutrient medium composition and temperature on the germination of conidia and the entomopathogenic activity of the fungi Beauveria bassiana and Metarhizium anisopliae . Applied Biochemistry and Microbiology , New York,v.42, n.1, p.72-76, 2006.
- LANZA, L.M.; MONTEIRO, A.C.; MALHEIROS, E.B. Sensibilidade de Metarhizium anisopliae à temperatura e umidade em três tipos de solos. Ciência Rural , Santa Maria, v.39, n.1, p.6-12, 2009.
- MORLEY-DAVIES, J.; MOORE, D.; PRIOR, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research , Cambridge, v.100, n.1, p.31-38, 1996.
- NEVES, P.M.J.O.; MOINO JUNIOR, A.; ALVES, S.B. Recomendações para o uso de micoinseticidas destinados ao controle da broca-do-cafeeiro. In: ALVES, L.F.A.; NEVES, P.M.J.O.; FARIA, M.R. (Orgs.) Recomendações para utilização de fungos entomopatogênicos no controle de pragas . Piracicaba: CP2 , 2010. p.25-28.
- NICHOLSON, W.L.; MUNAKATA, N.; HORNECK, G.; MELOSH, H.J.; SETLOW, P. Resistence of Bacillus endospores to extreme terrestrial end extraterrestrial environments. Microbiology and Molecular Biology Reviews , New York, v.64, n.3, p.548-572, 2000.
- RANGEL, D.E.N.; BRAGA, G.U.L.; ANDERSON, A.J.; ROBERTS, D.W. Variability in conidial thermotolerance of Metarhizium anisopliae isolates from different geographic origins. Journal of Invertebrate Pathology , San Diego, v.88, n.2, p.116-125, 2005.
- RANGEL, D.E.N.; BUTLER, M.J.; TORABINEJAD, J.; ANDERSON, A.J.; BRAGA, G.U.L.; DAY, A.W.; ROBERTS, D.W. Mutants and isolates of Metarhizium anisopliae are diverse in their relationships between conidial pigmentation and stress tolerance. Journal of Invertebrate Pathology , San Diego, v.93, n.3, p.170-182, 2006.
- RANGEL, D.E.N.; FERNANDES, E.K.K.; BRAGA, G.U.L.; ROBERTS, D.W. Visible light during mycelial growth and conidiation of Metarhizium robertsii produces conidia with increased stress tolerance. FEMS Microbiology Letters , Oxford, v.315, n.2, p.81-86, 2011.
- RATH, A.C. Ecology of entomopathogenic fungi in field soils. In: INTERNATIONAL COLLOQUIUM ON INVERTEBRATE PATHOLOGY AND MICROBIAL CONTROL, 8, Foz do Iguaçu, PR, 2002. Anais... Foz do Iguaçu: Society for Invertebrate Pathology, 2002. p.65-71.
- REHNER, S.A. Ecology and evolution of fungal endophytes and their role against insects. In: VEGA, F.E.; BLACKWELL, M. (Eds.) Insect-fungal associations: ecology and evolution . Oxford: Oxford University Press, 2005. p.74-96.
- WRAIGHT, S.P.; INGLIS, G.D.; GOETTEL, M.S. Fungi. In: LACEY, L.A.; KAYA, H.K. (Eds.) Field manual of techniques in invertebrate pathology . 2 ed. Dordrecht: Springer, 2007. Cap.4, p.223-248.
- ZHOU, B.B.S.; ELLEDGE, S.J. The DNA damage response: putting checkpoints in perspective. Nature , London, v.408, n.6811, p.433-439, 2000.
Datas de Publicação
-
Publicação nesta coleção
2016
Histórico
-
Recebido
12 Dez 2013 -
Aceito
30 Out 2015