RESUMO:
O presente estudo teve como objetivo determinar a frequência, os fatores de risco e o mapeamento de focos em rebanhos leiteiros do estado do Maranhão, Brasil, associados à Leptospira spp. Foram colhidas 420 amostras de soros sanguíneos de fêmeas com idade ≥24 meses selecionadas de forma aleatória simples, distribuídas em 70 rebanhos provenientes de 14 municípios. Foi aplicado um questionário epidemiológico para investigar os principais fatores de riscos associados à infecção. As amostras foram submetidas à prova de soroaglutinação microscópica (SAM), sendo utilizados 24 sorovares de Leptospira spp. Das amostras analisadas, 70 (100%) para rebanhos e 420 (100%) para animais foram reagentes a pelo menos um dos sorovares de Leptospira spp., com títulos variáveis entre 100 e 800. Os sorovares mais prevalentes foram Patoc (410/420; 97%), Castellonis (351/420; 84%), Hardjo (347/420; 83%), Hebdomadis (335/420; 80%), Sentot (328/420; 78%), Wolffi (330/420; 79%), Icterohaemorrhagiae (300/420; 71%) e Pomona (286/420; 69%). As variáveis não realização de inseminação artificial, criação conjunta de caprinos, ovinos, equinos e caninos e maior taxa de nascimento de bezerros no período seco apresentaram associação estatística significativa (p<0,05) à ocorrência de animais sororreagentes para Leptospira interrogans e foram considerados fatores de risco. Os resultados revelaram elevados títulos aglutinantes para diversos sorovares de Leptospira no rebanho bovino leiteiro do estado do Maranhão. Esses resultados demonstram a necessidade de implementação de estratégias que consistem na realização de vacinações, preferencialmente com sorovares regionais, exames sorológicos, aquisição de animais de propriedades idôneas, efetivação de quarentena ao ingresso de novos animais e notificação da doença na Agência de Defesa Agropecuária do Estado.
PALAVRAS-CHAVE:
leptospirose; bovinos leiteiros; epidemiologia; Maranhão; soroaglutinação microscópica
ABSTRACT:
The present study's aim was to determine frequency, risk factors and mapping outbreaks in dairy cattle of Maranhão state, Brazil, associated to Leptospira spp. Four hundred and twenty samples of blood serum from females were analyzed, age ≥24 months, selected in a random way, distributed in 70 herds from 14 townships. An epidemiological questionnaire was applied to investigate possible factors that could have been associated to the infection. Serum samples were submitted to the serum agglutination test (SAT). It was used 24 serovars from the Leptospira spp. complex. From the analyzed samples, 70 (100%) for herds and 420 (100%) for animals were reagent to at least one of the Leptospira spp. serovar, reaching titles between 100 and 800. The most prevalent serovars were Patoc (410/420; 97%), Castellonis (351/420; 84%), Hardjo (347/420; 83%), Hebdomadis (335/420; 80%), Sentot (328/420; 78%), Wolffi (330/420; 79%), Icterohaemorrhagiae (300/420; 71%) and Pomona (286/420; 69%). From the variables considered as risk factors, the not utilization of artificial insemination, mixed herds of goats, sheeps, equines and canines in the properties, and the birth of calves in the non-rainy period showed significant statistical association (p<0.05) to the risk of infection with Leptospira interrogans . The results show elevated levels of leptospirosis frequency in dairy cattle herd from Maranhão state. Therefore, there is a necessity to implement strategies consisting of vaccinations with region serovares and serological exams, establishment of quarantine for arrival of new animals, monitoring existent herds in the properties and notification of the disease to the State Animal Health Agency.
KEYWORDS:
leptospirosis; dairy cattle; epidemiology; Maranhão; microscopic serum agglutination
INTRODUÇÃO
A leptospirose é uma antropozoonose bacteriana de elevada prevalência, cosmopolita, diagnosticada em países de climas tropical e subtropical, principalmente nos períodos de altos índices pluviométricos e que acomete os animais domésticos e silvestres, roedores sinantrópicos e o homem (Acha; Szyfres, 2003ACHA, P.N.; SZYFRES, B Zoonoses and communicable diseases common to man and animals. 3rd.ed. Washington, D.C.: Pan American Health Organization, 2003. v.1. p.28-45, 2003.; Corcho, 2009CORCHO, D.B.; ACOSTA, A.M.C.; BOZA, E.R. Leptospirosis humana, una enfermedad olvidada. Revista Cubana de Medicina General Integral , v.25, n.1, 2009.; Oie, 2014ORGANIZAÇÃO MUNDIAL DE SAÚDE ANIMAL (OIE). Terrestrial Manual . Leptospirosis. 2014. chap. 2.1.9. <http://www.oie.int/eng/normes/mmanual/a_00043.htm>. Acesso em: 21. jun. 2014.
http://www.oie.int/eng/normes/mmanual/a_...
). É causada por uma bactéria do gênero Leptospira , constituída das espécies L. interrogans e L. biflexa . No ano de 2013, foram incluídas mais quatro genomo espécies, permanecendo a sua classificação da seguinte forma: L. interrogans , L. biflexa , L. borgpetersenii , L. inadai , L. wolbachii , L. meyeri , L. noguchii , L. santarosai , L. weilii , L. kirschneri , L. fainei , L. alexanderi , L. broomii , L. wolffii , L. kmetyi , L. licerasiae , L. alstonii , L. terpstrae , L. yanagawae , L. idonii e L. vanthielii (Gomes, 2013GOMES, M.J.P. Gênero Leptospira spp. Microbiologia Clínica Veterinária. Rio Grande do Sul: FAVET-UFRGS, 2013. Disponível em: <Disponível em: http://www.ufrgs.br/labacvet/files/G%C3%AAnero%20Leptospira%204-2013-1.pdf
>. Acesso em: 01 ago. 2014.
http://www.ufrgs.br/labacvet/files/G%C3%...
).
É considerada uma enfermidade reemergente, sobretudo nos países das Américas Central e Sul, da África, da Ásia e da Europa (Levett, 2001LEVETT, P.N. Leptospirosis. Clinical Microbiology Reviews , v.14, n.2, p.296-326, 2001. Disponível em: <Disponível em: http://cmr.asm.org/content/14/2/296
>. Acesso em: 21. ago. 2013. DOI: 10.1128/CRM.14.2.296-326
http://cmr.asm.org/content/14/2/296...
; Palaniappan et al., 2007PALANIAPPAN, R.U.M.; RAMANUJAM, S.; CHANG, Y.-F. Leptospirosis: pathogenesis, immunity and diagnosis. Current Opinion Infectious Diseases , v.20, p.284-292, 2007.; Hartskell, 2009HARTSKEEL, R.A. Leptospirosis: current status and future trendsIndian Journal Medical Microbiology, v.24, n.4, p.309, 2009.). Investigações efetuadas em diferentes regiões do Brasil comprovaram prevalências em rebanhos bovinos que variam de 74 a 100% e, em animais, de 45,56 a 62,30% (Langoni et al., 2000LANGONI, H.; MEIRELES, L.R.; GOTTSCHALK, S.; CABRAL, K.G.; SILVA, A.V. Perfil sorológico da leptospirose bovina em regiões do estado de São Paulo. Arquivos do Instituto Biológico , São Paulo, v.67, n.1, p.37-41, 2000.; Favero et al., 2001FÁVERO, M.; PINHEIRO, S.R.; VASCONCELLOS, S.A.; MORAIS, Z.M.; FERREIRA, F.; FERREIRA NETO, J.S. Leptospirose bovina: variantes sorológicas predominantes em colheitas efetuadas no período de 1984 a 1997 em rebanhos de 21 estados do Brasil. Arquivos do Instituto Biológico , São Paulo, v.68, n.2, p.29-35, 2001.; Homem et al., 2001HOMEM, V.S.F.; HEINEMANN, M.B.; MORAES, Z.M.; VASCONCELLOS, S.A.; FERREIRA, F.; FERREIRA NETO, J.S. Estudo epidemiológico da leptospirose bovina e humana na Amazônia oriental brasileira. Revista da Sociedade Brasileira de Medicina Tropical , v.34, n.2, p.173-180, mar./abr.2001.; Lage et al., 2007LAGE, A.P.; LEITE, R. de M.H.; THOMPSON, J.A.; BANDEIRA, D.A.; HERRMANN, G.P.; MOREIRA, É.C.; GONÇALVES, V.S.P. Serology for Leptospira sp. in cattle of the State of Paraíba, Brazil. Arquivos do Instituto Biológico , v.74, n.3, p.185-190, 2007.). Diversas pesquisas constataram os sorovares Hardjo, Wolffi, Pomona, Grippotyphosa, Icterohaemorrhagiae e Canicola entre os mais frequentes, sendo o Hardjo o mais comum em bovinos. No Maranhão, Silva et al. (2012SILVA, F.J.; CONCEIÇÃO, W.L.F.; FAGLIARI, J.J.; GIRIO, R.J.S.; DIAS, R.A.; BORBA, M.R.; MATHIAS, L.A. Prevalência e fatores de risco de leptospirose bovina no estado do Maranhão. Pesquisa Veterinária Brasileira , v.32, n.4, p.303-312, 2012.) registraram predominância de 64,81 e 35,94% para rebanhos bovinos e animais reagentes, respectivamente.
Os impactos negativos advindos da doença refletem-se em termos econômicos, por conta dos abortamentos, em torno de 12 a 68,4%, em rebanhos não vacinados, dos natimortos, da flacidez de úbere, da diminuição da produção láctea, da redução da taxa de concepção e de infertilidade em 47% e do alto custo com o tratamento, tendo em vista sua transmissão às diversas espécies animais de produção (Pires, 2010PIRES, A.V. Bovinocultura de corte . Piracicaba: FEALQ, 2010. V.2. p.971-975.chap.51.).
Do ponto de vista da saúde pública, a referida zoonose está relacionada às más condições de infraestrutura sanitária, o que respinga na baixa condição socioeconômica do país (Brasil, 2009BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Guia de Vigilância Epidemiológica . 7.ed. Brasília, 2009. Série A. Normas e Manuais Técnicos. Disponível em: <Disponível em: http://www.ammabarbacena.com.br/files/a7341de89b43294954a4ebdbd75be42d.pdf
>. Acesso em: 6 nov. 2013.
http://www.ammabarbacena.com.br/files/a7...
). É uma enfermidade que consta da lista múltipla de espécies do Código Sanitário de Animais Terrestres da Organização Internacional de Epizootias, por difundir-se em diversas nações e ter consequência na comercialização internacional de animais, produtos e subprodutos (Oie, 2009ORGANIZAÇÃO MUNDIAL DE SAÚDE ANIMAL (OIE). Código Sanitário para los Animales Terrestres . Criterio de inscripción de enfermedades en la lista de la OIE. 2009. p.4-8, chap. 1.2. Disponível em: <Disponível em: http://www.oie.int/doc/ged/d6515.pdf
>. Acesso em: 12 dez. 2013.
http://www.oie.int/doc/ged/d6515.pdf...
).
Considerando a abertura de mercados no segmento de laticínios no Maranhão, além da importância socioeconômica que a leptospirose representa e da necessidade da obtenção de dados soroepidemiológicos sobre a ocorrência dessa enfermidade em rebanhos bovinos de aptidão leiteira no estado, este trabalho foi realizado com o objetivo de determinar a frequência, os fatores de risco, os sorovares predominantes e o mapeamento de focos de Leptospira spp. em rebanhos bovinos das bacias leiteiras maranhenses.
MATERIAL E MÉTODOS
Este estudo transversal observacional abrangeu os principais municípios das bacias leiteiras pertencentes a três regionais: Bacabal (Bacabal, Bom Lugar, Lago Verde, Olho d'Água das Cunhãs, São Luís Gonzaga e Vitorino Freire), Pedreiras (Bernardo do Mearim, Igarapé Grande, Pedreiras, Trizidela do Vale, Lima Campos, Poção de Pedra e Lago da Pedra) e São Luís (São Luís). As bacias leiteiras das regionais de Bacabal e Pedreiras estão localizadas na região central do estado do Maranhão, enquanto as da regional de São Luís ficam no nordeste do estado. O critério de seleção deu-se de acordo com o banco de dados referente ao efetivo de bovídeos leiteiros da Agência Estadual de Defesa Agropecuária do Maranhão (AGED-MA). Foram selecionados os municípios com a produção de leite ≥ 1.000 litros/dia. Esses municípios, conjuntamente, produzem em média 47.261 litros de leite/dia, produção considerada expressiva no estado (Aged, 2012AGÊNCIA ESTADUAL DE DEFESA AGROPECUÁRIA DO MARANHÃO. Coordenadoria de Defesa Animal. Programa de Prevenção e Erradicação da Febre Aftosa. Efetivo de bovinos leiteiros do estado do Maranhão . AGED, 2012. Arquivo impresso.).
A amostragem foi estabelecida conforme preconiza o Centro Panamericano de Zoonosis (1979CENTRO PANAMERICANO DE ZOONOSIS. Procedimientos para estudios de la prevalencia por muestreo Ramos Mejia, Buenos Aires, 1979. 35p. (Nota técnica 18).), para pesquisa de estimativa de prevalência. A fim de determinar o tamanho da amostra, foi adotada como valor de referência a prevalência encontrada por Langoni et al. (2000LANGONI, H.; MEIRELES, L.R.; GOTTSCHALK, S.; CABRAL, K.G.; SILVA, A.V. Perfil sorológico da leptospirose bovina em regiões do estado de São Paulo. Arquivos do Instituto Biológico , São Paulo, v.67, n.1, p.37-41, 2000.), no estado de São Paulo, de 38,48%, considerando erro (d) não superior a 12% e nível de confiança de 95% (z).
Utilizaram-se os cadastros de propriedade e o número de rebanho leiteiro informados pela Aged-MA (2012AGÊNCIA ESTADUAL DE DEFESA AGROPECUÁRIA DO MARANHÃO. Coordenadoria de Defesa Animal. Programa de Prevenção e Erradicação da Febre Aftosa. Efetivo de bovinos leiteiros do estado do Maranhão . AGED, 2012. Arquivo impresso.), totalizando 420 fêmeas bovinas com idade ≥ 24 meses, distribuídas em cinco rebanhos, com seis animais cada, por município. O sorteio ocorreu de forma aleatória simples, e as amostras selecionadas foram iguais para todos os rebanhos.
O sangue foi colhido nos meses de maio e junho de 2013, por punção jugular, com agulhas descartáveis (25 × 8mm) e tubos (10 mL), com sistema de vácuo, e encaminhado ao Laboratório de Doenças Infecciosas, do curso de Medicina Veterinária da Universidade Estadual do Maranhão (UEMA), onde foi centrifugado a 2.500 G por 5 min. As alíquotas de soro obtidas foram identificadas com o número do animal e o código da propriedade e mantidas à temperatura de -20ºC. Em cada propriedade foi aplicado um questionário epidemiológico, com o objetivo de avaliar potenciais fatores de riscos associados à leptospirose nos rebanhos averiguados.
Para o georreferenciamento dos dados e das propriedades, utilizou-se aparelho de navegação posicionamento global por satélite (GPS). Cada endereço foi localizado em um ponto no espaço e identificado de acordo com as informações do banco de dados de propriedades da Aged-MA (2012AGÊNCIA ESTADUAL DE DEFESA AGROPECUÁRIA DO MARANHÃO. Coordenadoria de Defesa Animal. Programa de Prevenção e Erradicação da Febre Aftosa. Efetivo de bovinos leiteiros do estado do Maranhão . AGED, 2012. Arquivo impresso.), contendo o código da propriedade, com 11 dígitos (sete dígitos correspondiam ao código do município e quatro dígitos aos da propriedade). Para a confecção dos mapas temáticos e o mapeamento dos focos, empregou-se o software ArcGis.
A técnica sorológica aplicada foi a soroaglutinação microscópica (SAM), descrita por Galton et al. (1965GALTON, M.M.; SULZER, C.R.; SANTA ROSA, C.A.; FIELDS, M.J. Application of a microtechnique to the agglutination test for Leptospiral antibodies. Applied Microbiology , v.13, p.81-85, 1965. Disponível em: <Disponível em: http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1058195&blobtype=pdf
>. Acesso em: 24 ago. 2013.
http://www.pubmedcentral.nih.gov/picrend...
) e Cole et al. (1973COLE JR., J.R.; SULZER, C.R.; PURSELL, A.R. Improved microtechnique for the leptospiral microscopic agglutination. Applied Microbiology , v.25, p.976-980, 1973.). Recorreram-se a antígenos vivos compostos de 24 sorovares do complexo Leptospira spp.: Hardjo, Wolffii, Pomona, Australis, Bratislava, Autumnalis, Hebdomadis, Canicola, Sentot, Copenhageni, Icterohaemorrhagiae, Pyrogenes, Cynopteri, Butembo, Castellonis, Javanica, Tarassovi, Whitcombi, Grippotyphosa, Panama, Bataviae, Shermani, Patoc e Andamana. Para interpretação da prova de SAM, foi considerada reação positiva a presença de aglutininas anti-Leptospira nas amostras com aglutinação microscópica igual ou superior a 50% das Leptospiras . Após a leitura, o grau de aglutinação seguiu o seguinte critério: 1 + (menos de 50% de Leptospiras aglutinadas), 2 + (de 51 a 74% de aglutinações) e 3 + (75 a 100% de aglutinações). Foram então levadas em conta reagentes as amostras examinadas com título igual ou superior a 100.
O antígeno foi preparado utilizando-se culturas vivas de Leptospira interrogans mantidas em meio semissólido de Fletcher (1928FLETCHER, W. Recent work on leptospirosis, tsutsugamushi disease and tropical typhus in the Federated Maloy States. Transactions of the Royal Society of Tropical Medicine Hygiene, n.21, p.267-287, 1928. In: CENTRO PANAMERICANO DE ZOONOSIS.Manual sobre métodos de laboratórios para leptospirose. 1928. (Nota Técnica, n. 9).) e em meio líquido EMJH (DIFCO(r), Estados Unidos), suplementados com 10% de soro de coelho estéril. Os dois meios foram preparados, esterilizados e depois distribuídos para 48 tubos de ensaio rosqueados, sendo 24 com o meio de Fletcher e 24 com o meio de EMJH (DIFCO(r)). Sequencialmente, os tubos foram incubados em estufa bacteriológica à temperatura de 28 a 30ºC durante 7 a 14 dias. Os inóculos foram repicados toda semana em novos tubos contendo os dois meios.
As informações dos questionários e do resultado da sorologia foram armazenadas em um banco de dados por meio do programa Microsoft Access(r). Foram consideradas propriedades foco aquelas com presença de animais sororreagentes nos rebanhos. Para avaliar a associação entre os sororreagentes e as variáveis estudadas, realizou-se a análise univariada. Foram utilizados o teste exato de Fisher e o teste qui-quadrado de independência. O nível de significância utilizado foi de 5% (p < 0,05). Estimaram-se as razões de probabilidade odds ratio (OR), com intervalo de confiabilidade de 95%. Os programas estatísticos usados foram o InStat 2.0, versão 2003, e o Epi Info, versão 2007. Este trabalho foi realizado conforme os princípios éticos da experimentação animal estabelecidos pela Comissão de Ética e Experimentação Animal (CEEA) do curso de Medicina Veterinária da UEMA, recebendo o número de protocolo 025/2014.
RESULTADOS
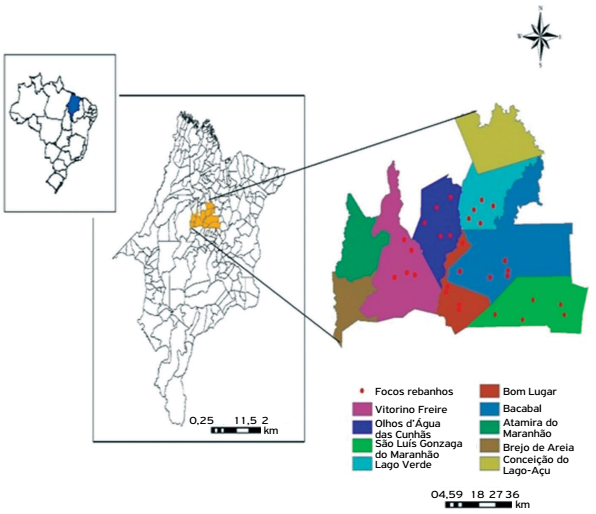
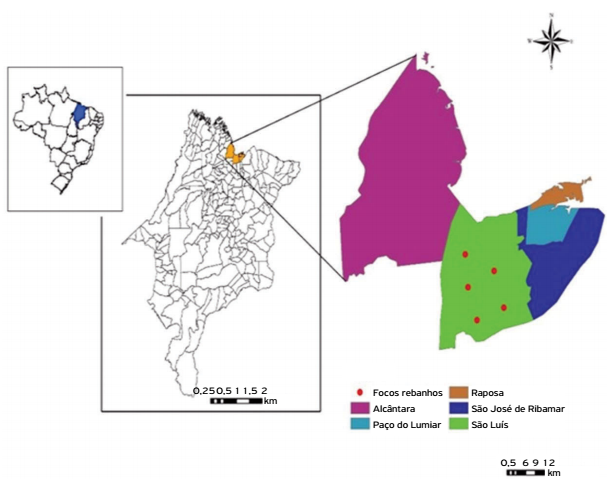
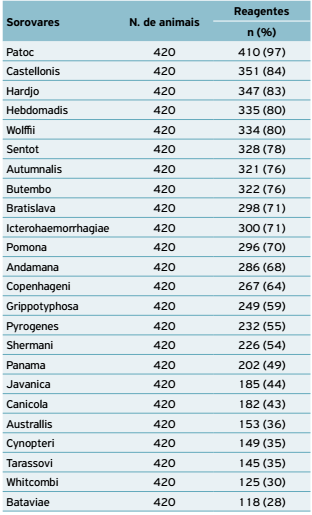
Do total de amostras analisadas, 70 rebanhos e 420 animais, todas (100%) foram reagentes para um dos 24 sorovares da coleção de antígenos de Leptospira spp. Os sorovares mais frequentes foram Patoc, Castellonis, Hardjo, Hebdomadis, Wolffii, Sentot, Autumnalis, Butembo, Bratislava, Icterohaemorrhagiae e Pomona (Tabela 1). O mapeamento dos rebanhos foco nas três unidades regionais avaliadas está evidenciado nos mapas (Figs. 1, 2 e 3).
Frequência de sorovares Leptospira spp. em fêmeas bovinas das bacias leiteiras das unidades regionais de Bacabal, Pedreiras e São Luís, MA, Brasil, 2014.
Distribuição espacial de focos de leptospirose em rebanhos bovinos leiteiros da unidade regional de Bacabal, MA, Brasil, 2014.
Distribuição espacial de focos de leptospirose em rebanhos bovinos leiteiros da unidade regional de Pedreiras, MA, Brasil, 2014.
Distribuição espacial de focos de leptospirose em rebanhos bovinos leiteiros da unidade regional de São Luís, MA, Brasil, 2014.
A maior frequência por rebanhos nas bacias leiteiras das regionais de Bacabal e Pedreiras foi para o sorovar Hardjo, com 16/30 (53,33%) e 14/35 (40%), respectivamente. O sorovar Wolffii predominou na regional de Pedreiras, com 18/35 (51%), seguido da regional de Bacabal, com 14/30 (47%). O sorovar Pomona teve maior frequência na regional de Bacabal, com 13/30 (43%) (Tabela 2).
Nos soros animais, constatou-se que os sorovares Hardjo, Wolffii e Pomona foram os de maior frequência na regional de Pedreiras, com 185/210 (88%), 178/210 (85%) e 156/210 (74%), nessa ordem. Na regional de São Luís a maior frequência verificada foi para o sorovar Hardjo, de 26/30 (87%), bem como na regional de Bacabal, onde o percentual foi de 136/180 (76%). Os sorovares Wolffii e Pomona também foram observados com frequência elevada (Tabela 3).
Os sorovares encontrados com maior frequência nos rebanhos, por município, são demonstrados na Tabela 4.
Frequência dos sorovares Hardjo, Wolffii e Pomona realizado pelo teste de SAM em rebanhos bovinos, das bacias leiteiras, por município, das unidades regionais de Bacabal, Pedreiras e São Luís, MA, Brasil, 2014.
O sorovar Hardjo foi o mais frequente (83%), seguido de Wolffii (79%) e Pomona (68%), nas 420 fêmeas bovinas examinadas dos 14 municípios amostrados, e o município de Olho d'Água das Cunhãs foi o que apresentou o maior percentual de amostras reagentes para o sorovar Hardjo (100%) (Tabela 5).
Frequência dos sorovares Hardjo, Wolffi e Pomona realizado pelo teste de soroaglutinação microscópica em fêmeas bovinas das bacias leiteiras por município das unidades regionais de Bacabal, Pedreiras e São Luís, MA, Brasil, 2014.
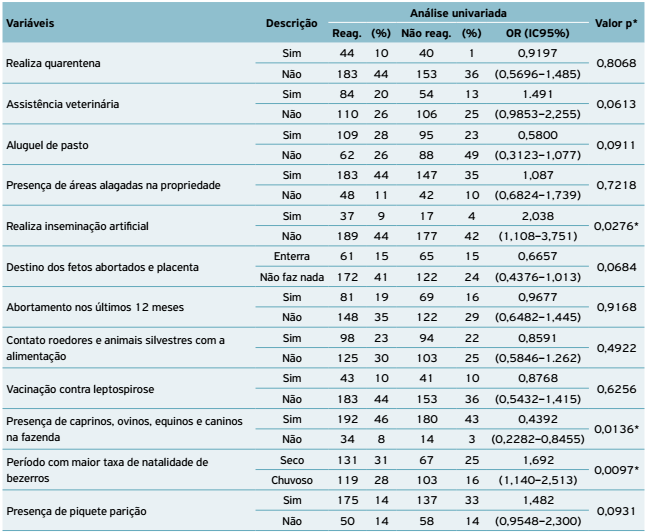
Ao analisar os possíveis fatores de risco, diante do teste estatístico univariado, viu-se que a não realização de inseminação artificial, a criação conjunta de caprinos, ovinos, equinos e caninos e a taxa de natalidade maior de bezerros no período seco indicaram significativa estatística (p < 0,05) associada à leptospirose (Tabela 6).
DISCUSSÃO
A frequência de aglutininas de Leptospira spp. encontrada nas bacias leiteiras das regionais de Bacabal, Pedreiras e São Luís foi elevada, tanto para rebanho como para animais. A alta prevalência e a distribuição de focos nas áreas amostradas podem estar relacionadas também ao tipo de sistema de criação semi-intensivo dos animais. A leptospirose em rebanhos bovinos leiteiros pode estar associada à densidade animal, pois os animais convivem mais aglomerados, logo, mais expostos, direta ou indiretamente, ao micro-organismo ou à presença do agente etiológico no ambiente em condições climáticas satisfatórias. De acordo com Thrusfield (2007THRUSFIELD, M. Veterinary epidemiology . London: Butterworths, 2007. 610P.), a aglomeração de animais favorece a disseminação de doenças para os suscetíveis no interior das populações, à medida que o número de animais e o tempo de exposição aumentam.
A alta frequência obtida neste estudo, no tocante ao sorovar Patoc, pode estar associada à detecção de roedores e animais silvestres no ambiente. Conforme Cubas et al. (2007CUBAS, Z.S.; SILVA, J.C.R.; Catão-Dias, J.L. Tratado de animais selvagens: medicina veterinária. São Paulo: Roca, 2007. p.736-741.), a constante presença dessas espécies em áreas rurais atua como importantes reservatórios. Outro aspecto considerado são as alterações desordenadas do sistema ecológico por conta das ações antrópicas, o que condiciona a mudança de comportamento dos animais em busca de outros ecossistemas. Tal fato possibilita a disseminação das leptospiras até o alcance de novos hospedeiros e/ou reservatórios, inclusive o homem. Genovéz (2009GENOVÉZ, M.E. Leptospirose: uma doença de ocorrência além da época das chuvas! Biológico , São Paulo, v.71, n.1, p.1-3, jan./jun. 2009.) afirmou que, na zona rural, as peculiaridades do hábitat e a presença de animais silvestres possuem relevância na transmissão da leptospirose quanto a criações de animais de produção.
Os sorovares Shermani, Grippotyphosa, Hebdomadis, Tarassovi, Autumnalis, Pyrogenes, Copenhageni, Australis, Canicola, Castellonis, Icterohaemorrhagiae, Panama, Sentot e Andamana remetem também à suspeita da existência de animais selvagens de vida livre nas propriedades. Silva et al. (2010SILVA, F.J.; MATHIAS, L.A.; MAGAJEVSKI, F.S.; WERTHER, K.; ASSIS, N.A.; GIRIO, R.J.S. Anticorpos contra Leptospira spp. em animais domésticos e silvestres presentes no Campus Universitário da FCAV, UNESP, Jaboticabal/SP. ARS Veterinária , Jaboticabal, v.26, n.1, p.17-25, 2010.), em São Paulo, ao pesquisarem anticorpos de Leptospira spp. em animais domésticos e silvestres, constataram que gambás (Didelphis albiventris ) e cervídeos podem ser reservatórios dos sorovares Patoc, Autumnalis, Icterohaemorrhagiae, Andamana e Canicola para animais domésticos como bovinos, caprinos, ovinos, suínos, equinos e cães.
Diversos estudos epidemiológicos realizados no Brasil demonstram a importância de animais domésticos e silvestres na cadeia epidemiológica de transmissão da leptospirose. Paixão et al. (2011PAIXÃO, M.S.; ALVES, M. F.; PIRAJÁ, G.V.; FERREIRA, A. G.; ALVES, M. L.; TENORIO, M. S.; BUZETTI, W. A. S.; LUCHEIS, S.B. Soroprevalência para leptospirose em animais silvestres de vida livre procedentes do centro de conservação da fauna silvestre de Ilha Solteira, SP. Biológico , São Paulo, v.73, n.2, p.210-213, jul./dez. 2011.), em São Paulo, encontraram 14/14 (100%) animais silvestres de vida livre soropositivos para Australis, 86% para Autumnalis, 66% para Shermani, 44% para Sentot, 55% para Cynopteri, Butembo, Grippotyphosa, Hebdomadis, Icterohaemorrhagiae, Patoc e Canicola e 22,2% para Tarassovi. Rolim et al. (2013ROLIM, M.B.Q.; BARROS, S.E.M.; SILVA, V.C.L.; SANTANA, V.L.A.; SOUZA, M.A.; HAROP, M.H.V.; MOTA, R.A.; OLIVEIRA, M.A.L.; MOURA, A.P.B.L.; LIMA, P.F. Determinação de anticorpos anti-Leptospira spp. e anti-Brucella abortus em bovinos abatidos em matadouro público no estado de Pernambuco. Revista de Medicina Veterinária , Recife, v.7, n.1, p.24-30, 2013.), em Pernambuco, detectaram 55/412 (13,3%) bovinos reagentes. Destes, 10,9 e 9,1% foram sororreagentes aos sorovares Hebdomadis e Grippotyphosa, respectivamente.
Quanto aos sorovares Hardjo, Wolffii e Pomona, suas ocorrências sugerem que os rebanhos bovinos exibem resposta imunológica ativa à leptospirose. Foi constatada frequência elevada para esses sorovares nos rebanhos e em animais das bacias leiteiras das regionais de Bacabal e Pedreiras, possivelmente por causa do tipo de exploração para aptidão leiteira. Langoni et al. (2000LANGONI, H.; MEIRELES, L.R.; GOTTSCHALK, S.; CABRAL, K.G.; SILVA, A.V. Perfil sorológico da leptospirose bovina em regiões do estado de São Paulo. Arquivos do Instituto Biológico , São Paulo, v.67, n.1, p.37-41, 2000.) relataram que animais produtores de leite apresentam 1,9 vez mais reagentes positivos quando comparados aos destinados à produção de carne. Essas bacias leiteiras localizam-se geograficamente na região central do Maranhão, havendo, portanto, mais possibilidade de movimentação de animais com a divisa entre os estados do Pará, Piauí e Tocantins. De acordo com a Organização Mundial da Saúde (2003WORLD HEALTH ORGANIZATION. Human leptospirosis: guidance for diagnosis, surveillance and control. Geneva: World Health Organization, 2003.), a aquisição e o trânsito de animais contribuem como fonte permanente de infecção aos susceptíveis, assim como aglomerações de animais em exposições, leilões e vaquejadas, eventos muito comuns nas regionais examinadas.
Na bacia leiteira da regional de São Luís, a frequência encontrada nos rebanhos para o sorovar Hardjo foi inferior em comparação às regionais de Bacabal e Pedreiras, o que pode estar relacionado ao menor trânsito de animais. No entanto, foi considerada frequência elevada desse sorovar para animais, o que ter a ver com a localização das propriedades próximas ao aterro sanitário de São Luís, onde possivelmente a presença de roedores (tidos como reservatórios) é comum.
Acerca da frequência estudada nos rebanhos bovinos por municípios, ressalta-se que o sorovar Hardjo não foi observado em Vitorino Freire nem em São Luís, e o Pomona não foi detectado em rebanhos leiteiros dos municípios de Trizidela do Vale, de Pedreiras nem de Lima Campos. A ausência desses sorovares pode ser justificada pelo manejo sanitário adotado por cada propriedade, pela não introdução de animais portadores destes e consequentemente pela não exposição dos rebanhos a ambientes com a presença do agente etiológico.
Entre os fatores de risco ligados a detecção de animais reagentes, a não realização de inseminação artificial teve associação estatística significativa. A Leptospira é relativamente sensível ao congelamento e aos antibióticos presentes na conservação do sêmen (Costa et al., 1998COSTA, M.C.R.; MOREIRA, E.C.; LEITE, R.C.; MARTINS, N.R.S. Avaliação da imunidade cruzada entre Leptospira hardjo e L. wolffi . Arquivo Brasileiro de Medicina Veterinária e Zootecnia , v.50, n.1, p.11-17, 1998.; Radostits et al., 2002RADOSTITS, O.M.; GAY, C.C.; BLOOD, D.C.; HINCHCLIFF, K.W. Clínica veterinária: um tratado de doenças dos bovinos, suínos, caprinos e equinos. 9th.ed.Rio de Janeiro: Guanabara Koogan, 2002. 1737p.). Adicionalmente, o sêmen deve passar por um rigoroso controle de qualidade nas centrais de colheita e no preparo das doses, o que é um indicativo de que essa biotécnica reprodutiva pode ser considerada um fator de proteção.
A criação conjunta de caprinos, ovinos, equinos e caninos também foi vista como fator de risco neste estudo, apesar de não ter sido observada em nenhum desses sinais clínicos sugestivos da leptospirose. Pesquisadores acreditam que a criação consorciada com outras espécies domésticas na mesma propriedade constitui fonte constante de transmissão aos suscetíveis (Lilenbaum, 1996LILENBAUM, W. Atualização em leptospiroses bovinas. Revista Brasileira de Medicina Veterinária , v.18, n.1, p.9-13, 1996.; Radostits et al., 2002RADOSTITS, O.M.; GAY, C.C.; BLOOD, D.C.; HINCHCLIFF, K.W. Clínica veterinária: um tratado de doenças dos bovinos, suínos, caprinos e equinos. 9th.ed.Rio de Janeiro: Guanabara Koogan, 2002. 1737p.). Alguns autores versam que os ovinos atuam como hospedeiros acidentais (Ellis, 1994ELLIS, W.A. Leptospirosis as a cause of reproductive failure.Food Animal Practice v.10, n.3, p.463-478, 1994.; Lilenbaum; Souza, 2003LILENBAUM, W.; SOUZA, G.N. Factors associated with bovine leptospirosis in Rio de Janeiro, Brazil. Research in Veterinary Science , v.75, p.249-251, 2003.). Silva (2007SILVA, L.G. Incidência de leptospirose em animais e em seres humanos em região representativa do noroeste do estado do Rio de Janeiro . 70f. 2007. Dissertação (Mestrado em Produção Animal) - Centro de Ciências e Tecnologias Agropecuárias, Universidade Estadual do Norte Fluminense, Campos dos Goytacazes, Rio de Janeiro, 2007.) afirmou que a espécie ovina pode atuar como hospedeiro de manutenção do sorogrupo Autumnalis, infectando bovinos, equinos e até mesmo a espécie humana. Para Genovéz (2009GENOVÉZ, M.E. Leptospirose: uma doença de ocorrência além da época das chuvas! Biológico , São Paulo, v.71, n.1, p.1-3, jan./jun. 2009.), há certa evidência de que os ovinos também são hospedeiros de manutenção do sorovar Hardjo.
Os equinos criados nas propriedades são empregados com a finalidade de transporte, tração e esporte, podendo ser fonte de transmissão, pois os herbívoros possuem a urina ligeiramente alcalina, o que favorece a sobrevivência do microrganismo no ambiente (Faine et al., 2000FAINE, S.; ADLER, B.; BOLIN, C.; PEROLAT, P.Leptospira and leptospirosis2nd.ed. Melbourne: MedSci, 2000. ). A espécie canina é com frequência utilizada no manejo dos rebanhos nas regiões estudadas. A criação conjunta de cães reagentes com bovinos pode ser considerada fator relevante e, segundo Vasconcellos (2003VASCONCELOS, C.G.C. Zoonoses ocupacionais: inquérito soroepidemiológico em estudantes de Medicina Veterinária e análise de risco para leptospirose, brucelose e toxoplasmose . 2003. 108f. Tese (Doutorado em Doenças Tropicais) - Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, 2003.) e Araújo (2010ARAÚJO, B.M. Soroepidemiologia da infecção por Leptospira spp. em bovinos, equídeos, caninos e trabalhadores rurais em assentamento no município de Aragominas, Tocantins, Brasil . 2010. 112f. Tese (Doutorado em Veterinária) - Escola de Veterinária, Universidade Federal de Goiás, 2010.), a exposição de cães em contato com coleções hídricas e com restos de parições contaminadas pode contribuir para a disseminação de sorovares na propriedade.
A maior taxa de natalidade de bezerros no período seco também foi apontada como fator de risco estatisticamente significativo. As fêmeas cobertas no período chuvoso têm mais probabilidade de ser infectadas em virtude das condições edafoclimáticas favoráveis para a disseminação do agente etiológico, havendo consequentemente transmissão do micro-organismo via transplacentários neonatos (Speelman; Hartskeerl, 2008SPEELMAN, P.; HARTSKEERL, R.A. Leptospirosis. In: KASPER, D.; FAUCI, A.S.; HAUSER, S.; LONGO, D.; JAMESON, J.L.; LOSCALZO, J. Harrison's principles of internal medicine . New York: McGraw-Hill , 2008. p.1048-1051.; Philip, 2011PHILIP, S.S. Spirochetal infections. In: MC PHEE S.J.; PAPADAKIS, M.A. (Eds.). Current Medical Diagnosis & Treatment . New York: McGraw-Hill, 2011. p.1414-1415.).
Outras variáveis que, apesar de não serem analisadas como fatores de risco, apresentaram associação estatística significativa aqui (p < 0,05) evidenciaram considerável associação (OR > 1) e, portanto, merecem destaque, como: ausência de assistência veterinária e presença de áreas alagadas e de piquetes maternidade nas propriedades. A assistência veterinária é de grande importância na sistematização do controle sanitário dos rebanhos, com o propósito de evitar a introdução do agente infeccioso. Foi constatado que 98% dos proprietários não adotavam medidas sanitárias adequadas, o que pode ter contribuído com as frequências elevadas obtidas.
Observou-se ainda que em 100% das unidades epidemiológicas havia presença de áreas alagadas, como córregos, igarapés e rios, sendo os açudes a principal fonte de água para todas as espécies domésticas presentes. Brod; Fehlberg (1992BROD, C.S.; FEHBERG, M.F. Epidemiologia da leptospirose em bovinos. Ciência Rural , Santa Maria, v.22, p.239-45, 1992.) descreveram que o acesso a fontes de água contaminada e alagamentos aumenta o risco de transmissão por Leptospira spp.
A presença de piquetes de parição nas propriedades não foi considerada fator de risco, porém foi averiguado que eles não continham estruturas adequadas, o que impossibilitava a higienização e a desinfecção correta. As áreas externas apresentavam solo lamacento, fezes e urina, propiciando ambiente favorável para a sobrevivência das leptospiras. As espécies patógenas não se multiplicam, mas sobrevivem nesses ambientes, com pH levemente alcalino, salinidade baixa e ausência de radiação ultravioleta (Genovéz, 2009GENOVÉZ, M.E. Leptospirose: uma doença de ocorrência além da época das chuvas! Biológico , São Paulo, v.71, n.1, p.1-3, jan./jun. 2009.).
A ocorrência de aborto nos últimos 12 meses não foi considerada fator de risco associado à infecção pelos sorovares Hardjo, Wolffii e Pomona, no entanto são variantes sorológicas relacionadas à esfera reprodutiva, sobretudo em fêmeas bovinas leiteiras. O sorovar Pomona possui elevada patogenicidade, ocasionando icterícia e abortamento. A infecção pelo sorovar Hardjo tem efeito direto sobre a fertilização, interferindo na função do corpo lúteo, causando diminuição dos níveis de progesterona, enquanto o sorovar Wolffii está comumente associado ao Hardjo (Dhaliwal et al., 1996DHALIWAL, G.S.; MURRAY, R.D.; DOBSON, H.; MONTGOMERY, J.; ELLIS, W.A. Reduced conception rate in dairy cattle associated with serological evidence of Leptospira interrogans sorovar hardjoinfection. The Veterinary Record , v.139, p.110-114, 1996.; Vasconcellos et al., 1997VASCONCELLOS, S.A.; BARBARINI JÚNIOR, O.; UMECHARA, O.; ORAIS, Z.M.; CORTEZ, A.; PINHEIRO, S.R.; FERREIRA, F.; FAVERO, A.C.M.; FERREIRA NETO, J.S. Leptospirose bovina. Níveis de ocorrência e sorotipos predominantes em rebanhos dos Estados de Minas Gerais, São Paulo, Rio de Janeiro, Paraná, Rio Grande do Sul e Mato Grosso do Sul. Período de janeiro a abril de 1996. Arquivos do Instituto Biológico , São Paulo, v.64, n.2, p.7-15, 1997.).
Sarmento et al. (2012SARMENTO, A.M.C.; AZEVEDO, S.S.; MORAIS, Z.M.; SOUZA, G.O.; OLIVEIRA, F.C.S.; GONÇALES, A.P.; MIRAGLIA, F.; VASCONCELLOS, S.A. Emprego de estirpes Leptospira spp. isoladas no Brasil na microtécnica de soroaglutinação microscópica aplicada ao diagnóstico de leptospirose em rebanhos bovinos de oito estados brasileiros. Pesquisa Veterinária Brasileira , v.32, n.7, p.601-606, 2012.), em inquéritos realizados em oito estados brasileiros, obtiveram maiores frequências para os sorovares Hardjo (43%), Wolffii (9,96%) e Pomona (4,28%). A prevalência desses sorovares também foi diagnosticada por Santos (1988SANTOS, H.P. Alguns aspectos do sistema de produção e da sanidade dos bovinos de leite da Ilha de São Luís - MA . 1988. 91f. Dissertação (Mestrado em Medicina Veterinária Preventiva e Epidemiologia) - Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, 1988.), em São Luís, onde foram alcançadas frequências para os sorovares Hardjo (19,10%), Wolffii (16,70%) e Pomona (2,40%). Silva et al. (2012SILVA, F.J.; CONCEIÇÃO, W.L.F.; FAGLIARI, J.J.; GIRIO, R.J.S.; DIAS, R.A.; BORBA, M.R.; MATHIAS, L.A. Prevalência e fatores de risco de leptospirose bovina no estado do Maranhão. Pesquisa Veterinária Brasileira , v.32, n.4, p.303-312, 2012.), ao fazer estudo soroepidemiológico no estado do Maranhão, detectaram os sorovares Hardjo e Wolffii com percentuais para rebanhos e animais na regional de São Luís de 78/136 (57,35%) e 347/841 (41,63%), enquanto nas regionais de Bacabal e Pedreiras foram representativos para rebanhos e animais com prevalência de 120/238 (50,42%) e 523/2.582 (22,20%), respectivamente.
A prática de aluguel de pasto não apresentou valor estatisticamente significativo na análise univariada de risco para os animais, entretanto essa prática não deve ser desconsiderada. O contato de animais com pastos contaminados, de modo especial com urina, restos placentários e fetos, atua como fonte de transmissão em potencial. As espécies patogênicas possuem período de sobrevida no solo de até 180 dias (Faine et al., 2000FAINE, S.; ADLER, B.; BOLIN, C.; PEROLAT, P.Leptospira and leptospirosis2nd.ed. Melbourne: MedSci, 2000. ; Levett, 2001LEVETT, P.N. Leptospirosis. Clinical Microbiology Reviews , v.14, n.2, p.296-326, 2001. Disponível em: <Disponível em: http://cmr.asm.org/content/14/2/296
>. Acesso em: 21. ago. 2013. DOI: 10.1128/CRM.14.2.296-326
http://cmr.asm.org/content/14/2/296...
; Who, 2003WORLD HEALTH ORGANIZATION. Human leptospirosis: guidance for diagnosis, surveillance and control. Geneva: World Health Organization, 2003.; Hamond, 2010HAMOND, C. Avaliação do impacto da Leptospira no desempenho atlético de equinos . Dissertação (Mestrado em Microbiologia e Parasitologia) - Universidade Federal Fluminense, Rio de Janeiro, 2010.).
A vacinação contra leptospirose neste estudo não indicou significância estatística. De fato, apenas 5% dos questionados revelaram que vacinavam o rebanho, porém sem utilizar o cronograma de vacinação da maneira correta. Cabe enfatizar que animais vacinados apresentam sorologia positiva sem, contudo, apontarem sinais clínicos da doença e que o uso de um programa de vacinação é uma das principais medidas na prevenção e no controle da leptospirose. Segundo Herrmann et al. (2012HERRMANN, G.P.; RODRIGUES, R.O.; MACHADO, G.; LAGE, A.P.; MOREIRA, E.C.; LEITE, R.C. Soroprevalência de leptospirose em bovinos nas mesorregiões sudeste e sudoeste do estado do Rio Grande do Sul, Brasil. Ciência Animal Brasileira , Goiânia, v.13, n.1, p.131-138, jan./mar. 2012. ), a imunização atua na prevenção de sinais clínicos como abortamento, morte embrionária e outros sinais característicos da doença, permitindo o controle sanitário do plantel.
CONCLUSÕES
Com base nos resultados obtidos, podemos concluir que a frequência de Leptospira spp. foi elevada nos rebanhos bovinos leiteiros das regiões central e nordeste do estado do Maranhão. Os sorovares Patoc, Hardjo, Wolffii e Pomona foram os mais frequentes em ordem crescente de ocorrência, e os fatores de risco associados à infecção para leptospirose foram a não realização de inseminação artificial, a criação conjunta de caprinos, ovinos, equinos e caninos nas propriedades e a maior taxa de natalidade de bezerros no período seco. O segmento de laticínios no Estado encontra-se em expansão. Portanto, medidas sanitárias com vistas ao controle e à prevenção dessa zoonose devem ser adotadas por todos os atores (públicos e privados) envolvidos na cadeia produtiva do leite.
REFERÊNCIAS
- ACHA, P.N.; SZYFRES, B Zoonoses and communicable diseases common to man and animals. 3rd.ed. Washington, D.C.: Pan American Health Organization, 2003. v.1. p.28-45, 2003.
- AGÊNCIA ESTADUAL DE DEFESA AGROPECUÁRIA DO MARANHÃO. Coordenadoria de Defesa Animal. Programa de Prevenção e Erradicação da Febre Aftosa. Efetivo de bovinos leiteiros do estado do Maranhão . AGED, 2012. Arquivo impresso.
- ARAÚJO, B.M. Soroepidemiologia da infecção por Leptospira spp. em bovinos, equídeos, caninos e trabalhadores rurais em assentamento no município de Aragominas, Tocantins, Brasil . 2010. 112f. Tese (Doutorado em Veterinária) - Escola de Veterinária, Universidade Federal de Goiás, 2010.
- BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Guia de Vigilância Epidemiológica . 7.ed. Brasília, 2009. Série A. Normas e Manuais Técnicos. Disponível em: <Disponível em: http://www.ammabarbacena.com.br/files/a7341de89b43294954a4ebdbd75be42d.pdf >. Acesso em: 6 nov. 2013.
» http://www.ammabarbacena.com.br/files/a7341de89b43294954a4ebdbd75be42d.pdf - BROD, C.S.; FEHBERG, M.F. Epidemiologia da leptospirose em bovinos. Ciência Rural , Santa Maria, v.22, p.239-45, 1992.
- CENTRO PANAMERICANO DE ZOONOSIS. Procedimientos para estudios de la prevalencia por muestreo Ramos Mejia, Buenos Aires, 1979. 35p. (Nota técnica 18).
- COLE JR., J.R.; SULZER, C.R.; PURSELL, A.R. Improved microtechnique for the leptospiral microscopic agglutination. Applied Microbiology , v.25, p.976-980, 1973.
- CORCHO, D.B.; ACOSTA, A.M.C.; BOZA, E.R. Leptospirosis humana, una enfermedad olvidada. Revista Cubana de Medicina General Integral , v.25, n.1, 2009.
- COSTA, M.C.R.; MOREIRA, E.C.; LEITE, R.C.; MARTINS, N.R.S. Avaliação da imunidade cruzada entre Leptospira hardjo e L. wolffi . Arquivo Brasileiro de Medicina Veterinária e Zootecnia , v.50, n.1, p.11-17, 1998.
- CUBAS, Z.S.; SILVA, J.C.R.; Catão-Dias, J.L. Tratado de animais selvagens: medicina veterinária. São Paulo: Roca, 2007. p.736-741.
- DHALIWAL, G.S.; MURRAY, R.D.; DOBSON, H.; MONTGOMERY, J.; ELLIS, W.A. Reduced conception rate in dairy cattle associated with serological evidence of Leptospira interrogans sorovar hardjoinfection. The Veterinary Record , v.139, p.110-114, 1996.
- ELLIS, W.A. Leptospirosis as a cause of reproductive failure.Food Animal Practice v.10, n.3, p.463-478, 1994.
- FAINE, S.; ADLER, B.; BOLIN, C.; PEROLAT, P.Leptospira and leptospirosis2nd.ed. Melbourne: MedSci, 2000.
- FÁVERO, M.; PINHEIRO, S.R.; VASCONCELLOS, S.A.; MORAIS, Z.M.; FERREIRA, F.; FERREIRA NETO, J.S. Leptospirose bovina: variantes sorológicas predominantes em colheitas efetuadas no período de 1984 a 1997 em rebanhos de 21 estados do Brasil. Arquivos do Instituto Biológico , São Paulo, v.68, n.2, p.29-35, 2001.
- FLETCHER, W. Recent work on leptospirosis, tsutsugamushi disease and tropical typhus in the Federated Maloy States. Transactions of the Royal Society of Tropical Medicine Hygiene, n.21, p.267-287, 1928. In: CENTRO PANAMERICANO DE ZOONOSIS.Manual sobre métodos de laboratórios para leptospirose. 1928. (Nota Técnica, n. 9).
- GALTON, M.M.; SULZER, C.R.; SANTA ROSA, C.A.; FIELDS, M.J. Application of a microtechnique to the agglutination test for Leptospiral antibodies. Applied Microbiology , v.13, p.81-85, 1965. Disponível em: <Disponível em: http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1058195&blobtype=pdf >. Acesso em: 24 ago. 2013.
» http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1058195&blobtype=pdf - GENOVÉZ, M.E. Leptospirose: uma doença de ocorrência além da época das chuvas! Biológico , São Paulo, v.71, n.1, p.1-3, jan./jun. 2009.
- GOMES, M.J.P. Gênero Leptospira spp. Microbiologia Clínica Veterinária. Rio Grande do Sul: FAVET-UFRGS, 2013. Disponível em: <Disponível em: http://www.ufrgs.br/labacvet/files/G%C3%AAnero%20Leptospira%204-2013-1.pdf >. Acesso em: 01 ago. 2014.
» http://www.ufrgs.br/labacvet/files/G%C3%AAnero%20Leptospira%204-2013-1.pdf - HAMOND, C. Avaliação do impacto da Leptospira no desempenho atlético de equinos . Dissertação (Mestrado em Microbiologia e Parasitologia) - Universidade Federal Fluminense, Rio de Janeiro, 2010.
- HARTSKEEL, R.A. Leptospirosis: current status and future trendsIndian Journal Medical Microbiology, v.24, n.4, p.309, 2009.
- HERRMANN, G.P.; RODRIGUES, R.O.; MACHADO, G.; LAGE, A.P.; MOREIRA, E.C.; LEITE, R.C. Soroprevalência de leptospirose em bovinos nas mesorregiões sudeste e sudoeste do estado do Rio Grande do Sul, Brasil. Ciência Animal Brasileira , Goiânia, v.13, n.1, p.131-138, jan./mar. 2012.
- HOMEM, V.S.F.; HEINEMANN, M.B.; MORAES, Z.M.; VASCONCELLOS, S.A.; FERREIRA, F.; FERREIRA NETO, J.S. Estudo epidemiológico da leptospirose bovina e humana na Amazônia oriental brasileira. Revista da Sociedade Brasileira de Medicina Tropical , v.34, n.2, p.173-180, mar./abr.2001.
- LAGE, A.P.; LEITE, R. de M.H.; THOMPSON, J.A.; BANDEIRA, D.A.; HERRMANN, G.P.; MOREIRA, É.C.; GONÇALVES, V.S.P. Serology for Leptospira sp. in cattle of the State of Paraíba, Brazil. Arquivos do Instituto Biológico , v.74, n.3, p.185-190, 2007.
- LANGONI, H.; MEIRELES, L.R.; GOTTSCHALK, S.; CABRAL, K.G.; SILVA, A.V. Perfil sorológico da leptospirose bovina em regiões do estado de São Paulo. Arquivos do Instituto Biológico , São Paulo, v.67, n.1, p.37-41, 2000.
- LEVETT, P.N. Leptospirosis. Clinical Microbiology Reviews , v.14, n.2, p.296-326, 2001. Disponível em: <Disponível em: http://cmr.asm.org/content/14/2/296 >. Acesso em: 21. ago. 2013. DOI: 10.1128/CRM.14.2.296-326
» http://cmr.asm.org/content/14/2/296 - LILENBAUM, W. Atualização em leptospiroses bovinas. Revista Brasileira de Medicina Veterinária , v.18, n.1, p.9-13, 1996.
- LILENBAUM, W.; SOUZA, G.N. Factors associated with bovine leptospirosis in Rio de Janeiro, Brazil. Research in Veterinary Science , v.75, p.249-251, 2003.
- ORGANIZAÇÃO MUNDIAL DE SAÚDE ANIMAL (OIE). Código Sanitário para los Animales Terrestres . Criterio de inscripción de enfermedades en la lista de la OIE. 2009. p.4-8, chap. 1.2. Disponível em: <Disponível em: http://www.oie.int/doc/ged/d6515.pdf >. Acesso em: 12 dez. 2013.
» http://www.oie.int/doc/ged/d6515.pdf - ORGANIZAÇÃO MUNDIAL DE SAÚDE ANIMAL (OIE). Terrestrial Manual . Leptospirosis. 2014. chap. 2.1.9. <http://www.oie.int/eng/normes/mmanual/a_00043.htm>. Acesso em: 21. jun. 2014.
» http://www.oie.int/eng/normes/mmanual/a_00043.htm - PAIXÃO, M.S.; ALVES, M. F.; PIRAJÁ, G.V.; FERREIRA, A. G.; ALVES, M. L.; TENORIO, M. S.; BUZETTI, W. A. S.; LUCHEIS, S.B. Soroprevalência para leptospirose em animais silvestres de vida livre procedentes do centro de conservação da fauna silvestre de Ilha Solteira, SP. Biológico , São Paulo, v.73, n.2, p.210-213, jul./dez. 2011.
- PALANIAPPAN, R.U.M.; RAMANUJAM, S.; CHANG, Y.-F. Leptospirosis: pathogenesis, immunity and diagnosis. Current Opinion Infectious Diseases , v.20, p.284-292, 2007.
- PHILIP, S.S. Spirochetal infections. In: MC PHEE S.J.; PAPADAKIS, M.A. (Eds.). Current Medical Diagnosis & Treatment . New York: McGraw-Hill, 2011. p.1414-1415.
- PIRES, A.V. Bovinocultura de corte . Piracicaba: FEALQ, 2010. V.2. p.971-975.chap.51.
- RADOSTITS, O.M.; GAY, C.C.; BLOOD, D.C.; HINCHCLIFF, K.W. Clínica veterinária: um tratado de doenças dos bovinos, suínos, caprinos e equinos. 9th.ed.Rio de Janeiro: Guanabara Koogan, 2002. 1737p.
- ROLIM, M.B.Q.; BARROS, S.E.M.; SILVA, V.C.L.; SANTANA, V.L.A.; SOUZA, M.A.; HAROP, M.H.V.; MOTA, R.A.; OLIVEIRA, M.A.L.; MOURA, A.P.B.L.; LIMA, P.F. Determinação de anticorpos anti-Leptospira spp. e anti-Brucella abortus em bovinos abatidos em matadouro público no estado de Pernambuco. Revista de Medicina Veterinária , Recife, v.7, n.1, p.24-30, 2013.
- SANTOS, H.P. Alguns aspectos do sistema de produção e da sanidade dos bovinos de leite da Ilha de São Luís - MA . 1988. 91f. Dissertação (Mestrado em Medicina Veterinária Preventiva e Epidemiologia) - Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, 1988.
- SARMENTO, A.M.C.; AZEVEDO, S.S.; MORAIS, Z.M.; SOUZA, G.O.; OLIVEIRA, F.C.S.; GONÇALES, A.P.; MIRAGLIA, F.; VASCONCELLOS, S.A. Emprego de estirpes Leptospira spp. isoladas no Brasil na microtécnica de soroaglutinação microscópica aplicada ao diagnóstico de leptospirose em rebanhos bovinos de oito estados brasileiros. Pesquisa Veterinária Brasileira , v.32, n.7, p.601-606, 2012.
- SILVA, L.G. Incidência de leptospirose em animais e em seres humanos em região representativa do noroeste do estado do Rio de Janeiro . 70f. 2007. Dissertação (Mestrado em Produção Animal) - Centro de Ciências e Tecnologias Agropecuárias, Universidade Estadual do Norte Fluminense, Campos dos Goytacazes, Rio de Janeiro, 2007.
- SILVA, F.J.; MATHIAS, L.A.; MAGAJEVSKI, F.S.; WERTHER, K.; ASSIS, N.A.; GIRIO, R.J.S. Anticorpos contra Leptospira spp. em animais domésticos e silvestres presentes no Campus Universitário da FCAV, UNESP, Jaboticabal/SP. ARS Veterinária , Jaboticabal, v.26, n.1, p.17-25, 2010.
- SILVA, F.J.; CONCEIÇÃO, W.L.F.; FAGLIARI, J.J.; GIRIO, R.J.S.; DIAS, R.A.; BORBA, M.R.; MATHIAS, L.A. Prevalência e fatores de risco de leptospirose bovina no estado do Maranhão. Pesquisa Veterinária Brasileira , v.32, n.4, p.303-312, 2012.
- SPEELMAN, P.; HARTSKEERL, R.A. Leptospirosis. In: KASPER, D.; FAUCI, A.S.; HAUSER, S.; LONGO, D.; JAMESON, J.L.; LOSCALZO, J. Harrison's principles of internal medicine . New York: McGraw-Hill , 2008. p.1048-1051.
- THRUSFIELD, M. Veterinary epidemiology . London: Butterworths, 2007. 610P.
- VASCONCELOS, C.G.C. Zoonoses ocupacionais: inquérito soroepidemiológico em estudantes de Medicina Veterinária e análise de risco para leptospirose, brucelose e toxoplasmose . 2003. 108f. Tese (Doutorado em Doenças Tropicais) - Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, 2003.
- VASCONCELLOS, S.A.; BARBARINI JÚNIOR, O.; UMECHARA, O.; ORAIS, Z.M.; CORTEZ, A.; PINHEIRO, S.R.; FERREIRA, F.; FAVERO, A.C.M.; FERREIRA NETO, J.S. Leptospirose bovina. Níveis de ocorrência e sorotipos predominantes em rebanhos dos Estados de Minas Gerais, São Paulo, Rio de Janeiro, Paraná, Rio Grande do Sul e Mato Grosso do Sul. Período de janeiro a abril de 1996. Arquivos do Instituto Biológico , São Paulo, v.64, n.2, p.7-15, 1997.
- WORLD HEALTH ORGANIZATION. Human leptospirosis: guidance for diagnosis, surveillance and control. Geneva: World Health Organization, 2003.
-
1
Artigo extraído da dissertação apresentada ao Programa de Pós-Graduação do Mestrado Profissional em Defesa Sanitária Animal da Universidade Estadual do Maranhão (UEMA) para obtenção do grau de mestre em Defesa Sanitária Animal.
Datas de Publicação
-
Publicação nesta coleção
2016
Histórico
-
Recebido
02 Dez 2014 -
Aceito
28 Set 2016