RESUMO:
O objetivo deste trabalho foi avaliar o efeito do contato direto e da fração volátildo óleo de café verde, testado nas concentrações de 500, 1.000, 1.500 e 2.000 µL L-1, sobre o crescimento micelial e a esporulação dos fungos Penicillium roqueforti e Rhizopus stolonifer. O óleo essencial de cravo-da-índia na concentração de 800 µL L-1 foi utilizado para comparação. Nas concentrações de 1.500 e 2.000 µL L-1, o óleo de café verde em contato direto proporcionou redução da esporulação do fungo R. stolonifer , sendo estatisticamente semelhante ao óleo de cravo-da-índia. Na fração volátil do óleo de café verde, observou-se redução significativa da esporulação de P. roqueforti e R. stolonifer na concentração de 2.000 µL L-1. O óleo de café verde, em contato direto ou por volatilização, reduziu significativamente o crescimento micelial e a esporulação de ambos os fungos em comparação com a testemunha.
PALAVRAS-CHAVE:
Penicillium roqueforti; Rhizopus stolonifer; óleo de cravo-da-índia.
ABSTRACT:
The objective of this study was to evaluate the effect of direct contact and volatile fraction of from green coffee oil, tested at concentrations of 500, 1,000, 1,500 and 2,000 µL L-1, on mycelial growth and sporulation of Penicillium roqueforti and Rhizopus stolonifer . The essential oil of clove at a concentration of 800 µL L-1 was used for comparison. At concentrations of 1,500 and 2,000 µL L-1, the green coffee oil in direct contact caused a reduction of sporulation for R. stolonifer, similar to clove oil. In the volatile fraction of the green coffee oil, there was a significant reduction in sporulation of P. roqueforti and R. stolonifer at a concentration of 2,000 µL L-1. The green coffee oil, in direct contact or by volatilization, significantly reduced the mycelial growth and sporulation of both fungi compared to the control.
KEYWORDS:
Penicillium roqueforti; Rhizopus stolonifer; oil clove.
O fungo Penicillium roqueforti , comumente encontrado em silagem e grãos, pode produzir diversas micotoxinas, como roquefortina C, isofumigaclavina A e B, toxina PR e ácido micofenólico, que podem causar tanto perdas econômicas quanto afetar a saúde humana (Chitarra et al., 2003CHITARRA, G.S.; BREEUWER, P.; NOUT, M.J.; van AELST, A.C.; ROMBOUTS, F.M.; ABEE, T.. An antifungal compound produced by Bacillus subtilis YM 10-20 inhibits germination of Penicillium roqueforti conidiospores. Journal of Applied Microbiology , v.94, p.159-166, 2003). Adicionalmente, o fungo Rhizopus stolonifer (Ehrenb: Fr). Vuill, agente causal da podridão pós-colheita em diversos legumes e frutas (Stevens et al., 2004STEVENS, C.; LIU, J.; KHAN, V.A.; LU, J.Y.; KABWE, M.K.; WILSON, C.L. The effects of low-dose ultraviolet light-C treatment on polygalacturonase activity, delay ripening and Rhizopus soft rot development of tomatoes.Crop Protection, v.23, p.551-555, 2004.; Zhang et al., 2007ZHANG, Y.; BAO, F.; HU, J.; LIANG, S.; ZHANG, Y; DU, G; ZHANG, C.; CHENG, Y. Antibacterial lignans and triterpenoids from Rostellularia procumbens. Planta Medica, v.73, n.15, p.1596-1599, 2007.), também é responsável por expressivas perdas econômicas no setor agrícola. Os tratamentos comumente utilizados para controle de fungos em alimentos são os tratamentos térmicos ou químicos (Samson et al., 1995SAMSON, R.A.; HOEKSTRA, E.S.; FRISVAD, J.C.; FILTENBORG, O. Introduction to food-borne fungi . Baarn, the Netherlands: Centra-albureau voor Schimmelcultures; 1995.; Pitt; Hoching, 1997PITT, J.I.; HOCHING, A.D. Fungi and food spoilage . London: Blackie Academic and Professional; 1997.). Com isso, a procura por novos agentes antimicrobianos, a partir de plantas, é intensa devido à resistência dos microrganismos diante de produtos sintéticos (Araújo, 2005ARAÚJO, R.C.Z. Embalagens ativas com ervas aromáticas e condimentos na conservação de pães artesanais . 2005. 45f. Dissertação (Mestrado em Ciência dos Alimentos) - Universidade Federal de Lavras, Lavras, 2005.).
O uso intensivo de agroquímicos para controlar doenças em plantas e frutos vem causando prejuízos ao meio ambiente e selecionando espécies de fungos com resistência a fungicidas. Isso justifica, portanto, a busca por métodos alternativos de controle, no qual se incluem o controle biológico e a indução de resistência em plantas pelo uso de extratos vegetais e óleos essenciais, entre outros (Stangarlin et al., 1999STANGARLIN, J.R.; SCHWAN-ESTRADA, K.R.F.; CRUZ, M.E.S.; NOZAKI, M.H. Plantas medicinais e controle alternativo de fitopatógenos. Biotecnologia Ciência & Desenvolvimento , v.2, n.11, p.16-24, 1999.; Schwan-Estrada; Stangarlin, 2005SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R. Extratos e óleos essenciais de plantas medicinais na indução de resistência. In: CAVALCANTI, L.S; DI PIERO, R.M.; CIA, P.; PASCHOLATI, S.F.; RESENDE, M.L.V.; ROMEIRO, R.S. (Ed.). Indução de resistência em plantas a patógenos e insetos . Piracicaba: Fealq; 2005. p.125-132.).
Diversos estudos têm comprovado o efeito de extratos e óleos essenciais de plantas medicinais quanto a sua capacidade de controlar doenças em plantas, tanto por sua atividade antimicrobiana direta quanto indireta (Chao; Young, 2000CHAO, S.C.; YOUNG, D.G. Screening for inhibitory activity of essential oils ou selected bacteria, fungi and virusesJournal Essentials Oil Research , v.12, n.4, p.630-649, 2000.; Fiori et al., 2000FIORI, A.C.G; SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R.; VIDA, J.B.; SCAPIM, C.A.; CRUZ, M.E.S.; PASCHOLATI, S.F. Antifungal activity of leaf extracts and essential oils of some medicinal plants against Didymella bryoniae . Journal Phytopathology , v.148, n.7-8, p.483-487, 2000.; Bastos; Albuquerque, 2004BASTOS, C.N.; ALBUQUERQUE, P.S.B. Efeito do óleo de Piper aduncum no controle em pós-colheita de Colletotrichum musae em banana. Fitopatologia Brasileira , v.29, n.5, p.555-557, 2004.).
O óleo de café verde é constituído por triacilgliceróis (75%), matéria insaponificável (13,54%) e ceras (0,24%) (Wagemaker et al., 2012WAGEMAKER, T.A.L.; FERNANDES, A.S.; CAMPOS, P.M.; RODRIGUES, L.M.; RIJO, P. Evaluation of antioxidant and antimicrobial activities of green coffee oil in cosmetic formulations. Biomedical and Biopharmaceutical Research Journal , v.9, n.2, p.207-214, 2012.). Esse óleo possui propriedades cosméticas (Speer; Kolling-Speer, 2006SPEER, K.; KOLLING-SPEER, I. The lipid fraction of the coffee bean. Brazilian Journal of Plant Physiology, v.18, n.1, p.201-216, 2006.), com efeitos antioxidantes e antimicrobianos avaliados em formulações cosméticas (Wagemaker et al., 2012WAGEMAKER, T.A.L.; FERNANDES, A.S.; CAMPOS, P.M.; RODRIGUES, L.M.; RIJO, P. Evaluation of antioxidant and antimicrobial activities of green coffee oil in cosmetic formulations. Biomedical and Biopharmaceutical Research Journal , v.9, n.2, p.207-214, 2012.). Contudo, estudos da atividade antimicrobiana desse óleo em fungos de importância agrícola são escassos. Dessa forma, a presente pesquisa teve como objetivo avaliar o efeito in vitro do óleo de café verde em dois métodos de aplicação (efeito volátil e contato direto) sobre o crescimento micelial e a esporulação dos fungos P. roqueforti e R. stolonifer .
As sementes de cafeeiro (Coffea arabica L.), cultivar Mundo Novo 376-4, utilizadas para obtenção do óleo de café foram obtidas na Fazenda Experimental de Três Pontas (MG) pertencente à Empresa Agropecuária de Minas Gerais (EPAMIG). O óleo essencial de café verde foi obtido por prensagem hidráulica e foi filtrado por membranas Millipore(r). As concentrações testadas foram de 0, 500, 1.000, 1.500 e 2.000 µL L-1. O óleo essencial de cravo-da-índia na concentração de 800 µL L-1 foi usado como tratamento padrão, uma vez que sua eficácia foi comprovada no controle de Penicillium spp. (Souza et al., 2004SOUZA, S.M.C.; PEREIRA, M.C.; ANGÉLICO, C.L.; PIMENTA, C.J. Avaliação de óleos essenciais de condimentos sobre o desenvolvimento micelial de fungos associados a produtos de panificação. Ciência e Agrotecnologia , v.28, n.3, p.685-690, 2004.).
Para a avaliação do efeito de contato, as diluições do óleo formam feitas diretamente em 100 mL de meio de cultura BDA. Uma alíquota de 100 µL de suspensão de esporos, de cada fungo estudado, padronizada para a concentração de 106 esporos mL-1, foi adicionada ao meio de cultura, sendo a mistura homogeneizada e posteriormente vertida em placas de Petri de 9 cm de diâmetro.
O teste de princípios ativos voláteis às diluições do óleo de café verde foi realizado em álcool etílico hidratado de cereais nas concentrações de 500, 1.000, 1.500 e 2.000 µL L-1. Foram utilizados discos de papel de filtro esterilizados (5 mm de diâmetro), os quais foram embebidos nas soluções de óleo de café verde diluído nas concentrações citadas e colocados na tampa das placas de Petri. Posteriormente, as placas foram vedadas utilizando filme plástico para impedir que os princípios voláteis dos óleos fossem perdidos. O álcool de cereais, utilizado na diluição do óleo, foi testado como controle negativo. As placas de ambos os experimentos foram incubadas em estufa BOD a 24 ± 1ºC com fotoperíodo de 12 horas pelo período de 7 dias.
Para a avaliação do crescimento micelial (cm/dia), foram realizadas medições do diâmetro das colônias, em dois eixos perpendiculares entre si, aos sete dias após a instalação do experimento.
A quantificação da esporulação dos fungos, também realizada aos 7 dias após a instalação do experimento, foi realizada com a raspagem das colônias com pincel (15 mL de água destilada esterilizada/placa), filtragem em gaze esterilizada e quantificação dos conídios obtidos utilizando câmara de Neubauer.
O experimento para verificar o efeito de contato direto do óleo de café verde foi instalado em delineamento inteiramente casualizado, com 6 tratamentos (óleo de café verde nas concentrações de 0, 500, 1.000, 1.500 e 2.000 µL L-1 e óleo essencial de cravo-da-índia na concentração de 800 µL L-1) e 4 repetições, sendo cada placa de Petri considerada uma unidade experimental. Para avaliação do efeito da fração volátil do óleo, o delineamento utilizado foi o inteiramente casualizado, com 7 tratamentos (óleo de café verde nas concentrações de 0, 500, 1.000, 1.500 e 2.000 µL L-1, óleo essencial de cravo-da-índia na concentração de 800 µL L-1 e álcool de cereais) e 4 repetições. As análises foram feitas usando o pacote estatístico Sistema de Análise de Variância para Dados Balanceados - Sisvar, e as medias foram comparadas pelo teste Scott & Knott a 5% de significância.
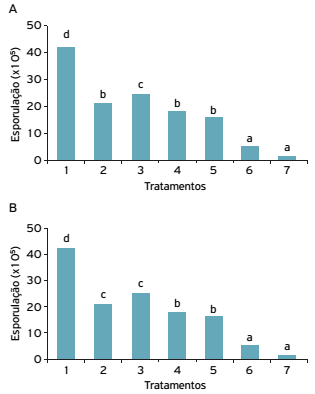
Não se observou efeito de contato direto do óleo de café verde sobre a inibição do desenvolvimento micelial de ambos os fungos testados. Contudo, a ação do óleo reduziu significativamente a esporulação tanto do fungo P. roqueforti quanto do fungo R. stolonifer (Figs. 1A e 1B). O óleo de cravo-da-índia na concentração de 800 µL L-1 apresentou redução de 95% na esporulação do fungo P. roqueforti , sendo o tratamento mais eficaz. A concentração de 2.000 µL L-1 do óleo de café foi a mais efetiva, dentre as concentrações testadas, apresentando redução na esporulação de 63%, quando comparada ao tratamento controle (Fig. 1A). As demais concentrações testadas diferiram somente do tratamento controle.
Efeito do óleo de café verde misturado ao meio de cultura (contato direto) na redução da esporulação de Penicillium roqueforti (A) e Rhizopus stolonifer (B). Tratamentos: 1) controle; 2) óleo de café verde (OC) 500 µL L-1; 3) OC 1.000 µL L-1; 4) OC 1.500 µL L-1; 5) OC 2.000 µL L-1; 6) óleo essencial de cravo-da-índia 800 µL L-1. Letras distintas representam diferença significativa entre os tratamentos pelo teste de Scott-Knott a 5% de probabilidade.
A esporulação do fungo R. stolonifer foi significativamente reduzidanos tratamentos com a aplicação do óleo de café verde nas concentrações de 1.500 e 2.000 µL L-1 e óleo de cravo-da-índia, sendo os tratamentos mais eficazes (Fig. 1B). Costa et al. (2011COSTA, A.R.T.; AMARAL, M.F.Z.J.; MARTINS, P.M.; PAULA, J.A.M.; FIUZA, T.S.; TRESVENZOL, L.M.F.; PAULA, J.R.; BARA, M.T.F. Ação do óleo essencial de Syzygium aromaticum (L.) Merr. & L.M.Perry sobre as hifas de alguns fungos fitopatogênicos. Revista Brasileira de Plantas Medicinais , v.13, n.2, p.240-245, 2011.) constataram que o óleo essencial de cravo-da-índia apresentou atividade fungicida na concentração de 0,15% sobre o crescimento de R. solani , F. oxysporum e F. solani. A avaliação microscópica dos micélios dos fungos evidenciou diversas alterações morfológicas, como presença de vacúolos, desorganização dos conteúdos celulares, diminuição na nitidez da parede celular, intensa fragmentação e menor turgência das hifas.
Com relação ao efeito da fração volátil do óleo de café verde, observou-se que, assim como efeito de contato direto, somente a esporulação foi influenciada pela aplicação dos óleos. Para o fungo P. roqueforti , observou-se redução da variável estudada somente para a maior concentração testada de óleo de café verde, 2.000 µL L-1, não diferindo do óleo de cravo-da-índia (Fig. 2A). As concentrações de 1.000 e 1.500 µL L-1 apresentaram efeito semelhante ao controle negativo (álcool de cereais). Assim como observado para o fungo P. roqueforti ,oóleo de café verde na concentração de 2.000 µL L-1 reduziu significativamente a esporulação do fungo R. stolonifer , sendo semelhante à aplicação do óleo de cravo-da-índia (Fig. 2B).
Efeito da fração volátil do óleo de café verde na redução da esporulação de Penicillium roqueforti (A) e Rhizopus stolonifer (B). Tratamentos: 1) controle; 2) álcool; 3) óleo de café verde (OC) 500 µL L-1; 4) OC 1.000 µL L-1; 5) OC 1.500 µL L-1; 6) OC 2.000 µL L-1; 7) óleo essencial de cravo-da-índia 800 µL L-1. Letras distintas representam diferença significativa entre os tratamentos pelo teste de Scott-Knott a 5% de probabilidade.
Durante a extração do óleo de café verde, compostos fenólicos possivelmente foram extraídos juntamente. Os ácidos clorogênicos e compostos relacionados são os principais componentes da fração fenólica dos grãos de café verde, alcançando teores de até 14% (em massa de matéria seca) (Farah; Donangelo, 2006FARAH, A.; DONANGELO, C.M. Phenolic compounds in coffee. Brazilian Journal of Plant Physiology , v.18, n.1, p.23-36, 2006.). Nas plantas, os ácidos clorogênicos e outros compostos fenólicos participam de uma série de funções biológicas, como na resistência a pragas e doenças, resposta à seca e proteção contra a radiação solar (Mondolot et al., 2006MONDOLOT, L.; LA FISCA, P.; BUATOIS, B.; TALANSIER, E.; DE KOCHKO, A.; CAMPA, C. Evolution in caffeoylquinic acid content and histolocalization during coffea canephora leaf development. Annals of Botany , v.98, p.33-40, 2006.).
REFERÊNCIAS
- ARAÚJO, R.C.Z. Embalagens ativas com ervas aromáticas e condimentos na conservação de pães artesanais . 2005. 45f. Dissertação (Mestrado em Ciência dos Alimentos) - Universidade Federal de Lavras, Lavras, 2005.
- BARA, M.T.F.; AMARAL, M.F.Z.J. Avaliação da atividade antifúngica de extratos de plantas sobre o crescimento de fitopatógenos. Revista Eletrônica de Farmácia Suplemento, v.2, p.5-8, 2005.
- BASTOS, C.N.; ALBUQUERQUE, P.S.B. Efeito do óleo de Piper aduncum no controle em pós-colheita de Colletotrichum musae em banana. Fitopatologia Brasileira , v.29, n.5, p.555-557, 2004.
- CHAO, S.C.; YOUNG, D.G. Screening for inhibitory activity of essential oils ou selected bacteria, fungi and virusesJournal Essentials Oil Research , v.12, n.4, p.630-649, 2000.
- CHITARRA, G.S.; BREEUWER, P.; NOUT, M.J.; van AELST, A.C.; ROMBOUTS, F.M.; ABEE, T.. An antifungal compound produced by Bacillus subtilis YM 10-20 inhibits germination of Penicillium roqueforti conidiospores. Journal of Applied Microbiology , v.94, p.159-166, 2003
- COSTA, A.R.T.; AMARAL, M.F.Z.J.; MARTINS, P.M.; PAULA, J.A.M.; FIUZA, T.S.; TRESVENZOL, L.M.F.; PAULA, J.R.; BARA, M.T.F. Ação do óleo essencial de Syzygium aromaticum (L.) Merr. & L.M.Perry sobre as hifas de alguns fungos fitopatogênicos. Revista Brasileira de Plantas Medicinais , v.13, n.2, p.240-245, 2011.
- FARAG, R.S.; DAW, Z.Y.; ABO-RAYA, S.H. Influence of Some Spice Essential Oils on Aspergillus Parasiticus Growth and Production of Aflatoxins in a Synthetic Medium. Journal of Food Science , v.54, n.1, p.54-74, 1989.
- FARAH, A.; DONANGELO, C.M. Phenolic compounds in coffee. Brazilian Journal of Plant Physiology , v.18, n.1, p.23-36, 2006.
- FIORI, A.C.G; SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R.; VIDA, J.B.; SCAPIM, C.A.; CRUZ, M.E.S.; PASCHOLATI, S.F. Antifungal activity of leaf extracts and essential oils of some medicinal plants against Didymella bryoniae . Journal Phytopathology , v.148, n.7-8, p.483-487, 2000.
- MONDOLOT, L.; LA FISCA, P.; BUATOIS, B.; TALANSIER, E.; DE KOCHKO, A.; CAMPA, C. Evolution in caffeoylquinic acid content and histolocalization during coffea canephora leaf development. Annals of Botany , v.98, p.33-40, 2006.
- PITT, J.I.; HOCHING, A.D. Fungi and food spoilage . London: Blackie Academic and Professional; 1997.
- SAMSON, R.A.; HOEKSTRA, E.S.; FRISVAD, J.C.; FILTENBORG, O. Introduction to food-borne fungi . Baarn, the Netherlands: Centra-albureau voor Schimmelcultures; 1995.
- SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R. Extratos e óleos essenciais de plantas medicinais na indução de resistência. In: CAVALCANTI, L.S; DI PIERO, R.M.; CIA, P.; PASCHOLATI, S.F.; RESENDE, M.L.V.; ROMEIRO, R.S. (Ed.). Indução de resistência em plantas a patógenos e insetos . Piracicaba: Fealq; 2005. p.125-132.
- SOUZA, S.M.C.; PEREIRA, M.C.; ANGÉLICO, C.L.; PIMENTA, C.J. Avaliação de óleos essenciais de condimentos sobre o desenvolvimento micelial de fungos associados a produtos de panificação. Ciência e Agrotecnologia , v.28, n.3, p.685-690, 2004.
- SPEER, K.; KOLLING-SPEER, I. The lipid fraction of the coffee bean. Brazilian Journal of Plant Physiology, v.18, n.1, p.201-216, 2006.
- STANGARLIN, J.R.; SCHWAN-ESTRADA, K.R.F.; CRUZ, M.E.S.; NOZAKI, M.H. Plantas medicinais e controle alternativo de fitopatógenos. Biotecnologia Ciência & Desenvolvimento , v.2, n.11, p.16-24, 1999.
- STEVENS, C.; LIU, J.; KHAN, V.A.; LU, J.Y.; KABWE, M.K.; WILSON, C.L. The effects of low-dose ultraviolet light-C treatment on polygalacturonase activity, delay ripening and Rhizopus soft rot development of tomatoes.Crop Protection, v.23, p.551-555, 2004.
- WAGEMAKER, T.A.L.; FERNANDES, A.S.; CAMPOS, P.M.; RODRIGUES, L.M.; RIJO, P. Evaluation of antioxidant and antimicrobial activities of green coffee oil in cosmetic formulations. Biomedical and Biopharmaceutical Research Journal , v.9, n.2, p.207-214, 2012.
- ZHANG, Y.; BAO, F.; HU, J.; LIANG, S.; ZHANG, Y; DU, G; ZHANG, C.; CHENG, Y. Antibacterial lignans and triterpenoids from Rostellularia procumbens. Planta Medica, v.73, n.15, p.1596-1599, 2007.
Datas de Publicação
-
Publicação nesta coleção
2016
Histórico
-
Recebido
27 Nov 2013 -
Aceito
03 Nov 2015