RESUMO
INTRODUÇÃO:
O subgalato de bismuto é um sal derivado de metal pesado. A ideia desta pesquisa é avaliar sua interferência em alguma das fases da cicatrização.
OBJETIVO:
Delinear a ação do subgalato em mucosas. Avaliar a relação entre a utilização do subgalato de bismuto e a neoformação de vasos nas feridas em mucosa oral, para evidenciar o possível benefício resultante do seu uso.
MÉTODO:
Estudo experimental, prospectivo. Utilizou-se sessenta ratos, que foram divididos igualmente em grupo controle e experimento. Foram submetidos a um procedimento cirúrgico onde foi feito uma lesão na mucosa oral dos animais, após, uma solução de soro fisiológico foi aplicada sobre a lesão do grupo controle e sobre a ferida do grupo experimento foi aplicada uma solução de subgalato de bismuto.
RESULTADOS:
o grupo experimento apresentou maior reação inflamatória com crescente proliferação monomórfica. Vasos: houve maior proliferação no grupo controle.
CONCLUSÕES:
concluiu-se que o subgalato de bismuto teve uma ação negativa no processo de cicatrização, atrasando a velocidade de formação dos neovasos e a cicatrização ideal da ferida operatória.
Palavras-chave:
Cicatrização; Tonsilectomia; Indutores da angiogênese
ABSTRACT
INTRODUCTION:
Bismuth subgallate is a salt derived from heavy metal. The aim of this study was to evaluate the effect of this salt on some phases of healing.
OBJECTIVES:
To assess the effect of subgallate on mucosa and to evaluate the association between the use of bismuth subgallate and neogenesis of vessels in oral mucosal wounds.
METHODS:
This was a prospective and experimental study. This study used sixty rats, which were divided into control and experimental groups. The animals were submitted to a surgical procedure, which caused oral mucosal injury. A saline solution was applied on the wound of the control group, and in the experimental group, a solution of bismuth subgallate was administrated.
RESULTS:
The experimental group showed greater inflammatory reaction with increasing monomorphic proliferation. There was increased vessel proliferation in the control group.
CONCLUSION:
Bismuth subgallate had a negative influence on the healing process, delaying the rate of new vessel formation and optimal wound healing.
Keywords:
Wound healing; Tonsillectomy; Angiogenesis-inducing agents
Introdução
O subagalato de bismuto, ou oxigalato de bismuto, é uma substância de coloração amarelada, que se apresenta na forma de pó inodoro e sofre descoloração na presença de luz solar. 11. Mandelbaum SH, Di Santis EP, Mandelbaum MHS. Cicatrização: conceitos atuais e recursos auxiliares/Parte I. An Bras Dermatol. 2003;78:393-410. É um sal derivado de metal pesado, pouco adsorvido e com forte poder adstringente. 22. Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71.
O dermatol, outro nome dado ao sal, tem sido cada vez mais utilizado pelos profissionais de otorrinolaringologia e odontologia. Devido às suas propriedades adstringentes e hemostáticas, a substância pode ser utilizada de várias formas; dentre elas estão: tratamento tópico de feridas abertas; tratamento de úlceras gastroduodenais, como antidiarreico; para controle do odor em colostomias; em cirurgias odontológicas; manejo da epistaxe; e, empiricamente, em adenotonsilectomias.
A literatura não é objetiva sobre o benefício do subgalato na hemostasia ou no efeito cicatricional, havendo discordância, e nem trabalha os possíveis efeitos pró-cicatricionais, deixando a desejar em se tratando de grupos comparativos ou controle. Contudo, Arroyo Júnior et al. 22. Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71. afirmam que o subgalato de bismuto atua na ativação do fator 12, que acelera a via intrínseca na cascata de coagulação, o que contribui para o caráter hemostático desse composto. O autor relata também sobre a possibilidade de o subgalato de bismuto inibir a fibrinólise, aumentando, com isso, a fibrose.
De acordo com Hernández-Paz et al. 33. Paz SHH, Reyes AO, Guzmán CMG. Estudio comparativo de dos agentes hemostáticos adicionados con epinefrina en la adenoamigdalectomía. Rev Esp Méd Quir. 2012;17:3-7. (do serviço de otorrinolaringologia do centro de cirurgia ambulatorial de ISSSTE, no México, DF), atualmente estão sendo investigados métodos com o objetivo de diminuir ou evitar a hemorragia trans ou pós-operatória em adenoamigdalectomias. Por este motivo, vários meios têm sido comparados, como o laser, a eletrodissecção, a ablação a frio, o uso de bisturi harmônico ou a radiofrequência. No entanto, nenhuma destas técnicas apresentou 100% de eficácia. Dentro dessa procura por um método ideal, têm sido relatadas duas substâncias derivadas do bismuto (subgalato e subsalicilato de bismuto), as quais apresentam efeitos hemostáticos que ativam o fator XII através da via intrínseca da coagulação. Quando aplicadas topicamente na ferida operatória, logo após a extração do tecido, diminuem significativamente o sangramento.
Padilla et al .44. Padilla RM, Valdés CM, Asato JR, Márquez M, Gutiérrez SC, González YA, et al. Eficacia del subgalato de bismuto, como agente hemostático tópico, en el sangrado transoperatorio de la adenoamigdalectomía o amigdalectomía. An Orl Mex. 2012;57:65-8. (do serviço de otorrinolaringologia do Centro Médico Nacional La Raza, IMSS, México, DF) descrevem o subgalato de bismuto como um metal pesado que acelera a formação do coágulo e melhora a hemostasia. Apontam também que alguns autores têm sugerido apenas a adrenalina como princípio ativo que ajuda na hemostasia por seu efeito vasoconstritor. De acordo com Padilla et al., existem poucos estudos que utilizam o subgalato de bismuto sozinho (sem a adrenalina) para demonstrar seu efeito hemostático; tendo isso em vista, propuseram um ensaio clínico comparando o efeito hemostático do subgalato em adenotonsilectomia em relação a um grupo controle em que foi utilizado apenas gaze seca. No presente trabalho, o subgalato de bismuto não demonstrou atividade como agente hemostático para diminuir o sangramento transoperatório.
A ideia desta pesquisa foi avaliar se o subgalato de bismuto promove interferência em alguma das fases da cicatrização, pois, sendo um material de fácil manejo (pó) e de custo reduzido, o seu uso poderia beneficiar a população do ponto de vista cicatricional, caso os estudos indiquem essa correlação.
Muitos serviços de otorrinolaringologia não utilizam o subgalato de bismuto, alegando que o resultado pós-operatório imediato do seu uso não revela benefício, enquanto outros referem grande facilidade no controle de sangramento, quando do uso do mesmo. Os trabalhos, de uma forma geral, enfocam seu uso referindo controle imediato de sangramento pós-operatório.
A cicatrização de ferida ocorre em processos simultâneos, na qual não é possível distinguir o início ou o final de cada um deles; porém, para fins didáticos, divide-se em etapas: coagulação, inflamação, proliferação, contração e remodelação. 11. Mandelbaum SH, Di Santis EP, Mandelbaum MHS. Cicatrização: conceitos atuais e recursos auxiliares/Parte I. An Bras Dermatol. 2003;78:393-410. A fase da proliferação é subdividida em reepitelização, fibroplasia e angiogênese.
Uma vez que a angiogênese é uma das importantes fases cicatricionais, se o subgalato de bismuto induzir a uma maior atividade angiogênica, espera-se ter neovasos de forma precoce e maior em termos quantitativos, os quais culminariam com a otimização do processo cicatricional.
A angiogênese ocorre a partir de vasos preexistentes, no soro e na matriz extracelular. Esses novos vasos auxiliam na formação de tecido de granulação, bem como na oferta de nutrientes e oxigênio para os tecidos, tornando-se, então, um processo fundamental para a cicatrização, em que corresponde a 60% do tecido de reparo. 55. Arnold F, West DC. Angiogenesis in wound healing. Pharmacol Ther. 1991;52:407-22.,66. Mendonca RJ, Coutinho-Netto J. Aspectos celulares da cicatrização. An Bras Dermatol. 2009;84:257-62.
A formação de neovasos é fundamental para a regeneração do tecido, e, para tanto, desenvolvem-se concomitante fatores locais, mediadores químicos, matriz extracelular e gradientes metabólicos. 77. Fonseca VRCD, Malafaia O, Ribas Filho JM, Nassif PAN, Czeczko NG, Marcondes CAP, et al. Angiogenesis, fibrinogenesis and presence of synechiae after exeresis of a swine vocal fold mucosal microflap and use of topical mitomycin-C. Acta Cir Bras. 2010;25:80-5.
Dentre os objetivos deste trabalho, constam como geral o delineamento e a ação do subgalato em mucosas, e como específicos a avaliação da relação entre a utilização do subgalato de bismuto e a neoformação de vasos nas feridas em mucosa oral, possibilitando, assim, evidenciar o possível benefício resultante do seu uso, podendo, por fim, inserir novos protocolos nos serviços de otorrinolaringologia envolvendo o uso do sal, principalmente em cirurgias de cavidade oral.
Método
Procedimento cirúrgico
Os experimentos foram realizados no período de 24 de setembro a 1 de outubro de 2012. Foram utilizados 60 ratos machos ( Rattus norvegiccus albinus ) da linhagem Wistar, adultos jovens com idade de 110 dias e peso médio entre 250 g e 300 g. O tamanho da amostra foi estimado por estudos realizados na literatura pesquisada, e o projeto seguiu as orientações da Lei 11.797 de 8 de outubro de 2008, regulamentada pelo decreto nº 6899, de 15 de julho de 2009, e as recomendações do Colégio Brasileiro de Experimentação Animal. O trabalho foi realizado sob aprovação do comitê de ética no uso de animais com o número 666.
Os animais foram anestesiados com 0,1 mL / 100 g de peso do animal com uma mistura de 1 mL de ketamina (50 mg) e 1 mL de xilazina 2% (20 mg), por via intramuscular, na porção posterior da coxa. Em seguida, foram posicionados em decúbito ventral e tiveram os membros inferiores e superiores fixados num suporte de madeira ( fig. 1 ). Com o auxílio de um abridor de boca adaptado, foi realizada uma ferida de aproximadamente 0,7 cm de diâmetro em mucosa oral do lado esquerdo, através do uso de uma pinça de biópsia.
Neste ponto do trabalho preferimos realizar a ferida operatória unilateral para diminuir a agressão ao animal e facilitar sua recuperação; o lado esquerdo foi escolhido para padronizar o estudo. Preferimos utilizar a pinça de biópsia em vez de um punch , devido à chance de este segundo material transfixar completamente a parede da cavidade oral do rato. Após o término do ato operatório, os animais receberam dipirona sódica (na dose de 10 mg / kg) por via intramuscular com finalidade analgésica, conforme o que foi proposto e aceito pelo CEUA.
Os animais foram aleatoriamente marcados e divididos em três grupos de dez, e estes foram submetidos à aplicação de 0,5 mg de subgalato de bismuto tópico após ferida com pinça de biópsia. Cada grupo foi reoperado para retirada da ferida e avaliação em 24 horas (GII), três dias (GIII) e sete dias (GIV) após a lesão ( fig. 2 ). Os 30 animais restantes fizeram parte do grupo controle (GI), e também foram divididos em três grupos de dez animais e igualmente avaliados em 24 horas, três dias e sete dias ( tabela 1 ).
O grupo controle foi tratado através de lavagem da ferida com solução de NaCl 0,9%, conforme preconiza a literatura. O fragmento foi retirado com margem de aproximadamente 0,5 cm de mucosa íntegra em torno da lesão, com profundidade até a musculatura bucal do rato. Imediatamente após o término de cada ato operatório, os animais foram submetidos à eutanásia por dose letal de tiopental sódico intraperitoneal (120 mg/kg). Houve apenas uma perda durante a pesquisa: um animal do grupo controle, número 57 ( tabela 2 ), com cinco dias de pós-operatório.
Análise histológica e imuno-histoquímica
Os resultados do estudo foram descritos por médias, medianas, valores mínimos, valores máximos e desvios-padrão. Para a comparação dos grupos estudo e controle em relação ao percentual de colágeno (maduro e imaturo), e também ao escore de contagem de células e ao número de vasos, foi considerado o teste −não paramétrico de Mann-Whitney. As comparações dos dias de avaliação dentro de cada grupo foram feitas usando-se o teste não paramétrico de Kruskal-Wallis. Valores de p < 0,05 indicariam significância estatística. Os dados foram analisados com o programa computacional SPSS v.20.0.
O segmento destinado à histologia foi estendido sobre papel cartão identificado e, ainda, fixado com alfinetes coloridos para esquematizar a posição da ferida no rato. Na sequência, foi mergulhado em recipiente com formol a 10% por 24 horas. Após este período, foi colocado em bloco de parafina e submetido a cortes de 5 micrômetros.
Os cortes histológicos foram corados por hematoxilina eosina e picrosírius. Para cada lâmina, foi realizada a leitura de três campos, para ambas as colorações, com ampliação de 200 × sobre a área da lesão ( figs. 3 e 4 ).
Na hematoxilina eosina, avaliou-se o processo inflamatório com contagem das células monomorfonucleares e polimorfonucleares e número de vasos. A coloração picrosírius avalia o colágeno através da birrefringência específica do mesmo, identificando o direcionamento das fibras através de um microscópio de luz polarizada. As fibras mais espessas, e com maior birrefringência, apresentar-se-ão coradas em tons laranja e vermelho, identificando o colágeno tipo I, e as fibras mais finas, e com menor birrefringência, apresentar-se-ão coradas em verde, identificando o colágeno tipo III.
O microscópio utilizado era da marca Olympus BX50 com câmaras de captura 3CCD pró-séries, e o programa de captura de imagens foi o pró- plus versão 4.5 da Cybermetics. As imagens foram captadas por uma câmera Dinolite, tendo sido analisadas pelo aplicativo Image plus 4.5 para Windows em computador Pentium III. Após a leitura, foram utilizadas as áreas demarcadas com maior celularidade, as quais foram submetidas a um punch para confecção do TMA − tissue macroarray , para imuno-histoquímica ( fig. 5 ).
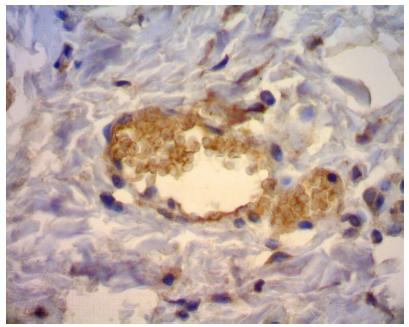
Após a realização do TMA, o material foi encaminhado para processamento imuno-histoquímico. O marcador utilizado foi o CD34 , o qual propiciou a avaliação do processo de angiogênese através da demarcação da proliferação de células endoteliais, uma vez que seu antígeno é uma cadeia simples de glicoproteína transmembrana, associado a células progenitoras hematopoiéticas humanas ( fig. 6 ). A reação antígeno x anticorpo é demarcada por meio de reação química de cor acastanhada, permitindo a quantificação e qualificação do processo reparacional ( fig. 7 ).
Análise estatística
A análise foi realizada levando em conta os resultados do estudo, descritos por médias, medianas, valores mínimos, valores máximos e desvios-padrão. Para a comparação dos grupos estudo e controle, foi considerado o teste não paramétrico de Mann-Whitney. As comparações dos dias de avaliação dentro de cada grupo foram feitas usando-se o teste não paramétrico de Kruskal-Wallis.
Resultados
O colágeno é o principal componente da matriz extracelular dos tecidos. Estrutura-se em rede densa e dinâmica resultante da sua constante deposição e reabsorção. A degradação do colágeno se inicia precocemente e é muito ativa durante o processo inflamatório. Através desse processo torna-se possível avaliar a atividade cicatricial principalmente através de sua forma imatura, o colágeno tipo III, o qual está presente em cerca de 40% do tecido de granulação.
Colágeno maduro
Inicialmente, em cada dia de avaliação (1, 3 e 7), testou-se a hipótese nula de que o percentual de colágeno maduro é igual nos dois grupos vs. a hipótese alternativa de percentuais de colágeno maduro diferentes ( tabela 3 ). Em seguida, dentro de cada grupo, testou-se a hipótese nula de que o percentual de colágeno maduro é igual nos três dias de avaliação vs. a hipótese alternativa de que os percentuais não são todos iguais. Não houve diferença no percentual de colágeno maduro no grupo experimento nos dias avaliados (p = 0,180). O mesmo ocorreu com o grupo controle (p = 0326).
Colágeno imaturo
Inicialmente, em cada dia de avaliação (1, 3 e 7), testou-se a hipótese nula de que o percentual de colágeno imaturo é igual nos dois grupos vs. a hipótese alternativa de percentuais de colágeno imaturo diferentes ( tabela 4 ). Em seguida, dentro de cada grupo, testou-se a hipótese nula de que o percentual de colágeno imaturo é igual nos três dias de avaliação vs. a hipótese alternativa de que os percentuais não são todos iguais. O resultado da avaliação do colágeno imaturo não apresentou diferença em relação ao seu percentual nos dias avaliados no controle (p = 0,326) e experimento (p = 0,180).
Contagem de células do processo inflamatório
Inicialmente, em cada dia de avaliação (1, 3 e 7), testou-se a hipótese nula de que o escore de contagem celular do processo inflamatório é igual nos dois grupos vs. a hipótese alternativa de escores diferentes ( tabela 5 ).
Em seguida, dentro de cada grupo, testou-se a hipótese nula de que o escore é igual nos três dias de avaliação vs. a hipótese alternativa de que os escores não são todos iguais. Para o grupo estudo, o resultado do teste indicou a rejeição da hipótese nula (p = 0,016). Considerando-se que foi encontrada diferença significativa entre os dias, estes foram comparados dois a dois ( tabela 6 ).
Para o grupo controle, o resultado do teste indicou a não rejeição da hipótese nula (p = 0,289). Sendo assim, neste grupo, não foi encontrada diferença significativa entre os dias de avaliação em relação ao escore de contagem celular. O grupo experimento apresentou maior reação inflamatória com crescente proliferação monomórfica (p = 0,016).
Número de vasos
Coloração hematoxilina eosina
Inicialmente, em cada dia de avaliação (1, 3 e 7), testou-se a hipótese nula de que o número de vasos é igual nos dois grupos vs. a hipótese alternativa de números de vasos diferentes ( tabela 7 ).
Em seguida, dentro de cada grupo, testou-se a hipótese nula de que o escore é igual nos três dias de avaliação vs . a hipótese alternativa de que os escores não são todos iguais. Houve maior proliferação de vasos no grupo controle (p = 0,006). O grupo experimento não demonstrou proliferação significativa dos vasos nos dias avaliados (p = 0,119) ( tabela 8 ).
Marcador CD34
Inicialmente, em cada dia de avaliação (1, 3 e 7), testou-se a hipótese nula de que o resultado de CD34 é igual nos dois grupos vs. a hipótese alternativa de resultados diferentes ( tabela 9 ). Em seguida, dentro de cada grupo, testou-se a hipótese nula de que o resultado de CD34 é igual nos três dias de avaliação vs . a hipótese alternativa de que os resultados não são todos iguais.
Houve maior proliferação no grupo controle no sétimo dia (p = 0,036); não houve proliferação significativa de vasos no grupo experimento.
Discussão
Tendo em vista a utilização do subgalato de bismuto na prática médica, principalmente na otorrinolaringológica e na dermatológica, procuramos utilizar este estudo como ferramenta para elucidar os benefícios do sal em procedimentos cirúrgicos, já que o mesmo é utilizado de maneira cotidiana em adenoamigdalectomias em vários serviços, principalmente no sul do Brasil. Indiscutivelmente, em nosso serviço notamos certo benefício na sua utilização, já que o subgalato proporciona, além de um possível efeito cicatricial e hemostático, uma melhor visualização dos pontos sangrantes em lesões da orofaringe.
O processo cicatricional envolve várias reações que ocorrem de forma simultânea, e não se consegue, com isso, separar o início e o final de cada etapa. Na teoria, porém, as reações são divididas em etapas: coagulação, inflamação, proliferação, contração e remodelação. 11. Mandelbaum SH, Di Santis EP, Mandelbaum MHS. Cicatrização: conceitos atuais e recursos auxiliares/Parte I. An Bras Dermatol. 2003;78:393-410. Esse processo tem como objetivo final a reparação do tecido, mas para isso é necessário que todas as etapas sejam realizadas de maneira satisfatória.
A coagulação inicia-se alguns segundos após a instalação da ferida. Forma-se o coágulo e a matriz extracelular, que contêm compostos químicos (fator de crescimento) e mediadores inflamatórios (citocinas) que contribuem para os processos de reepitelização e contração da ferida.
O processo inflamatório caracteriza-se por hemostasia, migração celular e deposição provisória de matriz. As plaquetas, essenciais à formação desse tampão hemostático, também secretam múltiplos mediadores, incluindo fatores de crescimento liberados na área lesada. Induzidas pela trombina, ainda sofrem a degranulação plaquetária e liberam vários fatores de crescimento, como o derivado de plaquetas (PDGF), o de crescimento transformante-β (TGF-β), o de crescimento epidérmico (EGF), o de crescimento transformante-a (TGF-α) e o fator de crescimento de células endoteliais (VEGF), além de glicoproteínas adesivas, como a fibronectina e a trombospondina, que são importantes constituintes da matriz extracelular provisória. 55. Arnold F, West DC. Angiogenesis in wound healing. Pharmacol Ther. 1991;52:407-22.,66. Mendonca RJ, Coutinho-Netto J. Aspectos celulares da cicatrização. An Bras Dermatol. 2009;84:257-62.,88. Streit M, Velasco P, Riccardi L, Spencer L, Brown LF, Janes L, et al. Thrombospondin-1 suppresses wound healing and granulation tissue formation in the skin of transgenic mice. EMBO J. 2000;19:3272-82.
A célula de grande importância no processo cicatricial é o macrófago. Além desse papel na fagocitose de fragmentos celulares, os macrófagos também secretam fatores quimiotáticos que atraem outras células inflamatórias ao local da ferida e produzem prostaglandinas, que funcionam como potentes vasodilatadores, afetando a permeabilidade dos microvasos. Eles também preparam a ferida para a fase proliferativa. A proliferação na formação de cicatriz promove o fechamento da ferida. Essa fase é composta por reepitelização, fibroplasia e angiogênese.
Nesta pesquisa, optou-se por dar enfoque ao processo de angiogênse, visto que ele é fundamental para a cicatrização, correspondendo a 60% do tecido de reparo. 55. Arnold F, West DC. Angiogenesis in wound healing. Pharmacol Ther. 1991;52:407-22.,66. Mendonca RJ, Coutinho-Netto J. Aspectos celulares da cicatrização. An Bras Dermatol. 2009;84:257-62. Stashak et al . , citados por Souza et al . , 99. Souza DW, Machado TSL, Zoopa ALV, Cruz RSF, Gárague AP, Silva LCLC. Ensaio da aplicação de creme à base de Triticum vulgare na cicatrização de feridas cutâneas induzidas em eqüinos. Rev Bras Pl Med. 2006;8:9-13. referem que a angiogênese favorece o tempo de cicatrização por aumentar o aporte de nutrientes e o ingresso celular na região afetada, diminuindo, dessa forma, o tempo de retração da ferida. Balbino et al .1010. Balbino CA, Pereira LM, Curi R. Mecanismos envolvidos na cicatrização: uma revisão. Rev Bras Cienc Farm. 2005;41: 27-51. referem que ocorre a migração das células endoteliais, que atravessam a parede do vaso e, através da matriz extracelular, seguem em direção ao sítio da lesão. Uma vez na região externa do vaso, passam por um processo de diferenciação e adquirem a capacidade de formar novos tubos capilares. As células endoteliais migratórias formam, na parte externa do vaso, um broto capilar que se une ao capilar de origem, restabelecendo o fluxo sanguíneo.
A formação do neovaso começa com a agressão tecidual, com a ativação dos macrófagos e as substâncias que estes produzem. As proteases (plasmina e colagenases) digerem a membrana basal e permitem que as células endoteliais estimuladas pelas citocinas angiogênicas formem o novo novelo vascular que invade a ferida. A angiogênese cessa por apoptose. 1111. Hanson D, Langemo D, Thompson P, Anderson J, Hunter S. Understanding wound fluid and the phases of healing. Adv Skin Wound Care. 2005;18:360-2.,1212. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med. 1999;341:738-46.
O mecanismo responsável pela contração, especificamente, pode se dever ao movimento dos miofibroblastos através da matriz extracelular. Estes possuem em seu citoplasma fibras contráteis de actina e miosina, que se originam de células mesenquimatosas, de mononucleares circulantes ou de fibrócitos situados ao redor da adventícia de vasos sanguíneos locais, processo facilitado pelo TGF-β. Os fibroblastos das margens da ferida apresentam mudança de fenótipo para miofibroblastos, com características funcionais similares ao músculo liso. Estas células encontram-se alinhadas ao redor de depósitos da nova matriz extracelular, fazendo uniões célula a célula e gerando a força de tensão. 1010. Balbino CA, Pereira LM, Curi R. Mecanismos envolvidos na cicatrização: uma revisão. Rev Bras Cienc Farm. 2005;41: 27-51.
A modelagem do colágeno ocorre pelo equilíbrio entre a síntese e a degradação deste. Este processo é mediado pelas enzimas proteolíticas (metaloproteinases), células epidérmicas, células endoteliais e fibroblastos. 1111. Hanson D, Langemo D, Thompson P, Anderson J, Hunter S. Understanding wound fluid and the phases of healing. Adv Skin Wound Care. 2005;18:360-2. No remodelamento ocorrem etapas sucessivas de produção, digestão e orientação das fibras de colágeno. As fibras são digeridas pela colagenase, ressintetizadas, rearranjadas de acordo com a organização das fibras do tecido conjuntivo adjacente e ligadas, lateralmente, por ligações covalentes. A quantidade de colágeno aumenta durante as primeiras semanas, e em torno de 21 dias ocorre um equilíbrio entre a produção e a degradação. A resistência da cicatriz é dada pela quantidade de colágeno depositada e pela forma como as fibras estão organizadas, sendo o aumento da resistência maior do que se poderia esperar apenas pela deposição do colágeno. Este processo tem início por volta da terceira semana após o trauma e persiste por meses ou anos. 1010. Balbino CA, Pereira LM, Curi R. Mecanismos envolvidos na cicatrização: uma revisão. Rev Bras Cienc Farm. 2005;41: 27-51.,1313. Baum CL, Arpey CJ. Normal cutaneous wound healing: clinical correlation with cellular and molecular events. Dermatol Surg. 2005;31:674-86.
Em se tratando de recuperação cirúrgica, objetiva-se também a recuperação tissular mais rápida e eficaz. Esta pesquisa propôs-se a avaliar a atividade do subgalato de bismuto na cicatrização de ferida, de modo a melhorar a resposta ao trauma. O subgalato de bismuto, ou oxigalato de bismuto, é uma substância de coloração amarelada, que se apresenta na foram de pó inodoro e sofre descoloração na presença de luz solar. 11. Mandelbaum SH, Di Santis EP, Mandelbaum MHS. Cicatrização: conceitos atuais e recursos auxiliares/Parte I. An Bras Dermatol. 2003;78:393-410. É um sal derivado de metal pesado, pouco adsorvido e com forte poder adstringente. 22. Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71.
Esse composto tem sido utilizado com a finalidade de conter hemorragias, em tosilectomia, turbinectomia e em estudo de hepatectomia parcial. 22. Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71. O subgalato de bismuto − metal pesado, relativamente insolúvel e pouco absorvido no leito cirúrgico, de baixo custo e fácil utilização − tem apresentado boa eficácia como agente hemostático local. Seu mecanismo de ação é atribuído à ativação do fator 12 de coagulação, além de se supor um efeito adstringente local. 1414. Molina FD, Maniglia JV, Magalhães FP, Dafico SR, Rezende RS. A eficácia do subgalato de bismuto em tonsilectomias como agente hemostático. Rev Bras Otorrinolaringol. 2000;66: 194-7.
Arroyo Júnior et al. 22. Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71. também afirmam que o subgalato de bismuto atua na ativação do fator 12, que acelera a via intrínseca na cascata de coagulação, o que contribui para o caráter hemostático desse composto. O autor relata a possibilidade de o subgalato de bismuto inibir a fibrinólise e, com isso, aumentar a fibrose. Essa afirmação corrobora com a intenção do estudo de buscar resultados que mostrem a contribuição do subgalato de bismuto para a cicatrização e, consequentemente, para uma maior formação de neovasos.
Com relação ao processo inflamatório avaliado através do número de células monomorfonucleares e polimorfonucleares, o estudo demonstrou que o grupo experimento teve o tempo de processo inflamatório reduzido, ou seja, o tecido foi exposto a uma reação inflamatória mais rápida, não proporcionando a formação esperada de neocélulas.
Ficou evidenciado que o subgalato de bismuto promoveu uma diferença significativa no padrão inflamatório no sétimo dia, quando promoveu uma redução do processo inflamatório, levando a um status crônico maior que o grupo controle.
Considerando a coloração hematoxilina−eosina, o subgalato de bismuto não promoveu aumento de vasos quando comparados o grupo controle e o grupo experimento. Porém, ao comparar a angiogênese do primeiro com o sétimo dia no grupo controle, encontrou-se um aumento significativo no número de vasos. Tal relação é a esperada dentro do processo fisiológico normal de cicatrização. Ainda sobre o processo de angiogênese, quando estudado pelo método de imuno-histoquímica com o marcador CD34, houve maior proliferação de vasos no grupo controle, o que demonstra que o subgalato inibiu a neoangiogênese no experimento. O sal promoveu um status de cronificação de processo inflamatório, o que poderia justificar a inibição do processo de angiogênese quando comparado ao grupo controle.
Outro fator avaliado neste estudo foi a atividade do colágeno. Afirma-se que o colágeno é a proteína mais abundante do tecido conectivo em fase de cicatrização. 1515. Campos ACL, Borges-Branco A, Groth AK. Cicatrização de feridas. Arq Bras Cir Dig. 2007;20:51-8. Essa proteína compõe, principalmente, a matriz extracelular, fazendo parte da fase de remodelamento da cicatrização.
O colágeno tipo I é o mais frequente. Ele é sintetizado pelos fibroblastos, sendo mais predominante em ossos e tendões. O tipo III é mais comumente encontrado em tecidos moles, como vasos sanguíneos, derme e fáscia. A derme sã contém aproximadamente 80% de colágeno tipo I e 20% de colágeno tipo III. Já o tecido de granulação expressa 30 a 40% de colágeno do tipo III, sendo considerado colágeno imaturo. 1515. Campos ACL, Borges-Branco A, Groth AK. Cicatrização de feridas. Arq Bras Cir Dig. 2007;20:51-8.
Não houve diferença na produção de colágeno, com os grupos controle e experimento apresentando a mesma eficiência.
Conclusão
Levando em consideração o processo de cicatrização na ferida da mucosa dos animais estudados, evidenciou-se uma possível interferência negativa do subgalato de bismuto. O sal proporcionou uma menor exposição do tecido ao processo inflamatório, levando a um status crônico precoce, com certa estabilização no número de vasos, atrasando até mesmo o processo fisiológico de cicatrização e prejudicando a angiogênese.
Quando levamos em conta o estímulo à fibroplasia, seu uso foi indiferente, não interferindo na formação do colágeno, seja na sua forma imatura ou madura.
Contudo, demonstrou-se que o subgalato, levando em conta o processo cicatricial, não proporciona uma melhora na qualidade da cicatrização, e o metal pesado ainda interfere, atrasando a velocidade de formação dos neovasos e a cicatrização ideal da ferida operatória.
References
-
1Mandelbaum SH, Di Santis EP, Mandelbaum MHS. Cicatrização: conceitos atuais e recursos auxiliares/Parte I. An Bras Dermatol. 2003;78:393-410.
-
2Arroyo Júnior PC, Silva RCMA, Santi Neto D, Santana Júnior D, Ferreira FD, Silva RF. Uso do subgalato de bismuto para hemostasia local em hepatectomisas parciais de ratos. Rev Col Bras Cir. 2004;31:165-71.
-
3Paz SHH, Reyes AO, Guzmán CMG. Estudio comparativo de dos agentes hemostáticos adicionados con epinefrina en la adenoamigdalectomía. Rev Esp Méd Quir. 2012;17:3-7.
-
4Padilla RM, Valdés CM, Asato JR, Márquez M, Gutiérrez SC, González YA, et al. Eficacia del subgalato de bismuto, como agente hemostático tópico, en el sangrado transoperatorio de la adenoamigdalectomía o amigdalectomía. An Orl Mex. 2012;57:65-8.
-
5Arnold F, West DC. Angiogenesis in wound healing. Pharmacol Ther. 1991;52:407-22.
-
6Mendonca RJ, Coutinho-Netto J. Aspectos celulares da cicatrização. An Bras Dermatol. 2009;84:257-62.
-
7Fonseca VRCD, Malafaia O, Ribas Filho JM, Nassif PAN, Czeczko NG, Marcondes CAP, et al. Angiogenesis, fibrinogenesis and presence of synechiae after exeresis of a swine vocal fold mucosal microflap and use of topical mitomycin-C. Acta Cir Bras. 2010;25:80-5.
-
8Streit M, Velasco P, Riccardi L, Spencer L, Brown LF, Janes L, et al. Thrombospondin-1 suppresses wound healing and granulation tissue formation in the skin of transgenic mice. EMBO J. 2000;19:3272-82.
-
9Souza DW, Machado TSL, Zoopa ALV, Cruz RSF, Gárague AP, Silva LCLC. Ensaio da aplicação de creme à base de Triticum vulgare na cicatrização de feridas cutâneas induzidas em eqüinos. Rev Bras Pl Med. 2006;8:9-13.
-
10Balbino CA, Pereira LM, Curi R. Mecanismos envolvidos na cicatrização: uma revisão. Rev Bras Cienc Farm. 2005;41: 27-51.
-
11Hanson D, Langemo D, Thompson P, Anderson J, Hunter S. Understanding wound fluid and the phases of healing. Adv Skin Wound Care. 2005;18:360-2.
-
12Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med. 1999;341:738-46.
-
13Baum CL, Arpey CJ. Normal cutaneous wound healing: clinical correlation with cellular and molecular events. Dermatol Surg. 2005;31:674-86.
-
14Molina FD, Maniglia JV, Magalhães FP, Dafico SR, Rezende RS. A eficácia do subgalato de bismuto em tonsilectomias como agente hemostático. Rev Bras Otorrinolaringol. 2000;66: 194-7.
-
15Campos ACL, Borges-Branco A, Groth AK. Cicatrização de feridas. Arq Bras Cir Dig. 2007;20:51-8.
-
☆ Como citar este artigo: Couto EV, Ballin CR, Sampaio CPP, Maeda CAS, Ballin CH, Dassi CS, et al. Experimental study on the effects of bismuth subgallate on the inflammatory process and angiogenesis of the oral mucosa. Braz J Otorhinolaryngol. 2016;82:17-25.
-
☆ ☆ Instituição: Pontifícia Universidade Católica do Paraná (PUCPR), Curitiba, PR, Brasil.
Datas de Publicação
-
Publicação nesta coleção
Jan-Fev 2016
Histórico
-
Recebido
15 Set 2013 -
Aceito
09 Dez 2014