Resumo
A criopreservação seminal apresenta baixos resultados produtivos. Objetivou-se testar a Água de Coco em Pó (ACP-103®) como diluente de ressuspensão após a descongelação seminal e avaliar a qualidade espermática durante a curva de resfriamento até a descongelação do sêmen. Para isso, o sêmen de 15 reprodutores foi coletado uma vez por semana, incubado a 30 ºC por 15 minutos, e em seguida diluído em Beltsville Thawing Solution - BTS (controle) ou em ACP-103®, e submetidos a uma curva de resfriamento lenta, onde foram feitas análises de vigor e motilidade em cada passo. O sêmen descongelado foi ressuspenso em seus respectivos diluentes e analisado quanto às características: vigor, motilidade, vitalidade, integridade acrossomal e funcionalidade da membrana. Durante as análises de vigor e motilidade que compõem a curva de resfriamento, e na descongelação, para as análises de vitalidade e membrana acrossomal intacta, observou-se que não houve diferença significativa entre os tratamentos. Já após a descongelação, o BTS apresentou melhores resultados de vigor, motilidade espermática e funcionalidade da membrana. No entanto, a curva de resfriamento e o ACP-103® podem ser utilizadas no protocolo de criopreservação do sêmen suíno, visto que ambas asseguraram qualidade da viabilidade espermática.
Palavras-chave:
Sêmen suíno; diluente alternative; congelação; viabilidade espermática
Abstract
Semen cryopreservation is associated with low productivity results. This study aimed to test the Coconut Water Powder (ACP®-103) as a ressuspension diluent after thawing semen, also evaluate sperm quality during the cooling curve until thawing of the semen. For this, the semen was collected from 15 boars once a week, incubated at 30 ºC for 15 minutes, and afterwards, the samples were diluted in the diluent Beltsville Thawing Solution - BTS (Control) or ACP-103®, and subjected to a slow cooling curve, where the force and the motility were analyzed in each step. The thawed semen was ressuspended in its respective solvents and analyzed in the characteristics of vigor, motility, vitality, acrosome integrity and functionality of the membrane. During the analysis of vigor and motility that make up the cooling curve, and thawing, for analysis of vitality and intact acrosomal membrane, it was observed that there was no significant difference between treatments. Besides, after thawing, the BTS showed better results of sperm vigor, sperm motility and membrane functionality. However, the cooling curve and coconut water powder can be used in the protocol for cryopreservation of boar semen, as both ensured quality of sperm viability that may be used in artificial insemination.
Keywords:
Swine semen; alternative extender; freezing; sperm viability
Introdução
A criopreservação do sêmen suíno proporciona a conservação de ejaculados de animais de alto valor genético por tempo indeterminado, maximizando assim o poder reprodutivo do macho e permitindo o uso mesmo após a morte do animal(11 Toniolli R, Costa e Silva M, Chaves RN. Utilização de diferentes meios de ressuspensão para o sêmen do varrão após descongelação. Revista Brasileira de Ciências Veterinárias. 2009;16(1):41-45. Portuguese.). Ela também permite a redução de custos com manutenção de reprodutores, já que pode ser adquirido sêmen congelado com qualidade comprovada(22 Castelo TS, Silva AR, Frota TR. Considerations on goat semen cryopreservation. Acta Veterinaria Brasilica. 2008;2(3):67-75. Portuguese.).
Estudos realizados nas últimas três décadas sobre criopreservação de sêmen resultaram em avanços no tocante ao uso de diferentes crioprotetores, embalagens, diluentes e curvas de congelação(11 Toniolli R, Costa e Silva M, Chaves RN. Utilização de diferentes meios de ressuspensão para o sêmen do varrão após descongelação. Revista Brasileira de Ciências Veterinárias. 2009;16(1):41-45. Portuguese.,33 Antunes RC. Avanço tecnológico e aplicabilidade da técnica de congelamento de sêmen suíno. Revista Brasileira de Reprodução Animal. 2007;31(1):60-63. Portuguese.
4 Hammitt DG, Martin A. Fertility of frozen-thawed porcine semen following controlled-rate freezing in straws. Theriogenology. 1989;32(3):359-368. English.-55 Woelders H. Fundamentals and recent development in cryopreservation of bull and boar semen. Veterinary Quarterly. 1997;19(3):135-138. English.). No entanto, o emprego de sêmen congelado na espécie suína ainda apresenta índices reprodutivos insatisfatórios e está associado à redução da taxa de parto e do número de leitões por leitegada(66 Johnson LA. Current developments in swine semen: preservation, artificial insemination and sperm sexing. In: Proceedings of 15th International Pig Veterinary Society Congress; 1998 Jul 5-9. 1998. p. 225-229. English.).
A diminuição da viabilidade espermática após a descongelação é uma característica bastante comum na espécie suína devido ao estresse térmico e osmótico impostos aos espermatozoides, especialmente à sua membrana plasmática. Se a congelação é lenta, há danos por excessiva desidratação da célula; no caso de ser muito rápida, os espermatozoides não perdem água suficiente, provocando a formação de cristais de gelo no citoplasma, o que provoca danos irreversíveis, tais como a ruptura da membrana plasmática. A taxa de congelação deve ser, então, suficientemente lenta para permitir a saída de água de dentro da célula por osmose, prevenindo o gelo intracelular, e suficientemente rápida para minimizar os danos pela exposição prolongada à altas concentrações de solutos(77 Escobar CJ. Inseminación artificial em caninos. In: Gobello C, ed. Temas de reproducción de caninos y felinos por autores latino americanos. Buenos Aires: Latina; 2004. 157 p. Spanish.).
Para que o sêmen possa ser conservado, ele deve ser devidamente diluído, visando maior durabilidade e transporte. O diluente protege a membrana espermática contra o choque térmico e injúrias mecânicas causadas pelo transporte, além de fornecer nutrientes e estabilizar o pH do meio(88 Verstegen JP, Onclin K, Iguer-Ouada M. Long-term motility and fertility conservation of chilled canine semen using egg yolk added Tris-glucose extender: in vitro and in vivo studies. Theriogenology. 2005;64(3):720-733. English.).
Na atualidade os diluentes oferecem uma boa proteção à integridade espermática em protocolos de refrigeração. Entretanto, a baixa fertilidade do sêmen congelado pode estar relacionada à composição dos diluentes, que, por não ter substâncias capazes de proteger suficientemente a célula durante grandes reduções de temperatura, pode permitir modificações nas características dos componentes de membrana que cobrem o espermatozoide, resultando na sua desestabilização, provocada por um problema de permeabilidade da mesma(99 Silva TASN. Efeito do plasma seminal na descongelação do sêmen ovino avaliado in vitro e na inseminação artificial cervical [Dissertação]. Brasília: Universidade de Brasília; 2007. 64 p. [Acesso 2017 Nov 22]. Disponível em: http://repositorio.unb.br/handle/10482/3338. Portuguese.
http://repositorio.unb.br/handle/10482/3...
). Que características a água de coco em pó apresenta para ser considerado um diluente seminal?
Desta forma, objetivou-se desenvolver uma nova curva de resfriamento de temperatura e testar a água de coco em pó (ACP-103®) como diluente alternativo em protocolos de congelação e descongelação do sêmen suíno.
Material e Métodos
O presente trabalho foi aprovado pelo Comitê de Ética da Universidade Estadual do Ceará, em 25 de janeiro de 2012, processo nº 11518234-9/72. Os animais utilizados para o estudo foram provenientes do Laboratório de Reprodução Suína e Tecnologia do Sêmen, da Faculdade de Veterinária, na Universidade Estadual do Ceará e da Granja Xerez Avícula LTDA, no Município de Maranguape, Ceará. Foram utilizados animais com idades entre 12 e 24 meses, em sistema rotineiro de trabalho.
Um total de 15 reprodutores foi submetido à coleta de sêmen, sendo cada animal coletado uma vez por semana durante 4 semanas, perfazendo um total de 60 ejaculados. A coleta do sêmen (ejaculado total) foi realizada pela técnica da mão enluvada em recipiente com capacidade para 500 mL, coberto por um filtro (gaze) e protegido por envoltório térmico. Após a coleta, o sêmen foi levado ao laboratório para o seu processamento, com a fração gelatinosa, retida pela gaze, sendo desprezada e o ejaculado avaliado.
A avaliação do sêmen in natura foi feita através das seguintes características: o volume (mL), medido em balança digital; a concentração (x106sptz/mL), avaliada em espectrofotômetro, e o total de espermatozoides (x109 sptz). O vigor espermático (0 a 5)(1010 Toniolli R. Pouvoir fecondant des spermatozoïdes de verrat: amèlioration des conditions de conservation [These de Doctorat]. Tours: Université François Rabelais; 1996. 91 p. French.) e motilidade espermática (0 a 100%) foram avaliados por meio da microscopia óptica, com uma amostra de sêmen (15µL) colocada entre lâmina e lamínula e levada ao microscópio em um aumento de 200 vezes. Estes exames serviram para a avaliação e controle de cada ejaculado durante o período experimental, sendo utilizado apenas aqueles com valores mínimos de vigor ≥3,5 e de motilidade ≥85%. Para ser utilizado nos protocolos experimentais, foi retirando-se um total de 2,5 x109 sptz/ejaculado.
Visando os tratamentos experimentais do presente trabalho, foram utilizados dois diluentes de sêmen, o Beltsville Thawing Solution (BTS) e o diluente Água de Coco em Pó (ACP-103®), sendo este segundo o tratamento a ser testado como diluente alternativo para a criopreservação de ejaculados de suínos. Todos os ejaculados produzidos foram utilizados nos dois tratamentos acima descritos.
Para se proceder a congelação do sêmen após as primeiras avaliações in natura, o sêmen foi dividido igualmente entre dois tubos de 50 mL, em que cada tubo correspondia a um tratamento, e em seguida submetido a uma curva de resfriamento descrita abaixo. Inicialmente, o sêmen foi incubado por 15 minutos a 30 ºC e diluído (diluição 1 -3vol:1vol) em BTS ou ACP-103® (24g de água de coco em pó em 100 mL de água destilada, adicionado 80mg do antibiótico gentamicina). Após a diluição, o sêmen foi mantido a esta temperatura por mais 45 minutos.
O sêmen diluído foi resfriado a 25 ºC durante 30 minutos. Em seguida os tubos foram transferidos para o escuro por 2 horas a 17 ºC. Posteriormente, sendo centrifugadas a 800G/15 min. a 5 ºC.
Após centrifugação, o sêmen foi transferido para geladeira a 5 ºC, sendo desprezado o sobrenadante, e o pellet foi ressuspenso no diluente de resfriamento (diluição 2 - 20 % de gema de ovo e 34,23g de glicose), a uma concentração inicial de 6 x109 células/mL. Após a ressuspensão, o sêmen continuou a 5 ºC por mais 60 minutos (resfriamento lento). Ao final desse tempo, foi adicionado o diluente de congelação (diluição 3 - volume a volume), com a mesma composição do diluente de resfriamento acrescido do glicerol a 6% (2mL:2mL), com uma concentração final de 100 x106 células/mL.
O sêmen foi envasado em palhetas de plástico de 0,5 mL e selado com álcool polivinílico em pó (PVC). Após o envase, as palhetas foram colocadas em uma rampa de congelação (-60 a -70 ºC) a 5 cm acima do nitrogênio líquido por 30 minutos, e em seguida submersas em nitrogênio líquido (-196 ºC), permanecendo congeladas por no mínimo 7 dias para posterior descongelação e análises.
Para a descongelação do sêmen, a palheta foi colocada em banho maria a uma temperatura de 39 ºC durante 50 segundos. Após a descongelação, o conteúdo de cada palheta foi ressuspenso em cada diluente testado (BTS e ACP-103®), que estavam à mesma temperatura. Para os testes in vitro, a diluição do sêmen nos diluentes de ressuspensão foi feita respeitando a concentração de uma dose inseminante. Sendo assim, foi utilizado 0,5 mL do sêmen diluído em 2mL do diluente de ressuspensão. As amostras foram colocadas em tubos de ensaio e mantidas em banho maria a 39 ºC durante todo o período das análises do sêmen.
Foram utilizadas as características vigor espermático (0 a 5)(1010 Toniolli R. Pouvoir fecondant des spermatozoïdes de verrat: amèlioration des conditions de conservation [These de Doctorat]. Tours: Université François Rabelais; 1996. 91 p. French.)) e motilidade espermática (0 a 100%), sendo para essa finalidade avaliados três diferentes campos no microscópio e repetindo-se as análises em seis diferentes momentos durante a curva de resfriamento: Análise 1 (A1) = feita logo após a diluição (diluição 3:1) do ejaculado, a 30 ºC; Análise 2 (A2) = feita após os 45 minutos da diluição, também a 30 ºC; Análise 3 (A3) = feita após os 30 minutos do sêmen a 25 ºC; Análise 4 (A4) = feita após as 2 horas na fase escura do sêmen a 17 ºC; Análise 5 (A5) = feita após centrifugação e diluente de resfriamento (diluição 2) ser adicionado a 5 ºC; Análise 6 (A6) = feita após 1 hora do sêmen a 5 ºC, antes do diluente de congelação (diluição 3) ser adicionado (Figura 1)).
Curva de resfriamento com suas respectivas análises de vigor e motilidade na congelação e descongelação do sêmen suíno.
Das análises 1 a 4, foi retirada uma alíquota (15 µL) do sêmen e diluído (3:1) em seus respectivos diluentes e, para as análises 5 e 6, foi retirada uma alíquota (15 µL) do sêmen diluído nos diluentes de resfriamento e congelação. As alíquotas foram aquecidas durante 2 minutos a 30 ºC, e colocado entre lâmina e lamínula para em seguida ser analisada à luz da microscopia óptica em aumento de 200x. Uma última análise de vigor e motilidade foi feita após descongelação, com o sêmen envasado e submerso a 39 ºC por 50 segundos; logo após, foram diluídos/ressuspensos com 2mL de BTS para o tratamento 1, e 2mL de ACP para o tratamento 2. Logo após a ressuspensão, foi retirada uma alíquota (15 µL) do sêmen, colocada entre lâmina e lamínula, e à luz da microscopia óptica analisado em aumento de 200x.
As avaliações morfológica e da porcentagem de célula vivas foram realizadas somente após a descongelação e ressuspensão do sêmen, avaliando-se a integridade acrossomal e vitalidade espermática, respectivamente, ambas com resultados expressos em porcentagem. Para este exame, foi utilizada uma alíquota de sêmen descongelado (15 µL) e uma do corante (15 µL), homogeneizadas e procedendo-se em seguida esfregaço, no qual foi analisado um total de 200 células através da microscopia óptica com lente de imersão a um aumento de 1000x. A solução corante utilizada foi o azul de bromo-fenol (0,1g de azul de bromo-fenol, 0,4g de citrato de sódio e 100 mL de água destilada, 300 a 310 mOsm). Segundo a morfologia do acrossoma e vitalidade, os espermatozoides foram então classificados em quatro categorias: 01. Vivos com acrossoma íntegro; 02. Vivos com acrossoma danificado; 03. Mortos com acrossoma íntegro; 04. Mortos com acrossoma danificado.
O teste de termorresistência permite fazer a avaliação da funcionalidade da membrana do espermatozoide e foi realizado também somente após a descongelação. Para tanto, foi colocado em um tubo de ensaio 0,5 mL de sêmen ressuspenso acrescido com 7,5 mL de água destilada mantido por 15 minutos a 39 ºC (solução A). Posteriormente, foi retirado 1 mL da solução A e colocado em outro tubo de ensaio contendo 0,5 mL de Formol salina a 1% (solução B). Em seguida, foi retirada 15 µL da solução B e colocada entre lâmina e lamínula. Foram avaliados 200 espermatozoides/esfregaço e as células foram avaliadas de acordo com a proporção de espermatozoides com cauda enrolada (reagentes) ou cauda reta (não reagentes), utilizando-se do contraste de fase com aumento de 1000 vezes.
O delineamento experimental utilizado foi o de blocos ao acaso. A análise estatística foi processada pela avaliação das médias e desvios padrões, aos quais foram aplicados os testes de Mann-Witney e o teste t Student. Para comparação de múltiplas médias, foi utilizado o teste ANOVA com pós-teste de TUKEY. Quando constatados dados com variância diferentes pelo teste de Bartlett, foi utilizado o teste de Kruskal Wallys com pós-teste de Dunns. Todos os testes foram realizados com um índice de significância de 5% (P<0,05).
Resultados e Discussão
O sêmen in natura dos 75 ejaculados obtidos no experimento apresentou aspecto normal e coloração branco leitosa; volume médio de 249,4 mL e concentração média de 319,1 x106 sptz/mL, com tais características encontrando-se dentro de padrões normais para a espécie suína(1111 Corrêa MN, Meincke W, Lucia T Jr, Deschamps JC. Inseminação artificial em suínos. Copyright. 1st ed. Londrina: Printpar, Brasil. 2001. 181 p. Portuguese.). A avaliação microscópica do mesmo apresentou um valor médio para o vigor espermático de 4,2±0,3 e para a motilidade espermática de 89,4±4,9. Estes valores considerados normais(1212 Colégio Brasileiro de Reprodução Animal (CBRA). Manual para exame andrológico e avaliação de sêmen animal. 3ª ed. Belo Horizonte: CBRA; 2013. 104 p.) se mantiveram acima dos parâmetros mínimos estipulados para serem utilizados no experimento (vigor ≥3,5 e motilidade ≥85%).
Visando a avaliação do efeito da curva de resfriamento, foram analisados o vigor e a motilidade espermática, em momentos pré-determinados. Ambas as características apresentaram uma queda de valores (Tabelas 1) e 2), devido ao próprio declínio da temperatura e consequente redução do metabolismo espermático, acompanhada da redução da atividade mecânica da célula, pois, durante períodos de incubação, gradativamente os espermatozoides consomem os nutrientes disponíveis no diluente, além de excretar produtos tóxicos como os radicais livres, resultantes de seu próprio metabolismo(1111 Corrêa MN, Meincke W, Lucia T Jr, Deschamps JC. Inseminação artificial em suínos. Copyright. 1st ed. Londrina: Printpar, Brasil. 2001. 181 p. Portuguese.).
Valores do vigor espermático durante a curva de resfriamento (36 a 5 ºC), do sêmen suino, conservado nos diluentes Beltsville Thawing Solution (BTS) e o diluente Água de Coco em Pó (ACP-103®), visando a sua criopreservação
Valores da motilidade espermática (%) durante a curva de resfriamento (36 a 5 ºC), do sémen suíno, conservado nos diluientes Beltsviile Thawing Solution (BTS) e o diluente Água de Coco em Pó (ACP-103®), visando a sua congelação
A produção de radicais livres durante a incubação também contribui para o decréscimo da sobrevivência espermática, uma vez que em ambiente aeróbio ou parcialmente anaeróbio a produção de espécies reativas de oxigênio (ROS) é inevitável(1010 Toniolli R. Pouvoir fecondant des spermatozoïdes de verrat: amèlioration des conditions de conservation [These de Doctorat]. Tours: Université François Rabelais; 1996. 91 p. French.). No entanto, mesmo sob essas circunstâncias que ocorrem durante o período de resfriamento e que podem afetar a motilidade espermática, a curva de resfriamento utilizada no presente estudo apresentou resultados satisfatórios e similares à de Westendorf(1313 Westendorf P, Richter L, Treu H. Deep-freezing of boar semen: laboratory findings and insemination results with the "Hülsenberger Oailleten" technique. Deutsche Tierärztliche Wochenschrift. 1975;82:261-267. German.) avaliada em estudos anteriores(44 Hammitt DG, Martin A. Fertility of frozen-thawed porcine semen following controlled-rate freezing in straws. Theriogenology. 1989;32(3):359-368. English.,1414 Bianchi I, Mirapalheta MEM, Schneider A, Rabassa VR, Corrêa EK, Lucia JTE, et al. Efeito de diferentes métodos de congelamento, diluentes e tempos de resfriamento sobre a qualidade do sêmen suíno criopreservado. Acta Scitifiae Veterinaria. 2011;39(1):940-949. Portuguese.).
Comparando-se os resultados entre os diferentes tratamentos (BTS e ACP) durante a curva de resfriamento (A1 a A6), o vigor espermático nos dois diluentes apresentou-se de forma semelhante, não havendo diferenças significativas entre eles (P>0,05) em cada análise realizada durante todo o período de abaixamento da temperatura antes da congelação (Tabela 1). O mesmo resultado foi visto em estudos recentes, nos quais estes diluentes também não apresentaram diferenças significativas para as características vigor e motilidade espermática, durante a conservação do sêmen do varrão nas temperaturas de 17 e 10 ºC(1515 Araújo LRS. Uso de diluentes alternativos a baixas temperaturas na manutenção da qualidade espermática do sêmen suíno [Dissertação]. Fortaleza: Programa de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2012. 92 p. [Acesso 2017 Nov 22]. Disponível em: http://www.uece.br/ppgcv/dmdocuments/linaraquel.pdf. Portuguese.
http://www.uece.br/ppgcv/dmdocuments/lin...
). Desta forma, pode-se constatar que o ACP utilizado como diluente alternativo pode substituir o diluente comercial BTS, que é amplamente utilizado em protocolos de inseminação artificial para a espécie suína, servindo como opção simples, barata e de fácil obtenção sem comprometer a qualidade espermática e os resultados de fertilidade.
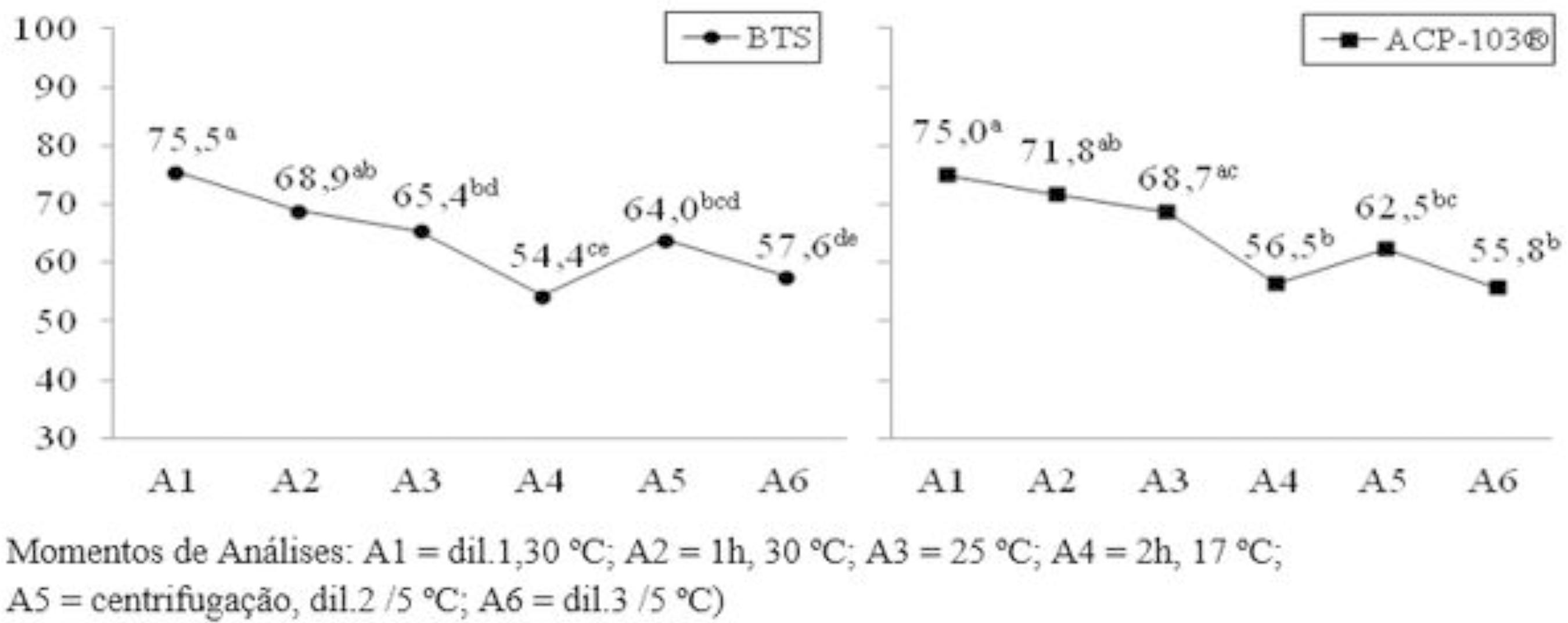
Avaliando os resultados do comportamento de cada diluente no decorrer das análises que compõe a curva de resfriamento (Figura 1), evidenciou-se uma queda contínua dos valores até A4, em ambos os tratamentos. Este tipo de tendência já era esperado devido à diminuição da temperatura. Dentro de cada tratamento, houve diferenças dos resultados do vigor espermático durante a descida da temperatura, tendo apresentado o valor mais baixo na análise A4, independentemente do diluente utilizado.
Os resultados obtidos no momento da quarta análise (A4) apresentaram o menor valor médio tanto no BTS (2,4±0,6) como no ACP (2,5±0,5), com diferenças significativas (P<0,05) quando comparados com as demais análises de cada tratamento. Este resultado pode estar relacionado com o fato de que, neste momento, o sêmen passou por um longo período de equilíbrio a uma temperatura baixa (2 horas a 17 ºC), proporcionando uma maior redução do metabolismo celular. Estes resultados estão de acordo com as observações de Watson(1616 Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development. 1995;7(4):871-891. English.), que afirma que o resfriamento do sêmen que ocorre durante o tempo de equilíbrio contribui para a redução do metabolismo espermático.
Na sequência do protocolo (A5), ocorreu um aumento nas médias do vigor em ambos os tratamentos, significativamente diferentes (P<0,05) dos valores comparados em A4. Tal acontecimento pode estar relacionado com a centrifugação do sêmen, que atua como uma capacitação celular induzida através da retirada do plasma seminal e, consequentemente, um aumento no vigor espermático. Provavelmente, a inclusão do diluente de resfriamento também contribuiu para esse bom resultado, protegendo o espermatozoide contra o estresse provocado pelo frio, em uma temperatura conhecidamente lesiva (5 ºC) para a célula espermática suína, uma vez que a LDL, uma lipoproteína de baixa densidade presente na gema de ovo, pode agregar-se à membrana plasmática durante o processo, evitando a perda de fosfolipídios da membrana e diminuindo as lesões provocadas pela ação do frio e da crioinjúria(1717 Watson PF. The causes of reduced fertility with cryopreserved semen. Animal Reproduciton Science. 2000;60-61:481-492. English.).
Por fim, na análise realizada antes da congelação (A6), ambos os diluentes apresentaram um pequeno declínio no vigor espermático, mas sem diferença significativa (P<0,05) com a A5, mostrando que os espermatozoides foram congelados com um vigor espermático de boa qualidade. Por isso, um dos grandes desafios para a criobiologia é desenvolver um meio quimicamente definido(1818 Houpalathi R, López-Fandiño R, Anton M, Schade R. Bioactive Egg Compounds. New York: Springer Verlag; 2007. 298 p. English.), bem como um método eficiente de criopreservação de células(1919 Pyles E. Criopreservação de embriões e oócitos. Acesso: 19 Ago 2013. Bio Embryo; 2013. [Acesso 2013 Ago 19]. Disponível em: http://www.bioembryo.com.br/noticias.php?cat=1&subcat=2&id=188 .), que permitam uma boa manutenção da qualidade espermática.
Como pode ser visto na Tabela 2, a motilidade espermática foi também analisada em seis diferentes momentos durante o abaixamento de temperatura do sêmen e, da mesma, forma ela não apresentou diferenças estatisticamente significativas (P>0,05) entre os resultados das seis análises (A1 a A6) em ambos os diluentes.
Da mesma forma, para a característica motilidade espermática evidenciou-se uma queda contínua dos valores até A4, em ambos os tratamentos (Figura 2), também sendo esperada esta tendência devido ao abaixamento da temperatura de conservação do sêmen. Dentro de cada tratamento também houve diferenças dos resultados da motilidade espermática, com o resultado mais baixo acontecendo em A4, independentemente do diluente utilizado.
Análise da variação do vigor espermático (0 a 5), durante a curva de resfriamento do sêmen suíno, por diluente utilizado (BTS e ACP-103®).
Quanto ao efeito da curva, para a característica motilidade, os dois diluentes (Figura 3) apresentaram comportamento distintos entre si. No ACP, a variação dos resultados das análises na curva foi menor, enquanto que no BTS houve uma diferença significativa em quase todos os momentos de análises quando comparados entre si. Conforme pode ser observado, também para esta característica, nos resultados dos quatros primeiros pontos analisados (A1 a A4) houve uma redução na motilidade espermática em ambos os tratamentos, pois esta queda natural pode ser explicada pelo abaixamento da temperatura, bem como pelas alterações de pH e osmolaridade do meio, já que com o decorrer do tempo há o consumo do substrato energético e a produção de metabólitos(2020 Fontenele OS, Cardoso JFS, Cardoso RCS, Silva AR, Uchoa DC, Silva LDM. Conservação a 5 ºC do sêmen canino diluído em água de coco. In: Anais do IV Simpósio Cearense de Ciência Animal; Fortaleza; II Simpósio Nordestino de Buiatria; 2002; Fortaleza, CE, Brasil. Fortaleza: SCCA;2002. CD-ROM.).
Análise da variaçào da motilidade espermática (%), durante a curva de resfriamento do sêmen suíno, por diluente utilizado (BTS e ACP-103®).
Para a motilidade espermática, os resultados obtidos em A4 também apresentaram o menor valor médio tanto no BTS (54,4±19,3) como no ACP (56,5±16,7), entretanto, sem diferenças significativas (P>0,05) quando comparados com as análises em A5 e A6. Para esta característica, a variação dos valores médios durante o abaixamento da temperatura foi menor do que para o vigor espermático, reforçando o fato de que se faz necessário o desenvolvimento de um método eficiente de criopreservação de células(1919 Pyles E. Criopreservação de embriões e oócitos. Acesso: 19 Ago 2013. Bio Embryo; 2013. [Acesso 2013 Ago 19]. Disponível em: http://www.bioembryo.com.br/noticias.php?cat=1&subcat=2&id=188 .), que permita uma boa manutenção da qualidade espermática.
Já na avaliação seguinte (A5), houve um aumento da média da motilidade espermática em ambos os tratamentos. Este resultado pode estar relacionado com o fato que, para ser realizada esta análise, o sêmen sofreu uma centrifugação em que o plasma seminal foi retirado, bem como foi adicionado ao meio o diluente de resfriamento, com gema de ovo em sua constituição. Estudos relatam que a presença do plasma seminal proporciona uma maior sensibilidade do espermatozoide suíno ao choque térmico(2121 Dalimata AM, Graham JK. Cryopreservation of rabbit spermatozoa using acetamide in combination with trehalose and methyl cellulose. Theriogenology. 1997;48(5):831-841.), pois ele contém fatores que modificam a célula espermática antes da congelação(2222 Kawano N, Shimada M, Terada T. Motility and penetration competence of frozen-thawed miniature pig spermatozoa are substantially altered by exposure to seminal plasma before freezing. Theriogenology. 2004; 61(2-3):351-364.). Desta forma, são válidas, para a motilidade espermática, as mesmas observações feitas acima para o vigor espermático, que poderiam em trabalhos futuros proporcionar uma melhoria das condições de conservação do ejaculado suíno, visando sua criopreservação.
Por fim, pode-se observar que as células espermáticas foram congeladas apresentando um vigor e uma motilidade espermática de boa qualidade, mesmo após o sêmen ser submetido ao estresse da redução de temperatura. Tais resultados obtidos podem estar relacionados com a curva de resfriamento utilizada, pois o momento de redução de temperatura deve ser suficientemente lento para minimizar a formação de cristais de gelo intracelular e o suficientemente rápido para tornar mínimo o dano do "efeito solução"(1616 Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development. 1995;7(4):871-891. English.).
Sendo assim, uma boa taxa de refrigeração deve permitir que a célula espermática perca água, mas não de forma excessiva, possibilitando que pequenos cristais possam ser formados, mas que estes não sejam prejudiciais a ponto de causar a morte da célula(2323 Graham JK. Response of spermatozoa to freezing. In: Proceedings of Techniques for handling and utilization of transported cooled and frozen equine spermatozoa. 1995; Colorado State University; Fort Collins, CO; USA. 1995. p. 83-95. English.).
Com relação ao efeito do diluente após a descongelação e ressuspensão do sêmen (Tabela 3), o BTS apresentou melhores resultados (P<0,05) para as características vigor (1,8±0,9) e motilidade espermática (31,4±22,4), quando comparado com os obtidos com o diluente ACP (1,5±0,9 e 21,3±18,3, respectivamente), confirmando a boa condição que este meio químico oferece aos espermatozoides.
Valores do vigor e da motilidade espermática do sêmen suíno analisados após a descongelação e ressuspensão nos diluentes nos diluentes BTS e ACP-103®
Da mesma forma, em relação aos resultados pós-descongelação, em estudos recentes com ejaculados de varrões, utilizando-se o ACP como diluente de conservação durante 5 dias a 17 ºC, evidenciou-se uma redução da qualidade espermática (vigor e motilidade) em diferentes ejaculados(2424 Barros TB. Qualidade espermática do sêmen suíno conservado a baixas temperaturas em diluentes alternativos [Dissertação]. Fortaleza: Programa de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2010. 66 p. Fortaleza, CE. [Acesso 2017 Nov 22]. Disponível em: http://www.uece.br/ppgcv/dmdocuments/tatyane_barros.pdf. Portuguese.
http://www.uece.br/ppgcv/dmdocuments/tat...
), apresentando resultados inferiores quando comparado aos do presente estudo, fato este que vem corroborar com a afirmativa de Pyles(1919 Pyles E. Criopreservação de embriões e oócitos. Acesso: 19 Ago 2013. Bio Embryo; 2013. [Acesso 2013 Ago 19]. Disponível em: http://www.bioembryo.com.br/noticias.php?cat=1&subcat=2&id=188 .) no tocante à necessidade do desenvolvimento de um método eficiente de criopreservação que permita uma boa manutenção da qualidade espermática, sendo que ela está ligada não só às possíveis modificações nos procedimentos técnicos, bem como à composição e qualidade do diluente utilizado no processo.
Quando comparado o presente estudo com trabalhos que utilizaram a água de coco em pó na criopreservação de sêmen de outras espécies, os resultados de motilidade espermática obtidos após a descongelação na espécie suína (21,3%) foram inferiores quando comparados com os resultados em ovinos (40,3%)(2525 Cavalcante JM. Avaliação do sêmen ovino diluído e congelado em meio à base de água de coco em pó (ACP-102c) ou Tris [Dissertação]. Fortaleza: grama de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2008. 89 p. Portuguese.) e em caninos (58,4%)(1616 Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development. 1995;7(4):871-891. English.). Tais resultados podem ser justificados pelo fato de que a célula espermática do suíno, dentre as diferentes espécies de mamíferos domésticos, é a mais sensível às flutuações de temperatura(1111 Corrêa MN, Meincke W, Lucia T Jr, Deschamps JC. Inseminação artificial em suínos. Copyright. 1st ed. Londrina: Printpar, Brasil. 2001. 181 p. Portuguese.), necessitando também de estudos complementares de sua composição, particularmente da membrana plasmática, além das possíveis e necessárias adequações à técnica de congelação do sêmen.
Apesar do sêmen ter sido congelado com uma boa qualidade em ambos diluentes (2,7/57,6 no BTS e 2,7/55,8 no ACP, para vigor e motilidade, respectivamente), após a descongelação e ressuspensão estes resultados reduziram bastante, pois o declínio no percentual de células móveis durante criopreservação pode ser devido à sua inabilidade em gerar adenosina de trifosfato (ATP) suficiente pelas mitocôndrias, em consequência dos danos sofridos por estas organelas(2626 Vishwanath R, Shannon P. Do sperm cells age? A review of the physiological changes in sperm during storage at ambient temperature. Reproduction Fertility and Development. 1997;9(3):321-331. English.); ou devido ao efeito nocivo das enzimas aminoácido-aromático-oxidase ligadas à membrana plasmática e liberadas pelos espermatozoides mortos(2727 Shannon P, Curson B. Toxic effect and action of dead sperm on diluted bovine semen. Journal of Dairy Science. 1972;55(4):614-620. English.).
Por isso, é necessária a definição de uma curva de resfriamento lenta, de crioprotetores e de diluentes(33 Antunes RC. Avanço tecnológico e aplicabilidade da técnica de congelamento de sêmen suíno. Revista Brasileira de Reprodução Animal. 2007;31(1):60-63. Portuguese.), tais como foram utilizados no presente estudo, com o intuito de evitar lesões celulares, pois, apesar da baixa produtividade do sêmen congelado, as perspectivas para o uso desta técnica parecem promissoras, devido aos avanços de novas tecnologias e o aprimoramento de equipamentos de congelação do sêmen(2828 Wolders G, Ten Napel J. Semen in straws. Pig International. 2005;35:10-14. English.).
O sêmen suíno é o mais sensível às flutuações de temperatura, sendo valores abaixo de 15 ºC causadores de choque térmico, com perda irreversível da motilidade e lesões nas estruturas celulares(1111 Corrêa MN, Meincke W, Lucia T Jr, Deschamps JC. Inseminação artificial em suínos. Copyright. 1st ed. Londrina: Printpar, Brasil. 2001. 181 p. Portuguese.).
Quanto às características total de espermatozoides vivos, total de acrossoma intacto e total de células vivas com acrossoma intacto, o BTS e o ACP apresentaram resultados semelhantes, não havendo diferença significativa (P>0,05) entre os diluentes (Tabela 4). Considerando-se que a congelação de sêmen nos quais variam o crioprotetor, a velocidade no abaixamento de temperatura, os tipos de embalagens para conservação e os métodos de descongelação(2929 Bortolozzo FP, Wentz I, eds. Suinocultura em ação: Inseminação artificial na suinocultura tecnificada. Porto Alegre: Pallotti; 2005. 185 p. Portuguese.), estudos adicionais ainda são necessários para se consolidar uma técnica com resultados satisfatórios após descongelação.
Valores do total de espermatozoides vivos (%), total de acrossoma intacto e espermatozoides vivos com acrossoma intacto do sêmen suíno analisados após a descongelação e ressuspensão, nos diluentes BTS e ACP-103®
No entanto, como verificado na Tabela 4, o percentual de células vivas com acrossomo intacto apresentaram valores um pouco baixos após a descongelação, em ambos os diluentes. Apesar desses valores, os resultados ainda parecem satisfatório, uma vez que segundo Salamon e Maxwell(3030 Salamon S, Maxwell WM. Storage of ram semen. Animal Reproduction Science. 2000;62(1-3):77-111. English), apenas 20-30% dos espermatozoides permanecem biologicamente íntegros após o processo de congelação e descongelação.
A criopreservação de sêmen é uma biotécnica que proporciona um elevado número de espermatozoides com acrossomas capacitados(3131 Peris SI, Morrier A, Dufour M, Bailey JL. Cryopreservation of ram semen facilitates sperm DNA damage: relationship between sperm andrological parameters and the sperm chromatin structure assay. Journal of Andrology. 2004; 25(2):224-233. English.), fato que pode ocorrer devido às variações de temperatura(3232 Stornelli MC, Tittarelli CM, Savignone CA, Stornelli MA. Efecto de los procesos de criopreservación sobre lafertilidad seminal. Analecta Veterinaria. 2005;25(2):28-35. Spanish.), ou ao aumento da concentração de Ca2+ intracelular, gerado durante o processo de armazenamento do sêmen3333 Sanocka D, Kurpisz M. Reactive oxygen species and sperm cells. Reproduction Biology and Endocrinology. 2004;2:12-18. English). Embora a capacitação seja um processo fisiológico, ela pode ocorrer precocemente em espermatozoides que foram submetidos ao processo de congelação/descongelação(3434 Mortimer ST, Maxwell WM. Effects of medium on the kinematics of frozen-thawed ram spermatozoa. Reproduction. 2004;127(2):285-291. English.), podendo diminuir a capacidade de fertilização dos gametas(3535 Silva PF, Gadella BM. Detection of damage in mammalian sperm cells. Theriogenology. 2006;65(5):958-978. English.).
O uso de sêmen congelado na espécie suína ainda é limitado, pois apresenta alterações moleculares na membrana acrossomal, instabilidade da membrana após o descongelação(3636 Breininger E, Beorlegui NB, O'Flaherty CM, Beconi MT. Alpha-tocopherol improves biochemical and dynamic parameters in cryopreserved boar semen. Theriogenology. 2005;63(8):2126-2135. English.) e uma desestabilização na estrutura da cromatina espermática(3737 Fraser L, Strzezek J. Is there a relationship between the chromatin status and DNA fragmentation of boar spermatozoa following freezing-thawing? Theriogenology. 2007;68(2):248-257. English.).
Conforme pode ser visto na Tabela 5, quanto à avaliação da funcionalidade da membrana do espermatozoide, os diluentes testados apresentaram diferença significativa (P>0,05) em que o BTS (28,4%) apresentou maior percentual de células com membranas funcionais do que o ACP (24,2%). Desta forma, a proteção conferida pelo diluente utilizado é importante, uma vez que o espermatozoide do varrão é muito sensível ao estresse osmótico, devido às mudanças de volume durante a congelação, assim sendo, a curva de resfriamento é essencial para preservar a integridade dessas células(1616 Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development. 1995;7(4):871-891. English.).
Total de espematozoides reativos ao teste de resistência osmótica (%) do sêmen suíno aualísado após descongelação e ressuspensão, nos diluentes BTS e ACP-103®
O fato de mais de 70% das células espermáticas não apresentarem membranas funcionais, deve-se à ação lesiva da criopreservação, que induz danos físicos às células(3838 Holt WV. Basic aspects of frozen storage of semen. Animal Reproduction Science. 2000; 62(1-3):3-22. English.), pois este processo promove grande estresse celular e impõe aos espermatozoides condições extremamente desfavoráveis à manutenção de sua viabilidade(3939 Purdy PH. A review on goat sperm cryopreservation. Small Ruminants Research. 2006;63(3):215-). Durante a criopreservação, a membrana plasmática sofre modificações para se adequar às mudanças de temperatura, as quais acontecem durante o procedimento de congelação/descongelação e assemelham-se às alterações fisiológicas da capacitação(4040 Silva AR, Fontenele-Neto JD, Cardoso RCS, Silva LDM, Chiniréa VHE, Lopes MD. Description of ultrastructural damages in frozen-thawed canine spermatozoa. Ciência Animal Brasileira. 2009;10(2):595-601. English.).
Sendo assim, integridade da membrana plasmática parece ser o parâmetro espermático mais afetado pela criopreservação(4141 Ávila-Portillo LM, Madero JI, López C, León MF, Acosta L, Gómez C, et al. Fundamentos de criopreservación. Revista Colombiana de Obstetrícia e Ginecologia. 2006;57(4):291-300. Spanish.,4242 Arruda RP, Andrade AFC, Peres KR, Raphael CF, Nascimento JE, Celeghini ECC. Biotécnicas aplicadas à avaliação do potencial de fertilidade do sêmen equino. Revista Brasileira de Reprodução Animal. 2007;31(1):8-16. Portuguese.). Isso porque as mudanças de temperatura submetem às membranas estresses oriundos da fase de transição de sua estrutura do estado líquido cristalino para o de gel(4343 Canisso IF, Souza FA, Escobar JMO, Carvalho GR, Morel MCD, Silva EC, et al. Congelamiento de semen de burro (Equus asinus). Revista de Investigaciones Veterinarias del Perú. 2008;19(2):113-125. Spanish.), alterando sua função(1717 Watson PF. The causes of reduced fertility with cryopreserved semen. Animal Reproduciton Science. 2000;60-61:481-492. English.). Como consequência disto, ocorrem danos às membranas acrossomais e mitocondriais(4444 Quinn PJ, Chow PY, White IG. Evidence that phospholipid protects ram spermatozoa from cold shock at a plasma membrane site. Journal of Reproduction and Fertility. 1980;60(2):403-407. English.), assim como reação acrossomal prematura(4545 Leboeuf B, Restall B, Salamon S. Production and storage of goat semen for artificial insemination. Animal Reproduction Science. 2000;62(1-3):113-141. English.). Tal fato leva os espermatozoides com membranas plasmáticas danificadas a serem considerados incapazes de realizar o processo de fertilização(3535 Silva PF, Gadella BM. Detection of damage in mammalian sperm cells. Theriogenology. 2006;65(5):958-978. English.), uma vez que apenas espermatozoides com membranas intactas podem sofrer capacitação e reação acrossomal(4646 Pesch S, Bergmann M. Structure of mammalian spermatozoa in respect to viability and cryopreservation. Micron. 2006;37(7):597-612. English.).
No sêmen criopreservado, o número de danos observados nas células espermáticas é significativamente maior em relação ao sêmen in natura, e este fato não depende das técnicas utilizadas para a criopreservação(4747 Membrillo Ortega A, Córdova Izquierdo A, Hicks Gómez JJ, Olivares-Corichi IM, Martínez Torres VM, Valencia Méndez JJ. Peroxidación lipídica y antioxidantes en la preservación de semen. Una revisión. Interciencia. 2003;28(12):699-704. Spanish.), tampouco da espécie trabalhada. Estes lesões observadas nos espermatozoides decorrem da interação entre as mudanças biofísicas, bioquímicas e ambientais ocorridas durante o processo de congelação(4848 Fickel J, Wagner A, Ludwig A. Semen cryopreservation and the conservation of endangered species. European Journal of Wildlife Research. 2007;53(2):81-89. English.), submetendo as células criopreservadas a estresses resultantes das mudanças de volume e consequentes alterações nas concentrações de íons e eletrólitos nas soluções intra e extracelulares(3232 Stornelli MC, Tittarelli CM, Savignone CA, Stornelli MA. Efecto de los procesos de criopreservación sobre lafertilidad seminal. Analecta Veterinaria. 2005;25(2):28-35. Spanish.).
Apesar da descongelação estar ligada ao restabelecimento das características celulares, esta pode ocasionar peroxidação lipídica e danos à membrana, decorrentes do rápido aumento da utilização de oxigênio pelo espermatozoide(4949 Guerra MMP, Evans G, Maxwell WMC. Papel de oxidantes e antioxidantes na andrologia. Revista Brasileira de Reprodução Animal. 2004; 28(4):187-195. Portuguese.), assim como a ruptura da membrana em razão do excessivo fluxo de água para o interior da célula(3838 Holt WV. Basic aspects of frozen storage of semen. Animal Reproduction Science. 2000; 62(1-3):3-22. English.). Deste modo, é esperado que a avaliação da funcionalidade da membrana apresente resultados insatisfatórios, caso a descongelação não tenha sido feita de forma satisfatória. Alguns pesquisadores(5050 Schober D, Aurich C, Nohl H, Gille L. Influence of cryopreservation on mitochondrial functions in equine spermatozoa. Theriogenology. 2007;68(5):745-754. English.) afirmam que o dano mitocondrial durante criopreservação pode ser a maior razão para redução da qualidade do sêmen pós-descongelação.
Quanto à curva de resfriamento, esta se adequou ao processo de congelação lenta, mantendo a viabilidade espermática até a congelação do sêmen. No entanto, a taxa ótima de resfriamento, congelação e descongelação pode diferir de acordo com a composição do diluente utilizado(5151 Salamon S, Maxwell WMC. Frozen storage of ram semen. I. Processing, freezing, thawing and fertility after cervical insemination. Animal Reproduction Science. 1995;37(3-4):185-249. English.). Desta forma, são necessários maiores estudos utilizando o diluente ACP-103 na criopreservação do sêmen suíno para a obtenção de melhores resultados.
Pode ser visto no presente estudo que, embora o BTS tenha apresentado melhores resultados que o ACP para diferentes características estudadas, o ACP ainda assim apresentou resultados aceitáveis para seu uso em programas de inseminação artificial para a espécie suína. Vários estudos de conservação espermática têm sido realizados utilizando o ACP como diluente. Sua relação custo/benefício é favorável aos programas de IA, podendo ser utilizada sob diferentes apresentações e se apresentar como um diluente eficiente para o sêmen de diferentes espécies(4848 Fickel J, Wagner A, Ludwig A. Semen cryopreservation and the conservation of endangered species. European Journal of Wildlife Research. 2007;53(2):81-89. English.).
Conclusão
O diluente ACP não deve ser utilizado em protocolos de congelação/criopreservação do sêmen suíno. A curva de resfriamento utilizada deve ser melhor trabalhada de forma a possibilitar ao final, antes da congelação, a recuperação de uma maior porcentagens de espermatozoides móveis, permitindo, desta forma, uma melhor viabilidade celular visando a congelação. Assim, a modificação do protocolo de criopreservação utilizado, bem como a modificação da composição dos atuais diluentes de sêmen, são necessários, com o intuito de minimizar os danos celulares causados pela criopreservação.
Referências
-
1Toniolli R, Costa e Silva M, Chaves RN. Utilização de diferentes meios de ressuspensão para o sêmen do varrão após descongelação. Revista Brasileira de Ciências Veterinárias. 2009;16(1):41-45. Portuguese.
-
2Castelo TS, Silva AR, Frota TR. Considerations on goat semen cryopreservation. Acta Veterinaria Brasilica. 2008;2(3):67-75. Portuguese.
-
3Antunes RC. Avanço tecnológico e aplicabilidade da técnica de congelamento de sêmen suíno. Revista Brasileira de Reprodução Animal. 2007;31(1):60-63. Portuguese.
-
4Hammitt DG, Martin A. Fertility of frozen-thawed porcine semen following controlled-rate freezing in straws. Theriogenology. 1989;32(3):359-368. English.
-
5Woelders H. Fundamentals and recent development in cryopreservation of bull and boar semen. Veterinary Quarterly. 1997;19(3):135-138. English.
-
6Johnson LA. Current developments in swine semen: preservation, artificial insemination and sperm sexing. In: Proceedings of 15th International Pig Veterinary Society Congress; 1998 Jul 5-9. 1998. p. 225-229. English.
-
7Escobar CJ. Inseminación artificial em caninos. In: Gobello C, ed. Temas de reproducción de caninos y felinos por autores latino americanos. Buenos Aires: Latina; 2004. 157 p. Spanish.
-
8Verstegen JP, Onclin K, Iguer-Ouada M. Long-term motility and fertility conservation of chilled canine semen using egg yolk added Tris-glucose extender: in vitro and in vivo studies. Theriogenology. 2005;64(3):720-733. English.
-
9Silva TASN. Efeito do plasma seminal na descongelação do sêmen ovino avaliado in vitro e na inseminação artificial cervical [Dissertação]. Brasília: Universidade de Brasília; 2007. 64 p. [Acesso 2017 Nov 22]. Disponível em: http://repositorio.unb.br/handle/10482/3338 Portuguese.
» http://repositorio.unb.br/handle/10482/3338 -
10Toniolli R. Pouvoir fecondant des spermatozoïdes de verrat: amèlioration des conditions de conservation [These de Doctorat]. Tours: Université François Rabelais; 1996. 91 p. French.
-
11Corrêa MN, Meincke W, Lucia T Jr, Deschamps JC. Inseminação artificial em suínos. Copyright. 1st ed. Londrina: Printpar, Brasil. 2001. 181 p. Portuguese.
-
12Colégio Brasileiro de Reprodução Animal (CBRA). Manual para exame andrológico e avaliação de sêmen animal. 3ª ed. Belo Horizonte: CBRA; 2013. 104 p.
-
13Westendorf P, Richter L, Treu H. Deep-freezing of boar semen: laboratory findings and insemination results with the "Hülsenberger Oailleten" technique. Deutsche Tierärztliche Wochenschrift. 1975;82:261-267. German.
-
14Bianchi I, Mirapalheta MEM, Schneider A, Rabassa VR, Corrêa EK, Lucia JTE, et al. Efeito de diferentes métodos de congelamento, diluentes e tempos de resfriamento sobre a qualidade do sêmen suíno criopreservado. Acta Scitifiae Veterinaria. 2011;39(1):940-949. Portuguese.
-
15Araújo LRS. Uso de diluentes alternativos a baixas temperaturas na manutenção da qualidade espermática do sêmen suíno [Dissertação]. Fortaleza: Programa de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2012. 92 p. [Acesso 2017 Nov 22]. Disponível em: http://www.uece.br/ppgcv/dmdocuments/linaraquel.pdf Portuguese.
» http://www.uece.br/ppgcv/dmdocuments/linaraquel.pdf -
16Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development. 1995;7(4):871-891. English.
-
17Watson PF. The causes of reduced fertility with cryopreserved semen. Animal Reproduciton Science. 2000;60-61:481-492. English.
-
18Houpalathi R, López-Fandiño R, Anton M, Schade R. Bioactive Egg Compounds. New York: Springer Verlag; 2007. 298 p. English.
-
19Pyles E. Criopreservação de embriões e oócitos. Acesso: 19 Ago 2013. Bio Embryo; 2013. [Acesso 2013 Ago 19]. Disponível em: http://www.bioembryo.com.br/noticias.php?cat=1&subcat=2&id=188 .
-
20Fontenele OS, Cardoso JFS, Cardoso RCS, Silva AR, Uchoa DC, Silva LDM. Conservação a 5 ºC do sêmen canino diluído em água de coco. In: Anais do IV Simpósio Cearense de Ciência Animal; Fortaleza; II Simpósio Nordestino de Buiatria; 2002; Fortaleza, CE, Brasil. Fortaleza: SCCA;2002. CD-ROM.
-
21Dalimata AM, Graham JK. Cryopreservation of rabbit spermatozoa using acetamide in combination with trehalose and methyl cellulose. Theriogenology. 1997;48(5):831-841.
-
22Kawano N, Shimada M, Terada T. Motility and penetration competence of frozen-thawed miniature pig spermatozoa are substantially altered by exposure to seminal plasma before freezing. Theriogenology. 2004; 61(2-3):351-364.
-
23Graham JK. Response of spermatozoa to freezing. In: Proceedings of Techniques for handling and utilization of transported cooled and frozen equine spermatozoa. 1995; Colorado State University; Fort Collins, CO; USA. 1995. p. 83-95. English.
-
24Barros TB. Qualidade espermática do sêmen suíno conservado a baixas temperaturas em diluentes alternativos [Dissertação]. Fortaleza: Programa de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2010. 66 p. Fortaleza, CE. [Acesso 2017 Nov 22]. Disponível em: http://www.uece.br/ppgcv/dmdocuments/tatyane_barros.pdf Portuguese.
» http://www.uece.br/ppgcv/dmdocuments/tatyane_barros.pdf -
25Cavalcante JM. Avaliação do sêmen ovino diluído e congelado em meio à base de água de coco em pó (ACP-102c) ou Tris [Dissertação]. Fortaleza: grama de Pós-graduação em Ciências Veterinárias. Universidade Estadual do Ceará; 2008. 89 p. Portuguese.
-
26Vishwanath R, Shannon P. Do sperm cells age? A review of the physiological changes in sperm during storage at ambient temperature. Reproduction Fertility and Development. 1997;9(3):321-331. English.
-
27Shannon P, Curson B. Toxic effect and action of dead sperm on diluted bovine semen. Journal of Dairy Science. 1972;55(4):614-620. English.
-
28Wolders G, Ten Napel J. Semen in straws. Pig International. 2005;35:10-14. English.
-
29Bortolozzo FP, Wentz I, eds. Suinocultura em ação: Inseminação artificial na suinocultura tecnificada. Porto Alegre: Pallotti; 2005. 185 p. Portuguese.
-
30Salamon S, Maxwell WM. Storage of ram semen. Animal Reproduction Science. 2000;62(1-3):77-111. English
-
31Peris SI, Morrier A, Dufour M, Bailey JL. Cryopreservation of ram semen facilitates sperm DNA damage: relationship between sperm andrological parameters and the sperm chromatin structure assay. Journal of Andrology. 2004; 25(2):224-233. English.
-
32Stornelli MC, Tittarelli CM, Savignone CA, Stornelli MA. Efecto de los procesos de criopreservación sobre lafertilidad seminal. Analecta Veterinaria. 2005;25(2):28-35. Spanish.
-
33Sanocka D, Kurpisz M. Reactive oxygen species and sperm cells. Reproduction Biology and Endocrinology. 2004;2:12-18. English
-
34Mortimer ST, Maxwell WM. Effects of medium on the kinematics of frozen-thawed ram spermatozoa. Reproduction. 2004;127(2):285-291. English.
-
35Silva PF, Gadella BM. Detection of damage in mammalian sperm cells. Theriogenology. 2006;65(5):958-978. English.
-
36Breininger E, Beorlegui NB, O'Flaherty CM, Beconi MT. Alpha-tocopherol improves biochemical and dynamic parameters in cryopreserved boar semen. Theriogenology. 2005;63(8):2126-2135. English.
-
37Fraser L, Strzezek J. Is there a relationship between the chromatin status and DNA fragmentation of boar spermatozoa following freezing-thawing? Theriogenology. 2007;68(2):248-257. English.
-
38Holt WV. Basic aspects of frozen storage of semen. Animal Reproduction Science. 2000; 62(1-3):3-22. English.
-
39Purdy PH. A review on goat sperm cryopreservation. Small Ruminants Research. 2006;63(3):215-
-
40Silva AR, Fontenele-Neto JD, Cardoso RCS, Silva LDM, Chiniréa VHE, Lopes MD. Description of ultrastructural damages in frozen-thawed canine spermatozoa. Ciência Animal Brasileira. 2009;10(2):595-601. English.
-
41Ávila-Portillo LM, Madero JI, López C, León MF, Acosta L, Gómez C, et al. Fundamentos de criopreservación. Revista Colombiana de Obstetrícia e Ginecologia. 2006;57(4):291-300. Spanish.
-
42Arruda RP, Andrade AFC, Peres KR, Raphael CF, Nascimento JE, Celeghini ECC. Biotécnicas aplicadas à avaliação do potencial de fertilidade do sêmen equino. Revista Brasileira de Reprodução Animal. 2007;31(1):8-16. Portuguese.
-
43Canisso IF, Souza FA, Escobar JMO, Carvalho GR, Morel MCD, Silva EC, et al. Congelamiento de semen de burro (Equus asinus). Revista de Investigaciones Veterinarias del Perú. 2008;19(2):113-125. Spanish.
-
44Quinn PJ, Chow PY, White IG. Evidence that phospholipid protects ram spermatozoa from cold shock at a plasma membrane site. Journal of Reproduction and Fertility. 1980;60(2):403-407. English.
-
45Leboeuf B, Restall B, Salamon S. Production and storage of goat semen for artificial insemination. Animal Reproduction Science. 2000;62(1-3):113-141. English.
-
46Pesch S, Bergmann M. Structure of mammalian spermatozoa in respect to viability and cryopreservation. Micron. 2006;37(7):597-612. English.
-
47Membrillo Ortega A, Córdova Izquierdo A, Hicks Gómez JJ, Olivares-Corichi IM, Martínez Torres VM, Valencia Méndez JJ. Peroxidación lipídica y antioxidantes en la preservación de semen. Una revisión. Interciencia. 2003;28(12):699-704. Spanish.
-
48Fickel J, Wagner A, Ludwig A. Semen cryopreservation and the conservation of endangered species. European Journal of Wildlife Research. 2007;53(2):81-89. English.
-
49Guerra MMP, Evans G, Maxwell WMC. Papel de oxidantes e antioxidantes na andrologia. Revista Brasileira de Reprodução Animal. 2004; 28(4):187-195. Portuguese.
-
50Schober D, Aurich C, Nohl H, Gille L. Influence of cryopreservation on mitochondrial functions in equine spermatozoa. Theriogenology. 2007;68(5):745-754. English.
-
51Salamon S, Maxwell WMC. Frozen storage of ram semen. I. Processing, freezing, thawing and fertility after cervical insemination. Animal Reproduction Science. 1995;37(3-4):185-249. English.
Datas de Publicação
-
Publicação nesta coleção
2018
Histórico
-
Recebido
23 Out 2015 -
Aceito
22 Nov 2017