Resumo
A cevada (Hordeum vulgare) é o principal cereal utilizado na produção de cerveja, mas é importada, na maioria dos países tropicais e subtropicais. Isto implica no aumento do custo de produção da bebida, além de não satisfazer a demanda das bebidas sem glúten no mercado. O sorgo (Sorghum bicolor L. Moench) é um dos cereais que também podem ser usados na produção de cerveja e, ao contrário da cevada, é livre de glúten, recomendado para doentes celíacos. Assim, recentemente tem aumentado o interesse no uso do malte de sorgo para substituir o malte de cevada na produção de bebidas. No entanto, as principais dificuldades encontradas na produção de bebidas fermentadas a partir de malte de sorgo têm sido o baixo nível de enzimas hidrolíticas e a alta temperatura de gelatinização. O objetivo deste trabalho de revisão foi avaliar os principais fatores que afetam os processos de maltagem (tempo e temperatura de imersão, de germinação e de secagem) e a mosturação com malte de sorgo (pH e temperatura das enzimas, e métodos usados) na produção de cerveja sem glúten.
Palavras-chave:
Bebidas; Cereais; Cevada; Enzimas; Maltagem; Mosturação; Sem glúten; Substituição
Abstract
Barley (Hordeum vulgare) is the main cereal used in beer production, but is imported in most of the tropical and subtropical countries. This increases the production costs, without satisfying the market demand for gluten-free beverages. Sorghum ( Sorghum bicolor L. Moench) is one of the cereals that can also be used in brewing, and, unlike barley, is gluten-free and hence recommended for celiac patients. Thus interest in the use of sorghum malt to replace barley malt in beverage production has increased recently. However, the main difficulties encountered in the production of fermented beverages using sorghum malt have been the low level of hydrolytic enzymes and high gelatinization temperature. Hence the objective of this review was to evaluate the main factors affecting malting processes (drying and germination, steeping time and temperature) and mashing with sorghum malt (pH and temperature of the enzymes and methods used) in gluten-free beer production.
Keywords:
Beverage; Cereals; Barley; Enzymes; Malting; Mashing; Gluten-free; Replacement
1 Introdução
Apesar das numerosas vantagens da cevada sobre outros cereais, no processo de produção de cerveja, tem aumentado o interesse pelas pesquisas sobre o uso de cereais tropicais para oferecer bebidas sem glúten, que possam ser consumidas pelos doentes celíacos, e que possibilitem também reduzir os custos de produção ( ARCHIBONG et al., 2015 ARCHIBONG, E. J.; ONUORA, V. C.; USOEGBU, O.; EZEMBA, C. C. Mashing studies of two (2) improved sorghum varieties (SK5912 and CSR01) using crude enzyme extract from Aspergillus sydowii.
World Journal of Pharmacy and Pharmaceutical Sciences , v. 4, p. 113-125, 2015. ; ABUAJAH et al., 2016a ABUAJAH, C. I.; OGBONNA, A. C.; ONWUKA, N. U.; UMOREN, P. E.; OJUKWU, M. Effect of varietal differences and germination period on some malting and brewing potentials of new improved sorghum varieties (SAMSORG17, SAMSORG14, and SAMSORG40) from Nigeria. International Food Research Journal, v. 23, n. 4, p. 1600-1608, 2016a. Disponível em: <http://www.ifrj.upm.edu.my/23%20(04)%202016/(33).pdf>. Acesso em: 19 nov. 2015.
http://www.ifrj.upm.edu.my/23%20(04)%20...
). Conforme Fasano e Catassi (2001) FASANO, A.; CATASSI, C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology, v. 120, n. 3, p. 636-651, 2001. http://dx.doi.org/10.1053/gast.2001.22123. PMid:11179241.
http://dx.doi.org/10.1053/gast.2001.221...
, a doença celíaca (CD), em indivíduos geneticamente suscetíveis, é uma síndrome caracterizada por dano da mucosa do intestino delgado, causada pela fração de gliadina de glúten do trigo e de proteínas semelhantes (prolaminas) da cevada e do centeio. Os autores afirmam que o tratamento chave da CD é a dieta, ao longo da vida, na qual os produtos que contêm glúten são eliminados. Nesse sentido, há vários estudos, direcionados aos doentes celíacos, sobre alimentos livres de glúten, tais como bolos ( GOMES et al., 2014 GOMES, L. O. F.; SANTIAGO, R. A. C.; KOAKUZU, S. N.; BASSINELLO, P. Z. Estabilidade microbiológica e físico-química de misturas para bolo sem glúten e qualidade dos bolos prontos para consumo. Brazilian Journal of Food Technology, v. 17, n. 4, p. 283-295, 2014. http://dx.doi.org/10.1590/1981-6723.0914.
http://dx.doi.org/10.1590/1981-6723.091...
), biscoitos ( MARIANI et al., 2015 MARIANI, M.; OLIVEIRA, V. R.; FACCIN, R.; RIOS, A. O.; VENZKE, J. G. Elaboração e avaliação de biscoitos sem glúten a partir de farelo de arroz e farinhas de arroz e de soja. Brazilian Journal of Food Technology, v. 18, n. 1, p. 70-78, 2015. http://dx.doi.org/10.1590/1981-6723.6514.
http://dx.doi.org/10.1590/1981-6723.651...
) e pães ( SILVA et al., 2017 SILVA, C.; BRITO, J.; SOUZA, M. Z.; SILVEIRA, A.; LUVIELMO, M. M.; SALAS, M. M. Adição de colágeno em pão sem glúten elaborado com farinha de arroz. Brazilian Journal of Food Technology, v. 20, p. 2-10, 2017. ). É assumido que o sorgo tem grande potencial para ser usado na produção de alimentos e bebidas sem glúten ( ARENDT; SCHNITZENBAUMER, 2014 ARENDT, E. K.; SCHNITZENBAUMER, B. Brewing with up to 40% unmalted oats (Avena sativa ) and sorghum (Sorghum bicolor): a review. Journal of the Institute of Brewing, v. 120, p. 315-330, 2014. ). O sorgo pertence à família Graminae e ao gênero sorghum ( OWUAMA, 1997 OWUAMA, C. I. Sorghum: a cereal with lager beer brewing potential. World Journal of Microbiology & Biotechnology, v. 13, n. 3, p. 253-260, 1997. http://dx.doi.org/10.1023/A:1018566503879.
http://dx.doi.org/10.1023/A:10185665038...
). O sorgo, ao contrário da cevada, é muito bem adaptado às condições semiáridas e subtropicais. Uma das vantagens de seu cultivo é que ele pode crescer sob forte estresse ambiental, como a seca, em que os cereais temperados não conseguem se desenvolver ( AGU; PALMER, 1998 AGU, R. C.; PALMER, G. H. A reassessment of sorghum for lager-beer brewing. Bioresource Technology, v. 66, n. 3, p. 253-261, 1998. http://dx.doi.org/10.1016/S0960-8524(98)00047-9.
http://dx.doi.org/10.1016/S0960-8524(98...
). Em países da América, o sorgo tem um preço relativamente mais baixo, quando comparado ao da cevada. Por exemplo, os preços registrados do sorgo (USD/ton) e da cevada para Bolívia, Colômbia, México, Uruguai e EUA têm sido 163,50 e 407,30, 300,20 e 429,10, 189,20 e 235,70, 156,10 e 227,30, 120,00 e 253,00, respectivamente ( FAO, 2015 FOOD AND AGRICULTURE ORGANIZATION – FAO. Produces prices – annual . Rome: FAO, 2015. Disponível em: <http://www.fao.org/faostat/en/#data/PP>
http://www.fao.org/faostat/en/#data/PP ...
). Contudo, as principais dificuldades encontradas no uso do sorgo, na produção cervejas, são a alta temperatura de gelatinização (> 70 °C) e o baixo poder diastático (DP) ( OWUAMA, 1997 OWUAMA, C. I. Sorghum: a cereal with lager beer brewing potential. World Journal of Microbiology & Biotechnology, v. 13, n. 3, p. 253-260, 1997. http://dx.doi.org/10.1023/A:1018566503879.
http://dx.doi.org/10.1023/A:10185665038...
; OGBONNA, 2011 OGBONNA, A. C. Current developments in malting and brewing trials with sorghum in Nigeria: a review. Journal of the Institute of Brewing, v. 117, n. 3, p. 394-400, 2011. http://dx.doi.org/10.1002/j.2050-0416.2011.tb00485.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
). Portanto, o foco das pesquisas tem sido melhorar a qualidade do malte ( DJAMEH et al., 2015 DJAMEH, C.; SAALIA, F. K.; SINAYOBYE, E.; BUDU, A.; ESSILFIE, G.; MENSAH-BROWN, H.; SEFA-DEDEH, S. Optimization of the sorghum malting process for pito production in Ghana. Journal of the Institute of Brewing, v. 121, n. 1, p. 106-112, 2015. http://dx.doi.org/10.1002/jib.191.
http://dx.doi.org/10.1002/jib.191 ...
; EBBAH et al., 2015 EBBAH, L.; LARYEA, D.; BARIMAH, J.; DJAMEH, C. Effect of steeping temperature on the quality of malt and Pito (an indigenous Ghanaian drink). Journal of the Institute of Brewing , v. 121, n. 4, p. 518-523, 2015. http://dx.doi.org/10.1002/jib.265.
http://dx.doi.org/10.1002/jib.265 ...
). Visando usar o sorgo na produção de cervejas, para aproveitar suas potencialidades, é necessário o conhecimento dos fatores que influenciam na qualidade de seu malte e na mosturação; assim, tais informações podem ajudar a identificar o impacto sobre o processo geral. Para viabilizar a etapa de fermentação, é necessário conhecer, além do tipo de cultivar, as faixas adequadas de variáveis independentes, tais como: i) na maltagem: tempo e temperatura de imersão, de germinação e de secagem; ii) na mosturação: pH e temperatura das enzimas, e métodos. Dessa forma, é possível usar as informações adquiridas com a finalidade de produzir bebidas sem glúten, com baixo teor alcoólico. Portanto, nesta revisão, buscou-se reunir os estudos que levam a aceitáveis parâmetros de qualidade, tais como perdas da maltagem (MWL), poder diastático, extrato em água fria (CWE), extrato em água quente (HWE), atenuação limite (AAL), amino nitrogênio livre (FAN), nitrogênio solúvel total (TSN) e Índice de Kolbach (KI), de modo que tais informações possam auxiliar na avaliação do potencial de variedades não estudadas para a produção de bebidas fermentadas sem glúten.
1.1 Limitações do sorgo na produção de cerveja
Conforme Owuama e Okafor (1987) OWUAMA, C. I.; OKAFOR, N. Studies on mashing methods for beer brewing with sorghum. MIRCEN Journal of Applied Microbiology and Biotechnology, v. 3, n. 3, p. 243-253, 1987. http://dx.doi.org/10.1007/BF00933578.
http://dx.doi.org/10.1007/BF00933578 ...
, o processo de produção de cerveja consta de seis etapas principais: maltagem, mosturação, fervura do mosto, fermentação, maturação e engarrafamento. Contudo, esta revisão mostra que as limitações do processo, a partir do malte de sorgo, estão relacionadas, principalmente, com as etapas de maltagem e de mosturação. Além da alta temperatura de gelatinização, o malte de sorgo apresenta insuficiente nível de enzimas hidrolíticas, quando comparado com o malte da cevada, especificamente o nível de β-amilase. Taylor e Robbins (1993) TAYLOR, J. R. N.; ROBBINS, D. J. Factors influencing beta-amylase activity in sorghum malt. Journal of the Institute of Brewing, v. 99, n. 5, p. 413-416, 1993. http://dx.doi.org/10.1002/j.2050-0416.1993.tb01181.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
relataram que os grãos de sorgo não germinados não exibem atividade β-amilase e que, depois da maltagem, o sorgo tem uma atividade β-amilase inferior aos 25% do nível dessa atividade no malte de cevada. Por outro lado, tem sido reportado que o tempo de germinação é um fator crítico na atividade β-amilase ( HASSANI et al., 2014 HASSANI, A.; ZARNKOW, M.; BECKER, T. Influence of malting conditions on sorghum ( Sorghum bicolor (L.) Moench) as a raw material for fermented beverages. Food Science & Technology International, v. 20, n. 6, p. 453-463, 2014. http://dx.doi.org/10.1177/1082013213490710. PMid:23751551.
http://dx.doi.org/10.1177/1082013213490...
). As causas da baixa atividade β-amilase têm sido explicadas por vários autores. Por exemplo, Uriyo e Eigel (1999) URIYO, M.; EIGEL, W. E. Duration of kilning treatment on α-amylase, β-amylase and endo-(1, 3) (1, 4)-β-D- glucanase activity of malted sorghum (Sorghum bicolor).
Process Biochemistry, v. 35, n. 5, p. 433-436, 1999. http://dx.doi.org/10.1016/S0032-9592(99)00071-0.
http://dx.doi.org/10.1016/S0032-9592(99...
explicaram que essa debilidade é devida à interação entre a β-amilase e polifenóis. Diversamente, Dufour et al. (1992) DUFOUR, J. P.; MÉLOTTE, L.; SREBRNIK, S. Sorghum malts for the production of lager beer. Journal of the American Society of Brewing Chemists, v. 50, n. 3, p. 110-119, 1992. http://dx.doi.org/10.1094/ASBCJ-50-0110.
http://dx.doi.org/10.1094/ASBCJ-50-0110...
mostraram que a atividade β-amilase permanece fraca, mesmo em variedades de sorgo com baixo teor de polifenóis. Os autores atribuíram os problemas de sacarificação, nas variedades de sorgo estudadas, à grande variabilidade da temperatura de gelatinização e viscosidade do amido, e à falta de β-amilase em muitos dos grãos. A variabilidade no comportamento da temperatura de gelatinização e das viscosidades foi atribuída a porcentagens variáveis de ramificação em amilopectina e diferentes forças de ligação nos grânulos (maior resistência ao inchamento e à ruptura). Outros autores afirmam que, à parte dos polifenóis, o baixo nível de proteínas solúveis também pode inibir a atividade β-amilase. As proteínas formam uma matriz que envolve os grânulos de amido e, se não são solubilizadas durante a germinação, inibem a hidrólise do amido pela β-amilase ( PALMER et al., 1989 PALMER, G. H.; ETOKAKPAN, O. U.; IGYOR, M. A. Sorghum as brewing material. MIRCEN Journal of Applied Microbiology and Biotechnology, v. 5, n. 3, p. 265-275, 1989. http://dx.doi.org/10.1007/BF01741756.
http://dx.doi.org/10.1007/BF01741756 ...
). Por outra parte, a proteólise é vital para a geração de FAN e peptídeos curtos, durante a maltagem. No sorgo, a atividade proteolítica também é outra limitação. Segundo Evans e Taylor (1990) EVANS, D. J.; TAYLOR, J. R. N. Extraction and assay of proteolytic activities in sorghum malt. Journal of the Institute of Brewing, v. 96, n. 4, p. 201-207, 1990. http://dx.doi.org/10.1002/j.2050-0416.1990.tb01028.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
, a proteólise é provocada pela ação das enzimas proteolíticas do malte. O baixo grau de proteólise (atividade proteolítica) afeta negativamente o rendimento, a filtração e a fermentabilidade do mosto, como também a espuma e a estabilidade da cerveja. Um grau de proteólise adequado é decorrente de adequados níveis de TSN e de FAN. Além disso, a degradação incompleta das proteínas estruturais e de armazenamento do grão, durante a maltagem, limita a extensão da solubilização de carboidratos, durante a mosturação ( AGU; PALMER, 1997 AGU, R. C.; PALMER, G. H. The effect of temperature on the modification of sorghum and barley during malting. Process Biochemistry, v. 32, n. 6, p. 501-507, 1997. http://dx.doi.org/10.1016/S0032-9592(97)00002-2.
http://dx.doi.org/10.1016/S0032-9592(97...
). Como observado, os principais obstáculos do malte de sorgo para ser usado na produção de cerveja são decorrentes das ações limitadas das enzimas amilolíticas e proteolíticas; dessa maneira, fica comprometida a produção de malte de boa qualidade devido à baixa atividade enzimática. Isso proporciona as desvantagens econômicas relacionadas com a filtração do mosto. Entretanto, essas limitações podem ser minimizadas por meio de: (i) a escolha adequada da variedade de sorgo, que apresente baixa temperatura de gelatinização e alto poder diastático; (ii) otimização da maltagem, e (iii) otimização da mosturação.
1.2 Maltagem
Agu e Palmer (1996) AGU, R. C.; PALMER, G. H. Enzymic breakdown of endosperm proteins of sorghum at different malting temperatures. Journal of the Institute of Brewing, v. 102, n. 6, p. 415-418, 1996. http://dx.doi.org/10.1002/j.2050-0416.1996.tb00924.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
destacaram que o objetivo principal do processo da maltagem é gerar as enzimas hidrolíticas, as quais clivam os compostos principais, amido e proteínas, para proporcionar açúcares fermentáveis, nitrogênio amino livre e aminoácidos. As três etapas que envolvem este processo, assinaladas por Dewar et al. (1997) DEWAR, J.; TAYLOR, J. R. N.; BERJAK, P. Determination of improved steeping conditions for Sorghum malting. Journal of Cereal Science, v. 26, n. 1, p. 129-136, 1997. http://dx.doi.org/10.1006/jcrs.1996.0101.
http://dx.doi.org/10.1006/jcrs.1996.010...
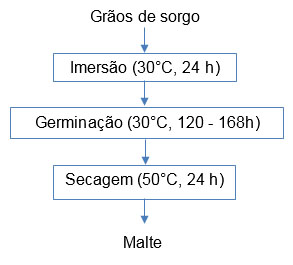
, assim como as melhores condições na maltagem de sorgo, extraídas desta revisão, são mostradas na Figura 1 . Geralmente, a qualidade do malte de sorgo é influenciada pelas condições da maltagem, tais como tempo e temperatura de imersão, de germinação e de secagem, e pela variedade. Visando incentivar o desenvolvimento de pesquisas com variedades de sorgo diferentes às já estudadas, as Tabelas 1
e 2 mostram um resumo das condições do processo e das cultivares estudadas, das condições otimizadas e dos parâmetros de qualidade obtidos na maltagem, respectivamente.
Condições do processo de maltagem e cultivares de sorgo estudadas para a produção de cerveja sem glúten.
1.2.1 Parâmetros de qualidade do malte
1.2.1.1 Perdas da maltagem
As perdas da maltagem são aquelas registradas como resultado de processos metabólicos associados à germinação dos grãos, que se manifestam pelo crescimento e desenvolvimento das raízes e gêmulas ( AISEN; MUTS, 1987 AISEN, A. O.; MUTS, G. C. J. Micro-scale malting and brewing studies of some sorghum varieties. Journal of the Institute of Brewing, v. 93, n. 4, p. 328-331, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04513.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). A faixa de perda entre 10% e 15% é aceitável na maltagem de sorgo ( NOVELLIE, 1962a NOVELLIE, L. Kaffir corn malting and brewing studies XII. Effect of malting conditions on malting losses and total amylases activity. Journal of the Science of Food and Agriculture , v. 13, n. 2, p. 121-123, 1962a. http://dx.doi.org/10.1002/jsfa.2740130211.
http://dx.doi.org/10.1002/jsfa.27401302...
). Geralmente, as perdas estão em proporção direta com o tempo de germinação e são maiores nos últimos dias de germinação ( BEKELE et al., 2012 BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
; NNAMCHI et al., 2014 NNAMCHI, C. I.; OKOLO, B. N.; MONEKE, A. N. Grain and malt quality properties of some improved Nigerian sorghum varieties. Journal of the Institute of Brewing, v. 120, p. 353-359, 2014. ). As altas perdas dos grãos de sorgo são atribuídas à temperatura de maltagem predominante nos cenários tropicais (30 °C), a qual é adequada para a germinação desse cereal ( AGU; PALMER, 1998 AGU, R. C.; PALMER, G. H. A reassessment of sorghum for lager-beer brewing. Bioresource Technology, v. 66, n. 3, p. 253-261, 1998. http://dx.doi.org/10.1016/S0960-8524(98)00047-9.
http://dx.doi.org/10.1016/S0960-8524(98...
; OGU et al., 2006 OGU, E. O.; ODIBO, F. J. C.; AGU, R. C.; PALMER, G. H. Quality assessment of different sorghum varieties for their brewing potential. Journal of the Institute of Brewing , v. 112, n. 2, p. 117-121, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00241.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
). As MWL, assim como outros parâmetros de qualidade, são influenciados pela variedade de sorgo. Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
estudaram seis variedades, com 144 h (seis dias) de germinação, e a perda mais alta (27,56%) foi verificada com a variedade Meko, e a perda mais baixa (19,91%), com a variedade Teshale. Igualmente, Nnamchi et al. (2014) NNAMCHI, C. I.; OKOLO, B. N.; MONEKE, A. N. Grain and malt quality properties of some improved Nigerian sorghum varieties. Journal of the Institute of Brewing, v. 120, p. 353-359, 2014. reportaram que, das 10 variedades avaliadas, a maior perda (37,74%) ocorreu com a variedade White Kaura e a menor (13,77%), com a variedade Boboje. Na maltagem, minimizar as perdas e conseguir a modificação necessária dos grãos são metas essenciais para o bom desenvolvimento do processo.
1.2.1.2 Poder diastático
Conforme Novellie (1959) NOVELLIE, L. Kaffircorn malting and brewing studies. III. Determination of amylases in kaffircorn malts. Journal of the Science of Food and Agriculture, v. 10, n. 8, p. 441-449, 1959. http://dx.doi.org/10.1002/jsfa.2740100808.
http://dx.doi.org/10.1002/jsfa.27401008...
, o poder diastático é a capacidade de ambas as enzimas, α e β-amilase, de hidrolisar o amido em açúcares menores. Graus Lintner (°L) e unidades diastáticas de sorgo (SDU), unidades usadas para expressar o DP, são definidos como a quantidade de atividade enzimática, sob condições determinadas, em dependência do método usado. O autor acrescentou que um grau Lintner é equivalente a meio SDU g -1. É recomendado que o DP do sorgo esteja entre 60 e 80 SDU g-1 (30 °L e 40 °L) ( NOVELLIE, 1962b NOVELLIE, L. Kaffircorn malting and brewing studies. XIII. Variation of diastatic power with variety, season, maturity and age of grain. Journal of the Science of Food and Agriculture , v. 13, n. 2, p. 124-126, 1962b. http://dx.doi.org/10.1002/jsfa.2740130212.
http://dx.doi.org/10.1002/jsfa.27401302...
), e que seja de 80 °L para a cevada ( PALMER et al., 1989 PALMER, G. H.; ETOKAKPAN, O. U.; IGYOR, M. A. Sorghum as brewing material. MIRCEN Journal of Applied Microbiology and Biotechnology, v. 5, n. 3, p. 265-275, 1989. http://dx.doi.org/10.1007/BF01741756.
http://dx.doi.org/10.1007/BF01741756 ...
). O malte de sorgo tem baixo DP, quando comparado ao DP do malte de cevada; assim, o DP é uns dos parâmetros de qualidade mais importantes. O uso de compostos químicos, em baixa concentração na imersão, tais como álcalis, pode melhorar o poder diastático. Por exemplo, é recomendado o uso de até 0,3% de Ca(OH)2, KOH ou NaOH ( DEWAR et al., 1997 DEWAR, J.; TAYLOR, J. R. N.; BERJAK, P. Determination of improved steeping conditions for Sorghum malting. Journal of Cereal Science, v. 26, n. 1, p. 129-136, 1997. http://dx.doi.org/10.1006/jcrs.1996.0101.
http://dx.doi.org/10.1006/jcrs.1996.010...
). Por outro lado, Lefyedi e Taylor (2006) LEFYEDI, M. L.; TAYLOR, J. R. N. Effect of dilute alkaline steeping on the microbial contamination, toxicity and diastatic power of sorghum malt. Journal of the Institute of Brewing , v. 112, n. 2, p. 108-116, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00240.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
reportaram que, além de aumentar o DP, a imersão dos grãos em 0,2% de NaOH é um método recomendado para o controle da contaminação bacteriana e fúngica, durante a maltagem. O poder diastático é influenciado pela temperatura e pela quantidade de água absorvida durante a imersão. Ebbah et al. (2015) EBBAH, L.; LARYEA, D.; BARIMAH, J.; DJAMEH, C. Effect of steeping temperature on the quality of malt and Pito (an indigenous Ghanaian drink). Journal of the Institute of Brewing , v. 121, n. 4, p. 518-523, 2015. http://dx.doi.org/10.1002/jib.265.
http://dx.doi.org/10.1002/jib.265 ...
reportaram que, a 40 °C, a quantidade de água absorvida pela cultivar ( Tabela 1 ), na imersão, contribui para o alto DP (88,1 SDU g-1), devido ao fato de se ter criado um ambiente propício para o desenvolvimento das enzimas. Além disso, o tempo de germinação e a variedade também influenciam o DP. Geralmente, o DP aumenta com o aumento do tempo de germinação em até 120 h ( DJAMEH et al., 2015 DJAMEH, C.; SAALIA, F. K.; SINAYOBYE, E.; BUDU, A.; ESSILFIE, G.; MENSAH-BROWN, H.; SEFA-DEDEH, S. Optimization of the sorghum malting process for pito production in Ghana. Journal of the Institute of Brewing, v. 121, n. 1, p. 106-112, 2015. http://dx.doi.org/10.1002/jib.191.
http://dx.doi.org/10.1002/jib.191 ...
; ABUAJAH et al., 2016a ABUAJAH, C. I.; OGBONNA, A. C.; ONWUKA, N. U.; UMOREN, P. E.; OJUKWU, M. Effect of varietal differences and germination period on some malting and brewing potentials of new improved sorghum varieties (SAMSORG17, SAMSORG14, and SAMSORG40) from Nigeria. International Food Research Journal, v. 23, n. 4, p. 1600-1608, 2016a. Disponível em: <http://www.ifrj.upm.edu.my/23%20(04)%202016/(33).pdf>. Acesso em: 19 nov. 2015.
http://www.ifrj.upm.edu.my/23%20(04)%20...
). Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
chegaram a um tempo de germinação ótimo de 96 h para obter alto DP, nas cultivares estudadas ( Tabela 1 ). Nesse tempo, obtiveram valores entre 23,91 °L e 31,39 °L para as variedades 76T1#23 e Gambella 1107, respectivamente. Ogu et al. (2006) OGU, E. O.; ODIBO, F. J. C.; AGU, R. C.; PALMER, G. H. Quality assessment of different sorghum varieties for their brewing potential. Journal of the Institute of Brewing , v. 112, n. 2, p. 117-121, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00241.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
obtiveram, com um tempo de germinação maior (120 h), com a cultivar KSV 4, o maior valor de DP (30 °L), similar ao obtido por Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
.
1.2.1.3 Extrato em água fria
Conforme Ezeogu e Okolo (1999) EZEOGU, L. I.; OKOLO, B. N. Relationship between some sorghum malt quality characteristics and nature of alkaline steep. Journal of the Institute of Brewing, v. 105, n. 1, p. 49-54, 1999. http://dx.doi.org/10.1002/j.2050-0416.1999.tb00005.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
, o extrato em água fria é um dos indicadores úteis da modificação do malte e representa os produtos solúveis da hidrólise enzimática durante o processo de maltagem. Estes produtos são açúcares disponíveis e aminoácidos localizados no endosperma. Acrescentaram que o valor de CWE do malte bem modificado é cerca de 20%. O CWE também mostra uma tendência de aumentar com o aumento do tempo de germinação entre 96 h e 168 h ( PATHIRANA et al., 1983 PATHIRANA, R. A.; SIVAYOGASUNDARAM, K.; JAYATISSA, P. M. Optimisation of conditions for malting of sorghum. Journal of Food Science and Technology, v. 20, n. 3, p. 108-111, 1983. ) e pode ser melhorado com um tratamento alcalino durante a imersão ( OKOLO; EZEOGU, 1996 OKOLO, B. N.; EZEOGU, L. I. Enhancement of amylolytic potential of sorghum malts by alkaline steep treatment. Journal of the Institute of Brewing, v. 102, n. 2, p. 79-85, 1996. http://dx.doi.org/10.1002/j.2050-0416.1996.tb00897.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). O CWE, assim como as MWL e o DP, também é influenciado pela variedade. Nnamchi et al. (2014) NNAMCHI, C. I.; OKOLO, B. N.; MONEKE, A. N. Grain and malt quality properties of some improved Nigerian sorghum varieties. Journal of the Institute of Brewing, v. 120, p. 353-359, 2014. estudaram a maltagem, realizada com 24 h de imersão, 96 h de germinação e 24 h de secagem a 48 °C, de 10 cultivares de sorgo ( Tabela 1 ), e os valores de CWE variaram entre 14,80% e 22,50% nas cultivares ICSV III e SK 5912, respectivamente. Mas, em um estudo anterior feito por Ogu et al. (2006) OGU, E. O.; ODIBO, F. J. C.; AGU, R. C.; PALMER, G. H. Quality assessment of different sorghum varieties for their brewing potential. Journal of the Institute of Brewing , v. 112, n. 2, p. 117-121, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00241.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
, com 40 h de imersão, com um período de quatro horas de AR, 120 h de germinação e 16 h de secagem a 50°C, atingiram-se valores mais altos, de 31% para a cultivar KSV 8 e de 36% para as restantes cultivares (SK5912, KSV 4 e ICSV 400). No período de AR, os grãos ficam expostos ao ar por um tempo predeterminado, antes de preencher novamente o recipiente com água fresca ( DEWAR et al., 1997 DEWAR, J.; TAYLOR, J. R. N.; BERJAK, P. Determination of improved steeping conditions for Sorghum malting. Journal of Cereal Science, v. 26, n. 1, p. 129-136, 1997. http://dx.doi.org/10.1006/jcrs.1996.0101.
http://dx.doi.org/10.1006/jcrs.1996.010...
). Além das características próprias dos grãos, as quais podem ter uma importante influência, isso pode ser devido às condições de maltagem usadas pelos autores citados. Assim, maiores tempos de imersão, com períodos de AR, e de germinação podem aumentar os valores de CWE. Igualmente, Pathirana et al. (1983) PATHIRANA, R. A.; SIVAYOGASUNDARAM, K.; JAYATISSA, P. M. Optimisation of conditions for malting of sorghum. Journal of Food Science and Technology, v. 20, n. 3, p. 108-111, 1983. , entre 48 h e 144 h de germinação, obtiveram valores superiores de CWE com 18 h (21% a 32%) e com 32 h (21% a 31%) de imersão, quando comparados com os CWE obtidos com 8 h (17% a 28%). Do mesmo modo, esses estudos mostram que tempos de imersão, entre 24 h e 40 h, com períodos de AR e tempos de germinação entre 120 h e 168 h, são recomendados para a maltagem de sorgo, em termos de CWE.
1.2.1.4 Extrato em água quente
O extrato em água quente é uma medida da quantidade de materiais solúveis lixiviados em água sob condições de mosturação a 65 °C ( AGU; PALMER, 1998 AGU, R. C.; PALMER, G. H. A reassessment of sorghum for lager-beer brewing. Bioresource Technology, v. 66, n. 3, p. 253-261, 1998. http://dx.doi.org/10.1016/S0960-8524(98)00047-9.
http://dx.doi.org/10.1016/S0960-8524(98...
) e é composto, principalmente, por açúcares fermentáveis ( KUMAR et al., 2013 KUMAR, D.; KUMAR, V.; VERMA, R. P. S.; KHARUB, A. S.; SHARMA, I. Quality parameter requirement and standards for malt barley-a review. Agricultural Reviews, v. 34, n. 4, p. 313-317, 2013. http://dx.doi.org/10.5958/j.0976-0741.34.4.018.
http://dx.doi.org/10.5958/j.0976-0741.3...
). O valor mínimo recomendado de HWE é de 80%, em peso seco ( AALBERS; EERDE, 1986 AALBERS, V. J.; EERDE, P. Centenary review evaluation of malt quality. Journal of the Institute of Brewing, v. 92, n. 5, p. 420-425, 1986. http://dx.doi.org/10.1002/j.2050-0416.1986.tb04434.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
assinalaram que HWE é um dos mais importantes parâmetros de qualidade do malte. Altos níveis de maltose podem ser obtidos a partir do HWE do malte de sorgo. Pathirana et al. (1983) PATHIRANA, R. A.; SIVAYOGASUNDARAM, K.; JAYATISSA, P. M. Optimisation of conditions for malting of sorghum. Journal of Food Science and Technology, v. 20, n. 3, p. 108-111, 1983. obtiveram, a partir da variedade amarela (IS 2941), 89,3% de maltose com 18 h de imersão e 144 h de germinação. No estudo posterior, feito por Okoli et al. (2010) OKOLI, E. V.; OKOLO, B. N.; MONEKE, A. N.; IRE, F. S. Effects of cultivar an germination time on amynolitic potential, extract yield and wort fermenting properties of malting sorgum. Asian Journal of Biotechnology, v. 2, n. 1, p. 14-26, 2010. http://dx.doi.org/10.3923/ajbkr.2010.14.26.
http://dx.doi.org/10.3923/ajbkr.2010.14...
, encontraram que a maltose constituiu o principal açúcar fermentável (74% a 80% do total) nas cultivares ( Tabela 1 ), entre 120 h e 144 h de germinação. O HWE, assim como o PD, também mostra uma tendência de aumentar com o incremento do tempo de germinação em até 144 h e 168 h ( HASSANI et al., 2014 HASSANI, A.; ZARNKOW, M.; BECKER, T. Influence of malting conditions on sorghum ( Sorghum bicolor (L.) Moench) as a raw material for fermented beverages. Food Science & Technology International, v. 20, n. 6, p. 453-463, 2014. http://dx.doi.org/10.1177/1082013213490710. PMid:23751551.
http://dx.doi.org/10.1177/1082013213490...
). Independentemente do tipo de cultivar, geralmente, o HWE aumenta com o aumento do tempo de germinação; contudo, podem ser obtidos valores diferentes de HWE em função da cultivar, mostrando, mais uma vez, a influência desta na qualidade do malte. Por exemplo, com 144 h de germinação, Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
obtiveram o maior teor de HWE (85,08%) com a cultivar Meko, seguida pela Teshale (83,4%), enquanto o valor mais baixo (66,5%) foi observado na Red-Swazi. Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
reportaram um período de maltagem ótimo de 96 h devido ao fato de que o HWE mostrou pouco incremento, depois desse período. Altos valores de HWE podem ser obtidos com o incremento do tempo de imersão, além de períodos de AR e água morna, ao final da etapa. Foram obtidos 310,70 e 303,50 °L kg -1 para as cultivares ICSV 400 e KSV 8, respectivamente ( EZEOGU; OKOLO, 1995 EZEOGU, L. I.; OKOLO, B. N. Effects of air rest periods on malting sorghum response to final warm water steep. Journal of the Institute of Brewing, v. 101, n. 1, p. 39-45, 1995. http://dx.doi.org/10.1002/j.2050-0416.1995.tb00848.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). No caso do malte de sorgo, para obter altos teores de HWE, o método de decantação é mais efetivo do que o método de infusão, usado para o malte de cevada.
1.2.1.5 Atenuação limite
A atenuação limite representa a quantidade de açúcares fermentáveis (geralmente glicose, maltose e maltotriose) presente no mosto preparado a partir do malte. O princípio é que esses açúcares fermentáveis são absorvidos pelas leveduras (na fermentação), resultando na produção de CO2 e etanol ( EBBAH et al., 2015 EBBAH, L.; LARYEA, D.; BARIMAH, J.; DJAMEH, C. Effect of steeping temperature on the quality of malt and Pito (an indigenous Ghanaian drink). Journal of the Institute of Brewing , v. 121, n. 4, p. 518-523, 2015. http://dx.doi.org/10.1002/jib.265.
http://dx.doi.org/10.1002/jib.265 ...
). Portanto, tanto o HWE como a AAL dependem diretamente das enzimas amilolíticas. São recomendados valores de atenuação limite entre 81% e 86% ( ZARNKOW et al., 2007 ZARNKOW, M.; KEßLER, M.; BURBERG, F.; BACK, W.; ARENDT, E. K.; KREISZ, S. KEßLER, M.; BURBERG, F.; BACK, W.; ARENDT, E. K.; KREISZ, S. The use of response surface methodology to optimise malting conditions of proso millet (Panicum miliaceum L.) as a raw material for gluten-free foods. Journal of the Institute of Brewing, v. 113, n. 3, p. 280-292, 2007. http://dx.doi.org/10.1002/j.2050-0416.2007.tb00288.x.
http://dx.doi.org/10.1002/j.2050-0416.2...
). Odibo et al. (2002) ODIBO, F. J. C.; NWANKWO, L. N.; AGU, R. C. Production of malt extract and beer from Nigerian sorghum varieties. Process Biochemistry, v. 37, n. 8, p. 851-855, 2002. http://dx.doi.org/10.1016/S0032-9592(01)00286-2.
http://dx.doi.org/10.1016/S0032-9592(01...
obtiveram, com uma temperatura de imersão de 30 °C, melhores resultados de AAL, 78% e 82%, para as duas cultivares nigerianas de sorgo, SK 5912 e Fara fara, respectivamente, se comparados com a faixa de AAL (71,43% a 78,95%) obtida por Ebbah et al. (2015) EBBAH, L.; LARYEA, D.; BARIMAH, J.; DJAMEH, C. Effect of steeping temperature on the quality of malt and Pito (an indigenous Ghanaian drink). Journal of the Institute of Brewing , v. 121, n. 4, p. 518-523, 2015. http://dx.doi.org/10.1002/jib.265.
http://dx.doi.org/10.1002/jib.265 ...
com a cultivar Kadaga, com 30 °C e 40 °C na imersão, respectivamente. Isto se deve a uma quantidade maior de açúcares fermentáveis presentes nas cultivares SK 5912 e Fara fara do que na Kadaga. Além disso, se o mosto contém altas concentrações de maltotriose (parcialmente fermentável por algumas cepas de leveduras) e dextrinas, resultará em uma atenuação limite inferior. Djameh et al. (2015) DJAMEH, C.; SAALIA, F. K.; SINAYOBYE, E.; BUDU, A.; ESSILFIE, G.; MENSAH-BROWN, H.; SEFA-DEDEH, S. Optimization of the sorghum malting process for pito production in Ghana. Journal of the Institute of Brewing, v. 121, n. 1, p. 106-112, 2015. http://dx.doi.org/10.1002/jib.191.
http://dx.doi.org/10.1002/jib.191 ...
reportaram que a AAL da cultivar Chireh foi significativamente influenciada pelo tempo de imersão. A atenuação limite aumentou de 74,24% até 78,68% entre 12 h e 22 h de imersão, mas decresceu ligeiramente de 78,21% para 77,23%, com o incremento da temperatura de secagem de 30 °C até 40 °C, ficando praticamente constante entre 40 °C e 50 °C. O maior valor foi atingido com 22 h de imersão e 120 h de germinação.
1.2.1.6 Nitrogênio amino livre
Conforme Knatchbull e Slaughter (1987) KNATCHBULL, F. B.; SLAUGHTER, C. The effect of low CO2 pressures on the absorption of amino acids and production of flavour-active volatiles by yeast. Journal of the Institute of Brewing, v. 93, n. 5, p. 420-424, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04530.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
, o nitrogênio amino livre do mosto representa a maior fonte de nitrogênio assimilável pelas leveduras, na produção de cerveja. Há relatos de que os níveis necessários são entre 100 e 150 mg L -1, para manter satisfatórios o crescimento das leveduras e a fermentação ( PIERCE, 1987 PIERCE, J. S. The role of nitrogen in brewing. Journal of the Institute of Brewing , v. 93, n. 5, p. 378-381, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04520.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). Assim como o DP e o HWE, o FAN é influenciado pelo tempo de germinação e pela variedade. Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
reportaram que o aumento do tempo de germinação resultou em um consistente incremento nos valores de FAN nas cultivares estudadas ( Tabela 1 ). Com 144 h, foi obtido o mínimo valor (232,73 mg L-1) do FAN com a cultivar Teshale e o máximo valor (343,29 mg L-1) com a cultivar 76T1#23. Evans e Taylor (1990) EVANS, D. J.; TAYLOR, J. R. N. Extraction and assay of proteolytic activities in sorghum malt. Journal of the Institute of Brewing, v. 96, n. 4, p. 201-207, 1990. http://dx.doi.org/10.1002/j.2050-0416.1990.tb01028.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
também reportaram o incremento da atividade proteolítica do malte de sorgo com o incremento do tempo de germinação. Os valores reportados por Bekele et al. (2012) BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
http://dx.doi.org/10.1002/jib.19 ...
são marcantemente superiores àqueles considerados ótimos para a fermentação, devido ao fato de que os valores do FAN foram determinados a partir dos maltes inteiros, ou seja, incluindo as raízes secas, as quais são ricas em FAN. Sob as mesmas condições de maltagem ( Tabela 1 ), foram obtidos por Nnamchi et al. (2014) NNAMCHI, C. I.; OKOLO, B. N.; MONEKE, A. N. Grain and malt quality properties of some improved Nigerian sorghum varieties. Journal of the Institute of Brewing, v. 120, p. 353-359, 2014. diferentes valores de FAN com a cultivar SK 5912 (185 mg L-1) e com a cultivar Nafelen (109 mg L-1). Várias razões podem explicar essas diferenças, tais como condições de cultivo e ambientais, e composição dos grãos. Esse fato demonstra que a cultivar tem um papel chave nos parâmetros de qualidade do malte de sorgo.
1.2.1.7 Nitrogênio solúvel total e Índice de Kolbach
Conforme Evans e Taylor (1990) EVANS, D. J.; TAYLOR, J. R. N. Extraction and assay of proteolytic activities in sorghum malt. Journal of the Institute of Brewing, v. 96, n. 4, p. 201-207, 1990. http://dx.doi.org/10.1002/j.2050-0416.1990.tb01028.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
, a atividade proteolítica pode ser medida em termos de solubilização do nitrogênio total e do FAN, pela ação das enzimas proteinases e carboxipeptidases, respectivamente. A solubilização das proteínas durante a maltagem, expressa como TSN, está relacionada com o KI. Conforme Hassani et al. (2014) HASSANI, A.; ZARNKOW, M.; BECKER, T. Influence of malting conditions on sorghum ( Sorghum bicolor (L.) Moench) as a raw material for fermented beverages. Food Science & Technology International, v. 20, n. 6, p. 453-463, 2014. http://dx.doi.org/10.1177/1082013213490710. PMid:23751551.
http://dx.doi.org/10.1177/1082013213490...
, o Índice de Kolbach é a relação porcentual entre nitrogênio solúvel e o nitrogênio total presente nos grãos. São recomendados valores de KI perto de 40% ( JIN et al., 2012 JIN, Y.; DU, J.; ZHANG, K.; XIE, L.; LI, P. Relationship between Kolbach index and other quality parameters of wheat malt. Journal of the Institute of Brewing, v. 118, n. 1, p. 57-62, 2012. http://dx.doi.org/10.1002/jib.15.
http://dx.doi.org/10.1002/jib.15 ...
). Os grãos de cevada e de sorgo apresentam teores similares de nitrogênio total ( AGU; PALMER, 1999 AGU, R. C.; PALMER, G. H. Comparative development of soluble nitrogen in the malts of barley and sorghum. Process Biochemistry, v. 35, n. 5, p. 497-502, 1999. http://dx.doi.org/10.1016/S0032-9592(99)00092-8.
http://dx.doi.org/10.1016/S0032-9592(99...
; AGU; PALMER, 2013 AGU, R. C.; PALMER, G. H. Evaluation of the potentials of millet, sorghum and barley with similar nitrogen contents malted at their optimum germination temperatures for use in brewing. Journal of the Institute of Brewing, v. 119, n. 4, p. 258-264, 2013. http://dx.doi.org/10.1002/jib.91.
http://dx.doi.org/10.1002/jib.91 ...
). No entanto, a habilidade para produzir nitrogênio solúvel é diferente em ambos os maltes. Também, outro fato importante é que ambos os cereais mostram alto potencial para o desenvolvimento do DP com o tempo de germinação, mas, com a atividade proteolítica, é diferente. Por exemplo, com similar nitrogênio total (% seco), 1,63 e 1,60 para a cevada e o sorgo, respectivamente, Agu e Palmer (2013) AGU, R. C.; PALMER, G. H. Evaluation of the potentials of millet, sorghum and barley with similar nitrogen contents malted at their optimum germination temperatures for use in brewing. Journal of the Institute of Brewing, v. 119, n. 4, p. 258-264, 2013. http://dx.doi.org/10.1002/jib.91.
http://dx.doi.org/10.1002/jib.91 ...
reportaram que, às 120 h de germinação, o DP e o nitrogênio solúvel foram 46 °L e 0,65% e 32 °L e 0,45%, para a cevada e o sorgo, respectivamente. Os autores acrescentaram que não há uma relação clara entre o desenvolvimento do DP e o nível de proteólise resultante da liberação de nitrogênio solúvel durante a maltagem dos dois cereais. Seus resultados confirmam que o sorgo tem potencial, em termos de qualidade (DP, HWE e nitrogênio solúvel), para ser usado na fabricação de cerveja, quando se trabalha nas condições ótimas ( Tabela 2 ) de maltagem e usa-se o método de mosturação por decantação em vez do método de infusão. Por outra parte, os resultados de Hassani et al. (2014) HASSANI, A.; ZARNKOW, M.; BECKER, T. Influence of malting conditions on sorghum ( Sorghum bicolor (L.) Moench) as a raw material for fermented beverages. Food Science & Technology International, v. 20, n. 6, p. 453-463, 2014. http://dx.doi.org/10.1177/1082013213490710. PMid:23751551.
http://dx.doi.org/10.1177/1082013213490...
mostraram que um maior grau de imersão (umidade ao final da imersão) e um maior tempo de germinação levaram a altos Índices de Kolbach (30,30%). Portanto, estes estudos mostram que as limitações do sorgo na produção de cerveja podem ser minimizadas com a otimização do processo de maltagem e a etapa de mosturação. Na Tabela 1 , são apresentados alguns dos fatores que têm otimizado parâmetros de qualidade do malte de sorgo.
2 Mosturação
Os objetivos da mosturação são de formar e de extrair, em solução, açúcares fermentáveis, aminoácidos, vitaminas etc., a partir do malte. Dentre as principais enzimas envolvidas na hidrólise do amido estão α e β-amilase, dextrinase limite e α-glicosidase. Além disso, são muito importantes as enzimas proteolíticas, as quais hidrolisam as proteínas. A eficiência da mosturação depende do desenvolvimento dessas enzimas, na maltagem, e do regime de temperatura e tempo usado na mosturação. Conforme Brosnan et al. (1992) BROSNAN, M. P.; KELLY, C. T.; FOGARTY, W. M. Investigation of the mechanisms of irreversible thermoinactivation of Bacillus stearothermophilus α-amylase. European Journal of Biochemistry, v. 203, n. 1-2, p. 225-231, 1992. http://dx.doi.org/10.1111/j.1432-1033.1992.tb19850.x. PMid:1730228.
http://dx.doi.org/10.1111/j.1432-1033.1...
, a α-amilase catalisa a hidrólise aleatória das ligações glicosídicas α (1,4) internas, liberando pequenos oligossacarídeos e glicose. Já a β-amilase atua na penúltima ligação glicosídica (1,4), na extremidade não redutora, liberando maltose ( MA et al., 2000 MA, Y.; STEWART, D. C.; EGLINTON, J. K.; LOGUE, S. J.; LANGRIDGE, P.; EVANS, D. E. Comparative enzyme kinetics of two allelic forms of Barley (Hordeum vulgare L.) beta-amylase. Journal of Cereal Science, v. 31, n. 3, p. 335-344, 2000. http://dx.doi.org/10.1006/jcrs.2000.0303.
http://dx.doi.org/10.1006/jcrs.2000.030...
). Ambas as enzimas não hidrolisam as ligações α (1,6), mas a dextrinase limite realiza essa função ( MANNERS et al., 1970 MANNERS, D. J.; MARSHALL, J. J.; YELLOWLEES, D. The specificity of cereal limit dextrinases. The Biochemical Journal, v. 116, n. 3, p. 539-541, 1970. http://dx.doi.org/10.1042/bj1160539. PMid:5435695.
http://dx.doi.org/10.1042/bj1160539 ...
). Outra enzima que catalisa a hidrólise das ligações α (1,4) é a α-glicosidase, liberando glicose a partir das ligações terminais não redutoras ( TAYLOR; DEWAR, 1994 TAYLOR, B. J. R. N.; DEWAR, J. Role of alpha-glucosidase in the fermentable sugar composition of sorghum malt mashes. Journal of the Institute of Brewing, v. 100, n. 6, p. 417-419, 1994. http://dx.doi.org/10.1002/j.2050-0416.1994.tb00840.x.
http://dx.doi.org/10.1002/j.2050-0416.1...
). Por outra parte, as enzimas proteolíticas (ou proteases) catalisam a quebra de grandes moléculas de proteínas, hidrolisando ligações peptídicas, liberando pequenos fragmentos de proteínas ou aminoácidos livres como produtos ( OGBONNA, 2009 OGBONNA, A. C. Proteolytic enzymes and protein modification in malting sorghum: a review. Master Brewers Association of the Americas Technical Quarterly, v. 10, n. 1, p. 1-6, 2009. http://dx.doi.org/10.1094/TQ-46-3-0714-01.
http://dx.doi.org/10.1094/TQ-46-3-0714-...
). A Tabela 3 apresenta valores de pH e de temperatura ótimos para cada uma destas enzimas, as quais são ativadas na mosturação. A mosturação pode ser feita por infusão ou por decantação. Um estudo feito por Ndubisi et al. (2016) NDUBISI, C. F.; OKAFOR, E. T.; AMADI, O. C.; NWAGU, T. N.; OKOLO, B. N.; MONEKE, A. N.; ODIBO, F. J. C.; OKORO, P. M.; AGU, R. C. Effect of malting time, mashing temperature and added commercial enzymes on extract recovery from a Nigerian malted yellow sorghum variety. Journal of the Institute of Brewing, v. 122, n. 1, p. 156-161, 2016. http://dx.doi.org/10.1002/jib.307.
http://dx.doi.org/10.1002/jib.307 ...
sobre a mosturação por infusão (temperatura constante de 65 °C) de uma variedade amarela de sorgo a 65° C resultou em baixos valores de HWE (100 °L kg-1). Já com enzimas comerciais, tanto a 65 °C como a 85 °C, os valores de HWE melhoraram, indicando a temperatura de 65 °C como a mais adequada para o HWE, 300 °L kg-1. Alternativamente, para atingir o mesmo objetivo, a mosturação pode ser feita a 85°C sem a adição de enzimas comerciais, para reduzir custos. A mosturação por decantação (decocção) é amplamente aplicada na África ( LYUMUGABE et al., 2015 LYUMUGABE, F.; GROS, J.; BAJYANA SO, E.; THONART, P. Sorghum beer brewing using eleusine coracana “Finger Millet” to improve the saccharification. American Journal of Food Technology, v. 10, n. 4, p. 167-175, 2015. http://dx.doi.org/10.3923/ajft.2015.167.175.
http://dx.doi.org/10.3923/ajft.2015.167...
). A decantação usada por Agu e Palmer (2013) AGU, R. C.; PALMER, G. H. Evaluation of the potentials of millet, sorghum and barley with similar nitrogen contents malted at their optimum germination temperatures for use in brewing. Journal of the Institute of Brewing, v. 119, n. 4, p. 258-264, 2013. http://dx.doi.org/10.1002/jib.91.
http://dx.doi.org/10.1002/jib.91 ...
consistiu na obtenção do extrato a 30 °C por 30 min, decantação do extrato enzimático, fervura do extrato residual até 100 °C, para gelatinizar o amido, e, quando frio, misturar ambos os mostos para realizar a mosturação a 65 °C por 1 h. Com esse método, os autores atingiram um valor de HWE do malte de sorgo (ver Tabela 1 ) superior ao valor de HWE do malte de cevada (323 °L kg-1), quando foi usado o método de infusão (65 °C por 1 h). Por outra parte, a mosturação por decantação produz mostos com maior quantidade de açúcares fermentáveis, quando comparada à mosturação por infusão. Por exemplo, Archibong et al. (2015) ARCHIBONG, E. J.; ONUORA, V. C.; USOEGBU, O.; EZEMBA, C. C. Mashing studies of two (2) improved sorghum varieties (SK5912 and CSR01) using crude enzyme extract from Aspergillus sydowii.
World Journal of Pharmacy and Pharmaceutical Sciences , v. 4, p. 113-125, 2015. estudaram ambos os métodos, usando enzimas a partir de Aspergillus sydowii , com duas variedades de sorgo. Quando usado o método de infusão, as concentrações de glicose, maltose, maltotriose e dextrina foram 26,41, 13,33, 8,24 e 9,26 mg mL-1 com enzimas e 25,91, 12,7, 4,72 e 11,55 mg mL-1 sem enzimas, respectivamente, para a variedade SK5912. Já os resultados foram inferiores no mosto da variedade CSR01, em que as concentrações de glicose, maltose, maltotriose e dextrinas foram 19,59, 3,7, 4,07 e 4,33 mg mL-1 com enzimas e 15,18, 3,65, 3,91 e 5 mg mL-1 sem enzimas, respectivamente. No entanto, quando feita a mosturação por decantação, os resultados foram melhores. Para a variedade SK5912, as concentrações de glicose, maltose, maltotriose e dextrina foram 37,71, 25,77, 17,48 e 9,33 mg mL-1 com enzimas e 21,27, 10,91, 8,8 e 14,45 mg L-1 sem enzimas, respectivamente.
Já para a variedade CSR01, os valores foram 31,06, 15,57, 8,28 e 4,32 mg mL-1 com enzimas e 23,16, 12,38, 8,19 e 4,35 mg mL-1 sem enzimas. Como observado na maltagem, a variedade também influencia na etapa de mosturação. As diferenças observadas por esses autores nos açúcares fermentáveis podem ser decorrentes do nível de enzimas hidrolíticas de cada variedade. Deste modo, quando se trabalha com malte de sorgo, a mosturação por decantação é mais adequada do que a mosturação por infusão, constituído assim um método de otimização.
3 Considerações finais
O conhecimento dos fatores que influenciam o processo de maltagem e a etapa de mosturação permite o entendimento necessário do processo de produção de bebidas fermentadas com sorgo. Os fatores que otimizam os parâmetros de qualidade do malte, tais como tempo e temperatura de imersão, de germinação e de secagem, assim como o pH e a temperatura das enzimas, e o apropriado método de mosturação, resumidos na presente revisão, fornecem informações que podem apoiar a escolha do malte de sorgo como substituto do malte de cevada. Considerando-se as vantagens do sorgo, dos pontos de vista agronômico e alimentar, os estudos já existentes fornecem informações capazes de sustentar a utilização do seu malte para esse fim.
Agradecimentos
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Processo nº 870130/2011-0), pelo apoio financeiro e por concessão de bolsa a Yanet Boffill Rodríguez.
-
Cite as : Use of sorghum malt in brewing: review. Braz. J. Food Technol., v. 21, e2017198, 2018.
Referências
- AALBERS, V. J.; EERDE, P. Centenary review evaluation of malt quality. Journal of the Institute of Brewing, v. 92, n. 5, p. 420-425, 1986. http://dx.doi.org/10.1002/j.2050-0416.1986.tb04434.x.
» http://dx.doi.org/10.1002/j.2050-0416.1986.tb04434.x - ABUAJAH, C. I.; OGBONNA, A. C.; ONWUKA, N. U.; UMOREN, P. E.; OJUKWU, M. Effect of varietal differences and germination period on some malting and brewing potentials of new improved sorghum varieties (SAMSORG17, SAMSORG14, and SAMSORG40) from Nigeria. International Food Research Journal, v. 23, n. 4, p. 1600-1608, 2016a. Disponível em: <http://www.ifrj.upm.edu.my/23%20(04)%202016/(33).pdf>. Acesso em: 19 nov. 2015.
» http://www.ifrj.upm.edu.my/23%20(04)%202016/(33).pdf - ABUAJAH, C. I.; OGBONNA, A. C.; SONDE, C. U.; OFFIA-OLUA, B.; OWHOEKE, E. Variety and germination time effect on total β-glucan, water-insoluble β-glucan, water-soluble β-glucan components and β-glucanase levels in improved sorghum varieties SK5912, KSV8 and ICSV400 before and after malting and their relationships to wort viscosity. Journal of the Institute of Brewing, v. 122, n. 1, p. 93-101, 2016b. http://dx.doi.org/10.1002/jib.300.
» http://dx.doi.org/10.1002/jib.300 - AGU, R. C.; PALMER, G. H. Enzymic breakdown of endosperm proteins of sorghum at different malting temperatures. Journal of the Institute of Brewing, v. 102, n. 6, p. 415-418, 1996. http://dx.doi.org/10.1002/j.2050-0416.1996.tb00924.x.
» http://dx.doi.org/10.1002/j.2050-0416.1996.tb00924.x - AGU, R. C.; PALMER, G. H. The effect of temperature on the modification of sorghum and barley during malting. Process Biochemistry, v. 32, n. 6, p. 501-507, 1997. http://dx.doi.org/10.1016/S0032-9592(97)00002-2.
» http://dx.doi.org/10.1016/S0032-9592(97)00002-2 - AGU, R. C.; PALMER, G. H. A reassessment of sorghum for lager-beer brewing. Bioresource Technology, v. 66, n. 3, p. 253-261, 1998. http://dx.doi.org/10.1016/S0960-8524(98)00047-9.
» http://dx.doi.org/10.1016/S0960-8524(98)00047-9 - AGU, R. C.; PALMER, G. H. Comparative development of soluble nitrogen in the malts of barley and sorghum. Process Biochemistry, v. 35, n. 5, p. 497-502, 1999. http://dx.doi.org/10.1016/S0032-9592(99)00092-8.
» http://dx.doi.org/10.1016/S0032-9592(99)00092-8 - AGU, R. C.; PALMER, G. H. Evaluation of the potentials of millet, sorghum and barley with similar nitrogen contents malted at their optimum germination temperatures for use in brewing. Journal of the Institute of Brewing, v. 119, n. 4, p. 258-264, 2013. http://dx.doi.org/10.1002/jib.91.
» http://dx.doi.org/10.1002/jib.91 - AISEN, A. O.; MUTS, G. C. J. Micro-scale malting and brewing studies of some sorghum varieties. Journal of the Institute of Brewing, v. 93, n. 4, p. 328-331, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04513.x.
» http://dx.doi.org/10.1002/j.2050-0416.1987.tb04513.x - ARCHIBONG, E. J.; ONUORA, V. C.; USOEGBU, O.; EZEMBA, C. C. Mashing studies of two (2) improved sorghum varieties (SK5912 and CSR01) using crude enzyme extract from Aspergillus sydowii. World Journal of Pharmacy and Pharmaceutical Sciences , v. 4, p. 113-125, 2015.
- ARENDT, E. K.; SCHNITZENBAUMER, B. Brewing with up to 40% unmalted oats (Avena sativa ) and sorghum (Sorghum bicolor): a review. Journal of the Institute of Brewing, v. 120, p. 315-330, 2014.
- BEKELE, A.; BULTOSA, G.; BELETE, K. The effect of germination time on malt quality of six sorghum (Sorghum bicolor) varieties grown at Melkassa, Ethiopia. Journal of the Institute of Brewing, v. 118, n. 1, p. 76-81, 2012. http://dx.doi.org/10.1002/jib.19.
» http://dx.doi.org/10.1002/jib.19 - BROSNAN, M. P.; KELLY, C. T.; FOGARTY, W. M. Investigation of the mechanisms of irreversible thermoinactivation of Bacillus stearothermophilus α-amylase. European Journal of Biochemistry, v. 203, n. 1-2, p. 225-231, 1992. http://dx.doi.org/10.1111/j.1432-1033.1992.tb19850.x. PMid:1730228.
» http://dx.doi.org/10.1111/j.1432-1033.1992.tb19850.x - CLAVER, I. P.; ZHANG, H.; LI, Q.; ZHOU, H.; ZHU, K. Optimized conditions of steeping and germination and their effect on sorghum [Sorghum bicolor (L.) Moench] composition. Pakistan Journal of Nutrition, v. 9, n. 7, p. 686-695, 2010. http://dx.doi.org/10.3923/pjn.2010.686.695.
» http://dx.doi.org/10.3923/pjn.2010.686.695 - DEWAR, J.; TAYLOR, J. R. N.; BERJAK, P. Determination of improved steeping conditions for Sorghum malting. Journal of Cereal Science, v. 26, n. 1, p. 129-136, 1997. http://dx.doi.org/10.1006/jcrs.1996.0101.
» http://dx.doi.org/10.1006/jcrs.1996.0101 - DJAMEH, C.; SAALIA, F. K.; SINAYOBYE, E.; BUDU, A.; ESSILFIE, G.; MENSAH-BROWN, H.; SEFA-DEDEH, S. Optimization of the sorghum malting process for pito production in Ghana. Journal of the Institute of Brewing, v. 121, n. 1, p. 106-112, 2015. http://dx.doi.org/10.1002/jib.191.
» http://dx.doi.org/10.1002/jib.191 - DUFOUR, J. P.; MÉLOTTE, L.; SREBRNIK, S. Sorghum malts for the production of lager beer. Journal of the American Society of Brewing Chemists, v. 50, n. 3, p. 110-119, 1992. http://dx.doi.org/10.1094/ASBCJ-50-0110.
» http://dx.doi.org/10.1094/ASBCJ-50-0110 - EBBAH, L.; LARYEA, D.; BARIMAH, J.; DJAMEH, C. Effect of steeping temperature on the quality of malt and Pito (an indigenous Ghanaian drink). Journal of the Institute of Brewing , v. 121, n. 4, p. 518-523, 2015. http://dx.doi.org/10.1002/jib.265.
» http://dx.doi.org/10.1002/jib.265 - EL-NOUR, M. E. M.; YAGOUB, S. O. Partial purification and characterization of α and β-Amylase isolated from Sorghum bicolor c.v. (Feterita) malt. Journal of Applied Sciences, 2010, 10: 1314-1319.
- EVANS, D. J.; TAYLOR, J. R. N. Extraction and assay of proteolytic activities in sorghum malt. Journal of the Institute of Brewing, v. 96, n. 4, p. 201-207, 1990. http://dx.doi.org/10.1002/j.2050-0416.1990.tb01028.x.
» http://dx.doi.org/10.1002/j.2050-0416.1990.tb01028.x - EZEOGU, L. I.; OKOLO, B. N. Effects of air rest periods on malting sorghum response to final warm water steep. Journal of the Institute of Brewing, v. 101, n. 1, p. 39-45, 1995. http://dx.doi.org/10.1002/j.2050-0416.1995.tb00848.x.
» http://dx.doi.org/10.1002/j.2050-0416.1995.tb00848.x - EZEOGU, L. I.; OKOLO, B. N. Relationship between some sorghum malt quality characteristics and nature of alkaline steep. Journal of the Institute of Brewing, v. 105, n. 1, p. 49-54, 1999. http://dx.doi.org/10.1002/j.2050-0416.1999.tb00005.x.
» http://dx.doi.org/10.1002/j.2050-0416.1999.tb00005.x - FASANO, A.; CATASSI, C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology, v. 120, n. 3, p. 636-651, 2001. http://dx.doi.org/10.1053/gast.2001.22123. PMid:11179241.
» http://dx.doi.org/10.1053/gast.2001.22123 - FOOD AND AGRICULTURE ORGANIZATION – FAO. Produces prices – annual . Rome: FAO, 2015. Disponível em: <http://www.fao.org/faostat/en/#data/PP>
» http://www.fao.org/faostat/en/#data/PP - GOMES, L. O. F.; SANTIAGO, R. A. C.; KOAKUZU, S. N.; BASSINELLO, P. Z. Estabilidade microbiológica e físico-química de misturas para bolo sem glúten e qualidade dos bolos prontos para consumo. Brazilian Journal of Food Technology, v. 17, n. 4, p. 283-295, 2014. http://dx.doi.org/10.1590/1981-6723.0914.
» http://dx.doi.org/10.1590/1981-6723.0914 - HARDIE, D. G.; MANNERS, D. J.; YELLOWLEES, D. The limit dextrinase from malted sorghum (Sorghum vulgare). Carbohydrate Research, v. 50, n. 1, p. 75-85, 1976. http://dx.doi.org/10.1016/S0008-6215(00)84084-7. PMid:975121.
» http://dx.doi.org/10.1016/S0008-6215(00)84084-7 - HASSANI, A.; ZARNKOW, M.; BECKER, T. Influence of malting conditions on sorghum ( Sorghum bicolor (L.) Moench) as a raw material for fermented beverages. Food Science & Technology International, v. 20, n. 6, p. 453-463, 2014. http://dx.doi.org/10.1177/1082013213490710. PMid:23751551.
» http://dx.doi.org/10.1177/1082013213490710 - JIN, Y.; DU, J.; ZHANG, K.; XIE, L.; LI, P. Relationship between Kolbach index and other quality parameters of wheat malt. Journal of the Institute of Brewing, v. 118, n. 1, p. 57-62, 2012. http://dx.doi.org/10.1002/jib.15.
» http://dx.doi.org/10.1002/jib.15 - KNATCHBULL, F. B.; SLAUGHTER, C. The effect of low CO2 pressures on the absorption of amino acids and production of flavour-active volatiles by yeast. Journal of the Institute of Brewing, v. 93, n. 5, p. 420-424, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04530.x.
» http://dx.doi.org/10.1002/j.2050-0416.1987.tb04530.x - KUMAR, D.; KUMAR, V.; VERMA, R. P. S.; KHARUB, A. S.; SHARMA, I. Quality parameter requirement and standards for malt barley-a review. Agricultural Reviews, v. 34, n. 4, p. 313-317, 2013. http://dx.doi.org/10.5958/j.0976-0741.34.4.018.
» http://dx.doi.org/10.5958/j.0976-0741.34.4.018 - LEFYEDI, M. L.; TAYLOR, J. R. N. Effect of dilute alkaline steeping on the microbial contamination, toxicity and diastatic power of sorghum malt. Journal of the Institute of Brewing , v. 112, n. 2, p. 108-116, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00240.x.
» http://dx.doi.org/10.1002/j.2050-0416.2006.tb00240.x - LYUMUGABE, F.; GROS, J.; BAJYANA SO, E.; THONART, P. Sorghum beer brewing using eleusine coracana “Finger Millet” to improve the saccharification. American Journal of Food Technology, v. 10, n. 4, p. 167-175, 2015. http://dx.doi.org/10.3923/ajft.2015.167.175.
» http://dx.doi.org/10.3923/ajft.2015.167.175 - MA, Y.; STEWART, D. C.; EGLINTON, J. K.; LOGUE, S. J.; LANGRIDGE, P.; EVANS, D. E. Comparative enzyme kinetics of two allelic forms of Barley (Hordeum vulgare L.) beta-amylase. Journal of Cereal Science, v. 31, n. 3, p. 335-344, 2000. http://dx.doi.org/10.1006/jcrs.2000.0303.
» http://dx.doi.org/10.1006/jcrs.2000.0303 - MANNERS, D. J.; MARSHALL, J. J.; YELLOWLEES, D. The specificity of cereal limit dextrinases. The Biochemical Journal, v. 116, n. 3, p. 539-541, 1970. http://dx.doi.org/10.1042/bj1160539. PMid:5435695.
» http://dx.doi.org/10.1042/bj1160539 - MARIANI, M.; OLIVEIRA, V. R.; FACCIN, R.; RIOS, A. O.; VENZKE, J. G. Elaboração e avaliação de biscoitos sem glúten a partir de farelo de arroz e farinhas de arroz e de soja. Brazilian Journal of Food Technology, v. 18, n. 1, p. 70-78, 2015. http://dx.doi.org/10.1590/1981-6723.6514.
» http://dx.doi.org/10.1590/1981-6723.6514 - MEZGEBE, A. G.; ABEGAZ, K.; TAYLOR, J. R. N. Relationship between waxy (high amylopectin) and high protein digestibility traits in sorghum and malting quality. Journal of Cereal Science, v. 79, p. 319-327, 2018. http://dx.doi.org/10.1016/j.jcs.2017.11.015.
» http://dx.doi.org/10.1016/j.jcs.2017.11.015 - MOKHAWA, G.; KERAPELETSWE-KRUGER, C. K.; EZEOGU, L. I. Electrophoretic analysis of malting degradability of major sorghum reserve proteins. Journal of Cereal Science , v. 58, n. 1, p. 191-199, 2013. http://dx.doi.org/10.1016/j.jcs.2013.05.008.
» http://dx.doi.org/10.1016/j.jcs.2013.05.008 - NDUBISI, C. F.; OKAFOR, E. T.; AMADI, O. C.; NWAGU, T. N.; OKOLO, B. N.; MONEKE, A. N.; ODIBO, F. J. C.; OKORO, P. M.; AGU, R. C. Effect of malting time, mashing temperature and added commercial enzymes on extract recovery from a Nigerian malted yellow sorghum variety. Journal of the Institute of Brewing, v. 122, n. 1, p. 156-161, 2016. http://dx.doi.org/10.1002/jib.307.
» http://dx.doi.org/10.1002/jib.307 - NNAMCHI, C. I.; OKOLO, B. N.; MONEKE, A. N. Grain and malt quality properties of some improved Nigerian sorghum varieties. Journal of the Institute of Brewing, v. 120, p. 353-359, 2014.
- NOVELLIE, L. Kaffircorn malting and brewing studies. III. Determination of amylases in kaffircorn malts. Journal of the Science of Food and Agriculture, v. 10, n. 8, p. 441-449, 1959. http://dx.doi.org/10.1002/jsfa.2740100808.
» http://dx.doi.org/10.1002/jsfa.2740100808 - NOVELLIE, L. Kaffir corn malting and brewing studies XII. Effect of malting conditions on malting losses and total amylases activity. Journal of the Science of Food and Agriculture , v. 13, n. 2, p. 121-123, 1962a. http://dx.doi.org/10.1002/jsfa.2740130211.
» http://dx.doi.org/10.1002/jsfa.2740130211 - NOVELLIE, L. Kaffircorn malting and brewing studies. XIII. Variation of diastatic power with variety, season, maturity and age of grain. Journal of the Science of Food and Agriculture , v. 13, n. 2, p. 124-126, 1962b. http://dx.doi.org/10.1002/jsfa.2740130212.
» http://dx.doi.org/10.1002/jsfa.2740130212 - ODIBO, F. J. C.; NWANKWO, L. N.; AGU, R. C. Production of malt extract and beer from Nigerian sorghum varieties. Process Biochemistry, v. 37, n. 8, p. 851-855, 2002. http://dx.doi.org/10.1016/S0032-9592(01)00286-2.
» http://dx.doi.org/10.1016/S0032-9592(01)00286-2 - OGBONNA, A. C. Proteolytic enzymes and protein modification in malting sorghum: a review. Master Brewers Association of the Americas Technical Quarterly, v. 10, n. 1, p. 1-6, 2009. http://dx.doi.org/10.1094/TQ-46-3-0714-01.
» http://dx.doi.org/10.1094/TQ-46-3-0714-01 - OGBONNA, A. C. Current developments in malting and brewing trials with sorghum in Nigeria: a review. Journal of the Institute of Brewing, v. 117, n. 3, p. 394-400, 2011. http://dx.doi.org/10.1002/j.2050-0416.2011.tb00485.x.
» http://dx.doi.org/10.1002/j.2050-0416.2011.tb00485.x - OGU, E. O.; ODIBO, F. J. C.; AGU, R. C.; PALMER, G. H. Quality assessment of different sorghum varieties for their brewing potential. Journal of the Institute of Brewing , v. 112, n. 2, p. 117-121, 2006. http://dx.doi.org/10.1002/j.2050-0416.2006.tb00241.x.
» http://dx.doi.org/10.1002/j.2050-0416.2006.tb00241.x - OKOLI, E. V.; OKOLO, B. N.; MONEKE, A. N.; IRE, F. S. Effects of cultivar an germination time on amynolitic potential, extract yield and wort fermenting properties of malting sorgum. Asian Journal of Biotechnology, v. 2, n. 1, p. 14-26, 2010. http://dx.doi.org/10.3923/ajbkr.2010.14.26.
» http://dx.doi.org/10.3923/ajbkr.2010.14.26 - OKOLO, B. N.; EZEOGU, L. I. Enhancement of amylolytic potential of sorghum malts by alkaline steep treatment. Journal of the Institute of Brewing, v. 102, n. 2, p. 79-85, 1996. http://dx.doi.org/10.1002/j.2050-0416.1996.tb00897.x.
» http://dx.doi.org/10.1002/j.2050-0416.1996.tb00897.x - OWUAMA, C. I. Sorghum: a cereal with lager beer brewing potential. World Journal of Microbiology & Biotechnology, v. 13, n. 3, p. 253-260, 1997. http://dx.doi.org/10.1023/A:1018566503879.
» http://dx.doi.org/10.1023/A:1018566503879 - OWUAMA, C. I.; OKAFOR, N. Studies on mashing methods for beer brewing with sorghum. MIRCEN Journal of Applied Microbiology and Biotechnology, v. 3, n. 3, p. 243-253, 1987. http://dx.doi.org/10.1007/BF00933578.
» http://dx.doi.org/10.1007/BF00933578 - PALMER, G. H.; ETOKAKPAN, O. U.; IGYOR, M. A. Sorghum as brewing material. MIRCEN Journal of Applied Microbiology and Biotechnology, v. 5, n. 3, p. 265-275, 1989. http://dx.doi.org/10.1007/BF01741756.
» http://dx.doi.org/10.1007/BF01741756 - PATHIRANA, R. A.; SIVAYOGASUNDARAM, K.; JAYATISSA, P. M. Optimisation of conditions for malting of sorghum. Journal of Food Science and Technology, v. 20, n. 3, p. 108-111, 1983.
- PIERCE, J. S. The role of nitrogen in brewing. Journal of the Institute of Brewing , v. 93, n. 5, p. 378-381, 1987. http://dx.doi.org/10.1002/j.2050-0416.1987.tb04520.x.
» http://dx.doi.org/10.1002/j.2050-0416.1987.tb04520.x - SILVA, C.; BRITO, J.; SOUZA, M. Z.; SILVEIRA, A.; LUVIELMO, M. M.; SALAS, M. M. Adição de colágeno em pão sem glúten elaborado com farinha de arroz. Brazilian Journal of Food Technology, v. 20, p. 2-10, 2017.
- TAYLOR, B. J. R. N.; DEWAR, J. Role of alpha-glucosidase in the fermentable sugar composition of sorghum malt mashes. Journal of the Institute of Brewing, v. 100, n. 6, p. 417-419, 1994. http://dx.doi.org/10.1002/j.2050-0416.1994.tb00840.x.
» http://dx.doi.org/10.1002/j.2050-0416.1994.tb00840.x - TAYLOR, J. R. N.; ROBBINS, D. J. Factors influencing beta-amylase activity in sorghum malt. Journal of the Institute of Brewing, v. 99, n. 5, p. 413-416, 1993. http://dx.doi.org/10.1002/j.2050-0416.1993.tb01181.x.
» http://dx.doi.org/10.1002/j.2050-0416.1993.tb01181.x - TOKPOHOZIN, S. E.; FISCHER, S.; BECKER, T. Assessment of malting and mash bio-acidification on the turnover of sorghum cyanogenic glucoside and protein hydrolysis improvement. Lebensmittel-Wissenschaft + Technologie, v. 90, p. 303-309, 2018. http://dx.doi.org/10.1016/j.lwt.2017.12.043.
» http://dx.doi.org/10.1016/j.lwt.2017.12.043 - URIYO, M.; EIGEL, W. E. Duration of kilning treatment on α-amylase, β-amylase and endo-(1, 3) (1, 4)-β-D- glucanase activity of malted sorghum (Sorghum bicolor). Process Biochemistry, v. 35, n. 5, p. 433-436, 1999. http://dx.doi.org/10.1016/S0032-9592(99)00071-0.
» http://dx.doi.org/10.1016/S0032-9592(99)00071-0 - ZARNKOW, M.; KEßLER, M.; BURBERG, F.; BACK, W.; ARENDT, E. K.; KREISZ, S. KEßLER, M.; BURBERG, F.; BACK, W.; ARENDT, E. K.; KREISZ, S. The use of response surface methodology to optimise malting conditions of proso millet (Panicum miliaceum L.) as a raw material for gluten-free foods. Journal of the Institute of Brewing, v. 113, n. 3, p. 280-292, 2007. http://dx.doi.org/10.1002/j.2050-0416.2007.tb00288.x.
» http://dx.doi.org/10.1002/j.2050-0416.2007.tb00288.x
Datas de Publicação
-
Publicação nesta coleção
18 Out 2018 -
Data do Fascículo
2018
Histórico
-
Recebido
14 Mar 2017 -
Aceito
21 Jun 2018