SHORT COMMUNICATION COMUNICAÇÃO
Detecção de Meloidogyne mayaguensis em goiabeira e mamoeiro no estado de Goiás, usando marcadores moleculares
Detection of Meloidogyne mayaguensis on guava and papaya in Goiás State of Brazil using molecular markers
Kércya M.S. de SiqueiraI; Vânia M. FreitasI; Maria Ritta A. AlmeidaI; Marcilene F.A. dos SantosI; Juvenil A. CaresII; Myrian S. TiganoI; Regina M.D.G. CarneiroI
IEMBRAPA Recursos Genéticos e Biotecnologia, 70849-979, Brasília, DF, Brasil
IIDepartamento de Fitopatologia, Universidade de Brasília, 79919-970 Brasília, DF, Brasil
RESUMO
Meloidogynemayaguensis foi detectado pela primeira vez no estado de Goiás, em duas propriedades (Formosa e Luziânia), causando dano em pomares comerciais de goiaba (Psidium guajava) cv. Paluma de um ano de idade e de 14 anos, respectivamente. Plantas infectadas pelo nematóide mostraram redução de crescimento, clorose generalizada, deficiência nutricional e redução qualitativa e quantitativa de produção. As raízes severamente infestadas apresentaram-se pouco desenvolvidas e deformadas pela presença de múltiplas galhas de tamanho variado. Mamoeiros (Carica papaya) cv. Formosa, plantados em consórcio com as goiabeiras na propriedade de Formosa, apresentaram numerosas galhas no sistema radicular, embora, nenhum sintoma secundário de meloidoginose tenha sido observado na parte aérea. A produção de frutos dos mamoeiros foi alta, evidenciando tolerância dessa cultivar ao nematóide. O fenótipo M2 para a isoenzima esterase (Rm: 0,7, 0,9) foi detectado e M. mayaguensis identificado em ambas as culturas e propriedades. As análises com marcadores moleculares espécie-específica usando primers que amplificam regiões intergênicas do DNA ribossomal e do DNA mitocondrial também confirmaram esse diagnóstico. Levantamento realizado, em outras localidades da fazenda em Formosa mostrou a presença de Meloidogyne javanica em baixa população, corroborando a idéia de introdução de M. mayaguensis na área, através do plantio de mudas infectadas, oriundas da região de Petrolina. Na propriedade em Luziânia, o nematóide é provavelmente de ocorrência natural, considerando-se a idade das plantas e o número reduzido de goiabeiras infectadas.
Palavras-chave: fenótipo de esterase, DNA ribossômico, DNA mitocondrial, identificação, nematóide das galhas.
ABSTRACT
Meloidogyne mayaguensis was reported for the first time in the State of Goiás (Formosa and Luziânia), causing damage in one-year old and 14 year-old commercial guava (Psidium guajava) cv. Paluma orchards. Plants infected by the nematode showed symptoms such as stunted growth, general chlorosis, nutrient deficiency and consequent decline in yield quality and quantity. Severely infested root systems were poorly developed, distorted by small and large multiple galls and devoid of fine roots. Plants of papaya cv. Formosa were cultivated in consortium with guava in the Formosa orchard and presented several galls in the root system, but no root-knot-nematode secondary symptoms were observed in the aerial part. The production of papaya fruits was high, evidencing tolerance of this cultivar to the nematode. The M2 phenotype (Rm: 0.7, 0.9) was detected for the isoenzyme esterase and M. mayaguensis wasidentified in both crops and orchards. The analyses with species-specific molecular markers using primers that amplify intergenic regions of the ribosomal DNA and the mitochondrial DNA confirmed the same diagnosis. Surveys carried out in other localities of the farm in Formosa detected the presence of Meloidogyne javanica in low population, corroborating the idea that M. mayaguensis was introduced from the Petrolina nursery with planting materials. In the Luziânia orchard the nematode probably occurs naturally, considering the age of plants and the small numbers of infected guavas.
Keywords: esterase phenotype, ribosomal DNA, mitochondrial DNA, identification, root-knot nematode.
A exploração comercial de plantas de goiabeira (Psidiumguajava) é afetada por problemas fitossanitários, com destaque ao parasitismo dos nematóides do gênero Meloidogyne Goeldi, os quais são responsáveis pela inviabilização do cultivo em áreas altamente infestadas, causando migração da cultura para novas áreas (El Borai & Duncan, 2005). Meloidogyne mayaguensis Rammanh & Hirschmann 1988, é uma espécie polífaga, com alta taxa de reprodução e grande capacidade de disseminação no país. Foi assinalada pela primeira vez no Brasil, em raízes de goiabeira nos municípios de Petrolina PE, Curaçá e Maniçoba BA, causando sérios prejuízos econômicos (Carneiro et al., 2001). A partir de então, esse nematóide vem sendo detectado parasitando goiabeiras em plantios comerciais nos estados do Rio de Janeiro (Lima et al., 2003), Rio Grande do Norte (Torres et al., 2004), Ceará (Torres et al., 2005), São Paulo (Almeida et al., 2006), Paraná (Carneiro et al., 2006), Piauí (Silva et al., 2006), Espírito Santo (Lima et al., 2007), Paraíba (Gomes et al., 2007) Mato Grosso do Sul (Asmus et al., 2007), Santa Catarina (Gomes et al., 2006) e Rio Grande do Sul (Gomes et al., 2008).
Meloidogyne mayaguensis causa sérios danos econômicos em goiabeiras afetando a qualidade e quantidade da produção dos frutos. De acordo, com levantamento realizado por Moreira e colaboradores (2003) no Vale do Submédio São Francisco, M. mayaguensis foi encontrado, associado com raízes de goiabeira, em todas as amostras analisadas, demonstrando estar amplamente disseminado na cultura e na região. Nessa mesma região, ocorreu um aumento de 70% das áreas infestadas nos últimos sete anos, provocando um decréscimo da área cultivada de 6.000 para 1.669 ha (Carneiro et al., 2007). Além disso, o período de exploração econômica do pomar de goiabeiras, que em condições ideais de desenvolvimento é em torno de 20 anos (Barbosa, 2001), tem sido reduzido para quatro ou cinco anos em pomares infestados pelo nematóide. O objetivo do presente estudo foi relatar a ocorrência de Meloidogyne mayaguensis em plantas de goiabeiras em dois municípios do estado de Goiás, consorciadas ou não com plantas de mamoeiro em área comerciais, empregando marcadores moleculares.
Em janeiro de 2008, na Fazenda Barreiro do Rodeador, situada no município de Formosa GO, foi observado que plantas de goiabeira cv. Paluma de um ano de idade, apresentavam sintomas de amarelecimento, redução no desenvolvimento vegetativo da parte aérea e deficiência nutricional. O sistema radicular encontrava-se mal desenvolvido, por vezes deformado pela presença de galhas de dimensões variadas, e geralmente desprovido de raízes finas, com intenso descortiçamento e infecções secundárias causadas por outros microorganismos. As goiabeiras foram consorciadas com plantas de mamoeiro (Carica papaya) cv. Formosa produzidas na região de Formosa GO, as quais não apresentavam nenhum sintoma secundário de meloidoginose na parte aérea, além de elevada produtividade e excelente qualidade de frutos. Entretanto, o sistema radicular apresentou numerosas galhas de tamanhos diversos com ausência de necroses. Aos 18 meses, os mamoeiros completaram seu ciclo e foram cortados, permanecendo todo o sistema radicular no pomar de goiabeira. Em fevereiro de 2009, em uma área de 96 ha plantada com goiabeiras de 14 anos de idade na Agroindústria Agriter Goiás Verde, situada no Município Luziânia, foram observadas cerca de 300 goiabeiras com os mesmos sintomas de meloidoginose descritos acima.
Para efetivação do estudo foram coletadas amostras compostas de raízes e solo das plantas de goiabeira sintomáticas, bem como das plantas de mamoeiro consorciadas. Coletaram-se também raízes de mamoeiro, cultivados em outra área da plantação em sistema de monocultivo, além de outras espécies vegetais utilizadas na pastagem dos animais da fazenda. As amostras foram coletadas em pontos próximos à linha de projeção da copa na faixa de profundidade de 0-30 cm, onde foram encontradas as raízes mais jovens e ativas. Após a coleta, as amostras foram acondicionadas em sacos plásticos e levadas ao laboratório de Nematologia da EMBRAPA Recursos Genéticos e Biotecnologia. Brasília DF, para serem processadas e analisadas.
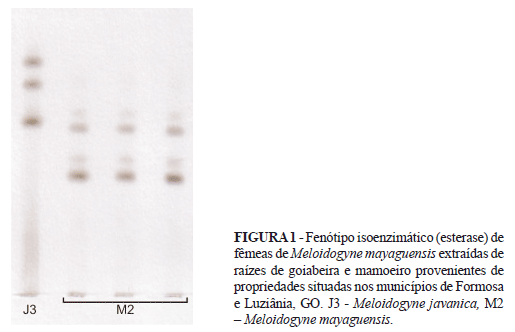
Foram realizadas análises isoenzimáticas a partir de fêmeas coletadas nas raízes de goiabeira (Carneiro & Almeida, 2001). As análises dos perfis enzimáticos de todas as amostras da duas área de plantio revelaram o fenótipo de esterase (Est M2), com duas bandas principais (RM:0,70 e 0,90) e duas bandas menos intensas (Rm: 0,75, 0,95). Esse fenótipo foi caracterizado anteriormente por Carneiro et al. (2000, 2001) como típico de M. mayaguensis. A espécie M. javanica (Treub) Chitwood (Est J3) foi utilizada como padrão para essa enzima (Figura 1). Nas raízes de mamoeiro, consorciadas com goiabeira em Formosa também foi detectada a presença de M. mayaguensis. No entanto, na área de monocultivo de mamoeiro foi encontrado apenas o perfil enzimático típico da espécie M. javanica (Est J3, Rm:1,0, 1,25, 1,4). Com o objetivo de confirmar o diagnóstico por meio de marcadores moleculares, as populações obtidas nas duas propriedades foram multiplicadas em tomateiro (Lycopersicum esculentum) cv. Santa Cruz em condições de casa de vegetação. Decorrido o período de três meses após a inoculação das plantas, procedeu-se a extração dos ovos pelo método descrito por Carneiro et al. (2004) e extração do DNA genômico pelo método de Randig et al. (2002). O DNA genômico foi utilizado para a análise da região intergênica entre os genes 5S e 18S do DNA ribossomal (IGS) e da região mitocondrial (mtDNA) entre os genes citocromo oxidase subunidade II (COII) e 18 S rRNA. A amplificação da região IGS foi realizada com o uso dos primers 194 (5'- TTAACTTGCCAGATCGGACG-3') e 195 (5'- TCTAATGAGCCGTACGC-3') (Vahidi et al., 1988). Enquanto, para a amplificação da região do mtDNA foram utilizados os primers C2F3 (5´-GGTCAATGTTCAGAAATTTGTGG-3') e 1108 (5'- TACCTTTGACCAATCACGCT-3') (Powers & Harris, 1993). Esses primers foram sintetizados pela empresa Prodimol (Belo Horizonte MG). As reações de PCR foram realizadas em volume final de 25 µL contendo: 1,5 µL de DNA (3ng/ µL); 14,7 µL de água MilliQ; 2,5 µL de tampão de reação 10x; 4 µL de dNTPs (1,25 µM); 0,3 µL de Taq DNA polimerase (Phoneutria Biotecnologia & Serviços) e 1 µL de cada primer (10 µM). Para as amplificações foi utilizado o termociclador PTC-100 (MJ Research) com o programa de desnaturação inicial de 94ºC por 2 min; 35 ciclos de desnaturação a 94ºC por 30 seg, anelamento a 50ºC por 30 seg e extensão a 72ºC por 2 minutos. Um ciclo de 72ºC por 7 minutos foi realizado ao final. Os fragmentos amplificados foram separados por eletroforese em gel de agarose 1,5% e visualizados com coloração utilizando brometo de etídio.
Esses marcadores permitiram a diferenciação de M. mayaguensis com relação a outras espécies comuns de Meloidogyne devido ao tamanho do produto de amplificação. Os resultados obtidos confirmaram a detecção de M. mayaguensis nas duas propriedades, pois os fragmentos de PCR obtidos foram os mesmos previamente descritos para essa espécie, isto é 780 pb para IGS (Block et al., 1997; Adam et al., 2007) e 705 pb para a região do DNA mitocondrial (Block et al., 2002; Brito et al., 2004; Tigano et al., 2005; Jeyaprakash et al., 2006) (Figura 2).
A espécie M. mayaguensis foi encontrado apenas nas raízes de goiabeiras e mamoeiros na área consorciada em Formosa, em alto nível populacional expresso pelo número de nematóides/grama de raiz (10.890 ovos e J2). No entanto, nas raízes das plantas de mamoeiro cultivadas em monocultivo, foi encontrada apenas M. javanica, em baixa densidade populacional. Esses resultados indicam que M. javanica é nativa nessa propriedade e que M. mayaguensis provavelmente foi introduzida a partir de mudas de goiabeira provenientes de viveiro idôneo (mudas certificadas) da região de Petrolina. Com relação ao padrão de distribuição horizontal de M. mayaguensis observou-se que, até o momento está caracterizada por pontos isolados. Fato que, não corresponde ao padrão de formação de reboleiras esperado para infestações de campo, ocasionadas pelos nematóides formadores de galhas. Isso se torna um indício da introdução recente do nematóide, através de poucas mudas contaminadas, o que corresponde aproximadamente a 2% da área plantada. Contudo, apesar da baixa infestação o consórcio goiabeira - mamoeiro representa um grande risco para a disseminação de M. mayaguensis na área de cultivo, uma vez que o contato radicular entre essa duas espécies vegetais pode acelerar a disseminação desse nematóide na linha de plantio ou mesmo nas entre-linhas. Assevera-se ainda o fato de o mamoeiro por ser tolerante a M. mayaguensis pode mascarar a presença do mesmo em áreas infestadas, uma vez que mamoeiros infestados mantêm uma produtividade elevada sem sintomas reflexos na parte aérea.
Recentemente, mudas de goiabeira provenientes do Espírito Santo, com registro na FRUCAFÉ, também produzidas por viveirista idôneo com produção em substrato e em bancada suspensa, apresentaram galhas e alta incidência de M. mayaguensis. Uma das hipóteses para a contaminação dessas mudas em substrato é a água de irrigação ou a contaminação do próprio substrato. Na propriedade em Luziânia, detectou-se a presença de M. mayaguensis em goiabeiras de 14 anos de idade, com nítida distribuição em reboleiras. Considerando a idade das plantas, ocorrência restrita e a distribuição em manchas é bem provável que nessa área, o nematóide seja de ocorrência natural. Outras detecções de ocorrência natural de M. mayaguensis foram relatadas no Paraná e Mato Grosso do Sul (Carneiro et al., 2006; Asmus et al., 2007).
Uma vez presente na área, o controle com nematicidas sistêmicos torna-se difícil, por se tratar de uma cultura perene, com produção permanente de frutos e não haver nematicidas registrados para essa fruteira. Até o momento, o controle de M. mayaguensis em goiabeira deve ser preventivo, feito preferencialmente através de mudas sadias, plantadas em áreas não infestadas. Embora esse nematóide já tenha sido detectado por Carneiro e colaboradores desde 2001, ainda não existe nenhuma instrução normativa do Ministério da Agricultura que inclua esse patógeno e preveja regras para fiscalização e comercialização de mudas e contenção da sua disseminação.
Recebido 27 Agosto 2008
Aceito 4 Agosto 2009
Autor para Correspondência: Regina M.D.G. Carneiro, e-mail: recar@cenargen.embrapa.br
TPP 8105
Editor de Seção convidado: Vicente P. Campos
- Almeida EJ, Soares PLM, Santos JM, Martins ABG (2006) Ocorrência de Meloidogyne mayaguensis na cultura da goiaba (Psidium guajava) no estado de São Paulo. Nematologia Brasileira 30:112-113.
- Adam MAM, Phillips MS, Blok VC (2007) Molecular diagnostic key for identification of single juveniles of seven common and economically important species of root-knot nematode (Meloidogyne spp.). Plant Pathology 56:190-197.
- Asmus GL, Vicentini EM, Carneiro RMDG (2007) Ocorrência de Meloidogynemayaguensis em goiabeira no Estado de Mato Grosso do Sul. Nematologia Brasileira 31:112. (Resumo)
- Barbosa FR (2001) Goiaba. Fitossanidade. Frutas do Brasil no. 18. Petrolina PE. EMBRAPA Semi-árido e EMBRAPA Informação Tecnológica.
- Block VC, Phillips MS, Fargette M (1997) Comparison of sequences from the ribossomal DNA intergenic region of Meloidogyne mayaguensis and other major root-knot nematodes. Journal of Nematology 29:16-22.
- Block VC, Wishart J., Fargette M, Berthier K, Phillips MS (2002) Mitochondrial DNA differences distinguishing Meloidogyne mayaguensis from the major species of tropical root-knot nematodes. Nematology 4:773-781.
- Brito JA, Powers TO, Mullin PG, Inserra RN, Dickson DW (2004) Morphological and molecular characterization of Meloidogyne mayaguensis isolates from Florida. Journal of Nematology 36:232-240.
- Carneiro RMDG, Almeida MRA, Quénhervé P (2000) Enzyme phenotype of Meloidogyne spp. populations. Nematology 2:645-654.
- Carneiro RMDG, Moreira WA, Almeida MRA, Gomes ACMM (2001) Primeiro registro de Meloidogyne mayaguensis em goiabeira no Brasil. Nematologia Brasileira 25:223-228.
- Carneiro RMDG, Almeida MRA (2001) Técnica de eletroforese usada no estudo de enzimas dos nematóides de galhas para identificação de espécies. Nematologia Brasileira 25:555-560.
- Carneiro RMDG, Tigano MS, Ranging MRA, Almeida MRA, Sarah JL (2004) Identification and genetic diversity of Meloidogyne spp. (Tylenchida: Meloidogynidae) on coffee from Brazil, Central America and Hawaii. Nematology 6:287-298.
- Carneiro RMDG, Mônaco APA, Mortiz MP, Nakamura KC, Scherer A (2006) Identificação de Meloidogyne mayaguensis em goiabeira e em plantas invasoras, em solo argiloso, no Estado do Paraná. Nematologia Brasileira 30:293-298.
- Carneiro RMDG, Cirotto PA, Quintanilha A, Silva DB, Carneiro RG (2007) Resistance to Meloidogynemayaguensis in Psidium spp. accessions and their grafting compatibility with P. guajava cv. Paluma. Fitopatologia Brasileira 32:281-284.
- El Borai FE, Duncan LW (2005) Nematodes parasites of subtropical and tropical fruits tree crops. In: Luc M, Sikora RA, Bridge J (Eds.) Plant parasitic nematodes in subtropical and tropical agriculture. Wallingford UK. CAB International. pp. 467-492.
- Gomes CB, Lima DL, Carneiro RMDG (2006) Ocorrência de Meloidogyne mayaguensis em fumo (Nicotiana tabacum) no Estado de Santa Catarina. Nematologia Brasileira 30:115. (Resumo)
- Gomes AR, Faustino JF, Wilcken SRS, Carneiro RMDG, Ambrósio MMQ, Souza NL (2007) Ocorrência de Meloidogyne mayaguensis em Psidium guajava L. no Estado da Paraíba. Fitopatologia Brasileira 32:273. (Resumo)
- Gomes CB, Couto ME, Carneiro RMDG (2008) Registro de Ocorrência de Meloidogyne mayaguensis em Goiabeira (Psidium guajava L.) e Fumo (Nicotiana tabacum L.) no Sul do Brasil. Nematologia Brasileira 32:244-247.
- Jeyaprakash A, Tigano MS, Brito J, Carneiro RMDG, Dickson DW (2006) Differentiation of Meloidogyne floridensis from M. arenaria using high-fidelity PCR amplified mitochondrial AT-Rich sequences. Nematropica 36:1-12.
- Lima IM, Dolinski CM, Souza RM (2003) Dispersão de Meloidogyne mayaguensis em goiabais de São João da Barra (RJ) e relato de novos hospedeiros dentre plantas invasoras e cultivadas. Nematologia Brasileira 27:257-258.
- Lima IM, Martins MVV, Serrano LAL, Carneiro RMDG (2007) Ocorrência de Meloidogyne mayaguensis em goiabeira cv Paluma no estado do Espírito Santo Resumo. Nematologia Brasileira 31:133. (Resumo)
- Moreira WA, Magalhães EE, Moura AOS, Pereira AVS, Barbosa FR, Lopes DB (2003) Espécies de nematóides das galhas associadas a culturas no Submédio São Francisco. Nematologia Brasileira 27:257.
- Powers TO, Harris TS (1993) A polymerase chain reaction method for identification of five major Meloidogyne species. Journal of Nematology 25:1-6.
- Randig O, Bongiovanni M, Carneiro RMDG, Castagnone-Sereno P (2002) Genetic diversity of root-knot nematodes from Brazil and development of SCAR markers specific for the coffee-damaging species. Genome 45:862-870.
- Silva GS, Atayde Sobrinho C, Pereira AL, Santos JM (2006) Ocorrência de Meloidogyne mayaguensis em goiabeira no Estado do Piauí. Nematologia Brasileira 30:307-309.
- Tigano MS, Carneiro RMDG, Jeyaprakash A, Dickson, DW, Adams B (2005) Phylogeny of Meloidogyne spp. based on 18S rDNA and the intergenic region of mitochondrial DNA sequence. Nematology 7:851-862.
- Torres GRC, Covello VN, Sales Júnior R, Pedrosa EMR, Moura RM (2004) Meloidogyne mayaguensis em Psidium guajava no Rio Grande do Norte. Fitopatologia Brasileira 29:570.
- Torres GRC, Sales Júnior R, Rehn VNC, Pedrosa EMR, Moura RM (2005) Ocorrência de Meloidogyne mayaguensis em goiabeiras no Estado do Ceará. Nematologia Brasileira 29:105-107.
- Vahidi H, Curran J, Nelson DW, Webster JM, McClure MA, Honda BM (1988) Unusual sequences homologous to 5S RNA, in ribossomal DNA repeats of the nematode Meloidogyne arenaria Journal of Molecular Evolution 27:222-227.
Datas de Publicação
-
Publicação nesta coleção
25 Nov 2009 -
Data do Fascículo
Ago 2009