Resumos
Este trabalho teve como objetivo estudar o processo infeccioso de Ramularia areola, agente causal da ramulária, em folhas de algodoeiro utilizando-se a microscopia eletrônica de varredura. Plantas de algodoeiro da cultivar Nu-Opal no estádio V4 foram inoculadas com uma suspensão de 1,5 × 10(5) conídios mL-1 de R. areola. Amostras de folhas foram coletadas 12 horas após a inoculação (h.a.i.) e aos 12 e 22 dias após a inoculação (d.a.i.) e preparadas para observação no microscópio eletrônico de varredura. A partir das 12 h.a.i. após a inoculação das plantas, conídios de R. areola germinaram sem a formação de apressório e a maioria deles produziram dois tubos germinativos que cresceram em direção aos estômatos na tentativa de penetrá-los. Aos 12 e 22 d.a.i., as hifas de R. areola colonizaram, inter e intracelularmente, o mesófilo foliar e a esporulação ocorreu através dos estômatos presentes nas faces adaxial e abaxial da epiderme foliar.
Gossypium hirsutum; patogênese; ramulária
This study aimed to elucidate the infectious process of Ramularia areola, the causal agent of ramularia leaf spot, on cotton leaves by using scanning microscopy. Plants from cotton cultivar Nu-Opal at growth stage V4 were inoculated with a 1.5 × 10(5) conidial suspension of R. areola. Leaf samples were collected at 12 hours after inoculation (h.a.i.) and also at 12 and 22 days after inoculation (d.a.i.) and prepared to be observed under scanning electron microscope. At 12 h.a.i., conidia of R. areola started to germinate without formation of appressoria and most of them produced two germ tubes that grew towards the stomata in an attempt to penetrate them. At 12 and 22 d.a.i., hifa of R. areola colonized, inter and intracellularly, the mesophyll cells and sporulation occurred through the stomata present on both adaxial and abaxial leaf epidermis.
Gossypium hirsutum; pathogenesis; ramularia leaf spot
COMUNICAÇÃO SHORT COMMUNICATION
Microscopia eletrônica de varredura do processo infeccioso de Ramularia areola em folhas de algodoeiro
Scanning microscopy of the infectious process of Ramularia areola on cotton leaves
Carmen R. S. CurveloI; Fabrício A. RodriguesII; Paulo G. BergerI; Dalilla C. RezendeII
IDepartamento de Fitotecnia, Universidade Federal de Viçosa, 36570-000, Viçosa, MG, Brasil
IIDepartamento de Fitopatologia, Universidade Federal de Viçosa, 36570-000, Viçosa, MG, Brasil
RESUMO
Este trabalho teve como objetivo estudar o processo infeccioso de Ramularia areola, agente causal da ramulária, em folhas de algodoeiro utilizando-se a microscopia eletrônica de varredura. Plantas de algodoeiro da cultivar Nu-Opal no estádio V4 foram inoculadas com uma suspensão de 1,5 × 105 conídios mL-1 de R. areola. Amostras de folhas foram coletadas 12 horas após a inoculação (h.a.i.) e aos 12 e 22 dias após a inoculação (d.a.i.) e preparadas para observação no microscópio eletrônico de varredura. A partir das 12 h.a.i. após a inoculação das plantas, conídios de R. areola germinaram sem a formação de apressório e a maioria deles produziram dois tubos germinativos que cresceram em direção aos estômatos na tentativa de penetrá-los. Aos 12 e 22 d.a.i., as hifas de R. areola colonizaram, inter e intracelularmente, o mesófilo foliar e a esporulação ocorreu através dos estômatos presentes nas faces adaxial e abaxial da epiderme foliar.
Palavras-chave: Gossypium hirsutum, patogênese, ramulária.
ABSTRACT
This study aimed to elucidate the infectious process of Ramularia areola, the causal agent of ramularia leaf spot, on cotton leaves by using scanning microscopy. Plants from cotton cultivar Nu-Opal at growth stage V4 were inoculated with a 1.5 × 105 conidial suspension of R. areola. Leaf samples were collected at 12 hours after inoculation (h.a.i.) and also at 12 and 22 days after inoculation (d.a.i.) and prepared to be observed under scanning electron microscope. At 12 h.a.i., conidia of R. areola started to germinate without formation of appressoria and most of them produced two germ tubes that grew towards the stomata in an attempt to penetrate them. At 12 and 22 d.a.i., hifa of R. areola colonized, inter and intracellularly, the mesophyll cells and sporulation occurred through the stomata present on both adaxial and abaxial leaf epidermis.
Keywords:Gossypium hirsutum, pathogenesis, ramularia leaf spot.
O algodoeiro (Gossypium hirsutum L.) é uma das culturas de maior expressão econômica no Brasil por ser um dos pilares da cadeia produtiva têxtil. Entretanto, uma das principais dificuldades no estabelecimento da cotonicultura em diversas regiões do Brasil e do mundo é a ocorrência de doenças. No cerrado do Centro-Oeste, o algodoeiro não é cultivado por mais de dois a quatro anos na mesma área, pois se realiza a rotação com milho ou soja. A sucessão de culturas não é uma prática comum devido ao prolongamento da época de semeadura de dezembro a janeiro e a preferência por cultivares tardia (ciclo superior a 180 dias), estendendo a colheita até meados de setembro (Iamamoto, 2007). O cultivo do algodoeiro por até quatro anos na mesma área acarreta uma maior prevalência de epidemias severas de várias doenças, ao contrário do que ocorre em cultivos consorciados ou com a utilização da rotação de cultura (Suassuna & Coutinho, 2007). Além disso, a indisponibilidade de cultivares com resistência às diversas doenças foliares torna esse panorama mais agravante (Lazarotto et al., 2001).
A ramulária, causada por Ramularia areola G.F. Atk. (teleomorfo Mycosphaerella areola Ehrlich & F.A. Wolf), é uma das principais doenças foliares do algodoeiro em praticamente todas as regiões produtoras dessa cultura no Brasil, principalmente no Centro-Oeste (Suassuna & Coutinho, 2007). Embora considerada no passado como de importância secundária por ocorrer no final do ciclo da cultura, a ramulária passou a ganhar importância econômica devido ao aumento da área cultivada com algodão na região dos Cerrados e uso de cultivares suscetíveis (Lazarotto et al., 2001). A doença causa desfolha precoce e ocasiona perdas de até 30 % quando medidas de controle não são adotadas (Suassuna & Coutinho, 2007). O seu potencial destrutivo é maior em outros países como Madagascar e Índia ocasionando perdas na produção de até 60% (Shivankar & Wangikar, 1992).
Ao estudar a germinação dos conídios de R. areola, Rathaiah (1977) observou que tanto a germinação quanto a emissão do tubo germinativo foram influenciados pela umidade do meio ambiente. Os fungos pertencentes ao gênero Ramularia mostram-se bastante variáveis com relação à germinação, penetração e esporulação nos tecidos dos seus diversos hospedeiros. Salienta-se, ainda, que estudos sobre o processo infeccioso de R. areola em algodoeiro são escassos e várias indagações sobre a patogênese desse fungo precisam ser elucidadas. Assim, esse trabalho teve como objetivo estudar o processo infeccioso de R. areola em folhas de algodoeiro utilizando-se a microscopia eletrônica de varredura (MEV).
Plantas de algodoeiro da cultivar Nu-Opal, suscetível à ramulária, foram crescidas em vasos de plástico contendo 6 kg de substrato composto de uma mistura de solo da classe Argissolo Vermelho Amarelo textura argilosa, areia e esterco de curral na proporção de 3:1:1. A acidez do solo foi corrigida com 2 g de calcário dolomítico kg-1 de substrato. Foram adicionados, ainda, superfosfato simples, sulfato de amônio, cloreto de potássio e sulfato de magnésio (10; 0,75; 0,25 e 0,5 g kg-1 de substrato, respectivamente) cinco dias antes da semeadura. As plantas foram mantidas em casa de vegetação, regadas diariamente e pulverizadas de duas a quatro vezes com o inseticida Endosulfan (0,75 ml L-1).
Folhas de plantas de algodoeiro, também da cultivar Nu-Opal, cultivadas na área experimental da UFV em Coimbra MG, apresentando sintomas típicos da ramulária, foram coletadas e lavadas com água destilada com auxílio de um pincel de cerdas macias para remoção dos conídios de R. areola. Posteriormente, a suspensão obtida foi filtrada em camada dupla de gaze estéril para retirar possíveis impurezas e ajustada para a concentração de 1,5 × 105 conídios mL-1 com auxílio de uma câmara de Neubauer. Plantas de algodoeiro (estádio V4, 30 dias após emergência) (Marur & Ruano, 2001) foram inoculadas com a suspensão de conídios de R. areola utilizando-se um atomizador modelo Devilbs. Cada planta recebeu 15 mL de suspensão até atingir o ponto de escorrimento nas superfícies abaxial e adaxial das folhas. Em seguida, as plantas foram mantidas em câmara de nevoeiro sob temperatura de 25 ± 2ºC e umidade relativa de 90 ± 5 % por 48 h e depois transferidas para casa de vegetação onde permaneceram até o final das coletas das folhas. Um total de 35 fragmentos de folhas medindo aproximadamente 5 cm2 foram coletados das plantas 12 horas após a inoculação (h.a.i.) e aos 12 e 22 dias após a inoculação (d.a.i.). Os fragmentos obtidos foram colocados em frascos de vidro contendo fixativo glutaraldeído 2,5 %, em tampão cacodilato de sódio 0,1 M (pH 7,2) e armazenados em geladeira. Uma semana após, os fragmentos foram lavados com tampão cacodilato de sódio por quatro vezes durante 10 min cada e desidratados em uma série alcoólica de 30, 50, 70, 80, 95 e 100 %, com intervalos de 10 min entre as trocas, sendo realizadas três passagens na última concentração no mesmo intervalo de tempo. As amostras coletadas aos 12 e 22 d.a.i. foram pós-fixadas com tetróxido de ósmio a 1 %, preparado em tampão cacodilato de sódio 0,2 M (pH 7,2) durante duas horas em temperatura ambiente. Após desidratação, os fragmentos foram submetidos à secagem no ponto crítico utilizando-se o aparelho "Critical Point Dryer" (Balzers, modelo CPD020). Alguns fragmentos foram montados sobre suportes metálicos de alumínio previamente cobertos com fita adesiva dupla face. Uma outra parte das amostras foi seccionada transversalmente com auxílio de um bisturi para obtenção de fragmentos de aproximadamente 1 mm de altura. Esses fragmentos foram dispostos sobre os suportes metálicos com a face cortada voltada para cima. Em seguida, todos os fragmentos foram cobertos com ouro por meio de metalização no aparelho "Sputter Coater" acoplado a um "Freezing Drying Unit" (Balzers, FDU010). Os fragmentos foram examinados no microscópio eletrônico de varredura (LEO, modelo 1430VP) operado a 10 Kv para a obtenção das eletromicrografias.
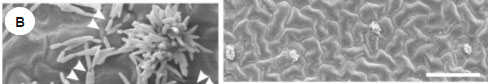
Os conídios de R. areola germinaram sobre a superfície das folhas de algodoeiro a partir das 12 h.a.i. e produziram, na sua maioria, dois tubos germinativos em suas extremidades (Figura 1a). As extremidades dos tubos germinativos direcionaram-se para os estômatos mais próximos passando pelas cristas das células guardas, porém sem penetrá-los (Figura 1b). Em alguns eventos, o tubo germinativo foi encontrado lateralmente às células guardas do estômato, mas sem dirigirem-se para o interior da cavidade sub-estomática, indicando, possivelmente, ausência de quimiotropismo (Figura 1c). Fato semelhante também foi registrado para Puccinia sorghi e Septoria silybi, em folhas de sorgo (Sorghum bicolor) e cardo mariano (Silybum marianum), respectivamente (Wynn, 1981; Moscow & Lindow, 1989). Cerca de 87 % dos conídios germinados de R. areola examinados emitiram mais de um tubo germinativo corroborando com o relato de Zhao et al. (2006) para R. rhei em ruibarbo (Rheum palmatum) e de Stabentheiner et al. (2009) para R. collo-cygni em cevada. Graaf et al. (2002) relataram até quatro tubos germinativos oriundos de um único conídio germinado de Phomaclematidina. Essa grande quantidade de tubos germinativos foi atribuída ao fenômeno denominado de confusão trópica, que nada mais é do que um mecanismo de resistência do hospedeiro para impedir a penetração do patógeno (Wynn, 1981). Babu et al. (2007, 2009), estudando os patossistemas mamona - Cercospora ricinella e mandioca - Cercospora henningsii também não observaram direcionamento dos tubos germinativos dos conídios dessas duas espécies de Cercospora para o interior dos estômatos presentes na superfície adaxial das folhas dos seus hospedeiros.
Os tubos germinativos de R. areola foram de certa forma alongados (Figura 1b), o que leva a hipótese da existência de uma relação nutricional entre esse fungo e a filosfera da folha de algodoeiro. Fato semelhante foi relatado por Ellingboe (1972) para o patossistema cevada-Erysiphe graminis. Não foi constatada a presença de apressórios, nem mesmo rudimentares, nas extremidades dos tubos germinativos formados pelos conídios de R. areola. A penetração no hospedeiro por algumas espécies de fungos, como Pyricularia grisea em arroz, ocorre mediante a formação de um apressório melanizado que necessita de energia oriunda do conídio para garantir a formação de uma alta pressão de turgor necessária para penetrar mecanicamente a camada de cutícula e a parede celular da folha (Howard et al., 1991). De acordo com Rathaiah (1977), conídios de R. areola são capazes de formar apressórios, porém apenas quando as plantas são submetidas às condições de noites com alta umidade relativa e dias secos, condições essas não contempladas no presente trabalho.
A possível penetração de R. areola pelos estômatos, sem nenhum impedimento tigmotrópico, pode contribuir para a eficiência do processo de colonização dos tecidos foliares do algodoeiro. Diversos autores afirmam que a penetração estomatal é a via preferencial para os fungos ingressarem nos tecidos dos seus hospedeiros (Ruehle 1964; Moscow & Lindow 1989). Porém, a relação entre a penetração estomatal e o processo infeccioso de alguns fungos causadores de doenças foliares é complexa. Algumas espécies de fungos biotróficos podem secretar terpenóides que aumentam o fluxo de potássio no interior das células guardas dos estômatos induzindo a contínua abertura dessas estruturas e, consequentemente, a perda excessiva de água pela transpiração foliar (Turner & Graniti, 1969). Os estômatos podem também se fechar quando ocorre a secreção de toxinas não específicas produzidas por patógenos necrotrófico (Arntzen et al., 1973). Não há registro na literatura de fatores de natureza química possivelmente envolvidos com a fase de pré-penetração de R. areola.
A esporulação de R. areola ocorreu com os conidióforos emergindo agrupados através dos estômatos (Figuras 2a-b). A esporulação do fungo pelos estômatos aumentou consideravelmente dos 12 d.a.i. (Figura 2d) para os 22 d.a.i. (Figura 2e). É interessante registrar que a esporulação de R. areola ocorreu por um dos estômatos presente na nervura foliar (Figura 2c). Fungos que colonizam preferencialmente as nervuras das folhas são mais agressivos, pois, em contato direto com os vasos do xilema carreando seiva bruta, podem disseminar suas estruturas reprodutivas, além de toxinas, de forma mais rápida e eficiente a exemplo de Colletotrichum lindemuthianum em feijoeiro (Jerba et al., 2005). No caso do algodoeiro, é raro observar estômatos sob as nervuras. Babu et al. (2009) também relataram o mesmo fato em folhas de mandioca. A presença de conidióforos de R. areola produzindo conídios sobre a nervura leva a deduzir que esse fungo possa ter colonizado os tecidos vasculares do algodoeiro não sendo necessariamente específico para tecidos do mesófilo e ou parênquima. A esporulação de R. areola ocorreu nas faces adaxial e abaxial das folhas (Figura 2f). Resultados semelhantes foram observados para Ramularia sphaeroidea em Vicia sp. (Koike et al., 2004) e C. ricinella em folhas de mamona (Babu et al., 2007). Observou-se uma grande quantidade de hifas de R. areola colonizando inter e intra-celularmente o mesófilo foliar (Figura 2f) a semelhança do que foi relatado para R. collo-cygni em cevada (Stabentheiner et al., 2009). Ocorreu profundo colapso de células aos 22 dai (Figura 2f) indicando um estádio avançado de infecção. De acordo com Huss & Sachs (1998), os primeiros sintomas de manchas foliares causadas por Ramularia collo-cygni em cevada ocorreu a partir dos 7 dai. Entretanto, Huerta-Espino et al. (2006) relataram um período de quase 14 dias para o aparecimento dos primeiros sintomas causados por R. cercosporelloides em folhas de cártamo, o que demonstra uma certa variabilidade fisiológica entre as espécies fúngicas pertencentes ao gênero Ramularia. Em termos práticos, a diagnose precoce da presença do patógeno nos tecidos do seu hospedeiro é importante quando se almeja obter o controle eficiente da doença. Os resultados desse trabalho contribuem com informações que permitem melhor entender o processo infeccioso de R. areola em folhas de algodoeiro, contribuindo, de certa forma, para que as estratégias de controle da ramulária, como a aplicação de fungicidas, sejam maximizadas.
AGRADECIMENTOS
F.Á. Rodrigues e C.R.S. Curvelo agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq pela bolsa de produtividade em pesquisa e de Mestrado, respectivamente. Os autores agradecem ao Núcleo de Microscopia e Microanálise (CCB/UFV) pela utilização do MEV e os equipamentos auxiliares e a Fundação de Amparo à Pesquisa do Estado de Minas Gerais - FAPEMIG pelo apoio financeiro.
Recebido 31 Julho 2009
Aceito 22 Fevereiro 2010
Autor para correspondência: Fabrício A. Rodrigues, e-mail: fabricio@ufv.br
Parte da Dissertação de Mestrado da primeira autora. Universidade Federal de Viçosa. Viçosa MG. 2007.
TPP 9097
Editor de Seção: Luadir Gasparotto
- Arntzen CJ, Haugh MF, Bobick S (1973) Induction of stomatal closure by Helminthosporium maydis pathotoxin. Plant Physiology 52:569-574.
- Babu AM, Philip T, Kumar V (2007) Development of the leaf spot fungus, Cercospora ricinella, on Castor leaf - an SEM account. Journal of Phytopathology 155:426-430.
- Babu AM, Philip T, Kariarpa BK, Kamble CK (2009) Scanning electron microscopy of the infection process of Cercospora henningsii on cassava leaves. Journal of Phytopathology 157:57-62.
- Ellingboe AH (1972) Genetics and physiology of primary infection by Erysiphe graminis Phytopathology 62:401-406.
- Graaf PV, Joseph ME, Chartier-Hollis JM, O'Neill, TM (2002) Pre-penetration stages in infection of clematis by Phoma clematidina Plant Pathology 51:331-337.
- Howard RJ, Ferrari MA, Roach DH, Money NP (1991) Penetration of hard substrates by a fungus employing enormous turgor pressures. Microbiology 88:11281-11284.
- Huerta-Espino J, Constantinescu O, Velasquez C, Herrera-Foessel SA, Figueroa-Lopes P (2006) First report of Ramularia cercosporelloides on Carthamus tinctorius in Northwestern México. Plant Disease 90:1552.
- Huss H, Sachs E (1998) Ramularia-Blattflecken-oder-Sprenkelkrankheit der Gerste. Der Pflanzenarzt 51:15-18.
- Iamamoto MM (2007). Doenças do algodoeiro - interação patógeno-hospedeiro. Jaboticabal SP. Fundação de Apoio a Pesquisa, Ensino e Extensão - FUNEP.
- Jerba VF, Rodella RA, Furtado EL (2005) Relação entre a estrutura foliar de feijoeiro e a pré-infecção por Glomerella cingulata f.sp. phaseoli Pesquisa Agropecuária Brasileira 40:217-223.
- Koike ST, Smith RF, Crous PW, Groenewald JZ (2004) Leaf and stem spot caused by Ramularia sphaeroidea on purple and lana woollypod vetch (Vicia spp.) cover crops in California. Plant Disease 88:221.
- Lazarotto C, Arantes EM, Lamas FM (Eds.) (2001) Algodão: Tecnologia de Produção. Embrapa Agropecuária Oeste. Dourados MS.
- Marur CJ, Ruano O (2001) A reference system for determination of developmental stages of upland cotton. Revista de Oleaginosas e Fibrosas 5:313-317.
- Moscow D, Lindow SE (1989) Infection of milk thistle (Silybum marianum) leaves by Septoria silybi Phytopathology 79:1085-1090.
- Rathaiah Y (1977) Spore germination and mode of cotton infection by Ramularia areola Phytopathology 67:351-357.
- Ruehle GD (1964) A strain of Alternaria citri Ellis & Pierce causing a leaf spot of rough lemon in Florida. Phytopathology 27:863-865.
- Shivankar SK, Wangikar PD (1992) Estimation of crop losses due to grey mildew disease of cotton caused by Ramularia areola Indian Phytopathology 45:74-76.
- Stabentheiner E, Minihofer T, Huss H (2009) Infection of barley by Ramularia collo-cygni: Scanning electron microscopic investigations. Mycopathologia 168:135-143.
- Suassuna ND, Coutinho WM (2007) Manejo das principais doenças do algodoeiro no cerrado brasileiro. In: Freire EC (Ed.) Algodão no Cerrado do Brasil. Brasília DF. Associação Brasileira dos Produtores de Algodão ABRAPA. pp. 479-521.
- Turner NC, Graniti A (1969) Fusicoccin: a fungal toxin that opens stomata. Nature 223:1070-1071.
- Wynn WK (1981) Tropic and taxic responses of pathogens to plants. Annual Review of Phytopathology 19:237-255.
- Zhao Y, Grout BW, Xu X (2006) Effects of temperature on germination and hyphal growth from conidia of Ramuralia rhei and Ascochyta rhei, causing spot diseases of rhubarb (Rheum rhaponticum). Plant Pathology 55:664-670.
Datas de Publicação
-
Publicação nesta coleção
18 Jun 2010 -
Data do Fascículo
Abr 2010
Histórico
-
Recebido
31 Jul 2009 -
Aceito
22 Fev 2010