Resumos
Os sinais clínicos das infecções por Ehrlichia canis e Anaplasma platys são similares, e o diagnóstico desses patógenos feito por esfregaços sanguíneos corados é difícil devido à sensibilidade e especificidade. Por outro lado, os diagnósticos moleculares são altamente sensíveis e específicos, e nested-PCRs têm sido otimizadas para o diagnóstico preciso desses patógenos em cães. Em um Hospital Veterinário Escola, amostras de sangue total com EDTA foram obtidas de 100 cães, e esfregaços foram feitos das amostras de sangue para busca dos parasitos intracelulares. Para cada amostra, DNA foi extraído e submetido à nPCR para detecção de E. canis e A. platys. Os resultados dos esfregaços sanguíneos mostraram que 9% dos animais foram positivos para E. canis e 21% para A. platys. Com relação à nPCR, 57 e 55% dos cães foram positivos para E. canis e A. platys, respectivamente. Quando comparados com a nPCR, os esfregaços sanguíneos corados revelaram resultados falso-negativos para E. canis e A. platys. Os resultados indicam que a nPCR é altamente sensível e específica para detecção de ambos os patógenos, e os diagnósticos moleculares podem ser mais úteis nos Hospitais Veterinários.
nPCR; cães; Ehrlichia; Anaplasma
The clinical signs of Ehrlichia canis and Anaplasma platys infection are similar, and the diagnosis of these pathogens made by stained blood smears is poor due sensibility and specificity. On the other hand, the molecular diagnosis is highly sensitive and specific and nested-PCR have been optimized for accurate diagnosis these pathogens in dogs. At the veterinary teaching hospital, whole-blood samples with EDTA were obtained from 100 dogs and smears were made from blood samples for evaluation for intracellular parasites. For each sample, DNA was extracted and submitted to nPCR analysis for detection of E. canis and A. platys. The results of stained blood smears showed 9% of the animals were positive for E. canis and 21% for A. platys. Regarding of nPCR analysis, 57 and 55% of dogs were positive for E. canis and A. platys respectively. As compared to a nested PCR, the stained blood smears revealed false-negative results for both E. canis and A. platys. The results indicate that the nPCR is highly sensitive and specific for detection of both pathogens and the molecular diagnosis could be more useful at veterinary hospital.
nPCR; dogs; Ehrlichia; Anaplasma
ARTIGO COMPLETO
Comparação de nested-PCR com o diagnóstico direto na detecção de Ehrlichia canis e Anaplasma platys em cães
Comparison of nested-PCR with blood smear examination in detection of Ehrlichia canis and Anaplasma platys in dogs
Carlos A. N. RamosI; Rafael A. N. RamosI; Flábio R. AraújoII; Daniel S. Guedes Jr.III; Ingrid I. F. SouzaII; Tatiana M. OnoIV; Anahi S. VieiraIV; Danillo S. PimentelI; Eduardo O. RosasI, Maria A. G. FaustinoI; Leucio C. AlvesI
ILaboratório de Doenças Parasitárias, Departamento de Medicina Veterinária, Universidade Federal Rural de Pernambuco - UFRPE
IIEmbrapa Gado de Corte - CNPGC
IIIUniversidade Federal Rural do Rio de Janeiro - UFRRJ
IVUniversidade Federal de Mato Grosso do Sul - UFMS
Autor para correspondência Autor para correspondência: Carlos A. N. Ramos Laboratório de Doenças Parasitárias, Departamento de Medicina Veterinária, Universidade Federal Rural de Pernambuco - UFRPE, Av. Dom Manoel de Medeiros s/n, Dois Irmãos, CEP 52171-900, Recife - PE, Brasil e-mail: carlosanramos@yahoo.com.br
RESUMO
Os sinais clínicos das infecções por Ehrlichia canis e Anaplasma platys são similares, e o diagnóstico desses patógenos feito por esfregaços sanguíneos corados é difícil devido à sensibilidade e especificidade. Por outro lado, os diagnósticos moleculares são altamente sensíveis e específicos, e nested-PCRs têm sido otimizadas para o diagnóstico preciso desses patógenos em cães. Em um Hospital Veterinário Escola, amostras de sangue total com EDTA foram obtidas de 100 cães, e esfregaços foram feitos das amostras de sangue para busca dos parasitos intracelulares. Para cada amostra, DNA foi extraído e submetido à nPCR para detecção de E. canis e A. platys. Os resultados dos esfregaços sanguíneos mostraram que 9% dos animais foram positivos para E. canis e 21% para A. platys. Com relação à nPCR, 57 e 55% dos cães foram positivos para E. canis e A. platys, respectivamente. Quando comparados com a nPCR, os esfregaços sanguíneos corados revelaram resultados falso-negativos para E. canis e A. platys. Os resultados indicam que a nPCR é altamente sensível e específica para detecção de ambos os patógenos, e os diagnósticos moleculares podem ser mais úteis nos Hospitais Veterinários.
Palavras-chave: nPCR, cães, Ehrlichia, Anaplasma
ABSTRACT
The clinical signs of Ehrlichia canis and Anaplasma platys infection are similar, and the diagnosis of these pathogens made by stained blood smears is poor due sensibility and specificity. On the other hand, the molecular diagnosis is highly sensitive and specific and nested-PCR have been optimized for accurate diagnosis these pathogens in dogs. At the veterinary teaching hospital, whole-blood samples with EDTA were obtained from 100 dogs and smears were made from blood samples for evaluation for intracellular parasites. For each sample, DNA was extracted and submitted to nPCR analysis for detection of E. canis and A. platys. The results of stained blood smears showed 9% of the animals were positive for E. canis and 21% for A. platys. Regarding of nPCR analysis, 57 and 55% of dogs were positive for E. canis and A. platys respectively. As compared to a nested PCR, the stained blood smears revealed false-negative results for both E. canis and A. platys. The results indicate that the nPCR is highly sensitive and specific for detection of both pathogens and the molecular diagnosis could be more useful at veterinary hospital.
Keywords: nPCR, dogs, Ehrlichia, Anaplasma
Introdução
Uma grande variedade de patógenos é transmitida por carrapatos para cães, incluindo Babesia spp., Ehrlichia spp., Anaplasma spp., e outros (SOLANO-GALLEGO et al., 2006). Ehrlichia canis e Anaplasma platys são riquétsias intracelulares obrigatórias, tendo a primeira tropismo por monócitos e neutrófilos e, a segunda, por plaquetas (RIKIHISA, 2000). Como principal transmissor desses agentes tem-se o carrapato Rhipicephalus sanguineus (GROOVES et al., 1975; INOKUMA et al., 2000).
O diagnóstico desses patógenos é geralmente realizado pelos sinais clínicos, detecção das riquétsias em esfregaços sanguíneos corados e por métodos sorológicos (WANER et al., 2001). No entanto, em virtude das semelhanças com sinais clínicos apresentados em outras enfermidades (RIKIHISA, 2000), a baixa bacteremia (HARRUS et al., 1997), e reações sorológicas cruzadas entre espécies relacionadas (RIKIHISA et al., 1994), esses métodos têm suas sensibilidades e/ou especificidades comprometidas. Assim, ferramentas moleculares, como a nested-PCR (nPCR), têm sido otimizadas para o diagnóstico eficiente dessas bactérias em cães (WEN et al., 1997; MARTIN et al., 2005).
No Brasil, a detecção de E. canis e A. platys tem se baseado geralmente no diagnóstico direto por meio de esfregaços sanguíneos e métodos sorológicos (SOARES et al., 2006; CARLOS et al., 2007), dificultando a determinação da prevalência desses patógenos devido à baixa sensibilidade (MYLONAKYS et al., 2003) e especificidade, respectivamente (RIKIHISA et al., 1994). Além disso, por causa do crescente interesse no estudo dessas riquétsias como agentes causais de infecções em humanos (UNVER et al., 2001; TAMI; TAMI-MAURY, 2004), a precisa identificação do estado de infecção dos cães torna-se cada vez mais importante. Objetivou-se, neste estudo, comparar uma ferramenta molecular (nPCR) no diagnóstico de infecções por E. canis e A. platys, frente ao diagnóstico direto, em cães com suspeita clínica de hemoparasitoses.
Material e Métodos
Foram avaliados 100 cães de ambos os sexos, de raças e idades variadas, com suspeita clínica de infecções por hemoparasitos, atendidos no Hospital Veterinário da Universidade Federal Rural de Pernambuco, Recife, Brasil. Após o exame clínico, amostras de sangue foram coletadas com EDTA e esfregaços sanguíneos confeccionados para realização do diagnóstico direto. Posteriormente, a mesma amostra sanguínea foi utilizada para isolamento de DNA genômico, utilizando-se o Kit Easy DNA (Invitrogen, EUA), conforme instruções do fabricante.
Como testes de referência para a detecção de A. platys e E. canis, reações de nPCR foram realizadas segundo Martin et al. (2005) e Wen et al. (1997), respectivamente, utilizando-se os primers descritos na Tabela 1. As reações foram preparadas em volume de 50 μL, contendo 10 mM tris-HCl (pH 8,3), 50 μM KCl, 1,5 mM MgCl2, 0,2 mM de cada deoxynucleosídeo triphosphatado, 1,5 U Taq DNA polymerase (Invitrogen, EUA), 11 pmol de cada primer (8-F e 1448- R para A. platys e ECC e ECB para E. canis) e 100 ηg de DNA genômico. O esquema de amplificação foi o seguinte: 94 ºC por 2 minutos, seguido por 40 ciclos de desnaturação a 94 ºC por 1 minuto, anelamento a 45 ºC por 1 minuto para A. platys e 60 ºC por 1 minuto para E. canis e extensão a 72 ºC por 40 segundos, com uma etapa final a 72 ºC por 4 minutos. Na segunda reação, 1 μL do produto da primeira reação foi utilizado como DNA molde em uma reação de 50 μL utilizando-se os primers PLATYS-F e EHR16S-R para A. platys, e HE e ECA para E. canis, com o seguinte esquema de amplificação: 94 ºC por 1 minuto, 40 ciclos de 94 ºC por 1 minuto, 53 ºC por 30 segundos para A. platys e 60 ºC por 1 minuto para E. canis, e 72 ºC por 30 segundos, seguidos novamente por uma etapa de extensão final a 72 ºC por 4 minutos. Os amplicons foram revelados após eletroforese em gel de agarose 1,5% corado com brometo de etídeo (0,5 μg.mL-1).
Foi utilizado o teste Qui-quadrado de McNemar (ZAR, 1996), para avaliar a significância dos resultados entre os testes (nPCR e diagnóstico direto) tanto para A. platys como para E. canis.
Resultados e Discussão
Dentre os animais analisados por meio do diagnóstico direto, apenas 9% (9/100) e 21% (21/100) foram positivos para E. canis e A. platys, respectivamente.
Embora simples e de fácil execução (HARRUS et al., 1997), esse método diagnóstico tem uma sensibilidade baixa. Recentemente, Mylonakis et al. (2003) compararam o diagnóstico direto para E. canis a partir de diferentes tecidos, como sangue periférico (SP), capa leucocitária (CL), aspirados de medula óssea (MO) e linfonodo (LN), e concluíram que o diagnóstico, a partir de SP, é o que apresenta a menor sensibilidade (8%) quando comparado a CL (66%), MO (34%) e LN (60,9%), desencorajando a utilização dessa técnica para diagnóstico.
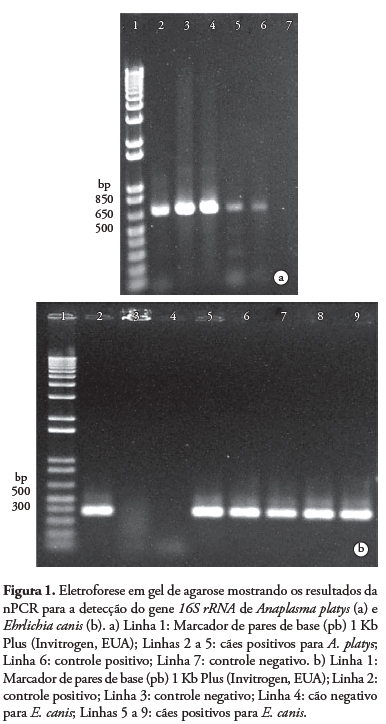
A amplificação da segunda reação resultou em fragmentos de 670 pb para A. platys e 389 pb para E. canis (Figura 1), compatíveis com os tamanhos descritos (WEN et al., 1997; MARTIN et al., 2005).
Após a realização da nPCR, observou-se que 57% (57/100) dos cães foram positivos para E. canis, e 55% (55/100) para A. platys. Esses resultados foram superiores aos observados por Wen et al. (1997), que observaram 44% de animais positivos para E. canis, nos Estados Unidos, por Yabsley et al. (2008) no Caribe (24,7% para E. canis e 19,2% para A. platys), e por Huang et al. (2005), na Venezuela, e De La Fuente et al. (2006), na Itália, que observaram 16 e 4%, respectivamente, de cães positivos para A. platys. Foram superiores também ao observado por Ferreira et al. (2007), no Rio de Janeiro (15,84% para A. platys), e por Santos et al. (2009), em Ribeirão Preto (38,9% para E. canis e 14,9% para A. platys). No entanto, foram inferiores ao observado por Diniz et al. (2007) para E. canis (76,8%) em cães no Estado de São Paulo.
Essas variações nos porcentuais de positividade estão relacionadas principalmente à população canina estudada, à exposição dessas populações ao carrapato vetor e ao método diagnóstico empregado (SOLANO-GALLEGO et al. 2006). Neste estudo, especificamente, a alta taxa de positividade encontrada na nPCR provavelmente ocorreu devido ao fato da população analisada ser composta apenas por indivíduos clinicamente suspeitos de hemoparasitose, além da alta sensibilidade do teste (WEN et al., 1997; MARTIN et al., 2005).
Confrontando-se os resultados do diagnóstico molecular com os resultados do diagnóstico direto (Tabelas 2 e 3), observou-se uma proporção significativamente maior (p = 0,000001) de animais falso-negativos neste último do que na nPCR, tanto para E. canis quanto para A. platys. Esses resultados discordam do observado por Ferreira et al. (2007), que não detectaram diferença significativa (p = 0,289) entre PCR e diagnóstico direto para A. platys em cães.
Vale a pena ressaltar que foram encontrados 5% (5/100) dos cães positivos para A. platys e 4% (4/100) para E. canis no exame direto, mas negativos na nPCR. Corpúsculos de inclusão em células sanguíneas muitas vezes estão relacionados à ativação celular em processos inflamatórios, podendo ser confundidos com inclusões de E. canis e/ou, A. platys (MYLONAKIS et al., 2003; FERREIRA et al., 2007). Além disso, a possibilidade de infecções por outros organismos da ordem Rickettsialles, como Anaplasma phagocytophilum, E. chaffeensis e E. ewingii, que também resultam em inclusões citoplasmáticas, não pode ser descartada (RIKIHISA, 2000; FERREIRA et al., 2007). Um outro resultado interessante observado neste estudo foi que, dentre os animais positivos para A. platys no diagnóstico direto, três cães (3%) apresentaram resultados negativos na nPCR para essa riquétsia, porém positivos para E. canis. Isso pode representar mais um fator de confusão no diagnóstico direto dessas hemoparasitoses, devido à possibilidade de E. canis, em determinado estágio da infecção, ser confundida com A. platys. Em cães experimentalmente infectados com E. canis, mórulas foram detectadas em plaquetas 12 dias após a infecção (ALMOSNY, 1998).
Co-infecções por A. platys e E. canis têm sido relatadas em diferentes regiões do mundo, como China (HUA et al., 2000), Caribe (YABSLEY et al., 2008), Venezuela (SUKSAWAT et al., 2001) e Brasil (SANTOS et al., 2009). Neste estudo, 32% (32/100) dos animais analisados pela nPCR apresentavam-se infectados por ambos os patógenos. Esses dados sugerem que A. platys e E. canis podem ser transmitidos pelo mesmo vetor (HUANG et al., 2005).
O principal vetor de E. canis para cães é o carrapato Rhipicephalus sanguineus (LEWIS et al., 1977) e, embora a transmissão experimental de A. platys por este carrapato tenha falhado (SIMPSON et al., 1991), ele é apontado como o principal transmissor para cães em diversas regiões do mundo (SANOGO et al., 2003; YABSLEY et al., 2008).
Embora não seja habitual, o carrapato R. sanguineus tem sido descrito, recentemente, parasitando humanos no Uruguai, (VENZAL et al., 2003), Venezuela (PEREZ et al., 2006), e Brasil (DANTAS-TORRES et al., 2006). Trapp et al. (2006) observaram que o risco de proprietários de cães infestados por R. sanguineus também serem parasitados por esse carrapato era 3,2 vezes maior do que o risco de proprietários de cães não infestados serem parasitados. Essa observação, aliada ao alto porcentual de cães positivos no diagnóstico molecular para E. canis (57%) e A. platys (55%), no presente estudo, serve de alerta para o risco de transmissão de tais patógenos aos humanos. Infecções por E. canis (UNVER et al., 2001; PEREZ et al., 2006) e o encontro de inclusões plaquetárias semelhantes a A. platys (TAMI; TAMI-MAURY, 2004), é comum tanto em pessoas imunocomprometidas, devido à infecção pelo vírus da imunodeficiência humana (HIV), quanto em indivíduos imunocompetentes.
Por fim, a realização do diagnóstico direto desses parasitos por esfregaço sanguíneo deve ser feita cuidadosamente, haja vista a possibilidade de confusão com inclusões intracelulares inespecíficas. Os dados aqui apresentados indicam que a nPCR é uma importante ferramenta de diagnóstico, superior ao diagnóstico direto, que pode ser utilizada para definir com maior precisão o estado de infecção dos cães por E. canis e/ou A. platys.
CARLOS, R. S. A. et al. Freqüência de anticorpos anti-Erhlichia canis, Borrelia burgdorferi e antígenos de Dirofilaria immitis em cães na microrregião de Ilhéus-Itabuna, Bahia, Brasil. Revista Brasileira de Parasitologia Veterinária, v. 16, n. 3, p. 117-120, 2007.
DANTAS-TORRES, F.; FIGUEREDO, L. A.; BRANDAO-FILHO, S. P. Rhipicephalus sanguineus (Acari: Ixodidae), the brown dog tick, parasitizing humans in Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v. 39, n. 1, p. 64-67, 2006.
DINIZ, P. P. V. P. et al. Surveillance for zoonotic vector-borne infections using sick dogs from Southeastern Brazil. Vector Borne and Zoonotic Disease, v. 7, n. 4, p. 689-697, 2007.
FERREIRA, R. F. et al. Anaplasma platys diagnosis in dogs: comparison between morphological and molecular tests. International Journal of Applied Research in Veterinary Medicine, v. 5, n. 3, p. 113-119, 2007.
FUENTE, J. de la. et al. Molecular characterization of Anaplasma platys strains from dogs in Sicily, Italy. BMC Veterinary Research, v. 2, n. 24, p. 1-5, 2006.
GROOVES, M. G. et al. Transmission of Ehrlichia canis to dogs by ticks (Rhipicephalus sanguineus). American Journal of Veterinary Research, v. 36, n. 7, p. 937-940, 1975.
HARRUS, S. et al. Clinical manifestations of infectious canine cyclic thrombocytopenia. Veterinary Record, v. 141, n. 10, p. 247-250, 1997.
HUANG, H. et al. Prevalence and molecular analysis of Anaplasma platys in dogs in Lara, Venezuela. Brazilian Journal of Microbiology, v. 36, n. 3, p. 211-216, 2005.
HUA, P. et al. Canine ehrlichiosis caused simultaneously by Ehrlichia canis and Ehrlichia platys. Microbiology and Immunology, v. 44, n. 9, p. 737-739, 2000.
INOKUMA, H.; RAOULT, D.; BROUQUI, P. Detection of Ehrlichia platys DNA in brown dog ticks (Rhipicephalus sanguineus) in Okinawa Island, Japan. Journal of Clinical Microbiology, v. 38, n. 11, p. 4219-4221, 2000.
LEWIS, J. R. et al. The brown dog tick Rhipicephalus sanguineus and the dog as experimental hosts of Ehrlichia canis. American Journal of Veterinary Research, v. 38, n. 12, p. 953-1955, 1977.
MARTIN, A. R. et al. Anaplasma platys: an improved PCR for its detection in dogs. Experimental Parasitology, v. 109, n. 3, p. 176-180, 2005.
MYLONAKYS, M. E. et al. Evaluation of cytology in the diagnosis of acute canine monocyticehrlichiosis (Ehrlichia canis): a comparison between five methods. Veterinary Microbiology, v. 91, n. 2/3, p. 197-204, 2003.
PEREZ, M. et al. Human infection with Ehrlichia canis accompanied by clinical signs in Venezuela. Annals of the New York Academy of Science, v. 1078, n. 1, p. 110-117, 2006.
RIKIHISA, Y.; EWING, S. A.; FOX, J. C. Western immunoblot analysis of Ehrlichia chaffeensis, E. canis, or E. ewingii infections in dogs and humans. Journal of Clinical Microbiology, v. 32, n. 9, p. 2107-212, 1994.
RIKIHISA, Y. Diagnosis of emerging ehrlichial diseases of dogs, horses, and humans. Journal of Veterinary Internal Medicine, v. 14, n. 3, p. 250-251, 2000.
SANOGO, Y. O. B. et al. First evidence of Anaplasma platys in Rhipicephalus sanguineus (Acari: Ixodida) collected from dogs in Africa. Onderstepoort Journal of Veterinary Research, v. 70, n. 3, p. 205-212, 2003.
SANTOS, F. et al. Molecular evaluation of the incidence of Ehrlichia canis, Anaplasma platys and Babesia spp. in dogs from Ribeirão Preto, Brazil. Veterinary Journal, v. 179, n. 1, p. 145-148, 2009.
SIMPSON, R. M. et al. Evaluation of Rhipicephalus sanguineus as a potential biologic vector of Ehrlichia platys. American Journal of Veterinary Research, v. 52, n. 9, p. 1537-1541, 1991.
SOARES, A. O. et al. Avaliação ectoparasitológica e hemoparasitológica em cães criados em apartamentos e casas com quintal na cidade de Juiz de Fora, MG. Revista Brasileira de Parasitologia Veterinária, v. 15, n. 1, p. 13-16, 2006.
SOLANO-GALEGO, L. et al. A serological study of exposure to arthropod-borne pathogens in dogs from northeastern Spain. Veterinary Research, v. 37, n. 2, p. 231-244, 2006.
SUKSAWAT, J. et al. Coinfection with three Ehrlichia species in dogs from Thailand and Venezuela with emphasis on consideration of 16S ribosomal DNA secondary structure. Journal of Clinical Microbiology, v. 39, n. 1, p. 90-93, 2001.
TAMI, I. C.; TAMI-MAURY, I. M. Identification morfologica de Ehrlichia sp. en las plaquetas de pacientes con infección por vírus de la immunodeficiencia humana em Venezuela. Pan American Journal of Public Health, v. 16, n. 5, p. 345-349, 2004.
TRAPP, S. M. et al. Seroepidemiology of canine babesiosis and ehrlichiosis in a hospital population. Veterinary Parasitology, v. 140, n. 3/4, p. 223-230, 2006.
UNVER, A. et al. Molecular and antigenic comparison of Ehrlichia canis isolates from dogs, ticks and a human in Venezuela. Journal of Clinical Microbiology, v. 39, n. 8, p. 2788-2793, 2001.
VENZAL, J. M. et al. Ticks (Ixodida: Ixodidae) parasitising humans in Uruguay. Annals of Tropical Medicine and Parasitology, v. 97, n. 7, p. 769-772, 2003.
WANER, T. et al. Significance of serological testing for ehrlichial diseases with special emphasis on the diagnosis of canine monocytic ehrlichiosis caused by Ehrlichia canis. Veterinary Parasitololy, v. 95, n. 1, p. 1-15, 2001.
WEN, B. et al. Comparison of nested PCR with imunofluorescent antibody assay for detection of Ehrlichia canis infection in dogs treated with doxycycline. Journal of Clinical Microbiology, v. 35, n. 7, p. 1852-1855, 1997.
YABSLEY, M. J. et al. Prevalence of Ehrlichia canis,Anaplasma platys, Babesia canis vogeli, Hepatozoon canis, Bartonella vinsonii berkhoffi, and Rickettsia spp. in dogs from Grenada. Veterinary Parasitology, v. 151, n. 2/4, p. 279-285, 2008.
Recebido em 5 de Junho de 2008
Aceito em 19 de Agosto de 2009
- ALMOSNY, N. R. P. Ehrlichia canis (Donatien e Lestoquard, 1935): avaliação parasitológica, hematológica e bioquímica sérica da fase aguda, em cães e gatos experimentalmente infectados Rio de Janeiro, 1998. 202 p. Tese (Doutorado) - Universidade Federal Rural do Rio de Janeiro - UFRRJ.
- ZAR, J. H. Biostatistical analysis 1996. Upper Saddle River: Prentice Hall International, 1996 662 p.
Datas de Publicação
-
Publicação nesta coleção
12 Abr 2012 -
Data do Fascículo
Dez 2009