Resumo
Mimoseae, uma das tribos do clado Mimosoide - Leguminosae, possui 41 gêneros e cerca de 860 espécies. No Brasil, está representada por 16 gêneros e 614 espécies. Dada relevância do grupo para a flora brasileira e para a Mata Atlântica, este trabalho apresenta o estudo florístico dos gêneros Anadenanthera, Leucaena, Neptunia, Parapiptadenia, Parkia, Piptadenia, Plathymenia, Pseudopiptadenia e Stryphnodendron no estado do Espírito Santo. Foram realizadas expedições de campo entre abril de 2014 e julho de 2015 e examinados materiais originados do Espírito Santo depositados em herbários. No Espírito Santo, foram encontradas 22 espécies e 24 táxons infraespecíficos. Os gêneros Piptadenia, Pseudopiptadenia, Stryphnodendron e Anadenanthera foram os que mais se destacaram em número de espécies, com seis, seis, três e duas, respectivamente. Os demais gêneros foram representados por apenas uma espécie cada. Os resultados representam o acréscimo de dois gêneros e nove táxons, específicos e infraespecíficos, em relação à lista da Flora do Espírito Santo: Anadenanthera colubrina var. cebil, A. colubrina var. colubrina, A. peregrina var. peregrina, Neptunia plena, Piptadenia santosii, Pseudopiptadenia bahiana, P. psilostachya, Stryphnodendron polyphyllum e S. pulcherrimum. Chaves de identificação, diagnoses morfológicas, comentários, ilustrações e mapas de distribuição geográfica são apresentados.
Palavras-chave:
clado Mimosoide; Fabaceae; Mata Atlântica
Abstract
Tribe Mimoseae (Mimosoid clade - Leguminosae) has 41 genera and about 860 species, of which, 16 genera and 614 species are recorded in Brazil. As a very representative group from Brazilian flora and from Atlantic Rainforest, this paper aims to provide the floristic and taxonomic treatment for genera Anadenanthera, Leucaena, Neptunia, Parapiptadenia, Parkia, Piptadenia, Plathymenia, Pseudopiptadenia, and Stryphnodendron from Espírito Santo state (ES). Fieldwork was performed from April 2014 to July 2015 and vouchers housed at herbaria were examined. A total of 24 taxa (22 species and two varieties) were found in the state. Piptadenia (six spp.), Pseudopiptadenia (six spp.), Stryphnodendron (three spp.), and Anadenanthera (two spp.) are the richest genera amongst analyzed. Leucaena, Neptunia, Parapiptadenia, Parkia, and Plathymenia were represented by only one species each. Compared to the previously known for ES, results increased two genera and nine taxa (specific and infraspecific), as follow: Anadenanthera colubrina var. cebil, A. colubrina var. colubrina, A. peregrina var. peregrina, Neptunia plena, Piptadenia santosii, Pseudopiptadenia bahiana, P. psilostachya, Stryphnodendron polyphyllum, and S. pulcherrimum. Identification keys, descriptions, taxonomic comments, illustrations, and geographic distribution maps are provided.
Key words:
Mimosoid clade; Fabaceae; Atlantic Rainforest
Introdução
A tribo Mimoseae está incluída no clado Mimosoide, subfamília Caesalpinoideae, Leguminosae (LPWG 2017LPWG - The Legume Phylogeny Working Group (2017) A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny. Taxon 66: 44-77.). Apresenta espécies com flores radialmente simétricas, com corola com pré-floração valvar, isostêmones ou diplostêmones, com estames exsertos, livres ou unidos na base e as anteras com ou sem glândulas no ápice do conectivo (Lewis & Elias 1981Lewis GP & Elias TS (1981) Mimosoideae. In: Polhill RM & Raven PH (eds.) Advances in legume systematics, part I. Royal Botanic Gardens, Kew. Pp. 143-151.; LPWG 2017LPWG - The Legume Phylogeny Working Group (2017) A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny. Taxon 66: 44-77.).
Mimoseae possui 41 gêneros contendo entre 860 e 880 espécies (Luckow et al. 2005Luckow M (2005) Tribe Mimoseae. Lewis G, Schrire B, Mackinder B & Lock M (eds.) Legumes of the world. Royal Botanical Gardens, Kew. Pp. 163-183.), distribuídas nos trópicos e subtrópicos, com menor frequência nas regiões temperadas e 1/3 dos gêneros endêmicos do Novo Mundo (Schrire et al. 2005Schrire B D, Lewis GP & Lavin M (2005) Biogeography of the Leguminosae. In: Lewis GP, Schrire B D, Mackinder B A & Lock M (eds.) Legumes of the world Royal Botanic Gardens, Kew. Pp. 21-54.). Para o Brasil, são citados 16 gêneros e 614 espécies para a tribo, distribuídas por todos os estados, das quais 308 são endêmicas (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Para o Espírito Santo, são registrados oito gêneros e 31 espécies (Dutra et al. 2015Dutra VF, Alves-Araújo A & Carrijo TT (2015) Angiosperm checklist of Espírito Santo: using electronic tools to improve the knowledge of an Atlantic Forest biodiversity hotspot. Rodriguésia 66: 1145-1152.).
Na flora do Brasil, Leguminosae é a família mais diversa, com 2.756 espécies e 222 gêneros, e a segunda mais numerosa na Floresta Atlântica, com 945 espécies (Stehmann et al. 2009Stehmann JR, Forzza RC, Salino A, Sobral M, Costa DD & Kamino LHY (2009) Plantas da floresta Atlântica. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. 516p.; BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Apesar da riqueza de espécies, floras e revisões taxonômicas que incluem espécies de Leguminosae do Espírito Santo vêm se intensificando aos poucos, principalmente, ao longo da última década. Alguns dos trabalhos existentes focaram grupos taxonômicos tais como os realizados por Weiler Jr. (1998)Weiler Júnior I (1998) Leguminosae - Faboideae das restingas do estado de Espírito Santo. Dissertação de Mestrado. Universidade Federal do Rio de Janeiro, Rio de Janeiro. 189p., com o levantamento das espécies de Papilionoideae das restingas capixabas, o de Chagas et al. (2014)Chagas AP, Peterle PL, Thomaz LD, Dutra VF & Valadares RT (2014) Leguminosae-Caesalpinioideae do Parque Estadual Paulo César Vinha, Espírito Santo, Brasil. Rodriguésia 65: 099-112. e o de Peterle et al. (2015)Peterle PL, Chagas AP, Thomaz LD, Dutra VF & Valadares RT (2015) Leguminosae-Mimosoideae do Parque Estadual Paulo César Vinha, Espírito Santo, Brasil. Rodriguésia 66: 245-257. com as flórulas de Caesalpinoideae e Mimosoideae na restinga do Parque Estadual Paulo César Vinha, respectivamente; e o de França (2014)França JRKG (2014) Estudo taxonômico de Leguminosae- "Caesalpinoideae" do Parque Nacional do Caparaó, Espírito Santo, Minas Gerais, Brasil. Dissertação de Mestrado. Universidade Federal do Rio de Janeiro/Museu Nacional Rio de Janeiro, Rio de Janeiro. 152p. com Caesalpinoideae ocorrentes no Parque Nacional do Caparaó. A tribo Ingeae Benth. para o Espírito Santo foi estudada por Chagas (2014)Chagas AP (2014) Ingeae Benth. (Leguminosae-Mimosoideae) no Espírito Santo, Brasil. Dissertação de Mestrado. Universidade Federal de Viçosa, Viçosa. 109p. e outros estudos incluíram o levantamento de espécies do Estado, como os gêneros Abarema Pittier (Iganci & Morim 2012Iganci JRV & Morim MP (2012) Abarema (Fabaceae, Mimosoideae) in the Atlantic domain, Brazil. Botanical Journal of the Linnean Society 168: 473-486.), Machaerium Pers. (Filardi & Lima 2014Filardi FLR & Lima HC (2014) The diversity of Machaerium (Leguminosae: Papilionoideae) in the Atlantic Forest: three new species, nomenclatural updates, and a revised key. Systematic Botany 39: 145-159.) e Senegalia Raf. (Barros & Morim 2014Barros MJF & Morim MP (2014) Senegalia (Leguminosae, Mimosoideae) from the Atlantic Domain, Brazil. Systematic Botany 39: 452-477.) no Domínio Atlântico e para o Brasil (Santos 2014Santos TS (2014) Senegalia Raf. (Leguminosae- Mimosoideae) no Brasil: taxonomia, filogenia e distribuição geográfica. Tese de Doutorado. Universidade Federal de Viçosa, Viçosa. 200p.).
Este trabalho tem por objetivo apresentar o levantamento taxonômico das espécies de nove gêneros da tribo Mimoseae no estado do Espírito Santo, visando contribuir para o conhecimento da família Leguminosae para a flora do estado.
Material e Métodos
O levantamento das espécies e o estudo morfológico foram realizados com base em novas coletas e no material originado do Espírito Santo depositado nos herbários CVRD, MBML, VIES, CEPEC, ESA, HUEFS, RB (acrônimos segundo Thiers, continuamente atualizadoThiers B [continuamente atualizado]. Index herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden's Virtual Herbarium. Disponível em <http://sweetgum.nybg.org/science/ih/> Acesso em 12 Dezembro 2015.
http://sweetgum.nybg.org/science/ih/...
). As coleções dos herbários K e NY foram examinadas por consulta virtual. Para coletas de espécimes e observação das populações foram realizadas 29 expedições a campo, entre abril de 2014 e julho de 2015, em 15 Unidades de Conservação e oito áreas particulares (Fig. 1). Para cada indivíduo amostrado foram coletados preferencialmente cinco ramos férteis (com folhas, flores e/ ou frutos). Todos os exemplares coletados foram prensados e secos em estufas de campo, de acordo com procedimentos usuais de coleta e herborização (Fidalgo & Bononi 1989Fidalgo O & Bononi VLR (1989) Técnica de coleta, preservação e herborização de material botânico. (Série Documentos) Instituto de Botânica, São Paulo. 62p.). Os espécimes foram depositados no herbário VIES. A identificação dos materiais foi realizada através da bibliografia especializada (Altschul 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.; Hopkins 1986Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.; Tamashiro 1989Tamashiro JY (1989) Estudos taxonômicos e morfológicos do gênero Piptadenia sensu Bentham no sudoeste do Brasil: avaliação das modificações taxonômicas recentemente propostas. Dissertação de Mestrado. Universidade Estadual de Campinas, São Paulo. 101p.; Lewis & Lima 1991Tamashiro JY (1989) Estudos taxonômicos e morfológicos do gênero Piptadenia sensu Bentham no sudoeste do Brasil: avaliação das modificações taxonômicas recentemente propostas. Dissertação de Mestrado. Universidade Estadual de Campinas, São Paulo. 101p.; Ribeiro 2012Ribeiro PG (2012) Flora da Bahia: família Leguminosae, subfamília Mimosoideae: Tribo Acacieae e Tribo Mimoseae - Parte I. Dissertação de Mestrado. Universidade Estadual de Feira de Santana, Feira de Santana. 351p.; Scalon 2007Scalon VR (2007) Revisão taxonômica de Stryphnodendron Mart. (Leguminosae Mimosoideae). Tese de Doutorado. Universidade de São Paulo, São Paulo. 264p.), fotos das coleções tipo disponíveis on-line no K e NY e por comparação com o material previamente identificado em herbários.
Unidades de conservação e propriedades particulares estudadas - 1. Reserva Natural Vale; 2. Reserva Biológica de Sooretama; 3. Reserva Biológica de Duas Bocas; 4. Reserva Biológica de Córrego Grande; 5. Reserva Biológica de Córrego do Veado; 6. Reserva Biológica de Comboios; 7. Governador Lindemberg; 8. Pedra do Cruzeiro, Marilândia; 9. Pedra de Santa Luzia, Governador Lindemberg; 10. Parque Nacional do Caparaó; 11. Parque Estadual de Mata das Flores; 12. Parque Estadual de Itaúnas; 13. Margem do Rio Cricaré; 14. Morro de São Carlos - Vargem Alta; 15. Monumento Natural dos Pontões Capixabas; 16. Floresta Nacional de Goytacazes; 17. Estação Biológica de Santa Lúcia; 18. São Mateus; 19. Alfredo Chaves; 20. Água Doce do Norte; 21. APA Pedra do Elefante; 22. APA Mestre Álvaro.
Figure 1
Studied conservation units and private properties - 1. Reserva Natural Vale; 2. Reserva Biológica de Sooretama; 3. Reserva Biológica de Duas Bocas; 4. Reserva Biológica de Córrego Grande; 5. Reserva Biológica de Córrego do Veado; 6. Reserva Biológica de Comboios; 7. Governador Lindemberg; 8. Pedra do Cruzeiro, Marilândia; 9. Pedra de Santa Luzia, Governador Lindemberg; 10. Parque Nacional do Caparaó; 11. Parque Estadual de Mata das Flores; 12. Parque Estadual de Itaúnas; 13. Margem do Rio Cricaré; 14. Morro de São Carlos - Vargem Alta; 15. Monumento Natural dos Pontões Capixabas; 16. Floresta Nacional de Goytacazes; 17. Estação Biológica de Santa Lúcia; 18. São Mateus; 19. Alfredo Chaves; 20. Água Doce do Norte; 21. APA Pedra do Elefante; 22. APA Mestre Álvaro.
A terminologia utilizada nas descrições morfológicas seguiu Radford et al. (1974)Radford AE, Dickison WC, Massey JR & Bell CR (1974) Vascular plant systematics. Harper & Row, New York. 891p., Barroso et al. (1999Barroso GM, Morim MP, Peixoto AL & Ichasso CLF (1999) Frutos e sementes: morfologia aplicada à sistemática de dicotiledôneas. Imprensa Universitária, Viçosa. 444p.) para frutos e sementes, e Melo et al. (2010)Melo Y, Córdula E, Machado SR & Alves M (2010) Morfologia de nectários em Leguminosae senso lato em áreas de caatinga no Brasil. Acta Botanica Brasilica 24: 1034-1045. e Fernandes (2011)Fernandes JM (2011) Ingeae Benth. (Leguminosae) no estado de MG, Brasil: taxonomia, morfoanatomia de nectários extraflorais e padrões de distribuição geográfica. Tese de Doutorado. Universidade Federal de Viçosa, Viçosa. 298p. para nectários extraflorais. As chaves de identificação para os gêneros e para as espécies foram elaboradas com base em caracteres vegetativos e reprodutivos. Para cada espécie, foram elaboradas diagnoses morfológicas, ilustrações e apresentados comentários, sobre a distribuição geográfica, hábitats preferenciais, fenologia reprodutiva, variações morfológicas e taxonomia. As descrições da tribo e dos gêneros foram realizadas com base nos táxons do Espírito Santo. Para a obtenção da distribuição geográfica das espécies no estado, foram realizadas coletas georreferenciadas, consultas às etiquetas dos espécimes depositados nos herbários supracitados e ao banco de dados do speciesLink (<http://splink.cria.org.br/>), no qual foram usadas apenas espécies identificadas por especialistas. O banco de dados obtido, com 874 registros, foi refinado, com a inclusão de coordenadas geográficas ausentes, completadas com a coordenada da sede do município através do Google Maps (2016), e com a atualização das determinações das espécies. Os mapas foram criados no programa Qgis.
Resultados e Discussão
No Espírito Santo, Mimoseae está representada por dez gêneros, 42 espécies e 45 táxons infraespecíficos, sendo o gênero Mimosa o mais diverso, com 21 táxons e que será tratado separadamente. Dentre os nove gêneros de Mimoseae abordados neste trabalho, foram registradas 22 espécies e 24 táxons infraespecíficos. Foi registrado o acréscimo de dois gêneros e de oito táxons para a lista das espécies da flora do Espírito Santo (Dutra et al. 2015Dutra VF, Alves-Araújo A & Carrijo TT (2015) Angiosperm checklist of Espírito Santo: using electronic tools to improve the knowledge of an Atlantic Forest biodiversity hotspot. Rodriguésia 66: 1145-1152.): Anadenanthera colubrina var. cebil (Griseb.) Altschul, A. colubrina (Vell.) Brenan var. colubrina, A. peregrina (L.) Speg. var. peregrina, Neptunia plena, Piptadenia santosii, Pseudopiptadenia bahiana, P. psilostachya, Stryphnodendron polyphyllum e S. pulcherrimum.
O grupo mais representativo nos herbários foi o gênero Piptadenia com 178 espécimes, provavelmente devido à sua grande ocorrência em bordas de fragmentos e áreas antropizadas. É seguido do gênero Anadenanthera, com 90 espécimes, que ocorre em áreas abertas e estradas, onde tem facilidade de visualização e coleta. Apesar da ampla ocorrência nas áreas degradadas do Estado, Leucaena leucocephala tem baixo número de registros (10), provavelmente, por ser invasora e naturalizada (Hughes 1998Hughes C (1998) Monograph of Leucaena (Leguminosae-Mimosoideae). Systematic Botany Monographs 55: 1-244.). Neptunia contou apenas com dois registros da mesma localidade. O gênero Desmanthus, apesar de listado para o Espírito Santo pelo BFG (2015)BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113. não foi encontrado em campo, nem nos herbários consultados. Nenhuma das espécies listadas é endêmica do Espírito Santo (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.), nem consta na lista de espécies da flora ameaçadas de extinção no estado do Espírito Santo (Simonelli & Fraga 2007Simonelli M & Fraga CN (2007) Espécies da flora ameaçadas de extinção no estado do Espírito Santo. Ipema, Vitória. 144p.).
Tratamento taxonômico
Mimoseae Bronn, Form. Pl. Leg. 1822.
Ervas, trepadeiras, arbustos escandentes, arvoretas ou árvores. Ramos glabros a denso-puberulentos, aculeados ou inermes. Estípulas decíduas ou persistentes. Nectários extraflorais peciolares presentes ou ausentes, quando presentes, sésseis, elípticos a circulares, pateliformes, capitados, cupuliformes ou verruciformes, localizados na região basal ou mediana do pecíolo, os da raque sésseis, subsésseis ou estipitados, pateliformes, ciatiformes, circulares, verruciformes, discoides, cupuliformes, localizados no segmento interpinas distal. Pinas 5−14 pares; parafilídios presentes ou ausentes, foliólulos da pina mediana 2−76 pares, 3−86 × 0,5−65 mm. Inflorescências capitadas globosas ou espiciformes. Flores trímeras, tetrâmeras ou pentâmeras, isostêmones ou diplostêmones, sésseis ou pediceladas, anteras com ou sem glândulas apicais; ovário subestipitado ou estipitado. Legumes, folículos, legumes nucóides, criptolomentos, craspédios; sementes 7−17, reniformes, circulares, oblongas, elípticas, aladas ou não aladas.
- Chave de identificação dos gêneros de Mimoseae no Espírito Santo
-
1. Nectários extraflorais ausentes....................................................................................................Mimosa
1'. Nectários extraflorais presentes.
-
2. Foliólulos 1 par por pina.
-
3. Ramos aculeados. Foliólulos falcados. Inflorescências capitadas globosas. Frutos do tipo craspédio.....................................................................................................................Mimosa
-
3'. Ramos inermes. Foliólulos elípticos. Inflorescências espiciformes. Frutos do tipo folículo.......................................................................................................................8. Pseudopiptadenia
-
-
2'. Foliólulos 2-76 pares por pina.
-
4. Ramos com nectários extraflorais localizados próximo da inserção da folha. Frutos do tipo criptolomento...................................................................................................7. Plathymenia
-
4'. Ramos sem nectários extraflorais. Frutos do tipo legume, folículo ou legume nucoide.
-
5. Ervas. Pinas 3-4 pares. Flores com estaminódios laminares amarelos.........3. Neptunia
-
5'. Trepadeiras, arbustos, arbustos escandentes ou árvores. Pinas 1-25 pares. Flores sem estaminódios laminares.
-
6. Ápice dos ramos dotados de indumento ferrugíneo. Frutos do tipo legume nucóide...................................................................................................9. Stryphnodendron
-
6'. Ápice dos ramos sem indumento ferrugíneo. Frutos do tipo legume ou folículo.
-
7. Ramos aculeados ou raramente inermes.....................................6. Piptadenia
-
7'. Ramos sempre inermes.
-
8. Cicatriz ou invólucro do botão presente na base da inflorescência.......... .....................................................................................1. Anadenanthera
-
8'. Cicatriz ou invólucro do botão ausente na base da inflorescência.
-
9. Inflorescências espiciformes. Sementes aladas.
-
10. Filetes alvos, amarelados ou esverdeados. Frutos do tipo folículo.....................................................8. Pseudopiptadenia
-
10'. Filetes vináceos. Frutos do tipo legume......4. Parapiptadenia
-
-
9'. Inflorescências capitadas globosas. Sementes não aladas.
-
11. Pinas 7-8 pares. Inflorescências eretas; pedúnculos 24−26 mm compr.; anteras sem glândulas apicais; filetes alvos................. ...............................................................................2. Leucaena
-
11'. Pinas 20-25 pares. Inflorescências pêndulas; pedúnculos 340−601 mm compr.; anteras com glândulas apicais; filetes vináceos.....................................................................5. Parkia
-
-
-
-
-
-
-
-
1. Anadenanthera Speg., Physis (Buenos Aires) 6: 313. 1923.
Arbustos ou árvores. Ramos glabros, inermes, lenticelados, sem indumento ferrugíneo no ápice. Estípulas decíduas; nectários extraflorais peciolares sésseis, pateliformes, cupuliformes ou verruciformes, localizados na região basal ou mediana do pecíolo, os da raque sésseis, verruciformes, discoides, pateliformes ou cupuliformes, localizados na porção distal da raque entre os 3−4 últimos pares de pinas; pinas 12−24 pares; parafilídios ausentes; foliólulos da pina mediana 37−62 pares, 2,5−5 × 0,5−11 mm, margem inteira, tricomas simples, amarelados. Inflorescências capitadas globosas, eretas; pedúnculo 12-35 mm compr.; cicatriz ou invólucro do botão presente na base da inflorescência. Flores pentâmeras, diplostêmones, sésseis; filetes alvos, anteras com ou sem glândulas apicais, estaminódios laminares ausentes; ovário subestipitado. Folículos glabros; sementes 8−15, oblongas a elípticas, castanhas, aladas.
O gênero Anandenanthera apresenta duas espécies distribuídas das ilhas do Caribe ao Brasil, incluindo Peru, Bolívia, Argentina e Paraguai; provavelmente foi introduzida no Caribe. Para a flora do Brasil, são citadas duas espécies e quatro variedades (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Ocorre por quase todo o Brasil, na Amazônia, Cerrado e Mata Atlântica. O gênero caracteriza-se pela presença de frutos do tipo folículo, inflorescências capitadas globosas alvas e sementes aladas (Brenan 1955Brenan JPM (1955) Notes on Mimosoideae: I. Kew Bulletin 10: 161-192.). No Espírito Santo, está representado pelos quatro táxons citados para o Brasil.
- Chave de identificação das espécies e variedades de Anadenanthera no Espírito Santo
-
1. Invólucro da inflorescência (ou cicatriz deixada por este) distante 1,1−2,3 mm da base da inflorescência. Anteras com glândulas apicais. Folículos lisos ou reticulados, geralmente nítidos.
-
2. Segmentos interpinas 4−6 mm compr.; pina mediana 28−47 mm compr.; foliólulos da pina mediana 2,5−3 × 0,3−0,5 mm.........................................................1.1. Anadenanthera colubrina var. cebil
-
2'. Segmentos interpinas 9−10 mm compr., pina mediana 58−71 mm compr.; foliólulos da pina mediana 4−5 × 0,5−0,8 mm....................................................1.2. Anadenanthera colubrina var. colubrina
-
-
1'. Invólucro da inflorescência (ou cicatriz deixada por este) distante 5−8 mm da base da inflorescência. Anteras sem glândulas apicais. Folículos ásperos a verrucosos, foscos.
-
3. Pinas 12−15 pares, a mediana 45−67 mm compr., prolongamento da raque ca. 1 mm compr.; foliólulos da pina mediana 50−61 pares, 3,6−4 mm compr. Folículos retos, estípite 16−20 mm compr........................................................................1.4. Anadenanthera peregrina var. peregrina
-
3'. Pinas 16−21 pares, a mediana 29−42 mm compr., prolongamento da raque 0,35−0,5 mm compr.; foliólulos da pina mediana 37−50 pares, 2−3 mm compr. Folículos curvos, estípite 4−15 mm compr.............................................................................1.3. Anadenanthera peregrina var. falcata
-
1.1. Anadenanthera colubrina var. cebil (Griseb.) Altschul, Contr. Gray Herb. 193: 53-58. 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.. Figs. 2a; 3a-c
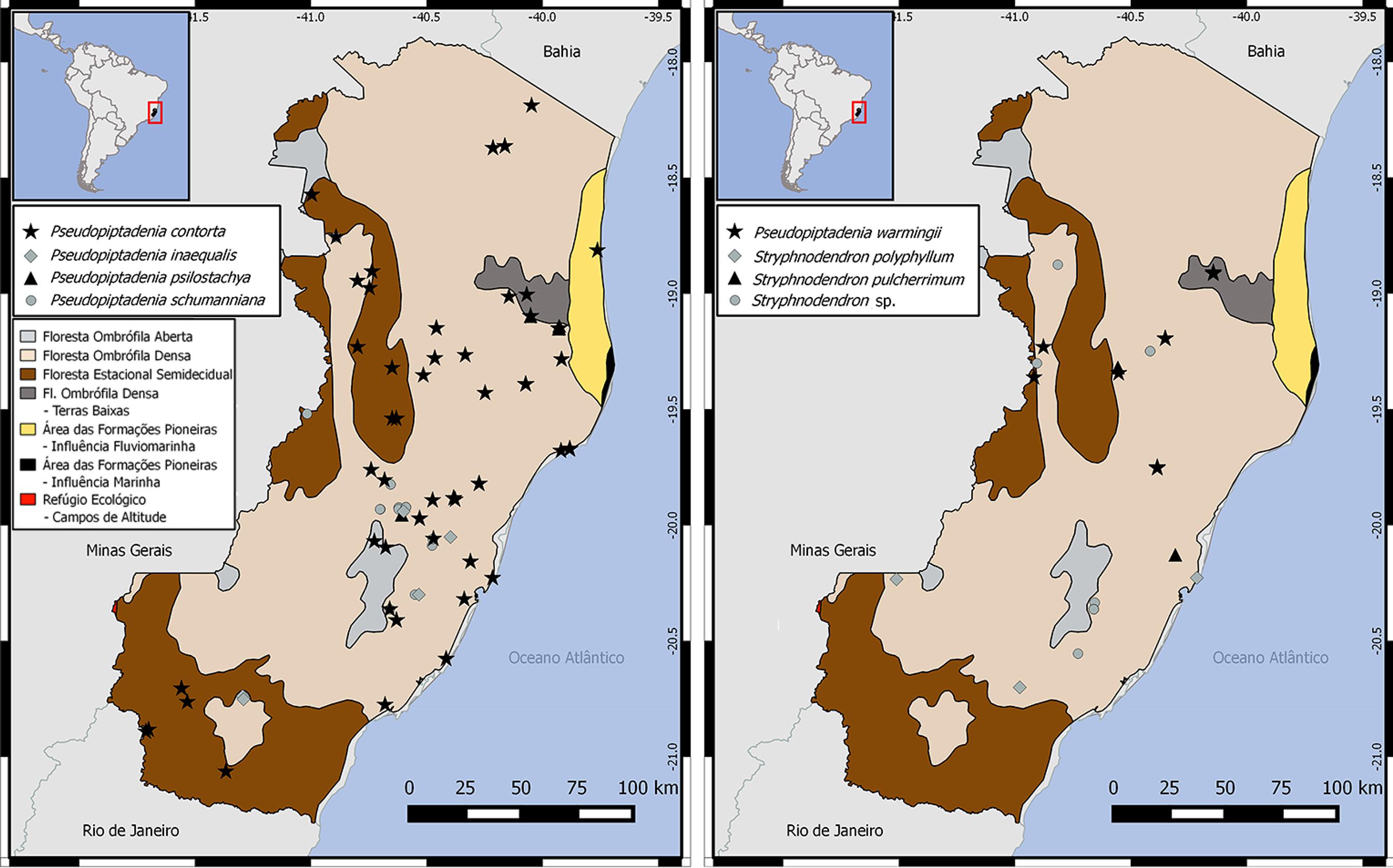
Distribuição geográfica de Mimoseae no Espírito Santo - a. Anadenanthera colubrina var. cebil (★), A. colubrina var. colubrina (♦), A. peregrina var. falcata (▲) e A. peregrina var. peregrina (●). b. Leucaena leucocephala (★), Neptunia plena (♦), Parapiptadenia pterosperma (▲) e Parkia pendula (●). c. Piptadenia adiantoides (★), Piptadenia gonoacantha (♦), Piptadenia micracantha (▲) e Piptadenia paniculata (●). d. Piptadenia santosii (★), Piptadenia trisperma (♦), Plathymenia reticulata (▲) e Pseudopiptadenia bahiana (●).
Figure 2
Geografic distribution of Mimoseae in Espírito Santo - a. Anadenanthera colubrina var. cebil (★), A. colubrina var. colubrina (♦), A. peregrina var. falcata (▲) and A. peregrina var. peregrina (●). b. Leucaena leucocephala (★), Neptunia plena (♦), Parapiptadenia pterosperma (▲) and Parkia pendula (●). c. Piptadenia adiantoides (★), Piptadenia gonoacantha (♦), Piptadenia micracantha (▲) and Piptadenia paniculata (●). d. Piptadenia santosii (★), Piptadenia trisperma (♦), Plathymenia reticulata (▲) and Pseudopiptadenia bahiana (●).
a-c. Anadenanthera colubrina var. cebil - a. nectário extrafloral peciolar; b. nectário extrafloral da raque; c. folículo. d-e. A. colubrina var. colubrina - d. folículo; e. invólucro do botão floral. f-g. A. peregrina var. falcata - f. folículo; g. semente. h-i. A. peregrina var. peregrina - h. folículo; i. invólucro do botão floral. j-k. Leucaena leucocephala - j. legume; k. semente. (a-c. S.R.D.F. da S. Nunes 122; d-e. D.A. Folli 1535; f-g. L.A. Silva 495; h-i. L.A. Silva 487; j-k. L.A. Silva 170).
Figure 3
a-c. Anadenanthera colubrina var. cebil – a. petiolar extrafloral nectary; b. rachis extrafloral nectary; c. follicle. d-e. A. colubrina var. colubrina – d. follicle; e. floral button involucre. f-g. A. peregrina var. falcata – f. follicle; g. seed. h-i. A. peregrina var. peregrina – h. follicle; i. floral button involucre. j-k. Leucaena leucocephala – j. legume; k. seed (a-c. S.R.D.F. da S. Nunes 122; d-e. D.A. Folli 1535; f-g. L.A. Silva 495; h-i. L.A. Silva 487; j-k. L.A. Silva 170).
Árvores, 15 m alt. Ramos cilíndricos a sulcados, castanhos, puberulentos. Estípulas não observadas; pecíolos 15−22 mm compr., nectários extraflorais peciolares sésseis, pateliformes, localizados na região basal ou mediana do pecíolo, raramente 2 nectários, um na região mediana e outro na apical; raque 101-115 mm compr., nectários extraflorais da raque sésseis, verruciformes a pateliformes, localizados no ápice da raque, entre o último par de foliólulos, segmentos interpinas 4-6 mm compr.; pinas 16-24 pares, pina mediana 28-47 mm compr., prolongamento da raque 0,7-1 mm compr.; foliólulos da pina mediana 42−55 pares, 2,5-3 × 0,3-0,5 mm, os medianos elípticos, ápice agudo, os distais elípticos a oblongos, ambas as faces glabras, exceto pela margem puberulenta. Inflorescências 10-14 × 10-13 mm; pedúnculo 12-22 mm compr.; bractéolas 0,9-1 mm compr., persistentes, glabras, exceto pela margem puberulenta; cicatriz ou invólucro do botão distante 1,1−2,3 mm da base da inflorescência. Cálice 1,5-2 mm compr., lobos 0,05-0,2 mm compr., glabro, exceto pelos lobos puberulentos; corola 2,7-3,5 mm compr., lobos 0,7-1,5 mm compr., tubo 2-2,1 mm compr., glabra; filetes 7,5-8,5 mm compr., anteras com glândulas apicais; ovário 0,5-1,2 mm compr., estípite 0,4-1 mm compr., glabro. Folículos 220-236 × 18,2-19,6 mm, estípite 29,3-37 mm compr., nítidos, reticulados, margem levemente sinuosa a reta; sementes 12-15.
Material examinado: Alegre, PCH - Santa Fé, área de vazão reduzida, 14.X.2008, fl., V.C. Manhães & D.R. Couto 134 (MBML). Baixo Guandú, 15.XII.1991, fl., D.A. Folli 1535 (CVRD, VIES). Cachoeiro de Itapemirim, 14.XI.2014, fl., D. Julkoski 50 (VIES).
Material examinado adicional: BRASIL. BAHIA: São Félix do Coribe, lageado de calcário, a 4 km à esquerda em estrada vicinal próximo a colônia de Formoso e cerca de 28 km de São Félix do Coribe, Estrada São Félix-Coribe, Caatinga arbustiva, 20.VII.2009, fr., J. Neri et al. 66 (RB).
Anadenanthera colubrina var. cebil ocorre na Argentina, Bolívia, Brasil, Paraguai e Peru (Altschul 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.). No Brasil é encontrada nas regiões Nordeste (Bahia), Sudeste (Minas Gerais, Rio de Janeiro e São Paulo) e Sul (Paraná), na Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.), sendo esta a primeira citação de sua ocorrência para o Espírito Santo. No estado, pode ser encontrada na Floresta Ombrófila Densa, na Floresta Estacional Semidecidual e na Restinga, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 5-530 m. Coletada com flores em outubro a dezembro. Caracteriza-se pelo invólucro ou cicatriz a 1,1−2,3 mm de distância da base da inflorescência e por possuir frutos com margens de levemente sinuosas a retas, com bordas mais espessadas que as de A. colubrina var. colubrina. Diferencia-se de A. peregrina por apresentar glândula no ápice da antera. É conhecida popularmente como cebil.
1.2. Anadenanthera colubrina (Vell.) Brenan var. colubrina, Kew Bull. 10(2): 182. 1955Brenan JPM (1955) Notes on Mimosoideae: I. Kew Bulletin 10: 161-192.. Figs. 2a; 3d,e
Árvores, 5−8 m alt. Ramos cilíndricos, castanhos, glabros. Estípulas não observadas; pecíolos 19−50 mm compr., nectários extraflorais peciolares sésseis, cupuliformes ou verruciformes, localizados na porção basal ou média do pecíolo; raque 92−151 mm compr., nectários extraflorais da raque sésseis, cupuliformes, localizados na porção distal da raque, entre os pares distais de pinas, segmentos interpinas 9−10 mm compr.; pinas 10-23 pares, nectários extraflorais da raquíola ausentes, pina mediana 58−71 mm compr., prolongamento da raque 0,2−0,9 mm compr.; foliólulos da pina mediana 46−74 pares, 3−5,7 × 0,5−0,85 mm, os medianos estreito-elípticos, ápice agudo a falcado, os distais elípticos, ápice arredondado a falcado, ambas as faces glabras, exceto pela margem pubescente. Inflorescências ca. 15 × 15 mm; pedúnculo ca. 15 mm compr.; bractéolas 0,9-1,4 mm compr., persistentes, glabras; cicatriz ou invólucro do botão distante ca. 1,8 mm da base do pedúnculo. Cálice 1,1-1,4 mm compr., lobos ca. 0,05 mm compr., glabro; corola 2,5-3,7 mm compr., lobos ca. 1,2 mm compr., tubo 1,7-2,5 mm compr., glabra; filetes 6-7,1 mm compr., anteras com glândulas apicais; ovário 1,1-1,2 mm compr., estípite 0,1-0,2 mm compr., glabro. Folículos 110−240 × 6−18 mm, estípite 14−24 mm compr., nítidos, lisos, margem regularmente constricta; sementes 9−11.
Material examinado: Águia Branca, Santa Luzia, 27.IV.2006, fr., V. Demuner 2268 (MBML, VIES); Pedra da Bandeira, 26.VII.2006, fr., L.F.S. Magnago et al. 1131 (MBML). Água Doce do Norte, Pedra das Torres, 12.III.2010, fr., D.P. Saraiva et al. 30 (RB). Pancas, Trilha do Morro do Camelo, propr. Fabio, 8.VII.2015, fr., L.A. Silva et al. 708 (VIES). Santa Teresa, Alto Santo Antônio, Terreno do Vago, Cruzeiro, 20.V.2005, fr., L. Kollmann 7802 (RB, MBML). São Roque do Canaã, Alto Misterioso, beira da estrada, 24.XII.2003, fl. A.P. Fontana et al. 663 (MBML, RB).
Anadenanthera colubrina var. colubrina ocorre na Argentina e Brasil (Altschul 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.), nas regiões Nordeste (Bahia, Ceará, Paraíba, Pernambuco, Piauí, Rio Grande do Norte e Sergipe), Centro-Oeste (Distrito Federal, Goiás, Mato Grosso do Sul e Mato Grosso) e Sudeste (Minas Gerais), na Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre nas formações: Floresta Ombrófila Densa e Floresta Estacional Semidecidual, em áreas de vegetação secundária e de atividades agrícolas, em altitudes que variam de 32-815 m. Coletada com frutos entre março e julho. Pode ser reconhecida entre os táxons de Anadenanthera pelos frutos com margens regularmente constrictas entre as sementes e pelos pecíolos e raques sulcados. Diferencia-se de A. colubrina var. cebil por apresentar um maior comprimento dos segmentos interpinas, pinas mais longas e foliólulos mais numerosos.
1.3. Anadenanthera peregrina var. falcata (Benth.) Altschul, Contr. Gray Herb. 193: 50-51. 1964. Figs. 2a; 3f,g
Arbustos, 2,4−15 m alt. Ramos cilíndricos, castanhos, glabros. Estípulas 1,3−2 × 0,2−0,7 mm, ovadas, pubescentes; pecíolos 14−16 mm compr., nectários extraflorais peciolares sésseis, impressos a semi-internos, localizados na região basal do pecíolo; raque 74−135 mm compr., nectários extraflorais da raque, sésseis, discoides ou verruciformes, localizados entre o último par de pinas, segmentos interpinas 4,4−7 mm compr.; pinas 16−21 pares, nectários extraflorais da raquíola ausentes, pina mediana 29−42 mm compr., prolongamento da raque 0,35−0,5 mm compr.; foliólulos da pina mediana 37−50 pares, 2−3 × 0,5−1 mm, os medianos elípticos, ápice arredondado, os distais elípticos, margem inteira, ambas as faces glabras. Inflorescências 9-10 × 9-10 mm; pedúnculo 22-27 mm compr.; bractéolas 0,9-1 mm compr., persistentes, glabras; cicatriz ou invólucro do botão distante ca. 5 mm da base do pedúnculo. Cálice 1,3-1,6 mm compr., lobos ca. 0,05 mm compr., glabro; corola 2,7-3,6 mm compr., lobos 0,25-0,6 mm compr., tubo 2-2,1 mm compr., glabra; filetes 8-9 mm compr., anteras sem glândulas apicais; ovário 1-1,5 mm compr., estípite 0,2-0,6 mm compr., glabro. Folículos 129−258 × 18−27 mm, estípite 4−15 mm compr., foscos, verrucosos, curvos, margem irregularmente constricta; sementes 8−11.
Material examinado: Águia Branca, São Pedro, 26.IV.2006, fr., V. Demuner 2243 (VIES, MBML). Água Doce do Norte, Afloramento rochoso "Antena da Vivo" e "Pedreira", 25.IX.2014, fr., L.A. Silva 498 (VIES). Barra de São Francisco, estrada Ecoporanga/Barra de São Francisco, 10.IX.2009, fr., L. Kollmann 11788 (MBML, VIES). Colatina, Alto Moacir, propr. Lalau, 11.IX.2007, fr., R.R. Vervloet et al. 3417 (MBML, VIES). Muqui, Serra da Morubia, estrada para Serra das Torres, 15.X.2009, fr., A.M. Assis 2192 (MBML). Nova Venécia, APA Pedra do Elefante, 24.IV.2013, fr., R.C. Forzza et al. 7641 (RB, VIES). Pancas, Pontões Capixabas, subida do Morro do Camelo, 8.VII.2015, fr., L.A. Silva 693 (VIES). Santa Luzia, 4.VII.2007, fr., R.R. Vervloet 2795 (MBML, VIES); Rochedo, 16.V.2007, fr., V. Demuner 3907 (VIES, MBML); 16.V.2007, fr., V. Demuner 3925 (MBML). Santa Teresa, São João de Petrópolis, 29.IV.2001, fr., L. Kollmann 3632 (MBML, VIES). Serra, APA Mestre Álvaro, trilha principal, 19.IX.2014, fr., L.A. Silva et al. 478 (VIES). Vila Velha, Morro do Penedo, 1.IV.2007, fr., J.M.L. Gomes 3013 (VIES). Vitória, 13.VIII.1991, fr., S.V. Pereira 109 (VIES); Parque Estadual da Fonte Grande, 3.VII.2003, fr., O.J. Pereira et al. 7191 (VIES).
Anadenanthera peregrina var. falcata ocorre no Brasil e Paraguai (Altschul 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.). No Brasil, é encontrada nas regiões Nordeste (Bahia e Paraíba), Centro-Oeste (Mato Grosso do Sul e Mato Grosso), Sudeste (Minas Gerais, Rio de Janeiro e São Paulo) e Sul (Paraná), na Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa e Floresta Estacional Semidecidual, em áreas de vegetação secundária e de atividades agrícolas, em altitudes que variam de 8-447 m. Foi coletada com frutos em abril e entre julho e novembro. É caracterizada pelos frutos curvos e com textura verrucosa, além disso, os ramos apresentam lenticelas. Diferencia-se de A. peregrina var. peregrina por possuir maior número de pinas (16−21 pares vs. 12−15 pares).
1.4. Anadenanthera peregrina (L.) Speg. var. peregrina, Physis (Buenos Aires) 6: 314. 1923. Figs. 2a; 3h,i
Árvores, 3−15 m alt. Ramos cilíndricos, castanhos, glabros. Estípulas não observadas; pecíolos 11−28 mm compr., nectários extraflorais peciolares sésseis, pateliformes, localizados na região mediana do pecíolo; raque 82−97 mm compr., nectários extraflorais da raque sésseis, pateliformes, segmentos interpinas 6−8 mm compr.; pinas 12−15 pares, nectários extraflorais da raquíola ausentes, pina mediana 45−67 mm compr., prolongamento da raque ca. 1 mm compr.; foliólulos da pina mediana 50−61 pares, 3,6−4 × 0,6−1 mm, os medianos elípticos, ápice agudo a mucronado, margem inteira, os distais elípticos, margem inteira, face adaxial glabra, face abaxial esparso-puberulenta. Inflorescências 8−9 × 8−9 mm; pedúnculo 24−35 mm compr.; bractéolas 0,9-1,1 mm compr., persistentes, glabras; cicatriz ou invólucro do botão distante 5−8 mm da base do pedúnculo. Cálice 1,4−2 mm compr., lobos 0,05−0,15 mm compr., glabro; corola 2,8-3,4 mm compr., lobos 0,7−1 mm compr., tubo 1,75-2,5 mm compr., glabra; filetes 7,7-8 mm compr., anteras sem glândulas apicais; ovário 0,85−0,9 mm compr., estípite 0,4-0,5 mm compr., glabro. Folículos 170−174 × 20−25 mm, estípite 16−20 mm compr., foscos, ásperos, retos, margem levemente sinuosa a reta; sementes 7−12.
Material examinado: Água Doce do Norte, 25.IX.2014, fl. e fr., L.A. Silva 487 (VIES). Águia Branca, Assentamento 16 de abril, 3.VII.2007, fr., R.R Vervloet et al. 2708 (MBML). Alegre, ARIE Laerth Paiva Gama, 15.II.2008, fr., A.M. Assis 1397 (VIES, MBML). Cachoeiro de Itapemirim, RPPN Cafundó, 1.IV.2009, fr., J.M.L. Gomes 3309 (VIES). Colatina, a 40 km de S.G. da Palha, lado esquerdo, 29.V.1990, fr., M.S. Menandro 184 (VIES, CVRD). Domingos Martins, 29. V.1993, fr., J.M. Simões 72 (VIES). Ibitirama, estrada entre os municípios de Iuna e Ibitirama, beira de estrada, 26.X.2012, fl., T.B. Flores 1577 (ESA, MBML). Mantenópolis, São Geraldo, 23.IX.2009, fl. e fr., A.M. Assis 2100 (MBML, VIES). Presidente Kennedy, São Salvador, 28.III.1993, fr., J.M.L. Gomes 2004 (VIES). São Gabriel da Palha, Faz. Rondeli, prox. Clube Campestre (Torre 72/1 - LT Mascarenhas x Verona), 26.IV.2008, fr., A.M. Assis 1577 (VIES, MBML, HUEFS).
Anadenanthera peregrina var. peregrina ocorre no Brasil, Colômbia, Guiana, Haiti, República Dominicana, Porto Rico e Venezuela (Altschul 1964Altschul SR (1964) A taxonomic study of the genus Anadenanthera. Contributions from the Gray Herbarium of Harvard University 193: 3-65.). No Brasil, ocorre nas regiões Norte (Amazonas, Pará e Roraima), Centro-Oeste (Distrito Federal, Goiás e Mato Grosso do Sul) e Sudeste (Minas Gerais), na Amazônia e Cerrado (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre nas formações: Floresta Ombrófila Densa, Floresta Ombrófila Aberta e Floresta Estacional Semidecidual, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 32-616 m. Coletada com flores em setembro e outubro e com frutos entre fevereiro a maio, agosto e setembro. Caracteriza-se pelo fruto com superfície áspera, cicatriz ou invólucro do botão localizado entre 5−8 mm de distância da base da inflorescência, ramos com lenticelas e sementes lustrosas. Além disso, em campo diferencia-se de A. peregrina var. falcata por características do tronco, pois esta possui tronco inerme e suberoso, formando placas, enquanto A. peregrina var. peregrina possui tronco com acúleos (Tamashiro 1989Tamashiro JY (1989) Estudos taxonômicos e morfológicos do gênero Piptadenia sensu Bentham no sudoeste do Brasil: avaliação das modificações taxonômicas recentemente propostas. Dissertação de Mestrado. Universidade Estadual de Campinas, São Paulo. 101p.).
2. Leucaena Benth., J. Bot. (Hooker) 4: 416. 1842.
O gênero Leucaena possui 22 espécies, encontradas nas Américas, exceto por Leucaena leucocephala (Lam.) de Wit, que foi introduzida em diversos países do mundo, em todos os continentes. No Brasil, ocorre apenas Leucaena leucocephala (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). São características do gênero: hábito arbustivo-arbóreo, ramos inermes, inflorescências capitadas globosas e fruto do tipo legume (Pedroche 1994Pedroche SZ (1994) Revisión del género Leucaena em México. Anales del Instituto de Biologia de la Universidad Nacional Autonoma de Mexico, Serie Botanica 65: 83-162.).
2.1. Leucaena leucocephala (Lam.) de Wit, Taxon 10: 54. 1961. Figs. 2b; 3j,k
Arbustos ou arvoretas, 2−4 m alt. Ramos cilíndricos, glabros, inermes, castanhos, sem indumento ferrugíneo no ápice. Estípulas decíduas, ca. 2 × 1 mm, lanceoladas a triangulares, glabras; pecíolos 15−25 mm compr., nectários extraflorais peciolares sésseis, pateliformes, localizados na porção basal do pecíolo; raque 105-140 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 16-19 mm compr.; pinas 7−8 pares, nectários extraflorais da raquíola ausentes, pina mediana 93−127 mm compr., prolongamento da raque 1,7-2 mm compr.; parafilídios ausentes; foliólulos da pina mediana 10−15 pares, 9−12 × 3−3,8 mm, os medianos elípticos, ápice apiculado, margem inteira, os distais elíptico-falcados, ambas as faces glabras. Inflorescências 16−19 × 16−19 mm, capitadas globosas, eretas; pedúnculo 24−26 mm compr.; bractéolas ca. 0,05 mm compr., persistentes, glabras; cicatriz ou invólucro do botão ausente na base do pedúnculo. Flores pentâmeras, diplostêmones, sésseis; cálice 2,5-3 mm compr., lobos 0,3-0,5 mm compr., glabro; corola 4-5,5 mm compr., lobos 4,3−5,8 mm compr., tubo ausente, glabra; filetes 6−8,8 mm compr., alvos, anteras sem glândulas apicais, estaminódios laminares ausentes; ovário 2-10 mm compr., estípite 0,4-0,7 mm compr., esparso-pubescente. Legumes 170−220 × 18−21 mm, estípite 19−31 mm compr., glabros, margens retas; sementes 12−17, elípticas, castanhas.
Material examinado: Anchieta, estrada de terra a caminho de Castellanos, beira da estrada à 7 metros do mar; no morro, 1.II.2012, fl. e fr., N.E. Oliveira Filho & D.T. Wandekoken 18 (VIES). Conceição da Barra, Parque Estadual de Itaúnas, 3.III.2007, fl. e fr., G. Pandolfii 08 (VIES). Piúma, Ilha do Francês, Restinga - prainha, 24.X.2002, fl. e fr., H. Pinheiro 43 (VIES); IX.2002, fr., H. Pinheiro 14 (VIES). Vila Velha, Parque Natural Municipal de Jacarenema, porção norte do Parque, próximo à ponte sobre o rio Jucu, área aberta periodicamente inundável, 27.X.2012, fl. e fr., L.A. Silva 277 (VIES); 28.VI.2012, fr., L.A. Silva 170 (VIES); Ponte da Madalena e praia, 1.III.2012. fl. e fr., L.A. Silva 105 (VIES).
Leucaena leucocephala possui distribuição Pantropical (Hughes 1998Hughes C (1998) Monograph of Leucaena (Leguminosae-Mimosoideae). Systematic Botany Monographs 55: 1-244.). No Brasil, ocorre nas regiões Norte (Acre e Amazonas), Nordeste (Bahia, Ceará, Paraíba e Pernambuco), Centro-Oeste (Distrito Federal e Mato Grosso), em todo o Sudeste e Sul (Paraná), ocorrendo na Amazônia, Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Estacional Semidecidual e Restinga, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 0-464 m. Coletada com flores em fevereiro, março e outubro, e com frutos em fevereiro, março, julho, setembro e outubro. Pode ser identificada pelo seguinte conjunto de caracteres: hábito arbustivo-arbóreo, ramos inermes, inflorescências capitadas globosas, alvas, legumes e sementes não aladas. É uma espécie com grande potencial invasor, devido às suas capacidades de dispersão, de produção e de germinação de sementes e pela alta tolerância a ambientes degradados, sendo considerada indicadora de ambientes impactados. É amplamente utilizada como forrageira (Manella et al. 2002Manella MQ, Lourenço AJ & Leme PR (2002) Recria de bovinos nelore em pastos de Brachiaria brizantha com suplementação protéica ou com acesso a banco de proteína de Leucaena lecocephala. Desempenho Animal. Revista Brasileria de Zootecnia 31: 2274-2282.). A espécie não está bem representada nos herbários pelo costume de se evitar a coleta de espécies invasoras, por isso o número de exemplares em herbário é insignificante em comparação à distribuição da planta em campo. Nome popular: leucena.
3. Neptunia Lour., Fl. Cochinch. 641, 653-654. 1790.
O gênero Neptunia apresenta 12 espécies com distribuição para a Austrália (4 spp.), China (2 spp.), India (1 spp.), Pantropical (1 spp.), Américas (1 spp.) e entre América Central e América do Sul (3 spp.) (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.). Três espécies são citadas para a flora do Brasil (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.): Neptunia plena (L.) Benth, N. oleracea Lour. e N. pubescens Benth. O gênero compreende ervas, terrestres ou aquáticas, com inflorescências com estames petaloides (Windler 1966Windler DR (1966) A revision of the genus Neptunia (Leguminosae). Australian Journal of Botany 14: 379-420.). No Espírito Santo, é representada apenas por uma espécie, N. plena (L.) Benth., uma nova ocorrência para o estado.
3.1. Neptunia plena (L.) Benth., J. Bot. (Hooker) 4: 355. 1842. Fig. 2b
Ervas, 20-40 cm alt. Ramos cilíndricos, glabros, inermes, castanhos a vináceos, alguns flexuosos, sem indumento ferrugíneo no ápice. Estípulas decíduas, 6-8 × 3,5-5 mm, cordiformes, esparso-puberulentas a glabras; pecíolos 9-21 mm compr., nectários extraflorais peciolares sésseis, pateliformes, localizados na porção terminal do pecíolo, abaixo do primeiro par de pinas; raque 21-48 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 15-25 mm compr.; pinas 3-4 pares, nectários extraflorais da raquíola ausentes, pina mediana 29-42 mm compr., prolongamento da raque 2-4 mm compr.; parafilídios ausentes; foliólulos da pina mediana 21-26 pares, 6-7,6 × 1-1,45 mm, os medianos elípticos, ápice agudo, margem inteira, os distais elípticos, ambas as faces glabras, exceto pela margem esparso-puberulenta. Inflorescências 12-18 × 5,5-6 mm, capitadas globosas, eretas; pedúnculo 70-105 mm compr.; bractéolas 1,5-2,3 mm compr., decíduas, glabras; cicatriz ou invólucro do botão ausente na base do pedúnculo. Flores pentâmeras, diplostêmones, sésseis; cálice 2,2-2,5 mm compr., lobos 0,4-0,6 mm compr., glabro; corola 2,5-4 mm compr., lobos 2,5-4 mm compr., tubo ausente, glabra; filetes 0,65-0,70 mm compr., brancos, antera com glândula apical, estaminódios laminares amarelos presentes nas flores basais da inflorescência; ovário 1,5-2,3 mm compr., estípite 0,1-0,5 mm compr., puberulento. Legumes ca. 20 × 9 mm, estípite ca. 4 mm compr., glabros a esparso-puberulentos, margens retas; sementes ca. 5, obovadas, castanhas.
Material examinado: Serra, Carapina, área antropizada, 21.III.2016, fl. e fr., D.T. Wandekoken & O.J. Pereira, 57 (VIES); 23.III.2016, fl. e fr., L.A. Silva & D.T. Wandekoken 714 (VIES).
Neptunia plena ocorre nos Estados Unidos, América Central, Venezuela, Suriname, Guiana Francesa, Equador, Colombia, Guiana e Brasil (Windler 1966Windler DR (1966) A revision of the genus Neptunia (Leguminosae). Australian Journal of Botany 14: 379-420.), nas regiões Norte (Acre, Amazonas e Pará), em toda região Nordeste e no Centro-Oeste (Goiás, Mato Grosso do Sul e Mato Grosso), na Amazônia, Caatinga, Cerrado, Mata Atlântica, Pantanal (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre na formação Floresta Ombrófila Densa, em área degradada, na altitude de 10 m. Coletada com flores e frutos em março. Esta espécie pode ser facilmente identificada pela presença de estaminódios petaloides amarelos nas flores basais da inflorescência.
4. Parapiptadenia Brenan, Kew Bulletin 17(2): 228. 1963.
O gênero Parapiptadenia apresenta seis espécies (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.) com distribuição restrita à América do Sul (Lima & Lima 1984) todas elas citadas para a flora do Brasil (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). O gênero compreende árvores e arbustos, que apresentam o seguinte conjunto de caracteres diagnósticos: filetes geralmente vináceos, legumes com as margens sinuosas a irregularmentes constrictas e sementes aladas. No Espírito Santo, é representada apenas por uma espécie: Parapiptadenia pterosperma (Benth.) Brenan.
4.1. Parapiptadenia pterosperma (Benth.) Brenan, Kew Bulletin 17(2): 228. 1963. Fig. 2b
Árvores, 5-25 m alt. Ramos cilíndricos, glabros, inermes, castanho-claros a castanhos, sem indumento ferrugíneo no ápice. Estípulas decíduas, ca. 1 × 0,5 mm, triangulares, glabras; pecíolos 15-21 mm compr., nectários extraflorais peciolares sésseis, pateliforme a verruciforme, localizados na porção basal do pecíolo; raque 38-44 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 8-9 mm compr.; pinas 5-6 pares, nectários extraflorais da raquíola ausentes, pina mediana 52-65 mm compr., prolongamento da raque ausente; parafilídios ausentes; foliólulos da pina mediana 14-16 pares, 8,7-10,3 × 2,7-3,1 mm, os medianos elípticos, ápice arredondado, margem inteira a levemente revoluta, os distais obovados, ambas as faces puberulentas, tricomas amarelados. Inflorescências 118-141 × 7,5-12 mm, espiciformes, eretas; pedúnculo 20-25 mm compr.; bractéolas ca. 0,1 compr., decíduas, pubescentes; cicatriz ou invólucro do botão ausente na base do pedúnculo. Flores pentâmeras, diplostêmones, sésseis; cálice 0,75-1 mm compr., lobos ca. 0,05 mm compr., glabro; corola 2,5-2,7 mm compr., lobos 1,4-2,2 mm compr., tubo 0,7-1 mm compr., glabra; filetes 3,6-4,55 mm compr., vináceos, anteras com glândulas apicais, estaminódios laminares ausentes; ovário 0,8-0,9 mm compr., estípite 1,4-1,5 mm compr., glabro. Legumes 120-200 × 25-38 mm, estípite 13-25 mm compr., glabros, margem sinuosa a irregularmente constricta; sementes 10−12, reniformes, achatadas, aladas e beges.
Material examinado: Colatina, Rio Doce, 1.XII.1943, fl., J.G. Kuhlmann 6578 (RB, IPA, HUEFS). Linhares, Reserva Natural da CVRD, 12.VIII.1982, fr., D.A. Folli 385 (CVRD, VIES); 16.XI.1977, fl., J. Spada 22 (CVRD, RB); 3.XII.1981, fl., D.A. Folli 349 (CVRD, RB, HUEFS). Marilândia, Liberdade, prop. Deoclécio Lorenccini, 11.XII.2007, fl., V. Demuner et al. 4738 (MBML, HUEFS, VIES); 11.XII.2007, fl., V. Demuner et al. 4738 (RB, MBML); 19.IV.2006, fr., L.F.S. Magnago et al. 947 (RB); 13.XII.2007, fr., R.R. Vervloet et al. 3511 (RB). Nova Venécia, APA Pedra do Elefante - estrada para a Pedra do Elefante, 25.IV.2010, fr., A.M. Assis 2456 (MBML, HUEFS). Santa Leopoldina, Pedra Branca, prop. Crist. Bremenkanp, 28.VIII.2007, fr., R.R. Vervloet et al. 3279 (RB); Fazenda Caioaba, 18.VII.2007, fr., R.R. Vervloet 2936 (RB, MBML). Serra, Mestre Álvaro, trilha principal, 15.II.2013, fr., A.D. Firmino et al. 8 (VIES).
Parapiptadenia pterosperma é endêmica do Brasil onde é encontrada nas regiões Nordeste (Bahia) e Sudeste (Espírito Santo, Minas Gerais, Rio de Janeiro), na Mata Atlântica (Lima & Lima 1984; BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Ombrófila Densa das Terras Baixas, Floresta Estacional Semidecidual e Restinga, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 7-751 m. Coletada com flores em janeiro, março, novembro e dezembro, com frutos em fevereiro, março, julho, agosto e dezembro. Parapiptadenia pterosperma pode ser identificada, entre as demais espécies de Mimoseae ocorrentes no Espírito Santo, pelo seguinte conjunto de caracteres: hábito arbóreo, ramos inermes, filetes geralmente vináceos, legumes com as margens sinuosas a irregularmente constrictas e sementes aladas.
5. Parkia R. Br., Narr. Travels Africa 234. 1826.
O gênero Parkia apresenta 34 espécies com distribuição pantropical (Hopkins 1984Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.), com três centros de diversidade: no Indopacífico (12 spp.), na região da Africa-Madagascar (4 spp.) e na região Amazônica (18 spp.) (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.). No Brasil ocorrem na Região Norte e Nordeste (Hopkins 1984Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.) se extendendo para a região Centro-Oeste e Sudeste (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.), somando no país 17 espécies. Compreende espécies com grandes inflorescências globosas, biglobosas, clavadas ou subesféricas, adaptadas para a polinização realizada por morcegos, suas flores possuem prefloração imbricada, diferindo das demais espécies da tribo, que possuem prefloração valvar (Hopkins 1986Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.). No Espírito Santo, está representado por apenas uma espécie, Parkia pendula.
5.1. Parkia pendula (Willd.) Benth. ex Walp., Repertorium Botanices Systematicae 5(4): 577. 1846. Fig. 2b
Árvores, 26-30 m alt. Ramos cilíndricos, glabros a puberulentos, inermes, castanhos, lenticelado, sem indumento ferrugíneo no ápice. Estípulas decíduas, não observadas; pecíolos 32-38 mm compr., nectários extraflorais peciolares, sésseis, verruciformes ou capitados, localizados na região basal ou mediana; raque 120-170 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 5-8 mm compr.; pinas 20-25 pares, nectários extraflorais da raquíola ausentes, pina mediana 38-45 mm compr., prolongamento da raque 5-7 mm compr.; parafilídios ausentes; foliólulos da pina mediana 60-76 pares, 7-8 × 1 mm, os medianos estreito-elípticos, ápice agudo, margem inteira, os distais elípticos, face adaxial pulverulenta com a margem pubescente, face abaxial glabra, tricomas amarelados. Inflorescências 19-25 × 19-25 mm, capitadas globosas, pêndulas; pedúnculo 340-601 mm compr.; bractéolas 5-9,5 mm compr., decíduas, glabras; cicatriz ou invólucro do botão ausente na base do pedúnculo. Flores pentâmeras, diplostêmones, sésseis; cálice 8,5-9 mm compr., lobos 0,5-1 mm compr., glabro a pubescente, exceto pelo ápice tomentoso; corola 8,2-10,5 mm compr., lobos ca. 7,2 mm compr., tubo ca. 2,8 mm compr., glabra, exceto pelo ápice pubescente a tomentoso; filetes 13-13,5 mm compr., vináceos, anteras com glândulas apicais, estaminódios laminares ausentes; ovário 4-5 mm compr., estípite 1,8-7 mm compr., glabro. Legumes 150-225 × 27-30 mm, estípite 3-25 mm compr., glabro, margens retas; sementes 8−11, não observadas.
Material examinado: Conceição da Barra, área 157 da Aracruz Celulose S.A., 10.IX.1992, fl. e fr., O.J. Pereira 3870 (VIES). Linhares, Reserva Vale, 16.XII.1981, fr., H.C. Lima 1671 (CVRD); 16.II.1990, fl. e fr., D.A. Folli 1100 (CVRD); 3.XI.1997, fr., M. Simonelli 823 (CVRD); 17.X.1984, fl., G.L. Farias 11 (CVRD); talhão 301, 27.XI.1972, fl., J. Spada 97 (CVRD); 21.XI.1979, fl., D.A. Folli 172 (CVRD). Pedro Canário, Rebio do Córrego Grande, 11.XI.2014, fr., L.A. Silva et al. 508 (VIES).
Parkia pendula distribui-se por Honduras, Colômbia, Venezuela, Guiana, Guiana Francesa, Peru, Brasil e Bolívia (Hopkins 1984Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.). No Brasil, ocorre em toda a região Norte, no Nordeste (Alagoas, Bahia, Ceará, Maranhão, Paraíba, Pernambuco, Piauí e Sergipe), Centro-Oeste (Mato Grosso) e Sudeste (Espírito Santo), na Amazônia e Mata Atlântica (Hopkins 1984Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.; BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre na formação Floresta Ombrófila Densa, em altitudes entre 3-92 m. Coletada com flores em fevereiro, outubro e novembro, com frutos em fevereiro, novembro e dezembro. Pode ser facilmente idenficada no Espírito Santo pelo seguinte conjunto de caracteres: hábito arbóreo e inflorescência com um longo pedúnculo (34-60 cm de comprimento).
6. Piptadenia Benth., J. Bot. (Hooker) 2(11): 135. 1840.
Trepadeiras, arbustos escandentes ou árvores. Ramos glabros a densamente pubescentes, aculeados ou raramente inermes, sem indumento ferrugíneo no ápice. Estípulas decíduas ou persistentes; nectários extraflorais da raque, sésseis ou estipitados, ciatiformes, circulares ou discoides, localizados na porção basal do pecíolo, entre os 3 pares de foliólulos apicais ou entre o par de folilólulos apicais; pinas 1-11 pares, parafilídios presentes ou ausentes; folíólulos da pina mediana 2-40 pares, 3-86 × 0,9-37 mm. Inflorescências espiciformes, eretas; pedúnculo 4-16 mm compr.; cicatriz ou invólucro do botão ausente na base da inflorescência. Flores pentâmeras, diplostêmones, sésseis; filetes alvos, avermelhados, esverdeados, lilases ou vermelhos, anteras com glândulas apicais, estaminódios laminares ausentes; ovário estipitado. Legumes glabros; sementes 5-12, elípticas a oblongas.
Piptadenia possui 21 espécies ocorrentes na América do Sul (Luckow 2005Luckow M (2005) Tribe Mimoseae. Lewis G, Schrire B, Mackinder B & Lock M (eds.) Legumes of the world. Royal Botanical Gardens, Kew. Pp. 163-183.; Jobson & Luckow 2007; Queiroz 2009), todas elas citadas para a flora do Brasil (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Os caracteres diagnósticos do gênero incluem o fruto do tipo legume, as sementes não aladas e geralmente a presença de acúleos ou espinhos nodais nos ramos (Ribeiro 2012Ribeiro PG (2012) Flora da Bahia: família Leguminosae, subfamília Mimosoideae: Tribo Acacieae e Tribo Mimoseae - Parte I. Dissertação de Mestrado. Universidade Estadual de Feira de Santana, Feira de Santana. 351p.). No Espírito Santo, está representado por seis espécies.
- Chave de identificação das espécies de Piptadenia no Espírito Santo
-
1. Foliólulos da pina mediana 2−6 pares.
-
2. Pinas 1−2 pares; segmentos interpinas 22,2−47 mm compr.; foliólulos da pina mediana 2 pares. Filetes esverdeados .................................................................................. 6.5. Piptadenia santosii
-
2'. Pinas 3−4 pares; segmentos interpinas 8−21,9 mm compr.; foliólulos da pina mediana 3−6 pares. Filetes alvos ou vermelhos.
-
3. Pecíolos 9−10 mm compr.; segmentos interpinas 8−14 mm compr. Inflorescências 70-78 mm compr.; filetes alvos. Legumes 32-36 mm larg. .......................... 6.4. Piptadenia paniculata
-
3'. Pecíolos 27−52 mm compr.; segmentos interpinas 17−21,9 mm compr. Inflorescências 53-61 mm compr.; filetes vermelhos. Legumes 17-27 mm larg. ......... 6.1. Piptadenia adiantoides
-
-
-
1'. Foliólulos da pina mediana 23−54 pares.
-
4. Estípulas ca. 1 mm compr.; pinas 5−6 pares; parafilídios presentes. Filetes lilases. Legumes 72-83 × 14-16 mm. Sementes 4−5 .................................................................. 6.6. Piptadenia trisperma
-
4'. Estípulas 3,5−4 mm compr.; pinas 6−11 pares; parafilídios ausentes. Filetes alvos ou avermelhados. Legumes 110-148 × 21-28 mm. Sementes 7−9.
-
5. Árvores. Nectários extraflorais peciolares cupuliformes, localizados na porção distal do pecíolo. Filetes alvos; ovários glabros ..................................... 6.2. Piptadenia gonoacantha
-
5'. Arbustos escandentes ou trepadeiras. Nectários extraflorais peciolares capitados, localizados na porção mediana do pecíolo. Filetes avermelhados; ovários puberulentos a pubescentes ........................................................................................................ 6.3. Piptadenia micracantha
-
-
6.1. Piptadenia adiantoides (Spreng.) J.F. Macbr., Contr. Gray Herb. 59: 17. 1919. Figs. 2c; 4a,b
a-b. Piptadenia adiantoides - a. foliólulo; b. ramo. c-e. Piptadenia gonoacantha - c. folhas e inflorescências; d. foliólulo; e. antera com glândula apical. f-h. P. micracantha - f. folha e inflorescência; g. nectário da raque; h. foliólulo. i. P. paniculata - folha. j-k. P. santosii - j. ramo; k. nectário da raque. (a-b. L.A. Silva 466; c-e. L.A. Silva 515; f-h. O.J. Pereira 7164; i. D.A. Folli 1638; j-k. M. Ribeiro 66).
Figure 4
a-b. Piptadenia adiantoides - a. foliolule; b. branch. c-e. Piptadenia gonoacantha - c. leaves and inflorescences; d. foliolule; e. anther with apical gland. f-h. P. micracantha - f. leaf and inflorescence; g. rachis nectary; h. foliolule. i. P. paniculata - leaf. j-k. P. santosii - j. branch; k. rachis nectary. (a-b. L.A. Silva 466; c-e. L.A. Silva 515; f-h. O.J. Pereira 7164; i. D.A. Folli 1638; j-k. M. Ribeiro 66).
Trepadeiras ou arbustos escandentes, 3−8 m alt. Ramos cilíndricos, glabros, aculeados, castanhos. Estípulas decíduas, ca. 2,9 × 0,2 mm, lanceoladas, pubescentes; pecíolos 27-52 mm compr., nectários extraflorais peciolares, sésseis, cupuliformes cônicos ou verruciformes, localizados na porção basal do pecíolo; raque 34-50 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 17-21,9 mm compr.; pinas 3-4 pares, nectários extraflorais da raquíola, sésseis, verruciformes a cupuliformes, localizado abaixo dos pares de pinas, prolongamento da raque ca. 1 mm compr., pina mediana 50-59 mm compr.; parafilídios ausentes; foliólulos da pina mediana 3-5 pares, 10-19× 7,5-9,5 mm, os medianos elípticos, ápice agudo, margem inteira, os distais oblongos a elípticos, face abaxial glabra, exceto pela nervura principal puberulenta, face adaxial esparsamente puberulenta, tricomas amarelados. Inflorescências 53-61 × 4,8-6,1 mm; pedúnculo 7-16 mm compr.; bractéolas 2-2,5 mm compr., decíduas, esparso-puberulentas. Cálice 0,7-1,2 mm compr., lobos ca. 0,05 mm compr., glabro a puberulento; corola 1,9-2,1 mm compr., lobos 1,1-2 mm compr., tubo 0,05-1 mm compr., glabra; filetes 2,4-3,5 mm compr., vermelhos; ovário 0,4-0,7 mm compr., estípite 0,6-1,3 mm compr., tomentoso. Legumes 48-150 × 17-27 mm, estípite 10,8-15 mm compr., margem reta a levemente sinuosa; sementes 7-10, elípticas, castanhas.
Material examinado: Alto Rio Novo, Monte Carmelo, Macega, 23.IX.2009, fr., A.M. Assis & A Wieringa 2089 (MBML, VIES). Castelo, Parque Estadual do Forno Grande, trilha para as piscinas, Floresta Ombrófila Densa Altomontana com inselbergues, 17.VII.2008, fr., A.P. Fontana 5400 (RB, MBML). Conceição da Barra, Parque Estadual de Itaúnas, 18.V.2014, fl., L.A. Silva 430 (VIES). Itaguaçu, Caparaó, 17.VII.2007, fr., L. Kollmann et al. 9927 (MBML); Pedra Menina, Parque Nacional do Caparaó, 29.IV.2015, fl., L.A. Silva et al. 676 (VIES). Linhares, Comboios, Restinga, Mata seca, 19.X.1993, fr., O.J. Pereira 5105 (VIES); Reserva da Companhia Vale do Rio Doce, Aceiro catelã, 8.IV.2006, fl., M. A. Pinho-Ferreira 611 (RB); Trilha do Flamengo, 17.VIII.2014, fr., L.A. Silva et al. 472 (VIES). Mimoso do Sul, Conceição do Muqui, Pedra dos Pontões, 21.IV.2010, fl., D.R. Couto & T.R. Couto 1574 (VIES). Pedra Azul, Rod. BR-262, Pedra Azul, 7.IV.1984, fl., G. Hatschbach 47692 (RB, MBML); 7.IV.1984, fl., G. Hatschbach 47692 (RB, MBML). Pedro Canário, Rebio do Córrego Grande, 11.XI.2014, fr., L.A. Silva et al. 509, 510 (VIES). Pinheiros, Reserva Biológica de Córrego do Veado, Floresta Atlântica de Tabuleiro, estrada a direita da sede da reserva a cerca de uns 5 km, 2.XI.2010, fr., M. Ribeiro 338 (VIES). Santa Teresa, Penha, 10.IV.1984, fl., W. Boone 33 (MBML, RB); Dois Pinheiros, mata do Banestes, 31.VI.1998, fr., L. Kollmann et al. 160 (MBML). São Mateus, Bairro do Guriri, 13.III.2007, fr., R.D. Ribeiro 788 (RB); Lajinha, estrada velha para Conceição da Barra, lado esquerdo do rio Cricaré, Restinga Pleistocênica, 6.VI.2007, fl., M.C. Souza et al. 532 (MBML, RB). Serra, Bicanga, Tabuleiro, 27.V.1993, fl., O.J. Pereira 4559 (VIES); Bacia Rio Jacaraípe, Dominio Floresta Ombrófla Densa de terras baixas, Tabuleiro, 12.VIII.2009, fl., O.J. Pereira 7707 (VIES); Parque Ecológico da C.S.T., área de Tabuleiro (Ipês), 22.IV.1995, fl., I. Weiler Junior 199 (VIES). Serra do Caparaó, 262 km 310, 28.IV.1975, fl., P. Occhioni 7210 (RB). Sooretama, Reserva Biológica de Sooretama, estrada do meio, borda da trilha, 26.X.2013, fr., A. Alves-Araújo 1631 (VIES); Estrada do Picadão, 10.VII.2014, fr., L.A. Silva et al. 466 (VIES).
Piptadenia adiantoides é endêmica do Brasil e ocorre nas regiões Nordeste (Bahia, Paraíba, Pernambuco), Sudeste e Sul (Paraná), podendo ser encontrada na Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Ombrófila Densa das Terras Baixas, Floresta Estacional Semidecidual, Restinga e área das Formações Pioneiras, em vegetação com influência fluviomarinha e de influência marinha, em vegetação secundária e de atividades agrícolas, em altitudes entre 0-1.245 m. Coletada com flores entre abril e junho, com frutos em março e de maio a novembro. Piptadenia adiantoides é uma espécie com muitos pontos de ocorrência e bem coletada no Espírito Santo, provavelmente por ocorrer frequentemente nas bordas das matas, onde são visíveis e de mais fácil acesso. As folhas são semelhantes às de P. paniculata, pois possuem o mesmo número de pares de pinas (3-4 em P. adiantoides vs. 4 em P. paniculata). No entanto, as espécies podem ser diferenciadas por meio das seguintes características: tamanhos dos pecíolos (27-52 mm compr. em P. adiantoides vs. 9-10 mm compr. em P. paniculata), número de foliólulos da pina mediana (3-5 pares vs. 6 pares), tamanho das bractéolas (2-2,5 mm compr. vs. 0,3-0,4 compr.), e tamanho do pedúnculo (7-16 mm compr. vs. ca. 6 mm compr.).
6.2. Piptadenia gonoacantha (Mart.) J.F.Macbr., Contr. Gray Herb. 59: 17. 1919. Figs. 2c; 4c-e
Árvores, ca. 12 m alt. Ramos cilíndricos, glabros a tomentosos, aculeados, castanhos. Estípulas decíduas, ca. 3,5 × 0,2 mm, lanceoladas, pubescentes; pecíolos 10-16,4 mm compr., nectários extraflorais peciolares, sésseis, cupuliformes, localizados na porção distal do pecíolo; raque 27-60 mm compr., nectários extraflorais da raque, sésseis, cupuliformes, localizados entre os 2 pares apicais de foliólulos, segmentos interpinas 6-9,7 mm compr.; pinas 6-11 pares, nectários extraflorais da raquíola ausentes, pina mediana 37-54 mm compr., prolongamento da raque ca. 1,4 mm compr.; parafilídios ausentes; foliólulos da pina mediana 31-54 pares, 2,8-4,2 × 0,4-0,9 mm, os medianos triangulares, ápice agudo, margem inteira, os distais elípticos, ambas as faces glabras. Inflorescências 50-91 × 9-11 mm; pedúnculo 6,5-12 mm compr.; bractéolas 0,3-0,5 mm compr., decíduas, puberulentas. Cálice 0,5-0,8 mm compr., lobos 0,05-0,1 mm compr., glabro a puberulento; corola 1,9-2,3 mm compr., lobos 1,4-1,5 mm compr., tubo 0,5-0,7 mm compr., glabra; filetes 3-3,5 mm compr., alvos; ovário 0,5-0,6 mm compr., estípite 0,5-1,6 mm compr., glabro. Legumes 110-141 × 21-28 mm, estípite 10-15 mm compr., margem levemente sinuosa a reta; sementes 7-9, oblongas, castanhas.
Material examinado: Cariacica, Reserva Biológica de Duas Bocas, 18.VI.2014, fr., L.A. Silva et al. 449 (VIES); estrada para São Paulo de Biriricas, 20.XII.1991, fr., J.M.L. Gomes 1691 (VIES, HUEFS). Castelo, Mata das Flores, 18.IV.2014, fr. L.A. Silva et al. 404 (VIES). Dores do Rio Preto, Parque Nacional do Caparaó, 29.IV.2015, fl., L.A. Silva et al. 674 (VIES). Governador Linbemberg, Propriedade particular de Firmino Sotele, 19.XI.2014, fl., L.A. Silva et al. 515 (VIES). Guarapari, 27.V.1994, fr., S.V. Dutra s.n. (VIES 6774). Nova Venécia, Morros próximos ao Rio Cricaré, 2.VI.2014, fr., L.A. Silva 438 (VIES). Pancas, subida do Morro do Camelo, propr. Fabio, 8.VII.2015, fr., L.A. Silva et al. 697 (VIES). Vitória, Parque Estadual da Fonte Grande, fr., G.N. Martins 63 (VIES).
Piptadenia gonoacantha ocorre no Peru, Bolívia, Paraguai e Brasil, onde se distribui nas regiões Nordeste (Alagoas, Bahia, Paraíba, Pernambuco, Rio Grande do Norte, Sergipe), Centro-Oeste (Mato Grosso do Sul), Sudeste e Sul, no Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Ombrófila Aberta, Restinga e Floresta Estadual Semidecidual, em vegetação secundária e de atividades agrícolas, em altitudes entre 11-936 m. Coletada com flores em abril e novembro, com frutos de abril a julho e em dezembro. Um caráter morfológico importante para a identificação da espécie é a morfologia externa do caule, que possui cristas tetragonais na superfície, característico desta espécie (Ribeiro 2012Ribeiro PG (2012) Flora da Bahia: família Leguminosae, subfamília Mimosoideae: Tribo Acacieae e Tribo Mimoseae - Parte I. Dissertação de Mestrado. Universidade Estadual de Feira de Santana, Feira de Santana. 351p.). Entre as espécies arbóreas de Piptadenia encontradas no Espírito Santo, P. gonoacantha pode ser reconhecida por possuir o número maior de pinas (6-11 pares vs.1-2 pares em P. santosii e 3-4 pares em P. paniculata) e o número maior de foliólulos na pina mediana (31-54 pares vs. 5-6 em P. paniculata e ca. 2 em P. santosii). Conhecida popularmente como pau-jacaré.
6.3. Piptadenia micracantha Benth., Trans. Linn. Soc. London 30(3): 369. 1875. Figs. 2c; 4f-h
Arbustos escandentes ou trepadeiras. Ramos cilíndricos, canaliculados, pubescentes, aculeados, castanhos. Estípulas decíduas, 4 × 0,1-0,2 mm, lineares, pubescentes; pecíolos 15-52 mm compr., nectários extraflorais peciolares, sésseis, capitados, localizados na porção mediana do pecíolo; raque 24-95 mm compr., nectários extraflorais da raque sésseis, capitados, localizados entre o par de foliólulos apicais, segmentos interpinas 4-9 mm compr.; pinas 6-11 pares, nectários extraflorais da raquíola ausentes, pina mediana 23-40 mm compr., prolongamento da raque ca. 1,4 mm compr.; parafilídios ausentes; foliólulos da pina mediana 23-40 pares, 3-5 × 1 mm, os medianos elípticos, ápice agudo, margem inteira a revoluta, os distais elípticos, ambas as faces pubescentes nas nervuras centrais e margens, tricomas amarelados. Inflorescências 55-115 × 5-9 mm; pedúnculo 7-11 mm compr., bractéolas ca. 0,5-0,9 mm compr., persistentes, pubescentes. Cálice 0,9-1,6 mm compr., lobos 0,05-0,1 mm compr., puberulento a pubescente; corola 2,1-2,5 mm compr., lobos 1,5-2,35 mm compr., tubo 0,05-0,7 mm compr., glabra a esparso-puberulenta; filetes 3,5-4,5 mm compr., avermelhados; ovário 0,7-1 mm compr., estípite 0,7-1 mm compr., puberulento a pubescente. Legumes 125-148 × 26,5-27,5 mm, estípite 8,5-10 mm compr., margem reta a levemente sinuosa; sementes imaturas 8-9, não observadas.
Material examinado: Colatina, Jequitibá, 23.V.2008, fl., A.M. Assis 1677 (MBML, VIES). Domingos Martins, Panelas, 23.V.1993, fl., J.M.L. Gomes 1872 (VIES). Ibitirama, Trilha do Tecnotruta, 29.IV.2015, fl., L.A. Silva et al. 675 (VIES). Santa Teresa, Serra do Gelo, nascente do rio Sta Mª Rio Doce, divisor de água, 16.VII.2003, fr., A.M. Assis et al. 912 (MBML, HUEFS, VIES). Vitória, Parque Estadual da Fonte Grande, 29.V.2003, fl., O.J. Pereira 7164 (VIES).
Piptadenia micracantha é endêmica do Brasil e ocorre apenas na Região Sudeste, nos estados de Minas Gerais, Rio de Janeiro e São Paulo, na Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência no Espírito Santo, onde habita as formações: Floresta Ombrófila Densa e Floresta Estacional Semidecidual, em vegetação secundária e com atividades agrícolas, em altitudes entre 44-936 m. Coletada com flores em abril e maio, com frutos em julho. Piptadenia micracantha pode ser diferenciada das demais espécies de Piptadenia no estado, por apresentar o seguinte conjunto de caracteres: hábito arbustivo escandente ou trepador, estípulas medindo cerca de 4 mm de comprimento e pina mediana com 23-40 mm de comprimento.
6.4. Piptadenia paniculata Benth., J. Bot. (Hooker) 4(31): 338. 1842. Figs. 2c; 4i
Árvores, 14-29 m alt. Ramos cilíndricos, glabros, inermes, raramente aculeados, castanhos. Estípulas decíduas, não observadas; pecíolos 9-10 mm compr., nectários extraflorais peciolares sésseis, pateliformes, localizados na porção basal do pecíolo; raque 27,4-48 mm compr., nectários extraflorais da raque sésseis, ciatiformes, localizados abaixo do par apical de foliólulos, segmentos interpinas 8-14 mm compr.; pinas 3-4 pares, nectários extraflorais da raquíola ausentes, pina mediana 42-83 mm compr., prolongamento da raque ausente; parafilídios ausentes; foliólulos da pina mediana 5-6 pares, 20-23 × 8-12 mm, os medianos elípticos, ápice arredondado a agudo, margem inteira, os distais oblongos, face adaxial glabra, face abaxial esparso-puberulenta, exceto pela região da nervura primária puberulenta, tricomas amarelados. Inflorescências 70-78 × 6,5-7 mm; pedúnculo ca. 6 mm compr.; bractéolas 0,3-0,4 mm compr., persistentes, pubescentes. Cálice ca. 0,5 mm compr., lobos ca. 0,1 mm compr., esparso-puberulento; corola 1,2-1,6 mm compr., lobos 0,8-1 mm compr., tubo 0,4-0,6 mm compr., puberulenta; filetes ca. 3,5 mm compr., alvos; ovário ca. 0,5 mm compr., estípite ca. 0,45 mm compr., pubescente. Legumes 140-165 × 32-36 mm, estípite 15-18 mm compr., margem levemente sinuosa; sementes 7-12, elípticas a oblongas, negras.
Material examinado: Conceição da Barra, Reserva Biológica de Córrego Grande, domínio Floresta Ombrófila de Terras Baixas com trechos arenosos constituindo mussununga, 1.X.2008, fr., O.J. Pereira et al. 7666 (VIES). Linhares, Reserva Natural Vale, próximo ao pomar de frutas tropicais, 14.IX.1992, fr., D.A. Folli 1638 (CVRD); pasto, 12.III.2007, fl., D.A. Folli 5507 (CVRD); 23.I.2008, fl., J.A. Lombardi et al. 7116 (CVRD); localizada no final da estrada, 14.III.1990, fl., D.A. Folli 1111 (CVRD). Presidente Kennedy, São Salvador, 6.II.1988, fl., J.M.L. Gomes 493 (VIES).
Piptadenia paniculata é endêmica do Brasil e distribui-se pelas regiões Nordeste (Bahia), Sudeste e Sul (Paraná, Santa Catarina), podendo ser encontrada na Caatinga e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Estacional Semidecidual e Restinga, em vegetação secundária e com atividades agrícolas, em altitudes entre 3-727 m. Coletada com flores de janeiro a março, com frutos em setembro e outubro. Piptadenia paniculata pode ser identificada no Espírito Santo pelo do hábito arbóreo, ramos geralmente inermes e folhas com 3-4 pares de pinas. Assemelha-se a P. adiantoides e a relação entre as espécies já foi discutida nos comentários desta espécie.
6.5. Piptadenia santosii Barneby ex G.P.Lewis. Kew Bull. 46(1): 162.1991. Figs. 2d; 4j,k
Árvores, ca. 4 m alt. Ramos cilíndricos, puberulento a denso-pubescente, aculeados, verdes. Estípulas persistentes, 5-5,5 × 0,15 mm, lineares, denso-pubescentes; pecíolos 32-64 mm compr., nectários extraflorais peciolares sésseis, cupuliformes, localizados na porção basal do pecíolo; raque ca. 47 mm compr., nectários extraflorais da raque estipitados, ciatiformes ou cilíndricos, entre o par de foliólulos apicais, segmentos interpinas 22,2−47 mm compr.; pinas 1-2 pares, nectários extraflorais da raquíola ausentes, pina mediana 79-110 mm compr., prolongamento da raque ca. 2 mm compr.; parafilídios ausentes; foliólulos da pina mediana 2 pares, 41-86 × 19-37 mm, os medianos elípticos-falcados, ápice agudo, margem inteira, os distais elíptico-falcados, ápice agudo, ambas as faces esparso-puberulentas, exceto pelas nervuras primárias e secundárias e a margem pubescentes, tricomas amarelados. Inflorescências 40-81 × 5-9,5 mm; pedúnculo 8-15 mm compr.; bractéolas 1-2 mm compr., persistentes, tomentosas. Cálice 1,5-1,6 mm compr., lobos 0,2-0,25 mm compr., pubescente; corola 2,2-2,5 mm compr., lobos 0,05-1,3 mm compr., tubo 1,2-2,2 mm compr., glabra a pubescente; filetes 4,5-5,7 mm compr., esverdeados; ovário 0,4-0,7 mm compr., estípite 1,1-1,8 mm compr., puberulento a tomentoso. Legumes não observados.
Material examinado: Sooretama, Reserva Biológica de Sooretama, 20.I.2010, fl., M. Ribeiro 83 (VIES); 18.I.2010, fl., M. Ribeiro 66 (VIES).
Piptadenia santosii é endêmica do Brasil (BFG 2015) e é citada na literatura apenas para os estados da Bahia e Minas Gerais (Ribeiro 2012). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre na Floresta Ombrófila, em altitude de 98 m. Coletada com flores em janeiro. Difere-se das demais espécies do gênero ocorrentes no Espírito Santo por possuir o menor número de pinas, 1 ou 2, enquanto nas demais espécies o número varia entre 3 e 11. Além disso, P. santosii possui o maior comprimento de segmentos interpinas do gênero, medindo cerca de 47 mm de comprimento. A forma dos foliólulos distais, elíptico-falcados, também pode ser utilizada na identificação da espécie.
6.6. Piptadenia trisperma (Vell.) Benth., J. Bot. (Hooker) 4(31): 337. 1841. Figs. 2d; 5a-d
a-d. Piptadenia trisperma - a. ramo; b. nectário extrafloral do pecíolo tipo incluso-côncavo; c. nectário extrafloral da raque tipo cupuliforme; d. foliólulo. e-g. Pseudopiptadenia inaequalis - e. folha; f. nectário extrafloral da raquíola ciatiforme; g. foliólulo. h-i. P. schumanniana - h. folha; i. foliólulo. (a-d. O.J. Pereira 1410; e-g. D.A. Folli 6203; h-i. L. Kollmann 3789).
Figure 5
a-d. Piptadenia trisperma - a. branch; b. included in-concave extrafloral nectaries of the petiole; c. rachis with cupuliform extrafloral nectaries; d. foliolule. e-g. Pseudopiptadenia inaequalis - e. leaf; f. raquiole with ciatiform extrafloral nectaries; g. foliolule. h-i. P. schumanniana - h. leaf; i. foliolule. (a-d. O.J. Pereira 1410; e-g. D.A. Folli 6203; h-i. L. Kollmann 3789).
Arbustos escandentes. Ramos cilíndricos, glabros, com lenticelas, com espinhos nodais, castanhos. Estípulas decíduas, ca. 1 × 0,2 mm, lanceoladas ou estrito-triangulares, puberulentas; pecíolos 18-26 mm compr., nectários extraflorais peciolares sésseis, ciatiformes ou discoides, localizados na porção basal do pecíolo; raque 40-93 mm compr., nectários extraflorais da raque sésseis, ciatiformes ou discoides, entre os 3 pares de foliólulos apicais, segmentos interpinas 8,3-20 mm compr.; pinas 5-6 pares, nectários extraflorais da raquíola ausentes, pina mediana 27−58 mm compr., prolongamento da raque 1-1,4 mm compr.; parafilídios presentes; foliólulos da pina mediana 29-39 pares, 5-8 × 1 mm, os medianos estreito-obovados, ápice agudo a acuminado, margem inteira, os distais elípticos a elíptico-falcados, ambas as faces glabras, exceto pela margem puberulenta, tricomas alvos. Inflorescências 35-50 × 5-6 mm; pedúnculo 2,3−4 mm compr.; brácteas ca. 5 mm compr., persistentes, glabras exceto pelo ápice pubescente. Cálice 0,6-0,75 mm compr., lobos ca. 0,05 mm compr., glabro; corola 1,7-1,9 mm compr., lobos 1,7-1,9 mm compr., tubo ausente, glabra; filetes 3−3,2 mm compr., lilases; ovário ca. 2,6 mm compr., estípite 0,2−0,4 mm compr., glabro. Legumes 72-83 × 14-16 mm, estípite ca. 14 mm compr., margem reta a levemente sinuosa; sementes 4-5, não observadas.
Material examinado: Rio Novo do Sul, Rodovia do Sol, entroncamento para Marataízes, próximo a Pontal, 10.V.1987, fr., H.C. de Lima 2908 (RB). Serra, 4.II.1986, fl., O.J. Pereira 1410 (VIES). Vila Velha, Morro do Moreno, 14.I.2012, fl., R.T. Valadares et al. 1187 (VIES).
Endêmica do Brasil, Piptadenia trisperma ocorre na Região Sudeste (Espírito Santo, Rio de Janeiro), na Mata Atlântica (BFG 2015). No Espírito Santo, pode ser encontrada em Floresta Ombrófila Densa, Floresta Estacional Semidecidual e Restinga, em altitudes entre 0-102 m. Coletada com flores em janeiro, fevereiro e maio. Piptadenia trisperma apresenta o seguinte conjunto de características diagnósticas: o hábito arbustivo escandente e a presença de parafilídios, compartilhados apenas com P. micracantha. Diferencia-se desta espécie pelo comprimento das estípulas (ca. 1 mm em P. trisperma vs. ca. 4 mm em P. micracantha) e o comprimento das inflorescências (35−50 mm em P. trisperma vs. 55-115 mm em P. micracantha). Conhecida popularmente como cobi.
7. Plathymenia Benth., J. Bot. (Hooker) 2: 134. 1840.
O gênero Plathymenia é monotípico, representado apenas por Plathymenia reticulata Benth., que ocorre na América do Sul (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.). São características diagnósticas do gênero as inflorescências espiciformes, a corola dialipétala, o ovário estipitado e os criptolomentos com 10-17 sementes.
7.1. Plathymenia reticulata Benth., J. Bot. (Hooker) 4(30): 334. 1841. Fig. 2d
Árvores, ca. 16 m alt. Ramos cilíndricos, glabros, inermes, castanhos, nectários extraflorais sésseis, ciatiformes ou cupuliformes, localizados próximos das inserções das folhas, sem indumento ferrugíneo no ápice. Estípulas ausentes; pecíolos 25-31 mm compr., nectários extraflorais peciolares ausentes; raque 85-89 mm compr., nectários extraflorais da raque sésseis, verruciformes e cupuliformes, localizados por toda a raque entre os pares de pinas, segmentos interpinas 12,7-17 mm compr.; pinas 7-9 pares, nectários extraflorais da raquíola ausentes, pina mediana 63-76 mm compr., prolongamento da raque ausente; parafilídios ausentes; foliólulos da pina mediana 12-15 pares, 8,2-12 × 3-5 mm, os medianos elípticos, ápice arredondado a retuso, margem inteira a levemente retusa, os distais obovados, face adaxial glabra, face abaxial esparso-puberulenta, tricomas amarelos. Inflorescências 104-146 × 10,6-1,5 mm, espiciformes, eretas; pedúnculo 17-35 mm compr.; bractéolas não observadas, decíduas; cicatriz ou invólucro do botão ausente na base da inflorescência. Flores pentâmeras, diplostêmones, pediceladas; cálice 1,2−1,4 mm compr., lobos 0,1−0,2 mm compr., glabro; corola 3,3−3,6 mm compr., lobos 3,2−3,5 mm compr., tubo ca. 0,1 mm compr., glabra; filetes 4,7−5,3 mm compr., alvos ou castanho-claros, anteras com glândulas apicais, estaminódios laminares ausentes; ovário 1,5-2 mm compr., estípite 1,3−1,7 mm compr., tomentoso. Criptolomentos 116-160 × 27-38 mm, estípite 87-93 mm compr., glabros, margem reta a levemente sinuosa; sementes 10-17, estreito-oblongos, castanho-claras.
Material examinado: Águia Branca, Santa Luzia, propr. Ciro Ferreira, 20.XII.2007, fl., V. Demuner et al. 4854 (MBML, VIES). Domingos Martins, Panelas, Mata Atlântica, 23.V.1993, fr., J.M.L. Gomes1896 (VIES). Governador Lindemberg, Alto Moacir, propr. Vitório Salomão, 21.II.2006, fr., L.F.S. Magnago et al. 716 (MBML, VIES). Itaguaçu, palmeiras à dist., 4.XI.2004, fl., A.A. da Luz 254 (CVRD). Nova Venécia, poção, 29.IX.2009, fl., A.M. Assis 2114 (MBML, VIES). Rio Bananal, 6.I.2008, fl., D.A. Folli 5827 (CVRD). São Gabriel da Palha, estrada para Barra Seca, 29.IX.2009, A.M. Assis 2117, fl., (VIES). Serra, rio Timbuí, Fazenda Decuria, km 230 da BR101, 7.VI.1990, fr., M.S Menandro 195 (CVRD, VIES).
Plathymenia reticulata ocorre no Brasil, Paraguai, Bolívia, Suriname e Argentina (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.). No Brasil, pode ser encontrada nas regiões Norte (Pará), Nordeste (Bahia, Ceará, Maranhão, Piauí), Centro-Oeste, Sudeste e Sul (Paraná) (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito Santo, ocorre nas formações: Floresta Ombrófila Densa, Floresta Estacional Semidecidual e Restinga, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 18-683 m. Coletada com flores em janeiro, setembro, novembro e dezembro, com frutos em fevereiro, maio e junho. Diferencia-se das demais espécies de Mimoseae do Espírito Santo pelo seguinte conjunto de caracteres: ramos inermes, foliólulos de ápice arredondado a retuso e sub-opostos a opostos nas pinas, inflorescências espiciformes e frutos criptolomentos. Conhecido popularmente como vinhático.
8. Pseudopiptadenia Rauschert, Taxon 31(3): 559. 1982.
Árvores. Ramos esparso-puberulentos a glabros, inermes, sem indumento ferrugíneo no ápice. Estípulas decíduas ou persistentes; nectários extraflorais peciolares sésseis, capitados, localizados na região basal ou mediana do pecíolo, os da raque sésseis, discoides, localizados entre o par apical ou 2 pares de pinas apicais, ou por toda a raque entre os pares de pinas; pinas 1-13 pares, nectários extraflorais da raquíola ausentes ou entre o par de foliólulos terminais; parafilídios ausentes; foliólulos da pina mediana 2-36 pares, 6-60 × 9-23 mm. Inflorescências espiciformes, eretas; pedúnculo 3-41 mm compr.; cicatriz ou invólucro do botão ausente na base da inflorescência. Flores pentâmeras, diplostêmones, sésseis; filetes alvos, amarelados ou esverdeados, anteras com glândulas apicais, estaminódios laminares ausentes; ovário estipitado. Folículos glabros a granulares; sementes 4-11, elípticas, aladas.
O gênero Pseudopiptadenia apresenta 11 espécies (Lewis et al. 2005Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.) distribuídas da América do Norte até a Região Sul do Brasil (Lewis & Lima 1991Lewis GP & Elias TS (1981) Mimosoideae. In: Polhill RM & Raven PH (eds.) Advances in legume systematics, part I. Royal Botanic Gardens, Kew. Pp. 143-151.). Sua distribuição é concentrada no Nordeste e Sudeste do Brasil (região da Mata Atlântica) (Lewis & Lima 1991Lewis GP & Elias TS (1981) Mimosoideae. In: Polhill RM & Raven PH (eds.) Advances in legume systematics, part I. Royal Botanic Gardens, Kew. Pp. 143-151.), sendo citadas nove espécies para a flora do brasileira (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). O gênero compreende espécies com fruto do tipo folículo, ramos inermes e inflorescências espiciformes. No Espírito Santo, está representado por seis espécies.
- Chave de identificação das espécies de Pseudopiptadenia no Espírito Santo
-
1. Foliólulos glabros.
-
2. Raque 8,5−10 mm compr.; foliólulos da pina mediana 1 par ...................................................................................................................................................... 8.5. Pseudopiptadenia schumanniana
-
2'. Raque 13−145 mm compr.; foliólulos da pina mediana 2−41 pares.
-
3. Nectários extraflorais peciolares ausentes; foliólulos da pina mediana 2−7 pares. Folículos 70−167 mm compr............................................................ 8.3. Pseudopiptadenia inaequalis
-
3'. Nectários extraflorais peciolares presentes; foliólulos da pina mediana 12−41 pares. Folículos 220−425 mm compr.
-
4. Raque 13-23 mm compr.; pinas 1−3 pares; foliólulos da pina mediana 12−15 pares, 10-12 × 4-5 mm. Folículos lenhosos, margem sinuosa ........................................................................................................................................ 8.1. Pseudopiptadenia bahiana
-
4'. Raque 64-145 mm compr.; pinas 5−22 pares; foliólulos da pina mediana 29−41 pares, 3-7 × 0,5-1 mm. Folículos coriáceos, margem reta .... 8.2. Pseudopiptadenia contorta
-
-
-
-
1'. Foliólulos pubescentes ou puberulentos.
-
5. Pinas 3−4 pares; prolongamento da raque ausente; foliólulos medianos da pina mediana triangulares, falcados. Folículos 214−290 mm compr., lenhosos, margem sinuosa ................................................................................................................................................ 8.6. Pseudopiptadenia warmingii
-
5'. Pinas 10−11 pares; prolongamento da raque ca. 0,4 mm compr.; foliólulos medianos da pina mediana estreito-elípticos. Folículos 384−420 mm compr., coriáceos, margem reta ..................................................................................................................... 8.4. Pseudopiptadenia psilostachya
-
8.1. Pseudopiptadenia bahiana G.P. Lewis & M.P. Lima, Arch. Jard. Bot. Rio de Janeiro 30: 54. 1991. Fig. 2d
Arvoreta a árvores, 8-15 m alt. Ramos cilíndricos, glabros, inermes, castanhos. Estípulas decíduas, não observadas; pecíolos 7,5-20 mm compr., nectários extraflorais peciolares sésseis, inclusos-côncavos ou cupuliforme, localizados na porção basal, média ou distal do pecíolo; raque 13-23 mm compr., nectários extraflorais da raque, quando presentes, sésseis, inclusos-côncavos, localizados logo abaixo do par apical de pinas, segmentos interpinas 7-12 mm compr.; pinas 1-3 pares, nectários extraflorais da raquíola ausentes, pina mediana 47-53 mm compr., prolongamento da raque ca. 0,5 mm compr.; foliólulos da pina mediana 12-15 pares, 10-12 × 4-5 mm, os medianos elípticos a rombóides, ápice arredondado ou truncado, margem inteira, os distais obovados, ambas as faces glabras. Inflorescências não observadas. Folículos 220 mm × 10-12 mm, estípite 14-15 mm compr., glabros, lenhosos, margem sinuosa; sementes 5-10, circulares a elípticas, castanhas.
Material examinado: Santa Teresa, 25 de Julho, Bela Vista, 29.IV.2005, fr., L. Kollmann et al. 7679 (MBML); rio 15 de agosto, propriedade Giovani Pasolini, 26.VII.2000, fr., V. Demuner 1266 (MBML). Sooretama, Reserva Biológica de Sooretama, coletado em parcela dentro da mata, 17.X.2012, fr., M.B. Costa 23 (VIES).
Pseudopiptadenia bahiana é endêmica do Brasil, com ocorrência citada apenas para a Bahia, nos domínios fitogeográficos da Caatinga e Mata Atlântica (BFG 2015). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre na formação: Floresta Ombrófila Densa, em vegetação secundária e áreas de atividades agrícolas, em altitudes entre 77-829 m. Coletada com frutos em abril, julho e outubro. Entre as espécies com foliólulos numerosos ocorrentes no Espírito Santo, P. bahiana possui os de maior largura (4-5 mm). Pode ser confundida com P. warmingii, no entanto, diferenciam-se por P. bahiana apresentar foliólulos maiores (4-5 mm compr. vs. 10-12 mm compr.), pecíolos menores (7,5-20 mm compr. vs. 21-23 mm compr.) e pinas medianas com número de pares de foliólulos menor (12-15 pares vs. 19-22 pares). Conhecida popularmente como angico-facão.
8.2. Pseudopiptadenia contorta (DC.) G.P.Lewis & M.P.Lima, Arch. Jard. Bot. Rio de Janeiro 30: 57. 1991. Fig. 6a
Distribuição geográfica de Mimoseae no Espírito Santo - a. Pseudopiptadenia contorta (🟌), P. inaequalis (♦), P. psilostachya (▲), P. schumanniana (●); b. P. warmingii (🟌), Stryphnodendron polyphyllum (♦), S. pulcherrimum (▲) e Stryphnodendron sp. (●).
Figure 6
Geografic distribuition of Mimoseae in Espírito Santo - a. Pseudopiptadenia contorta (🟌), P. inaequalis (♦), P. psilostachya (▲) and P. schumanniana (●); b. P. warmingii (🟌), Stryphnodendron polyphyllum (♦), S. pulcherrimum (▲) and Stryphnodendron sp. (●).
Arbustos ou árvores, 3-25 m alt. Ramos cilíndricos, glabros, com lenticelas, inermes, castanhos. Estípulas decíduas, 1-3 × 0,1-0,8 mm, lineares a triangulares, glabras a puberulentas; pecíolos 8-24 mm compr., nectários extraflorais peciolares sésseis, pateliformes ou capitados, localizados na porção média do pecíolo; raque 64-145 mm compr., nectários extraflorais da raque sésseis, cupuliformes, circulares ou ciatiformes, localizados entre os pares de foliólulos apicais, segmentos interpinas 5-13 mm compr.; pinas 5-22 pares, nectários extraflorais da raquíola ausentes, pina mediana 30-58 mm compr., prolongamento da raque ca. 0,7 mm compr.; foliólulos da pina mediana 29-41 pares, 3-7 × 0,5-1 mm, os medianos elípticos, ápice arredondado, margem inteira, os distais elípticos, ápice acuminado a arredondado, ambas as faces glabras. Inflorescências 46-160 × 6-9 mm; pedúnculo 3-15 mm compr.; bractéolas ca. 0,5 mm compr., decíduas, esparso-pubescentes. Cálice 0,45-0,75 mm compr., lobos 0,05-0,15 mm compr., glabro a pubescente; corola 0,8-2,2 mm compr., lobos 0,5-1 mm compr., tubo 0,8-1,4 mm compr., puberulenta a denso-puberulenta; filetes 3-4,7 mm compr., alvos a amarelados; ovário 0,5-2,8 mm compr., estípite 0,8-1,9 mm compr., tomentoso. Folículos 230-425 × 8-19 mm, estípite 6-28 mm compr., glabros, coriáceos, margem reta; sementes 8-12, elípticas, aladas e castanhas.
Material examinado: Águia Branca, Córrego do Trinta, 19.X.2006, fl. e fr., V. Demuner 3001 (MBML, RB); mata do Assentamento 16 de abril, 25.VII.2006, L.F. Magnago 1094 (MBML); córrego do Trinta; 19.X.2015, fr., V. Demuner et al. 3001 (MBML, RB). Água Doce do Norte, estrada para torre da Vivo, 25.IX.2014, fl., L.A. Silva et al. 488 (VIES). Aracruz, Retiro, Mata Seca, 14.VIII.1992, fr., O.J. Pereira et al. 3715 (VIES); 28.IV.1992, fr., O.J. Pereira et al. 3332 (VIES). Barra de São Francisco, Parque Municipal Sombra da Tarde, 21.XI.2000, fl., L. Kollmann 3279 (VIES, MBML). Colatina, Fazenda Terra Nova, 23.V.2008, fr., A.M. Assis 1682 (VIES, MBML); Novo Brasil, localizada na Fazenda de José Berti, 10.IX.1991, fl. e fr., D.A. Folli 1405 (CVRD). Castelo, Mata das Flores, 15.VII.2015, fr., L.A. Silva et al. 713 (VIES). Domingos Martins, Mata Atlântica, 19.VII.2000, fr., O.J. Pereira & E. Espindula 6283 (VIES); 25.VIII.2000, fr., O.J. Pereira & E. Espindula 6440 (VIES). Fundão, Goiapaba-açu, 19.IX.1998, fl., L. Kollmann 560 (VIES, MBML). Governador Lindemberg, Pedra da Santa Luzia, 20.XI.14, fl., L.A. Silva & J. Freitas 532 (VIES); 20.XI.14, fl., L.A. Silva & J. Freitas 521 (VIES); Morelo, 13.XI.2006, fl., V. Demuner et al. 3036 (VIES, MBML, RB). Guarapari, Rodovia do Sol, km 24, Tabuleiro, 4.XI.1991; fl. e fr., P.C. Vinha 1369 (VIES). Ibiraçu, Estação Ecológica do Morro da Vargem, Floresta Atlântica, Trilha do Mirante II, floresta de ''vale'', primária, alterada, 31.V.1990, fr., J.M.L. Gomes et al. 1171 (VIES). Linhares, Regência, Rebio Comboios, 13.VIII.2014. fr., L.A. Silva 565 (VIES); Reserva Vale, talhão 502, 16.XI.1977, fl., J. Spata 19 (CVRD); estrada Flamengo, 1.XII.2014, fl., D.A. Folli 7310 (CVRD); 16.VI.1982, fl., G.S. Siqueira 1041 (CVRD); 12.XI.1984, fr., D.A. Folli 382 (CVRD); mata de tabuleiro, 16.X.1991, fl., D.A. Folli 1448 (CVRD); 4.X.1972, fl., A.M. Lino 131 (CVRD). Marilândia, Alto Liberdade, prop. Delclecio, 13.IX.2007, fl., R.R. Vervloet 3513 (VIES, MBML). Pancas, Morro do Camelo, 8.VII.2015, fr., L.A. Silva et al. 696 (VIES). Pinheiros, Reserva Biológica Córrego do Veado, 2.XI.2010, fl.; M. Ribeiro et al. 339 (VIES). Santa Teresa, Estação Biológica de Santa Lúcia, trilha do sagui, 13.I.1999, fl., L. Kollmann & E. Bausen 1535 (MBML). Santa Leopoldina, Serra do Ramalhete, Fazenda Caioaba, 16.II.2006, fl. e fr., V. Demuner 1874 (VIES, MBML). Santa Maria de Jetibá, Caramuri, Sítio Jetibá, propriedade de Ademival e Gildo Adeodato, 30.IV.2003, fr., L. Kollmann & M.V.S. Berger 6156 (VIES). São Roque do Canaã, Misterioso, 24.X.2004, fl., L. Kollmann et al. 7106 (VIES). Serra, APA Praia Mole, Carapebus, no bordo do tabuleiro voltado para a lagoa Carapebus, 13.V.2009, fr., O.J. Pereira 7801 (VIES); Mestre Álvaro, 3.I.2015, fl., C. Vazzoler 5 (VIES). Vitória, Parque Estadual da Fonte Grande, 27.III.2003, fr., O.J. Peireira 7114 (VIES).
Endêmica do Brasil, distribui-se pelas regiões do Nordeste (Alagoas, Bahia, Paraíba, Pernambuco, Sergipe) e Sudeste, habitando a Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). No Espírito, Santo ocorre nas formações: Floresta Ombrófila Densa, Floresta Ombrófila Aberta, Floresta Ombrófila Densa das Terras Baixas, Floresta Estacional Semidecidual, Área das Formações Pioneiras, em vegetação com influência fluviomarinha, e Restinga, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 0-879 m. Foi coletada com flores ao longo de quase todo o ano, exceto em março, abril, maio e agosto, e com frutos ao longo de quase todo o ano exceto janeiro, junho e dezembro. Pseudopiptadenia contorta é uma espécie bem representada no acervo dos herbários do Espírito Santo. É facilmente identificada devido a seus folículos estreitos, não constritos, longos e curvados. Pode ser confundida, vegetativamente, com espécies de Anadenanthera, sendo diferenciadas, quando estéreis, pela posição da nervura principal dos foliólulos, que é marginal em P. contorta e central ou subcentral nas espécies de Anadenanthera. Quando férteis, diferenciam-se pelas inflorescências espiciformes, em P. contorta, enquanto Anadenanthera possui inflorescências capitadas globosas.
8.3. Pseudopiptadenia inaequalis (Benth.) Rauschert, Taxon 31(3): 559. 1982. Figs. 5e-g; 6a
Árvores, 18-26 m alt. Ramos cilíndricos, glabros a pulverulentos, inermes, castanhos. Estípulas decíduas, 0,3-1 × 0,3-0,5 mm, triangulares a obovadas, pulverulentas; pecíolos 24,5-35,5 mm compr., nectários extraflorais peciolares ausentes; raque 20-35 mm compr., nectários extraflorais da raque sésseis, cupuliformes ou ciatiformes, localizados por toda a raque entre as pinas, segmentos interpinas 20-30 mm compr.; pinas 2-4 pares, nectários extraflorais da raquíola subsésseis, ciatiformes, entre os pares apicais de foliólulos; pina mediana 41-81 mm compr., prolongamento da raque ausente; foliólulos da pina mediana 2-7 pares, 19-60 × 9-24 mm, os medianos rômbicos ou elípticos, ápice acuminado, margem sinuosa ou inteira, os distais elípticos a falcados, ambas as faces glabras. Inflorescências 115-124 × 7,2-8,2 mm; pedúnculo 11,8-41 mm compr.; bractéolas 0,5-1 mm compr., persistentes, indumento não observado. Cálice ca. 0,8 mm compr., lobos 0,04-0,05 mm compr., glabro; corola 2-2,4 mm compr., lobos 1,5-2,3 mm compr., tubo ca. 0,1 mm compr., glabra; filetes ca. 3,9 mm compr., esverdeados; ovário ca. 0,7 mm compr., estípite ca. 0,9 mm compr., glabro. Folículos 70-167 × 5,3-12,3 mm, estípite 4-24 mm compr., glabros, coriáceos, margem regularmente constricta; sementes 4-9, não observadas.
Material examinado: Cachoeiro de Itapemirim, Flona de Pacotuba, 3.X.2008, fr., D.A. Folli 6203 (CVRD). Santa Teresa, Alto São José, 15.VI.1984, fr., R.M. Pizziolo 153 (RB). Serra, entre Santa Thereza e Vitoria, 25.IX.1953, fl., A.P. Duarte 4212 (RB).
Pseudopiptadenia inaequalis é endêmica do Brasil e sua ocorrência era citada apenas para o Rio de Janeiro, na Mata Atlântica (BFG 2015). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde pode ser encontrada na formação Floresta Ombrófila Densa, em altitudes entre 57-677 m. Coletada com flores em setembro e novembro, e com frutos em junho e outubro. É semelhante, morfologicamente, à P. schumanniana, mas podem ser diferenciadas por meio dos seguintes caracteres: número de pinas (2-4 pares vs. 1-2 pares) e prolongamento da raque (ausente vs. ca. 2 mm compr. em P. schumanniana).
8.4. Pseudopiptadenia psilostachya (DC.) G.P.Lewis & M.P.Lima, Arch. Jard. Bot. Rio de Janeiro 30: 55. 1991. Fig. 7a
a-c. Stryphnodendron sp. - a. folha; b. foliólulo; c. flor. d-f. S. polyphyllum - d. folha; e. foliólulo; f. flor. g-i. S. pulcherrimum - g. folha; h. foliólulo; i. flor. (a-b. L.A. Silva 645; c. D.A. Folli 1519; d-f. V. de Souza 49; g-i. O.J.Pereira 4550).
Figure 7
a-c. Stryphnodendron sp. - a. leaf; b. foliolule; c. flower. d-f. S. polyphyllum - d. leaf; e. foliolule; f. flower. g-i. S. pulcherrimum - g. leaf; h. foliolule; i. flower. (a-b. L.A. Silva 645; c. D.A. Folli 1519; d-f. V. de Souza 49; g-i. O.J.Pereira 4550).
Árvores, ca. 25 m alt. Ramos cilíndricos, sulcados, glabros, lenticelados, inermes, castanhos. Estípulas decíduas, não observadas; pecíolos 20-26 mm compr., nectários extraflorais peciolares sésseis, verruciformes, localizados na porção basal e média do pecíolo; raque 47-78 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 9-11 mm compr.; pinas 10-11 pares, nectários extraflorais da raque ausentes, pina mediana 62-67 mm compr., prolongamento da raque ca. 0,4 mm compr.; foliólulos da pina mediana 28-30 pares, 4,1-6 × 1,2-2,4 mm, os medianos estreito-elípticos, ápice agudo a mucronado, margem levemente revoluta a inteira, os distais elípticos, face adaxial esparso-pubescente, face abaxial pubescente, tricomas amarelos. Inflorescências 103-141 × 8-9 mm; pedúnculo 7-16 mm compr.; bractéolas não observadas. Cálice 1-1,3 mm compr., lobos 0,04-0,07 mm compr., pubescente; corola 1,8-3 mm compr., lobos 1-2 mm compr., tubo 0,8-1 mm compr., pubescente; filetes 4-4,5 mm compr., amarelos; ovário 0,9-1 mm compr., estípite 0,9-1,4 mm compr., tomentoso. Folículos 384-420 × 19-23 mm, estípite 13-18 mm compr., glabros a densamente puberulentos próximo das margens, coriáceos, margem reta; sementes não observadas.
Material examinado: Linhares, Reserva da Vale, 16.IX.2015, fr., D.A. Folli 6415 (CVRD, VIES); mata de tabuleiro, 10.I.2009, fl., D.A. Folli 6280 (CVRD, RB); 13.I.2009, fl., G.S. Siqueira 453 (CVRD); próximo à estrada, mata de tabuleiro, 19.XI.1991, fl., D.A. Folli 1491 (CVRD).
Pseudopiptadenia psilostachya ocorre na Guiana Francesa e no Brasil (BFG 2015), sendo citada apenas para a Região Norte (Acre, Amazonas, Amapá, Pará, Rondônia, Roraima), na Amazônia. Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde ocorre na Floresta Ombrófila Densa e Floresta Ombrófila Densa das Terras Baixas, em altitudes entre 19-829 m. Coletada com flores em janeiro e novembro, e com frutos em setembro. Pseudopiptadenia psilostachya pode ser identificada, entre as espécies do Espírito Santo, pelo seguinte conjunto de caracteres: 28-30 foliólulos na pina mediana, largura dos foliólulos entre 1,2-2,4 mm e folículos com 384-420 mm de comprimento.
8.5. Pseudopiptadenia schumanniana (Taub.) G.P.Lewis & M.P.Lima, Arch. Jard. Bot. Rio de Janeiro 30: 53. 1990. Figs. 5h,i; 6a
Árvores, 15-17 m alt. Ramos cilíndricos, esparsamente puberulentos a glabros, inermes, castanhos a acinzentados. Estípulas decíduas, não observadas; pecíolos 15-32 mm compr., nectários extraflorais peciolares ausentes; raque 8,5-10 mm compr., nectários extraflorais da raque subsésseis ou sésseis, cupuliformes ou circulares, localizados por toda a raque entre as pinas; segmentos interpinas 8,5-10 mm compr.; pinas 1-2 pares, nectários extraflorais da raquíola ausentes, entre os foliólulos, subsésseis ou sésseis, cupuliformes ou circulares, pina mediana 40-60 mm compr., prolongamento da raque ca. 2 mm compr.; foliólulos da pina mediana 1 par, 37-84 × 14-33 mm, os medianos elípticos, falcados, ápice agudo e arredondado, margem inteira, os distais elípticos, falcados, ambas as faces glabras. Inflorescências 77−90 × 6,5−7,5 mm; pedúnculo 10−16 mm compr.; bractéolas 0,15−0,2 mm compr., persistentes, puberulentas. Cálice 0,5−0,7 mm compr., lobos ca. 0,1 mm compr., glabro; corola 2,1-2,3 mm compr., lobos 2,1−2,2 mm compr., tubo ca. 0,05 mm compr., glabra; filetes 2,6-4,9 mm compr., alvos; ovário 0,7−0,9 mm compr., estípite 0,51,4 mm compr., pubescente. Folículos 95-136 × 11−13,8 mm, estípite ca. 3 mm compr., glabros a granulares, coriáceos, margem regularmente constricta; sementes 5-9, não observadas.
Material examinado: Baixo Guandú, Mata de montanha, 19.IX.2013, fr., D.A. Folli 7109 (CVRD, RB). Cariacica, Reserva Biológica Duas Bocas, 6.V.2008, fr., C.N. Fraga 2048 (MBML, RB). Santa Leopoldina, Fazenda Caioaba, propr. Caludio Villoni, 29.I.2008, fl., V. Demuner 4917 (MBML, RB). Santa Teresa, Parque Natural Municipal de São Lourenço, 19.IV.2003, fr., T.A. Cruz et al. 30 (MBML); Santo Antônio, terreno do Boza, 14.I.1999, fl., L. Kollmann 1582 (RB, MBML); Alto São José, 15.VI.1984, fr., W. Pizziolo 153 (MBML, RB); Mata Fria, Ter. Clério Loss (lado direito do asfalto), 9.XII.1999, fl., V. Demuner 321 (MBML, RB).
Pseudopiptadenia schumanniana é endêmica do Brasil e ocorre nos estados do Espírito Santo e Rio de Janeiro, na Mata Atlântica (BFG 2015). No Espírito Santo, é encontrada em Floresta Ombrófila e Floresta Estacional Semidecidual, em vegetação secundária e áreas de atividades agrícolas, em altitudes entre 76-836 m. Coletada com flores em janeiro e dezembro, com frutos em abril, maio, junho e setembro. Esta espécie assemelha-se morfologicamente a P. inaequalis. Os caracteres que distinguem estas espécies foram discutidos anteriormente.
8.6. Pseudopiptadenia warmingii (Benth.) G.P.Lewis & M.P.Lima, Jard. Bot. Rio de Janeiro 30: 54. 1991. Fig. 6b
Árvores, 4-19 m alt. Ramos cilíndricos, glabros a esparsamente puberulentos, lenticelados, inermes, cinza a castanhos. Estípulas persistentes, ca. 1,5 × 0,4 mm, triangulares; pecíolos 19-29 mm compr., nectários extraflorais peciolares sésseis, verruciformes, na porção basal do pecíolo; raque 20-99 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 5-13 mm compr.; pinas 3-4 pares, nectários extraflorais da raquíola ausentes, pina mediana 48−96 mm compr., prolongamento da raque ausente; foliólulos da pina mediana 19-25 pares, 5−6 × 1,3−1,7 mm, os medianos triangulares, falcados, ápice cuspidato, margem inteira, os distais falcados, ambas as faces puberulentas, tricomas alvos. Inflorescências não observadas. Folículos 214-290 × 25-33,5 mm, estípite 22-25,6 mm compr., glabros, lenhosos, margem sinuosa; sementes 6-10, não observadas.
Material examinado: Colatina, Alto Moacir, prop. Lalau, 11.IX.2007, fr., V. Vervloet 3417 (RB). Jaguaré, estrada de Jaguaré para Fátima, 5.VII.2010, fr., D.A. Folli 6638 (CVRD). João Neiva, BR 101, pasto, 10.VIII.2001, fr., A.A da Luz 20 (CVRD). Rio Bananal, estrada Rio Bananal à S.J.I., 2.VI.2010, fr., D.A. Folli 6634 (CVRD).
Pseudopiptadenia warmingii é endêmica do Brasil. Distribui-se pelas regiões Nordeste (Bahia), Sudeste e Sul (Paraná, Santa Catarina), na Mata Atlântica (BFG 2015). No Espírito Santo, pode ser encontrada nas formações Floresta Ombrófila Densa, Floresta Ombrófila Densa das Terras Baixas e Floresta Estacional Semidecidual, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 79-579 m. Coletada com frutos de junho a setembro. Pseudopiptadenia warmingii assemelha-se a morfologicamente a P. bahiana. Os caracteres que distinguem estas espécies foram discutidos anteriormente. Conhecida popularmente como angico e angico-facão.
9. Stryphnodendron Mart., Flora 20(2): Beibl. 117. 1837.
Arvoretas a árvores. Ramos glabros a ferrugíneo-pulverulentos, inermes, com indumento ferrugíneo no ápice. Estípulas decíduas; nectários extraflorais peciolares sésseis, verruciformes, localizados na região basal do pecíolo, os da raque subsésseis, pateliformes, verruciformes ou ciatiformes, localizados no segmento interpinas distal e entre os últimos 3-4 pares de foliólulos; pinas 8-14 pares, nectários extraflorais da raquíola ausentes ou entre os pares de foliólulos terminais; parafilídios ausentes; foliólulos da pina mediana 11-15 pares, 9-13 × 4-6 mm. Inflorescências espiciformes, eretas; pedúnculo 6,6-23 mm compr.; cicatriz ou invólucro do botão ausente na base da inflorescência. Flores pentâmeras, diplostêmones, sésseis; filetes alvos ou vináceos; anteras com glândulas apicais, estaminódios laminares ausentes; ovário subestipitado. Legumes nucóides glabros ou pulverulentos; sementes 7-14, oblongas.
Stryphnodendron apresenta 36 espécies distribuídas nas Américas do Sul e Central. Destas, apenas quatro não ocorrem no Brasil, e aproximadamente metade das ocorrentes é endêmica (Scalon 2007Scalon VR (2007) Revisão taxonômica de Stryphnodendron Mart. (Leguminosae Mimosoideae). Tese de Doutorado. Universidade de São Paulo, São Paulo. 264p.). O gênero possui centros de diversidade na Amazônia, Brasil Central e Florestas Costeiras (Scalon 2007Scalon VR (2007) Revisão taxonômica de Stryphnodendron Mart. (Leguminosae Mimosoideae). Tese de Doutorado. Universidade de São Paulo, São Paulo. 264p.). Apresenta as seguintes características morfológicas diagnósticas: ramos inermes, ápice dos ramos dotados de indumento ferrugíneo, inflorescências espiciformes e frutos legumes nucóides ou folículos. No Espírito Santo, está representado por três espécies.
- Chave de identificação das espécies de Stryphnodendron no Espírito Santo
-
1. Pinas 8-12 pares; nectários da raque localizados na porção basal da raque ................................................................................................................................................. 9.2. Stryphnodendron pulcherrimum
-
1'. Pinas 11-14 pares; nectários da raque localizados na região apical da raque.
-
2. Arvoretas ou árvores 2,5-13 m alt. Ramos pulverulentos. Nectários peciolares verruciformes, ciatiformes. Pedúnculo da inflorescência 11-16 mm compr. Cálice pubescente; corola puberulenta; filetes alvos ............................................................................................. 9.3. Stryphnodendron sp.
-
2'. Árvores ca. 14 m alt. Ramos glabros. Nectários peciolares elípticos. Pedúnculo da inflorescência 6-8 mm compr. Cálice e corola glabros; filetes vináceos ....... 9.1. Stryphnodendron polyphyllum
-
9.1. Stryphnodendron polyphyllum Mart., Herb. fl. bras. 20 (2): 117. 1837. Figs. 6b; 7d-f
Árvores, 13-14 m alt. Ramos cilíndricos, glabros, inermes, castanhos, com indumento ferrugíneo no ápice. Estípulas decíduas, não observadas; pecíolo 42-62 mm compr., nectários extraflorais peciolares sésseis, verruciformes, localizados na região basal ou mediana do pecíolo; raque 82-230 mm compr., nectários extraflorais da raque sésseis, verruciformes, localizados na região apical da raque, segmentos interpinas 9-16 mm compr.; pinas 13-14 pares, nectários extraflorais da raquíola sésseis; verruciformes, pina mediana 58-106 mm compr., prolongamento da raque ausente; foliólulos da pina mediana 11-18 pares, 8-10 × 4-5 mm, os medianos elípticos a ovados, ápice arredondado, margem inteira, os distais elípticos a obovados, margem inteira a levemente revoluta, face adaxial puberulenta, face abaxial pubescente, tricomas amarelados. Inflorescências 67-90 × 9 mm; pedúnculo 6-8 mm compr.; bractéolas 0,2-0,4 mm compr., decíduas, denso-puberulentas. Cálice 0,5-0,6 mm compr., lobos ca. 0,05 mm compr., glabro; corola 1,5-2,2 mm compr., lobos 1-1,3 mm compr., tubo 0,5-0,7 mm compr., glabra; filetes vináceos; ovário 1-1,1 mm compr., estípite 0,1-0,3 mm compr., densamente pubescente. Legumes nucóides 106-152 × 20-24 mm, estípite ca. 2 mm compr., pulverulentos, margem levemente sinuosa a reta; sementes 7-14, imaturas.
Material examinado: Águia Branca, Aguas Claras, Zequinha, 15.VIII.2007, fr., R.R. Vervloet 3202 (MBML); São José, Itabira, 21.III.1991, fl., V. de Souza 49 (CVRD, VIES). Serra, APA Praia Mole, Carapebus, floresta sobre tabuleiro terciário, na encosta voltada para o fundo do vale úmido, 14.V.2009, fr., O.J. Pereira 7804 (VIES). Vargem Alta, Morro de São Carlos, torre da Embratel, 3.II.2015, fr., L.A. Silva et al. 622 (VIES).
Stryphnodendron polyphyllum é endêmica do Brasil. Ocorre nas regiões Nordeste (Bahia e Maranhão), Centro-Oeste (Distrito Federal, Goiás, Mato Grosso do Sul e Mato Grosso) e Sudeste (Minas Gerais), na Caatinga, Cerrado e Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde pode ser encontrada na formação Floresta Ombrófila Densa, em vegetação secundária e áreas com atividades agrícolas, em altitudes entre 783-1.007 m. Coletada com flores em março e com frutos em fevereiro, maio e agosto. Espécie semelhante, morfologicamente, a Stryphnodendron sp., porém distinguem-se pelos seguintes caracteres morfológicos: comprimento dos foliólulos, maiores em Stryphnodendron sp. (10-13 mm vs. 8-10 mm em S. polyphyllum), indumento dos ramos (pulverulentos vs. glabros, exceto pelos ápices pulverulentos em S. polyphyllum), indumento do cálice e da corola (indumentado em Stryphnodendron sp. vs. glabro em S. polyphyllum).
9.2. Stryphnodendron pulcherrimum (Willd.) Hochr., Bull. New York Bot. Gard. 6(21): 274. 1910. Figs. 6b; 7g-i
Árvores, ca. 6 m alt. Ramos cilíndricos, glabros, inermes castanhos, com indumento ferrugíneo no ápice. Estípulas decíduas, não observadas; pecíolos 37-43 mm compr., nectários extraflorais peciolares sésseis, verruciformes, localizados na porção distal do pecíolo; raque 71-138 mm compr., nectários extraflorais da raque sésseis, pateliformes, verruciformes ou ciatiformes, localizados na porção basal da raque, segmentos interpinas 11-15 mm compr.; pinas 8-12 pares, nectários extraflorais da raquíola ausentes, pina mediana 57-64 mm compr., prolongamento da raque ausente; foliólulos da pina mediana 10-15 pares, 10-13 × 4,4-5,6 mm, os medianos elípticos, ápice arredondado, margem levemente revoluta a revoluta, os distais obovados, ambas as faces puberulentas, tricomas amarelados. Inflorescências 68-88 × 8 mm; pedúnculo 16-23 mm compr.; bractéolas decíduas, não observadas. Cálice 0,3-0,6 mm compr., lobos ca. 0,05 mm compr., pubescente; corola 2-2,3 mm compr., lobos 0,7-1 mm compr., tubo 0,9-1,2 mm compr., pubescente; filetes 4-4,3 mm compr., alvos; ovário não observado. Legumes nucóides não observados.
Material examinado: Serra, Bicanga, Tabuleiro, 6.V.1993, fl., Pereira O.J. et al. 4550 (VIES).
Stryphnodendron pulcherrimum ocorre na Bolívia, Peru, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa e Brasil (Scalon 2007Scalon VR (2007) Revisão taxonômica de Stryphnodendron Mart. (Leguminosae Mimosoideae). Tese de Doutorado. Universidade de São Paulo, São Paulo. 264p.). Distribui-se por toda Região Norte, no Nordeste (Alagoas, Bahia, Maranhão, Paraíba, Pernambuco e Sergipe) e no Centro-Oeste (Mato Grosso), na Amazônia e na Mata Atlântica (BFG 2015BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Esta é a primeira citação de sua ocorrência para o Espírito Santo, onde pode ser encontrada na formação Floresta Ombrófila Densa, em vegetação secundária e áreas de atividades agrícolas, em altitudes que entre 46-340 m. Coletada com flores em maio. Difere-se das demais espécies de Stryphnodendron encontradas no Espírito Santo por apresentar cerca de sete nectários extraflorais na raque, próximos da inserção das sete pinas apicais, enquanto nas demais espécies do gênero são encontrados apenas um nectário por raque.
9.3. Stryphnodendron sp. Figs. 6b; 7a-c
Arvoretas ou árvores, 2,5-13 m alt. Ramos cilíndricos, pulverulentos, inermes, castanhos, com indumento ferrugíneo no ápice. Estípulas decíduas, não observadas; pecíolos 38-84 mm compr., nectários extraflorais peciolares sésseis, verrucifomes e ciatiformes, localizados na região basal do pecíolo; raque 98-188 mm compr., nectários extraflorais da raque ausentes, segmentos interpinas 8-18 mm compr.; pinas 8-14 pares, nectários extraflorais da raquíola sésseis, ciatiformes, localizados entre os pares de foliólulos apicais; pina mediana 53-105 mm compr., prolongamento da raque ausente; foliólulos da pina mediana 11-12 pares, 10-13 × 4-6 mm, os medianos elípticos, ápice arredondado, margem revoluta, os distais oblongos, face abaxial pubescente, face adaxial puberulenta, tricomas amarelados. Inflorescências 61-94 × 6-8,5 mm; pedúnculo 11-16 mm compr.; bractéolas decíduas, não observadas. Cálice 0,4-0,6 mm compr., lobos 0,05-0,3 mm compr., pubescente; corola 1,9-2,3 mm compr., lobos 0,9-1,3 mm compr., tubo ca. 1 mm compr., puberulenta; filetes 4-5 mm compr., alvos; ovário ca. 0,8 mm compr., estípite ca. 0,1 mm compr., puberulento. Legumes nucóides 98-130 × 11,5-24 mm, estípite 2-4 mm compr., glabros, margem levemente sinuosa a reta; sementes 7-10, oblongas, castanhas.
Material examinado: Águia Branca, Aguas Claras, Zequinha, 15.VIII.2007, fr., R.R. Vervloet 3202 (RB, MBML). Alfredo Chaves, Fazenda 3 Palmeiras, 5.III.2015, fr., L.A. Silva 645 (VIES). Baixo Guandu, no barranco do rio, próx. à est. do Mutum Preto em Baixo Guandú, lado esquerdo, 12.XII.1991, fl., D.A. Folli 1519 (CVRD). Domingos Martins, Panelas, Mata Atlântica, 23.V.1993, fr., J.M.L. Gomes 1897 (VIES); Rod.BR-262, entrada para Domingos Martins, 6.XII.1984, fl., G. Hatschbach 48675 (MBML, RB). Rio Bananal, Alto Rio Bananal, 1.VIII.2007, fr., Vervloet 3111 (MBML, RB, VIES).
Stryphnodendron sp. pode ser encontrada em Floresta Ombrófila Densa, em áreas de vegetação secundária e de atividades agrícolas, em altitudes entre 297-616 m. Coletada com flores em agosto e dezembro, e com frutos em março e maio. Esta espécie assemelha-se morfologicamente a S. polyphyllum, e a diferença entre elas já foi discutida anteriormente. Trata-se de uma espécie inédita para a ciência que está sendo descrita (V.Scalon comun. pess.).
-
Editor de área: Dr. Marcelo Trovó
Agradecimentos
À CAPES, a bolsa concedida ao primeiro autor; a UFES/CEUNES, o apoio logístico; aos curadores dos herbários, os empréstimos e por disponibilizarem a consulta aos acervos; ao ilustrador botânico Reinaldo Pinto, as ilustrações; ao IEMA e ao ICMBio, as licenças de coleta concedidas; aos amigos do laboratório, o apoio em campo; à banca examinadora da dissertação, as valiosas considerações.
Referências
- Altschul SR (1964) A taxonomic study of the genus Anadenanthera Contributions from the Gray Herbarium of Harvard University 193: 3-65.
- Barros MJF & Morim MP (2014) Senegalia (Leguminosae, Mimosoideae) from the Atlantic Domain, Brazil. Systematic Botany 39: 452-477.
- Barroso GM, Morim MP, Peixoto AL & Ichasso CLF (1999) Frutos e sementes: morfologia aplicada à sistemática de dicotiledôneas. Imprensa Universitária, Viçosa. 444p.
- BFG - The Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.
- Brenan JPM (1955) Notes on Mimosoideae: I. Kew Bulletin 10: 161-192.
- Chagas AP (2014) Ingeae Benth. (Leguminosae-Mimosoideae) no Espírito Santo, Brasil. Dissertação de Mestrado. Universidade Federal de Viçosa, Viçosa. 109p.
- Chagas AP, Peterle PL, Thomaz LD, Dutra VF & Valadares RT (2014) Leguminosae-Caesalpinioideae do Parque Estadual Paulo César Vinha, Espírito Santo, Brasil. Rodriguésia 65: 099-112.
- Chappill JA (1995) Cladistic analysis of the Leguminosae: the development of an explicit phylogenetic hypothesis. In: Crisp MD & Doyle JJ (eds.) Advances in legume systematics, part 7. Royal Botanic Gardens, Kew. Pp. 1-9.
- Dutra VF, Alves-Araújo A & Carrijo TT (2015) Angiosperm checklist of Espírito Santo: using electronic tools to improve the knowledge of an Atlantic Forest biodiversity hotspot. Rodriguésia 66: 1145-1152.
- Fernandes JM (2011) Ingeae Benth. (Leguminosae) no estado de MG, Brasil: taxonomia, morfoanatomia de nectários extraflorais e padrões de distribuição geográfica. Tese de Doutorado. Universidade Federal de Viçosa, Viçosa. 298p.
- Fidalgo O & Bononi VLR (1989) Técnica de coleta, preservação e herborização de material botânico. (Série Documentos) Instituto de Botânica, São Paulo. 62p.
- Filardi FLR & Lima HC (2014) The diversity of Machaerium (Leguminosae: Papilionoideae) in the Atlantic Forest: three new species, nomenclatural updates, and a revised key. Systematic Botany 39: 145-159.
- França JRKG (2014) Estudo taxonômico de Leguminosae- "Caesalpinoideae" do Parque Nacional do Caparaó, Espírito Santo, Minas Gerais, Brasil. Dissertação de Mestrado. Universidade Federal do Rio de Janeiro/Museu Nacional Rio de Janeiro, Rio de Janeiro. 152p.
- Fundação SOS Mata Atlântica (2014) Mata Atlântica. Disponível em <http://www.sosmatatlantica.org.br/index.php?section=info&action=mata>. Acesso em 4 Abril 2014.
» http://www.sosmatatlantica.org.br/index.php?section=info&action=mata - Hopkins HC (1986) Parkia (Leguminosae: Mimosoideae). Flora Neotropica 43: 1-123.
- Hughes C (1998) Monograph of Leucaena (Leguminosae-Mimosoideae). Systematic Botany Monographs 55: 1-244.
- Iganci JRV & Morim MP (2012) Abarema (Fabaceae, Mimosoideae) in the Atlantic domain, Brazil. Botanical Journal of the Linnean Society 168: 473-486.
- Lewis GP & Elias TS (1981) Mimosoideae. In: Polhill RM & Raven PH (eds.) Advances in legume systematics, part I. Royal Botanic Gardens, Kew. Pp. 143-151.
- Lewis GP, Schrire BD, Mackinder BA & Lock JM (2005) Legumes of the world. Royal Botanic Garden, Kew. 592p.
- LPWG - The Legume Phylogeny Working Group (2017) A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny. Taxon 66: 44-77.
- Luckow M (2005) Tribe Mimoseae. Lewis G, Schrire B, Mackinder B & Lock M (eds.) Legumes of the world. Royal Botanical Gardens, Kew. Pp. 163-183.
- Manella MQ, Lourenço AJ & Leme PR (2002) Recria de bovinos nelore em pastos de Brachiaria brizantha com suplementação protéica ou com acesso a banco de proteína de Leucaena lecocephala Desempenho Animal. Revista Brasileria de Zootecnia 31: 2274-2282.
- Melo Y, Córdula E, Machado SR & Alves M (2010) Morfologia de nectários em Leguminosae senso lato em áreas de caatinga no Brasil. Acta Botanica Brasilica 24: 1034-1045.
- Pedroche SZ (1994) Revisión del género Leucaena em México. Anales del Instituto de Biologia de la Universidad Nacional Autonoma de Mexico, Serie Botanica 65: 83-162.
- Peterle PL, Chagas AP, Thomaz LD, Dutra VF & Valadares RT (2015) Leguminosae-Mimosoideae do Parque Estadual Paulo César Vinha, Espírito Santo, Brasil. Rodriguésia 66: 245-257.
- Radford AE, Dickison WC, Massey JR & Bell CR (1974) Vascular plant systematics. Harper & Row, New York. 891p.
- Ribeiro PG (2012) Flora da Bahia: família Leguminosae, subfamília Mimosoideae: Tribo Acacieae e Tribo Mimoseae - Parte I. Dissertação de Mestrado. Universidade Estadual de Feira de Santana, Feira de Santana. 351p.
- Santos TS (2014) Senegalia Raf. (Leguminosae- Mimosoideae) no Brasil: taxonomia, filogenia e distribuição geográfica. Tese de Doutorado. Universidade Federal de Viçosa, Viçosa. 200p.
- Scalon VR (2007) Revisão taxonômica de Stryphnodendron Mart. (Leguminosae Mimosoideae). Tese de Doutorado. Universidade de São Paulo, São Paulo. 264p.
- Schrire B D, Lewis GP & Lavin M (2005) Biogeography of the Leguminosae. In: Lewis GP, Schrire B D, Mackinder B A & Lock M (eds.) Legumes of the world Royal Botanic Gardens, Kew. Pp. 21-54.
- Simonelli M & Fraga CN (2007) Espécies da flora ameaçadas de extinção no estado do Espírito Santo. Ipema, Vitória. 144p.
- Stehmann JR, Forzza RC, Salino A, Sobral M, Costa DD & Kamino LHY (2009) Plantas da floresta Atlântica. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. 516p.
- Tamashiro JY (1989) Estudos taxonômicos e morfológicos do gênero Piptadenia sensu Bentham no sudoeste do Brasil: avaliação das modificações taxonômicas recentemente propostas. Dissertação de Mestrado. Universidade Estadual de Campinas, São Paulo. 101p.
- Thiers B [continuamente atualizado]. Index herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden's Virtual Herbarium. Disponível em <http://sweetgum.nybg.org/science/ih/> Acesso em 12 Dezembro 2015.
» http://sweetgum.nybg.org/science/ih/ - Thomaz LD & Monteiro R (1997) Composição florística da Mata Atlântica de encosta da Estação Biológica de Santa Lúcia, Município de Santa Teresa-ES. Boletim do Museu de Biologia Mello-Leitão, nov. ser. 7: 3-48.
- Weiler Júnior I (1998) Leguminosae - Faboideae das restingas do estado de Espírito Santo. Dissertação de Mestrado. Universidade Federal do Rio de Janeiro, Rio de Janeiro. 189p.
- Windler DR (1966) A revision of the genus Neptunia (Leguminosae). Australian Journal of Botany 14: 379-420.
Datas de Publicação
-
Publicação nesta coleção
Oct-Dec 2017
Histórico
-
Recebido
02 Maio 2017 -
Aceito
27 Out 2017