Resumo
A despeito da grande diversidade de espécies nativas do país, é comum que a arborização das cidades brasileiras seja constituída majoritariamente por espécies exóticas, algumas das quais invasoras. Isso tem resultado na pouca valorização que as espécies nativas têm recebido no paisagismo do país. Neste trabalho buscou-se caracterizar a arborização da cidade de Forquilha, estado do Ceará, avaliando o quanto as plantas nativas estão presentes na composição do paisagismo da cidade. Realizamos um levantamento das espécies arbóreo-arbustivas presentes nas ruas e praças da cidade de Forquilha e registramos 1.889 indivíduos distribuídos em 44 espécies. As espécies mais comuns foram as exóticas Azadirachta indica (com 1.184 indivíduos) e Ficus benjamina (com 276), ambas nativas da Ásia. Surpreendentemente, em nossa amostragem foram encontradas apenas três espécies nativas, somando somente cinco indivíduos. Isso deixa claro o quanto à arborização de Forquilha é predominantemente composta por espécies exóticas e chama a atenção para a necessidade de uma maior valorização da flora nativa nas cidades brasileiras.
Palavras-chave:
biodiversidade urbana; Brasil; espécies exóticas; paisagismo
Abstract
Despite the astonishing richness of native biodiversity in Brazil, it is common to see the urban landscapes composed mostly by exotic species, some of which are invasive. This results in little value being given to native plants by urban citizens. In this study we surveyed the urban forestry in the town of Forquilha, in the state of Ceará, Brazil. We aimed to assess how much native plants are being ignored in the composition of the town’s forestry. During a survey of tree and shrub species found in streets and squares of the town, we recorded 1,889 individuals belonging to 44 species. The most common species were the exotic Azadirachta indica (1,184 individuals) and Ficus benjamina (276) both native to Asia. Surprisingly, only three native species were found in our sample, totalling a mere five individuals. It is clear how much the urban forestry of Forquilha is composed predominantly by exotic species. We call here attention to the need for a greater valuation of the native flora in Brazilian cities.
Key words:
urban biodiversity; Brazil; exotic species; landscaping
Árvores urbanas cumprem uma série de funções ambientais. Elas reduzem os efeitos das ilhas de calor, fornecem sombra paras as pessoas, melhoram os aspectos estéticos da cidade e participam da própria ecologia urbana (Lombardo 1985Lombardo MA (1985) Ilha de calor nas metrópoles: o exemplo de São Paulo. Hucitec, São Paulo. Pp. 244.; Kweon et al. 1998Kweon BS, Sullivan WC & Wiley AR (1998) Green common spaces and the social integration of inner-city older adults. Environment and Behavior 30: 832-858. ; Mckinney 2002McKinney ML (2002) Urbanization, biodiversity, and conservation. BioScience, 52: 883-890. ). Entretanto, os aspectos da arborização relativos à biodiversidade são comumente esquecidos pela população, que em geral se concentra apenas nos benefícios trazidos pela sombra (Malavasi & Malavasi 2001Malavasi UC & Malavasi MDM (2001) Avaliação da arborização urbana pelos residentes - estudo de caso em Mal. Cândido Rondon, Paraná. Ciência Florestal 11: 189-193.), ou nos benefícios estéticos e psicológicos (Kweon et al. 199Kweon BS, Sullivan WC & Wiley AR (1998) Green common spaces and the social integration of inner-city older adults. Environment and Behavior 30: 832-858. 8), ignorando que as plantas urbanas podem ser importantes fontes de alimento e abrigo para a fauna (Ruszczyk & Nascimento 1999Ruszczyk A & Nascimento ES (1999) Biologia dos adultos de Methona themisto (Hübner 1818) (Lepidoptera, Nymphalidae, Ithomiinae) em praças públicas de Uberlândia, Minas Gerais, Brasil. Revista Brasileira de Biologia 59: 577-583.; Menezes 2004Menezes MOT (2004) The use of date palms (Phoenix sp.) as resting and sleeping sites by Callithrix jacchus in Northeastern Brazil. Neotropical Primates 12: 53-55.; Maruyama et al. 2012Maruyama PK, Mendes-Rodrigues C, Alves-Silva E & Cunha AF (2012) Parasites in the neighbourhood: Interactions of the mistletoe Phoradendron affine (Viscaceae) with its dispersers and hosts in urban areas of Brazil. Flora 207: 768-773.). Neste contexto, nem se valoriza nem se estimula o cultivo de plantas nativas, pois os benefícios para a conservação resultantes da introdução de espécies nativas nas cidades não são conhecidos ou percebidos pela população (Moro et al. 2014Moro MF, Westerkamp C & Araújo FS (2014) How much importance is given to native plants in cities’ treescape? A case study in Fortaleza, Brazil. Urban Forestry & Urban Greening 13: 365-374.). Ademais, plantas exóticas também podem se tornar invasoras, e de fato o mercado de plantas ornamentais já é conhecido como uma das principais vias de disseminação de plantas invasoras, tanto no Brasil quanto no mundo (Reichard & White 2001Reichard SH & White P (2001) Horticulture as a pathway of invasive plant introductions in the United States. BioScience 51: 103-113.; Harrington et al. 2003Harrington RA, Kujawski R & Ryan HDP (2003) Invasive plants and the green industry. Journal of Arboriculture 29: 42-48.; Pemberton & Liu 2009Pemberton RW & Liu H (2009) Marketing time predicts naturalization of horticultural plants. Ecology 90: 69-80. ; Zenni & Ziller 2011Zenni RD & Ziller SR (2011) An overview of invasive plants in Brazil. Revista Brasileira de Botânica 34: 431-446.; Ööpik et al. 2013Ööpik M, Bunce RGHB & Tischler M (2013) Horticultural markets promote alien species invasions: an Estonian case study of herbaceous perennials. NeoBiota 17: 19-37.).
Diversos casos de plantas cultivadas como ornamental que se tornaram naturalizadas ou invasoras já foram registrados no Brasil (Dislich et al. 2002Dislich R, Kisser N & Pivello VR (2002) A invasão de um fragmento florestal em São Paulo (SP) pela palmeira australiana Archontophoenix cunninghamiana H. Wendl. & Drude. Revista Brasileira de Botânica 25: 55-64.; Mondin 2006Mondin CA (2006) Espécies vegetais exóticas invasoras em florestas no Rio Grande do Sul. In: Congresso Nacional de Botânica: os avanços da botânica no início do século XXI: morfologia, fisiologia, taxonomia, ecologia e genética, 57, 2006, Porto Alegre. Anais ... Sociedade Botânica do Brasil, Porto Alegre. Pp. 529-531.; Moro et al. 2013Moro MF , Westerkamp C & Martins FR (2013)Naturalization and potential impact of the exotic tree Azadirachta indica A.Juss. in Northeastern Brazil. Check List 9: 153-156.), chamando a atenção para os riscos que essas plantas podem oferecer à biodiversidade. Plantas exóticas podem ameaçar ecossistemas e espécies nativas, na medida em que elas competem com a biodiversidade nativa, podendo alterar a composição e estrutura dos ecossistemas naturais ou seminaturais (Richardson et al. 2000Richardson DM, Pysek P, Rejmanek M, Barbour MG, Panetta FD & West CJ (2000) Naturalization and invasion of alien plants: concepts and definitions. Diversity and Distributions 6: 93-107.; Dislich et al. 2002Dislich R, Kisser N & Pivello VR (2002) A invasão de um fragmento florestal em São Paulo (SP) pela palmeira australiana Archontophoenix cunninghamiana H. Wendl. & Drude. Revista Brasileira de Botânica 25: 55-64.; Pegado et al. 2006Pegado CMA, Andrade LA, Félix LP & Pereira IM (2006) Efeitos da invasão biológica de algaroba - Prosopis juliflora (Sw.) DC. sobre a composição e a estrutura do estrato arbustivo-arbóreo da caatinga no Município de Monteiro, PB, Brasil. Acta Botanica Brasilica 20: 887-898.; Abreu & Rodrigues 2010Abreu RCR & Rodrigues PJFP (2010) Exotic tree Artocarpus heterophyllus (Moraceae) invades the Brazilian Atlantic Rainforest. Rodriguésia 61: 677-688.; Abreu & Durigan 2011Abreu RCR & Durigan G (2011) Changes in the plant community of a Brazilian grassland savannah after 22 years of invasion by Pinus elliottii Engelm. Plant Ecology & Diversity 4: 269-278.).
O Brasil é conhecido como um país megadiverso (Lewinsohn & Prado 2002Lewinsohn TM & Prado PI (2002) Biodiversidade brasileira. Contexto, São Paulo. Pp. 176.) e sua flora possui dezenas de milhares de espécies nativas (Forzza et al. 2010Forzza RC, Costa A, Walter BMT, Pirani JR, Morim MP et al. 2010. Catálogo de plantas e fungos do Brasil. Vols I & II. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. Pp. 1699.; Brazil Flora Group 2015BFG - Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.), milhares delas espécies arbóreas ou arbustivas com potencial ornamental (Lorenzi 2002aLorenzi H (2002a) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Vol I. Plantarum, Nova Odessa. Pp. 368.,bLorenzi H (2002b) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil . Vol II. Plantarum, Nova Odessa. Pp. 368., 2009Lorenzi H (2009) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil . Vol. III. Plantarum, Nova Odessa. Pp. 368., 2010Lorenzi H (2010) Flora brasileira Lorenzi: Arecaceae (palmeiras). Plantarum, Nova Odessa. Pp. 368., 2013Lorenzi H (2013) Plantas para jardim no Brasil: herbáceas, arbustivas e trepadeiras. Plantarum, Nova Odessa. Pp. 1120.). Ainda assim, um grande número de cidades brasileiras não valoriza a flora nativa de suas próprias regiões, implementando uma arborização constituída majoritariamente por plantas exóticas (Rocha et al. 2004Rocha RT, Leles PSDS & Oliveira-Neto SN (2004)Arborização de vias públicas em Nova Iguaçu, RJ: o caso dos bairros Rancho Novo e Centro. Revista Árvore 28: 599-607.; Santos et al. 2008Santos AR, Bergallo HDG & Rocha CFD (2008) Paisagem urbana alienígena. Ciência Hoje 41: 68-73., 2010Santos AR, Rocha CFD & Bergallo HG (2010) Native and exotic species in the urban landscape of the city of Rio de Janeiro, Brazil: density, richness, and arboreal deficit. Urban Ecosystems 13: 209-222.; Moro & Castro 2015Moro MF & Castro ASF (2015) A check list of plant species in the urban forestry of Fortaleza, Brazil: where are the native species in the country of megadiversity? Urban Ecosystems 18: 47-71. ). Poucas cidades do Ceará já foram amostradas quanto à sua arborização. Visando investigar essa situação, escolhemos uma cidade no semiárido cearense e fizemos um inventário quantitativo da arborização da cidade. Nosso objetivo foi conhecer as espécies presentes na arborização urbana da cidade de Forquilha, Ceará, e avaliar a proporção de plantas exóticas versus nativas presentes na cidade.
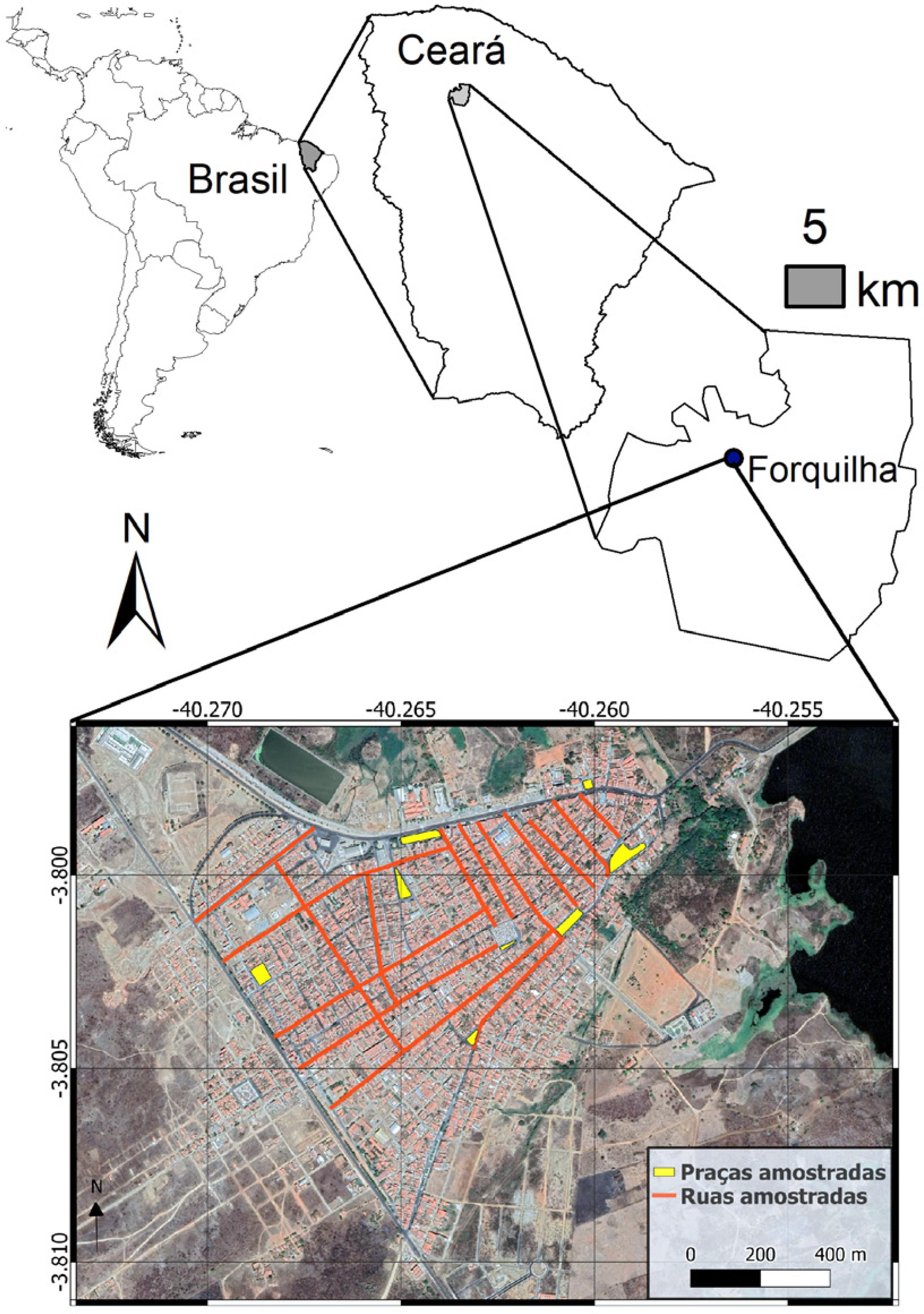
Nossa área de estudo se encontra na zona urbana do município de Forquilha, no interior do Ceará (Fig. 1). O município localiza-se a 3º47’54” de latitude sul e 40º15’38” de longitude oeste e possui clima tropical quente semiárido, com temperatura média de 26 a 28 ºC, com chuvas escassas e irregulares (pluviosidade média de 826,8 mm), concentradas principalmente nos meses de fevereiro a abril. Ocorrem na região solos bruno não-cálcico e podzólico vermelho-amarelo eutrófico (IPECE 2013). Os ecossistemas naturais ao redor da cidade são basicamente constituídos pela vegetação de caatinga típica, somada aos carnaubais, que são matas de caatinga ripária com presença da palmeira carnaúba (Copernicia prunifera (Mill.) H.E.Moore).
Mapa mostrando localização de Forquilha no estado do Ceará e uma imagem de satélite da sede urbana do município, mostrando em vermelho das ruas e em amarelo as praças amostradas por este trabalho.
Segundo os dados do Instituto de Pesquisa e Estratégia Econômica do Ceará (IPECE 2013IPECE - Instituto de Pesquisa e Estratégia Econômica do Ceará (2013) Perfil básico municipal 2013: Forquilha. Disponível em <http://www.ipece.ce.gov.br/publicacoes/perfil_basico/pbm-2013/Forquilha.pdf>. Acesso em 21 março 2015.
http://www.ipece.ce.gov.br/publicacoes/p...
) o município tem uma população de 21.786 habitantes. Está localizada na porção noroeste do estado do Ceará, microrregião de Sobral. Limita-se ao norte com o município de Sobral; ao sul com os municípios de Santa Quitéria, Sobral e Groaíras; ao leste com o município de Sobral e ao oeste com o município de Sobral e Groaíras. Sua superfície é de 516,99 km2, correspondendo a 0,52% da área do Ceará (Aragão & Loiola 2006Aragão J. & Loiola J (2006) Três riachos, uma Forquilha. Edição do autor, Forquilha. 346p.; IPECE 2013IPECE - Instituto de Pesquisa e Estratégia Econômica do Ceará (2013) Perfil básico municipal 2013: Forquilha. Disponível em <http://www.ipece.ce.gov.br/publicacoes/perfil_basico/pbm-2013/Forquilha.pdf>. Acesso em 21 março 2015.
http://www.ipece.ce.gov.br/publicacoes/p...
).
Para a obtenção dos dados, ou seja, para o inventário das árvores e arbustos presentes, foram selecionadas 15 ruas e oito praças da cidade (Fig. 1). Toda a extensão dessas 15 ruas foi percorrida a pé, em um total de 6,8 km. Nestas 15 ruas, bem como em oito praças da cidade, todos os indivíduos arbóreos ou arbustivos que tivesse pelo menos 2 m de altura foram registrados em caderneta de campo e identificados em campo ou por comparação com os guias fotográficos pertinentes (Lorenzi et al. 2003Lorenzi H, Souza HM, Torres MAV & Bacher LB (2003) Árvores exóticas no Brasil: madeireiras, ornamentais e aromáticas. Plantarum, Nova Odessa. Pp. 368., 2004Lorenzi H, Souza HM, Cerqueira LSC, Costa JTM & Ferreira E (2004) Palmeiras brasileiras e exóticas cultivadas. Plantarum, Nova Odessa. Pp. 416.; Lorenzi & Souza 2008Lorenzi H & Souza HM (2008) Plantas ornamentais no Brasil: arbustivas, herbáceas e trepadeiras. Plantarum, Nova Odessa. Pp. 1088.). O levantamento foi realizado no período de julho a novembro de 2013, e os dados foram organizados em uma tabela com as seguintes informações: nome da rua ou da praça, nome das espécies presentes, número de indivíduos de cada espécie, família, nome popular, hábito (árvore/arbusto) e origem (nativa ou exótica). Os dados foram posteriormente transferidos para uma planilha eletrônica e o conjunto completo de dados coletados em cada rua e praça é fornecido como suplemento eletrônico a este artigo no repositório FigShare: <https://doi.org/10.6084/m9.figshare.1245073>.
A grafia dos nomes foi verificada através da base de dados The Plant List (<http://www.theplantlist.org>). Foram consideradas nativas as espécies que possuem distribuição geográfica com ocorrência natural no estado do Ceará e exóticas as espécies sem ocorrência natural no Ceará, sendo oriundas de outros ecossistemas ou regiões geográficas que não o semiárido cearense.
A densidade de árvores por rua foi calculada considerando o número total de indivíduos divididos pela extensão de vias públicas percorridas. A extensão de cada rua foi calculada vetorizando-se no programa Google Earth os trechos percorridos sobre a imagem de satélite da cidade (Fig. 1).
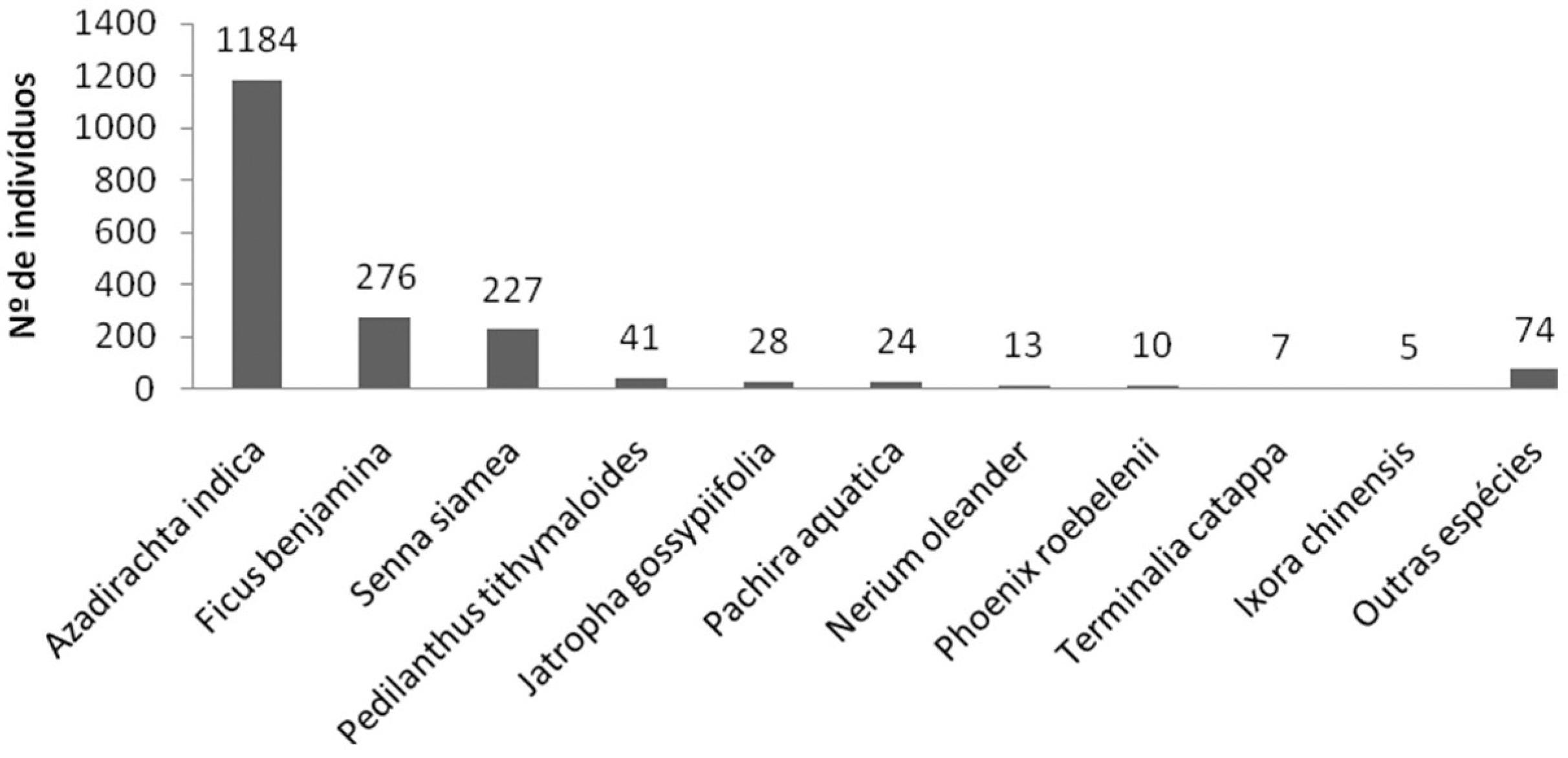
Nosso levantamento mostrou que a maioria absoluta das espécies presentes na arborização de Forquilha é formada por espécies exóticas. Nas 15 ruas e oito praças amostradas foram registradas um total de 1889 árvores e arbustos pertencentes a 44 espécies (Tabs. 1; 2). Destas, 41 espécies representando 1.884 indivíduos eram exóticos, e apenas três espécies, representando cinco indivíduos, eram nativos. As árvores e arbustos registrados nas ruas totalizaram 1.748 indivíduos pertencentes a 32 espécies (Tab. 2). Destes, 31 espécies (97% do total de espécies) e 1.746 indivíduos (99,9%) eram exóticos e uma única espécie (Cereus jamacaru DC., com dois indivíduos) era nativa (Tab. 2). A espécie mais abundante nas ruas foi Azadirachta indica A.Juss., com 1.161 indivíduos, seguida de Ficus benjamina L. (229 indivíduos) e Senna siamea (Lam.) H.S.Irwin & Barneby (217), todas espécies exóticas.
Extensão das ruas amostradas e densidade de árvores e arbustos registrados nas vias públicas de Forquilha, Ceará.
Espécies amostradas na arborização de ruas e praças de Forquilha, Ceará, com suas respectivas famílias, nomes populares, abundâncias e origens.
Já nas praças, apenas 141 indivíduos de 21 espécies foram registrados, com destaque para Ficus benjamina (47 indivíduos) e Azadirachta indica (23). Três praças não apresentavam nenhuma árvore ou arbusto, pois a prefeitura suprimiu toda a arborização das mesmas para realizar uma reforma nas praças, e precisará reimplantar futuramente a arborização. O conjunto detalhado de dados do inventário nas ruas e praças está disponível para consulta no suplemento digital do artigo: <https://doi.org/10.6084/m9.figshare.1245073>.
Somando-se ruas e praças (Tab. 2), observamos que a arborização de Forquilha é bastante homogênea, possuindo poucas espécies, a grande maioria das quais é exótica, ao passo que espécies nativas são praticamente ausentes. A arborização de Forquilha é fortemente dominada por Azadirachta indica, que representou 62,68% (1.184 exemplares) dos indivíduos amostrados (Figs. 2; 3; Tab. 2). Além dela, as espécies arbóreas Ficus benjamina (14,61%), Senna siamea (12,02%) e Pachira aquatica Aubl. (1,27%) e as arbustivas Pedilanthus tithymaloides (L.) Poit. (2,17%) e Jatropha gossypiifolia L. (1,48%) estão entre as espécies mais abundantes. Todas as outras espécies possuem abundâncias inferior a 1% e juntas representam apenas 5,8% do total de indivíduos amostrados (Fig. 2; Tab. 2). Tanto Azadirachta indica quanto Ficus benjamina e Senna siamea, as espécies mais comuns, são oriundas da Ásia.
Os diversos ecossistemas naturais do planeta possuem uma rica biota adaptada a uma grande variedade de condições ambientais (Olson et al. 2001Olson DM, Dinerstein E, Wikramanayake ED, Burgess ND, Powell GVN, Underwood EC, D'Amico JA, Itoua I, Strand HE, Morrison JC, Loucks CJ, Allnutt TF, Ricketts TH, Kura Y, Lamoreux JF, Wettengel WW, Hedao P & Kassem, KR (2001) Terrestrial ecoregions of the world: a new map of life on earth. BioScience 51: 933-938.) e o Brasil possui em seu território diversos desses ecossistemas (IBGE 2004IBGE - Instituto Brasileiro de Geografia e Estatística (2004) Mapa de biomas do Brasil: primeira aproximação. IBGE, Rio de Janeiro.) com um número estonteante de espécies, estando entre os países mais ricos em espécies vegetais no mundo (Forzza et al. 2010Forzza RC, Costa A, Walter BMT, Pirani JR, Morim MP et al. 2010. Catálogo de plantas e fungos do Brasil. Vols I & II. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. Pp. 1699.; Brazil Flora Group 2015BFG - Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.). Entretanto, nossas cidades muitas vezes têm implementado uma arborização majoritariamente exótica, ignorando a biodiversidade nativa (Santos et al. 2010Santos AR, Rocha CFD & Bergallo HG (2010) Native and exotic species in the urban landscape of the city of Rio de Janeiro, Brazil: density, richness, and arboreal deficit. Urban Ecosystems 13: 209-222.; Moro & Castro 2015Moro MF & Castro ASF (2015) A check list of plant species in the urban forestry of Fortaleza, Brazil: where are the native species in the country of megadiversity? Urban Ecosystems 18: 47-71. ).
O desapreço pela biodiversidade nativa é algo já antigo no Brasil e entendemos que precisa ser alterado em nossa cultura. O sociólogo Gilberto Freyre, importante pensador e teórico sobre a formação do povo brasileiro, notou em suas observações na primeira metade do século 20 esse comportamento, registrado em seu livro Nordeste, de 1937 (e edições posteriores):
“Nunca nos esqueceremos do dia em que entramos por uns restos de matas virgens do Sul de Pernambuco com o seu dono [...]. Êle sabia quase tão mal quanto nós, meninos da cidade, os nomes das árvores da mata grande do seu engenho. [...]. Foi preciso que o caboclo nos fôsse dizendo: isto é um pé disso; isto é um pé daquilo; isto dá um leite que serve para ferida brava; isto dá um chá que serve para as febres.
Essa distância entre o colono branco e a mata, entre o dono da terra e a floresta, explica o nosso quase nenhum amor pela árvore ou pela planta da região, quando se trata de arborizar as ruas das cidades do litoral. Explica a indiferença com que deixamos que a arborização das cidades do Nordeste vá se estandardizando no fico benjamim e no eucalipto australiano.
Ninguém diz que nos devemos fechar às novidades e aos brilhos da planta exótica. [...] Mas só pelo fato de não se ter desenvolvido entre nós nenhum lirismo entre o homem e a mata, se explica a indiferença, tão da gente do litoral do Nordeste pela árvore da terra. Desprezada dêsse jeito, a árvore da terra acabará talvez vencida de todo pela estranha ou pela simplesmente aclimada aqui, nos antigos hortos del-Rei. E essa vitória assim à grande, com conseqüências infelizes quase certas do ponto de vista ecológico.” (Freyre 1967Freyre G (1967) Nordeste: aspectos da influência da cana sobre a vida e a paisagem do Nordeste do Brasil. 4ª ed. Livraria José Olympio, Rio de Janeiro. 272p.)
Ignatieva (2012)Ignatieva M (2012) Plant material for urban landscapes in the era of globalization: roots, challenges and innovative solutions. In: Richter M & Weiland U (ed.) Applied urban ecology: a global framework. Wiley-Blackwell, Oxford. Pp. 139-151. discute essa situação em escala global, ao mostrar que houve no paisagismo e na rede internacional de jardins botânicos a criação de um conceito geral de “paisagismo tropical”, em que um grupo relativamente homogêneo de espécies “tropicais” foram selecionadas e replicadas extensivamente por horticulturistas para cultivo em cidades geograficamente distantes (Ignatieva 2012). Isso levou à oferta generalizada de um pequeno grupo pré-selecionado e mais ou menos homogêneo de espécies ornamentais para cultivo mundo afora, de modo descontextualizado da biota dos ecossistemas de cada país ou região. Como consequência, diversas cidades ignoraram a biodiversidade das suas próprias regiões para cultivar esse pequeno conjunto de espécies padronizadas que eram oferecidas como modelo pelos jardins botânicos (Ignatieva 2012Ignatieva M (2012) Plant material for urban landscapes in the era of globalization: roots, challenges and innovative solutions. In: Richter M & Weiland U (ed.) Applied urban ecology: a global framework. Wiley-Blackwell, Oxford. Pp. 139-151. ).
Proporção entre o número de indivíduos e espécies exóticos versus nativos para Forquilha no levantamento da arborização pública da cidade.
Isso resultou no fenômeno que McKinney (2006)McKinney ML (2006) Urbanization as a major cause of biotic homogenization. Biological Conservation 127: 247-260. chamou de homogeneização biológica. Embora cada região do planeta tenha uma biota diferente, cidades, mesmo que localizadas em lugares muito distantes, acabam possuindo espécies em comum nos seus ecossistemas urbanos. Elas são, portanto, mais homogêneas entre si do que os ecossistemas naturais seriam naturalmente. Um dos problemas com essa situação é que as pessoas passam a ter mais contato com a biota exótica, que foi introduzida para arborização ou paisagismo, do que elas têm com a biota nativa de suas próprias regiões. Com isso, elas passam a conhecer, e potencialmente valorizar, apenas plantas exóticas, ficando sem contato ou conhecimento sobre as espécies regionais, as quais muitas vezes precisam de suporte para conservação (Mckinney 2006McKinney ML (2006) Urbanization as a major cause of biotic homogenization. Biological Conservation 127: 247-260.; Moro & Castro 2015Moro MF & Castro ASF (2015) A check list of plant species in the urban forestry of Fortaleza, Brazil: where are the native species in the country of megadiversity? Urban Ecosystems 18: 47-71. ).
Outro problema do excesso de exóticas é que parte das plantas introduzidas para uso ornamental se torna invasora, ocupando ecossistemas naturais e gerando impactos para a já ameaçada flora nativa (Reichard & White 2001Reichard SH & White P (2001) Horticulture as a pathway of invasive plant introductions in the United States. BioScience 51: 103-113.; Harrington et al. 2003Harrington RA, Kujawski R & Ryan HDP (2003) Invasive plants and the green industry. Journal of Arboriculture 29: 42-48.; Zenni 2014Zenni RD (2014) Analysis of introduction history of invasive plants in Brazil reveals patterns of association between biogeographical origin and reason for introduction. Austral Ecology 39: 401-407.). De fato, a maioria das plantas que se tornaram invasoras no Brasil foram inicialmente introduzidas com fins ornamentais (Zenni 2014), sem que se tenha tomado o devido cuidado em relação aos riscos de bioinvasão. Azadirachta indica, a espécie mais abundante na arborização de Forquilha, por exemplo, já está naturalizada e potencialmente se tornará invasora no Nordeste do Brasil (Moro et al. 2013Moro MF , Westerkamp C & Martins FR (2013)Naturalization and potential impact of the exotic tree Azadirachta indica A.Juss. in Northeastern Brazil. Check List 9: 153-156.).
Apesar dos riscos à biodiversidade gerados pelas espécies invasoras, o conhecimento popular e das autoridades a respeito do assunto da bioinvasão é bastante precário e cuidados para evitar a disseminação de plantas invasoras não são tomados. Com isso, prefeituras, ONGs e a própria população distribuem mudas de plantas exóticas que geram riscos à biodiversidade nativa, sem perceber os problemas e riscos associados a esta ação.
Enquanto o nim-indiano (Azadirachta indica), apesar dos riscos de bioinvasão (Moro et al. 2013Moro MF , Westerkamp C & Martins FR (2013)Naturalization and potential impact of the exotic tree Azadirachta indica A.Juss. in Northeastern Brazil. Check List 9: 153-156.), se tornou extremamente comum na arborização de cidades do semiárido brasileiro (Fig. 2; Tab. 2; Moro et al. 2014Moro MF , Westerkamp C & Martins FR (2013)Naturalization and potential impact of the exotic tree Azadirachta indica A.Juss. in Northeastern Brazil. Check List 9: 153-156.), espécies nativas da região são praticamente ignoradas para uso ornamental. Árvores nativas com potencial ornamental como o juazeiro (Ziziphus joazeiro Mart.), o angico (Anadenanthera colubrina (Vell.) Brenan), o pau-branco (Cordia oncocalyx Allemão), a oiticica (Licania rigida Benth.) e a catingueira (Poincianella pyramidalis (Tul.) L.P. Queiroz), estão ausentes ou têm baixa incidência na arborização do semiárido (Tab. 2; Moro et al. 2014Moro MF, Westerkamp C & Araújo FS (2014) How much importance is given to native plants in cities’ treescape? A case study in Fortaleza, Brazil. Urban Forestry & Urban Greening 13: 365-374.), embora estejam presentes nos ecossistemas naturais remanescentes ao redor das cidades da região.
Embora a carnaúba (Copernicia prunifera), árvore símbolo do Ceará e endêmica do Brasil, esteja presente em algumas praças de Forquilha e embora alguns poucos indivíduos de espécies nativas como o mandacaru (Cereus jamacaru - Tab. 2) sejam encontrados pelas ruas, vemos que a flora natural da caatinga sensu stricto e dos carnaubais está praticamente alijada da concepção de arborização de Forquilha. Essas vegetações são encontradas ao redor da cidade, mas estão sob ameaça devido ao corte, queimadas e sobrepastoreio e muitas vezes são encarados de forma negativa pela população humana, que não vê valor estético na vegetação natural, muitas vezes chamada pejorativamente de “mato”. Trazer plantas nativas para dentro da cidade sob a ótica de plantas ornamentais e merecedoras de cultivo e cuidado poderia ser uma ferramenta de educação ambiental, levando as pessoas a valorizar a flora do semiárido brasileiro. Infelizmente vemos o quadro oposto, onde as plantas nativas estão praticamente banidas das cidades e apenas plantas exóticas têm sido merecedoras e apreço e cultivo.
Malavasi & Malavasi (2001)Malavasi UC & Malavasi MDM (2001) Avaliação da arborização urbana pelos residentes - estudo de caso em Mal. Cândido Rondon, Paraná. Ciência Florestal 11: 189-193. chamam a atenção para o fato de que o “sombreamento” e a “redução de calor” foram os atributos considerados pela população de uma cidade do sul do Brasil como mais “vantajosos”. No semiárido brasileiro, região de elevadas temperaturas e grande intensidade de radiação solar, tais atributos se tornam ainda mais desejáveis. Em conversas informais, também percebemos que a obtenção de sombra é um atributo valorizado pela população, embora, contraditoriamente, haja uma cultura muito forte de “podar as árvores”, que induz a população a mutilar as copas das árvores, reduzindo a sombra fornecida pelas plantas (Fig. 4). Percebemos a busca por sombra no fato de que as árvores mais abundantes são exóticas perenifólias, que retêm as folhas o ano inteiro, enquanto muitas nativas da caatinga são caducifólias. Entretanto, destacamos que espécies nativas do Ceará como Licania tomentosa (oiti), Licania rigida (oiticica), Ziziphus joazeiro (joazeiro), Guazuma ulmifolia Lam. (mutamba), Anacardium occidentale L. (cajueiro) e Libidibia ferrea (Mart. ex Tul.) L.P.Queiroz (jucá) também são perenifólias e mantêm suas folhas mesmo na estação seca. Licania tomentosa, Licania rigida e Anacardium occidentale, inclusive, são espécies já cultivadas com relativa frequência na arborização do estado (Moro & Castro 2015Moro MF & Castro ASF (2015) A check list of plant species in the urban forestry of Fortaleza, Brazil: where are the native species in the country of megadiversity? Urban Ecosystems 18: 47-71. ) e que poderiam, junto com as outras citadas acima, ser cultivadas de modo mais extensivo na região. Além delas, plantas com atributos estéticos atrativos como floração intensa poderiam ser cultivadas com mais frequência (como os paus-d’arcos ou ipês - Tabebuia aurea (Silva Manso) Benth. & Hook.f. ex S.Moore e Handroanthus impetiginosus (Mart. ex DC.) Mattos, por exemplo, já são moderadamente comuns na arborização no Ceará).
Avenida de Forquilha, Ceará, mostrando um trecho da arborização implementado exclusivamente com Azadirachta indica. Note que na foto a totalidade das árvores está com o tamanho de copa reduzido por procedimentos de poda, diminuindo a função de sombreamento desempenhado pelas plantas.
Vale destacar que, nas conversas informais que temos travado, percebemos que aos poucos os gestores públicos do estado têm se conscientizado sobre a necessidade de valorizar as espécies nativas, embora mudanças práticas ocorram de modo extremamente lento. Ressaltamos que nosso trabalho não é uma defesa da erradicação de árvores exóticas da arborização simplesmente por não serem nativas. Mas defendemos que deveria haver presença predominante espécies nativas na arborização brasileira, mesmo havendo a presença de espécies exóticas que não sejam invasoras. A presença de árvores nativas permitiria à população maior contato com as plantas nativas de suas regiões geográficas e assim a arborização poderia dar suporte a ações de divulgação da biodiversidade local para uma população crescentemente urbana. Já nos casos onde espécies invasoras são cultivadas, como no caso de Azadirachta indica (nim-indiano), Leucaena leucocephala (leucena) ou Prosopis juliflora (Sw.) DC. (algaroba), certamente sua retirada da arborização se justifica, a fim para proteger os ecossistemas contra sua dispersão.
Mostramos aqui um caso de predomínio extremo de espécies exóticas na composição da arborização de uma cidade brasileira. Mas levantamentos em várias cidades (Rocha et al. 2004Rocha RT, Leles PSDS & Oliveira-Neto SN (2004)Arborização de vias públicas em Nova Iguaçu, RJ: o caso dos bairros Rancho Novo e Centro. Revista Árvore 28: 599-607.; Santos et al. 2008Santos AR, Bergallo HDG & Rocha CFD (2008) Paisagem urbana alienígena. Ciência Hoje 41: 68-73., 2010Santos AR, Rocha CFD & Bergallo HG (2010) Native and exotic species in the urban landscape of the city of Rio de Janeiro, Brazil: density, richness, and arboreal deficit. Urban Ecosystems 13: 209-222.; Moro et al. 2014Moro MF, Westerkamp C & Araújo FS (2014) How much importance is given to native plants in cities’ treescape? A case study in Fortaleza, Brazil. Urban Forestry & Urban Greening 13: 365-374.) têm demonstrado desapreço pelas espécies nativas. Defendemos que cidades de cada região do país façam uma seleção de plantas nativas dos ecossistemas do seu entorno e que plantas nativas selecionadas em cada região sejam cultivadas de modo preferencial. Caso exóticas sejam cultivadas, esperamos que sejam apenas não invasoras e, mesmo assim, esperamos que no futuro a arborização brasileira passe a valorizar bem mais as espécies naturais de cada região do país.
Agradecemos à equipe da Universidade Estadual Vale do Acaraú (UVA) e do herbário HUVA, o suporte para a realização deste trabalho.
-
Editora de área: Dra. Daniela Zappi
Referências
- Abreu RCR & Durigan G (2011) Changes in the plant community of a Brazilian grassland savannah after 22 years of invasion by Pinus elliottii Engelm. Plant Ecology & Diversity 4: 269-278.
- Abreu RCR & Rodrigues PJFP (2010) Exotic tree Artocarpus heterophyllus (Moraceae) invades the Brazilian Atlantic Rainforest. Rodriguésia 61: 677-688.
- Aragão J. & Loiola J (2006) Três riachos, uma Forquilha. Edição do autor, Forquilha. 346p.
- BFG - Brazil Flora Group (2015) Growing knowledge: an overview of seed plant diversity in Brazil. Rodriguésia 66: 1085-1113.
- Dislich R, Kisser N & Pivello VR (2002) A invasão de um fragmento florestal em São Paulo (SP) pela palmeira australiana Archontophoenix cunninghamiana H. Wendl. & Drude. Revista Brasileira de Botânica 25: 55-64.
- Freyre G (1967) Nordeste: aspectos da influência da cana sobre a vida e a paisagem do Nordeste do Brasil. 4ª ed. Livraria José Olympio, Rio de Janeiro. 272p.
- Forzza RC, Costa A, Walter BMT, Pirani JR, Morim MP et al 2010. Catálogo de plantas e fungos do Brasil. Vols I & II. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. Pp. 1699.
- Harrington RA, Kujawski R & Ryan HDP (2003) Invasive plants and the green industry. Journal of Arboriculture 29: 42-48.
- IBGE - Instituto Brasileiro de Geografia e Estatística (2004) Mapa de biomas do Brasil: primeira aproximação. IBGE, Rio de Janeiro.
- Ignatieva M (2012) Plant material for urban landscapes in the era of globalization: roots, challenges and innovative solutions. In: Richter M & Weiland U (ed.) Applied urban ecology: a global framework. Wiley-Blackwell, Oxford. Pp. 139-151.
- IPECE - Instituto de Pesquisa e Estratégia Econômica do Ceará (2013) Perfil básico municipal 2013: Forquilha. Disponível em <http://www.ipece.ce.gov.br/publicacoes/perfil_basico/pbm-2013/Forquilha.pdf>. Acesso em 21 março 2015.
» http://www.ipece.ce.gov.br/publicacoes/perfil_basico/pbm-2013/Forquilha.pdf - Kweon BS, Sullivan WC & Wiley AR (1998) Green common spaces and the social integration of inner-city older adults. Environment and Behavior 30: 832-858.
- Lewinsohn TM & Prado PI (2002) Biodiversidade brasileira. Contexto, São Paulo. Pp. 176.
- Lombardo MA (1985) Ilha de calor nas metrópoles: o exemplo de São Paulo. Hucitec, São Paulo. Pp. 244.
- Lorenzi H (2002a) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Vol I. Plantarum, Nova Odessa. Pp. 368.
- Lorenzi H (2002b) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil . Vol II. Plantarum, Nova Odessa. Pp. 368.
- Lorenzi H (2009) Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil . Vol. III. Plantarum, Nova Odessa. Pp. 368.
- Lorenzi H (2010) Flora brasileira Lorenzi: Arecaceae (palmeiras). Plantarum, Nova Odessa. Pp. 368.
- Lorenzi H (2013) Plantas para jardim no Brasil: herbáceas, arbustivas e trepadeiras. Plantarum, Nova Odessa. Pp. 1120.
- Lorenzi H, Souza HM, Torres MAV & Bacher LB (2003) Árvores exóticas no Brasil: madeireiras, ornamentais e aromáticas. Plantarum, Nova Odessa. Pp. 368.
- Lorenzi H, Souza HM, Cerqueira LSC, Costa JTM & Ferreira E (2004) Palmeiras brasileiras e exóticas cultivadas. Plantarum, Nova Odessa. Pp. 416.
- Lorenzi H & Souza HM (2008) Plantas ornamentais no Brasil: arbustivas, herbáceas e trepadeiras. Plantarum, Nova Odessa. Pp. 1088.
- Malavasi UC & Malavasi MDM (2001) Avaliação da arborização urbana pelos residentes - estudo de caso em Mal. Cândido Rondon, Paraná. Ciência Florestal 11: 189-193.
- Maruyama PK, Mendes-Rodrigues C, Alves-Silva E & Cunha AF (2012) Parasites in the neighbourhood: Interactions of the mistletoe Phoradendron affine (Viscaceae) with its dispersers and hosts in urban areas of Brazil. Flora 207: 768-773.
- McKinney ML (2002) Urbanization, biodiversity, and conservation. BioScience, 52: 883-890.
- McKinney ML (2006) Urbanization as a major cause of biotic homogenization. Biological Conservation 127: 247-260.
- Menezes MOT (2004) The use of date palms (Phoenix sp.) as resting and sleeping sites by Callithrix jacchus in Northeastern Brazil. Neotropical Primates 12: 53-55.
- Mondin CA (2006) Espécies vegetais exóticas invasoras em florestas no Rio Grande do Sul. In: Congresso Nacional de Botânica: os avanços da botânica no início do século XXI: morfologia, fisiologia, taxonomia, ecologia e genética, 57, 2006, Porto Alegre. Anais ... Sociedade Botânica do Brasil, Porto Alegre. Pp. 529-531.
- Moro MF & Castro ASF (2015) A check list of plant species in the urban forestry of Fortaleza, Brazil: where are the native species in the country of megadiversity? Urban Ecosystems 18: 47-71.
- Moro MF, Westerkamp C & Araújo FS (2014) How much importance is given to native plants in cities’ treescape? A case study in Fortaleza, Brazil. Urban Forestry & Urban Greening 13: 365-374.
- Moro MF , Westerkamp C & Martins FR (2013)Naturalization and potential impact of the exotic tree Azadirachta indica A.Juss. in Northeastern Brazil. Check List 9: 153-156.
- Olson DM, Dinerstein E, Wikramanayake ED, Burgess ND, Powell GVN, Underwood EC, D'Amico JA, Itoua I, Strand HE, Morrison JC, Loucks CJ, Allnutt TF, Ricketts TH, Kura Y, Lamoreux JF, Wettengel WW, Hedao P & Kassem, KR (2001) Terrestrial ecoregions of the world: a new map of life on earth. BioScience 51: 933-938.
- Ööpik M, Bunce RGHB & Tischler M (2013) Horticultural markets promote alien species invasions: an Estonian case study of herbaceous perennials. NeoBiota 17: 19-37.
- Pegado CMA, Andrade LA, Félix LP & Pereira IM (2006) Efeitos da invasão biológica de algaroba - Prosopis juliflora (Sw.) DC. sobre a composição e a estrutura do estrato arbustivo-arbóreo da caatinga no Município de Monteiro, PB, Brasil. Acta Botanica Brasilica 20: 887-898.
- Pemberton RW & Liu H (2009) Marketing time predicts naturalization of horticultural plants. Ecology 90: 69-80.
- Reichard SH & White P (2001) Horticulture as a pathway of invasive plant introductions in the United States. BioScience 51: 103-113.
- Richardson DM, Pysek P, Rejmanek M, Barbour MG, Panetta FD & West CJ (2000) Naturalization and invasion of alien plants: concepts and definitions. Diversity and Distributions 6: 93-107.
- Rocha RT, Leles PSDS & Oliveira-Neto SN (2004)Arborização de vias públicas em Nova Iguaçu, RJ: o caso dos bairros Rancho Novo e Centro. Revista Árvore 28: 599-607.
- Ruszczyk A & Nascimento ES (1999) Biologia dos adultos de Methona themisto (Hübner 1818) (Lepidoptera, Nymphalidae, Ithomiinae) em praças públicas de Uberlândia, Minas Gerais, Brasil. Revista Brasileira de Biologia 59: 577-583.
- Santos AR, Rocha CFD & Bergallo HG (2010) Native and exotic species in the urban landscape of the city of Rio de Janeiro, Brazil: density, richness, and arboreal deficit. Urban Ecosystems 13: 209-222.
- Santos AR, Bergallo HDG & Rocha CFD (2008) Paisagem urbana alienígena. Ciência Hoje 41: 68-73.
- Zenni RD (2014) Analysis of introduction history of invasive plants in Brazil reveals patterns of association between biogeographical origin and reason for introduction. Austral Ecology 39: 401-407.
- Zenni RD & Ziller SR (2011) An overview of invasive plants in Brazil. Revista Brasileira de Botânica 34: 431-446.
Datas de Publicação
-
Publicação nesta coleção
03 Out 2019 -
Data do Fascículo
2019
Histórico
-
Recebido
30 Set 2017 -
Aceito
05 Fev 2018


 Fonte da imagem de satélite: Google Earth.
Fonte da imagem de satélite: Google Earth.