Resumo
Um inventário de fanerógamas da planície costeira da região centro-norte do Rio Grande do Sul, Brasil é apresentado. Durante dois anos, todas as fitofisionomias dos municípios de Cidreira, Balneário Pinhal e Palmares do Sul foram amostradas. As espécies foram classificadas quanto ao ambiente de ocorrência, hábito preferencial, naturalidade e grau de ameaça. Foram coletadas 383 espécies de 92 famílias, sendo 365 (95%) nativas e 18 (5%) exóticas. As famílias de maior riqueza foram Asteraceae (45), Poaceae (30), Cyperaceae (24) e Fabaceae (23). As formações campestres apresentaram a maior riqueza florística (146), seguidas pelas florestais (132) e lacustres (17). Os hábitos preferenciais foram herbáceo/arbustivo (68%), árvore (20%), trepadeiras (6%), epífitas (6%) e parasitas (1%). Ao todo, foram registradas 18 espécies em alguma categoria de ameaça. Os dados encontrados representam uma alta riqueza de espécies para região sendo compatíveis às estimativas e ao encontrado por outros autores em áreas costeiras, e devem-se basicamente pelo mosaico fitofisionômico e geográfico da região e pela influência dos biomas Mata Atlântica e Pampa. Ameaças à flora local foram evidenciadas, principalmente relacionadas à degradação dos habitats naturais pelos cultivos agrícola e silvícola.
Palavras-chave:
Floresta Atlântica; formações pioneiras; macrófitas aquáticas; região costeira; restinga
Abstract
An inventory of phanerogams from the central-north coastal plain of Rio Grande do Sul, Brazil, is presented here. During two years, all the phytophysiognomies of the municipalities of Cidreira, Balneário Pinhal and Palmares do Sul were sampled. The species were classified according to the environment of occurrence, preferential habit, naturalness and degree of threat. A total of 383 species were collected from 92 families, of which 365 (95%) native and 18 (5%) were exotic. The richest families were Asteraceae (45), Poaceae (30), Cyperaceae (24) and Fabaceae (23). The field formations presented the highest floristic richness (146), followed by forest (132) and wetland (17). The preferred habits were herbaceous and shrub (68%), habit tree (20%), climbers (6%), epiphytes (6%) and parasites (1%). In all, 18 species were registered in some threat category. The data found represent a high species richness for the region, and are compatible with the estimates and those found by other authors in coastal areas, and are basically due to the phytophysiognomic and geographic mosaic of the region and the influence of the Mata Atlântica and Pampa biomes. Threats to the local flora were evidenced, mainly related to the degradation of the natural habitats by the agricultural and silvicultural crops.
Key words:
Atlantic forest; pioneer formations; aquatic macrophytes; coastal region; restinga
Introdução
Ecossistemas costeiros apresentam elevada importância ecológica por prestarem serviços ecológicos de natureza econômica, natural e cultural (Liquete et al. 2013Liquete C, Piroddi C, Drakou EG, Gurney L, Katsanevakis S, Charef A & Egoh B (2013) Current status and future prospects for the assessment of marine and coastal ecosystem services: a systematic review. Plos ONE 8: 1-15.), além de concentrarem cerca de 1.900 espécies animais e vegetais ao redor do mundo (Martínez et al. 2007Martínez LM, Intralawana A, Vázquez G, Pérez-Maqueo O, Suttond P & Landgrave R (2007) The coasts of our world: ecological, economic and social importance. Ecological Economics 63: 254-272.). Neles, a vegetação serve como berçário e habitat para as espécies, garante a estabilidade do solo, atua como filtro para a água continental, auxilia no sequestro do carbono atmosférico, bem como, serve como barreiras e atenuantes na dinâmica das marés e na contenção de eventos catastróficos (Worm et al. 2006Worm B, Barbier EB, Beaumont N, Duffy JE, Folke C, Halpern BS, Jackson JB, Lotze HK, Micheli F, Palumbi SR, Sala E, Selkoe KA, Stachowicz JJ, & Watson R (2006) Impacts of biodiversity loss on ocean ecosystem services. Science 314: 787-790.; Barbier et al. 2011Barbier EB, Hacker SD, Kennedy C, Koch EW, Stier AC & Silliman BR (2011) The value of estuarine and coastal ecosystem services. Ecological Monographs 81: 169-193.; Duarte et al. 2013Duarte CM, Losada IJ, Hendriks IE, Mazarrasa I & Marbà N (2013) The role of coastal plant communities for climate change mitigation and adaptation. Nature Climate Change 3: 961-969.). Socioeconomicamente, oferece madeira, lenha, resinas, mel, criatórios para caranguejos, além de compor ambiente de turismo, recreação, educação e pesquisa (Barbier et al. 2011).
O Brasil possui uma das maiores regiões costeiras do mundo, abrangendo cerca de 8.000 km de extensão (Ab’Saber 2001Ab’Saber AN (2001) Litoral do Brasil. Metalivros, São Paulo. 286p.), ocorrendo desde o Rio Grande do Sul ao Amapá (Amaral et al. 2008Amaral DD, Prost MT, Bastos MNC, Neto SVC & Santos JUM (2008) Restingas do litoral amazônico, estados do Pará e Amapá, Brasil. Boletim do Museu Paraense Emílio Goeldi 3: 35-67.). No estado do Rio Grande do Sul, tal formação geológica originou-se através dos eventos de transgressão e regressão marinhas quaternárias, ocorridos no Pleistoceno e Holoceno, dando origem a um complexo mosaico formado por bancos de dunas, banhados, sistemas aluviais e corpos lagunares (Tomazelli et al. 2000Tomazelli LJ, Dillemburg SR & Villwock JA (2000) Late quaternary geological history of Rio Grande do Sul coastal plain, Southern Brazil. Revista Brasileira de Geociências 30: 470-472.; Buchmann et al. 2009Buchmann FSC, Caron F, Lopes RP, Ugri A & Lima LGL (2009) Panorama geológico da Planície Costeira do Rio Grande do Sul. In: Ribeiro AM, Bauermann SG & Scherer CS (eds.) Quaternário do Rio Grande do Sul: integrando conhecimentos. Sociedade Brasileira de Paleontologia, Porto Alegre. Pp. 35-56.).
A flora que se estabelece na planície costeira é denominada como Vegetação de Formações Pioneiras (Leite & Klein 1990Leite P, & Klein RM (1990) Vegetação. In: IBGE - Instituto Nacional de Geografia e Estatística. Geografia do Brasil: Região Sul. Vol. 2. IBGE, Rio de Janeiro. Pp. 113-150.; Veloso 1992Veloso HP (1992) Manual técnico da vegetação brasileira. IBGE, Rio de Janeiro. 93p.) ou simplesmente Restinga (Rizzini 1992Rizzini CT (1992) Tratado de Fitogeografia do Brasil. Âmbito Cultural, Rio de Janeiro. 747p.; Falkenberg 1999Falkenberg DB (1999) Aspectos da flora e da vegetação secundária da restinga de Santa Catarina, Sul do Brasil. Insula 28: 1-30.; Silva 1999Silva SM (1999) Diagnósticos das restingas do Brasil. In: Workshop de avaliação e ações prioritárias para conservação da biodiversidade da zona costeira e marinha (Anais eletrônicos). Fundação Bio-Rio, Porto Seguro. 30p.), por ocorrer sobre ambientes altamente estressantes, submetidas à ação de variações ambientais físico-químicas e gradientes sucessionais (Rambo 1954Rambo B (1954) História da flora do litoral Riograndense. Sellowia 6: 113-172.; Klein 1984; Seeliger 1998Seeliger U (1998) A flora das dunas costeiras. In: Seeliger U, Odebrecht C & Castello JP (orgs.) Os ecossistemas costeiro e marinho do extremo sul do Brasil. Ecoscientia, Rio Grande. Pp. 109-113.). Fitogeograficamente, a planície costeira do Rio Grande do Sul é influenciada ao norte, pela confluência com as porções mais austrais da Serra do Mar, que está sob o domínio do bioma Mata Atlântica, já a porção mais austral, a partir do paralelo 30°, é influenciada pelo bioma Pampa (Fiaschi & Pirani 2009Fiaschi P, & Pirani JR (2009) Review of plant biogeographic studies in Brazil. Journal of Systematics and Evolution 47: 1-20.). Esta dupla influência é explicada pelos processos recentes da migração das florestas tropicais ao longo da planície costeira em direção ao Sul (Ledru et al. 1998Ledru MP, Labouriau MLS & Lorscheitter ML (1998) Vegetation dynamics in Southern and Central Brazil during the last 10,000 yr b.p. Review of Palaeobotany and Palynology 99: 131-142.; Lorscheitter 2003Lorscheitter ML (2003) Contribution to the Holocene history of Atlantic Rain Forest in the Rio Grande do Sul state, southern Brazil. Revista del Museo Argentino de Ciencias Naturales 5: 261-271.).
Atualmente, estimativas apontam que cerca de 25 a 50% da vegetação costeira tem sido perdida nos últimos 50 anos (Duarte et al. 2013Duarte CM, Losada IJ, Hendriks IE, Mazarrasa I & Marbà N (2013) The role of coastal plant communities for climate change mitigation and adaptation. Nature Climate Change 3: 961-969.). Tais eventos podem estar relacionados à concentração das populações humanas nestes ambientes (Gedan et al. 2011Gedan KB, Kirwan ML, Wolanski E, Barbier EB & Silliman BR (2011) The present and future role of coastal wetland vegetation in protecting shorelines: answering recent challenges to the paradigm. Climatic Change 106: 7-29.). Na planície costeira do Rio Grande do Sul, muitas formações campestres vêm sendo convertidos em arrozais, que provoca perda de habitats, além de propiciar a invasão de espécies exóticas especialmente pela aplicação de herbicidas (Boldrini et al. 2008Boldrini II, Trevisan R & Schneider AA (2008) Estudo florístico e fitossociológico de uma área às margens da lagoa do Armazém, Osório, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 6: 355-367.). Tal fator tem contribuído para a inclusão destas áreas da planície costeira na categoria de alta importância biológica para conservação (MMA 2000). Além de serem reconhecidos pela UNESCO como áreas integrantes oficiais da Reserva da Biosfera da Mata Atlântica (Marcuzzo et al. 1998Marcuzzo S, Pagel SM & Chiappetti MIS (1998) A Reserva da Biosfera da Mata Atlântica no Rio Grande do Sul: situação atual, ações e perspectivas. Caderno 11. Consórcio da Mata Atlântica e Conselho Nacional da Reserva da Biosfera da Mata Atlântica, São Paulo. 60p.), o que fazem destes ecossistemas importantes focos de pesquisa e de desenvolvimento de projetos conservacionistas.
Este artigo objetiva apresentar o inventário florístico das fanerógamas encontradas na porção centro-norte da planície costeira do Rio Grande do Sul, Brasil, listando as espécies ocorrentes, sua distribuição nas diferentes fitofisionomias, forma de vida, grau de ameaça e naturalidade. Tais resultados visam contribuir no conhecimento da flora do Rio Grande do Sul (RS), bem como prover dados para o manejo e uso das áreas nas mais diferentes abordagens.
Material e Métodos
Área de estudo
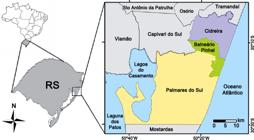
A área estudada localiza-se nos municípios de Cidreira (CD), Balneário Pinhal (BP) e Palmares do Sul (PS), posicionados entre as coordenadas 30°02’22”S-30°30’06”S e 50°10’15”W-50°43’44”W, no litoral centro-norte do estado do Rio Grande do Sul (RS). Os municípios possuem área territorial de 246, 104 e 949 km², respectivamente, totalizando uma área superficial de cerca de 1.300 km² (Fig. 1).
Mapa da área de estudo, com a localização dos municípios de Cidreira, Balneário Pinhal e Palmares do Sul, no litoral centro-norte do Rio Grande do Sul, Brasil.
Figure 1
Map of study area, in evidence the municipalities of Cidreira, Balneário Pinhal and Palmares do Sul, in center-north coastal of state of Rio Grande do Sul, Brazil.
A composição pedológica da área de estudo compreende uma mistura de areias quartzosas, originadas principalmente pelas deposições Holocênicas e Pleistocênicas, que dão origem a solos profundos, não hidromórficos, bem drenados e pouco evoluídos, de textura arenosa, e que ocorrem em áreas planas ou até 800 m de alt.; e areias quartzosas hidromórficas húmicas, que compõem solos mal drenados, de textura arenosa, também de origem Holocênica, ocorrendo principalmente nas áreas de baixadas, onde o lençol freático é próximo à superfície (Moser 1990Moser JM (1990) Solos. In: IBGE - Instituto Brasileiro de Geografia e Estatística. Geografia do Brasil, Região Sul. IBGE, Rio de Janeiro. Pp.81-112.; Embrapa 2006).
Segundo a classificação de Köppen, o clima é classificado em Cfa, ou seja, subtropical com a temperatura do mês mais quente superior a 22 °C e a mínima do mês mais frio superior a 3 °C. A média anual da temperatura é de 17,6 °C e a precipitação varia entre 1.250 a 2.550 mm anuais (Moreno 1961Moreno JA (1961) Clima do Rio Grande do Sul. Secretaria da Agricultura, Porto Alegre. 42p.). A região não apresenta uma estação seca, e a ocorrência de geadas não ultrapassa um dia por ano (Nimer 1990Nimer E (1990) Clima. Geografia do Brasil, Região Sul. Vol. 2. IBGE, Rio de Janeiro. Pp. 151-187.). A vegetação presente na área de estudo é composta por distintas fitofisionomias que são definidas pela matriz edáfica, grau de sucessão ecológica e presença dos corpos hídricos (Waechter 1985Waechter JL (1985) Aspectos ecológicos da vegetação de restinga no Rio Grande do Sul, Brasil. Comunicação do Museu de Ciências, PUCRS, série botânica 33: 49-68.).
Amostragem
As coletas foram realizadas por meio de incursões bimensais, entre julho de 2010 a setembro de 2012. Durante este período, todas as tipologias vegetacionais existentes na área de estudo foram percorridas através do caminhamento e varredura das áreas (Filgueiras et al. 1994Filgueiras TS, Nogueira PE, Brochado AL & Guala GF (1994) Caminhamento: um método expedito para levantamentos florísticos qualitativos. Cadernos de Geociências 12: 39-43.). Fitofisionomias como: campos psamófilos, campos úmidos, banhados, matas de restinga seca, matas de restinga paludosa, bem como a vegetação dos corpos d’água, entornos de plantios e áreas antropizadas foram amostradas (Figs. 2 e 3). As amostras foram coletadas e herborizadas conforme as técnicas usuais de inventários florísticos, e o material testemunho foi incorporado ao Herbário da Universidade de Caxias do Sul (HUCS), acrônimo conforme Thiers (continuamente atualizado). A redação nomenclatural, bem como o posicionamento taxonômico seguiu o apresentado pela Flora do Brasil 2020 (atual. const.).
Fitofisionomias úmidas presentes na área de estudo – a. áreas de transbordo das lagoas costeiras; b. matas ciliares do Rio Palmares; c. áreas perilacunares, com formações de maricazal; d. baixadas entre dunas; e. campos turfosos em sucessão; f. ao fundo, formação de mata turfosa ou paludosa.
Figure 2
Wet fitofisionomies in study area – a. floodplains surrounding lagoons; b. riparian forest of Palmares river; c. maricazal formations surrounding lagoons; d. depressions between dunes banks; e. peat grasses in succession process; f. in the background, peat forests.
Fitofisionomias secas presentes na área de estudo – a. campos psamófilos de bancos de dunas; b. campos psamófilos pastejados em áreas perilacunares; c. campos secos com formações de moitas de vegetação arbustivoarbóreas; d. aspecto dos cordões arenosos; e. matas de restinga seca sobre cordões de dunas; f. epifitismo em vegetação arbórea de restinga seca.
Figure 3
Dry fitofisionomies in study area – a. psammophilous grasses in dunes banks; b. psammophilous grasses in grazed areas surrounding lagoons; c. dry grasses with clumps of shrub-arboreal vegetation; d. aspect of sandy bars; e. dry restinga forests on sandy bars; f. epiphytism in dry restinga forests.
As espécies foram classificadas de acordo com a formação fitofisionômica que elas habitam, sendo, florestais: incluindo formações florestais de bancos de dunas (Fig. 3b,d,e) e matas paludosas (Fig. 2b,e,f); campestres: incluindo formações de campos psamófilos (Fig. 3a), campos secos (Fig. 3c) e úmidos (Fig. 2d); lacustres: espécies que habitam as lagoas costeiras (Fig. 2a,c), rios (Fig. 2b), bem como banhados e áreas alagadiças. As espécies foram classificadas também quanto ao hábito preferencial, sendo: herbáceo (plantas de consistência herbácea); arbustivo (plantas de consistência lenhosa ou sub-lenhosa, até 2 m de altura); arbóreo (plantas lenhosas com mais de 2 m de altura); trepador (plantas herbáceas ou lenhosas com crescimento volúvel, escandente ou trepador); parasítico (plantas com crescimento hemi ou holoparasita); epifítico (espécies herbáceas com crescimento epifítico). A naturalidade das espécies foi definida de acordo com Moro et al. (2012)Moro MF, Souza VC, Oliveira-Filho AT, Queiroz LP, Fraga CN, Rodal MJN, Araujo FS & Martins FR (2012) Alienígenas na sala: o que fazer com espécies exóticas em trabalhos de taxonomia, florística e fitossociologia? Acta botanica brasílica 26: 991-999., em nativas e exóticas. A identificação de espécies ameaçadas de extinção foi realizada por meio da consulta à Lista Vermelha das Espécies da Flora Ameaçadas de Extinção do Rio Grande do Sul (Rio Grande do Sul 2014).
Resultados e Discussão
O esforço amostral resultou no registro de 550 espécimes (CD - 221; BP - 58 e PS - 270), representando uma densidade amostral média de 0,42 espécimes por km² . De acordo com os dados disponíveis na base de dados do INCT Herbário Virtual, a área de estudo possui aproximadamente 1.351 registros de fanerógamas depositados nos mais diferentes herbários nacionais e do exterior (CD - 353; BP - 50; PS - 948). Com a realização deste inventário, houve o incremento de 41% na amostragem dos municípios, e as áreas passaram a possuir uma densidade amostral média de 1,0 esp./km² para 1,46 esp./km² (CD 2,30 esp./km²; BP 1 esp./km² e PS 1,28 esp./km²).
A Região Sul do Brasil como um todo, embora apresente longo histórico de estudos florísticos e taxonômicos, ainda possui amostragem insuficiente para o detalhamento da flora local (Shepherd 2003Shepherd G (2003) Conhecimento de diversidade de plantas terrestres do Brasil. Ministério do Meio Ambiente, Brasília. 60p.), mesmo assim é superior à média nacional de 0,44 esp./km² (Giulietti et al. 2005Giulietti AM, Raymond MH, Queiroz LP, Wanderley MGL & van den Berg C (2005) Biodiversity and conservation of plants in Brazil. Conservation Biology 19: 632-639.), e ao considerado mínimo para o conhecimento das floras tropicais, que é de cerca de 1 esp./ km² (Prance 1977Prance GT (1977) Floristic inventory of the tropics: where do we stand?. Annals of the Missouri Botanical Garden 64: 659-684.). Esta suficiência implica diretamente no aporte de material para o detalhamento das floras regionais e na elaboração de pesquisas aplicadas que utilizam os registros botânicos como base para o seu desenvolvimento como a Biogeografia, Ecologia e conservação das espécies vegetais (Prance 1977; Giulietti et al. 2005; Cielo-Filho et al. 2009Cielo-Filho R, Baitello JB, Pastore JA, Aguiar OT, Souza SCPM, Toniato MTZ, Lima CR & Ribeiro AP (2009) Ampliando a densidade de coletas botânicas na região da bacia hidrográfica do Alto Paranapanema: caracterização florística da Floresta Estadual e da Estação Ecológica de Paranapanema. Biota Neotropica 9: 255-276.). Neste sentido, os municípios que apresentaram melhor amostragem (CD e PS) são os que apresentam maior área superficial e consequentemente maior proporção de áreas rurais e naturais, que mais interessam ao desenvolvimento de atividades de coletas botânicas.
O inventário resultou no reconhecimento de 383 espécies (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>), distribuídas em 92 famílias e 272 gêneros. Estes dados são similares aos encontrados em outros levantamentos florísticos em regiões costeiras do sul do Brasil que levaram em consideração todas as sinúsias, como Silva Filho et al. (2013)Silva Filho PJS, Silva CC, Franco PF, Cavalli J, Bertholdo LM, Schmitt LA, Ilha R & Mondin CA (2013) Levantamento florístico de um fragmento de Floresta Ombrófila Densa no litoral norte do Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 11: 163-183. no município de Dom Pedro de Alcântara, RS, onde foram reconhecidas 348 espécies de fanerógamas, Duarte & Bencke (2006)Duarte MM, & Bencke GA (2006) Plano de Manejo do Parque Estadual de Itapeva, relatório final. Fundação Zoobotânica do Rio Grande do Sul, Porto Alegre. 274p., no plano de manejo Parque Estadual do Itapeva, Torres, RS, onde foram registradas 806 espécies de plantas vasculares, ou Melo & Boeger (2015)Melo JRJCF, & Boeger MRT (2015) Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, estado de Santa Catarina, Brasil. Hoehnea 42: 207-232., no Parque Estadual do Acaraí, São Francisco do Sul, SC, onde foram identificadas 319 espécies de angiospermas. Sevegnani et al. (2013)Sevegnani L, Uhlmann A, Gasper AL, Vibrans AC, Santos AS, Verdi M, Dreveck S, Korte A & Meyer L (2013) Estádios sucessionais na Floresta Ombrófila Densa em Santa Catarina. In: Vibrans AC, Sevegnani L, Gasper AL & Lingner DV (eds.) Inventário florístico florestal de Santa Catarina: Floresta Ombrófila Densa. Edifurb, Blumenau. Pp. 311-322. apontam que nas vertentes litorâneas e restingas do estado de Santa Catarina ocorram cerca de 1.612 espécies de fanerógamas. Em uma compilação pioneira da flora das planícies costeiras do sudeste e sul do Brasil, Marques et al. (2015)Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18. apontam a ocorrência de 1.466 espécies de angiospermas, uma de gimnosperma e 121 de samambaias e licófitas. Talvez, este número esteja subestimado, pois somente de samambaias e licófitas terrestres são registradas 221 espécies para a planície costeira do RS (Gonzatti et al. 2016Gonzatti F, Machado L & Windisch P (2016) Distribution patterns of ferns and lycophytes in the Coastal Region of the state of Rio Grande do Sul, Brazil. Acta Botanica Brasilica 30: 239-253.). Neste contexto, os dados encontrados neste estudo representam entre 23 e 25% das espécies registradas para este tipo de formação vegetacional, número elevado quando considerado o período de amostragem e o posicionamento fitogeográfico da área de estudo.
A elevada riqueza de espécies nas planícies costeiras do sul e sudeste do Brasil deve-se principalmente à grande diversidade de habitats originados pelas diferentes combinações de condições abióticas, o próprio padrão de distribuição geográfico das espécies, e a proximidade com outras formações fitofisionômicas, principalmente com a Floresta Ombrófila Densa, o que permite que muitas espécies co-ocorram simultaneamente (Rambo 1954Rambo B (1954) História da flora do litoral Riograndense. Sellowia 6: 113-172.; Marques et al. 2011Marques MCM, Swaine MD & Liebsch D (2011) Diversity distribution and floristic differentiation of the coastal lowland vegetation: implications for the conservation of the Brazilian Atlantic Forest. Biodiversity and Conservation 20: 153-168., 2015). No entanto, na área de estudo, o efeito do gradiente latitudinal de diversidade deve ser considerado como fator na redução da riqueza de espécies, já que a partir do paralelo 30°S, ocorre uma descontinuidade climática e fitogeográfica que limita a distribuição de muitos grupos funcionais e taxonômicos de caráter tropical da vegetação litorânea (mais detalhes em: Rambo 1951; Waechter 1985Waechter JL (1985) Aspectos ecológicos da vegetação de restinga no Rio Grande do Sul, Brasil. Comunicação do Museu de Ciências, PUCRS, série botânica 33: 49-68., 1990, 1998, 2002; Lorscheitter 2003Lorscheitter ML (2003) Contribution to the Holocene history of Atlantic Rain Forest in the Rio Grande do Sul state, southern Brazil. Revista del Museo Argentino de Ciencias Naturales 5: 261-271.; Scherer 2009Scherer A (2009) Estrutura e aspectos fitogeográficos de remanescentes florestais na restinga sulbrasileira. Tese de Doutorado. UFRGS, Porto Alegre. 130p.; Gonzatti et al. 2016Gonzatti F, Machado L & Windisch P (2016) Distribution patterns of ferns and lycophytes in the Coastal Region of the state of Rio Grande do Sul, Brazil. Acta Botanica Brasilica 30: 239-253.). Neste paralelo ocorre a transição entre o bioma Mata Atlântica e o bioma Pampa, o que reflete em uma mudança fitofisionômica da planície costeira meso-sul do RS (Overbeck et al. 2007Overbeck GE, Müller SC, Fidelis A, Pfadenhauer J, Pillar VP, Blanco CC, Boldrini II, Both R & Forneck ED (2007) Brazil’s neglected biome: the South Brazilian Campos. Perspectives in Plant Ecology, Evolution and Systematics 9: 101-116.; Fiaschi & Pirani 2009Fiaschi P, & Pirani JR (2009) Review of plant biogeographic studies in Brazil. Journal of Systematics and Evolution 47: 1-20.) e também uma redução nas taxas de riqueza de espécies e níveis de endemismos entre os dois biomas (Forzza et al. 2012Forzza RC, Baumgratz JFA, Bicudo CEM, Canhos DAL, Carvalho Jr AA, Coelho MAN, Costa AFC, Costa DP, Hopkins MG, Leitman PM, Lohmann LG, Lughadha EN, Maia LC, Martinelli G, Menezes M, Morim MP, Peixoto AL, Pirani JR, Prado J, Queiroz LP, Souza S, Souza VC, Stehmann JR, Sylvestre LS, Walter BMT & Zappi DC (2012) New Brazilian floristic list highlights conservation challenges. Bioscience 62: 39-45.).
As famílias com maior riqueza específica foram Asteraceae (45), Poaceae (30), Cyperaceae (24) e Fabaceae (23). As demais, Solanaceae, Myrtaceae, Rubiaceae e Orchidaceae, apresentaram entre 13 e 15 espécies. Das 92 famílias encontradas, 52 famílias apresentaram menos de 10 espécies, e 33 somente uma (Fig. 4). As formações campestres apresentaram a maior riqueza florística, ocorrendo o registro de 146 espécies exclusivas nesta formação, seguidas pelas formações florestais (132) e lacustres (17). As espécies que co-ocorrem nas formações campestres e lacustres foram 70 enquanto que as que ocorrem simultaneamente nas formações campestres e florestais somaram 16 (Fig. 5). Quanto aos hábitos preferenciais, as espécies herbáceas e arbustivas perfizeram um percentual de 68%, seguidas pelo hábito árvore (20%), trepadeiras (6%), epífitas (6%) e parasitas (1%) (Fig. 6). Com exceção de 23 espécies, todas as plantas herbáceas e arbustivas foram registradas nos ambientes campestres.
Famílias botânicas com maior riqueza florística encontradas na área de estudo. Famílias na categoria “uniespecíficas” contaram com o registro de somente uma única espécie.
Figure 4
Botanical families with the highest richness found in study area. “Unspecific” families presented only a unique specie record.
Riqueza específica presente nas diferentes formações fitofisionômicas estudadas. (C = campestre; CL = campestre e lacustre; F = florestal; L = lacustre; CF = campestre e florestal).
Figure 5
Species richness found in different fitofisionomics studied. (C = campestral; CL = campestral and lacustrine; F = forest; L = lacustrine; CF = campestral and forest).
Hábitos preferenciais das espécies encontradas no presente estudo. (Erb = herbáceas; Arv = arbóreas; Arb = arbustivas; Tre = trepadeiras; Epi = epifíticas; Par = parasitas). Valores em porcentagem.
Figure 6
Species preferential habit found in study area. (Erb = herbaceous; Arv = trees; Arb = shrubs; Tre = climbers; Epi = epiphytes; Par = parasites). Values in percentage.
A predominância destas famílias está relacionada à pluralidade de ecossistemas existentes na área de estudo, e foi compartilhada por outros inventários da sinúsia herbácea ou campestre na planície costeira (Boldrini et al. 2008Boldrini II, Trevisan R & Schneider AA (2008) Estudo florístico e fitossociológico de uma área às margens da lagoa do Armazém, Osório, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 6: 355-367.; Caetano 2003Caetano VL (2003) Dinâmica sazonal e fitossociologia da vegetação herbácea de uma baixada úmida entre dunas, Palmares do Sul, Rio Grande do Sul, Brasil. Iheringia, série botânica 8: 81-102.; Ferreira & Setubal 2009Ferreira PMA, & Setubal RB (2009) Florística e fitossociologia de um campo natural no município de Santo Antônio da Patrulha, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 7: 195-204.; Menezes et al. 2013Menezes LS, Leite SLC & Ritter MR (2013) Flora e vegetação de um fragmento de restinga em Imbé, Rio Grande do Sul, Brasil. Pesquisas, botânica 64: 141-155.). Tais grupos florísticos são os mais representativos no bioma Pampa, que apresenta forte influência florística nesta região e pode explicar a alta riqueza de espécies exclusivas aos ambientes campestres (Garcia & Boldrini 1999Garcia EM, & Boldrini II (1999) Fitossociologia de um campo modificado da Depressão Central do Rio Grande do Sul, Brasil. Iheringia, série botânica 52: 23-34.; Schneider & Irgang 2005Schneider AA, & Irgang BE (2005) Florística e fitossociologia da vegetação viária da RS-142 no município de Não-Me-Toque, RS, Brasil. Iheringia, série botânica 60: 49-62.; Caporal & Boldrini 2007Caporal FJM, & Boldrini I (2007) Florística e fitossociologia de um campo manejado na Serra do Sudeste, Rio Grande do Sul. Revista Brasileira de Biociências 5: 37-44.; Overbeck et al. 2007Overbeck GE, Müller SC, Fidelis A, Pfadenhauer J, Pillar VP, Blanco CC, Boldrini II, Both R & Forneck ED (2007) Brazil’s neglected biome: the South Brazilian Campos. Perspectives in Plant Ecology, Evolution and Systematics 9: 101-116.). A região costeira como um todo compreende uma extensa planície coberta por campos naturais e manejados, que se desenvolvem em solos mais ou menos estruturados, solos psamófilos, muitas vezes entremeados por lagoas costeiras de água doce ou então salinizados pela água do mar, formando charcos de diferentes níveis de umidade que por vezes são intermitentes, formando uma matriz heterogênea para o desenvolvimento das comunidades campestres.
Nas formações campestre, certas espécies, apresentam algum tipo de especialização à ocupação de ambientes salinos, xerofíticos, ou então excessivamente úmidos, como glândulas de sal, suculência, rizomas longos e profundos, aerênquimas bastante desenvolvidos ou então estratégias de reprodução e mecanismos fisiológicos adaptados (Pfadenhauer 1978Pfadenhauer J (1978) Contribuição ao conhecimento da vegetação e de suas condições de crescimento nas dunas costeiras do Rio Grande do Sul, Brasil. Revista Brasileira de Biologia 38: 827-836.; Rozema et al. 1985Rozema J, Bijwaard P, Prast G & Broekman R (1985) Ecophysiological adaptations of coastal halophytes from foredunes and salt marshes. Vegetatio 62: 499-521.; Justin & Armstrong 1987Justin SHFW, & Armstrong W (1987) The anatomical characteristics of roots and plant response to soil flooding. New Phytologist 106: 465-495.; Blom et al. 1990Blom CWPM, Bögemann GM, Laan P, van der Sman AJM, van de Steeg HM & Voesenek LACJ (1990) Adaptations to flooding in plants from river areas. Aquatic Botany 38: 29-47.; Ernest 1990Ernest WHO (1990) Ecophysiology of plants in waterlogged and flooded environments. Aquatic Botany 38: 73-90.; Maun 1998Maun MA (1998) Adaptations of plants to burial in coastal sand dunes. Canadian Journal of Botany 76: 713-738.; Rotondi et al. 2003Rotondi A, Rossi F, Asunis C & Cesaraccio C (2003) Leaf xeromorphic adaptations of some plants of a coastal Mediterranean macchia ecosystem. Journal Mediterran Ecology 4: 25-35.; Marques et al. 2015Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18.). Na área de estudo, em campos psamófilos (Fig. 3a) foram encontradas diversas espécies (Fig. 7), como: Acmella decumbens (Sm.) R.K.Jansen (Fig. 7c), Acicarpha tribuloides Juss., Andropogon arenarius Hack., Blutaparon portulacoides (A.St.-Hil.) Mears, Chaetogastra gracilis (Bonpl.) DC., Croton helichrysum Baill. (Fig. 7k), Rhynchospora brittonii Gale, Indigofera sabulicola Benth., Panicum racemosum (P.Beauv.) Spreng. (Fig. 7d), Senecio crassiflorus (Poir.) DC. (Fig. 7a), S. platensis Arechav. (Fig. 7e). Já nos campos úmidos e baixadas entre dunas são comuns espécies como Acisanthera alsinaefolia (Mart. & Schrank ex DC.) Triana (Fig. 7o), Cyperus virens Michx. (Fig. 7l), Eriocaulon ligulatum (Vell.) L.B.Sm. (Fig. 7n), Rhynchospora holoschoenoides (Rich.) Herter (Fig. 7m), Syngonanthus chrysanthus (Bong.) Ruhland, Utricularia tricolor A.St.-Hil., dentre outras (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>). Ainda nas formações campestres do litoral médio do Rio Grande do Sul, são identificadas formações chamadas de “parques de butiás” (Mauhs & Marchioretto 2006Mauhs J, & Marchioretto MS (2006) Formações vegetais do litoral central. Pesquisas, antropologia 63: 115-122.), compostas por populações de Butia catarinensis Noblick & Lorenzi. Tais espécies tem grande importância ecológica por servir de forófitos para espécies de musgos, samambaias e angiospermas epifíticas, além de fornecer recursos alimentares para a fauna local.
a-o. Algumas espécies encontradas em ambientes campestres secos e úmidos da área de estudo – a. Senecio crassiflorus; b. Varronia curassavica; c. Acmella decumbnes; d. Panicum racemosum; e. Senecio platensis; f. Schinus weinmanniifolia; g. Opuntia monacantha; h. Dalechampia micromeria; i. Vernonanthura nudiflora; j. Solanum reineckii; k. Croton helichrysum; l. Cyperus virens; m. Rhynchospora holoschoenoides; n. Eriocaulon ligulatum; o. Acisanthera alsinaefolia.
Figure 7
a-o. Some species found in dry and wet grasses in study area – a. Senecio crassiflorus; b. Varronia curassavica; c. Acmella decumbnes; d. Panicum racemosum; e. Senecio platensis; f. Schinus weinmanniifolia; g. Opuntia monacantha; h. Dalechampia micromeria; i. Vernonanthura nudiflora; j. Solanum reineckii; k. Croton helichrysum; l. Cyperus virens; m. Rhynchospora holoschoenoides; n. Eriocaulon ligulatum; o. Acisanthera alsinaefolia.
As adaptações relacionadas ao ambiente aquático podem explicar a ocorrência simultânea de 70 espécies em formações campestres e lacunares ou associadas. Irgang & Gastal Jr. (1996)Irgang BE, & Gastal Júnior CVS (1996) Macrófitas aquáticas da planície costeira do Rio Grande do Sul. UFRGS, Porto Alegre. 290p. indicam a ocorrência de mais de 300 espécies de macrófitas aquáticas na região costeira do RS, sendo que as formas anfíbias são sempre as mais frequentes (Kafer et al. 2011Kafer DS, Colares IG & Hefler SM (2011) Composição florística e fitossociologia de macrófitas aquáticas em um banhado continental em Rio Grande, RS, Brasil. Rodriguésia 62: 835-846.; Ferreira et al. 2017Ferreira JPR, Hassemer G & Trevisan R (2017) Aquatic macrophyte flora of coastal lakes in Santa Catarina, southern Brazil. Iheringia, série botânica 72: 409-419.). O predomínio desta forma de vida pode ser explicado pelo caráter raso das lagoas costeiras do RS (Tomazelli & Villwock 1991), e também pela dinâmica dos pulsos de inundação que aumentam a heterogeneidade do ambiente formando nichos ecológicos para que espécies anfíbias se estabeleçam (Mauhs et al. 2006Mauhs J, & Marchioretto MS (2006) Formações vegetais do litoral central. Pesquisas, antropologia 63: 115-122.; Maltchik et al. 2007Maltchik L, Rolon AS & Schott P (2007) Effects of hydrological variation on the aquatic plant community in a floodplain palustrine wetland of southern Brazil. Limnology 8: 23-28.). Já as espécies restritas ao interior dos corpos hídricos (Fig. 8) somam 17, e incluem desde as espécies lacustres como as espécies de corpos d’água lóticos [aqui representado principalmente pelo Rio Palmares (Fig. 2b)], entre as mais comuns estão Nymphoides humboldtiana (Kunh) Kuntze (Fig. 8b), Potamogeton ferrugineum Hagstr. (Fig. 8c) e Pontederia cordata L. Dentre as espécies deve-se destacar as espécies de Eichhornia crassipes (Mart.) Solms (Fig. 8a) e E. azzurea (Sw.) Kunth, que formam extensas populações (camalotes) que, juntamente com Cyperus blepharoleptos Steud., servem de base para processo de sucessão na formação de ilhas flutuantes (baceiros) de estrutura sucessional bastante complexa (Pivari et al. 2008Pivari MO, Pott VP & Pott A (2008) Macrófitas aquáticas de ilhas flutuantes (baceiros) nas sub-regiões do Abobral e Miranda, Pantanal, MS, Brasil. Acta Botanica Brasilica 22: 563-571.). Também vale destacar, nestes ambientes, populações monoespecíficas de Mimosa bimucronata (DC.) Kuntze (Figs. 2c; 8o), a qual circunda lagoas e matas paludosas, e que pela presença de ramos densos aculeados (Carvalho 2004Carvalho PER (2004) Maricá: Mimosa bimucronata. Embrapa Colombo, circular técnica 94: 1-10.) protege alguns habitats do acesso do gado. Outras espécies como Fuirena robusta Kunth (Fig. 8e) e Cladium mariscus subsp. jamaicense (Crantz) Kük. (Fig. 8d) também costumam formar extensas populações e podem ser encontradas associadas espécies como Boehmeria cylindrica (L.) Sw. (Fig. 8g), Cantinoa mutabilis (Rich.) Harley & J.F.B.Pastore (Fig. 8l), Hibiscus diversifolius Jacq. (Fig. 8f) e Ludwigia multinervia (Hook. & Arn.) Ramamoorthy (Fig. 8h).
a-o. Algumas espécies encontradas em ambientes associados às lagoas costeiras, campos úmidos ou banhados em sucessão – a. Eichhornia crassipes; b. Nymphoides humboldtiana; c. Potamogeton ferrugineus; d. Cladium mariscus subsp. jamaicense; e. Fuirena robusta; f. Hibiscus diversifolius; g. Boehmeria cylindrica; h. Ludwigia multinervia; i. Pleroma trichopodum; j. Hippeastrum breviflorum; k. Ilex pseudobuxus; l. Cantinoa mutabilis; m. Persea venosa; n. Gaylussacia brasiliensis; o. Mimosa bimucronata.
Figure 8
a-o. Some species found associated to lagoons, wet grasses and wetlands in succession process – a. Eichhornia crassipes; b. Nymphoides humboldtiana; c. Potamogeton ferrugineus; d. Cladium mariscus subsp. jamaicense; e. Fuirena robusta; f. Hibiscus diversifolius; g. Boehmeria cylindrica; h. Ludwigia multinervia; i. Pleroma trichopodum; j. Hippeastrum breviflorum; k. Ilex pseudobuxus; l. Cantinoa mutabilis; m. Persea venosa; n. Gaylussacia brasiliensis; o. Mimosa bimucronata.
As demais espécies herbáceas e arbustivas (23) foram amostradas no sub-bosque do componente florestal, tanto em formações de matas de restinga seca como paludosas. Levantamentos florísticos desta sinúsia na região costeira reportam que podem ocorrer cerca de 12 (Citadini-Zanette & Baptista 1989; Mauhs & Barbosa 2004Mauhs J, & Barreta L (2004) Levantamento das espécies arbustivas em borda de floresta de restinga psamófila, Palmares do Sul, RS. Pesquisas, botânica 55: 129-136.), 46 (Müller & Waechter 2001Müller SC, & Waechter JL (2001) Estrutura sinusial dos componentes herbáceo e arbustivo de uma floresta costeira subtropical. Revista Brasileira de Botânica 24: 395-406.), 70 (Fuhro et al. 2005Fuhro D, Vargas D & Larocca J (2005) Levantamento florístico das espécies herbáceas, arbustivas e lianas da floresta de encosta da Ponta do Cego, Reserva Biológica do Lami (RBL), Porto Alegre, Rio Grande do Sul, Brasil. Pesquisas, botânica 56: 239-256.) ou 48 (Záchia & Waechter 2011Záchia RA, & Waechter JL (2011) Diferenciação espacial de comunidades herbáceo-arbustivas em florestas costeiras do Parque Nacional da Lagoa do Peixe, Rio Grande do Sul. Pesquisas, botânica 62: 211-238.) espécies de angiospermas. No grupo das samambaias e licófitas, ca. de 70% das espécies ocorrentes na região costeira ocorrem no sub-bosque do componente florestal (159 ssp.) (Gonzatti et al. 2016Gonzatti F, Machado L & Windisch P (2016) Distribution patterns of ferns and lycophytes in the Coastal Region of the state of Rio Grande do Sul, Brazil. Acta Botanica Brasilica 30: 239-253.). Marques et al. (2015)Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18. sugerem que 12% da flora da planície costeira do sudeste e sul do Brasil é composta por espécies herbáceas. Segundo Záchia & Waechter (2011), dentro dos fragmentos florestais da planície costeira ocorrem grandes variações na distribuição das comunidades herbáceas e arbustivas que decorrem da estrutura edáfica e topográfica o que faz com que a composição florística destes ambientes varie consideravelmente em poucos metros de distância. Na área de estudo estas variações foram observadas. Nos componentes florestais paludosos ou turfosos, devido ao excessivo sombreamento e a periódica inundação, são frequentes elementos florísticos de caráter tropical, como Geonoma schottiana Mart. (Fig. 9a), Psychotria carthagenensis Jacq. (Fig. 9c), Philodendron bipinnatifidum Schott e Apteria aphylla (Nutt.) Barnhart ex Small. No entanto, nas matas arenosas de caráter mais seco o sub-bosque é formado basicamente por Chaptalia nutans (L.) Pol., Pavonia sepium A.St.-Hil., Triunphetta semitriloba Jacq. e Stachytarpheta cayennensis (Rich.) Vahl.
a-o. Algumas espécies encontradas no componente florestal da área de estudo – a. Geonoma schottiana; b. Laplacea fruticosa; c. Psychotria carthagenensis; d. Psidium cattleyanum; e. Sideroxylon obtusifolium; f. Myrsine guianensis; g. Gymnanthes serrata; h. Guapira opposita; i. Myrrhinium atropurpureum; j. Cereus hildmannianus; k. Annona maritima; l. Handroanthus pulcherrimus; m. Cattleya intermedia; n. Cattleya tigrina; o. Aechmea recurvata.
Figure 9
a-o. Some species found on forest component in study area – a. Geonoma schottiana; b. Laplacea fruticosa; c. Psychotria carthagenensis; d. Psidium cattleyanum; e. Sideroxylon obtusifolium; f. Myrsine guianensis; g. Gymnanthes serrata; h. Guapira opposita; i. Myrrhinium atropurpureum; j. Cereus hildmannianus; k. Annona maritima; l. Handroanthus pulcherrimus; m. Cattleya intermedia; n. Cattleya tigrina; o. Aechmea recurvata.
Segundo Marques et al. (2015)Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18., a planície costeira do sul e sudeste do Brasil apresenta mais de 740 (47%) espécies de árvores. Em nossas amostragens este percentual correspondeu a 20%, com 74 espécies (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>).
Dados similares foram encontrados por Silva Filho et al. (2013)Silva Filho PJS, Silva CC, Franco PF, Cavalli J, Bertholdo LM, Schmitt LA, Ilha R & Mondin CA (2013) Levantamento florístico de um fragmento de Floresta Ombrófila Densa no litoral norte do Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 11: 163-183. em um fragmento de floresta ombrófila densa no litoral norte do RS (Dom Pedro de Alcântara), outros levantamentos, principalmente de cunho fitossociológico reportam entre 15 (Moraes & Mondin 2001Moraes D, & Mondin CA (2001) Florística e fitossociologia do estrato arbóreo e mata arenosa no balneário do Quintão, Palmares do Sul, Rio Grande do Sul. Pesquisas, botânica 51: 87-100.) e 46 (Mauhs & Barreta 2004Mauhs J, & Barreta L (2004) Levantamento das espécies arbustivas em borda de floresta de restinga psamófila, Palmares do Sul, RS. Pesquisas, botânica 55: 129-136.) na região de Palmares do Sul e 148 (Venzke 2012Venzke TS (2012) Florística de comunidades arbóreas no Município de Pelotas, Rio Grande do Sul. Rodriguésia 63: 571-578.) na sinúsia arbórea de Pelotas. Na área de estudo as espécies arbóreas foram amostradas em três fitofisionomias distintas, sendo as matas secas arenosas (Fig. 3b,d,f), que se desenvolvem sobre os cordões arenosos deposicionais, por vezes entremeadas às formações campestres formando moitas insulares (Fig. 3c,e). Nas moitas, prevalecem espécies arbustivas como Eugenia uniflora L., Schinus weinmanniifolia Mart. ex Engl. (Fig. 7f), Opuntia monacantha Haw. (Fig. 7g), Varronia curassavica Jacq. (Fig. 7b) e Vernonanthura nudiflora (Less.) H.Rob. (Fig. 7i). Já no componente arbóreo (Fig. 9) encontra-se principalmente espécies como Annona maritima (Záchia) H.Rainer (Fig. 9k), Cereus hildmannianus K.Schum. (Fig. 9j), Guapira opposita (Vell.) Reitz (Fig. 9h), Gymnanthes serrata Baill. ex Müll.Arg. (Fig. 9g), Eugenia uruguaiensis Cambess., Handroanthus pulcherrimus (Sandwith) Mattos (Fig. 9l), Myrcia multiflora (Lam.) DC., Myrrhinium atropurpureum Schott (Fig. 9i), Myrsine guianensis (Aubl.) Kuntze (Fig. 9f), Sideroxylon obtusifolium (Roem. & Schult.) T.D.Penn. (Fig. 9e), e demais espécies das famílias Myrtaceae, Salicaceae, Sapindaceae. Outra formação florestal encontrada foi a mata turfosa ou paludosa (Fig. 2f), que se desenvolve em áreas de baixadas, geralmente constituindo os estágios mais avançados de sucessão de turfeiras e áreas deposicionais. Nestes ambientes foram comuns espécies como Aiouea saligna Meisn., Ficus cestrifolia Schott ex Spreng., Guarea macrophylla Vahl, Laplacea fruticosa (Schrad.) Kobuski (Fig. 9b), Ocotea pulchella (Nees & Mart.) Mez, Syagrus romanzoffiana (Cham.) Glassman, Trichilia elegans A.Juss. entre outras.
Outras espécies florestais foram amostradas nas formações de banhados em sucessão, que se caracterizam pelos estágios iniciais de estruturação das matas turfosas (Fig. 2e). Esta formação apresenta características próprias no seu conjunto de espécies, pois constitui uma mescla entre elementos arbustivos-arbóreos de porte pequeno (1-4 m) e formações herbáceas higrófitas como ciperáceas, gramíneas, gravatás, lírios [Hippeastrum breviflorum Herb. (Fig. 8j)] e extensas populações de musgos formadores de turfeiras (Sphagnum spp.). Nestas formações são comuns as espécies Gaylussacia brasiliensis (Spreng.) Meisn. (Fig. 8n), Esenbeckia grandiflora Mart., Ilex pseudobuxus Reissek (Fig. 8k), Myrsine parvifolia A.DC., Pleroma trichopodum DC. (Fig. 8i), Persea venosa Nees & Mart. (Fig. 8m), Psidium cattleianum Sabine (Fig. 9d), Vernonanthura puberula (Less.) H.Rob. entre outras. Embora as comunidades arbóreas apresentem fitofisionomias bastante distintas dentro do gradiente orográfico e latitudinais (Waechter 1985Waechter JL (1985) Aspectos ecológicos da vegetação de restinga no Rio Grande do Sul, Brasil. Comunicação do Museu de Ciências, PUCRS, série botânica 33: 49-68.; Scherer 2009Scherer A (2009) Estrutura e aspectos fitogeográficos de remanescentes florestais na restinga sulbrasileira. Tese de Doutorado. UFRGS, Porto Alegre. 130p.; Záchia & Waechter 2011Záchia RA, & Waechter JL (2011) Diferenciação espacial de comunidades herbáceo-arbustivas em florestas costeiras do Parque Nacional da Lagoa do Peixe, Rio Grande do Sul. Pesquisas, botânica 62: 211-238.), cerca de 50% das espécies do componente arbóreo das florestas litorâneas são compartilhadas entre elas (Marques et al. 2015Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18.).
Nestes ambientes florestais foram registradas todas as espécies epifíticas encontradas na área de estudo (22). Nossos dados foram inferiores aos registrados por outros autores como Silva Filho et al. (2013)Silva Filho PJS, Silva CC, Franco PF, Cavalli J, Bertholdo LM, Schmitt LA, Ilha R & Mondin CA (2013) Levantamento florístico de um fragmento de Floresta Ombrófila Densa no litoral norte do Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 11: 163-183. que registraram 31 espécies de angiospermas epifíticas em Dom Pedro de Alcântara, mesmo número por Staudt et al. (2013)Staudt MR, Lippert APU, Cunha S, Becker DFP, Marchioretto MS & Schmitt JL (2013) Composição florística de epífitos vasculares do Parque Natural Municipal Tupancy, Arroio do Sal, RS, Brasil. Pesquisas, botânica 63: 177-188. em um fragmento de mata arenosa em Arroio do Sal. Giongo & Waechter (2004)Giongo C, & Waechter JL (2004) Composição florística e estrutura comunitária de epífitos vasculares em uma floresta de galeria na Depressão Central do Rio Grande do Sul. Revista Brasileira de Botânica 27: 563-572. encontraram 40 espécies nesta sinúsia em um fragmento no município de Eldorado do Sul, e 104 nas matas paludosas do Faxinal, Torres, RS (Waechter 1986). Autores sugerem que ao longo do bioma Mata Atlântica ocorram cerca de 1.590 espécies de angiospermas epifíticas (Freitas et al. 2016Freitas L, Salino A, Menini Neto L, Almeida TE, Mortara S, Stehmann J, Amorin AM, Guimarães E, Coelho MAN, Zanin A & Forzza RC (2016) A comprehensive checklist of vascular epiphytes of the Atlantic Forest reveals outstanding endemic rates. Phytokeys 58: 65-79.) e que em torno de 310 ocorram nas florestas da planície costeira do sul e sudeste do Brasil (Marques et al. 2015Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18.) Considerando este grupo ecológico como um todo, estas projeções parecem estar subestimadas, pois somente de Orchidaceae na planície costeira do RS, Waechter (1998) aponta que hajam 130 espécies. Machado et al. (2016)Machado L, Gonzatti F & Windisch PG (2016) Epiphytic ferns in swamp forest remnants of the coastal plain of southern Brazil: latitudinal effects on the plant community. Acta Botanica Brasilica 30: 644-657. encontraram 44 espécies de samambaias epifíticas em florestas paludosas ao longo da região costeira do RS. Na área de estudo as famílias que apresentaram as maiores riquezas de espécies epifíticas foram Bromeliaceae, Orchidaceae e Piperaceae (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>), padrão identificado em outros levantamentos de fanerógamas epifíticas na região costeira do RS (Waechter 1986, 1998; Staudt et al. 2013). Dentre as espécies mais importantes encontradas destacamos Aechmea recurvata (Fig. 9o), Tillandsia gardneri Lindl., Vriesea friburgensis Mez, Lepismium cruciforme (Vell.) Miq., Tillandsia usneoides (L.) L., Cattleya intermedia Grah. (Fig. 9m), C. tigrina A.Rich. (Fig. 9n), Trichocentrum pumilum (Lindl.) M.W.Chase & N.H.Williams, Brassavola tuberculata Hook., dentre outras (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>).
As plantas de hábito trepador (23) foram amostradas nos mais diferentes ambientes. Com exceção de Mikania periplocifolia Hook. & Arn. e Vigna luteola (Jacq.) Benth. que foram encontradas em formações de campos úmidos e áreas perilacunares, as demais foram registradas nas formações campestres secas e nas formações florestais. Muitas espécies como Centrosema virginianum (L.) Benth., Dalechampia micromeria Baill. (Fig. 7h), Merremia dissecta (Jacq.) Hallier f., Ipomoea cairica (L.) Sweet e Solanum reineckii Briq. (Fig. 7j) ocorrem em dunas, campos em sucessão ou em moitas de vegetação lenhosa na matriz campestre. Demais como Anchietea pyrifolia (Mart.) G.Don, Cissus verticilata (L.) Nicolson & C.E.Jarvis, Dolichandra unguis-cati (L.) L.G.Lohmann, Mutisia speciosa Aiton ex Hook. e Passiflora suberosa L., entre outras (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>), são mais comuns em bordos de matas de restinga seca ou paludosa. Segundo Durigon et al. (2014)Durigon J, Ferreira PPA, Seger GDS & Miotto STS (2014) Trepadeiras na Região Sul do Brasil. In: Villagra BLP, Melo MMRF, Melo SR & Barbosa LM (eds.) Diversidade e conservação de trepadeiras: contribuição para a restauração de ecossistemas brasileiros. Instituto de Botânica, São Paulo. 224p. no sul do Brasil ocorrem cerca de 809 espécies fanerógamas trepadoras, das quais 428 ocorrem no RS. Autores como Marques et al. (2015)Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18., salientam que esta forma de vida corresponde a 4% da flora ocorrente nas planícies costeiras do sul e sudeste do Brasil. Na planície costeira do RS, foram registradas cerca de 44 espécies trepadoras no Horto Botânico Irmão Theodoro Luiz, Pelotas, RS (Guerra et al. 2015Guerra E, Streher NS & Lüdtke R (2015) Plantas trepadeiras do Horto Botânico Irmão Teodoro Luis, sul do Rio Grande do Sul, Brasil. Revista brasileira de biociências 13: 201-209.), 46 ssp. em um fragmento florestal do litoral norte, Dom Pedro de Alcântara, RS (Silva Filho et al. 2015), e 82 ssp. na Fazenda São Maximiano, município de Guaíba, RS (Durigon & Waechter 2011).
No que tange a presença de espécies ameaçadas de extinção, foram evidenciadas na área de estudo 18 espécies listadas na Lista Vermelha da Flora Ameaçada de Extinção do RS (Rio Grande do Sul 2014) (Tab. S1, disponível em <https://figshare.com/s/81433fc5a975f76ac210>). Destas, uma encontra-se como “Criticamente Ameaçada”, nove como “Em Perigo” e seis como “Vulnerável” e duas como “Quase Ameaçadas”. As demais espécies apresentaram-se como pouco preocupantes ou não foram avaliadas no processo de construção da lista. Eugenia hamiltonii (Mattos) Mattos é considerada como CR devido a aplicação dos critérios A4 da IUCN, os quais estão relacionados a diminuição de populações observáveis da espécie. Na área de estudo, esta foi amostrada em uma única população, em matas arenosas do município de Cidreira. As demais classificadas como EN e VU, deve-se principalmente pela peculiaridade de habitat onde ocorrem, padrão de distribuição restrito, ou por pressão antrópica exacerbada. Geonoma schottiana, por exemplo ocorre restritamente no sub-bosque das matas paludosas, enquanto Annona maritima é endêmica das florestas de restinga da costa atlântica do sul do Brasil e Uruguai (Sobral et al. 2006Sobral M, Jarenkow JA, Brack P, Larocca J & Rodrigues RS (2006) Flora arbórea e arborescente do Rio Grande do Sul, Brasil. RiMa, São Carlos. 350p.) e Cattleya intermedia e C. tigrina apresenta grande extrativismo para comercialização ornamental.
Dentre a natureza das espécies, 365 (95%) foram identificadas como espécies nativas, ao passo que 18 (5%) como espécies exóticas. Dentre as exóticas estão espécies cultivadas como frutíferas (Psidium guajava L.), plantas ornamentais (Casuarina equisetifolia L.), madeireiras (Pinus elliotii Engelm. e Eucalyptus sp.) ou então introduzidas como espécies fixadoras de dunas como Acacia longifolia (Andrews) Willd., e que hoje são encontradas como subespontâneas em áreas de entornos de lavouras, ou ambientes alterados. Outras espécies exóticas, no entanto, como Lantana camara L., Lysimachia arvensis (L.) U. Manns & Anderb., Cardionema ramosissima (Weinm.) A.Nelson & J.F.Macbr. e Asparagus setaceus (Kunth) Jessop já são tidas como espécies exóticas invasoras (Moro et al. 2012Moro MF, Souza VC, Oliveira-Filho AT, Queiroz LP, Fraga CN, Rodal MJN, Araujo FS & Martins FR (2012) Alienígenas na sala: o que fazer com espécies exóticas em trabalhos de taxonomia, florística e fitossociologia? Acta botanica brasílica 26: 991-999.), devido ao potencial biótico de ocupação e permanência de populações reprodutivas mesmo em ambientes naturais. Na área de estudo, foram evidenciadas amplas invasões de Asparagus setaceus nas matas arenosas, formando densas e extensas populações no sub-bosque e borda das matas. Embora, com menos intensidade, Pinus elliotii tem se tornado invasor na área de estudo, em áreas de campos psamófilos e campos úmidos.
Segundo Rosa & Cordazzo (2007)Rosa LS da, & Cordazzo CV (2007) Perturbações antrópicas na vegetação das dunas da Praia do Cassino (RS). Cadernos de Ecologia Aquática 2: 1-12. no extremo sul do litoral do RS, impactos antrópicos incidentes sobre os ecossistemas costeiros incluem o extrativismo de areia para a construção civil, a herbivoria, recreação, deposição de poluentes e lixo, deposição de lama, introdução de espécies exóticas de forma acidental e intencional e a presença de espécies invasoras. Com a exceção de depósitos de lama, os demais impactos foram evidenciados na área de estudo. Além disto, os extensos plantios silvícolas de pinus, eucalipto e arroz descaracterizam a paisagem e alteram a composição florística local. De acordo com Cordeiro & Hasenack (2009)Cordeiro JLP, & Hasenack H (2009) Cobertura vegetal atual do Rio Grande do Sul.In: Pillar VP, Müller SC, Castilhos ZMS & Jacques AVA (eds.) Campos Sulinos: conservação e uso sustentável. Ministério do Meio Ambiente, Brasília. Pp. 285-299., somente 15% da cobertura vegetal original ainda remanescem, e os cultivos de arroz têm conferido risco sobre a integridade do sistema hídrico dos ecossistemas costeiros, que representam cerca de 40,7 % do território da região.
As mudanças no uso e ocupação do solo geram impactos diversos nos diferentes ambientes naturais das regiões costeiras brasileiras comprometendo sua qualidade ambiental. O Litoral Médio e Norte do Rio Grande do Sul apresentou, nas últimas décadas, alterações relevantes desencadeadas pelo processo de urbanização, cultivos agrícolas e silvícolas e pelo turismo sazonal o que levou, consequentemente, a uma expressiva fragmentação dos ambientes naturais. Neste sentido, nossos dados sobre a composição e distribuição da flora atual além de contribuir para o conhecimento e a valorização dos recursos naturais, subsidia o planejamento para a sustentabilidade ambiental da Planície Costeira Sul Brasileira, incluindo a preservação da biodiversidade litorânea.
Agradecimentos
Os autores agradecem ao Programa Petrobrás Ambiental, o financiamento; à Universidade de Caxias do Sul, a disponibilidade de uso da infraestrutura; aos colegas do Projeto Lagoas Costeiras, o auxílio nos trabalhos de campo; e à equipe do Herbário HUCS, o auxílio no processamento e curadoria das amostras. Também são gratos aos revisores que prestaram criteriosas contribuições à redação e conteúdo do manuscrito.
Referências
- Ab’Saber AN (2001) Litoral do Brasil. Metalivros, São Paulo. 286p.
- Amaral DD, Prost MT, Bastos MNC, Neto SVC & Santos JUM (2008) Restingas do litoral amazônico, estados do Pará e Amapá, Brasil. Boletim do Museu Paraense Emílio Goeldi 3: 35-67.
- Barbier EB, Hacker SD, Kennedy C, Koch EW, Stier AC & Silliman BR (2011) The value of estuarine and coastal ecosystem services. Ecological Monographs 81: 169-193.
- Blom CWPM, Bögemann GM, Laan P, van der Sman AJM, van de Steeg HM & Voesenek LACJ (1990) Adaptations to flooding in plants from river areas. Aquatic Botany 38: 29-47.
- Boldrini II, Trevisan R & Schneider AA (2008) Estudo florístico e fitossociológico de uma área às margens da lagoa do Armazém, Osório, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 6: 355-367.
- Buchmann FSC, Caron F, Lopes RP, Ugri A & Lima LGL (2009) Panorama geológico da Planície Costeira do Rio Grande do Sul. In: Ribeiro AM, Bauermann SG & Scherer CS (eds.) Quaternário do Rio Grande do Sul: integrando conhecimentos. Sociedade Brasileira de Paleontologia, Porto Alegre. Pp. 35-56.
- Caetano VL (2003) Dinâmica sazonal e fitossociologia da vegetação herbácea de uma baixada úmida entre dunas, Palmares do Sul, Rio Grande do Sul, Brasil. Iheringia, série botânica 8: 81-102.
- Caporal FJM, & Boldrini I (2007) Florística e fitossociologia de um campo manejado na Serra do Sudeste, Rio Grande do Sul. Revista Brasileira de Biociências 5: 37-44.
- Carvalho PER (2004) Maricá: Mimosa bimucronata Embrapa Colombo, circular técnica 94: 1-10.
- Cielo-Filho R, Baitello JB, Pastore JA, Aguiar OT, Souza SCPM, Toniato MTZ, Lima CR & Ribeiro AP (2009) Ampliando a densidade de coletas botânicas na região da bacia hidrográfica do Alto Paranapanema: caracterização florística da Floresta Estadual e da Estação Ecológica de Paranapanema. Biota Neotropica 9: 255-276.
- Citadini-Zanette V, & Baptista LRM (1989) Vegetação herbácea terrícola de uma comunidade florestal em Limoeiro, município de Torres, Rio Grande do Sul. Boletim do Instituto de Biociências 45: 1-87.
- Cordeiro JLP, & Hasenack H (2009) Cobertura vegetal atual do Rio Grande do Sul.In: Pillar VP, Müller SC, Castilhos ZMS & Jacques AVA (eds.) Campos Sulinos: conservação e uso sustentável. Ministério do Meio Ambiente, Brasília. Pp. 285-299.
- Duarte MM, & Bencke GA (2006) Plano de Manejo do Parque Estadual de Itapeva, relatório final. Fundação Zoobotânica do Rio Grande do Sul, Porto Alegre. 274p.
- Duarte CM, Losada IJ, Hendriks IE, Mazarrasa I & Marbà N (2013) The role of coastal plant communities for climate change mitigation and adaptation. Nature Climate Change 3: 961-969.
- Durigon J, & Waechter JL (2011) Floristic composition and biogeographic relations of a subtropical assemblage of climbing plants. Biodiversity and Conservation 20: 1027-1044.
- Durigon J, Ferreira PPA, Seger GDS & Miotto STS (2014) Trepadeiras na Região Sul do Brasil. In: Villagra BLP, Melo MMRF, Melo SR & Barbosa LM (eds.) Diversidade e conservação de trepadeiras: contribuição para a restauração de ecossistemas brasileiros. Instituto de Botânica, São Paulo. 224p.
- EMBRAPA (2006) Sistema Brasileiro de Classificação de Solos. Empresa Brasileira de Pesquisa Agropecuária. 2a ed. Embrapa, Rio de Janeiro. 306p.
- Ernest WHO (1990) Ecophysiology of plants in waterlogged and flooded environments. Aquatic Botany 38: 73-90.
- Falkenberg DB (1999) Aspectos da flora e da vegetação secundária da restinga de Santa Catarina, Sul do Brasil. Insula 28: 1-30.
- Ferreira PMA, & Setubal RB (2009) Florística e fitossociologia de um campo natural no município de Santo Antônio da Patrulha, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 7: 195-204.
- Ferreira JPR, Hassemer G & Trevisan R (2017) Aquatic macrophyte flora of coastal lakes in Santa Catarina, southern Brazil. Iheringia, série botânica 72: 409-419.
- Fiaschi P, & Pirani JR (2009) Review of plant biogeographic studies in Brazil. Journal of Systematics and Evolution 47: 1-20.
- Filgueiras TS, Nogueira PE, Brochado AL & Guala GF (1994) Caminhamento: um método expedito para levantamentos florísticos qualitativos. Cadernos de Geociências 12: 39-43.
- Forzza RC, Baumgratz JFA, Bicudo CEM, Canhos DAL, Carvalho Jr AA, Coelho MAN, Costa AFC, Costa DP, Hopkins MG, Leitman PM, Lohmann LG, Lughadha EN, Maia LC, Martinelli G, Menezes M, Morim MP, Peixoto AL, Pirani JR, Prado J, Queiroz LP, Souza S, Souza VC, Stehmann JR, Sylvestre LS, Walter BMT & Zappi DC (2012) New Brazilian floristic list highlights conservation challenges. Bioscience 62: 39-45.
- Fuhro D, Vargas D & Larocca J (2005) Levantamento florístico das espécies herbáceas, arbustivas e lianas da floresta de encosta da Ponta do Cego, Reserva Biológica do Lami (RBL), Porto Alegre, Rio Grande do Sul, Brasil. Pesquisas, botânica 56: 239-256.
- Flora do Brasil 2020 em construção. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. Disponível em <http://floradobrasil.jbrj.gov.br/>. Acesso em 30 setembro 2018.
» http://floradobrasil.jbrj.gov.br/ - Freitas L, Salino A, Menini Neto L, Almeida TE, Mortara S, Stehmann J, Amorin AM, Guimarães E, Coelho MAN, Zanin A & Forzza RC (2016) A comprehensive checklist of vascular epiphytes of the Atlantic Forest reveals outstanding endemic rates. Phytokeys 58: 65-79.
- Garcia EM, & Boldrini II (1999) Fitossociologia de um campo modificado da Depressão Central do Rio Grande do Sul, Brasil. Iheringia, série botânica 52: 23-34.
- Gedan KB, Kirwan ML, Wolanski E, Barbier EB & Silliman BR (2011) The present and future role of coastal wetland vegetation in protecting shorelines: answering recent challenges to the paradigm. Climatic Change 106: 7-29.
- Giongo C, & Waechter JL (2004) Composição florística e estrutura comunitária de epífitos vasculares em uma floresta de galeria na Depressão Central do Rio Grande do Sul. Revista Brasileira de Botânica 27: 563-572.
- Giulietti AM, Raymond MH, Queiroz LP, Wanderley MGL & van den Berg C (2005) Biodiversity and conservation of plants in Brazil. Conservation Biology 19: 632-639.
- Gonzatti F, Machado L & Windisch P (2016) Distribution patterns of ferns and lycophytes in the Coastal Region of the state of Rio Grande do Sul, Brazil. Acta Botanica Brasilica 30: 239-253.
- Guerra E, Streher NS & Lüdtke R (2015) Plantas trepadeiras do Horto Botânico Irmão Teodoro Luis, sul do Rio Grande do Sul, Brasil. Revista brasileira de biociências 13: 201-209.
- Irgang BE, & Gastal Júnior CVS (1996) Macrófitas aquáticas da planície costeira do Rio Grande do Sul. UFRGS, Porto Alegre. 290p.
- Justin SHFW, & Armstrong W (1987) The anatomical characteristics of roots and plant response to soil flooding. New Phytologist 106: 465-495.
- Kafer DS, Colares IG & Hefler SM (2011) Composição florística e fitossociologia de macrófitas aquáticas em um banhado continental em Rio Grande, RS, Brasil. Rodriguésia 62: 835-846.
- Klein RM (1984) Aspectos dinâmicos da vegetação do Sul do Brasil. Sellowia 36: 5-54.
- Leite P, & Klein RM (1990) Vegetação. In: IBGE - Instituto Nacional de Geografia e Estatística. Geografia do Brasil: Região Sul. Vol. 2. IBGE, Rio de Janeiro. Pp. 113-150.
- Ledru MP, Labouriau MLS & Lorscheitter ML (1998) Vegetation dynamics in Southern and Central Brazil during the last 10,000 yr b.p. Review of Palaeobotany and Palynology 99: 131-142.
- Liquete C, Piroddi C, Drakou EG, Gurney L, Katsanevakis S, Charef A & Egoh B (2013) Current status and future prospects for the assessment of marine and coastal ecosystem services: a systematic review. Plos ONE 8: 1-15.
- Lorscheitter ML (2003) Contribution to the Holocene history of Atlantic Rain Forest in the Rio Grande do Sul state, southern Brazil. Revista del Museo Argentino de Ciencias Naturales 5: 261-271.
- Machado L, Gonzatti F & Windisch PG (2016) Epiphytic ferns in swamp forest remnants of the coastal plain of southern Brazil: latitudinal effects on the plant community. Acta Botanica Brasilica 30: 644-657.
- Maltchik L, Rolon AS & Schott P (2007) Effects of hydrological variation on the aquatic plant community in a floodplain palustrine wetland of southern Brazil. Limnology 8: 23-28.
- Marcuzzo S, Pagel SM & Chiappetti MIS (1998) A Reserva da Biosfera da Mata Atlântica no Rio Grande do Sul: situação atual, ações e perspectivas. Caderno 11. Consórcio da Mata Atlântica e Conselho Nacional da Reserva da Biosfera da Mata Atlântica, São Paulo. 60p.
- Marques MCM, Swaine MD & Liebsch D (2011) Diversity distribution and floristic differentiation of the coastal lowland vegetation: implications for the conservation of the Brazilian Atlantic Forest. Biodiversity and Conservation 20: 153-168.
- Marques MCM, Silva SM & Liebsch D (2015) Coastal plain forests in southern and southeastern Brazil: ecological drivers, floristic patterns and conservation status. Revista Brasileira de Botânica 38: 1-18.
- Martínez LM, Intralawana A, Vázquez G, Pérez-Maqueo O, Suttond P & Landgrave R (2007) The coasts of our world: ecological, economic and social importance. Ecological Economics 63: 254-272.
- Mauhs J, & Barbosa JF (2004) Levantamento do componente herbáceo em floresta de restinga psamófila, Palmares do Sul, RS. Pesquisas, botânica 55: 137-141.
- Mauhs J, & Barreta L (2004) Levantamento das espécies arbustivas em borda de floresta de restinga psamófila, Palmares do Sul, RS. Pesquisas, botânica 55: 129-136.
- Mauhs J, Marchioretto MS & Budke JC (2006) Riqueza e biomassa de macrófitas aquáticas em uma área úmida na planície costeira do Rio Grande do Sul, Brasil. Pesquisas, botânica 57: 289-301.
- Mauhs J, & Marchioretto MS (2006) Formações vegetais do litoral central. Pesquisas, antropologia 63: 115-122.
- Maun MA (1998) Adaptations of plants to burial in coastal sand dunes. Canadian Journal of Botany 76: 713-738.
- Melo JRJCF, & Boeger MRT (2015) Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.
- Menezes LS, Leite SLC & Ritter MR (2013) Flora e vegetação de um fragmento de restinga em Imbé, Rio Grande do Sul, Brasil. Pesquisas, botânica 64: 141-155.
- MMA - Ministério do Meio Ambiente (2000) Avaliação e ações prioritárias para a conservação da biodiversidade da Mata Atlântica e Campos Sulinos. MMA/SBF, Brasília. 40p.
- Moraes D, & Mondin CA (2001) Florística e fitossociologia do estrato arbóreo e mata arenosa no balneário do Quintão, Palmares do Sul, Rio Grande do Sul. Pesquisas, botânica 51: 87-100.
- Müller SC, & Waechter JL (2001) Estrutura sinusial dos componentes herbáceo e arbustivo de uma floresta costeira subtropical. Revista Brasileira de Botânica 24: 395-406.
- Moreno JA (1961) Clima do Rio Grande do Sul. Secretaria da Agricultura, Porto Alegre. 42p.
- Moro MF, Souza VC, Oliveira-Filho AT, Queiroz LP, Fraga CN, Rodal MJN, Araujo FS & Martins FR (2012) Alienígenas na sala: o que fazer com espécies exóticas em trabalhos de taxonomia, florística e fitossociologia? Acta botanica brasílica 26: 991-999.
- Moser JM (1990) Solos. In: IBGE - Instituto Brasileiro de Geografia e Estatística. Geografia do Brasil, Região Sul. IBGE, Rio de Janeiro. Pp.81-112.
- Nimer E (1990) Clima. Geografia do Brasil, Região Sul. Vol. 2. IBGE, Rio de Janeiro. Pp. 151-187.
- Overbeck GE, Müller SC, Fidelis A, Pfadenhauer J, Pillar VP, Blanco CC, Boldrini II, Both R & Forneck ED (2007) Brazil’s neglected biome: the South Brazilian Campos. Perspectives in Plant Ecology, Evolution and Systematics 9: 101-116.
- Pfadenhauer J (1978) Contribuição ao conhecimento da vegetação e de suas condições de crescimento nas dunas costeiras do Rio Grande do Sul, Brasil. Revista Brasileira de Biologia 38: 827-836.
- Pivari MO, Pott VP & Pott A (2008) Macrófitas aquáticas de ilhas flutuantes (baceiros) nas sub-regiões do Abobral e Miranda, Pantanal, MS, Brasil. Acta Botanica Brasilica 22: 563-571.
- Prance GT (1977) Floristic inventory of the tropics: where do we stand?. Annals of the Missouri Botanical Garden 64: 659-684.
- Rambo B (1951) imigração da selva higrófila no Rio Grande do Sul. Anais do Herbário Barbosa Rodrigues 3: 55-91.
- Rambo B (1954) História da flora do litoral Riograndense. Sellowia 6: 113-172.
- Rio Grande do Sul (2014) Decreto 52.109 de 19 de dezembro de 2014. Declara as espécies da flora nativa ameaçadas de extinção. Diário Oficial da União, Porto Alegre. Pp. 2-11.
- Rizzini CT (1992) Tratado de Fitogeografia do Brasil. Âmbito Cultural, Rio de Janeiro. 747p.
- Rosa LS da, & Cordazzo CV (2007) Perturbações antrópicas na vegetação das dunas da Praia do Cassino (RS). Cadernos de Ecologia Aquática 2: 1-12.
- Rotondi A, Rossi F, Asunis C & Cesaraccio C (2003) Leaf xeromorphic adaptations of some plants of a coastal Mediterranean macchia ecosystem. Journal Mediterran Ecology 4: 25-35.
- Rozema J, Bijwaard P, Prast G & Broekman R (1985) Ecophysiological adaptations of coastal halophytes from foredunes and salt marshes. Vegetatio 62: 499-521.
- Schneider AA, & Irgang BE (2005) Florística e fitossociologia da vegetação viária da RS-142 no município de Não-Me-Toque, RS, Brasil. Iheringia, série botânica 60: 49-62.
- Scherer A (2009) Estrutura e aspectos fitogeográficos de remanescentes florestais na restinga sulbrasileira. Tese de Doutorado. UFRGS, Porto Alegre. 130p.
- Seeliger U (1998) A flora das dunas costeiras. In: Seeliger U, Odebrecht C & Castello JP (orgs.) Os ecossistemas costeiro e marinho do extremo sul do Brasil. Ecoscientia, Rio Grande. Pp. 109-113.
- Sevegnani L, Uhlmann A, Gasper AL, Vibrans AC, Santos AS, Verdi M, Dreveck S, Korte A & Meyer L (2013) Estádios sucessionais na Floresta Ombrófila Densa em Santa Catarina. In: Vibrans AC, Sevegnani L, Gasper AL & Lingner DV (eds.) Inventário florístico florestal de Santa Catarina: Floresta Ombrófila Densa. Edifurb, Blumenau. Pp. 311-322.
- Shepherd G (2003) Conhecimento de diversidade de plantas terrestres do Brasil. Ministério do Meio Ambiente, Brasília. 60p.
- Silva SM (1999) Diagnósticos das restingas do Brasil. In: Workshop de avaliação e ações prioritárias para conservação da biodiversidade da zona costeira e marinha (Anais eletrônicos). Fundação Bio-Rio, Porto Seguro. 30p.
- Silva Filho PJS, Silva CC, Franco PF, Cavalli J, Bertholdo LM, Schmitt LA, Ilha R & Mondin CA (2013) Levantamento florístico de um fragmento de Floresta Ombrófila Densa no litoral norte do Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 11: 163-183.
- Sobral M, Jarenkow JA, Brack P, Larocca J & Rodrigues RS (2006) Flora arbórea e arborescente do Rio Grande do Sul, Brasil. RiMa, São Carlos. 350p.
- Staudt MR, Lippert APU, Cunha S, Becker DFP, Marchioretto MS & Schmitt JL (2013) Composição florística de epífitos vasculares do Parque Natural Municipal Tupancy, Arroio do Sal, RS, Brasil. Pesquisas, botânica 63: 177-188.
- Thiers B [continuamente atualizado] Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium. Disponível em <http://sweetgum.nybg.org/science/ih/>. Acesso em 25 setembro 2018.
» http://sweetgum.nybg.org/science/ih/ - Tomazelli LJ & Villwock JA (1991) Geologia do sistema lagunar holocênico do litoral norte do Rio Grande do Sul, Brasil. Pesquisas, geociências 18: 13-24.
- Tomazelli LJ, Dillemburg SR & Villwock JA (2000) Late quaternary geological history of Rio Grande do Sul coastal plain, Southern Brazil. Revista Brasileira de Geociências 30: 470-472.
- Veloso HP (1992) Manual técnico da vegetação brasileira. IBGE, Rio de Janeiro. 93p.
- Venzke TS (2012) Florística de comunidades arbóreas no Município de Pelotas, Rio Grande do Sul. Rodriguésia 63: 571-578.
- Waechter JL (1985) Aspectos ecológicos da vegetação de restinga no Rio Grande do Sul, Brasil. Comunicação do Museu de Ciências, PUCRS, série botânica 33: 49-68.
- Waechter JL (1986) Epífitos vasculares da mata paludosa do Faxinal, Torres, Rio Grande do Sul, Brasil. Iheringia, série botânica 34: 39-50.
- Waechter JL (1990) Comunidades vegetacionais das restingas do Rio Grande do Sul. In: Anais do Simpósio de Ecossistemas da Costa Sul e Sudeste Brasileira. Águas de Lindóia. Vol. 3. ACIESP, São Paulo. Pp. 228-248.
- Waechter JL (1998) Epiphytic orchids in eastern subtropical South America. In: Proceedings of the 15th World Orchid Conference. Naturalia, Rio de Janeiro. Pp. 332-341.
- Waechter JL (2002) Padrões geográficos na flora atual do Rio Grande do Sul. Ciência & Ambiente 24: 93-108.
- Worm B, Barbier EB, Beaumont N, Duffy JE, Folke C, Halpern BS, Jackson JB, Lotze HK, Micheli F, Palumbi SR, Sala E, Selkoe KA, Stachowicz JJ, & Watson R (2006) Impacts of biodiversity loss on ocean ecosystem services. Science 314: 787-790.
- Záchia RA, & Waechter JL (2011) Diferenciação espacial de comunidades herbáceo-arbustivas em florestas costeiras do Parque Nacional da Lagoa do Peixe, Rio Grande do Sul. Pesquisas, botânica 62: 211-238.
Editado por
Datas de Publicação
-
Publicação nesta coleção
30 Abr 2021 -
Data do Fascículo
2021
Histórico
-
Recebido
19 Nov 2018 -
Aceito
19 Ago 2019