RESUMO
Analisou-se a plasticidade morfoanatômica foliar de Smilax campestris (Smilacaceae) em distintas formações de restinga, em gradiente ambiental na planície costeira de São Francisco do Sul, SC, Brasil. De cada um dos vinte indivíduos selecionados por formação, foram coletadas folhas completamente expandidas, totalizando 140 folhas por ambiente destinadas à caracterização morfoanatômica. A heterogeneidade ambiental foi caracterizada pela nutrição do solo e radiação luminosa. Os dados foram avaliados por meio de ANOVA e PCA. Todos os atributos foliares analisados, bem como as variáveis ambientais, apresentaram diferença estatisticamente significativa entre as formações de restinga, com destaque aos atributos de massas seca e fresca, área foliar, área específica foliar, espessura da epiderme abaxial e densidade foliar. As variáveis ambientais de maior destaque foram: matéria orgânica, saturação por base, soma de bases e teor de magnésio. Os ajustes morfoanatômicos de S. campestris em resposta às distintas condições ambientais resultaram no uso de folhas esclerófilas e com características xeromórficas mais acentuadas próximo ao mar que se tornam gradativamente menores rumo ao continente.
Palavras-chave:
japecanga; heterogeneidade ambiental; planície costeira; plasticidade fenotípica
ABSTRACT
In this study, the foliar morphoanatomical plasticity of Smilax campestris (Smilacaceae) was analyzed along an environmental gradient in different restinga formations, in the coastal plain of São Francisco do Sul, Santa Catarina State, Brazil. Twenty individuals were selected by formation, from which 140 leaves were collected for the morphoanatomical characterization. The environmental heterogeneity was characterized by soil nutrition and light radiation. Data were evaluated using ANOVA and PCA. All the leaf traits analyzed, as well as the environmental variables, showed a statistically significant difference among the four restinga formations, with emphasis on the traits of dry mass, fresh mass, leaf area, specific leaf area, abaxial epidermis thickness and leaf density. The main environmental variables were: organic matter, base saturation, sum of bases and magnesium content. The morphoanatomical adjustments of S. campestris in response to different environmental conditions resulted in sclerophyllous leaves, with a pronounced xeromorphic appearance near the sea that gradually becomes less evident within the continent.
Keywords:
coastal plain; environmental heterogeneity; japecanga; phenotypic plasticity
Introdução
Entende-se como restinga o conjunto de comunidades vegetais que ocorre em faixas litorâneas arenosas cujo habitat oferece condições extremas de sobrevivência, caracterizadas por altas luminosidade e temperatura, ventos frequentes, alternância de períodos de inundação e seca, salinidade elevada e escassez de nutrientes (Scarano et al. 2001Scarano, F.R., Duarte, H.M., Ribeiro, K.T., Rodrigues, P.J.F.P., Barcellos, E.M.B., Franco, A.C., Brulfert, J., Deleâens, E. & Lüttge, U. 2001. Four sites with contrasting environmental stress in southeastern Brazil: relations of species, life form diversity, and geographical distribution to ecophysiological parameters. Botanical Journal of the Linnean Society 136: 345-364.). No Brasil, este ecossistema compreende 70% do litoral (Araújo 1992Araújo, D.S.D. 1992. Vegetation types of sandy coastal plains of tropical Brazil: a first approximation. In: U. Seeliger (ed.). Coastal plant communities of Latin America, Academic Press, London, pp. 337-347.) e apresenta diferentes fisionomias que variam de formações herbáceas, sobre solos arenosos de alta mobilidade na região pós-praia, até formações arbustivas e arbóreas, com melhorias nas condições do ambiente, adentrando o continente (Fernandes 2007Fernandes, A. 2007. Fitogeografia brasileira. UFC, Fortaleza., Graeff 2015Graeff, O. 2015. Fitogeografia do Brasil: uma atualização de bases e conceitos. Nau, Rio de Janeiro.). Sua flora é diversa e representada por plantas que se utilizam de uma gama variada de mecanismos adaptativos que as possibilita habitar os diferentes ambientes de restinga, geralmente influenciados por fatores abióticos em gradiente (Melo Júnior & Boeger 2016Melo Júnior, J.C.F & Boeger, M.R.T. 2016. Leaf traits and plastic potential of plant species in a light-edaphic gradient from a restinga in southern Brazil. Acta Biológica Colombiana 21: 51-62.) e, para isso, exibem respostas plásticas funcionais (Bächtold & Melo Júnior 2015Bächtold, B.A. & Melo Junior, J.C.F. 2015. Plasticidade morfológica de Calophyllum brasiliense Camb. (Calophyllaceae) em duas formações de restinga no sul do Brasil. Acta Biológica Catarinense 2: 21-32., Amorin & Melo Júnior 2017Amorim, M.W. & Melo Júnior, J.C.F. 2017. Plasticidade morfoanatômica foliar de Tibouchina clavata (Melastomataceae) ocorrente em duas formações de restinga. Rodriguésia 68: 545-555.).
Respostas funcionais em plantas (Schlichting 1986Schlichting, C.D. 1986. The Evolution of phenotypic plasticity in plants. Annual Review Ecology System 17: 667-693., Perez-Harguindeguy et al. 2013Pérez-Harguindeguy, N., Díaz, S., Garnier, E., Lavorel, S., Poorter, H., Jaureguiberry, P., Bret-Harte, M.S., Cornwell, W.K., Craine, J.M., Gurvich, D.E., Urcelay, C., Veneklaas, E.J., Reich, P.B., Poorter, L., Wright, I.J., Ray, P., Enrico, L., Pausas, J.G., de Vos, A.C., Buchmann, N., Funes, G., Quétier, F., Hodgson, J.G., Thompson, K., Morgan, H.D., ter Steege, H., van der Heijden, M.G.A., Sack, L., Blonder, B., Poschlod, P., Vaieretti, M.V., Conti, G., Staver, A.C., Aquino, S. & Cornelissen, J.H.C. 2013. New handbook for standardized measurement of plant functional traits worldwide. Australian Journal of Botany 61: 167-234.) são mais evidentes nas folhas, o órgão vegetal considerado como uma unidade de alto nível de plasticidade e adequação às diferentes condições ambientais as quais as plantas estão submetidas (Gratani et al. 2006Gratani, L., Covone, F. & Larcher, W. 2006. Leaf plasticity in response to light of three evergreen species of the Mediterranean maquis. Trees 20: 549-558.), permitindo boas inferências ecológicas sobre o crescimento e a sobrevivência das plantas.
Estudos ecológicos funcionais com diferentes espécies de restinga vêm sendo realizados com o intuito de caracterizar a diversidade morfoanatômica e ecofisiológica funcional de plantas em gradientes ambientais na busca de padrões ecológicos (Boeger & Gluzezak 2006Boeger, M.R.T. & Gluzezak, R.M. 2006. Adaptações estruturais de sete espécies de plantas para as condições ambientais da área de dunas de Santa Catarina, Brasil. Iheringia 61:73-82., Lüttge 2006Lüttge, U. 2006. Photosynthetic flexibility and ecophysiological plasticity: questions and lessons from Clusia, the only CAM tree, in the neotropics. New Phytologist 171: 7-25., Mantuano et al. 2006Mantuano, D.G., Barros, C.F. & Scarano F.R. 2006. Leaf anatomy variation within and between three "restinga" populations of Erythroxylum ovalifolium Peyr. (Erythroxylaceae) in Southeast Brazil. Revista Brasileira de Botânica 29: 209-215., Cavalin & Mattos 2007Cavalin, P.O. & Mattos, E.A. 2007. Spatio-temporal variation of photosynthetic pigments in the CAM tree Clusia hilariana Schlechtendal associated with dry spells during the rainy season in southeastern Brazil. Trees 21: 671-675., Rosado et al. 2013Rosado, B.H.P., Mattos, E.A. & Sternberg, L.S.L. 2013. Are leaf physiological traits related to leaf water isotopic enrichment in restinga woody species?. Anais da Academia Brasileira de Ciências 85: 1035-1045., Bächtold & Melo Jr. 2015Bächtold, B.A. & Melo Junior, J.C.F. 2015. Plasticidade morfológica de Calophyllum brasiliense Camb. (Calophyllaceae) em duas formações de restinga no sul do Brasil. Acta Biológica Catarinense 2: 21-32., Liberto & Melo Júnior 2016Liberato, I.S. & Melo Júnior, J.C.F. 2016. Morphological plasticity of Ilex theezans Mart. ex Reissek (Aquifoliaceae) in two restinga vegetation of Santa Catarina coastal plain. Acta Biológica Catarinense 3: 91-101., Melo Júnior & Boeger 2016Melo Júnior, J.C.F & Boeger, M.R.T. 2016. Leaf traits and plastic potential of plant species in a light-edaphic gradient from a restinga in southern Brazil. Acta Biológica Colombiana 21: 51-62., Amorim & Melo Júnior 2017Amorim, M.W. & Melo Júnior, J.C.F. 2017. Plasticidade morfoanatômica foliar de Tibouchina clavata (Melastomataceae) ocorrente em duas formações de restinga. Rodriguésia 68: 545-555., Silva & Melo Júnior 2017Silva, M.M. & Melo Júnior, J.C.F. 2017. Plasticidade da folha e lenho de cinco espécies lenhosas em duas áreas de restinga no Sul do Brasil. Iheringia, Série Botânica, 72: 173-180.). Tais estudos têm mostrado que os ajustes estruturais apresentados pelas plantas de restinga são modularizados e variam entre as espécies, sendo as alterações morfológicas, em geral, mais expressivas que as respostas anatômicas (Melo Júnior & Boeger 2016Melo Júnior, J.C.F & Boeger, M.R.T. 2016. Leaf traits and plastic potential of plant species in a light-edaphic gradient from a restinga in southern Brazil. Acta Biológica Colombiana 21: 51-62., Amorim & Melo Júnior 2017Amorim, M.W. & Melo Júnior, J.C.F. 2017. Plasticidade morfoanatômica foliar de Tibouchina clavata (Melastomataceae) ocorrente em duas formações de restinga. Rodriguésia 68: 545-555.). Isso deixa em evidência a plasticidade das espécies vegetais, dada pela capacidade de se ajustar e realizar um alto fitness em diferentes condições ambientes (Sultan 2000Sultan, S.E. 2000. Phenotypic plasticity for plant development, function and life history. Trends in Plant Science 5: 537-542.), além de fornecer insights sobre como as espécies podem lidar com possíveis mudanças climáticas e ambientais de ordem natural ou antrópica (Valladares et al. 2014Valladares, F., Matesanz, S., Guilhaumon, F., Araújo, M.B., Balaguer, L., Benito-Garzón, M., Cornwell, W., Gianoli, E., van Kleunen, M., Naya, D.E., Nicotra, A.B., Poorter, H. & Zavala, M.A. 2014. The effects of phenotypic plasticity and local adaptation on forecasts of species range shifts under climate change. Ecology Letters 17: 1351-1364.).
A variação edáfica, hídrica e lumínica em pequena escala espacial do ambiente de restinga gera uma pressão seletiva para o estabelecimento das espécies vegetais, de modo que ao longo desse gradiente ambiental ocorre um importante turnover de espécies (Melo Júnior & Boeger 2015Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.). Existem espécies, no entanto, que devido aos ajustes morfoanatômicos e ecofisiológicos podem ocorrer em diferentes formações de restinga, uma vez que o seu potencial plástico atua na produção de fenótipos para melhor lidar com a heterogeneidade ambiental (Valladares et al. 2007Valladares, F., Gianoli, E. & Gómez, J.M. 2007. Ecological limits to plant phenotypic plasticity. New Phytologist 176: 749-763.). Este é o caso de Smilax campestris Griseb. (Smilacaceae) que, além de ser abundante nas formações de restinga mais próximas ao mar, também é encontrada em formações mais interioranas deste ecossistema (Melo Júnior & Boeger 2015Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.).
O presente estudo objetiva verificar as respostas funcionais em atributos morfoanatômicos foliares apresentadas por populações de Smilax campestris em distintas formações de restinga ao longo de um gradiente ambiental de nutrição edáfica e de intensidade luminosa. Tem-se como hipótese que as condições ambientais influenciam diferentes padrões de resposta plástica nessa espécie, assumindo como predição que os espécimes encontrados nas formações pós-praia apresentam características xeromórficas acentuadas em relação às populações no interior do continente.
Material e métodos
A área de estudo está localizada no município de São Francisco do Sul, litoral norte do Estado de Santa Catarina, nos limites da unidade de conservação do Parque Estadual Acaraí (PEA), sob as coordenadas geográficas de 26º14'36"S e 48º38'17"W. Tem extensão territorial de 6.667 ha e é ocupada expressivamente por formações de restinga, além de formações florestais ombrófilas submontana e aluvial, manguezal e várzea (Melo Júnior & Boeger 2015Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.). Possui clima subtropical úmido, com atividade intensa de chuvas no verão e invernos levemente mais secos (Cfa de Köppen). A temperatura anual varia em torno dos 21,2 ºC e a média anual de pluviosidade é de 1.830 mm (Clima-data 2017Climate-Data. 2017. Clima: São Francisco do Sul. Disponível em https://pt.climate-data.org/location/28141/ (acesso em 5-IV-2017).
https://pt.climate-data.org/location/281...
).
Smilax campestris Griseb. (Smilacacae), popularmente chamada de japecanga, é uma espécie nativa, não endêmica do Brasil, que ocorre além da restinga, nos domínios fitogeográficos de Caatinga, Cerrado, Mata Atlântica stricto sensu e Pampa (Flora do Brasil 2017Flora do Brasil 2020 em construção. 2017. Jardim Botânico do Rio de Janeiro. Disponível em http://floradobrasil.jbrj.gov.br/ (acesso em 5-III-2017).
http://floradobrasil.jbrj.gov.br/...
). Está distribuída no Norte (Tocantins), Nordeste (Bahia, Ceará, Pernambuco), Centro-Oeste (Distrito Federal, Mato Grosso do Sul), Sudeste (Minas Gerais, Rio de Janeiro, São Paulo) e Sul (Paraná, Rio Grande do Sul, Santa Catarina) (REFLORA 2017). Tem forma de vida herbácea lianescente ou subarbustiva cespitosa, de caules cilíndricos ou angulosos, lisos ou ásperos, com acúleos de ápices escuros ou não. As folhas são glabras, oblongas, ovadas ou elípticas, de textura coriácea, ápice agudo, arredondado ou emarginado, base aguda, arredondada e em alguns casos cordada, margem lisa, as vezes aculeada, e venação acródroma proeminente em ambas as faces (Andreata 2003Andreata, R.H.P. 2003. Smilacaceae In: M.G.L. Wanderley, G.J. Shepherd, T.S. Melhem, A.M. Giulietti, M. Kirizawa (eds.). Flora Fanerogâmica do Estado de São Paulo. Instituto de Botânica, São Paulo, v. 3, pp. 323-332.). Os frutos são bagas globosas de cor verde quando imaturas, passando a violeta e preta na maturidade, com sementes cor castanho-claras (Andreata 2003Andreata, R.H.P. 2003. Smilacaceae In: M.G.L. Wanderley, G.J. Shepherd, T.S. Melhem, A.M. Giulietti, M. Kirizawa (eds.). Flora Fanerogâmica do Estado de São Paulo. Instituto de Botânica, São Paulo, v. 3, pp. 323-332.). Usados como recurso alimentar, os frutos de S. campestris têm influência direta na permanência de animais na restinga (Oliveira 2012Oliveira M.C.P., Sousa, G.M. & Oliveira, J.C. 2012. Dinâmica de entrada e saída de sementes em vegetação de cerrado. UFPI, Teresina.).
Para o estudo funcional foram consideradas as populações de S. campestris em todas as quatro formações que caracterizam a restinga do PEA (Melo Júnior & Boeger 2015Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.). São elas: restingas herbácea, arbustiva, arbustivo-arbórea e floresta de transição (adaptado de Silva & Britez 2005Silva, S.M. & Britez, R.M. 2005. A vegetação da planície costeira. In: M.C.M. Marques & R.M. Britez (eds.). História Natural e Conservação da Ilha do Mel. UFPR, Curitiba, pp.49-84.). Em cada formação mencionada, foram selecionados 20 indivíduos amostrais, dos quais foram coletadas 7 folhas de sol fixadas nos 4º e 5º nós a partir do ápice do ramo e desprovidas de lesões provocadas por herbívoros. Do total de 140 folhas por formação de restinga, 100 folhas foram destinadas à morfologia e 40 folhas à anatomia, sendo essas últimas fixadas em FAA 70% ainda em campo (Kraus & Arduin 1997Kraus, J.E., Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Edur, Rio de Janeiro.).
Os atributos morfoanatômicos funcionais foliares, baseados no Manual Global de Atributos Funcionais em Plantas (Pérez-Harguindeguy et al. 2013Pérez-Harguindeguy, N., Díaz, S., Garnier, E., Lavorel, S., Poorter, H., Jaureguiberry, P., Bret-Harte, M.S., Cornwell, W.K., Craine, J.M., Gurvich, D.E., Urcelay, C., Veneklaas, E.J., Reich, P.B., Poorter, L., Wright, I.J., Ray, P., Enrico, L., Pausas, J.G., de Vos, A.C., Buchmann, N., Funes, G., Quétier, F., Hodgson, J.G., Thompson, K., Morgan, H.D., ter Steege, H., van der Heijden, M.G.A., Sack, L., Blonder, B., Poschlod, P., Vaieretti, M.V., Conti, G., Staver, A.C., Aquino, S. & Cornelissen, J.H.C. 2013. New handbook for standardized measurement of plant functional traits worldwide. Australian Journal of Botany 61: 167-234.), compreenderam: massa fresca (g), obtida em balança analítica Shimadzu AUY220 após saturação em água por 12 h; massa seca (g), obtida em balança analítica após a desidratação das folhas em estufa de circulação forçada de ar a 70º C por 72 h; espessura foliar (mm), tomada com auxílio de paquímetro digital Mitutoyo; área foliar (cm2), obtida por meio de imagem digitalizada em software Sigma Scan Pro (versão 5.0, SPSS Inc., Chicago IL, USA); área especifica foliar (cm2.g-1), obtida pela razão entre a área foliar e a massa seca; grau de suculência (g.cm-2), medida pela diferença entre massa fresca e a massa seca dividida por duas vezes a área foliar; densidade foliar (mm3.g-1), obtida pela divisão da razão entre a massa seca e a área foliar pela espessura foliar; espessura dos tecidos foliares (µm), mensurada com auxílio do software Dino-Eye (versão 2.0, Dino-Lite Microscope, New York NY, USA) em fotomicroscópio Olympus CX 200.
Os atributos anatômicos foram mensurados a partir de seções transversais do terço médio da folha produzidas manualmente com auxílio de lâmina de aço. Após a seleção qualitativa dos cortes em termos de espessura, 100 seções anatômicas por formação foram coradas com azul de toluidina e montadas em lâminas histológicas semipermanentes com uso de água glicerinada e lutagem com esmalte sintético (Kraus & Arduim 1997Kraus, J.E., Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Edur, Rio de Janeiro.).
Para a caracterização nutricional dos solos de restinga, foram produzidas três amostras compostas por formação, a partir da coleta de 60 amostras de solo a uma profundidade de 15 cm (EMBRAPA 2013EMBRAPA (Empresa Brasileira de Pesquisa Agropecuária). 2013 Sistema brasileiro de classificação de solos. Brasília. 3: 353.). A análise química dos solos para pH, fósforo (P), potássio (K), sódio (Na), magnésio (Mg), acidez potencial (H+Al, íons H+ e Al3+), soma de bases (SB), capacidade de troca catiônica (CTC), saturação por bases (V) e matéria orgânica (MO) foi realizada pelo Instituto Agronômico de Campinas (IAC). A radiação fotossinteticamente ativa (PAR) foi mensurada com o uso de luxímetro (Li-250A LICOR, USA) junto a cada indivíduo amostral.
Para as análises estatísticas foram calculadas médias e desvio-padrão para os atributos morfoanatômicos foliares e realizada comparação entre as populações de S. campestris por meio de Análise de Variância (ANOVA), post hoc Tukey, com nível de significância de 5%. A análise dos componentes principais (PCA) foi utilizada para determinar a maior variância entre os atributos selecionados. Todas as análises estatísticas foram realizadas em software R (Borcard et al. 2011Borcard, D., Gillet, F. & Legendre, P. 2011. Numerical Ecology with R. Springer, New York.).
Resultados
Todos os atributos morfoanatômicos foliares analisados em S. campestris apresentam diferenças estatisticamente significativas entre as quatro formações de restinga consideradas (tabela 1, figura 1). A população de floresta apresentou maiores valores para os atributos de massas fresca e seca, espessura foliar e área foliar, os quais reduziram gradativamente até a restinga herbácea. Exceção se fez à espessura foliar, a qual manteve-se sem variação importante nas formações de restinga arbustivo-arbórea, arbustiva e herbácea.
Valores médios e respectivos desvios-padrão (entre parênteses) das variáveis morfoanatômicas das populações de Smilax campestris (Smilacaceae) das formações de Restinga herbácea (Rh), arbustiva (Ra), arbustiva-arbórea (Raa) e de Floresta de transição (Ft) do Parque Estadual do Acaraí, São Francisco do Sul/SC. Letras diferentes na mesma linha mostram diferença significativa (p < 0,05).
Table 1
Mean values and standard deviation (in parentheses) of the morphoanatomical variables of Smilax campestris (Smilacaceae) populations in the formations of herbaceous restinga (Rh), shrubby restinga (Ra), shrub-arboreal restinga (Raa) and transition forest (Ft) of the Parque Estadual do Acaraí, São Francisco do Sul, Santa Catarina State, Brazil. Different letters on the same line show significant difference (p < 0,05).
Aspecto morfoanatômico foliar de Smilax campestris (Smilacaceae) ocorrente nas formações de floresta de transição (A-B), restinga arbustivo-arbórea (C-D), restinga arbustiva (EF) e restinga herbácea (G-H) do Parque Estadual Acaraí, São Francisco do Sul, SC. Barras de escala: A, C, E e G = 1,5 cm; B, D, F e H = 100 µm.
Figure 1
Foliar morphoanatomical aspect of Smilax campestris (Smilacaceae) occurring in the formations of transition forest (A-B), shrub-arboreal restinga (C-D), shrubby restinga (E-F) and herbaceous restinga (G-H) in the Parque Estadual Acaraí, São Francisco do Sul, Santa Catarina State, Brazil. Scale: A, C, E and G = 1,5 cm; B, D, F and H = 100 µm.
De maneira inversa, os valores de área específica foliar, grau de suculência, espessura dos parênquimas paliçádico e lacunoso foram maiores em restinga herbácea. A AEF e a espessura do parênquima paliçádico foram menores nas populações de restinga arbustiva e arbustivo-arbórea. O grau de suculência e a espessura do parênquima lacunoso foram menores nas populações de restinga arbustivo-arbórea e floresta. A densidade foliar foi similar entre as formações de floresta de transição, restingas arbustivo-arbórea e arbustiva. Os indivíduos de restinga arbustivo-arbórea apresentaram ambas as faces da epiderme mais espessas. De modo geral, a epiderme abaxial apresentou-se mais espessa que a epiderme adaxial nos indivíduos de todas as formações de restinga (tabela 1).
A população da formação arbustivo-arbórea teve maior proximidade com a da floresta de transição para os atributos de grau de suculência, espessura da epiderme abaxial e do parênquima lacunoso, enquanto os da formação arbustiva apresentaram, para massa fresca, massa seca, espessura foliar e do parênquima lacunoso, maior semelhança com a formação herbácea (tabela 1).
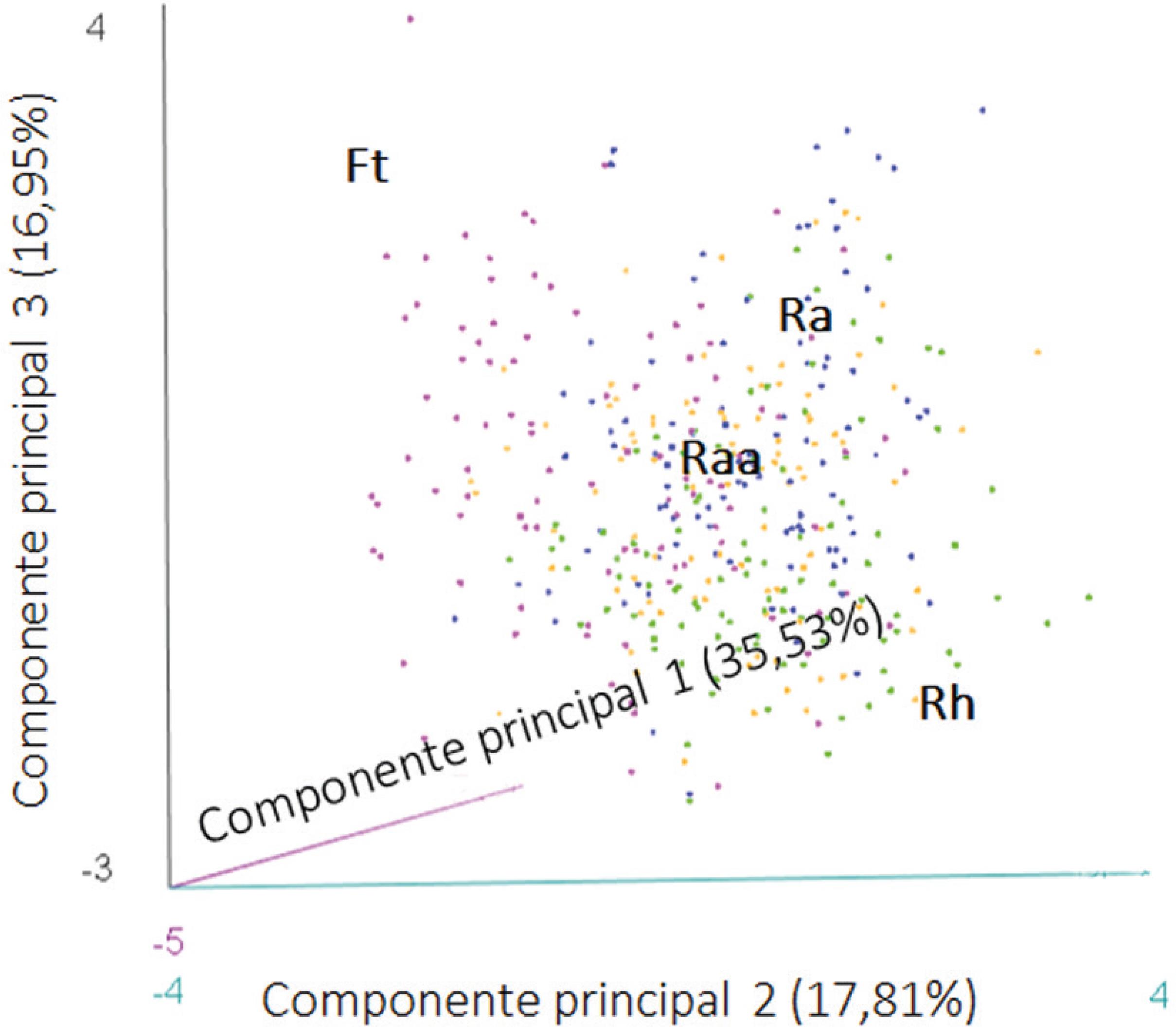
A análise de componentes principais (PCA) explicou 70,30% da variação de dados morfoanatômicos foliares de S. campestris nos três eixos principais (tabela 1, figura 2). Os atributos de massa seca, massa fresca e área foliar apresentaram maior importância para diferenciar as populações no eixo 1 (35,53%). O segundo eixo principal explicou 17,81% de variância dos dados, sendo os atributos de espessura da epiderme abaxial e AEF mais importantes para este eixo. O eixo principal 3 está relacionado à densidade foliar, explicando 16,95% de variância de dados. A distribuição dos indivíduos nos eixos 1 e 2 evidenciaram as diferenças morfoanatômicas entre as populações de floresta e restinga herbácea, principalmente em relação aos atributos AEF e espessura da epiderme abaxial.
Análise de componentes principais (PCA) dos atributos foliares das populações de Smilax campestris (Smilacaceae) ocorrentes nas formações de restinga do Parque Estadual Acaraí, São Francisco do Sul, SC. Os três primeiros eixos principais explicam 70,30% da variância dos dados. Ft: floresta de transição (rosa), Raa: restinga arbustivo-arbórea (laranja), Ra: restinga arbustiva (azul) e Rh: restinga herbácea (verde).
Figure 2
Principal Component Analysis (PCA) of foliar traits in the populations of Smilax campestris (Smilacaceae) occurring in the restinga formations of the Parque Estadual Acaraí, São Francisco do Sul, Santa Catarina State, Brazil. The three main axes explain 70,30% of variation. Ft: transition forest (pink), Raa: shrub-arboreal restinga (orange), Ra: shrubby restinga (blue), Rh: herbaceous restinga (green).
A análise dos dados ambientais indicou maiores valores de fósforo, potássio, sódio, acidez potencial, capacidade de troca catiônica e matéria orgânica para a formação de floresta de transição e os menores valores dos mesmos atributos para a formação de restinga herbácea, com exceção do fósforo e potássio (tabela 2). Situação oposta foi observada para o magnésio, pH, saturação por bases e para a radiação fotossinteticamente ativa, cujos maiores valores foram registrados em restinga herbácea e os menores em floresta de transição.
Caracterização nutricional dos solos e radiação fotossinteticamente ativa das formações de Restinga herbácea (Rh), arbustiva (Ra), arbustiva-arbórea (Raa) e de Floresta de transição (Ft) do Parque Estadual do Acaraí, São Francisco do Sul/SC. Letras diferentes na mesma linha mostram diferença significativa (p < 0,05). Ca: cálcio, Mg: magnésio, CTC: capacidade de troca catiônica, MO: matéria orgânica, H + Al: hidrogênio + alumínio, P: fósforo, K: potássio, pH: potencial hidrogeniônico, PAR: radiação fotossinteticamente ativa, Na: sódio, SB: soma de bases, V: saturação por bases.
Table 2
Nutritional characterization of soils and photosynthetically active radiation in the formations of herbaceous restinga (Rh), shrubby restinga (Ra), shrub-arboreal restinga (Raa) and transition forest (Ft) in the Parque Estadual do Acaraí, São Francisco do Sul, Santa Catarina State, Brazil. Different letters on the same line show significant difference (p < 0,05). Ca: calcium, Mg: magnesium, CTC: cation exchange capacity, MO: organic matter, H + Al: hydrogen + aluminum, P: phosphorus, K: potassium, pH: potential of hydrogen, PAR: photosynthetically active radiation, NA: sodium, SB: sum of bases, V: base saturation.
A análise de componentes principais (PCA) para as variáveis ambientais mostrou que os dois primeiros eixos explicaram 85,64% da variação total dos dados (tabela 2, figura 3). O eixo principal 1 explicou 56,43% da variância e foi relacionado à matéria orgânica e saturação por base, enquanto o segundo eixo principal foi relacionado à soma de bases e ao magnésio, explicando 29,20% da variação total dos dados.
Análise de componentes principais (PCA) das variáveis ambientais de solo e luz das formações de restinga de ocorrência das populações de Smilax campestris (Smilacaceae) no Parque Estadual Acaraí, São Francisco do Sul, SC. Os dois primeiros eixos principais explicam 85,65% da variância dos dados. Ft: floresta de transição, Raa: restinga arbustivo-arbórea, Ra: restinga arbustiva e Rh: restinga herbácea.
Figure 3
Principal Component Analysis (PCA) of environmental variables of soil and light radiation in the restinga formations where populations of Smilax campestris (Smilacaceae) occur, in the Parque Estadual Acaraí, São Francisco do Sul, Santa Catarina State, Brazil. The two main axes explain 85,65% of variation. Ft: transition forest, Raa: shrub-arboreal restinga, Ra: shrubby restinga, Rh: herbaceous restinga.
Discussão
A heterogeneidade nutricional dos solos de restinga, bem como a variação na disponibilidade de água e incidência luminosa, pode alterar a estrutura das comunidades vegetais, como observado no PEA, onde a comunidade vegetal apresenta variação em sua composição conforme distancia-se do mar e as condições ambientais vão se alterando para uma condição menos severa (Melo Júnior & Boeger 2015Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.). A restinga do PEA apresenta um nítido gradiente ambiental caracterizado pelo teor de matéria orgânica e água no solo, o que influencia diretamente na liberação de macro e micronutrientes e, por conseguinte, na oferta de recursos para o desenvolvimento das espécies vegetais.
Face a amplitude de variação nas características ambientais da restinga, Smilax campestris apresenta a capacidade de se desenvolver sob condições contrastantes na disponibilidade de água e nutrientes, como população pujante em floresta de transição com maior oferta de recursos, e população em situação oposta em restinga herbácea com condições ambientais mais severas. Tal capacidade é mediada pela plasticidade fenotípica, que se traduz na capacidade de um dado genótipo apresentar diferentes fenótipos, a fim de maximizar a habilidade reprodutiva em cada ambiente (West-Eberhard 2005West-Eberhard, M.J. 2005. Developmental plasticity and the origin of species diferences. Proceedings of the National Academy of Sciences 102: 6543-6549.). A plasticidade fenotípica pode ser observada em características morfológicas, anatômicas e fisiológicas (Sultan 2000Sultan, S.E. 2000. Phenotypic plasticity for plant development, function and life history. Trends in Plant Science 5: 537-542.), como evidenciado neste estudo.
Os atributos de massas seca e fresca, espessura e área foliar apresentaram aumento gradativo de valores no sentido restinga herbácea-floresta de transição, sendo relacionados positivamente ao gradiente ambiental, corroborando o padrão observado para outras espécies de restinga (Bächtold & Melo Júnior 2015Bächtold, B.A. & Melo Junior, J.C.F. 2015. Plasticidade morfológica de Calophyllum brasiliense Camb. (Calophyllaceae) em duas formações de restinga no sul do Brasil. Acta Biológica Catarinense 2: 21-32., Melo Júnior & Boeger 2016Melo Júnior, J.C.F & Boeger, M.R.T. 2016. Leaf traits and plastic potential of plant species in a light-edaphic gradient from a restinga in southern Brazil. Acta Biológica Colombiana 21: 51-62., Silva et al. 2016Silva, K.R., Melo Júnior, J.C.F. & Boeger, M.R.T. 2016. Variações fenotípicas em Andira fraxinifolia Benth. (Fabaceae) em duas fitofisionomias de Restinga. Hoehnea 43: 237-245.). A redução da produção de biomassa na população de restinga herbácea está associada, principalmente, à baixa disponibilidade de água no solo, visto que a água é necessária para compor a solução absorvida pelas raízes (Machado 1997Machado, P.L.O.A. 1997. Considerações gerais sobre a toxicidade do alumínio nas plantas. EMBRAPA, Rio de Janeiro.). A água é também componente principal da decomposição da matéria orgânica e liberação de nutrientes orgânicos para o solo, bem como nos processos metabólicos de fotossíntese e produção de biomassa (Faquin 2005Faquin, V. 2005. Nutrição Mineral de Plantas. UFLA/FAEPE, Lavras., Ronquim 2010Ronquim, C.S. 2010. Conceitos de fertilidade do solo e manejo adequado para as regiões tropicais. EMBRAPA, Campinas.). Do ponto de vista mecânico, a disponibilidade de água no solo é condicionada por características físicas tais como a densidade, porosidade, compacidade e granulometria, sendo os solos mais porosos, arenosos e de baixa compactação mais drenáveis e, por conseguinte, com menor retenção hídrica (IBGE 2015IBGE (Instituto Brasileiro de Geografia e Estatística). 2015. Manual técnico de pedologia. 3 ed. IBGE, Rio de Janeiro.).
A reserva de água nos tecidos do mesofilo constitui uma estratégia de sobrevivência para espécies de ambientes secos, conforme observado em S. campestris de restinga herbácea (Boeger & Gluzezak 2006Boeger, M.R.T. & Gluzezak, R.M. 2006. Adaptações estruturais de sete espécies de plantas para as condições ambientais da área de dunas de Santa Catarina, Brasil. Iheringia 61:73-82.). Em floresta de transição, por outro lado, a reserva de água no mesofilo foliar atua provavelmente como um mecanismo de balanço salino nos tecidos vegetais (Larcher 2004Larcher, W. 2004. Ecofisiologia Vegetal. RiMa, São Carlos.), visto o maior teor de sódio neste local.
A menor área foliar, por sua vez, é uma estratégia de redução da área de transpiração em ambientes com escassez hídrica e altas temperaturas (Boeger & Gluzezak 2006Boeger, M.R.T. & Gluzezak, R.M. 2006. Adaptações estruturais de sete espécies de plantas para as condições ambientais da área de dunas de Santa Catarina, Brasil. Iheringia 61:73-82.), como o observado nas populações de restinga herbácea. Nas formações de restinga arbustiva, arbustivo-arbórea e floresta de transição, a variação diária do sombreamento causada pela posição do sol, posição e movimento das copas causadas pelos ventos (observável pelo alto desvio padrão da PAR) influenciou na produção de maiores áreas foliares, a fim de maximizar a absorção de luz (Givnsh 1988Givnish, T.J. 1988. Adaptation to sun and shade: A whole-plant perspective. Australian Journal of Plant Physiology 15: 63-92., Silva 2010Silva, L.A. 2010. Plasticidade e aclimatação foliar à irradiância em espécies da floresta atlântica. Tese de doutorado, Universidade Federal de Viçosa.). Os resultados de maiores áreas foliares em floresta e menor em restinga herbácea em função da diferença no grau de exposição à radiação luminosa são convergentes à relação entre área foliar e a economia de água há muito preconizada pela literatura científica (Dickson 2000Dickson, W.C. 2000. Integrative plant anatomy. Academic Press, California, USA., Evert 2013Evert, R.F. 2013. Anatomia das Plantas de Esau. Meristemas, células e tecidos do corpo da planta: sua estrutura, função e desenvolvimento. 3 ed. Blucher, São Paulo.).
A menor densidade foliar na população de restinga herbácea está associada ao maior teor de água e menor incremento em tecido mecânico no mesofilo foliar em relação às demais formações de restinga. A escassez hídrica e de nutrientes pode influenciar na reserva de água e na produção de um mesofilo menos denso (Marschner 1995Marschner, H. 1995. Mineral nutrition of higher plants. Academic Press, London.), tal qual observado na população de restinga herbácea.
A maior alocação de biomassa vegetal na população florestal, representada pelos atributos de massa seca e área foliar, é influenciada, principalmente, pela maior concentração de fósforo no solo desta formação, visto que o fósforo é um mineral essencial aos processos metabólicos de aquisição, estocagem e utilização de energia e, por conseguinte, essencial na síntese de carboidratos (Epstein & Bloom 2006Epstein, E. & Bloom, A.J. 2006. Nutrição mineral de plantas: princípios e perspectivas. Editora Planta, Londrina.).
Devido às condições xéricas ocorrentes nos ambientes mais próximos ao mar (restingas herbácea e arbustiva) esperava-se que as plantas destes locais possuíssem características xeromórficas, tais como folhas esclerófilas. No entanto, a AEF, que representa o teor de matéria seca por unidade de área foliar e é um indicador de esclerofilia, apresentou padrão inverso ao esperado (Boeger et al. 2000Boeger, M.R.T., Negrelle, R.R.B. & Martins, R. 2000. Produção de serapilheira num gradiente sucessional em floresta ombrófila densa das terras baixas, Município de Itapoá, SC. Tecnologia e Ambiente 6: 91-106.).
Folhas com menores valores de AEF foram observadas em ambiente florestal, evidenciando que estas plantas apresentam maior investimento em tecido mecânico por área foliar em relação às plantas de restinga herbácea. A população de S. campestris em florestas de transição apresentou folhas com textura mais cartácea em relação a evidente textura coriácea nas folhas da população de restinga herbácea, o que pode ser explicado pela maior espessura da epiderme adaxial e abaxial e dos parênquimas paliçádico e lacunoso. Conforme Roth (1984)Roth, I. 1984. Stratification of tropical forest as seen in leaf structure - Tasks for Vegetation Science. Lieth, Hague. e Turner (1994)Turner, I.M. 1994. A quantitative analysis of leaf form in woody plants from the world's major broadleaved forest types. Journal of Biogeography 21: 413-419., a textura foliar está relacionada positivamente com a espessura dos tecidos constituintes da lâmina foliar.
Apesar da variação observada entre as populações de S. campestris com distribuição em diferentes formações da restinga do PEA, todas apresentaram folhas esclerófilas (< 70 cm2.g-1) (Boeger et al. 2000Boeger, M.R.T., Negrelle, R.R.B. & Martins, R. 2000. Produção de serapilheira num gradiente sucessional em floresta ombrófila densa das terras baixas, Município de Itapoá, SC. Tecnologia e Ambiente 6: 91-106.). Baixos valores de AEF significam alto investimento em tecido mecânico em detrimento do tecido fotossintético, resultando em folhas mais coriáceas, evidenciado pela alta densidade foliar (Boeger et al 2005Boeger, M.R.T., Wisniewski, C. & Reissmann, C.B. 2005. Nutrientes foliares de espécies arbóreas de três estádios sucessionais de floresta ombrófila densa no sul do Brasil. Acta Botanica Brasílica 19: 167-181.) e mais longevas, sendo uma estratégia ao ambiente pobre em nutrientes e com déficit hídrico (Chabot & Hicks 1982Chabot, B.F. & Hicks, D.J. 1982. The ecology of leaf life spans. Annual Review Ecology and Systematic 13: 229-259., Reich et al. 1992Reich, P.B., Walters, M.B. & Ellsworth, D.S. 1992. Leaf lifespan in relation to leaf, plant, and stand characteristics among diverse ecosystems. Ecological Monographs 62: 365-392.), além de representar uma economia de carbono e de proteção antiherbivoria (Bryant et al. 1983Bryant, J.P., Chapin III, F.S. & Klein, D.R. 1983. Carbon/Nutrient balance of boreal plants in relation to vertebrate herbivory. Oikos 40: 357-368.).
Os efeitos da luminosidade podem ser observados na organização dos tecidos do mesofilo, principalmente os fotossintetizantes. Tanto a quantidade quanto a qualidade da luz que atinge o vegetal influenciam a produção de fenótipos que favorecem a otimização desse recurso (Valladares et al. 2004Valladares, F., Aranda, I. & Sánchez-Gomes, D. 2004. La luz como factor ecológico y evolutivo para las plantas y su interacción con el agua. In: Ministerio de Medio Ambiente. Ecología del bosque mediterráneo en un mundo cambiante. EGRAF, Madrid, pp.335-369.), tanto em condições de alta radiação, observadas em restinga herbácea e arbustiva, quanto em condições de maior sombreamento em restinga arbustivo-arbórea e floresta de transição para as populações de S. campestris. O incremento da espessura do mesofilo através do investimento em parênquima lacunoso tem sido discutido como uma estratégia de otimizar processos fotossintéticos, visto que o espaço intercelular ocorrente no parênquima lacunoso favorece o transporte de gases no mesofilo (Tian et al. 2016Tian, M., Yu, G., Yu, G., He, N. & Hou, J. 2016. morphological and anatomical traits from tropical to temperate coniferous forests: Mechanisms and influencing factors. Scientific Reports 6: 19703.) e complementa a eficiência de absorção luminosa. A combinação de parênquimas paliçádico e lacunoso espessos, observada nas populações de S. campestris, aumenta a assimilação e, por consequente, o crescimento das plantas (Larcher et al. 2015Larcher, L., Nogueira, G. & Boeger, M.R. 2015. Morphological plasticity and gas exchange of Ligustrum lucidum W.T. Aiton in distinct light conditions. Brazilian Archives of Biology and Technology 58: 877-885.). Em adição, a maior produção de tecido fotossintético em indivíduos da restinga herbácea, se comparados às demais formações de restinga, pode ser resultante da melhor absorção de K, Mg e P, proporcionado pelo maior teor de Ca neste local, efeito denominado como "efeito Viets" (Viets 1944Viets, F.G. 1944. Calcium and other polyvalent cations as accelerators of ion accumulation by excised barley roots. Plant Physiology 19: 466-480.).
A maior espessura de epiderme adaxial observada em todos os indivíduos estudados é um ajuste estrutural comum em folhas expostas à alta incidência luminosa, constituindo estratégia de redução de perda de água e redução da incidência direta de luz por meio da refletância, evitando o superaquecimento do mesofilo (Lee et al. 1990Lee, D.W., Bone, R.A., Tarsis, S.L. & Storch, D. 1990 Correlates of Leaf Optical Properties in Tropical Forest Sun and Extreme-Shade Plants. American Journal of Botany 77: 370-380.).
O solo florestal dotado de maior valor de CTC não reflete uma maior fertilidade em relação ao solo das demais formações de restinga, uma vez que é altamente ocupada por H+ e Al3+, os quais apresentam potencial tóxico para plantas (Ronquim 2010Ronquim, C.S. 2010. Conceitos de fertilidade do solo e manejo adequado para as regiões tropicais. EMBRAPA, Campinas.). A interpretação da fertilidade do solo pode ser mais precisa observando os valores de soma de bases, a qual representa a soma dos cátions permutáveis e disponíveis para as plantas (Machado 1997Machado, P.L.O.A. 1997. Considerações gerais sobre a toxicidade do alumínio nas plantas. EMBRAPA, Rio de Janeiro., Ronquim 2010Ronquim, C.S. 2010. Conceitos de fertilidade do solo e manejo adequado para as regiões tropicais. EMBRAPA, Campinas.). Neste estudo, os resultados obtidos indicam que os solos florestal e de restinga arbustivo-arbórea são potencialmente tóxicos (Faquin 2005Faquin, V. 2005. Nutrição Mineral de Plantas. UFLA/FAEPE, Lavras., Miguel et al. 2010Miguel, P.S.B., Gomes, F.T., Rocha, W.S.D., Martins, C.E., Carvalho, C.A. & Oliveira, A.V. 2010. Efeitos tóxicos do alumínio no crescimento das plantas: mecanismos de tolerância, sintomas, efeitos fisiológicos, bioquímicos e controles genéticos. CES Revista 24: 13-29.) em função do alto teor de Al+H e baixo valor de saturação por bases. Nos solos do PEA, os teores de cálcio, magnésio e potássio apresentam concentração similar ao observado em outras restingas e florestas de terras baixas (Boeger et al. 2005Boeger, M.R.T., Wisniewski, C. & Reissmann, C.B. 2005. Nutrientes foliares de espécies arbóreas de três estádios sucessionais de floresta ombrófila densa no sul do Brasil. Acta Botanica Brasílica 19: 167-181.). O teor de fósforo no solo apresentou-se extremamente alto na formação florestal de restinga, se comparado a valores registrados em outros estudos realizados em solos arenosos (Boeger et al. 2005Boeger, M.R.T., Wisniewski, C. & Reissmann, C.B. 2005. Nutrientes foliares de espécies arbóreas de três estádios sucessionais de floresta ombrófila densa no sul do Brasil. Acta Botanica Brasílica 19: 167-181.), estando diretamente relacionado ao elevado teor de matéria-orgânica nesta formação.
Os resultados encontrados para os atributos foliares de S. campestris indicam que os ajustes morfoanatômicos em resposta às distintas condições nutricionais dos solos e de disponibilidade hídrica na restinga, resultaram no uso de folhas esclerófilas e com características xeromórficas como estratégia na economia de carbono e água. Considerando a perspectiva espacial de distribuição em gradiente edáfico e lumínico das populações de S. campestris em associação com as variações estruturais distintivas entre as formações da restinga, é possível inferir que as respostas plásticas desta apresentam xeromorfismo acentuado próximo ao mar e gradativamente menor rumo ao continente.
Literatura citada
- Amorim, M.W. & Melo Júnior, J.C.F. 2017. Plasticidade morfoanatômica foliar de Tibouchina clavata (Melastomataceae) ocorrente em duas formações de restinga. Rodriguésia 68: 545-555.
- Andreata, R.H.P. 2003. Smilacaceae In: M.G.L. Wanderley, G.J. Shepherd, T.S. Melhem, A.M. Giulietti, M. Kirizawa (eds.). Flora Fanerogâmica do Estado de São Paulo. Instituto de Botânica, São Paulo, v. 3, pp. 323-332.
- Araújo, D.S.D. 1992. Vegetation types of sandy coastal plains of tropical Brazil: a first approximation. In: U. Seeliger (ed.). Coastal plant communities of Latin America, Academic Press, London, pp. 337-347.
- Bächtold, B.A. & Melo Junior, J.C.F. 2015. Plasticidade morfológica de Calophyllum brasiliense Camb. (Calophyllaceae) em duas formações de restinga no sul do Brasil. Acta Biológica Catarinense 2: 21-32.
- Boeger, M.R.T., Negrelle, R.R.B. & Martins, R. 2000. Produção de serapilheira num gradiente sucessional em floresta ombrófila densa das terras baixas, Município de Itapoá, SC. Tecnologia e Ambiente 6: 91-106.
- Boeger, M.R.T., Wisniewski, C. & Reissmann, C.B. 2005. Nutrientes foliares de espécies arbóreas de três estádios sucessionais de floresta ombrófila densa no sul do Brasil. Acta Botanica Brasílica 19: 167-181.
- Boeger, M.R.T. & Gluzezak, R.M. 2006. Adaptações estruturais de sete espécies de plantas para as condições ambientais da área de dunas de Santa Catarina, Brasil. Iheringia 61:73-82.
- Borcard, D., Gillet, F. & Legendre, P. 2011. Numerical Ecology with R. Springer, New York.
- Bryant, J.P., Chapin III, F.S. & Klein, D.R. 1983. Carbon/Nutrient balance of boreal plants in relation to vertebrate herbivory. Oikos 40: 357-368.
- Cavalin, P.O. & Mattos, E.A. 2007. Spatio-temporal variation of photosynthetic pigments in the CAM tree Clusia hilariana Schlechtendal associated with dry spells during the rainy season in southeastern Brazil. Trees 21: 671-675.
- Climate-Data. 2017. Clima: São Francisco do Sul. Disponível em https://pt.climate-data.org/location/28141/ (acesso em 5-IV-2017).
» https://pt.climate-data.org/location/28141/ - Chabot, B.F. & Hicks, D.J. 1982. The ecology of leaf life spans. Annual Review Ecology and Systematic 13: 229-259.
- Chaves, L.H.G., Tito, G.A., Chaves, I.B., Luna J.G. & Silva, P.C.M. 2004. Propriedades químicas do solo aluvial da Ilha de Assunção-Cabrobó (Pernambuco). Revista Brasileira de Ciência do Solo 28: 431-437.
- Dickson, W.C. 2000. Integrative plant anatomy. Academic Press, California, USA.
- EMBRAPA (Empresa Brasileira de Pesquisa Agropecuária). 2013 Sistema brasileiro de classificação de solos. Brasília. 3: 353.
- Epstein, E. & Bloom, A.J. 2006. Nutrição mineral de plantas: princípios e perspectivas. Editora Planta, Londrina.
- Espindola Júnior, A., Boeger, M.R.T., Maccari Júnior, A., Reissmann, C.B. & Rickli, F.L. 2009. Variação na estrutura foliar de Mikania glomerata Spreng. (Asteraceae) sob diferentes condições de luminosidade. Revista brasileira de Botânica 32: 749-758.
- Evert, R.F. 2013. Anatomia das Plantas de Esau. Meristemas, células e tecidos do corpo da planta: sua estrutura, função e desenvolvimento. 3 ed. Blucher, São Paulo.
- Faquin, V. 2005. Nutrição Mineral de Plantas. UFLA/FAEPE, Lavras.
- Fernandes, A. 2007. Fitogeografia brasileira. UFC, Fortaleza.
- Flora do Brasil 2020 em construção. 2017. Jardim Botânico do Rio de Janeiro. Disponível em http://floradobrasil.jbrj.gov.br/ (acesso em 5-III-2017).
» http://floradobrasil.jbrj.gov.br/ - Givnish, T.J. 1988. Adaptation to sun and shade: A whole-plant perspective. Australian Journal of Plant Physiology 15: 63-92.
- Graeff, O. 2015. Fitogeografia do Brasil: uma atualização de bases e conceitos. Nau, Rio de Janeiro.
- Gratani, L., Covone, F. & Larcher, W. 2006. Leaf plasticity in response to light of three evergreen species of the Mediterranean maquis. Trees 20: 549-558.
- IBGE (Instituto Brasileiro de Geografia e Estatística). 2015. Manual técnico de pedologia. 3 ed. IBGE, Rio de Janeiro.
- Kraus, J.E., Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Edur, Rio de Janeiro.
- Larcher, W. 2004. Ecofisiologia Vegetal. RiMa, São Carlos.
- Larcher, L., Nogueira, G. & Boeger, M.R. 2015. Morphological plasticity and gas exchange of Ligustrum lucidum W.T. Aiton in distinct light conditions. Brazilian Archives of Biology and Technology 58: 877-885.
- Lee, D.W., Bone, R.A., Tarsis, S.L. & Storch, D. 1990 Correlates of Leaf Optical Properties in Tropical Forest Sun and Extreme-Shade Plants. American Journal of Botany 77: 370-380.
- Liberato, I.S. & Melo Júnior, J.C.F. 2016. Morphological plasticity of Ilex theezans Mart. ex Reissek (Aquifoliaceae) in two restinga vegetation of Santa Catarina coastal plain. Acta Biológica Catarinense 3: 91-101.
- Lüttge, U. 2006. Photosynthetic flexibility and ecophysiological plasticity: questions and lessons from Clusia, the only CAM tree, in the neotropics. New Phytologist 171: 7-25.
- Machado, P.L.O.A. 1997. Considerações gerais sobre a toxicidade do alumínio nas plantas. EMBRAPA, Rio de Janeiro.
- Mantuano, D.G., Barros, C.F. & Scarano F.R. 2006. Leaf anatomy variation within and between three "restinga" populations of Erythroxylum ovalifolium Peyr. (Erythroxylaceae) in Southeast Brazil. Revista Brasileira de Botânica 29: 209-215.
- Marschner, H. 1995. Mineral nutrition of higher plants. Academic Press, London.
- Medeiros, M.F.T., Senna-Valle, L. & Andreata R.H.P. 2007. Histórico e o uso da "salsa parrilha" (Smilax spp.) pelos boticários no Mosteiro de São Bento. Revista Brasileira de Biociências 5: 27-29.
- Melo Júnior. J.C.F, Bona C. & Ceccantini, G. 2012. Interpretações ecológicas da anatomia foliar comparada de Copaifera langsdorffii Desf. (Leguminosae) em diferentes condições edáficas de uma área de cerrado no Paraná. Biotemas 25: 29-36.
- Melo Júnior, J.C.F & Boeger, M.R.T. 2015. Riqueza, estrutura e interações edáficas em um gradiente de restinga do Parque Estadual do Acaraí, Estado de Santa Catarina, Brasil. Hoehnea 42: 207-232.
- Melo Júnior, J.C.F & Boeger, M.R.T. 2016. Leaf traits and plastic potential of plant species in a light-edaphic gradient from a restinga in southern Brazil. Acta Biológica Colombiana 21: 51-62.
- Melo Júnior, J.C.F., Silva, M.M., Amorim, M.W. & Tussolini, M.G. 2017. Adaptações estruturais de sete espécies ciófitas arbustivas de Floresta Ombrófila Densa. Hoehnea 44: 193-201.
- Miguel, P.S.B., Gomes, F.T., Rocha, W.S.D., Martins, C.E., Carvalho, C.A. & Oliveira, A.V. 2010. Efeitos tóxicos do alumínio no crescimento das plantas: mecanismos de tolerância, sintomas, efeitos fisiológicos, bioquímicos e controles genéticos. CES Revista 24: 13-29.
- Oliveira M.C.P., Sousa, G.M. & Oliveira, J.C. 2012. Dinâmica de entrada e saída de sementes em vegetação de cerrado. UFPI, Teresina.
- Peppe, D.J., Royer, D.L., Cariglino, B., Oliver, S.Y., Newman, S., Leight, E., Enikolopov, G., Fernandez-Burgos, M., Herrera, F., Adams, J.M., Correa, E., Currano, E.D., Erickson, J.M., Hinojosa, L.F., Hoganson, J.W., Iglesias, A., Jaramillo, C.A., Johnson, K.R., Jordan, G.J., Kraft, N.J.B., Lovelock, E.C., Lusk, C.H., Niinemets, U., Peñuelas, J., Rapson, G., Wing, S.L. & Wright, I.J. 2011. Sensitivity of leaf size and shape to climate: global patterns and paleoclimatic applications. New Phytologist 190: 724-739.
- Pérez-Harguindeguy, N., Díaz, S., Garnier, E., Lavorel, S., Poorter, H., Jaureguiberry, P., Bret-Harte, M.S., Cornwell, W.K., Craine, J.M., Gurvich, D.E., Urcelay, C., Veneklaas, E.J., Reich, P.B., Poorter, L., Wright, I.J., Ray, P., Enrico, L., Pausas, J.G., de Vos, A.C., Buchmann, N., Funes, G., Quétier, F., Hodgson, J.G., Thompson, K., Morgan, H.D., ter Steege, H., van der Heijden, M.G.A., Sack, L., Blonder, B., Poschlod, P., Vaieretti, M.V., Conti, G., Staver, A.C., Aquino, S. & Cornelissen, J.H.C. 2013. New handbook for standardized measurement of plant functional traits worldwide. Australian Journal of Botany 61: 167-234.
- Reich, P.B., Walters, M.B. & Ellsworth, D.S. 1992. Leaf lifespan in relation to leaf, plant, and stand characteristics among diverse ecosystems. Ecological Monographs 62: 365-392.
- Ronquim, C.S. 2010. Conceitos de fertilidade do solo e manejo adequado para as regiões tropicais. EMBRAPA, Campinas.
- Rosado, B.H.P., Mattos, E.A. & Sternberg, L.S.L. 2013. Are leaf physiological traits related to leaf water isotopic enrichment in restinga woody species?. Anais da Academia Brasileira de Ciências 85: 1035-1045.
- Roth, I. 1984. Stratification of tropical forest as seen in leaf structure - Tasks for Vegetation Science. Lieth, Hague.
- Sabbi, L.B.C., Angelo, A.C. & Boeger, M.R.T. 2010. Influência da luminosidade nos aspectos mor- foanatômicos e fisiológicos de folhas de Schinus terebinthifolius Raddi (Anacardiaceae) implantadas em duas áreas com diferentes graus de sucessão, nas margens do reservatório Iraí, Paraná, Brasil. Iheringia, Série Botânica 65: 171-181.
- Scarano, F.R. 2002. Structure, function and floristic relationships of plant communities in stressful Habitats to the brazilian atlantic rainforest. Annals of Botany 90: 517-524.
- Scarano, F.R., Duarte, H.M., Ribeiro, K.T., Rodrigues, P.J.F.P., Barcellos, E.M.B., Franco, A.C., Brulfert, J., Deleâens, E. & Lüttge, U. 2001. Four sites with contrasting environmental stress in southeastern Brazil: relations of species, life form diversity, and geographical distribution to ecophysiological parameters. Botanical Journal of the Linnean Society 136: 345-364.
- Silva, L.A. 2010. Plasticidade e aclimatação foliar à irradiância em espécies da floresta atlântica. Tese de doutorado, Universidade Federal de Viçosa.
- Silva, K.R., Melo Júnior, J.C.F. & Boeger, M.R.T. 2016. Variações fenotípicas em Andira fraxinifolia Benth. (Fabaceae) em duas fitofisionomias de Restinga. Hoehnea 43: 237-245.
- Silva, M.M. & Melo Júnior, J.C.F. 2017. Plasticidade da folha e lenho de cinco espécies lenhosas em duas áreas de restinga no Sul do Brasil. Iheringia, Série Botânica, 72: 173-180.
- Silva, S.M. & Britez, R.M. 2005. A vegetação da planície costeira. In: M.C.M. Marques & R.M. Britez (eds.). História Natural e Conservação da Ilha do Mel. UFPR, Curitiba, pp.49-84.
- Sultan, S.E. 2000. Phenotypic plasticity for plant development, function and life history. Trends in Plant Science 5: 537-542.
- Schlichting, C.D. 1986. The Evolution of phenotypic plasticity in plants. Annual Review Ecology System 17: 667-693.
- Taiz, L. & Zeiger, E. 2002. Plant physilogy. 3 ed. Sinauer, Sunderland.
- Tian, M., Yu, G., Yu, G., He, N. & Hou, J. 2016. morphological and anatomical traits from tropical to temperate coniferous forests: Mechanisms and influencing factors. Scientific Reports 6: 19703.
- Turner, I.M. 1994. A quantitative analysis of leaf form in woody plants from the world's major broadleaved forest types. Journal of Biogeography 21: 413-419.
- Valladares, F., Aranda, I. & Sánchez-Gomes, D. 2004. La luz como factor ecológico y evolutivo para las plantas y su interacción con el agua. In: Ministerio de Medio Ambiente. Ecología del bosque mediterráneo en un mundo cambiante. EGRAF, Madrid, pp.335-369.
- Valladares, F., Gianoli, E. & Gómez, J.M. 2007. Ecological limits to plant phenotypic plasticity. New Phytologist 176: 749-763.
- Valladares, F., Matesanz, S., Guilhaumon, F., Araújo, M.B., Balaguer, L., Benito-Garzón, M., Cornwell, W., Gianoli, E., van Kleunen, M., Naya, D.E., Nicotra, A.B., Poorter, H. & Zavala, M.A. 2014. The effects of phenotypic plasticity and local adaptation on forecasts of species range shifts under climate change. Ecology Letters 17: 1351-1364.
- Viets, F.G. 1944. Calcium and other polyvalent cations as accelerators of ion accumulation by excised barley roots. Plant Physiology 19: 466-480.
- West-Eberhard, M.J. 2005. Developmental plasticity and the origin of species diferences. Proceedings of the National Academy of Sciences 102: 6543-6549.
Datas de Publicação
-
Publicação nesta coleção
Apr-Jun 2018
Histórico
-
Recebido
27 Set 2017 -
Aceito
07 Mar 2018