RESUMO
JUSTIFICATIVA E OBJETIVOS:
Opioides são fármacos utilizados para o alívio da dor, porém, podem causar aumento da sensibilidade dolorosa, denominada hiperalgesia induzida por opioides, que afeta negativamente o tratamento da dor. O objetivo deste estudo foi avaliar se o fentanil, opioide amplamente utilizado na prática clínica, produz hiperalgesia que pode ser atenuada pela duloxetina, fluoxetina e pregabalina.
MÉTODOS:
Trinta ratos Wistar machos, foram divididos em 6 grupos. No grupo 1, os animais receberam 1mL de solução fisiológica (SF) a 0,9% por via intraperitoneal (IP) e por gavagem; no grupo 2, fentanil na dose de 100µg.kg-1 IP e SF a 0,9% por gavagem; nos grupos 3, 4 e 5 os animais receberam fentanil na dose de 100µg.kg-1 IP e, por gavagem, receberam respectivamente duloxetina, 40mg.kg-1, fluoxetina, 40mg.kg-1 e pregabalina, 40mg.kg-1. A avaliação da hiperalgesia e sua atenuação foi feita pela aplicação de filamentos de Von Frey, na 2ª hora e nos dias 1, 3, 5 e 7, após o tratamento.
RESULTADOS:
Na 2ª hora pós-procedimento não foram observadas diferenças entre G1 e G2, entretanto, G3, G4 e G5 se mostraram com menor hiperalgesia. No 1º e 3º dias foi observado maior efeito hiperalgésico em G2 quando comparado com G1, G3, G4 e G5. No 5º dia foi observado efeito hiperalgésico no G2, e no 7º dia não houve diferenças entre os grupos.
CONCLUSÃO:
Os resultados sugerem que o fentanil induz hiperalgesia e eficácia da duloxetina, fluoxetina e pregabalina na sua redução.
Descritores:
Duloxetina; Fentanil; Fluoxetina; Hiperalgesia; Pregabalina; Ratos
ABSTRACT
BACKGROUND AND OBJECTIVES:
Opioids are drugs used to relieve pain, but may cause increased pain sensitivity, known as opioid-induced hyperalgesia, which adversely affects pain management. This study aimed to check if fentanyl, an opioid widely used in the clinical practice, produces hyperalgesia that can be attenuated by duloxetine, fluoxetine and pregabalin.
METHODS:
Thirty male Wistar rats were divided into six groups. The animals in group 1 received 1mL of 0.9% saline solution intraperitoneally (IP) and gavage; group 2 received fentanyl at a dose of 100µg.kg-1 IP and 0.9% saline solution per gavage; groups 3, 4 and 5 received fentanyl at the dose of 100µg.kg-1 IP, and gavage with duloxetine, 40mg.kg-1, fluoxetine, 40mg.kg-1 and pregabalin, 40mg.kg-1, respectively. Under general anesthesia with isoflurane, all animals were submitted to plantar surgical incision. The application of Von Frey filaments assessed hyperalgesia at the second hour, one, three, five and seven days after treatment.
RESULTS:
Two hours after the procedure, no differences were observed between G1 and G2, although G3, G4, and G5 showed less hyperalgesia. On day one and day three, a greater hyperalgesic effect was observed in G2 when compared to G1, G3, G4 and G5. On day five, there was a hyperalgesic effect on G2, and on day seven, there were no differences among the groups.
CONCLUSION:
The results suggest that fentanyl induces hyperalgesia and the efficacy of duloxetine, fluoxetine, and pregabalin in reducing it.
Keywords:
Duloxetine; Fentanyl; Fluoxetine; Hyperalgesia; Pregabalin; Rats
INTRODUÇÃO
A dor é uma das mais importantes e complexas experiências humanas, associada à lesão tecidual real ou potencial, e o seu tratamento com opioides aumentou substancialmente nos últimos anos, tornando-os comumente prescritos nos Estados Unidos11 Pain terms: a list with definition and note on usage. Recommended by the IASP subcommittee on taxonomy. Pain. 1979;6(3):249.,22 Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87.. No entanto, o aumento de prescrições tem causado muitos problemas, entre os quais estão a falta de conhecimento referente à eficácia em longo prazo, uso abusivo e eventos adversos associados ao uso prolongado, incluindo a hiperalgesia induzida por opioides (HIO), fenômeno pelo qual, paradoxalmente, o opioide pode induzir ou sensibilizar os pacientes à dor aguda33 Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96.,44 Silverman SM. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12(3):679-84.. Nesse sentido, pacientes que recebem altas doses de opioides podem sofrer intensa dor aguda após a cirurgia, com aumento da dose de analgésicos, e ansiedade tanto para o paciente quanto para o médico44 Silverman SM. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12(3):679-84..
Múltiplos são os mecanismos propostos como responsáveis pela HIO, entre os quais alterações de receptores N-metil-D-aspartato (NMDA) e segundos mensageiros, ativação de ciclo-oxigenase (COX) espinhal, liberação de aminoácidos excitatórios, redução de neurotransmissores inibitórios, facilitação descendente e o sistema antianalgésico22 Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87.,33 Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96.,55 Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100(3):213-7.,66 Vanderah TW, Ossipov MH, Lai J, Malan TP Jr, Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain. 2001;92(1-2):5-9..
O aumento da liberação de glutamato no corno dorsal da medula espinhal, e o consequente aumento mantido de estímulo e resposta dos receptores NMDA pela remoção de magnésio mediada por proteinocinase-C parecem ser importantes mecanismos implicados na HIO77 Reznikov I, Pud D, Eisenberg E. Oral opioid administration and hyperalgesia in patients with cancer or chronic nonmalignant pain. Br J Clin Pharmacol. 2005;60(3):311-8.. Esses receptores NMDA podem ser ativados por opioides, que atuam como neurotransmissores excitatórios facilitando a entrada de cálcio na célula e sensibilização central (SC). A entrada de cálcio provoca aumento da atividade da proteinocinase-C, fosforilação e inativação de receptores opioides, além de causar aumento de óxido nítrico sintase88 Célèrier E, Rivat C, Jun Y, Laulin JP, Larcher A, Reynier P, et al. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology. 2000;92(2):465-72..
A HIO tem sido associada ao aumento de colecistocinina, peptídeo relacionado ao gene da calcitonina (CGRP), substância-P e nociceptina na medula rostral ventromedial devido ao aumento da expressão dos receptores opioides excitatórios, em detrimento dos receptores opioides inibitórios55 Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100(3):213-7.,99 Simonnet G, Rivat C. Opioid-induced hyperalgesia: abnormal or normal pain? Neuroreport. 2003;14(1):1-7.,1010 Ossipov MH, Lai J, King T, Vanderah TW, Porreca F. Underlying mechanisms of pronociceptive consequences of prolonged morphine exposure. Biopolymers. 2005;80(2-3):319-24..
As vias descendentes facilitadoras, mediadas por opioides, localizadas na medula rostral ventromedial, também parecem estar envolvidas na HIO devido a alterações neuroplásticas, visto que a exposição à morfina causa alteração neuroplástica na medula rostral ventromedial, com aumento da liberação de dinorfina e neurotransmissores de fibras aferentes primárias33 Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96.,66 Vanderah TW, Ossipov MH, Lai J, Malan TP Jr, Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain. 2001;92(1-2):5-9.,1111 Gebhart GF. Descending modulation of pain. Neurosci Biobehav Rev. 2004;27(8):729-37.. Nessa linha, a administração de opioide provocaria aumento de dinorfina, que pode favorecer a HIO55 Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100(3):213-7.,66 Vanderah TW, Ossipov MH, Lai J, Malan TP Jr, Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain. 2001;92(1-2):5-9..
Há evidências de que a dinorfina espinhal é pronociceptiva, provocando liberação de neurotransmissores excitatórios de neurônios aferentes primários, sugerindo retroalimentação positiva, amplificando a aferência sensitiva66 Vanderah TW, Ossipov MH, Lai J, Malan TP Jr, Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain. 2001;92(1-2):5-9.. Além disso, as prostaglandinas, as citocinas e as quimocinas também podem ser relevantes no desenvolvimento de HIO, visto que os opioides ativam a liberação de citocinas, com aumento de proteína C-fos em neurônios sensitivos da medula. Outros sistemas que podem estar envolvidos na HIO com redução do controle inibitório glicinérgico são o óxido nítrico sintase e a hemo-oxigenase22 Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87.,33 Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96..
Estudos em roedores têm demonstrado que o fentanil causa HIO e sugerido que a proteína quinase IIa (CaMKIIa) dependente de Ca2+/calmodulina na cápsula lateral do núcleo central da amígdala (CeLC) e na medula espinhal pode desempenhar papel fundamental na modulação da HIO1212 Li Z, Li C, Yin P, Wang ZJ, Luo F. Inhibition of CaMKIIa in the central nucleus of amygdala attenuates fentanyl-induced hyperalgesia in rats. J Pharmacol Exp Ther. 2016;359(1):82-9.,1313 Li Z, Yin P, Chen J, Jin S, Liu J, Luo F. CaMKIIa may modulate fentanyl-induced hyperalgesia via a CeLC-PAG-RVM-spinal cord descending facilitative pain pathway in rats. PLoS One. 2017;12(5):e0177412..
A duloxetina, fármaco antidepressivo da classe dos inibidores seletivos da recaptação de serotonina e noradrenalina (ISRSN), é indicada no tratamento do transtorno depressivo, transtorno de ansiedade generalizada e em condições dolorosas crônicas, como a dor neuropática diabética, fibromialgia e dores musculoesqueléticas crônicas1414 Pergolizzi JV Jr, Raffa RB, Taylor R Jr, Rodriguez G, Nalamachu S, Langley P. A review of duloxetine 60 mg once-daily dosing for the management of diabetic peripheral neuropathic pain, fibromyalgia, and chronic musculoskeletal pain due to chronic osteoarthritis pain and low back pain. Pain Pract. 2013;13(3):239-52..
O papel da serotonina e da noradrenalina na regulação do humor ocorre por meio das vias neuronais ascendentes, a partir da porção média do cérebro, estendendo-se para o sistema límbico e para o córtex pré-frontal. Além disso, as projeções noradrenérgicas e serotoninérgicas do tronco cerebral descem pela medula espinhal, onde se acredita estarem envolvidas na regulação da percepção somática sensorial. Alterações nas vias serotoninérgicas e noradrenérgicas modificam tanto a percepção cerebral dos estímulos sensoriais das vias ascendentes, como alteram o mecanismo de inibição da dor pelas vias descentes. A depressão e a dor crônica compartilham essas vias neuronais serotoninérgicas e noradrenérgicas, razão pela qual a duloxetina tem se mostrado eficaz nessas duas condições1515 Smith HS, Harris R, Clauw D. Fibromyalgia: an afferent processing disorder leading to a complex pain generalized syndrome. Pain Physician. 2011;14(2):E217-45..
A duloxetina se mostrou eficaz em condições dolorosas crônicas como a fibromialgia, a neuropatia diabética periférica, sintomas dolorosos da osteoartrite do joelho e dores lombares crônicas. Há também evidências de alívio dos sintomas dolorosos associados à depressão e ao transtorno de ansiedade generalizada1616 Chappell AS, Ossanna MJ, Liu-Seifert H, Iyengar S, Skljarevski V, Li LC, et al. Duloxetine, a centrally acting analgesic, in the treatment of patients with osteoarthritis knee pain: a 13-week, randomized, placebo-controlled trial. Pain. 2009;146(3):253-60..
O efeito da fluoxetina sobre o sistema serotoninérgico (ISRS) é conhecido, evidenciando a fluoxetina como opção de tratamento para diferentes condições de dor crônica como fibromialgia, cefaleia do tipo tensional crônica, enxaqueca sem aura, neuropatia diabética dolorosa, dor musculoesquelética, dor pélvica crônica e síndrome coronariana1717 Dharmshaktu P, Tayal V, Kalra BS. Efficacy of antidepressants as analgesics: a review. J Clin Pharmacol. 2012;52(1):6-17.. Devido aos efeitos dos ISRS elevando a serotonina no sistema nervoso central (SNC), postula-se que a duloxetina e a fluoxetina podem ter utilidade na atenuação da HIO.
O envolvimento da neurotransmissão do glutamato na plasticidade sináptica sugere que a pregabalina também pode ser útil na atenuação da HIO1818 Micó JA, Prieto R. Elucidating the mechanism of action of pregabalin: a(2)d as a therapeutic target in anxiety. CNS Drugs. 2012;26(8):637-48., sendo um fármaco análogo do GABA, que se liga seletivamente com alta afinidade aos canais de cálcio, amplamente distribuídos no SNC e periférico, produzindo efeito modulador com redução da liberação excessiva de vários neurotransmissores excitatórios.
Diversos ensaios clínicos documentaram seu efeito no alívio da dor e na qualidade de vida, incluindo humor e distúrbios do sono, sendo, portanto, indicada para o tratamento da fibromialgia, dor neuropática e transtorno de ansiedade generalizada1818 Micó JA, Prieto R. Elucidating the mechanism of action of pregabalin: a(2)d as a therapeutic target in anxiety. CNS Drugs. 2012;26(8):637-48.,1919 Bellato E, Marini E, Castoldi F, Barbasetti N, Mattei L, Bonasia DE, et al. Fibromyalgia syndrome: etiology, pathogenesis, diagnosis, and treatment. Pain Res Treat. 2012;2012:426130..
A pregabalina tem mostrado eficácia no tratamento da fibromialgia, com melhora de vários parâmetros do sono. Foi evidenciada a redução da dor, independentemente ou não de sintomas de ansiedade ou depressão, sugerindo que a redução da dor propiciada pela pregabalina resulta, principalmente, de efeito direto do tratamento, e não de efeito indireto pela melhora dos sintomas de ansiedade e depressão2020 Crofford LJ, Rowbotham MC, Mease PJ, Russell IJ, Dworkin RH, Corbin AE, et al. Pregabalin for the treatment of fibromyalgia syndrome: results of a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2005;52(4):1264-73..
Testes comportamentais como a aplicação de filamentos de von Frey e hiperalgesia térmica têm sido utilizados para a avaliação da hiperalgesia em ratos2121 Brennan TJ, Vandermeulen EP, Gebhart GF. Characterization of a rat model of incisional pain. Pain. 1996;64(3):493-501.. Neste estudo foi utilizado o teste com os filamentos de von Frey com o objetivo de avaliar se o fentanil, opioide amplamente utilizado na prática clínica, produz hiperalgesia que pode sofrer interferência dos fármacos duloxetina, fluoxetina e pregabalina.
MÉTODOS
Foram utilizados, pelas características da amostra animal e por conveniência, 30 ratos Wistar machos, pesando entre 220 e 300g, alocados em número de 5 animais por compartimento, onde permaneceram por 15 dias antes do início do experimento para adequada adaptação, tratados com ração balanceada comercial e água “ad libitum”, ciclo claro-escuro de 12 horas e temperatura ambiente variando entre 19 e 25ºC.
Para a realização dos procedimentos experimentais foram obedecidas as Normas Éticas da IASP, que regula experimentos realizados em animais (Committee for Research and Ethical Issues of the IASP, 1983). Todos os experimentos foram realizados nas dependências do Laboratório de Farmacologia e Fisiologia da Universidade de Taubaté, SP.
Para obter indução anestésica suave, os animais foram colocados em uma câmara de vidro transparente com medidas de 15x25x15cm, dotada de cobertura transparente para possibilitar a visualização do animal, com orifício na parte anterior e posterior para permitir entrada e saída de oxigênio (O2), gases anestésicos e gás carbônico, respectivamente. O agente halogenado utilizado na indução anestésica foi o isoflurano (Isoforine®, Cristália, Itapira, Brasil), na concentração de 4,0% em fração inspirada de oxigênio (FiO2) de 1,0, administrado por vaporizador calibrado (HB Hospitalar) e mantido por três minutos, tempo necessário para que o animal apresentasse perda dos reflexos posturais e incapacidade de se deslocar na câmara. A seguir, o animal foi retirado da câmara e posicionado com o focinho em uma máscara por onde recebia isoflurano a 4% em O2 como na câmara de indução da anestesia.
O procedimento cirúrgico constou de uma incisão cirúrgica, longitudinal, de 1,0cm de extensão, na pata posterior direita, de acordo com o modelo de dor pós-operatória2121 Brennan TJ, Vandermeulen EP, Gebhart GF. Characterization of a rat model of incisional pain. Pain. 1996;64(3):493-501.. Essa incisão foi realizada com o auxílio de um bisturi com lâmina número 11, incisando a pele e a fáscia da região plantar da pata, iniciando-se a 0,5cm da borda do calcâneo e estendendo-se em direção aos pododáctilos. A seguir, o músculo plantar foi elevado e incisado longitudinalmente, permanecendo a sua inserção intata. Após hemostasia com leve pressão sobre a área cirúrgica, todos os planos foram aproximados e suturados com dois pontos separados com fio agulhado mononylon 4-0.
Os animais foram divididos aleatoriamente em seis grupos para receber volumes semelhantes de fármacos ou solução fisiológica (SF) a 0,9%. No grupo 1, os animais receberam 1mL de SF a 0,9% por via intraperitoneal (IP) e por gavagem; grupo 2 fentanil (100µg.kg-1) (IP) em dose única e SF a 0,9% por gavagem; grupo 3 fentanil (100µg.kg-1) (IP) em dose única e duloxetina (40mg.kg-1) por gavagem; grupo 4 fentanil (100µg.kg-1) (IP) em dose única e fluoxetina (40mg.kg-1) por gavagem e, grupo 5 fentanil (100µg.kg-1) (IP) em dose única e pregabalina (40mg.kg-1) por gavagem.
A avaliação da hiperalgesia foi realizada pela aplicação do teste de filamentos de von Frey2121 Brennan TJ, Vandermeulen EP, Gebhart GF. Characterization of a rat model of incisional pain. Pain. 1996;64(3):493-501.. Os animais foram alojados em uma câmara de madeira, com piso de tela galvanizada quadriculada de 0,5cm. Sob o piso foi acoplado um espelho que permitiu ao pesquisador observar a aplicação do filamento e o reflexo de retirada do membro. Antes da aplicação do filamento, os animais foram mantidos na caixa por cerca de 15 minutos para adaptação. Cada um dos filamentos, em ordem crescente de pressão, foi aplicado três vezes consecutivas com intervalo de 3 a 5 segundos, passando-se então ao filamento seguinte, sendo considerada resposta positiva quando o animal retirava o apoio do membro lesionado do piso à aplicação do filamento. Foi considerado valor zero de pressão quando os animais se apresentaram com o membro totalmente recolhido, ou seja, não sendo necessário nenhum estímulo para que o animal recolhesse o apoio do membro. Os dados colhidos foram registrados em uma ficha de coleta de dados específica para cada animal nos momentos: 2ª hora, 1, 3, 5 e 7 dias após o procedimento cirúrgico e administração dos tratamentos.
O projeto teve início após aprovação pelo Comitê de Ética no Uso de Animais CEUA/UNITAU, sob o nº 03/2017.
Análise estatística
Foi utilizado o software JMP® do SAS (Statistical Analysis System) Institute, aplicando-se o teste t de Student, comparando par a par e adotando nível de significância menor que 5% (p<0,05).
RESULTADOS
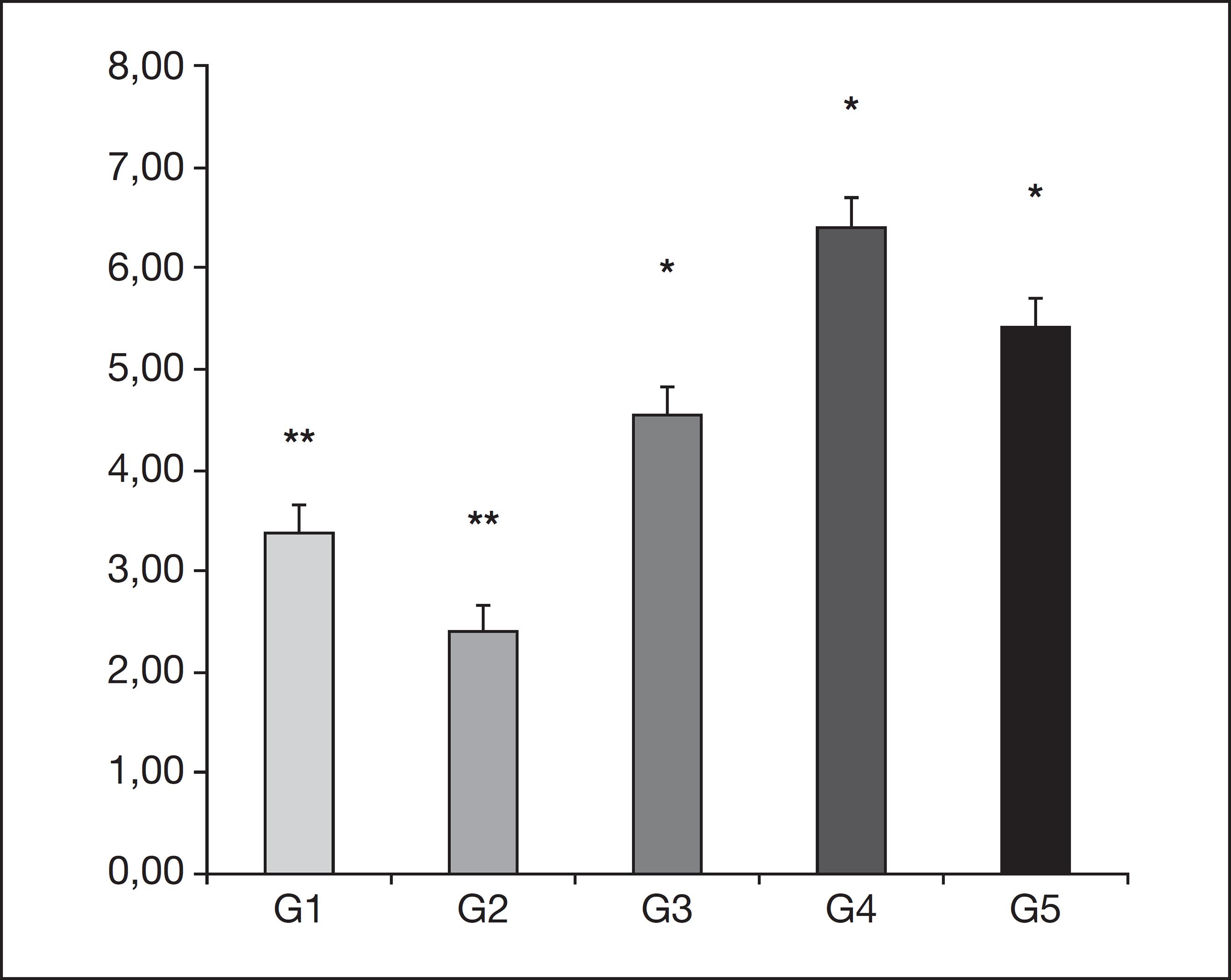
Ao se comparar o peso médio dos animais antes do início do experimento, não houve diferença estatisticamente significante entre os grupos (p<0,05). Na 2ª hora após o procedimento cirúrgico, a intensidade da dor, avaliada pelos filamentos de von Frey estão expressas na figura 1, mostrando não haver diferença significante quando comparado o G1 com o G2 (p=0,3759), mas com significância estatística quando estes foram comparados aos grupos G3, G4 e G5 (p<0,05).
Teste t de Student não mostrou diferença significativa quando comparado G1** com G2** (p=0,3759), mas com significância estatística quando comparado com G3*, G4* e G5* (p<0,05).
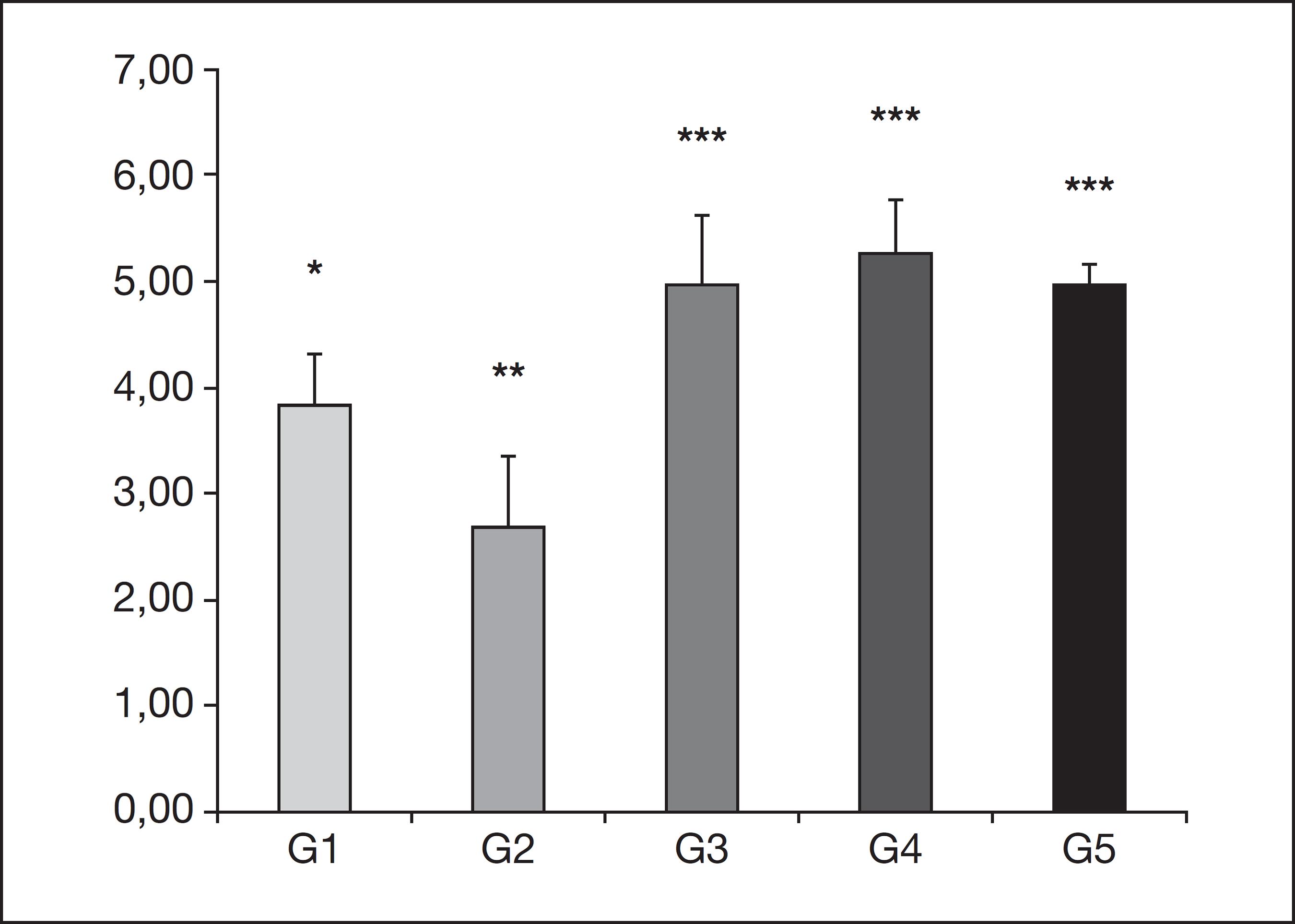
No primeiro dia após o procedimento cirúrgico, a intensidade da dor, avaliada pelos filamentos de von Frey, está expressa na figura 2, mostrando diferença significante entre G1 e G2 (p<0,05) e, entre estes e os grupos G3, G4 e G5 (p<0,01).
Teste t de Student mostrou diferença significativa quando comparou o G1* com o G2** e com o G3***, G4*** e G5*** (p<0,01).
No terceiro dia após o procedimento cirúrgico, a intensidade da dor, avaliada pelos filamentos de von Frey, está expressa na figura 3, mostrando diferença significante entre o G1 e G2 (p<0,05) e, entre estes e os grupos G3, G4 e G5 (p<0,01).
Teste t de Student mostrou diferença significante quando comparou o G1* com o G2** (p<0,05) e com o G3***, G4*** e G5*** (p<0,01).
No 5º dia após o procedimento cirúrgico, a intensidade da dor, avaliada pelos filamentos de von Frey, está expressa na figura 4, mostrando diferença significante entre G2 e os grupos G1, G3, G4 e G5 (p<0,05).
Teste t de Student mostrou diferença significante quando comparou o G2* com os grupos G1, G3, G4 e G5 (p<0,05)
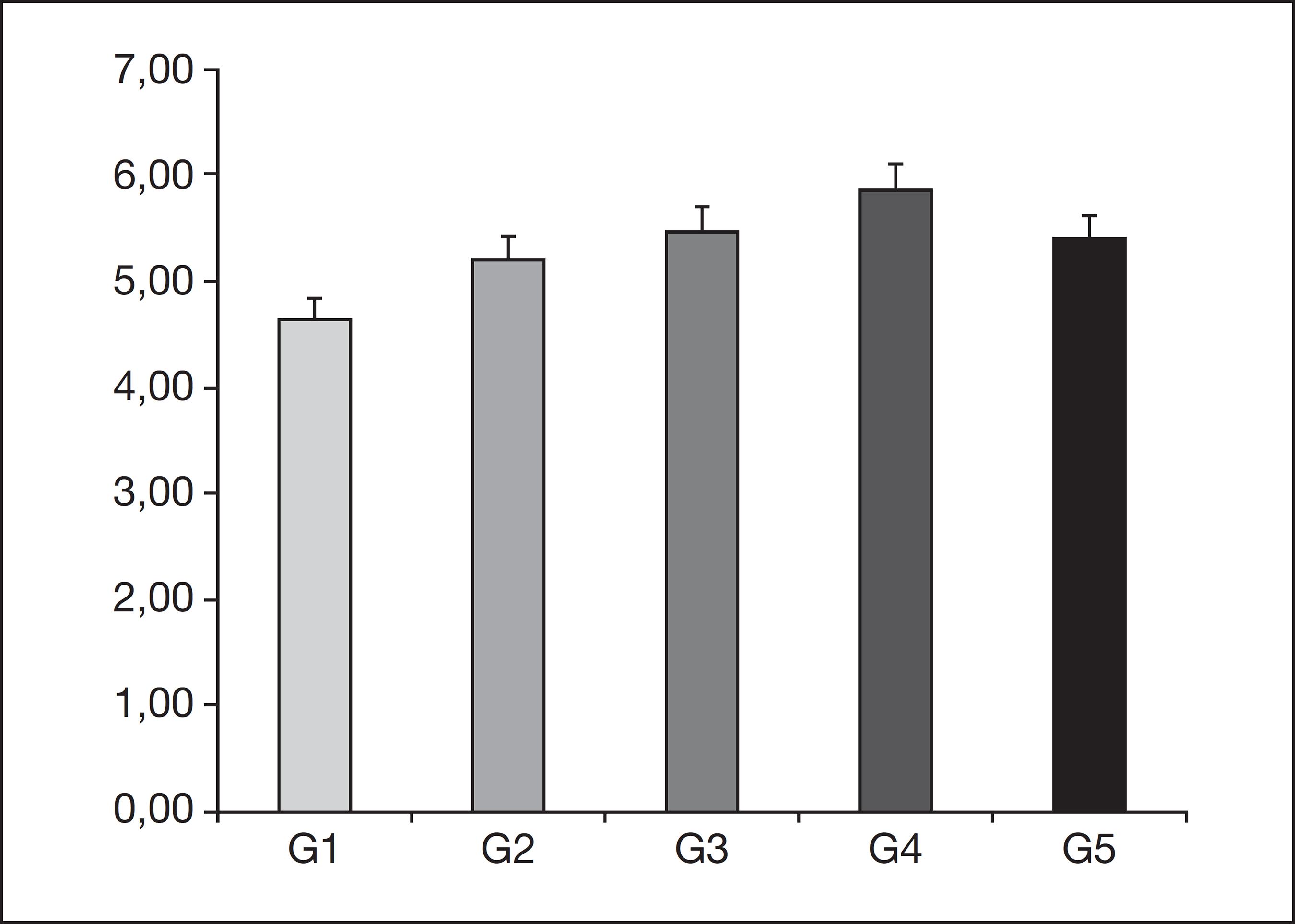
No 7º dia após o procedimento cirúrgico, a intensidade da dor, avaliada pelos filamentos de von Frey, está expressa na figura 5, sem mostrar diferença significante entre os grupos.
DISCUSSÃO
Os opioides são fármacos fundamentais para o tratamento da dor. Porém, ao mesmo tempo em que inicialmente são analgésicos e anti-hiperalgésicos, posteriormente podem provocar hiperalgesia, tornando o paciente mais sensível à dor22 Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87.
3 Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96.
4 Silverman SM. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12(3):679-84.-55 Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100(3):213-7..
A HIO tem sido atribuída à dessensibilização aguda de receptores por descarrilamento da proteína G dos receptores opioides, ativação dos receptores NMDA, entre outros mecanismos22 Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87..
Um estudo evidenciou que o uso concomitante de baixas doses de antagonistas opioides e antagonistas dos receptores NMDA podem prevenir ou reduzir o desenvolvimento da HIO, e que a cetamina em baixa dose pode modular a HIO77 Reznikov I, Pud D, Eisenberg E. Oral opioid administration and hyperalgesia in patients with cancer or chronic nonmalignant pain. Br J Clin Pharmacol. 2005;60(3):311-8.,2222 DuPen A, Shen D, Ersek M. Mechanisms of opioid-induced tolerance and hyperalgesia. Pain Manag Nurs. 2007;8(3):113-21.,2323 Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology. 2005;103(1):147-55..
Uma revisão comprova que os mecanismos implicados no desenvolvimento da HIO incluem o sistema glutamatérgico e receptores NMDA, ativação de ciclo-oxigenase espinhal, aminoácidos excitatórios, dinorfinas, citocinas e quimocinas, prostaglandinas e facilitação descendente. Nesse sentido, especula-se que a modulação da hiperalgesia pode ser feita com antagonistas de receptores NMDA, agonistas alfa-2 adrenérgicos, inibidores seletivos da recaptação de serotonina, inibidores de cicloxigenases e análogos do GABA2424 Leal P da C, Clivatti J, Garcia JB, Sakata RK. Opioid-induced hyperalgesia (HIO). Rev Bras Anestesiol. 2010;60(6):639-47. English, Portuguese, Spanish..
Em acordo com os presentes resultados, um estudo utilizando fentanil em ratos Sprague-Dawuley provocou a HIO e demonstrou efeito atenuante pelos fármacos duloxetina e pregabalina1212 Li Z, Li C, Yin P, Wang ZJ, Luo F. Inhibition of CaMKIIa in the central nucleus of amygdala attenuates fentanyl-induced hyperalgesia in rats. J Pharmacol Exp Ther. 2016;359(1):82-9..
No presente estudo, na 2ª hora após o procedimento cirúrgico, não se observou diferenças entre os grupos controle, que receberam SF por via IP associado à SF por gavagem em comparação com o grupo que recebeu fentanil por via IP associado à SF por gavagem. Entretanto, quando se comparou estes com os animais que receberam duloxetina, fluoxetina ou pregabalina, foi encontrada menor hiperalgesia, demonstrando possível envolvimento dos receptores de serotonina, noradrenalina e redução de neurotransmissores pró-nociceptivos dependentes de cálcio, na liberação na medula espinhal, em concordância com outros estudos2525 Mixcoatl-Zecuatl T, Jolivalt CG. A spinal mechanism of action for duloxetine in a rat model of painful diabetic neuropathy. Br J Pharmacol. 2011;164(1):159-69.
26 Nakajima K, Obata H, Iriuchijima N, Saito S. An increase in spinal cord noradrenaline is a major contributor to the antihyperalgesic effect of antidepressants after peripheral nerve injury in the rat. Pain. 2012;153(5):990-7.-2727 Andersen J, Stuhr-Hansen N, Zachariassen LG, Koldsø H, Schiøtt B, Strømgaard K, et al. Molecular basis for selective serotonin reuptake inhibition by the antidepressant agent fluoxetine (Prozac). Mol Pharmacol. 2014,85(5):703-14..
Quando os animais foram avaliados no 1º e 3º dia após o procedimento cirúrgico, o grupo que recebeu fentanil por via IP apresentou maior efeito hiperálgico e com diferença estatisticamente significante em relação ao grupo controle, evidenciando a HIO. Entretanto, o grupo que recebeu fentanil por via IP, além de apresentar diferença significante em relação ao controle com SF, exibiu diferença em relação ao grupo duloxetina, fluoxetina e pregabalina, que se mostraram diferentes do grupo controle que recebeu SF, sugerindo eficácia em reduzir a HIO.
No 5º dia após o procedimento cirúrgico, o grupo que recebeu fentanil manteve maior resposta álgica quando comparado aos outros grupos. Porém, embora o G1, que recebeu SF, tenha mostrado menor efeito hiperálgico em comparação ao grupo fentanil, não apresentou diferença em comparação aos grupos que receberam duloxetina, fluoxetina ou pregabalina, evidenciando ainda a presença de HIO.
No 7º dia não se observou diferenças entre os grupos, ou seja, o possível efeito residual da hiperalgesia induzida por dose única de fentanil não foi evidenciado.
Estudos utilizando duloxetina e fluoxetina no combate à dor em roedores apoiam os resultados deste estudo, que a 5-HT e a NE desempenham importante papel na atenuação dos mecanismos de dor persistente, presumivelmente por vias modulatórias descendentes da dor e consequentemente na HIO2828 Iyengar S, Webster AA, Hemrick-Luecke SK, Xu JY, Simmons RM. Efficacy of duloxetine, a potent and balanced serotonin-norepinephrine reuptake inhibitor in persistent pain models in rats. J Pharmacol Exp Ther. 2004;311(2):576-84.
29 Mixcoatl-Zecuatl T, Jolivalt CG. A spinal mechanism of action for duloxetine in a rat model of painful diabetic neuropathy. Br J Pharmacol. 2011;164(1):159-69.-3030 Obata H. Analgesic mechanisms of antidepressants for neuropathic pain. Int J Mol Sci. 2017;18(11): pii2483..
O uso de pregabalina sobre o comportamento nociceptivo e a SC em modelo de dor trigeminal em ratos, atenuando a alodinia mecânica e a SC sobre o modelo de dor trigeminal referenda seu uso clínico no tratamento da dor e, embora sejam escassos estudos com a HIO, há evidencia que poder ser útil no controle desse tipo de dor3131 Cao Y, Wang H, Chiang CY, Dostrovsky JO, Sessle BJ. Pregabalin suppresses nociceptive behavior and central sensitization in a rat trigeminal neuropathic pain model. J Pain. 2013;14(2):193-204..
CONCLUSÃO
O presente estudo apresentou evidências de que o fentanil produz HIO e de provável efeito atenuante mediado pela serotonina e noradrenalina e pelo bloqueio de canais de cálcio, pelos fármacos duloxetina, fluoxetina e pregabalina.
-
Oscar César Pires - https://orcid.org/0000-0002-7033-0764;
-
Maria Luiza Dalcim - https://orcid.org/0000-0002-5942-9691;
-
Ana Luiza Montes Pigozzi - https://orcid.org/0000-0001-5623-6096;
-
Fabiana Mara Scarpelli de Lima Alvarenga Caldeira - https://orcid.org/0000-0001-9084-9822;
-
Marta Helena Rovani Pires - https://orcid.org/0000-0003-0592-5304;
-
Lafayette de Almeida Neto - https://orcid.org/0000-0002-5449-3344;
-
Irimar de Paula Posso - http://orcid.org/0000-0003-0337-2531.
-
Fontes de fomento: não há.
REFERENCES
-
1Pain terms: a list with definition and note on usage. Recommended by the IASP subcommittee on taxonomy. Pain. 1979;6(3):249.
-
2Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104(3):570-87.
-
3Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24(6):479-96.
-
4Silverman SM. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12(3):679-84.
-
5Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100(3):213-7.
-
6Vanderah TW, Ossipov MH, Lai J, Malan TP Jr, Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain. 2001;92(1-2):5-9.
-
7Reznikov I, Pud D, Eisenberg E. Oral opioid administration and hyperalgesia in patients with cancer or chronic nonmalignant pain. Br J Clin Pharmacol. 2005;60(3):311-8.
-
8Célèrier E, Rivat C, Jun Y, Laulin JP, Larcher A, Reynier P, et al. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology. 2000;92(2):465-72.
-
9Simonnet G, Rivat C. Opioid-induced hyperalgesia: abnormal or normal pain? Neuroreport. 2003;14(1):1-7.
-
10Ossipov MH, Lai J, King T, Vanderah TW, Porreca F. Underlying mechanisms of pronociceptive consequences of prolonged morphine exposure. Biopolymers. 2005;80(2-3):319-24.
-
11Gebhart GF. Descending modulation of pain. Neurosci Biobehav Rev. 2004;27(8):729-37.
-
12Li Z, Li C, Yin P, Wang ZJ, Luo F. Inhibition of CaMKIIa in the central nucleus of amygdala attenuates fentanyl-induced hyperalgesia in rats. J Pharmacol Exp Ther. 2016;359(1):82-9.
-
13Li Z, Yin P, Chen J, Jin S, Liu J, Luo F. CaMKIIa may modulate fentanyl-induced hyperalgesia via a CeLC-PAG-RVM-spinal cord descending facilitative pain pathway in rats. PLoS One. 2017;12(5):e0177412.
-
14Pergolizzi JV Jr, Raffa RB, Taylor R Jr, Rodriguez G, Nalamachu S, Langley P. A review of duloxetine 60 mg once-daily dosing for the management of diabetic peripheral neuropathic pain, fibromyalgia, and chronic musculoskeletal pain due to chronic osteoarthritis pain and low back pain. Pain Pract. 2013;13(3):239-52.
-
15Smith HS, Harris R, Clauw D. Fibromyalgia: an afferent processing disorder leading to a complex pain generalized syndrome. Pain Physician. 2011;14(2):E217-45.
-
16Chappell AS, Ossanna MJ, Liu-Seifert H, Iyengar S, Skljarevski V, Li LC, et al. Duloxetine, a centrally acting analgesic, in the treatment of patients with osteoarthritis knee pain: a 13-week, randomized, placebo-controlled trial. Pain. 2009;146(3):253-60.
-
17Dharmshaktu P, Tayal V, Kalra BS. Efficacy of antidepressants as analgesics: a review. J Clin Pharmacol. 2012;52(1):6-17.
-
18Micó JA, Prieto R. Elucidating the mechanism of action of pregabalin: a(2)d as a therapeutic target in anxiety. CNS Drugs. 2012;26(8):637-48.
-
19Bellato E, Marini E, Castoldi F, Barbasetti N, Mattei L, Bonasia DE, et al. Fibromyalgia syndrome: etiology, pathogenesis, diagnosis, and treatment. Pain Res Treat. 2012;2012:426130.
-
20Crofford LJ, Rowbotham MC, Mease PJ, Russell IJ, Dworkin RH, Corbin AE, et al. Pregabalin for the treatment of fibromyalgia syndrome: results of a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2005;52(4):1264-73.
-
21Brennan TJ, Vandermeulen EP, Gebhart GF. Characterization of a rat model of incisional pain. Pain. 1996;64(3):493-501.
-
22DuPen A, Shen D, Ersek M. Mechanisms of opioid-induced tolerance and hyperalgesia. Pain Manag Nurs. 2007;8(3):113-21.
-
23Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology. 2005;103(1):147-55.
-
24Leal P da C, Clivatti J, Garcia JB, Sakata RK. Opioid-induced hyperalgesia (HIO). Rev Bras Anestesiol. 2010;60(6):639-47. English, Portuguese, Spanish.
-
25Mixcoatl-Zecuatl T, Jolivalt CG. A spinal mechanism of action for duloxetine in a rat model of painful diabetic neuropathy. Br J Pharmacol. 2011;164(1):159-69.
-
26Nakajima K, Obata H, Iriuchijima N, Saito S. An increase in spinal cord noradrenaline is a major contributor to the antihyperalgesic effect of antidepressants after peripheral nerve injury in the rat. Pain. 2012;153(5):990-7.
-
27Andersen J, Stuhr-Hansen N, Zachariassen LG, Koldsø H, Schiøtt B, Strømgaard K, et al. Molecular basis for selective serotonin reuptake inhibition by the antidepressant agent fluoxetine (Prozac). Mol Pharmacol. 2014,85(5):703-14.
-
28Iyengar S, Webster AA, Hemrick-Luecke SK, Xu JY, Simmons RM. Efficacy of duloxetine, a potent and balanced serotonin-norepinephrine reuptake inhibitor in persistent pain models in rats. J Pharmacol Exp Ther. 2004;311(2):576-84.
-
29Mixcoatl-Zecuatl T, Jolivalt CG. A spinal mechanism of action for duloxetine in a rat model of painful diabetic neuropathy. Br J Pharmacol. 2011;164(1):159-69.
-
30Obata H. Analgesic mechanisms of antidepressants for neuropathic pain. Int J Mol Sci. 2017;18(11): pii2483.
-
31Cao Y, Wang H, Chiang CY, Dostrovsky JO, Sessle BJ. Pregabalin suppresses nociceptive behavior and central sensitization in a rat trigeminal neuropathic pain model. J Pain. 2013;14(2):193-204.
Datas de Publicação
-
Publicação nesta coleção
27 Fev 2020 -
Data do Fascículo
Jan-Mar 2020
Histórico
-
Recebido
06 Mar 2019 -
Aceito
13 Dez 2019