Resumos
As matas de galeria são formações florestais que ocupam cerca de 10% da área dos cerrados e representam 1/3 da diversidade de espécies arbóreas ali encontradas. Estudos recentes têm demonstrado a importância dessas florestas em regiões do Brasil central, mas pouco se sabe sobre a fisiologia e plasticidade de espécies de mata de galeria em relação a variantes ambientais, como a irradiação solar. No presente estudo, foram comparados in situ aspectos fisiológicos e nutricionais de folhas de sol e sombra, em dez espécies arbóreas comumente encontradas em matas de galeria. Folhas de sol apresentaram maiores valores de assimilação de CO2 em base de área (Aarea), condutância estomática (gs), rendimento quântico do fotossistema II (ΦFSII) e uma maior fração de centros de reação abertos (qL), enquanto folhas de sombra apresentaram uma maior área foliar específica. Diferenças não foram encontradas para potencial hídrico foliar, assimilação de CO2 em base de massa e para a concentração foliar de macronutrientes. Dos atributos foliares analisados, a abertura estomática e o rendimento quântico do fotossistema II foram os principais fatores atuantes na Aarea em folhas de sol, enquanto em folhas de sombra apenas ΦFSII foi influente. As diferenças encontradas demonstram que, assim como em outras formações florestais, em mata de galeria as espécies arbóreas possuem a capacidade de se aclimatarem às condições contrastantes de sombreamento que ocorrem neste tipo de ambiente.
matas de galeria; fotossíntese; nitrogênio; fósforo; luz; fluorescência; trocas gasosas
Gallery forest is a forest formation that covers about 10% of the cerrado biome and represents about 1/3 of cerrado tree diversity in Brazil. Recent studies demonstrate the importance of gallery forest in central regions of Brazil, but little is known about the physiology and plasticity of gallery forest species in relation to environmental variability, particularly in terms of light availability. In this study we compared in situ physiological and nutritional aspects of shade and sun leaves, in ten tree species commonly found in gallery forests. Relative to shade leaves, sun leaves had higher values of CO2 assimilation rates on an area basis (Aarea), of stomatal conductance (gs), of quantum yield of Photosystem II (ΦPSIIL); and a larger fraction of PSII centers in the open state (qL), while shade leaves showed higher specific leaf area. However, shade and sun leaves did not differ in terms of leaf water potential, CO2 assimilation on a mass basis and in leaf concentrations of macronutrients. ΦPSII and gs were the main factors that influenced Aarea in sun leaves, while only ΦPSII significantly affected Aarea of shade leaves. The differences found here demonstrate that, like in other forest formations worldwide, gallery forest trees are able to acclimate to contrasting irradiance levels that typically occur in this type of environment.
gallery forest; photosynthesis; nitrogen; phosphorus; light; fluorescence; gas exchange
ARTIGOS
Características funcionais de folhas de sol e sombra de espécies arbóreas em uma mata de galeria no Distrito Federal, Brasil
Leaf functional traits in sun and shade leaves of gallery forest trees in Distrito Federal, Brazil
Davi Rodrigo RossattoI,III,* * Autor para correspondência: drrossatto@gmail.com ; Frederico Scherr Caldeira TakahashiI,III; Lucas de Carvalho Ramos SilvaII; Augusto César FrancoI
IUniversidade de Brasília, Instituto de Ciências Biológicas, Departamento de Botânica, Laboratório de Fisiologia Vegetal, Brasília, DF, Brasil
IIUniversity of Guelph, Department of Environmental Biology, Global Ecological Change Laboratory, Guelph, ON, Canada
IIIUniversidade de Brasília, Instituto de Ciências Biológicas, Pós-Graduação em Ecologia, Departamento de Ecologia, Brasília, DF, Brasil
RESUMO
As matas de galeria são formações florestais que ocupam cerca de 10% da área dos cerrados e representam 1/3 da diversidade de espécies arbóreas ali encontradas. Estudos recentes têm demonstrado a importância dessas florestas em regiões do Brasil central, mas pouco se sabe sobre a fisiologia e plasticidade de espécies de mata de galeria em relação a variantes ambientais, como a irradiação solar. No presente estudo, foram comparados in situ aspectos fisiológicos e nutricionais de folhas de sol e sombra, em dez espécies arbóreas comumente encontradas em matas de galeria. Folhas de sol apresentaram maiores valores de assimilação de CO2 em base de área (Aarea), condutância estomática (gs), rendimento quântico do fotossistema II (ΦFSII) e uma maior fração de centros de reação abertos (qL), enquanto folhas de sombra apresentaram uma maior área foliar específica. Diferenças não foram encontradas para potencial hídrico foliar, assimilação de CO2 em base de massa e para a concentração foliar de macronutrientes. Dos atributos foliares analisados, a abertura estomática e o rendimento quântico do fotossistema II foram os principais fatores atuantes na Aarea em folhas de sol, enquanto em folhas de sombra apenas ΦFSII foi influente. As diferenças encontradas demonstram que, assim como em outras formações florestais, em mata de galeria as espécies arbóreas possuem a capacidade de se aclimatarem às condições contrastantes de sombreamento que ocorrem neste tipo de ambiente.
Palavras-chave: matas de galeria, fotossíntese, nitrogênio, fósforo, luz, fluorescência, trocas gasosas
ABSTRACT
Gallery forest is a forest formation that covers about 10% of the cerrado biome and represents about 1/3 of cerrado tree diversity in Brazil. Recent studies demonstrate the importance of gallery forest in central regions of Brazil, but little is known about the physiology and plasticity of gallery forest species in relation to environmental variability, particularly in terms of light availability. In this study we compared in situ physiological and nutritional aspects of shade and sun leaves, in ten tree species commonly found in gallery forests. Relative to shade leaves, sun leaves had higher values of CO2 assimilation rates on an area basis (Aarea), of stomatal conductance (gs), of quantum yield of Photosystem II (ΦPSIIL); and a larger fraction of PSII centers in the open state (qL), while shade leaves showed higher specific leaf area. However, shade and sun leaves did not differ in terms of leaf water potential, CO2 assimilation on a mass basis and in leaf concentrations of macronutrients. ΦPSII and gs were the main factors that influenced Aarea in sun leaves, while only ΦPSII significantly affected Aarea of shade leaves. The differences found here demonstrate that, like in other forest formations worldwide, gallery forest trees are able to acclimate to contrasting irradiance levels that typically occur in this type of environment.
Key words: gallery forest, photosynthesis, nitrogen, phosphorus, light, fluorescence, gas exchange
Introdução
No bioma cerrado, é encontrada uma grande variedade de formações vegetacionais (Oliveira-Filho & Ratter 2002). Segundo o modelo de fisionomias proposto por Ribeiro & Walter (1998), há no bioma cerrado formações campestres, caracterizadas principalmente por espécies herbáceas; formações savânicas, onde são evidentes um estrato herbáceoarbustivo bem desenvolvido e um estrato arbóreo esparso; e formações florestais, onde o componente arbóreo é dominante e bem desenvolvido. Dentre as formações florestais presentes no cerrado, as mais características são as matas de galeria, faixas estreitas de vegetação florestal que margeiam os rios, sendo também chamadas de matas ciliares, quando as copas das duas margens não se tocam como ocorre em rios de maior largura (Ribeiro & Walter 1998). Apesar de representarem somente 10% da área do bioma cerrado, as matas de galeria são ubíquas no bioma, diferentemente das florestas sazonais mesofíticas que ocorrem em manchas espalhadas pelo domínio do cerrado (Oliveira-Filho & Ratter 2002). Em termos de composição florística, as matas de galeria destacam-se pelo grande número de espécies arbóreas, sendo muitas espécies comumente encontradas na floresta amazônica e na mata atlântica. Este tipo de formação florestal contém aproximadamente 1/3 da diversidade de espécies arbóreas encontradas no bioma cerrado (Felfili 1995; Ribeiro & Walter, 2001).
A escassez de dados ecofisiológicos de espécies provenientes de matas de galeria dificulta uma precisa definição dos fatores que limitam a distribuição deste ecossistema. A disponibilidade de água para as plantas de mata de galeria é bastante variável e as características físicas dos solos determinam diferentes graus de umidade, ocorrência e duração do período de alagamento (Veneklaas et al. 2005). Porém, há uma tendência de menor variação sazonal na disponibilidade hídrica nas matas de galeria do que nas áreas de savana circundantes (Oliveira-Filho & Ratter 2002); isto se deve não só a maior proximidade de fontes de água, mas também à maior quantidade de matéria orgânica nos solos, o que confere geralmente uma estrutura física com maior capacidade de retenção de água e de capacidade de troca catiônica (Haridasan 1998).
Dentro dos ambientes florestais o acesso à luz é um dos principais fatores limitantes ao crescimento de espécies arbóreas (Carswell et al. 2000; Felfili et al. 2001; Montgomery & Chazdon 2002). Florestas tropicais caracterizam-se pela presença de um estrato arbóreo desenvolvido que intercepta grande parte da irradiação solar incidente sobre a copa. Desta maneira, folhas de ramos próximos à superfície da copa estão expostas a uma alta irradiação solar ao longo do dia, tendendo a ser mais espessas, a ter menores concentrações de nitrogênio e a possuir mecanismos eficientes de dissipação do excesso de energia luminosa (Valladares & Niinemets 2008). Por outro lado, folhas de ramos no interior da copa destes mesmos indivíduos se desenvolvem em condições limitantes de luz, apresentando geralmente uma maior área foliar específica, maior concentração de nutrientes foliares e de pigmentos o que lhes permite uma melhor captação da luz difusa (Evans & Poorter 2001). Entretanto uma outra série de atributos da planta como tamanho do limbo foliar e a arquitetura da copa podem influenciar as respostas às diferentes condições de luminosidade (Valladares & Niinemets 2008). Compreender essa capacidade de resposta às variações locais na disponibilidade de recursos é fundamental para o entendimento do equilíbrio e dinâmica das comunidades florestais.
Atualmente informações provenientes de outras formações florestais tropicais têm sido utilizadas para inferir processos relacionados às matas de galeria. Contudo, importantes aspectos ecofisiológicos como respostas à limitação luminosa, sazonalidade e variações na taxa fotossintética podem diferir sensivelmente entre diferentes florestas topicais (Bonal et al. 2000; Miranda et al. 2005). Portanto, o presente estudo buscou avaliar in situ possíveis diferenças entre folhas de sol e de sombra para uma comunidade, representada aqui por dez espécies arbóreas mais representativas em matas de galeria do DF (Santiago et al. 2005). Espera-se assim que espécies florestais de mata de galeria tenham capacidade de aclimatação do aparato fotossintético às mudanças no ambiente luminoso, como demonstrado para outras formações florestais (Rozendaal et al. 2006, Markesteijn et al. 2007). Espera-se encontrar maiores teores de nitrogênio e fósforo nas folhas de sombra, além de uma maior área foliar específica, fatores relacionados a um melhor aproveitamento da luz em condições de baixa luminosidade. Por outro lado, espera-se que folhas de sol dos mesmos indivíduos apresentassem maiores taxas fotossintéticas, em termos de área, em função de uma maior capacidade no transporte de elétrons em comparação com folhas de sombra. Dessa forma, foi testada a esperada divergência (Gratani et al. 2006) entre folhas de sol e sombra para as variáveis relacionadas à captação de luz, trocas gasosas e conteúdo foliar de nutrientes.
Material e métodos
Área de estudo e seleção de espécies - Este estudo foi realizado na Reserva Ecológica do IBGE (Recor), distante aproximadamente 35 km do centro de Brasília-DF (15º56'S e 47º52'W). A área de estudo compreende a mata de galeria ao redor do córrego do Roncador (15º56'38''S e 47º52'21''W), sendo caracterizada como uma mata não alagável circundada por áreas de cerrado sensu stricto. Esta mata se apresenta sobre Latossolo vermelho-escuro (Silva-Júnior 2001), possuindo em torno de 80 m de largura no local estudado. Foram amostradas dez espécies arbóreas abundantes na mata de galeria estudada, que são também comuns e dominantes em outras matas de galeria do Distrito Federal (Silva-Júnior et al. 1998; Santiago et al. 2005), indicadas na Tabela 1. Para cada espécie selecionou-se um individuo ocorrente no interior da mata com diâmetro à altura do peito superior a 15 cm, com altura superior a 4 metros, onde parte da copa encontrava-se exposta à luminosidade direta no dossel, enquanto folhas de ramos mais baixos encontravam-se sombreadas no interior do sub-bosque. Uma vez que o foco deste trabalho foi de amostrar a comunidade de espécies arbóreas que compõem o dossel de uma mata de galeria, utilizou-se somente um indivíduo por espécie. Portanto, o esforço amostral foi de ampliar o numero de espécies amostradas em detrimento de um aumento do numero de réplicas por espécie, e com isto, evitar pseudo-repetição (Hurlbert 1984).
Variáveis fisiológicas - De cada indivíduo foram coletados dois ramos, sendo um deles localizado acima do dossel, estando exposto a altas intensidades luminosas no período do meio dia (aproximadamente 1987 ±12 µmol m-2 s-1), e o outro localizado abaixo do dossel, onde não havia exposição direta à luz (aproximadamente 278 ± 10 µmol m-2 s-1). As medições foram realizadas em três folhas/folíolos dos ramos destacados dos indivíduos estudados. As atividade em campo foram realizadas no período de 9:30 a 13:30 horas do dia 9 de dezembro de 2007, na estação chuvosa.
As trocas gasosas foram medidas em um sistema aberto (LI 6400, LICOR, Lincoln, USA) encerrando uma área de 6 cm2da porção média de cada folha/folíolo na câmara. Esta porção de cada folha/folíolo foi aclimatada à densidade de fluxo de fótons fotossintéticos (DFFF) de 1600 µmol m-2 s-1 (fonte de luz com LEDs vermelhos e azuis) e temperatura de 24ºC por 2 minutos. Após este período, foram registrados os valores de assimilação líquida de CO2 (Aarea) e condutância estomática (gs). A assimilação em base de massa (Amassa) foi calculada multiplicando-se a área foliar específica pela Aarea e por 0,1 devido a diferenças nas unidades (µmol m-2 s-1 x cm2 g-1). Apesar do procedimento utilizado (corte dos ramos) poder interferir nos resultados, nenhuma das espécies estudadas em questão apresentava pronunciada exsudação de resina ou goma na região do corte, fatores estes frequentemente responsáveis por alterações nos padrões de trocas gasosas (Santiago & Mulkey 2003). Em 21 e 22 de Fevereiro de 2009 foram realizados testes para se verificar um possível efeito do destacamento de ramos nas variáveis fotossintéticas estudadas (Aarea e gs). Para isso foi selecionado um indivíduo de cada espécie, em que foram medidos de 2-3 ramos. Folhas dos ramos ainda intactos foram acondicionadas no interior da câmara do LI-6400, sendo expostas a uma densidade de fluxo de fótons de 1600 µmol m-2 s-1, por 2 minutos. Após 30 segundos ou 1 minuto de estabilização, foram realizadas medições periódicas (a cada 15 ou 30 s) por um período de tempo de aproximadamente 1 minuto. Logo em seguida o ramo foi cortado e as trocas gasosas foram registradas por 5 minutos. Houve queda significativa nos valores de Aarea e gs apenas para Agonandra brasiliensis e Tapirira guianensis, entretanto as mesmas foram mantidas nas análises estatísticas deste trabalho devido aos valores obtidos anteriormente estarem bem acima dos obtidos neste teste. Em nível de comunidade, não houve um efeito significativo tanto para a assimilação líquida de CO2 (6.79 ± 1.5 µmol m-2 s-1não destacado vs. 7.05 ± 1.25 µmol m-2 s-1destacado; t9 = -1.01, P = 0.32) como para condutância estomática (0.23 ± 1.5 mol m-2 s-1 não destacado vs. 0.24 ± 1.25 mol m-2 s-1destacado; t9 = 0.47, P = 0.64).
Após cada medição de trocas gasosas, foram medidos os sinais de fluorescência da clorofila a utilizando um fluorômetro de pulso de amplitude modulada (PAM 2100, Walz, Effeltrich, Germany). Para isto, a folha/ folíolo utilizada na medição de trocas gasosas foi transferida para o clipe do fluorômetro sendo submetida a um período de aclimatação adicional de 2 minutos em uma DFFF de aproximadamente 1670 µmol m-2 s-1 fornecida, via fibra óptica, pela lâmpada halógena interna do instrumento. Foi medida a fluorescência em estado estável (FS), fluorescência máxima em folha aclimatada a luz (F'M), obtida durante pulso de luz saturante, e fluorescência inicial de folha aclimatada a luz (F'O), obtida após 5 segundos sob luz vermelho extremo. Foram calculados o rendimento quântico efetivo do fotossistema II ΦFSII =  e qL, um parâmetro que indica a fração de centros de reações que estão no estado aberto, sendo calculado como qL =
e qL, um parâmetro que indica a fração de centros de reações que estão no estado aberto, sendo calculado como qL =  (Kramer et al. 2004). Em seguida, foi estimado o potencial hídrico foliar (Ψf) utilizando-se bomba de pressão (PMS Instruments, Corvallis, USA). O tempo necessário para a realização de todas as medidas de trocas gasosas e fluorescência em um ramo foi de aproximadamente 8-10 minutos após o destacamento do ramo.
(Kramer et al. 2004). Em seguida, foi estimado o potencial hídrico foliar (Ψf) utilizando-se bomba de pressão (PMS Instruments, Corvallis, USA). O tempo necessário para a realização de todas as medidas de trocas gasosas e fluorescência em um ramo foi de aproximadamente 8-10 minutos após o destacamento do ramo.
Foram coletados discos foliares de área conhecida para a determinação, após secagem em estufa a 70ºC por 48 horas, da área foliar específica (AFE). As folhas utilizadas na análise de nutrientes foram as mesmas utilizadas nas medidas de trocas gasosas, fluorescência e potencial hídrico dos ramos (n = 3 folhas). Para as análises de nutrientes nas folhas foi realizada a digestão total das amostras seguida da determinação de N por colorimetria em um espectrofotômetro UV-visível e dos demais macronutrientes (P, Mg, Ca, Mg e S) por espectrometria de emissão atômica por plasma acoplado indutivamente (ICP Plasma - Thermojarrel, Japão) conforme metodologia descrita pela EMBRAPA (2005).
Análise Estatística - As médias dos valores obtidos para folhas de sol e de sombra foram analisadas por meio de testes t pareados utilizando o pacote Stats do programa R (versão 2.4.1) e considerando espécie como unidade amostral. Utilizou-se regressão linear simples para examinar as relações entre as variáveis AFE, concentração foliar de N, P, K, Ca, Mg e S e Amassa . Foi utilizado o software SMATR (Warton et al. 2006) para testar se houve diferenças entre folhas de sol e sombra, nas relações que foram estatisticamente significativas e que foram encontradas tanto em folhas de sol quanto em folhas de sombra. Para verificar as relações entre as variáveis gs, ΦFSII qL e concentração foliar de N e P na Aarea de folhas de sol e sombra foi utilizada uma regressão múltipla por passos ( step down multiple regression, utilizando o programa Statistica 7.0), onde essas variáveis foram considerados como fatores independentes. Nos resultados são apresentados os valores do r2 ajustado e os coeficientes de regressão. Em todas as análises foi utilizado o nível de significância de 5%. Por não ser objetivo deste estudo, não foram realizadas réplicas dentro de espécies, e por isto, estas não foram comparadas estatisticamente entre si.
Resultados
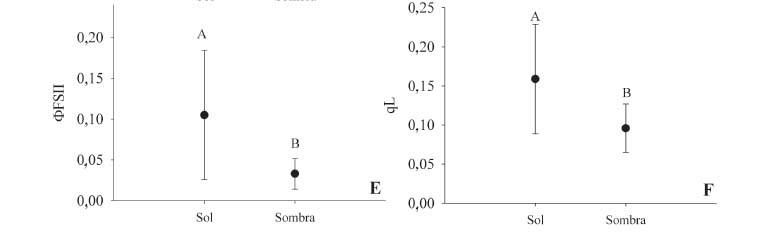
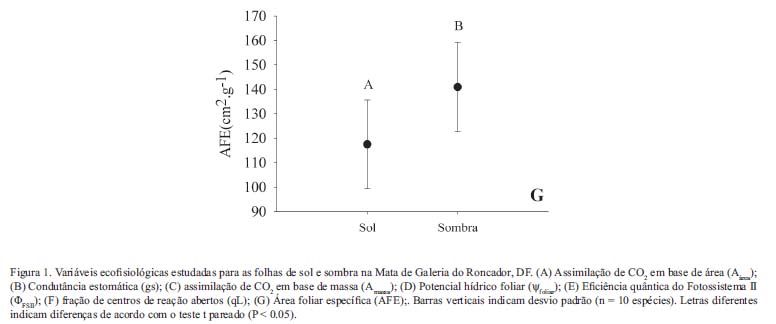
Trocas gasosas, fluorescência e potencial hídrico foliar - Em comparação a folhas de sombra, folhas de sol apresentaram valores signifi cativamente maiores de Aarea (Figura 1A; t9 = 3,04, P = 0,013), assim como maior condutância estomática (Figura 1B; t9 = 2,45 ,P = 0,035). A assimilação de CO2 em folhas do sol foi 37% maior, enquanto a condutância estomática apresentou um valor 51% maior que em folhas sombreadas. Amassa não diferiu entre folhas de sol e de sombra (t9 = 1,11, P = 0,19; Figura 1C). Os valores de potencial hídrico foliar (Figura 1D) para folhas de sol (-1,79±0,73 MPa) e sombra (-1,69±0,57 MPa) também foram muito semelhantes, não sendo encontradas diferenças significativas (t9 = -0,57, P = 0,567). Por outro lado, folhas de sol apresentaram maiores valores de ΦFSII(t9 = 2,74 , P=0,022; Figura 1E) e de qL (t9 = 3,05 , P = 0,001; Figura 1F).
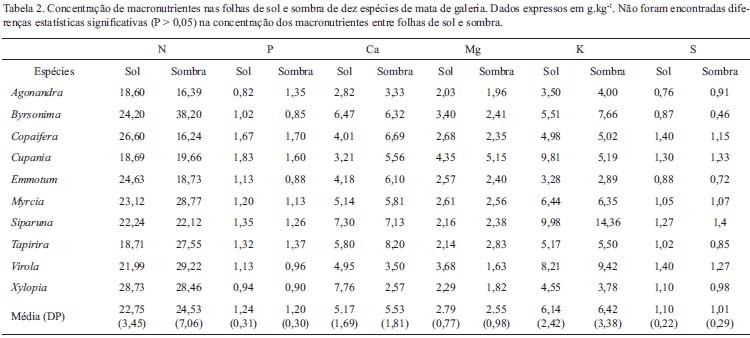
Área foliar específica e nutrientes foliares - A área foliar específica foi maior para folhas de sombra (t9 = -4,39 , P = 0,001), em relação as folhas de sol (Figura 1G). As folhas de sombra apresentaram valores superiores a 100 cm2.g-1; enquanto folhas de sol de algumas espécies atingiram baixos valores, como de 50 cm2.g-1. A concentração foliar de N, P e dos outros macronutrientes foram similares entre as folhas de sol e sombra em termos de massa foliar (t9 < 1,05, P > 0,10; Tabela 2). Siparuna guianenses foi uma espécie que se destacou pelos maiores valores de P, Mg, Ca e S em suas folhas, em relação as demais espécies (Tabela 2). Ao expressar os dados das concentrações de nutrientes em base de área foliar foram encontradas diferenças significativas entre folhas de sol e sombra apenas para fósforo (t9 = 2,51 , P = 0,032), atingindo valores de 0,011 ± 0,004 mg.cm-2 para folhas de sol e 0,008 ± 0,001 mg.cm-2 para folhas de sombra.
Relações entre as variáveis estudadas - As relações entre Aarea e as outras variáveis estudadas foram diferentes para folhas de sol e sombra. Nas folhas de sol, o resultado da  = 0,623) e ΦFSII (
= 0,623) e ΦFSII ( = 0,596) como principais fatores atuantes nos valores de Aarea (r2 = 0,96 , F5,4 = 134,04 , P < 0,001), enquanto para folhas de sombra o principal fator atuante no processo de assimilação de CO2 foi unicamente ΦFSII(r2 = 0,93,
= 0,596) como principais fatores atuantes nos valores de Aarea (r2 = 0,96 , F5,4 = 134,04 , P < 0,001), enquanto para folhas de sombra o principal fator atuante no processo de assimilação de CO2 foi unicamente ΦFSII(r2 = 0,93, = 0,834, F5,4 = 128,28 , P < 0,001)As relações entre Amassa e P e entre P e S foram signifi cativas para folhas de sol e sombra (Tabela 3), porém os dois tipos de folhas não se diferenciaram entre si para estas duas relações (Wald-Statistic < 0,26 e P > 0,60). Além destas, as relações entre Amassa e N, AFE e N, AFE e P e N e P foram significativas apenas para as folhas de sombra, (Tabela 3).
= 0,834, F5,4 = 128,28 , P < 0,001)As relações entre Amassa e P e entre P e S foram signifi cativas para folhas de sol e sombra (Tabela 3), porém os dois tipos de folhas não se diferenciaram entre si para estas duas relações (Wald-Statistic < 0,26 e P > 0,60). Além destas, as relações entre Amassa e N, AFE e N, AFE e P e N e P foram significativas apenas para as folhas de sombra, (Tabela 3).
Discussão
Diferenças significativas entre folhas de sol e sombra no que diz respeito à taxa de assimilação de CO2 em base de área são comumente encontradas nos diferentes ambientes florestais e mesmo entre folhas de sol e de sombra de um mesmo indivíduo (Lichtenthaler et al. 2007; Markesteijn et al. 2007). Em formações florestais das regiões temperadas, as diferenças na taxa de assimilação de CO2 por área entre folhas geralmente advêm de diferenças nas concentrações foliares de nitrogênio e fósforo (Takashima et al. 2004). Em folhas de sol, mais da metade do conteúdo destes elementos está associado ao aparato fotossintético e seriam investidas numa maior concentrações de pigmentos fotossintéticos por área foliar (Hölscher 2004, Sarijeva et al. 2007), além de uma maior concentração de Rubisco no mesófilo (Kubiske et al. 1997). Os valores de concentração de P expressos em área foliar foram maiores para folhas de sol, demonstrando um investimento maior desse elemento por área foliar, como esperado. Por outro lado folhas de sol e sombra não se diferenciaram nas concentrações foliares de nitrogênio e dos outros macronutrientes, expressos em termos de massa ou área.
Uma elevada capacidade de transporte de elétrons aliada a uma melhor fotoproteção são comumente encontradas em folhas de ambientes com alta luminosidade (Gonçalves et al. 2001, Lichtenthaler et al. 2007), ou mesmo em plantas crescendo sob altas irradiâncias (Maia et al. 2009). No presente estudo, foi observado que folhas de sol apresentaram um maior rendimento quântico do FSII aliado a uma maior proporção de centros de reação do FSII abertos (conforme indicado pela variável qL) e maior condutância estomática. A maior elevação na taxa de transporte eletrônico em folhas de sol pode também estar associada também ao ângulo da folha em relação ao plano horizontal, como demonstrado para plântulas de uma espécie de floresta (Maia et al. 2009). Para as folhas de sol, a condutância estomática foi o fator mais associado à assimilação de carbono. O efeito da condutância estomática sobrepujou outros fatores como conteúdo de nitrogênio, que estaria ligado à concentração de pigmentos fotossintéticos e Rubisco. Isto indica que a regulação estomática foi o principal fator limitante da assimilação de CO2 nestas folhas.
Os menores valores de Aarea das folhas de sombra sob luz intensa podem ser explicados pelo menor rendimento quântico do FSII. Sob intensidades luminosas elevadas, como as utilizadas nas medições, uma baixa capacidade de transferência de energia do FS II limita o processo fotossintético. A menor proporção de centros de reação do FS II abertos, estimada pela variável qL, é um indicativo da saturação do transporte de elétrons associada a uma baixa capacidade do complexo antena de dissipar níveis elevados de energia (Horton et al. 1996). Portanto, a energia luminosa absorvida em excesso por estas folhas pode resultar numa maior susceptibilidade de foto-oxidação (Melis 1999). Uma importante implicação deste padrão de fluorescência das folhas de sombra é apontar para uma capacidade relativamente baixa de aproveitamento de feixes de luz de grande intensidade que podem penetrar nas camadas mais baixas do dossel.
As concentrações de nutrientes para as espécies estão na faixa relatada para espécies de mata de galeria por Haridasan (1998); não sendo encontradas diferenças na concentração destes entre folhas de sol e sombra para nenhum dos macronutrientes estudados. Os resultados aqui apresentados mostram que a relação entre a assimilação de CO2 e nutrientes foliares, como N e P, foram significativas quando esta foi expressa com base na massa seca (Amassa) e somente para as folhas de sombra, de modo que essas relações são dependentes das condições ambientais. Investigações anteriores em outros tipos florestais mostram que essas relações tendem a ser variáveis e modificadas devido a diferentes características ambientais encontradas nos diversos ecossistemas florestais da região neotropical e da Oceania, onde geralmente há uma fraca, porém significativa, relação entre Amassa, SLA e os nutrientes foliares, como nitrogênio e fósforo (Wright et al. 2001; Prior et al. 2004; Wright et al. 2004; Coste et al. 2005).
As diferenças fisiológicas encontradas entre folhas de sol e sombra também são atribuídas parcialmente a diferenças na estrutura foliar (Gratani et al. 2006), sendo a área foliar específica um parâmetro diretamente relacionado ao investimento em estruturas foliares. A área foliar específica é uma variável altamente plástica e dependente das condições ambientais, principalmente a luz (Grime 1979, Dahlgren et al. 2006). Muitos estudos têm demonstrado que os menores valores dessa variável são encontrados geralmente em condições de alta luminosidade (Markesteijn et al. 2007, Sarijeva et al. 2007), como aqui observado. Maiores valores da AFE, encontrados para as folhas de sombra, demonstram um me-nor investimento na lignificação de tecidos como epiderme e cutícula, assim espécies crescendo em condição de sombreamento investem menos na espessura e lignificação destes tecidos, fato este encontrado para uma espécie da restinga quando crescendo em condições luminosas desfavoráveis (Pereira et al. 2009). As estruturas relacionadas anteriormente podem atuar não só relacionadas à fotoproteção (Fahn & Cutler 1992), mas também como estruturas impermeáveis que evitam a perda de água pela epiderme (Oliveira et al. 2003). Desta forma, altos valores de AFE, corresponderiam a uma alta capacidade competitiva por luz, em termos de fotossíntese na base de massa; entretanto esse fato pode levar a uma baixa resistência ao estresse, principalmente em relação ao excesso de luz (Grime 1979, Reich et al. 1999, Dahlgren et al. 2006), fato este incomum no sub-bosque.
Resultados similares a este estudo foram encontrados por Markesteijn et al. (2007) para uma floresta tropical na Bolívia, onde não houve diferenças significativas na concentração de nutrientes foliares, em base de massa, entre folhas de sol e sombra, entretanto diferenças foram encontradas nos parâmetros anatômicos, como espessura do parênquima paliçádico e outras estruturas, como cutícula e epiderme, que levaram a diferença na área foliar específica. Para florestas da bacia Amazônica, diversos autores têm relatado diferenças na concentração de nitrogênio foliar (Bonal et al. 2000, Coste et al. 2005, Rozendaal et al. 2006), e que as diferenças entre folhas de sol e sombra também estariam relacionadas a diferenças no investimento em diferentes estruturas foliares e a AFE. Markesteijn et al. (2007) comparando seus resultados com florestas mais secas e mais úmidas, sugeriram que a resposta de folhas de sol e sombra pode ser variável de acordo com interação entre disponibilidade hídrica e intensidade luminosa dos diferentes tipos florestais. Valladares & Niinemets (2008) demonstraram em sua revisão que as relações entre os atributos foliares entre plantas com diferentes capacidades de tolerar sombreamento ou mesmo entre folhas de sol e sombra, são altamente variáveis, não havendo um padrão específico e claro para os diferentes tipos florestais já estudados.
O potencial hídrico foliar é um reflexo do estado de hidratação e de uso dos recursos hídricos do solo. Os valores encontrados são muito similares aos citados por um estudo em região transicional entre a floresta Amazônica e o cerrado no Mato Grosso, com valores entre -1,4 e -2,8 MPa (Miranda et al. 2005). As semelhanças indicam que, apesar das diferenças ocorrerem nos níveis de luminosidade incidente e de fotossíntese, tanto folhas de sol e de sombra apresentam um status hídrico foliar muito semelhante, apesar de diferenças no grau de abertura do poro estomático. Este fato seria ocorrente devido à estrutura dos solos de mata de galeria permitir uma maior retenção de água (Haridasan 1998), além do fato de as medidas terem sido realizadas durante o período chuvoso. Assim, pode-se dizer que as diferentes condições de luminosidade aparentemente não parecem afetar o status hídrico foliar, pelo menos durante a época chuvosa.
As diferenças encontradas neste estudo demonstram que em formações de mata de galeria as espécies arbóreas ali presentes são capazes de se ajustar fisiologicamente em relação à disponibilidade de luz, o que resulta na sua aclimatação a altas e baixas intensidades luminosas. Assim, as maiores taxas fotossintéticas em termos de área em folhas de sol, têm relação com os maiores valores de condutância estomática e capacidade de transporte de elétrons do fotossistema II, comprovando a hipótese proposta, já que as concentrações de N e P, e dos outros macronutrientes, foram semelhantes nas condições estudadas, refutando a hipótese de que haveria diferenças nas concentrações de nutrientes foliares em termos de massa, porém havendo uma diferenciação em termos de área para P. Entretanto, as relações entre AFE, N e P com a assimilação de carbono em base de massa em folhas de sombra, demonstram a importância do investimento em nutrientes para a produtividade foliar em condições de sombreamento.
Recebido em 21/10/2008.
Aceito em 4/12/2009
- Bonal, D.; Sabatier, P.; Montpied, P.; Tremeaux, D. & Guehl, J.M. 2000. Interspecific variability of delta13 among trees in rainforests of French Guiana: functional groups and canopy integration. Oecologia 124: 454-468.
- Carswell, F.E.; Meier, P.; Wandelli, E.V.; Bonates, L.C.M.; Kruijt, B.; Barbosa, E.M.; Nobre, A.D.; Grace, J. & Jarvis, P.G. 2000. Photosynthetic capacity in central Amazonian rain forest. Tree Physiology 20: 179-186.
- Coste, S.; Roggy, J.C.; Imbert, P.; Born, C.; Bonal, D. & Dreyer, E. 2005. Leaf photosynthetic traits of 14 tropical rain forest species in relation to leaf nitrogen concentration and shade tolerance. Tree Physiology 25: 1127-1137.
- Dahlgren, J.P.; Eriksson, O.; Bolmgren, K.; Strindell, M. & Ehrlen, J. 2006. Specific leaf area as a superior predictor of changes in field layer abundance during forest sucession. Journal of Vegetation Science 17: 577-582.
- EMBRAPA. 2005. Manual de laboratórios: Solo, Água, Nutrição Animal e Alimentos. São Carlos, Embrapa Pecuária Sudeste.
- Evans, J.R. & Poorter, H. (2001). Photosynthetic acclimation of plants to growth irradiance: the relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain. Plant, Cell and Environment 24: 755-767.
- Fahn, A. & Cutler, D. 1992. Xerophytes. Gebrüder Borntraeger, Berlin.
- Felfili, J.M. (1995). Diversity, structure and dynamics of a gallery forest in Central Brazil. Vegetatio 117: 1-15.
- Felfili, J.M.; Franco, A.C.; Fagg, C.W. & Sousa-Silva, J.C. (2001) Desenvolvimento inicial de espécies de Mata de Galeria. Pp. 779-811. In: Ribeiro, J.F.; Fonseca, C.E.L. & Sousa-Silva, J.C (eds). Cerrado: caracterização e recuperação de Matas de Galeria. Planaltina, Embrapa Cerrados.
- Gonçalves, J.F.C.; Marenco, R.A. & Vieira, G. 2001. Concentration of photosynthetic pigments and chlorophyll fluorescence oh mahogany and tonka bean under two lights environments. Revista Brasileira de Fisiologia Vegetal 13: 149-157.
- Gratani, L.; Covone, F. & Larcher, W. 2006. Leaf plasticity in response to light of three evergreen species of the Mediterranean maquis. Trees 20: 549-558.
- Grime, J.P. 1979. Plant strategies and vegetation process. London, Wiley.
- Haridasan, M. 1998. Solos de mata de galeria e nutrição mineral de espécies arbóreas em condições naturais. Pp. 19-28. In: RIBEIRO, J.F. Ed. Cerrado: Matas de Galeria. Planaltina, Embrapa-CPAC.
- Hölscher, D. 2004. Leaf traits and photosynthetic parameters of saplings and adult trees of co-existing species in a temperate broad-leave forest. Basic and Applied Ecology 5: 163-172.
- Horton, P.; Ruban, A.V. & Walters, R.G. 1996. Regulation of light harvesting in green plants. Annual Review of Plant Physiology 47: 655-684.
- Hurlbert, S.H. 1984. Pseudoreplication and the design of ecological field experiments. Ecological Monographs 54:187-211.
- Kramer, D.M.; Johnson, G.; Kiirats, O. & Edwards, G.E. 2004. New fluorescence parameters for the determination of QA redox stat and excitation energy fluxes. Photosynthesis Research 79:209-218.
- Kubiske, M.E. & Pregitzer, K.S. 1997. Ecophysiological responses to simulated canopy gaps of two tree species of contrasting shade tolerance in elevated CO2 Functional Ecology 11: 24-32.
- Lichtenthaler, H.K.; Ac, A.; Marek, M.V.; Kalina, J. & Urban, O. 2007. Differences in pigment composition, photosynthetic rates and chlorophyll fluorescence images of sun and shade leaves of four tree species. Plant Physiology and Biochemistry 45: 577-588.
- Maia, G.M.; Balmant, B.D.; Vitolo, W.F.; Gomes, K.B.P.; Florentino, T.M.; Catuchi, T.A. & Vieira, W.L. 2009. Estratégias de utilização de luz e estabilidade do desenvolvimento de plântulas de Cordia superba Cham. (Boraginaceae) crescidas em diferentes ambientes luminosos. Acta Botanica Brasilica 23: 474-485.
- Markesteijn, L.; Poorter, L. & Bongers, F. 2007. Light-dependent leaf trait variation in 43 tropical dry forest tree species. American Journal of Botany 94(4): 515-525.
- Melis, A. 1999. Photosystem-II damage and repair cycle in chloroplasts: what modulates the rate of photodamage in vivo? Trends in Plant Science 4: 130-135.
- Miranda, E.J.; Vourlitis, G.L.; Priante Filho, N.; Priante, P.C.; Campelo JR, J.H.; Suli, G.S.; Fritzen, C.L.; Lobo, F.A. & Shiraiwa, S. 2005. Seasonal variation in the leaf gas exchange of tropical forest trees in the rain forest-savanna transition of the southern Amazon Basin. Journal of Tropical Ecology 21: 451-460.
- Montgomery, R.A. & Chazdon, R.L. 2002. Light gradient partitioning by tropical tree seedlings in the absence of canopy gaps. Oecologia 131: 165-174.
- Oliveira, A.F.M.; Meirelles, S.T. & Salatino, A. 2003. Epicuticular waxes from caatinga and cerrado species and their efficiency against water loss. Anais da Academia Brasileira de Ciências 75: 431-439.
- Oliveira-Filho, A.T. & Ratter, J.A. 2002. Vegetation physiognomies and woody flora of the Cerrado Biome. Pp. 121-140. In: OLIVEIRA, P.S & MARQUIS, R.J. 2002. The cerrados of Brazil. New York, Columbia University Press.
- Pereira, D.C.; Barros, C.F. & Scarano, F.R. 2009. In situ variation in leaf anatomy and morphology of Andira legalis (Leguminosae) in two neighbouring but contrasting light environments in a Brazilian sandy costal plain. Acta Botanica Brasilica 23: 267-273.
- Prior, L.D; Bowman, D.M.J.S. & Eamus, D. 2004. Seasonal differences in leaf attributes in Australian tropical tree species: family and habitat comparisons. Functional Ecology 18: 707-718.
- Reich, P.B.; Ellsworth, D.S.; Walters, M.B.; Vose, J.M.; Gresham, C.; Volin, J.C. & Bowman, W.D. 1999. Generality of leaf traits relationships: a test across six biomes. Ecology 80: 1955-1969.
- Ribeiro, J.F. & Walter, B.M.T. 1998 Fitofisionomias do Bioma Cerrado. Pp. 89-166. In Sano, S.M. & Almeida, S.P. eds. Cerrado: ambiente e flora Brasília, Embrapa/CPAC.
- Ribeiro, J.F. & Walter, B.M.T. 2001. As matas de galeria no contexto do bioma Cerrado. Pp. 29-47. In Ribeiro, J.F.; Fonseca, C.E.L. & Sousa-Silva, J.C. Cerrado: caracterização e recuperação de Matas de Galeria, Planaltina, Embrapa Cerrados.
- Rozendaal, D.M.A.; Hurtado, V.H. & Poorter, L. 2006. Plasticity in leaf traits of 38 tropical tree species in response to light; relationships with light demand and adult stature. Functional Ecology 20: 207-216.
- Santiago, L.S. & Mulkey, S.S. 2003. A test of gas exchange measurements on excised canopy branches of ten tropical tree species. Photosynthetica 41: 343-347.
- Santiago J.; Silva-Júnior & Lima, L.C. 2005. Fitossociologia da regeneração arbórea na Mata de Galeria do Pitoco (IBGE-DF), seis anos após fogo acidental. Scientia Forestalis 67: 64-77.
- Sarijeva, G.; Knapp, M. & Lichtenthaler, H.K. 2007. Differences in photosynthetic activity, chlorophyll and carotenoid levels, and in chlorophyll fluorescence parameters in green sun and shade leaves of Gingko and Fagus Journal of Plant Physiology 164: 950-955.
- Silva-Júnior, M.C. 2001. Comparação entre matas de galeria no Distrito Federal e a efetividade do código florestal na proteção de sua diversidade arbórea. Acta Botanica Brasilica 15: 139-146.
- Silva-Júnior, M.C.; Felfili, J.M.; Nogueira, P.E. & Rezende, A.V. 1998. Análise florística das Matas de Galeria do Distrito Federal. Pp. 53-84. In: RIBEIRO, J.F. (Ed.). Cerrado: Matas de Galeria. Planaltina, Embrapa-CPAC.
- Takashima, T.; Hikosaka, K.; Hirose, T. 2004. Photosynthesis or persistence: nitrogen allocation in leaves of evergreen and deciduous Quercus species. Plant Cell and Environment 27: 1047-1054
- Valladares, F. & Niinemets, U. 2008. Shade tolerance, a key plant feature of complex nature and consequences. Annual Review of Ecology and Systematics 39: 237-257.
- Veneklaas, E.J.; Fajardo, A.; Obregon, S. & Lozano, J. 2005. Gallery forest types and their environmental correlates in a Colombian savanna landscape. Ecography 28:236-252
- Warton, D.I., Wright, I.J., Falster, D.S. & Westoby, D. 2006. Bivariate line-fitting methods for allometry. Biological Reviews 81: 269-291.
- Wright, I.J.; Reich, P.B. & Westoby, M. 2001. Strategy shifts in leaf physiology, structure and nutrient content between species of high-and-low rainfall and high and low-nutrient habitats. Functional Ecology 15: 423-434.
- Wright, I.J.; Groom, P.K.; Lamont, B.B.; Poot, P.; Prior, L.D.; Reich, P.B.; Schulze, E.D.; Veneklaas, E.J. & Westoby, M. 2004. Leaf trait relationship in Australian plant species. Functional Plant Biology 31: 551-558.
Datas de Publicação
-
Publicação nesta coleção
10 Nov 2010 -
Data do Fascículo
Set 2010
Histórico
-
Recebido
21 Out 2008 -
Aceito
04 Dez 2009