Resumos
FUNDAMENTO: A doença de Chagas, causada pelo protozoário Trypanosoma cruzi, é uma das mais importantes causas de insuficiência cardíaca na América Latina. A terapia celular vem sendo investigada como uma possível opção terapêutica para pacientes com doenças cardiovasculares. OBJETIVO: O objetivo deste estudo foi avaliar os efeitos da terapia com células-tronco mesenquimais em um modelo experimental de cardiomiopatia chagásica crônica. MÉTODOS: Camundongos C57BL/6 foram infectados com 1000 tripomastigotas da cepa Colombiana de T. cruzi e, após seis meses de infecção, foram tratados com células-tronco mesenquimais derivadas de tecido adiposo humano (CTTAs) ou com meio DMEM (controle). O grupo tratado recebeu duas injeções intraperitoneais de CTTAs (1x106 células / dose), com um mês de intervalo entre as duas doses. Antes e após 1 e 2 meses de tratamento, os animais chagásicos e controles normais foram submetidos à eletrocardiograma e teste ergoespirométrico. Todos os animais foram sacrificados sob anestesia após 2 meses de tratamento, para análise histopatológica do coração. RESULTADOS: Não foi observada melhora de arritmias e da função cardiovascular no grupo tratado com CTTAs, porém secções de corações de camundongos deste grupo apresentaram uma redução significativa do número de células inflamatórias (p < 0,0001) e da área de fibrose (p < 0,01) em comparação com animais chagásicos tratados com DMEM. CONCLUSÃO: Deste modo, conclui-se que a administração de CTTAs por via intraperitoneal é capaz de reduzir inflamação e fibrose no coração de camundongos cronicamente infectados por T. cruzi, porém não teve efeitos na função cardíaca dois meses após o transplante.
Cardiomiopatia Chagásica; Células-Tronco; Terapia Celular; Tecido Adiposo
BACKGROUND: Chagas disease, caused by the protozoan Trypanosoma cruzi, is a major cause of heart failure in Latin America. Tissue therapy has been investigated as a possible therapeutic option for patients with cardiovascular disease. OBJECTIVE: This study evaluated the effects of therapy with mesenchymal stem cells in an experimental model of chronic Chagasic cardiomyopathy. METHODS: C57BL/6 mice were infected with 1000 trypomastigotes from the Colombian strain of T. cruzi and, after six months of infection, were treated with mesenchymal human stem cells from adipose tissue (STAT) or with Dulbecco/Vogt modified Eagle's minimal essential medium - DMEM (control). The treated group received two intraperitoneal injections of STAT (1x10(6) cells/dose), with a month interval between the two doses. Before and after the first and second months of treatment, the chagasic and normal control animals underwent cardiopulmonary exercise testing and electrocardiography. All animals were sacrificed under anesthesia after two months of treatment for histopathological analysis of the heart. RESULTS: No improvement was observed in arrhythmias and cardiovascular function in the group of animals treated with STAT; however, sections of mice hearts in this group revealed a significant reduction in the number of inflammatory cells (p<0.0001) and areas of fibrosis (p<0.01) in comparison with chagasic animals treated with DMEM. CONCLUSION: Thus, it is concluded that administration of intraperitoneal STAT can reduce inflammation and fibrosis in the heart of mice chronically infected with T. cruzi; however, there were no effects on the cardiac function two months after transplantation.
Chagas Cardiomyopathy; Stem Cells; Tissue Therapy; Adipose Tissue
Transplante de células mesenquimais de tecido adiposo na cardiopatia chagásica crônica experimental
Ticiana Ferreira LaroccaI,II; Bruno Solano de Freitas SouzaI,II; Cristina Aragão SilvaI,II; Carla Martins KanetoII; Adriano Costa de AlcantaraII; Carine Machado AzevedoII; Murilo Fagundes CastroI,II; Simone Garcia MacambiraI; Milena Botelho Pereira SoaresI,II; Ricardo Ribeiro-dos-SantosI,II
ICentro de Pesquisas Gonçalo Moniz - Fundação Oswaldo Cruz
IIHospital São Rafael, Salvador, BA - Brasil
Correspondência Correspondência: Ticiana Ferreira Larocca Av. Alphaville, 634 Cond Alpha Life, Ed. Paradiso, ap. 202, Alphaville I CEP 41701-015, Salvador, BA - Brasil E-mail: ticianaferreira@cardiol.br, ticiana@cbtc-hsr.org
RESUMO
FUNDAMENTO: A doença de Chagas, causada pelo protozoário Trypanosoma cruzi, é uma das mais importantes causas de insuficiência cardíaca na América Latina. A terapia celular vem sendo investigada como uma possível opção terapêutica para pacientes com doenças cardiovasculares.
OBJETIVO: O objetivo deste estudo foi avaliar os efeitos da terapia com células-tronco mesenquimais em um modelo experimental de cardiomiopatia chagásica crônica.
MÉTODOS: Camundongos C57BL/6 foram infectados com 1000 tripomastigotas da cepa Colombiana de T. cruzi e, após seis meses de infecção, foram tratados com células-tronco mesenquimais derivadas de tecido adiposo humano (CTTAs) ou com meio DMEM (controle). O grupo tratado recebeu duas injeções intraperitoneais de CTTAs (1x106 células / dose), com um mês de intervalo entre as duas doses. Antes e após 1 e 2 meses de tratamento, os animais chagásicos e controles normais foram submetidos à eletrocardiograma e teste ergoespirométrico. Todos os animais foram sacrificados sob anestesia após 2 meses de tratamento, para análise histopatológica do coração.
RESULTADOS: Não foi observada melhora de arritmias e da função cardiovascular no grupo tratado com CTTAs, porém secções de corações de camundongos deste grupo apresentaram uma redução significativa do número de células inflamatórias (p < 0,0001) e da área de fibrose (p < 0,01) em comparação com animais chagásicos tratados com DMEM.
CONCLUSÃO: Deste modo, conclui-se que a administração de CTTAs por via intraperitoneal é capaz de reduzir inflamação e fibrose no coração de camundongos cronicamente infectados por T. cruzi, porém não teve efeitos na função cardíaca dois meses após o transplante.
Palavras-chave: Cardiomiopatia Chagásica / terapia, Células-Tronco, Terapia Celular, Tecido Adiposo.
Introdução
A doença de Chagas, desencadeada após a infecção pelo protozoário flagelado Trypanosoma cruzi, representa um grave problema de saúde pública, afetando cerca de 18 milhões de pessoas na América Latina, com 200 mil novos casos por ano1. Estima-se que, nos países endêmicos, cerca de 20 mil pacientes morram a cada ano, por complicações associadas a cardiomiopatia chagásica crônica, para a qual ainda não existe uma terapêutica suficientemente eficaz. Por esses motivos, é de fundamental importância o estudo de novas alternativas terapêuticas para os pacientes portadores de cardiomiopatia chagásica crônica, levando em consideração a sua alta prevalência e sua elevada morbimortalidade, além do grande impacto socioeconômico causado por essa doença.
Diversas pesquisas sobre o potencial terapêutico do transplante de células-tronco têm sido realizadas nos últimos anos, sobretudo na área das doenças cardiovasculares. Bocchi e cols.2 estudaram o efeito de células mononucleares de medula óssea, em pacientes portadores de insuficiência cardíaca não isquêmica refratária, tendo sido evidenciada melhora de fração de ejeção, classe funcional e qualidade de vida. Também foi demonstrado anteriormente que o transplante de células da medula óssea singênicas causa a melhora da miocardite chagásica em camundongos cronicamente infectados por T. cruzi3, tendo como possível mecanismo de ação a indução de apoptose das células mononucleares do infiltrado inflamatório, com redução da inflamação e do percentual de fibrose. Apesar de estudo clínico piloto com a utilização de células mononucleares em portadores de miocardiopatia chagásica crônica ter sugerido benefícios4, esses dados não foram confirmados por ensaio clínico randomizado5. Desse modo, estudos em modelos animais devem ser desenvolvidos no sentido de investigar novos protocolos terapêuticos baseados em células-tronco.
As células-tronco mesenquimais (CTM), encontradas no estroma de vários órgãos, incluindo a medula óssea, vêm sendo intensamente estudadas quanto às suas características e ao seu potencial terapêutico em diversos modelos experimentais pela facilidade com que podem ser obtidas e expandidas in vitro. No trabalho de Guarita-Souza e cols.6, ratos Wistar com cardiomiopatia dilatada chagásica, com disfunção sistólica de ventrículo esquerdo, foram transplantados com cocultura de CTM e mioblastos esqueléticos, tendo sido observada, um mês após o transplante, importante melhora da função e diâmetros ventriculares.
Nesse contexto, o presente estudo testou a hipótese de que a terapia com células-tronco mesenquimais humanas derivadas de tecido adiposo é capaz de reduzir inflamação e fibrose e melhorar a aptidão cardiorrespiratória em um modelo experimental de cardiomiopatia chagásica crônica em camundongos.
Métodos
Animais
Trinta camundongos da linhagem C57BL/6 foram mantidos no biotério do Centro de Biotecnologia e Terapia Celular (CBTC) com água e comida ad libitum, sob condições ideais de temperatura e luminosidade. O protocolo foi aprovado pela Comissão de Ética no Uso de Animais do Hospital São Rafael, em 1º de janeiro de 2010, sob o número 05/10. As manipulações foram feitas de acordo com as normas de manipulação de animais estabelecidas no "Guide for the Care and Use of Laboratory Animals" (Institute of Laboratory Animal Resources, National Academy of Sciences Washington, D. C. 1996), respeitando os Princípios Éticos na Experimentação Animal do Colégio Brasileiro de Experimentação Animal (Cobea).
Infecção de camundongos por T. cruzi
Vinte camundongos da linhagem C57BL/6 com seis a oito semanas de idade foram inoculados por via intraperitoneal com 1000 tripomastigotas da cepa Colombiana de T. cruzi7, obtidos do sobrenadante de cultura de células da linhagem LCC-MK2 infectadas. A avaliação da infecção aguda foi feita por meio da parasitemia periódica.
Células-tronco mesenquimais derivadas do tecido adiposo
A linhagem de células-tronco do tecido adiposo (CTTA) humanas foi obtida a partir de material de descarte de lipoaspiração. Após incubação com colagenase (Blendzyme1, Roche), a preparação foi centrifugada, e as células foram cultivadas em meio DMEM acrescido de L-glutamina (2 mM/L), gentamicina (50 µg/mL), Hepes (10 mM) e 2 g/L de bicarbonato de sódio, enriquecido com 10% de soro fetal bovino, sendo mantidas em estufa a 37ºC a 5% de CO2. As CTTA foram isoladas de outras células mononucleares por sua capacidade de aderência ao plástico e de expansão, sendo posteriormente avaliadas quanto à expressão de marcadores de superfície por citometria de fluxo, potencial de diferenciação osteogênica e adipogênica e estabilidade cromossômica, comprovando as suas características de células mesenquimais.
Tratamento dos animais chagásicos crônicos
Cada camundongo C57BL/6, seis meses após a infecção por T. cruzi, foi transplantado com 1 x 106 CTTA derivadas de tecido adiposo humano, por via intraperitoneal. O transplante foi repetido após trinta dias. O grupo controle de animais infectados foi tratado com meio DMEM, também por via intraperitoneal.
Avaliação eletrocardiográfica
Após a indução de anestesia utilizando o sistema de isofluorano (0,5 a 2%), foi iniciada a aquisição dos registros eletrocardiográficos. Os registros de eletrocardiogramas foram adquiridos usando um equipamento Bio Amp PowerLab System (PowerLab 2/20; ADInstruments, Castle Hill, Australia), que permite o registro de sinais biológicos em animais com total isolamento elétrico. Os dados foram adquiridos e armazenados em computador, analisados no programa Chart 5 for Windows (Power Lab; ADInstruments, Castle Hill, Australia). As análises de ECG incluíram as medidas de frequência cardíaca, dos intervalos PR e QT corrigido e a avaliação quanto à presença de distúrbios de condução e arritmias. Para minimizar interferências, foi utilizado filtro de 0,1 a 1 Hz.
Avaliação funcional por ergometria
Para os estudos de ergometria, foi utilizado o equipamento LE 8700 - CO (Panlab, Barcelona, Espanha), com fluxo de ar na câmara controlado por um trocador de gases (LE 400, Panlab). A amostra de gases foi levada por um circuito fechado ao analisador de gases (OXYLET 00, Panlab), sendo os dados enviados ao computador através de um amplificador contendo uma placa analógico-digital (ML 820, PowerLAb, ADInstruments, Austrália). Os dados foram armazenados em computador para análise no programa Chart 5 for Windows - Metabolism for PowerLab System. Os animais foram colocados na esteira 20 minutos antes de iniciar o exercício. A velocidade inicial foi de 12 cm/s, com incrementos na velocidade de 6 cm/s a cada 5 minutos. O primeiro estágio foi estabelecido com a velocidade inicial de 12 cm/s. Após 5 minutos, o animal passava para o segundo estágio, com velocidade de 18 cm/s, e assim sucessivamente. Os testes foram realizados até os animais entrarem em exaustão, permanecendo por 5 segundos ou mais na área de choque. Para minimizar interferências, foi utilizado filtro de 0,1 a 1 Hz. Os parâmetros avaliados foram tempo de exercício, distância percorrida, velocidade final, estágio máximo alcançado, consumo de oxigênio e produção de dióxido de carbono.
Avaliações histológica e morfométrica
Após eutanásia dos animais, os corações e fragmentos de músculo esquelético foram removidos e fixados em formalina 4%, para processamento histológico. Seções dos corações e dos músculos dos animais foram coradas por hematoxilina e eosina e analisadas por microscopia de campo claro, para a contagem de células inflamatórias, ou por tricrômio de Masson, para avaliação do percentual de fibrose. As quantificações foram realizadas em quatro cortes de 5 micrômetros de coração inteiro, com 20 a 30 micrômetros entre cada corte, depois de escaneamento utilizando o sistema Aperio ScanScope (Aperio Technologies, Vista, CA). As imagens foram analisadas com o programa Image Pro Plus (versão 7.0, Media Cybernetics, San Diego, CA).
Análise estatística
Os dados obtidos foram avaliados considerando distribuição paramétrica, com o auxílio dos programas Graphpad Prism 5 (2007) e BioCalc. Para as comparações de intervalo PR, duração do QRS e frequência cardíaca foi utilizado o one-way ANOVA com pós-teste Tukey. O teste de Fisher foi utilizado para comparar os percentuais de animais com arritmias. O teste t não pareado foi utilizado na ergometria e na histopatologia para comparar os animais crônicos com os controles não infectados de mesma idade, e para comparar os animais chagásicos crônicos dos dois grupos. Os resultados foram considerados significantes quando p < 0,05.
Resultado
Mortalidade
O estudo foi iniciado com 30 camundongos da linhagem C57BL/6, divididos em três grupos: controles não infectados (n = 10); chagásicos crônicos tratados com DMEM (n = 10); e chagásicos crônicos tratados com CTTA (n = 10). Não houve óbitos entre os animais não infectados e os tratados com DMEM. Foram observados dois óbitos no grupo de animais tratados com CTTA, e um deles ocorreu ainda em fase considerada pré-tratamento, por acidente hemorrágico abdominal durante a infusão intraperitoneal das células-tronco. O segundo óbito nesse grupo ocorreu cerca de um mês após o transplante das CTTA, por causa não identificada. Não houve significância estatística no índice de sobrevida entre os grupos.
Resultados eletrocardiográficos
Na análise dos intervalos eletrocardiográficos, não houve diferença com significância estatística entre os animais chagásicos dos dois grupos de animais chagásicos, quando comparados entre si. Houve significância estatística, com p < 0,001, quando comparado o intervalo PR dos animais não infectados com os animais chagásicos tratados com DMEM ou com CTTA, o que não ocorreu com o intervalo QTc. Não houve influência da terapia com CTTA no prolongamento do intervalo PR, quando avaliado esse grupo nas fases pré e pós-tratamento. Os intervalos PR e QTc permaneceram estáveis nos dois grupos de animais chagásicos durante todo o período avaliado (Tabela 1).
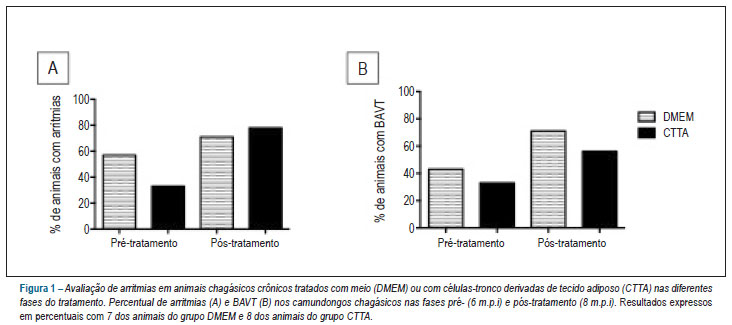
Na avaliação quanto à presença de arritmias cardíacas, dentre os animais chagásicos tratados com DMEM, dois animais evoluíram com BAVT. Três animais desse grupo já tinham BAVT na fase pré-tratamento, e dois passaram a cursar concomitantemente com frequentes extrassístoles ventriculares na fase pós-tratamento.
Entre os camundongos tratados com CTTA, três animais tinham BAVT, na fase pré-tratamento, e um deles apresentou reversão da arritmia, passando a ter ritmo sinusal, o que não ocorreu em nenhum dos animais tratados com DMEM. De quatro animais do grupo CTTA com ECG normal, um evoluiu com BAV de 2º grau tipo II e três animais evoluíram com BAVT.
As diferenças entre os percentuais de arritmias em geral e de BAVT não atingiram significância estatística quando comparados os grupos tratados com DMEM ou com CTTA. Também não se observou diferença quando os grupos foram comparados entre si nos dois tempos de infecção, apesar de ter sido observada uma tendência ao aumento de arritmias nos dois grupos estudados. Para arritmias em geral, os percentuais foram de 57% e 71% nos animais tratados com DMEM, e de 33% e 78% nos animais tratados com CTTA, nas fases pré- e pós-tratamento, respectivamente. Para BAVT, os percentuais foram de 43% e 71% nos animais tratados com DMEM, e de 33% e 56% nos animais tratados com CTTA, nas fases pré e pós-tratamento, respectivamente (Figura 1).
Resultados da avaliação funcional ergoespirométrica
Em relação aos parâmetros de tempo de exercício, distância percorrida, velocidade final e estágio máximo alcançado, não houve diferença com significância estatística entre os animais chagásicos dos dois grupos, quando comparados um com o outro, ou quando considerados isoladamente, nas fases pré- e pós-tratamento. Todos os parâmetros foram significativamente diferentes entre os animais não infectados e os chagásicos em geral. O tempo de exercício, em segundos, foi 2577 ± 371 nos animais não infectados; 1840 ± 342 e 1620 ± 690 nos animais do grupo DMEM nas fases pré e após 2 meses de tratamento, respectivamente; e de 1570 ± 436 e 1278 ± 454 nos animais do grupo CTTA nas fases pré e pós-tratamento, respectivamente. A distância percorrida, em metros, foi 730 ± 187 nos animais não infectados; 396 ± 127 e 342 ± 171 nos animais do grupo DMEM nas fases pré e após dois meses de tratamento, respectivamente; e de 358 ± 131 e 221 ± 125 nos animais do grupo CTTA nas fases pré e pós-tratamento, respectivamente (Figura 2).
O grupo DMEM evoluiu, após o primeiro mês, com aumento do VO2, sendo esse valor mantido após o segundo mês de observação. O grupo CTTA apresentou uma tendência a elevação do VO2 após o tratamento, porém, erro padrão de significância estatística.
Quanto à produção de dióxido de carbono, observamos um aumento do VCO2 em repouso no grupo DMEM após o primeiro mês, mas não no grupo CTTA. Houve uma queda acentuada no VCO2 em repouso e no pico do esforço após o segundo mês nos grupos DMEM e CTTA, com significância estatística, quando comparados com o primeiro mês pós-tratamento.
O VO2 em repouso, em mL/Kg/min, foi 3959 ± 830 nos animais não infectados; 2779 ± 1004 e 3925 ± 1158 nos animais do grupo DMEM nas fases pré- e após dois meses de tratamento, respectivamente; e de 3442 ± 770 e 4094 ± 1203 nos animais do grupo CTTA nas fases pré- e pós-tratamento, respectivamente. No pico do esforço, esses valores foram 6107 ± 983 nos animais não infectados; 4213 ± 1438 e 5540 ± 1088 nos animais do grupo DMEM nas fases pré- e após dois meses de tratamento, respectivamente; e de 5479 ± 1061 e 5000 ± 1475 nos animais do grupo CTTA nas fases pré e pós-tratamento, respectivamente. O VCO2 em repouso, em mL/Kg/min, foi 3716 ± 1113 nos animais não infectados e 3544 ± 472 e 1779 ± 1222 nos animais do grupo DMEM nas fases pré- e após dois meses de tratamento, respectivamente; e de 3988 ± 366 e 1993 ± 1784 nos animais do grupo CTTA nas fases pré- e pós-tratamento, respectivamente. No pico do esforço, esses valores foram 5171 ± 1454 nos animais não infectados; 4894 ± 880 e 2393 ± 1610 nos animais do grupo DMEM nas fases pré- e após dois meses de tratamento, respectivamente; e de 5261 ± 688 e 2425 ± 1802 nos animais do grupo CTTA nas fases pré- e pós-tratamento, respectivamente (Figura 3).
Avaliações histológicas e morfológicas
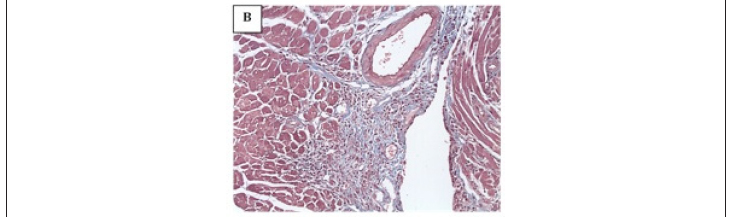
Seções de corações de camundongos chagásicos crônicos apresentaram alterações histológicas características da cardiomiopatia chagásica crônica (Figura 4). Observa-se a presença de infiltrados inflamatórios focais e disseminados compostos predominantemente por células mononucleares, miocitólise, mionecrose e fibrose. Ambos os grupos (tratados com DMEM ou CTTA) apresentaram padrão semelhante, porém o grau de inflamação e de fibrose nos corações de animais tratados com CTTA foi menor do que os tratados com DMEM.
Na figura 4A, um corte de coração normal, com coloração tricrômio de Masson, mostra uma estrutura arteriolar, com colágeno circunjacente a ela (corado em azul), fibras cardíacas normais e ausência de infiltrado inflamatório. A figura 4B mostra corte de coração chagásico crônico, com coloração tricrômio de Masson, evidenciando intenso infiltrado inflamatório multifocal produzido por células mononucleares, frequentemente aderidas a fibras cardíacas, produzindo lesões miocitolíticas nelas, sendo a área inflamada entremeada por intensa fibrose (corada em azul). Na figura 4C, observa-se corte de coração chagásico crônico tratado com CTTA, com coloração por tricrômio de Masson, com discretos infiltrados focais compostos por células mononucleares, sendo as áreas inflamadas entremeadas por discreta fibrose (corada em azul).
Ao avaliar por morfometria a inflamação e fibrose de forma comparativa entre os dois grupos de animais chagásicos, observamos uma redução de fibrose e inflamação nos animais tratados com CTTA, com significância estatística. O número de células inflamatórias por mm2 foi de 228,5 ± 80,4 nos animais não infectados; de 758,4 ± 194,7 nos animais do grupo DMEM; e de 382,4 ± 91,9 nos animais do grupo CTTA. O percentual de fibrose no coração foi de 2,60 ± 1,78 nos animais não infectados; de 8,95 ± 3,31 nos animais do grupo DMEM; e de 3,89 ± 1,14 nos animais do grupo CTTA (Figura 5).
Além do coração, foi realizada a avaliação histopatológica de músculo esquelético. Tanto os animais chagásicos tratados com DMEM quanto os com CTTA apresentaram inflamação no músculo esquelético, caracterizando uma miosite intensa observada na fase crônica da doença (dados não mostrados).
Discussão
Neste trabalho, foi demonstrada redução de inflamação e fibrose no coração de camundongos com miocardiopatia chagásica, induzida pela cepa Colombiana de Trypanosoma cruzi, tratados com CTTA. Estudos anteriores haviam demonstrado dados semelhantes, porém com a utilização de células mononucleares de medula óssea3. A despeito disso, o tratamento com as CTTA não influenciou o desenvolvimento de arritmias cardíacas e também não propiciou melhora dos parâmetros ergométricos, tendo sido mantida a baixa tolerância ao exercício com a progressão da doença.
Os efeitos benéficos da terapia com células mesenquimais, através do seu potencial regenerativo, já foram demonstrados em diversos estudos clínicos e experimentais, como em doenças dos tecidos ósseo e cartilaginoso8, insuficiência renal9, doenças cardiovasculares10, pulmonares11, dentre outras. Além do potencial regenerativo, foi identificada ainda a atividade imunossupressora dessas células12,13, que são capazes de modular a função dos linfócitos T, fundamentais para o desenvolvimento da resposta imune adaptativa. Portanto, é possível que os efeitos das CTTA na redução de fibrose e inflamação observados neste trabalho se devam a essa propriedade imunomoduladora, já descrita em diversos trabalhos na literatura. O fato de não ter sido evidenciada redução no percentual de arritmias sugere que pode não ter havido uma regeneração do tecido e/ou recuperação do sistema de condução cardíaco após a utilização desse esquema terapêutico, ao menos no tempo pós-tratamento avaliado.
No trabalho de Guarita-Souza e cols.6, ratos Wistar foram infectados com 15 x 104 tripomastigotas, desenvolvendo cardiomiopatia dilatada com disfunção sistólica de ventrículo esquerdo. Esses animais foram transplantados com cocultura de CTM e mioblastos esqueléticos, tendo sido observada, já após um mês do transplante, importante melhora da função e diâmetros ventriculares. A utilização de outro tipo celular juntamente com as CTM torna difícil avaliar o real papel das CTM neste modelo. É possível que os mioblastos esqueléticos atuem na recolonização das áreas fibróticas, promovendo, assim, a melhora da função cardíaca.
Em relação ao tipo celular utilizado em nosso estudo, algumas vantagens da utilização das células-tronco derivadas de tecido adiposo para o tratamento de doenças cardíacas em relação às de medula óssea já foram descritas anteriormente14, bem como a sua capacidade de diferenciação em cardiomiócitos15,16. Quanto à utilização de células xenogênicas (células humanas em camundongos), estudos prévios já demonstraram a segurança e a potencial eficácia dessas células, como o artigo publicado por Cai e cols.17 em modelo de infarto do miocárdio em ratos. Do mesmo modo, Hwangbo e cols.18 avaliaram o efeito do transplante de CTTA humanas em ratos Sprague-Dawley com infarto do miocárdio, com evidência de significativa melhora de função ventricular esquerda.
Em nosso estudo, optamos pela utilização da via intraperitoneal pelo fato de termos evidenciado em estudos anteriores a perda de animais por óbito após a administração de CTM por via endovenosa em camundongos. Em um trabalho realizado com insuficiência cardíaca refratária não isquêmica, foram utilizadas as vias endovenosa e intracoronariana, com resultados satisfatórios, porém as células estudadas foram as mononucleares, e não as mesenquimais2. Também utilizando células mononucleares de medula óssea, Nakamuta e cols.19 demonstraram maior retenção cardíaca das células, em modelo experimental de infarto do miocárdio, quando utilizada a via intramuscular. No entanto, Furlani e cols.20 avaliaram, por microscopia intravital, a cinética de migração de CTM humanas após a administração intravascular em camundongos SCID, através de um cateter inserido na aorta abdominal infrarrenal. Neste trabalho, o tamanho das CTM variou de 16 a 53 µm em suspensão, tendo sido observada interferência na microcirculação sanguínea conforme a densidade celular, com interrupção do fluxo sanguíneo e formação de trombo em arteríolas e vênulas nos animais nos quais foram injetadas as CTM. Em outro estudo, Gordon e cols.21 demonstraram o efeito terapêutico da injeção por via intraperitoneal de células-tronco mesenquimais humanas em camundongos com encefalomielite alérgica autoimune. Assim, além de não causar a perda de animais por embolia, esses trabalhos indicam que a via intraperitoneal de administração pode não comprometer os efeitos dessas células.
Uma limitação deste trabalho foi um viés na avaliação da ergometria causado pela presença de inflamação no músculo esquelético observada nos animais chagásicos. Mesmo nos animais que não apresentaram BAVT, observamos um pior desempenho no teste ergométrico, especialmente nos parâmetros de tempo de exercício e distância percorrida, além de claudicação de marcha. Ao avaliar a histologia e a morfometria de seções de músculo esquelético, encontramos uma grande quantidade de células inflamatórias, caracterizando miosite, considerada como fator ortopédico limitante para a progressão do esforço nos animais chagásicos no nosso trabalho. Em outro protocolo, estamos avaliando os efeitos da terapia com baixas doses de benzonidazol na miosite esquelética em camundongos cronicamente infectados por T. cruzi submetidos ao transplante com células-tronco mesenquimais cardíacas.
Conclusão
Em resumo, este trabalho contribuiu para a avaliação os efeitos da terapia com CTTA na forma arrítmica da doença de Chagas, tendo demonstrado que o tratamento com as CTTA não reduziu a incidência de arritmias cardíacas em camundongos cronicamente infectados pela cepa Colombiana de T. cruzi. Os animais tratados tiveram uma redução de inflamação e fibrose, com valores semelhantes àqueles encontrados em animais não infectados, quando realizada a avaliação histológica e morfométrica. Novos estudos poderão contribuir para o desenvolvimento de protocolos, com ajuste da terapia e do modelo experimental, até que possa ser desenvolvida uma abordagem terapêutica suficientemente eficaz, que justifique futuros estudos em pacientes portadores de cardiomiopatia chagásica crônica.
Potencial Conflito de Interesses
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo foi financiado pelo CNPq, FABESB e FINEP.
Vinculação Acadêmica
Este artigo é parte de dissertação de Mestrado de Ticiana Ferreira Larocca pelo Centro de Pesquisas Gonçalo Moniz-Fiocruz.
Artigo recebido em 03/07/12, revisado em 10/12/12, aceito em 21/12/12.
- 1. Rassi A Jr, Rassi A, Little WC, Xavier SS, Rassi SG, Rassi AG, et al. Development and validation of a risk score for predicting death in Chagas' heart disease. N Engl J Med. 2006;355(8):799-808.
- 2. Bocchi EA, Bacal F, Guimarães G, Mendroni A, Mocelin A, Filho AE, et al. Granulocyte-colony stimulating factor or granulocyte-colony stimulating factor associated to stem cell intracoronary infusion effects in non ischemic refractory heart failure. Int J Cardiol. 2010;138(1):94-7.
- 3. Soares MB, Lima RS, Rocha LL, Takyia CM, Pontes-de-Carvalho L, de Carvalho AC, et al. Transplanted bone marrow cells repair heart tissue and reduce myocarditis in chronic chagasic mice. Am J Pathol. 2004;164(2):441-7.
- 4. Vilas-Boas F, Feitosa GS, Soares MB, Mota A, Pinho-Filho JA, Almeida AJ, et al. [Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease]. Arq Bras Cardiol. 2006;87(2):159-66.
- 5. Ribeiro Dos Santos R, Rassi S, Feitosa G, Grecco OT, Rassi A Jr, da Cunha AB, et al. Cell therapy in Chagas cardiomyopathy (Chagas arm of the multicenter randomized trial of cell therapy in cardiopathies study): a multicenter randomized trial. Circulation. 2012;125(20):2454-61.
- 6. Guarita-Souza LC, Carvalho KA, Woitowicz V, Rebelatto C, Senegaglia A, Hansen P, et al. Simultaneous autologous transplantation of cocultured mesenchymal stem cells and skeletal myoblasts improves ventricular function in a murine model of Chagas disease. Circulation. 2006;114(1 Suppl):I120-4.
- 7. Federici EE, Abelmann WH, Neva FA. Chronic and progressive myocarditis and myositis in C3H mice infected with Trypanosoma cruzi. Am J Trop Med Hyg. 1964;13:272-80.
- 8. Larsen KH, Andersen TE, Kassem M. [Bone and cartilage repair using stem cells]. Ugeskr Laeger. 2010;172(38):2616-9.
- 9. Choi S, Kim J, Hwang S. Mesenchymal stem cell therapy for chronic renal failure. Expert Opin Biol Ther. 2010;10(8):1217-26.
- 10. Boyle AJ, McNiece IK, Hare JM. Mesenchymal stem cell therapy for cardiac repair. Methods Mol Biol. 2010;660:65-84.
- 11. Hackett TL, Knight DA, Sin DD. Potential role of stem cells in management of COPD. Int J Chron Obstruct Pulmon Dis. 2010;5:81-8.
- 12. Uccelli A, Pistoia V, Moretta L. Mesenchymal stem cells: a new strategy for immunosuppression? Trends Immunol. 2007;28(5):219-26.
- 13. Salem HK, Thiemermann C. Mesenchymal stromal cells: current understanding and clinical status. Stem Cells. 2010;28(3):585-96.
- 14. Schäffler A, Büchler C. Concise review: adipose tissue-derived stromal cells--basic and clinical implications for novel cell-based therapies. Stem Cells. 2007;25(4):818-27.
- 15. Planat-Bénard V, Menard C, André M, Puceat M, Perez A, Garcia-Verdugo JM, et al. Spontaneous cardiomyocyte differentiation from adipose tissue stroma cells. Circ Res. 2004;94(2):223-9.
- 16. Zhu Y, Liu T, Song K, Ning R, Ma X, Cui Z. ADSCs differentiated into cardiomyocytes in cardiac microenvironment. Mol Cell Biochem. 2009;324(1-2):117-29.
- 17. Cai L, Johnstone BH, Cook TG, Tan J, Fishbein MC, Chen PS, et al. IFATS collection: human adipose tissue-derived stem cells induce angiogenesis and nerve sprouting following myocardial infarction, in conjunction with potent preservation of cardiac function. Stem Cells. 2009;27(1):230-7.
- 18. Hwangbo S, Kim J, Her S, Cho H, Lee J. Therapeutic potential of human adipose stem cells in a rat myocardial infarction model. Yonsei Med J. 2010;51(1):69-76.
- 19. Nakamuta JS, Danoviz ME, Marques FL, dos Santos L, Becker C, Gonçalves GA, et al. Cell therapy attenuates cardiac dysfunction post myocardial infarction: effect of timing, routes of injection and a fibrin scaffold. PLoS One. 2009;4(6):e6005.
- 20. Furlani D, Ugurlucan M, Ong L, Bieback K, Pittermann E, Westien I, et al. Is the intravascular administration of mesenchymal stem cells safe? Mesenchymal stem cells and intravital microscopy. Microvasc Res. 2009;77(3):370-6.
- 21. Gordon D, Pavlovska G, Glover CP, Uney JB, Wraith D, Scolding NJ. Human mesenchymal stem cells abrogate experimental allergic encephalomyelitis after intraperitoneal injection, and with sparse CNS infiltration. Neurosci Lett. 2008;448(1):71-3.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
09 Abr 2013 -
Data do Fascículo
Maio 2013
Histórico
-
Recebido
03 Jul 2012 -
Aceito
21 Dez 2012 -
Revisado
10 Dez 2012