Resumo
Fundamento:
O núcleo do trato solitário (NTS) é uma área do cérebro que desempenha um papel fundamental na regulação renal e cardiovascular através dos impulsos dos barorreceptores.
Objetivos:
O objetivo deste estudo foi avaliar o efeito da Naringina (NAR) e trimetazidina (TMZ), isoladamente e combinadas, na atividade elétrica do NTS e na sensibilidade barorreflexa (SBR) na lesão de isquemia e reperfusão (I/R) renal.
Métodos:
Foram utilizados quarenta ratos machos Sprague-Dawley (200-250 g), alocados em 5 grupos com 8 ratos cada. Grupos: 1) Sham; 2) I/R; 3) TMZ 5 mg/kg; 4) NAR 100 mg/kg; e 5) TMZ5 + NAR100. A veia femoral esquerda foi canulada para infundir a solução salina ou droga e avaliar a SBR. A I/R foi induzida por oclusão dos pedículos renais por 45 min, seguida de reperfusão de 4 horas. O eletroencefalograma local do NTS foi registrado antes, durante a isquemia e durante a reperfusão. A fenilefrina foi injetada por via intravenosa para avaliar a SBR ao final do tempo de reperfusão. Os dados foram analisados por ANOVA de duas vias com medidas repetidas seguida pelo teste post hoc de Tukey. Um valor de p<0,05 foi considerado como significativo.
Resultados:
As ondas elétricas do NTS não se alteraram durante o tempo de isquemia, mas diminuíram significativamente durante todos os tempos de reperfusão. A atividade elétrica do NTS e a SBR foram reduzidas drasticamente em ratos com lesão I/R; no entanto, a administração de NAR e TMZ, isoladamente e combinadas, melhorou significativamente essas alterações em ratos com lesão I/R.
Conclusões:
Os resultados mostraram que a lesão de I/R leva à redução da atividade elétrica da SBR e do NTS, e pode haver uma ligação entre a I/R e a diminuição da SBR. Além disso, a NAR e a TMZ são agentes promissores para tratar complicações de I/R.
Palavras-chave:
Isquemia-Reperfusão Renal; Sensibilidade Barorreflexa; Núcleo do Trato Solitário; Naringina; Trimetazidina
Abstract
Background:
Nucleus tractus solitarius (NTS) is a brain area that plays a key role in kidney and cardiovascular regulation via baroreceptors impulses.
Objectives:
The aim of this study was to evaluate the effect of naringin (NAR) and trimetazidine (TMZ) alone and their combination on NTS electrical activity and baroreceptor sensitivity (BRS) in renal ischemia- reperfusion (I/R) injury.
Methods:
Forty male Sprague-Dawley rats (200- 250 g) were allocated into 5 groups with 8 in each. 1) Sham; 2) I/R; 3) TMZ 5 mg/kg; 4) NAR 100 mg/kg; and 5) TMZ5+ NAR100. The left femoral vein was cannulated to infuse saline solution or drug and the BRS was evaluated. I/R was induced by occlusion of renal pedicles for 45 min, followed by 4 hours of reperfusion. The NTS local electroencephalogram (EEG) was recorded before, during ischemia and throughout the reperfusion. Phenylephrine was injected intravenously to evaluate BRS at the end of reperfusion time. The data were analyzed by two-way repeated measurement ANOVA followed by Tukey's post hoc test. A p-value <0.05 was considered significant.
Results:
NTS electrical waves did not change during ischemia time, while they significantly decreased during the entire reperfusion time. NTS electrical activity and BRS dramatically reduced in rats with I/R injury; however, administration of NAR, TMZ alone or their combination significantly improved these changes in rats with I/R injury.
Conclusions:
The results showed that I/R injury leads to reduced BRS and NTS electrical activity and there may be an association between I/R and decreased BRS. In addition, NAR and TMZ are promising agents to treat I/R complications.
Keywords:
Renal ischemia-reperfusion injury; Baroreflex sensitivity; Nucleus tractus solitaries; Naringin; Trimetazidine
Introdução
A lesão renal aguda (LRA) é um grande problema clínico com alta prevalência que afeta mais de 50% dos pacientes na unidade de terapia intensiva e causa mortalidade superior a 60%.11. Trof RJ, Di Maggio F, Leemreis J, Groeneveld AJ. Biomarkers of acute renal injury and renal failure. Shock. 2006; 26 (3):245-53.,22. Leung AK, Yan WW. Renal replacement therapy in critically ill patients. Hong Kong Med J. 2009;15 (2):122-9. A isquemia/reperfusão renal (I/R) é uma das causas mais importantes de LRA, e a geração de espécies reativas de oxigênio (ERO) desempenha um papel importante em eventos de lesão de I/R.33. Kosieradzki M, Rowinski W. Ischemia/reperfusion injury in kidney transplantation: mechanisms and prevention. Transplantation proc. 2008;40 (10): 3279-88.
A superprodução de radicais livres na lesão de I/R induz apoptose e, em última instância, morte celular e disfunção orgânica.33. Kosieradzki M, Rowinski W. Ischemia/reperfusion injury in kidney transplantation: mechanisms and prevention. Transplantation proc. 2008;40 (10): 3279-88. O estresse oxidativo (ERO sobre o sistema de defesa antioxidante) é conhecido como um fator de lesão de I/R.33. Kosieradzki M, Rowinski W. Ischemia/reperfusion injury in kidney transplantation: mechanisms and prevention. Transplantation proc. 2008;40 (10): 3279-88. Radicais livres de oxigênio e ERO são transmitidos pela corrente sanguínea para órgãos distantes e são considerados agentes intermediários para danos a órgãos distantes resultantes de I/R.44. Kalogeris T, Baines CP, Krenz M, Korthuis RJ. Cell biology of ischemia/reperfusion injury. Int Rev Cell Mol Biol. 2012; 298: 229-317. doi.org/10.1016/B978-0-12-394309-5.00006-7
https://doi.org/10.1016/B978-0-12-394309...
,55. Carden DL, Granger DN. Pathophysiology of ischaemia–reperfusion injury. J Pathol. 2000; 190(3): 255-66.
O Núcleo do Trato Solitário (NTS) atua como a porta de entrada para o sistema nervoso central para inserir informações sensoriais que desempenham um papel importante na regulação cardiovascular.66. Dibona GF, Kopp UC. Neural control of renal function. Physiol Rev. 1997; 77(1): 75-197. Barorreceptores periféricos, quimiorreceptores e nervos aferentes simpáticos renais criam a sinapse primária no NTS.77. Kawabe T, Chitravanshi VC, Kawabe K, Sapru HN. Cardiovascular function of a glutamatergic projection from the hypothalamic paraventricular nucleus to the nucleus tractus solitarius in the rat. Neuroscience. 2008; 153(3): 605-17. A disfunção dos barorreceptores leva à perda da regulação das flutuações da pressão arterial e diminuição da sensibilidade barorreflexa (SBR), a qual é uma base fisiopatológica bem conhecida nos distúrbios cardiovasculares.88. Kaur M, Chandran DS, Jaryal AK, Bhowmik D, Agarwal SK, Deepak KK. Baroreflex dysfunction in chronic kidney disease. World J Nephrol. 2016;5(1):53-65. As evidências disponíveis indicam que a degradação do NTS leva a alternâncias da pressão arterial.77. Kawabe T, Chitravanshi VC, Kawabe K, Sapru HN. Cardiovascular function of a glutamatergic projection from the hypothalamic paraventricular nucleus to the nucleus tractus solitarius in the rat. Neuroscience. 2008; 153(3): 605-17. Portanto, o NTS é um dos principais centros de regulação da SBR.88. Kaur M, Chandran DS, Jaryal AK, Bhowmik D, Agarwal SK, Deepak KK. Baroreflex dysfunction in chronic kidney disease. World J Nephrol. 2016;5(1):53-65.
A Naringina (4, 5, 7-trihidroxiflavanona-7-ramnoglucosídeo, NAR) é um composto polifenol encontrado principalmente na toranja e em várias plantas cítricas. Os efeitos antimicrobianos, antimutagênicos, anticâncer, antiinflamatórios, eliminadores de radicais livres e antioxidantes da NAR foram demonstrados.99. Singh D, Chopra K. The effect of naringin, a bioflavonoid on ischemia-reperfusion induced renal injury in rats. Pharmacolol Res. 2004;50(2):187-93.,1010. Gaur V, Aggarwal A, Kumar A. Protective effect of naringin against ischemic reperfusion cerebral injury: possible neurobehavioral, biochemical and cellular alterations in rat brain. Eur J Pharmacol. 2009; 616(1-3):147-54. Os efeitos protetores da NAR através do aumento da atividade de enzimas antioxidantes foram documentados.99. Singh D, Chopra K. The effect of naringin, a bioflavonoid on ischemia-reperfusion induced renal injury in rats. Pharmacolol Res. 2004;50(2):187-93.,1010. Gaur V, Aggarwal A, Kumar A. Protective effect of naringin against ischemic reperfusion cerebral injury: possible neurobehavioral, biochemical and cellular alterations in rat brain. Eur J Pharmacol. 2009; 616(1-3):147-54.
A trimetazidina (dicloridrato de 1- [2,3,4-trimetoxibenzil] piperazina, TMZ), é uma droga anti-isquêmica utilizada na angina instável.1111. Szwed H, Sadowski Z, Pachocki R, Domżał-Bocheńska M, Szymczak K, Szydłowski Z, et al. Proposed antiischemic effects of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL-1. Cardiovasc Drugs Therap. 1999; 13 (3): 217-22. O poro de transição da permeabilidade mitocondrial (mPTP, do inglês mitochondrial permeability transition pore) localizado na membrana interna da mitocôndria desempenha um papel poderoso na produção de ERO e no início da apoptose após lesão de I/R.1212. Jassem W, Heaton ND. The role of mitochondria in ischemia/reperfusion injury in organ transplantation. Kidney Int. 2004;66(2):514-7. Um estudo experimental documentou que a TMZ foi capaz de inibir o mPTP e reduzir o tamanho do infarto na lesão de I/R do miocárdio e a atividade da caspase-3.1313. Argaud L, Gomez L, Gateau-Roesch O, Couture-Lepetit E, Loufouat J, Robert D, et al. Trimetazidine inhibits mitochondrial permeability transition pore opening and prevents lethal ischemia-reperfusion injury. J Mol Cell Cardiol. 2005; 39(6): 893-9. Além disso, foi relatada a inibição da peroxidação lipídica pela TMZ.1414. Grekas D, Dioudis C, Papageorgiou G, Iliadis S, Zilidis C, AlivanisP, et al. Lipid Peroxidation After Acute Renal Ischemia and Reperfusion in Rats: The Effect of Trimetazidine. Ren Fail. 1996;18(4): 545-52. O objetivo deste estudo foi avaliar o efeito da NAR e TMZ, isoladamente e em combinação, na atividade elétrica de campo local do NTS, no eletroencefalograma (EEG) local e na SBR após lesão renal de I/R.
Métodos
Drogas
TMZ, NAR, cetamina, xilazina e uretano foram adquiridos da Sigma Co. USA. NAR e TMZ foram dissolvidas em água destilada, e o uretano foi dissolvido em solução salina normal imediatamente antes do uso.
Animais
No estudo atual, e de acordo com nossos estudos anteriores e outros semelhantes, quarenta ratos machos Sprague-Dawley (pesando 200-250 g) foram adquiridos no centro de criação e cuidados de animais da Ahvaz Jundishapur University of Medical Sciences (AJUMS). Todos os animais foram alojados em gaiolas padrão (4 em cada gaiola) sob temperatura (22 ± 2°C) e umidade (50-55%) controladas e ciclo claro/escuro de 12 h (luzes ligadas às 07:00 da manhã), com livre acesso a pellets de ração alimentar e água da torneira. Os ratos foram alocados de forma simples e não randomizada em cinco grupos com oito ratos cada. Grupos: 1) Sham, 2) I/R, 3) TMZ 5 mg/kg; ratos com lesão de I/R receberam TMZ (5 mg/kg, iv) cinco minutos antes da reperfusão,1515. Cau J, Favreau F, Tillement JP, Lerman LO, Hauet T, Goujon JM. Trimetazidine reduces early and long-term effects of experimental renal warm ischemia: a dose effect study. J Vasc Surg. 2008; 47(4): 852-60. 4) NAR 100 mg/kg; ratos com lesão de I/R receberam NAR (100 mg/kg, ip) uma vez por dia durante sete dias antes da I/R,1010. Gaur V, Aggarwal A, Kumar A. Protective effect of naringin against ischemic reperfusion cerebral injury: possible neurobehavioral, biochemical and cellular alterations in rat brain. Eur J Pharmacol. 2009; 616(1-3):147-54. e 5) TMZ 5 mg/kg + NAR 100 mg/kg; ratos com lesão de I/R receberam TMZ 5 mg/kg + NAR 100 mg/kg. Os ratos nos grupos sham e I/R receberam veículo (solução salina estéril). Os ratos do grupo sham foram submetidos a procedimento cirúrgico idêntico, sem clampeamento e indução de I/R.
Cirurgia estereotáxica para implante de eletrodo
Uma semana antes do registro do EEG, os ratos foram anestesiados com cetamina (50 mg/kg) e xilazina (5 mg/kg), por via intraperitoneal. A temperatura corporal dos ratos foi mantida em 36,5 ± 0,5°C utilizando almofadas térmicas com as cabeças montadas em um dispositivo estereotáxico (Narishige Co., Japão) para a cirurgia de implantação de eletrodos. Um eletrodo bipolar de fio aço inoxidável revestido em teflon (0,005” tipo “bare”, 0,008” revestido, A-M Systems, Inc. WA) foi implantado no NTS com o atlas estereotáxico de Paxinos e Watson com coordenação de AP = −14,04 mm até o bregma; ML = 0,4 mm e DV = 8 mm a partir da dura-máter, de maneira adequada.1616. Nejad KH, Dianat M, Sarkaki A, GharibNaseri MK, Badavi M, Farbood Y. Ellagic acid improves electrocardiogram waves and blood pressure against global cerebral ischemia rat experimental models. Electron physician. 2015;7(4): 1153-62. Todos os implantes foram fixados no crânio com resina acrílica odontológica e dois pequenos parafusos-âncora de vidro.
Indução de isquemia/reperfusão (I/R) renal
Os ratos foram mantidos em jejum durante a noite antes da cirurgia (por pelo menos 10 h), mas com livre acesso à água. No dia da cirurgia, os ratos de cada grupo foram anestesiados com uretano (1,7 g/kg, i.p.).1717. Maleki M, Nematbakhsh M. Renal Blood Flow Response to Angiotensin 1-7 versus Hypertonic Sodium Chloride 7.5% Administration after Acute Hemorrhagic Shock in Rats. Int J Vas Med. 2016;2016: 6562017. Doi: 10.1155/2016/6562017
https://doi.org/10.1155/2016/6562017...
Em seguida, os ratos foram colocados sobre uma almofada térmica (Harvard Apparatus, Reino Unido) para manter a temperatura corporal em aproximadamente 37 ºC. Quinze minutos após a anestesia, a veia femoral esquerda foi cateterizada utilizando um cateter de polietileno (PE50) para infusão de solução salina ou TMZ, e a artéria femoral esquerda foi utilizada para medir a pressão arterial e a SBR. Os rins esquerdo e direito foram expostos através de uma incisão na linha média. A isquemia bilateral foi induzida por oclusão de ambos os pedículos renais através de clampeamento não-traumático por 45 min. Depois disso, as pinças de clampeamento foram removidas e a reperfusão continuou por 4 horas.1818. Nesic Z, Todorovic Z, Stojanovic R, Basta-Jovanovic G, Radojevic-Skodric S, Velickovic R, et al. Single-dose intravenous simvastatin treatment attenuates renal injury in an experimental model of ischemia-reperfusion in the rat. J Pharmacol Sci. 2006; 102(4): 413-7.
Registro local de EEG
Potenciais de campo locais (EEG local) do NTS dos ratos foram adicionados a um bio-amplificador ML135 (aquisição de dados de 4 canais, Power Lab. e software Lab Chart versão 7, AD Instruments Co., Austrália) com amplificação de 1 mV, taxa de amostragem de 400 Hz e filtragem de passa-banda de 0,3–70 Hz por 5 minutos. O período de variações básicas de 5 segundos do EEG foi comparado em todos os grupos. A potência elétrica das bandas de frequência foi medida em mV22. Leung AK, Yan WW. Renal replacement therapy in critically ill patients. Hong Kong Med J. 2009;15 (2):122-9./Hz. O registro do EEG local foi realizado antes da isquemia por 45 min e durante o tempo de isquemia e reperfusão, de maneira adequada.
Medida da pressão arterial média
A pressão arterial média foi registrada através da cateterização da artéria femoral esquerda conectada a transdutor de pressão e monitorada através do Power Lab System (AD Instruments, Austrália), antes da isquemia por 20 min para adaptação, durante o tempo de isquemia e reperfusão.
Sensibilidade barorreflexa
Em todos os grupos, ao final do período de reperfusão, foram realizadas injeções intravenosas de fenilefrina (10 a 20 µg/kg) e as alterações na pressão arterial e frequência cardíaca foram registradas com transdutor de pressão e monitoradas e registradas em um PC, utilizando o software Lab Chart. Intervalos de 15 minutos de recuperação foram realizados entre as injeções da droga para atingir o nível anterior de pressão arterial. Para cada injeção, a amplitude máxima da pressão resultante e bradicardia foram utilizadas para calcular a pressão arterial média (ΔPAM) e as alterações da frequência cardíaca (ΔFC). A razão da variação de ΔFC para a variação de ΔPAM foi utilizada como o índice da SBR.1919. Azadbakht MK, Nematbakhsh M. Angiotensin 1-7 administration alters baroreflex sensitivity and renal function in sympathectomized rats. J Nephropathol. 2017;7(2):79-82.
Análise estatística
Os dados obtidos para pressão arterial média, frequência cardíaca e EEG local foram analisados com ANOVA de duas vias com medidas repetidas seguida pelo teste post hoc de Tukey para comparações múltiplas utilizando o software Prisma versão 6.0 (San Diego, CA). Os dados foram expressos como média e desvio padrão (DP). Valores de p <0,05 foram considerados como diferenças significativas.
Resultados
Efeito da NAR, TMZ ou a combinação de ambas na atividade elétrica de campo local do NTS
Não houve alterações significativas na potência elétrica do NTS durante o período pré-I/R e durante os 45 minutos de isquemia. Entretanto, a potência elétrica do NTS diminuiu drasticamente durante toda a 1ᵃ, 2ᵃ, 3ᵃ e 4ᵃ horas do período de reperfusão no grupo I/R em comparação com os ratos do grupo sham. Por outro lado, a administração de NAR e TMZ, isoladamente ou combinadas, melhorou sua energia em comparação com o grupo I/R (Tabela 1).
Efeito do pré-tratamento com Naringina (NAR), Trimetazidina (TMZ) ou combinação de ambas na atividade elétrica do NTS após lesão renal de I/R
Efeito da NAR e TMZ na frequência cardíaca e pressão arterial
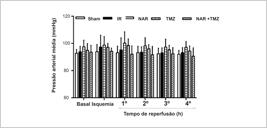
A lesão renal de I/R reduziu significativamente a frequência cardíaca, enquanto o pré-tratamento com NAR, TMZ ou a combinação de ambas restaurou de alguma forma a frequência cardíaca aos valores normais (Figura 1). Em relação à pressão arterial média, os resultados não mostraram diferenças entre os grupos (Figura 2).
Efeito do pré-tratamento com Naringina (NAR), Trimetazidina (TMZ) ou a combinação de ambas na frequência cardíaca após lesão de I/R renal (I/R). Os dados foram representados como média ± DP (n = 8). Sham (grupo cirúrgico sham), I/R (Isquemia-reperfusão + solução salina normal), NAR (I/R + NAR 100 mg/kg, ip, por uma semana), TMZ (I/R + TMZ 5 mg/kg, iv, antes da reperfusão). NAR + TMZ, combinação de NAR e TMZ. ANOVA de duas vias com medidas repetidas seguida pelo teste post hoc de Tukey. *p<0,05, vs. grupo sham.
Efeito da Naringina (NAR), Trimetazidina (TMZ) ou a combinação de ambas na pressão arterial média após lesão de I/R renal (I/R). Os dados foram representados como média ± DP (n = 8). Sham (grupo cirúrgico sham), I/R (Isquemia-reperfusão + solução salina normal), NAR (I/R + NAR 100 mg/kg, ip, por uma semana), TMZ (I/R + TMZ 5 mg/kg, iv, antes da reperfusão). NAR + TMZ, combinação de NAR e TMZ. ANOVA de duas vias com medidas repetidas seguida pelo teste post hoc de Tukey.
Efeito de NAR e TMZ na SBR
Como mostrado na 3, a SBR foi significativamente reduzida no grupo com lesão de I/R quando comparado ao grupo sham. No entanto, a administração de NAR ou TMZ restaurou-a; portanto, não houve diferença entre os grupos sham, NAR e TMZ; contudo, a combinação de ambas elevou a SBR de forma mais significativa.
Efeito do pré-tratamento com Naringina (NAR), Trimetazidina (TMZ) ou a combinação de ambas na sensibilidade barorreflexa (ΔFC/ΔPAM) após I/R renal (I/R). Os dados foram representados como média ± DP (n = 8). Sham (grupo cirúrgico sham), I/R (Isquemia-reperfusão + solução salina normal), NAR (I/R + NAR 100 mg/kg, ip, por uma semana), TMZ (I/R + TMZ 5 mg/kg, iv, antes da reperfusão). NAR + TMZ, combinação de NAR e TMZ. ANOVA de duas vias com medidas repetidas seguida pelo teste post hoc de Tukey. *p<0.05, ***p<0.001, vs. grupo sham, #p< 0.05 vs. grupo I/R.
Discussão
Os achados do presente estudo demonstraram que a lesão de I/R enfraqueceu a atividade elétrica do NTS e da SBR. Entretanto, as mudanças nas ondas cerebrais após a I/R mostraram que a atividade elétrica do NTS foi suprimida e essas alterações foram afetadas por uma possível disfunção cardíaca e renal. A atividade elétrica anormal subsequente do NTS pode prejudicar ainda mais a função cardíaca e agravar as complicações isquêmicas na função renal. Por outro lado, o pré-tratamento com NAR e TMZ por si só restaura as potências elétricas gama e delta, enquanto sua combinação com TMZ melhora todas as outras ondas elétricas registradas do NTS e também restaura a SBR. As fibras aferentes dos barorreceptores são recebidas principalmente no NTS, que tem uma complexa relação neuronal com outras áreas do sistema nervoso central e área vasomotora (o núcleo ambíguo e a medula ventrolateral rostral).2020. Franczyk-Skora B, Gluba-Brzozka A, Wranicz JK, Banach M, Olszewski R, Rysz J. Sudden cardiac death in CKD patients. Int Urol Nephrol. 2015; 47(6): 971-82. Vários estudos já mostraram que doenças como o diabetes, a hipertensão e a insuficiência renal mediada por estresse oxidativo podem enfraquecer a SBR.2121. Tu H, Zhang D, Li Y-L. Cellular and molecular mechanisms underlying arterial baroreceptor remodeling in cardiovascular diseases and diabetes. Neurosci Bull. 2019;35(1):98-112. A LRA aumenta a produção de citocinas anti-inflamatórias e reduz a clearance de citocinas, levando assim à respostas inflamatórias sistêmicas aumentadas.2222. Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R, et al. Cytokine production increases and cytokine clearance decreases in mice with bilateral nephrectomy, Nephrol Dial Transplant. 2012; 27(12):4339-4347.,2323. Chen J, Hartono JR, John R, Bennett M, Zhou XJ, Wang Y, et al. Early interleukin 6 production by leukocytes during ischemic acute kidney injury is regulated by TLR4. Kidney Int. 2011; 80(5): 504-15. Um estudo anterior mostrou uma correlação relativa entre a disfunção dos barorreceptores e o estresse oxidativo.2424. Monteiro MM, Franca-Silva MS, Alves NF, Porpino SK, Braga VA. Quercetin improves baroreflex sensitivity in spontaneously hypertensive rats. Molecules. 2012; 17(11): 12997-3008. Outros estudos mostraram que os antioxidantes podem melhorar a SBR em vários modelos experimentais.2525. Botelho-Ono MS, Pina HV, Sousa KH, Nunes FC, Medeiros IA, Braga VA. Acute superoxide scavenging restores depressed baroreflex sensitivity in renovascular hypertensive rats. Auton Neurosci. 2011; 159(1-2): 38-44. Por outro lado, verificou-se que a administração de sequestrantes de radicais livres como a enzima superóxido dismutase (SOD) e a catalase (CAT) em coelhos com aterosclerose foi capaz de melhorar a função dos barorreceptores, indicando a inibição do efeito das ERO no desempenho dos barorreceptores.2626. Li Z, Mao HZ, Abboud FM, Chapleau MW. Oxygen-derived free radicals contribute to baroreceptor dysfunction in atherosclerotic rabbits. Circ Res. 1996; 79(4): 802-11.
No presente estudo, a NAR e a TMZ, isoladamente ou combinadas, melhoraram a SBR, que pode ter ocorrido através de seus efeitos antioxidantes, através do sequestro da peroxidação lipídica. Nosso estudo anterior mostrou que a NAR ou a TMZ ou a combinação de ambas pode reduzir a disfunção glomerular através do aumento da capacidade antioxidante e redução do nível de microRNA-10a.2727. Amini N, Sarkaki A, Dianat M, Mard SA, Ahangarpour A, Badavi M. The renoprotective effects of naringin and trimetazidine on renal ischemia/reperfusion injury in rats through inhibition of apoptosis and down regulation of micoRNA-10a. Biom Pharmacother. 2019; 112: 108568. DOI: 10.1016/j.biopha.2019.01.029
https://doi.org/10.1016/j.biopha.2019.01...
Em concordância com este estudo e outros achados anteriores, a SBR é atenuada pelo estresse oxidativo, e os compostos polifenóis a melhoram através do sequestro dos radicais livres.2828. Queiroz TM, Guimaraes DD, Mendes-Junior LG, Braga VA. alpha-lipoic acid reduces hypertension and increases baroreflex sensitivity in renovascular hypertensive rats. Molecules. 2012;17(11): 13357-67. Além disso, muitas evidências indicaram que a lesão de I/R levou à redução da síntese de óxido nítrico, que é um dos principais contribuintes de disfunção endotelial, seguida pela disfunção dos barorreceptores.2929. Chapleau MW, Cunningham JT, Sullivan MJ, Wachtel RE, Abboud FM. Structural versus functional modulation of the arterial baroreflex. Hypertension. 1995;26 (2): 341–7. A este respeito, a NAR melhora a disfunção endotelial sintetizando e aumentando a biodisponibilidade do óxido nítrico.3030. Ikemura M, Sasaki Y, Giddings JC, Yamamoto J. Preventive effects of hesperidin, glucosyl hesperidin and naringin on hypertension and cerebral thrombosis in stroke-prone spontaneously hypertensive rats. Phytother Res. 2012; 26(9): 1272-7. Em um estudo realizado em humanos, também foi demonstrado que a TMZ melhorou a disfunção endotelial na insuficiência cardíaca crônica, ao reduzir os níveis de peroxidação de lipídios.3131. Belardinelli R, Solenghi M, Volpe L, Purcaro A. Trimetazidine improves endothelial dysfunction in chronic heart failure: an antioxidant effect. Eur Heart Journal. 2007; 28(9):1102-8. Um estudo experimental mostrou que a TMZ reduziu o malondialdeído, um índice de lesão oxidativa renal, em um modelo de lesão de I/R renal.1414. Grekas D, Dioudis C, Papageorgiou G, Iliadis S, Zilidis C, AlivanisP, et al. Lipid Peroxidation After Acute Renal Ischemia and Reperfusion in Rats: The Effect of Trimetazidine. Ren Fail. 1996;18(4): 545-52. A TMZ estimula a oxidação da glicose ao reduzir a oxidação dos ácidos graxos beta, que levam à produção de ATP com menor consumo de oxigênio.1111. Szwed H, Sadowski Z, Pachocki R, Domżał-Bocheńska M, Szymczak K, Szydłowski Z, et al. Proposed antiischemic effects of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL-1. Cardiovasc Drugs Therap. 1999; 13 (3): 217-22.
Os resultados deste estudo mostraram a melhora da SBR com o pré-tratamento com NAR e/ou TMZ na I/R. Embora o mecanismo preciso dos efeitos antioxidantes de NAR e TMZ na SBR não esteja claro na I/R renal, é possível que a NAR, a TMZ ou a combinação de ambas aumentem a SBR na I/R renal devido à melhora da função do sistema nervoso autônomo. Recentemente, foi demonstrado que a administração de antioxidantes pode melhorar a SBR através da melhora da função autonômica.2424. Monteiro MM, Franca-Silva MS, Alves NF, Porpino SK, Braga VA. Quercetin improves baroreflex sensitivity in spontaneously hypertensive rats. Molecules. 2012; 17(11): 12997-3008. Os mecanismos centrais da NAR e TMZ precisam ser esclarecidos em novos estudos sobre a função do sistema nervoso autônomo.2525. Botelho-Ono MS, Pina HV, Sousa KH, Nunes FC, Medeiros IA, Braga VA. Acute superoxide scavenging restores depressed baroreflex sensitivity in renovascular hypertensive rats. Auton Neurosci. 2011; 159(1-2): 38-44.
A redução da função renal leva ao acúmulo de toxinas e ao aumento da osmolalidade sérica, o que pode estimular diretamente a síntese do fator de crescimento endotelial vascular. Além disso, o aumento da produção de ERO leva ao dano endotelial e à permeabilidade da barreira hematoencefálica (BHE).3232. Chi OZ, HunterC, Liu X, Tan T, Weiss HR. Effects of VEGF on the blood-brain barrier disruption caused by hyperosmolarity. Pharmacology. 2008; 82(3):187-92.,3333. Sadik NA, Mohamed WA, Ahmed MI. The association of receptor of advanced glycated end products and inflammatory mediators contributes to endothelial dysfunction in a prospective study of acute kidney injury patients with sepsis. Mol Cell Biochem. 2012; 359(1-2): 73-81. Várias linhas de estudos mostraram que o desempenho da BHE foi interrompido em modelos experimentais de LRA indicados pelo corante azul de Evans sobre a permeabilidade para o tecido cerebral.3434. Tso N, Hsu HP, Wu CM, Liu CC, Lei HY. Tumour necrosis factor-α causes an increase in blood-brain barrier permeability during sepsis. J Med Microbiol. 2001;50(9): 812-21.,3535. Liu M, Liang Y, Chigurupati S, Lathia JD, Pletnikov M, Z Sun, et al. Acute kidney injury leads to inflammation and functional changes in the brain. J Am Soc of Nephrol. 2008;19(7): 1360-70. Por outro lado, modelos inflamatórios experimentais induzidos pelo fator de necrose tumoral alfa (TNF-α) aumentam a permeabilidade da BHE de forma anormal. Esses estudos experimentais apoiam a ideia de que a inflamação associada à LRA aumenta as citocinas inflamatórias na corrente sanguínea e isso pode prejudicar a permeabilidade da BHE.3636. Prieto I, Martinez JM, Hermoso F, Ramirez MJ, Vargas F, De Gasparo M, et al. Oral administration of losartan influences aminopeptidase activity in the frontal cortex. Eur Neuropsychopharmacol. 2000;10(4): 279-82. Muitas evidências demonstraram que a NAR é um potente antioxidante que atravessa a BHE e reduz os fatores inflamatórios para proteger o cérebro.3737. Zbarsky V, Datla KP, Parkar S, Rai DK, Aruoma OI, Dexter DT. Neuroprotective properties of the natural phenolic antioxidants curcumin and naringenin but not quercetin and fisetin in a 6-OHDA model of Parkinson's disease. Free Radic Res. 2005; 39(10):1119-25.,3838. Tsai TH. Determination of naringin in rat blood, brain, liver, and bile using microdialysis and its interaction with cyclosporin a, a p-glycoprotein modulator. J Agric Food Chem. 2002;50(23): 6669-74. Uma queda abrupta na função renal leva ao acúmulo de toxinas e ao aumento da osmolalidade sérica, o que pode aumentar as ERO, resultando em lesão endotelial, ruptura da BHE e dos transmissores cerebrais.3939. Nongnuch A, Panorchan K, Davenport A. Brain–kidney crosstalk. Crit Care. 2014;18(3): 225. doi: 10.1186/cc13907.
https://doi.org/10.1186/cc13907...
Um estudo experimental mostrou que a lesão cerebral de I/R resulta em alterações nos parâmetros eletrofisiológicos cardíacos, bem como na redução da atividade elétrica do NTS. Entretanto, a administração de antioxidantes evitou essas complicações.1616. Nejad KH, Dianat M, Sarkaki A, GharibNaseri MK, Badavi M, Farbood Y. Ellagic acid improves electrocardiogram waves and blood pressure against global cerebral ischemia rat experimental models. Electron physician. 2015;7(4): 1153-62. A redução da disponibilidade de oxigênio para o sistema neuronal, seguida pela ruptura dos vasos sanguíneos levou a uma cascata de eventos, incluindo ativação de receptores de glutamato e influxo de Ca2 +.4040. Mattson MP. Excitotoxic and excitoprotective mechanisms: abundant targets for the prevention and treatment of neurodegenerative disorders. Neuromolecular Med. 2003; 3(2): 65-94. A ativação dos receptores de glutamato causou um aumento na concentração citoplasmática de Ca2+ como resultado do influxo de Ca2+ através dos canais dos receptores α-amino-3-hidroxi-5-metilisoxazol-4-propionato (AMPA) e N-metil-D-aspartato (NMDA) e canais de Ca2+ dependentes de voltagem (VDCC, do inglês voltage-dependent Ca2+ channels). A abertura dos receptores inotrópicos de glutamato e o consequente influxo de Na+ e Ca2+ são identificados como os primeiros estágios do processo excitotóxico.4040. Mattson MP. Excitotoxic and excitoprotective mechanisms: abundant targets for the prevention and treatment of neurodegenerative disorders. Neuromolecular Med. 2003; 3(2): 65-94.
Outro estudo experimental mostrou que LRA induzida por I/R renal levava à disfunção renal e aumento da atividade do nervo simpático renal e aumento das concentrações de norepinefrina, indicando o papel do sistema nervoso simpático no desenvolvimento da LRA.4141. Fujii T, Kurata H, Takaoka M, Muraoka T, Fujisawa Y, Shokoji T, et al. The role of renal sympathetic nervous system in the pathogenesis of ischemic acute renal failure. Eur J Pharmacol. 2003; 481(2-3):241-8. Recentemente, o papel dos nervos renais no modelo de I/R renal mostrou que a denervação do nervo renal simpático melhorou a função do órgão, reduziu a resposta dos fatores inflamatórios e a apoptose sem alterações na pressão arterial.4242. Kim J, Padanilam BJ. Renal denervation prevents long-term sequelae of ischemic renal injury. Kidney Int. 2015; 87(2): 350-8. Por outro lado, Mitaka et al. mostraram que a I/R renal levou a uma redução da pressão arterial e nenhuma alteração da frequência cardíaca, o que se opõe aos resultados deste estudo.4343. Mitaka C, Si MK, Tulafu M, Yu Q, Uchida T, Abe S, et al. Effects of atrial natriuretic peptide on inter-organ crosstalk among the kidney, lung, and heart in a rat model of renal ischemia-reperfusion injury, Intensive Care Med. 2014;2(1):28. doi: 10.1186/s40635-014-0028-8.
https://doi.org/10.1186/s40635-014-00280...
Essa controvérsia pode estar relacionada ao modelo experimental, à espécie animal e ao período de reperfusão. Nosso estudo anterior indicou que a lesão renal de I/R resulta em disfunção renal e lesão miocárdica, e o pré-tratamento com NAR e TMZ, isoladamente ou combinadas, poderia ter papel protetor no efeito remoto da LRA no estresse oxidativo e lesão miocárdica através da regulação do Nrf-2.4444. Amini N, Dianat M, Mard SA, Ahangarpour A, Badavi M. Protective effects of naringin and trimetazidine on remote effect of acute renal injury on oxidative stress and myocardial injury through Nrf-2 regulation. Pharmacol Rep. 2019;71(6): 1059-1066.
Limitações
Este estudo apresentou algumas limitações. Primeiramente, ele é parte de uma tese de doutorado, incluindo limitações financeiras e de tempo. Portanto, não foi possível identificar alguns parâmetros como histologia cerebral e medidas de parâmetros moleculares e antioxidantes no tecido cerebral. Nosso objetivo foi investigar a atividade da SBR e do NTS no modelo de LRA.
Conclusão
Nossos achados, juntamente com os achados de outras pesquisas, estão de acordo com o presente estudo, que sugere que a redução da função renal devido à lesão de I/R renal leva à redução da atividade elétrica da SBR e do NTS. Provavelmente, existe uma ligação entre a redução da função renal e a diminuição da SBR, embora a NAR e a TMZ, isoladamente ou combinadas, melhorem a atividade elétrica da SBR e do NTS. Entretanto, pode-se esperar que esses tipos de agentes antioxidantes possam ser utilizados para prevenir complicações renais de lesão de I/R em áreas além do local da lesão.
-
Fontes de financiamentoO presente estudo foi financiado por The Persian Gulf Physiology Research Center of Ahvaz Jundishapur University of Medical Sciences.
-
Vinculação acadêmicaEste artigo é parte de tese de Doutorado de Negin Amini pelo Ahvaz Jundishapur University of Medical Sciences..
-
Aprovação ética e consentimento informadoEste estudo foi aprovado pelo Comitê de Ética do Ahvaz Jundishapur University of Medical Sciences sob o número de protocolo IR.AJUMS.REC.1395.149. Todos os procedimentos envolvidos nesse estudo estão de acordo com a Declaração de Helsinki de 1975, atualizada em 2013.
Agradecimentos
Este artigo é parte da tese de doutorado de Negin Amini, que é estudante da Ahvaz Jundishapur University of Medical Sciences. Este trabalho recebeu apoio do Persian Gulf Physiology Research Center of Ahvaz Jundishapur University of Medical Sciences. Os autores agradecem a ajuda e apoio financeiro do Persian Gulf Research Center of Ahvaz Jundishapur University of Medical Sciences.
Referências
-
1Trof RJ, Di Maggio F, Leemreis J, Groeneveld AJ. Biomarkers of acute renal injury and renal failure. Shock. 2006; 26 (3):245-53.
-
2Leung AK, Yan WW. Renal replacement therapy in critically ill patients. Hong Kong Med J. 2009;15 (2):122-9.
-
3Kosieradzki M, Rowinski W. Ischemia/reperfusion injury in kidney transplantation: mechanisms and prevention. Transplantation proc. 2008;40 (10): 3279-88.
-
4Kalogeris T, Baines CP, Krenz M, Korthuis RJ. Cell biology of ischemia/reperfusion injury. Int Rev Cell Mol Biol. 2012; 298: 229-317. doi.org/10.1016/B978-0-12-394309-5.00006-7
» https://doi.org/10.1016/B978-0-12-394309-5.00006-7 -
5Carden DL, Granger DN. Pathophysiology of ischaemia–reperfusion injury. J Pathol. 2000; 190(3): 255-66.
-
6Dibona GF, Kopp UC. Neural control of renal function. Physiol Rev. 1997; 77(1): 75-197.
-
7Kawabe T, Chitravanshi VC, Kawabe K, Sapru HN. Cardiovascular function of a glutamatergic projection from the hypothalamic paraventricular nucleus to the nucleus tractus solitarius in the rat. Neuroscience. 2008; 153(3): 605-17.
-
8Kaur M, Chandran DS, Jaryal AK, Bhowmik D, Agarwal SK, Deepak KK. Baroreflex dysfunction in chronic kidney disease. World J Nephrol. 2016;5(1):53-65.
-
9Singh D, Chopra K. The effect of naringin, a bioflavonoid on ischemia-reperfusion induced renal injury in rats. Pharmacolol Res. 2004;50(2):187-93.
-
10Gaur V, Aggarwal A, Kumar A. Protective effect of naringin against ischemic reperfusion cerebral injury: possible neurobehavioral, biochemical and cellular alterations in rat brain. Eur J Pharmacol. 2009; 616(1-3):147-54.
-
11Szwed H, Sadowski Z, Pachocki R, Domżał-Bocheńska M, Szymczak K, Szydłowski Z, et al. Proposed antiischemic effects of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL-1. Cardiovasc Drugs Therap. 1999; 13 (3): 217-22.
-
12Jassem W, Heaton ND. The role of mitochondria in ischemia/reperfusion injury in organ transplantation. Kidney Int. 2004;66(2):514-7.
-
13Argaud L, Gomez L, Gateau-Roesch O, Couture-Lepetit E, Loufouat J, Robert D, et al. Trimetazidine inhibits mitochondrial permeability transition pore opening and prevents lethal ischemia-reperfusion injury. J Mol Cell Cardiol. 2005; 39(6): 893-9.
-
14Grekas D, Dioudis C, Papageorgiou G, Iliadis S, Zilidis C, AlivanisP, et al. Lipid Peroxidation After Acute Renal Ischemia and Reperfusion in Rats: The Effect of Trimetazidine. Ren Fail. 1996;18(4): 545-52.
-
15Cau J, Favreau F, Tillement JP, Lerman LO, Hauet T, Goujon JM. Trimetazidine reduces early and long-term effects of experimental renal warm ischemia: a dose effect study. J Vasc Surg. 2008; 47(4): 852-60.
-
16Nejad KH, Dianat M, Sarkaki A, GharibNaseri MK, Badavi M, Farbood Y. Ellagic acid improves electrocardiogram waves and blood pressure against global cerebral ischemia rat experimental models. Electron physician. 2015;7(4): 1153-62.
-
17Maleki M, Nematbakhsh M. Renal Blood Flow Response to Angiotensin 1-7 versus Hypertonic Sodium Chloride 7.5% Administration after Acute Hemorrhagic Shock in Rats. Int J Vas Med. 2016;2016: 6562017. Doi: 10.1155/2016/6562017
» https://doi.org/10.1155/2016/6562017 -
18Nesic Z, Todorovic Z, Stojanovic R, Basta-Jovanovic G, Radojevic-Skodric S, Velickovic R, et al. Single-dose intravenous simvastatin treatment attenuates renal injury in an experimental model of ischemia-reperfusion in the rat. J Pharmacol Sci. 2006; 102(4): 413-7.
-
19Azadbakht MK, Nematbakhsh M. Angiotensin 1-7 administration alters baroreflex sensitivity and renal function in sympathectomized rats. J Nephropathol. 2017;7(2):79-82.
-
20Franczyk-Skora B, Gluba-Brzozka A, Wranicz JK, Banach M, Olszewski R, Rysz J. Sudden cardiac death in CKD patients. Int Urol Nephrol. 2015; 47(6): 971-82.
-
21Tu H, Zhang D, Li Y-L. Cellular and molecular mechanisms underlying arterial baroreceptor remodeling in cardiovascular diseases and diabetes. Neurosci Bull. 2019;35(1):98-112.
-
22Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R, et al. Cytokine production increases and cytokine clearance decreases in mice with bilateral nephrectomy, Nephrol Dial Transplant. 2012; 27(12):4339-4347.
-
23Chen J, Hartono JR, John R, Bennett M, Zhou XJ, Wang Y, et al. Early interleukin 6 production by leukocytes during ischemic acute kidney injury is regulated by TLR4. Kidney Int. 2011; 80(5): 504-15.
-
24Monteiro MM, Franca-Silva MS, Alves NF, Porpino SK, Braga VA. Quercetin improves baroreflex sensitivity in spontaneously hypertensive rats. Molecules. 2012; 17(11): 12997-3008.
-
25Botelho-Ono MS, Pina HV, Sousa KH, Nunes FC, Medeiros IA, Braga VA. Acute superoxide scavenging restores depressed baroreflex sensitivity in renovascular hypertensive rats. Auton Neurosci. 2011; 159(1-2): 38-44.
-
26Li Z, Mao HZ, Abboud FM, Chapleau MW. Oxygen-derived free radicals contribute to baroreceptor dysfunction in atherosclerotic rabbits. Circ Res. 1996; 79(4): 802-11.
-
27Amini N, Sarkaki A, Dianat M, Mard SA, Ahangarpour A, Badavi M. The renoprotective effects of naringin and trimetazidine on renal ischemia/reperfusion injury in rats through inhibition of apoptosis and down regulation of micoRNA-10a. Biom Pharmacother. 2019; 112: 108568. DOI: 10.1016/j.biopha.2019.01.029
» https://doi.org/10.1016/j.biopha.2019.01.029 -
28Queiroz TM, Guimaraes DD, Mendes-Junior LG, Braga VA. alpha-lipoic acid reduces hypertension and increases baroreflex sensitivity in renovascular hypertensive rats. Molecules. 2012;17(11): 13357-67.
-
29Chapleau MW, Cunningham JT, Sullivan MJ, Wachtel RE, Abboud FM. Structural versus functional modulation of the arterial baroreflex. Hypertension. 1995;26 (2): 341–7.
-
30Ikemura M, Sasaki Y, Giddings JC, Yamamoto J. Preventive effects of hesperidin, glucosyl hesperidin and naringin on hypertension and cerebral thrombosis in stroke-prone spontaneously hypertensive rats. Phytother Res. 2012; 26(9): 1272-7.
-
31Belardinelli R, Solenghi M, Volpe L, Purcaro A. Trimetazidine improves endothelial dysfunction in chronic heart failure: an antioxidant effect. Eur Heart Journal. 2007; 28(9):1102-8.
-
32Chi OZ, HunterC, Liu X, Tan T, Weiss HR. Effects of VEGF on the blood-brain barrier disruption caused by hyperosmolarity. Pharmacology. 2008; 82(3):187-92.
-
33Sadik NA, Mohamed WA, Ahmed MI. The association of receptor of advanced glycated end products and inflammatory mediators contributes to endothelial dysfunction in a prospective study of acute kidney injury patients with sepsis. Mol Cell Biochem. 2012; 359(1-2): 73-81.
-
34Tso N, Hsu HP, Wu CM, Liu CC, Lei HY. Tumour necrosis factor-α causes an increase in blood-brain barrier permeability during sepsis. J Med Microbiol. 2001;50(9): 812-21.
-
35Liu M, Liang Y, Chigurupati S, Lathia JD, Pletnikov M, Z Sun, et al. Acute kidney injury leads to inflammation and functional changes in the brain. J Am Soc of Nephrol. 2008;19(7): 1360-70.
-
36Prieto I, Martinez JM, Hermoso F, Ramirez MJ, Vargas F, De Gasparo M, et al. Oral administration of losartan influences aminopeptidase activity in the frontal cortex. Eur Neuropsychopharmacol. 2000;10(4): 279-82.
-
37Zbarsky V, Datla KP, Parkar S, Rai DK, Aruoma OI, Dexter DT. Neuroprotective properties of the natural phenolic antioxidants curcumin and naringenin but not quercetin and fisetin in a 6-OHDA model of Parkinson's disease. Free Radic Res. 2005; 39(10):1119-25.
-
38Tsai TH. Determination of naringin in rat blood, brain, liver, and bile using microdialysis and its interaction with cyclosporin a, a p-glycoprotein modulator. J Agric Food Chem. 2002;50(23): 6669-74.
-
39Nongnuch A, Panorchan K, Davenport A. Brain–kidney crosstalk. Crit Care. 2014;18(3): 225. doi: 10.1186/cc13907.
» https://doi.org/10.1186/cc13907 -
40Mattson MP. Excitotoxic and excitoprotective mechanisms: abundant targets for the prevention and treatment of neurodegenerative disorders. Neuromolecular Med. 2003; 3(2): 65-94.
-
41Fujii T, Kurata H, Takaoka M, Muraoka T, Fujisawa Y, Shokoji T, et al. The role of renal sympathetic nervous system in the pathogenesis of ischemic acute renal failure. Eur J Pharmacol. 2003; 481(2-3):241-8.
-
42Kim J, Padanilam BJ. Renal denervation prevents long-term sequelae of ischemic renal injury. Kidney Int. 2015; 87(2): 350-8.
-
43Mitaka C, Si MK, Tulafu M, Yu Q, Uchida T, Abe S, et al. Effects of atrial natriuretic peptide on inter-organ crosstalk among the kidney, lung, and heart in a rat model of renal ischemia-reperfusion injury, Intensive Care Med. 2014;2(1):28. doi: 10.1186/s40635-014-0028-8.
» https://doi.org/10.1186/s40635-014-00280028 -
44Amini N, Dianat M, Mard SA, Ahangarpour A, Badavi M. Protective effects of naringin and trimetazidine on remote effect of acute renal injury on oxidative stress and myocardial injury through Nrf-2 regulation. Pharmacol Rep. 2019;71(6): 1059-1066.
Datas de Publicação
-
Publicação nesta coleção
06 Set 2021 -
Data do Fascículo
Ago 2021
Histórico
-
Recebido
14 Fev 2020 -
Aceito
12 Ago 2020 -
Revisado
17 Jun 2020